Меланотан 2 помогает при витилиго
Обновлено: 24.04.2024
Витилиго — это часто встречающийся дерматоз, распространенность которого составляет 3–4% в структуре кожной патологии. Витилиго может появиться в любом возрасте (Р. С. Бабаянц, Ю. И. Лоншаков, 1978; M. Halder et al., 1996); 50% случаев приходится на возр
Витилиго — это часто встречающийся дерматоз, распространенность которого составляет 3–4% в структуре кожной патологии. Витилиго может появиться в любом возрасте (Р. С. Бабаянц, Ю. И. Лоншаков, 1978; M. Halder et al., 1996); 50% случаев приходится на возраст 10–30 лет. Мужчины и женщины болеют одинаково часто. Это мультифакторное заболевание, причем в каждом конкретном случае могут быть разные механизмы его патогенеза и разные уровни нарушения образования меланина в коже (В. Г. Панкратов, И. А. Евсеенко, 1999). Заболевание возникает при сочетании предрасполагающих и провоцирующих факторов. Оно часто сочетается с заболеваниями щитовидной железы, сахарным диабетом, В12-дефицитной анемией и др.
Для лечения витилиго используются различные методы, так как одного радикального способа нет (S. Changgeng, Y. Ganyun, 1995).
Стабильность химического состава организма является одним из важнейших и обязательных условий его нормального функционирования (Н. А. Агаджанян, А. В. Скальный, 2001). Патология человека, обусловленная дефицитом жизненно необходимых (эссенциальных) элементов, избыточным количеством как эссенциальных, так и токсичных элементов, а также дисбалансом микроэлементов, получила название микроэлементозов (А. П. Авцын и др., 1991). Изучение роли эссенциальных и токсичных элементов в патогенезе витилиго дает возможность расширить спектр методов лечения данной патологии (A. Vaisov et al., 1985; M. Molokhia et al., 1973).
Для оценки влияния среды обитания, алиментарных факторов на организм, а также выявления хронических заболеваний в последнее время все чаще используют мультиэлементный анализ волос, позволяющий своевременно обнаружить доклинические изменения в организме и назначить индивидуальную программу для устранения нарушений минерального обмена (А. В. Скальный, 1999).
Целью работы является изучение элементного статуса волос больных с диагнозом витилиго.
В ходе выполнения работы проведено обследование образцов волос 49 мужчин и 91 женщины в возрасте от 18 до 55 лет с установленным диагнозом витилиго. В качестве референтных значений использованы данные по аналогичным половозрастным группам лиц, не страдающих данным заболеванием и не имеющих других хронических заболеваний (А. В. Скальный, 2000).
Все образцы волос подвергались пробоподготовке и анализу согласно методическим указаниям МУК 4.1.1482-03, МУК 4.1.1483-03 (С. И. Иванов и др., 2003).
Аналитические исследования выполнены методами атомной эмиссионной спектрометрии с индукционно связанной аргоновой плазмой (АЭС-ИСП) и масс-спектрометрии с индуктивно связанной аргоновой плазмой (МС-ИСП) на приборах Optima 2000 DV и Elan 9000.
В образцах волос определяли содержание 22 химических элементов: K, Na, Ca, Mg, P, Co, Cr, Cu, Fe, Mn, Zn, Se, As, Sn, V, Si, Ti, Ni, Al, Cd, Pb, Hg.
Статистическая обработка результатов исследований проводилась с использованием программ Microsoft Excel XP.
Результаты проведенного исследования элементного состава волос больных витилиго представлены в таблице.
Анализ полученных данных показал, что у больных, страдающих витилиго, частота отклонений в минеральном составе волос в зависимости от пола имеет определенные различия. Прежде всего хотелось бы обратить внимание на содержание меди и марганца. Эти элементы участвуют в синтезе меланина и являются антагонистами. В литературных данных главная роль в патогенезе витилиго отводится меди (А. С. Ваисов, Е. А. Кадыров, М. А. Рахимова, Ш. Н. Муратходжаева, 1985), хотя, как видно из представленных в таблице данных, у женщин в 2 раза, а у мужчин в 8 раз чаще наблюдается дефицит Mn в волосах по сравнению с дефицитом Cu (p < 0,001). При этом дефицит меди в волосах чаще встречается у женщин, а марганца — у мужчин.
Также обращает на себя внимание нарушение содержания Zn в волосах в обеих группах. Дефицит Zn в волосах больных витилиго чаще встречается у мужчин, чем у женщин.
Уровни содержания в волосах Fe и Co существенно отличаются у мужчин в сравнении с женщинами, а Se, Si и Cr достоверно не отличаются (p > 0,05).
Также в обеих группах наблюдается избыток содержания в волосах тяжелых металлов (Ti, Ni, Al, Cd, Hg, Pb), которые могут существенно влиять на нарушение обмена эссенциальных элементов. У мужчин преобладает избыток в волосах Ni, Cd, Pb, у женщин — Ti и Al.
Таким образом, в результате сравнительных исследований нами получен «элементный портрет» больных витилиго. Так, содержание жизненно важных элементов у женщин указывает на преобладание дефицита элементов, участвующих в гормональной регуляции (Cu, Mn, K, Na, ), а у мужчин — стрессовых элементов (Mn, Mg). У пациентов обеих групп выявилось нарушение обмена химических элементов, участвующих в регуляции углеводного обмена (Cr, Mn, Zn), функции печени (Fe, Co, Se, Cu), а также накопление тяжелых металлов (Ti, Ni, Al, Cd, Hg, Pb).
Полученные данные свидетельствуют о влиянии нарушений обмена макро- и микроэлементов, а также тяжелых металлов на риск развития и течение витилиго. Таким образом, нам представляются перспективными исследования в данной области: возможно, они позволят сформировать правильный подход к пониманию механизмов возникновения витилиго и предложить эффективные схемы лечения.
Терапия витилиго
Целью лечения является остановка прогрессирования заболевания и достижение репигментации в очагах витилиго. Традиционно для лечения витилиго используют витамины, гепатопротекторы, глюкокортикоиды, иммуномодуляторы, ферменты, препараты меди и цинка, наружно назначают Мелагенин, кварц, ПУВА-терапию (с незначительным эффектом).
Наиболее эффективны методы с использованием ультрафиолетового (UV) излучения (А. А. Кубанова, 2005).
Для лечения витилиго используются аппарат X-Traq, способный синтезировать световой пучок в диапазоне UVB длиной 308 нм, а также Multi Clear (производитель — Cure Lighl, Израиль), который дает возможность использовать UVB 290–320 нм и совмещать UVB и UVA в одной вспышке с длиной волны 290–400 нм. Эффект основан на локальном воздействии светового пучка, вследствие чего меланоциты начинают вырабатывать пигмент.
Под нашим наблюдением находилось 158 пациентов (35 мужчин, 123 женщины) с различными формами витилиго. Возраст пациентов варьировал от 6 до 72 лет (в среднем 28,5 года). Продолжительность заболевания — от 3 мес до 43 лет, в среднем — 11,6 года; 3 пациента имели витилиго с рождения. Распространенность варьировалась от единичного пятна диаметром 5 мм до 40% площади тела. Локализация высыпаний на лице наблюдалась у 126 человек (80%), на конечностях — у 131 пациента (83%), в том числе на стопах и кистях — у 56 (36%) человек, на коже туловища — у 64 (41%) и на гениталиях — у 17 (11%). Количество процедур колебалось от 5 до 56. При использовании аппарата X-Traq получили лечение 122, аппарата Multi Clear — 36 человек.
Эффективность применяемых методик варьировалась в различных группах пациентов. Так, наилучший эффект наблюдался у лиц молодого возраста и до 50 лет со смуглой кожей (3–4-й тип по Фитспатрику), на очагах, где пигмент пропал не полностью и волосы не потеряли окраску. Лучше всего пигмент восстанавливался в области лица. Эффект практически отсутствовал у светлокожих блондинов, на длительно существующих очагах и при локализации высыпаний на кистях и стопах.
Эффект от лечения проявлялся в виде уменьшения площади и репигментацией внутри пятна витилиго, которые постепенно сливались и заполняли весь очаг депигментации. На здоровой коже, прилегающей к обрабатываемому участку, при этом появлялась гиперпигментация, которая со временем проходила. Надо отметить, что при использовании аппарата X–Traq пациенты жаловались на сильные ожоги, которые сопровождались пузырями и мокнутием; подобных осложнений в случаях применения аппарата Multi Clear не наблюдалось.
Кроме этого, больным проводилась общая терапия с применением гепатопротекторов, витаминов, иммуномодуляторов и коррекция нарушений обмена микроэлементов.
Таким образом, использование селективной UVA- и UVB-терапии на сегодняшний день является наиболее эффективным методом лечения витилиго, особенно у пациентов со свежими высыпаниями и смуглой кожей. Однако для повышения ее эффективности пациенты нуждаются в тщательном обследовании и подборе индивидуальной комплексной терапии с учетом патогенеза заболевания.
По вопросам литературы обращайтесь в редакцию.
И. В. Верхогляд, кандидат медицинских наук
РМАПО, Москва
ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздравсоцразвития РФ, Москва
Российский государственный медицинский университет, Москва
Российский государственный медицинский университет им. Н.И. Пирогова
Современный взгляд на проблему лечения витилиго
Журнал: Клиническая дерматология и венерология. 2012;10(2): 118‑123
Усовецкий И.А., Шарова Н.М., Короткий Н.Г. Современный взгляд на проблему лечения витилиго. Клиническая дерматология и венерология. 2012;10(2):118‑123.
Usovetskiĭ IA, Sharova NM, Korotkiĭ NG. The current view of the problem of vitiligo therapy. Klinicheskaya Dermatologiya i Venerologiya. 2012;10(2):118‑123. (In Russ.).
ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздравсоцразвития РФ, Москва
Представлены результаты собственных исследований, посвященных особенностям клинического течения разных форм витилиго, некоторым патогенетическим аспектам развития данного заболевания и оценке клинической эффективности комплексной терапии сегментарной и несегментарной формы витилиго.
ГБОУ ВПО РНИМУ им. Н.И. Пирогова Минздравсоцразвития РФ, Москва
Российский государственный медицинский университет, Москва
Российский государственный медицинский университет им. Н.И. Пирогова
Витилиго характеризуется внезапным возникновением депигментированных пятен вследствие нарушения секреторной функции меланоцитов или их гибели, развивается у лиц с генетической предрасположенностью, сопровождается выраженными дисрегуляторными изменениями клеточно-опосредованных реакций иммунной системы, вегетативного дисбаланса с преобладанием симпатического тонуса и серьезной социальной дезадаптацией, обусловленной личностными особенностями и внешними социальными факторами.
Витилиго является распространенным дерматозом. В мире число больных с данным заболеванием превышает 1% всего населения. В 70% случаев заболевание начинается в возрасте 10—25 лет, дети младше 10 лет, в том числе новорожденные и грудного возраста, составляют приблизительно 25% всех больных витилиго [1]. Витилиго может возникнуть в любом возрасте, длиться неопределенно долго, самопроизвольное восстановление нормальной окраски кожи наблюдается редко.
Причины появления депигментированных очагов не известны. Недостаточно понятно, в результате каких нарушений резко прекращается синтез меланина и погибают меланоциты. Разные эндогенные и экзогенные факторы могут оказывать прямое и опосредованное повреждающее действие на меланоциты.
Среди внешних факторов наибольшее значение придают инфекционным и токсическим агентам, чрезмерному ультрафиолетовому облучению, стрессам. На протяжении многих десятилетий витилиго связывали с аутоиммунным тиреоидитом, ревматоидным артритом, красной волчанкой, атопическим дерматитом, заболеваниями печени инфекционного или токсического генеза, глистной инвазией и рядом врожденных синдромов [2]. Однако частота встречаемости витилиго у этих больных не выше, чем в популяции в целом. Ряд авторов [3, 4], подводя итоги многолетним исследованиям, считают, что больные витилиго в большинстве случаев не имеют никаких тяжелых или хронических сопутствующих заболеваний, а терапия выявленных у 28% больных функциональных расстройств органов пищеварения, вегетососудистой дистонии не оказывала влияния на результат репигментации.
Многие исследователи считают [5, 6], что витилиго является серьезным косметическим дефектом, возникает у лиц с генетической предрасположенностью и в у большинстве случаев, перенесших эмоциональные расстройства. Лишь у 4—7% больных витилиго сочетается с аутоиммунным тиреоидитом.
В современных генетических исследованиях продемонстрирована связь возникновения витилиго с разными аспектами наследования. Среди спорадических случаев витилиго в европейской популяции средний возраст возникновения заболевания составляет 24,2 года, тогда как в семьях с множественными случаями заболевания средний возраст составляет 21,5 года (статистически достоверные различия) [7]. Более раннее начало заболевания в «семейных» случаях и риск заболевания у отдаленных родственников является типичной характеристикой полигенного заболевания. Около 20% больных витилиго имеют не менее одного кровного родственника с подобным заболеванием. Формально-генетический сегрегационный анализ витилиго определяет существование многих локусов, нарушения в которых формируют предрасположенность к витилиго. Однако не обнаружены ключевые гены, ответственные за манифестацию, прогрессирующее течение или предрасположенность к данному заболеванию.
При витилиго обнаружено снижение антиоксидантного потенциала, приводящего к активному повреждающему воздействию на меланоциты свободных радикалов и накоплению продуктов перекисного окисления липидов [8, 9]. Позднее выяснилось, что свободные радикалы оказывают повреждающее действие на разные клетки, участвующие в воспалительных реакциях разного типа, и нарушения антиоксидантной защиты не являются основными механизмами депигментации при витилиго.
Теория нарушений иммунных механизмов регуляции является наиболее обоснованной. При длительном течении и распространенном патологическом процессе наблюдаются изменения в субпопуляционном составе Т-лимфоцитов. Одновременно с этим, особенно на начальных стадиях заболевания, повышаются уровни активационных рецепторов лимфоцитов, отражающие степень активации иммунокомпетентных клеток [10]. В настоящее время большинство исследователей полагают, что ведущая роль в развитии аутоиммунных заболеваний принадлежит клеточно-опосредованным реакциям, при которых наблюдается выраженный дисбаланс цитокинов. При витилиго выявляется снижение активности регуляторных Т-лимфоцитов, что подтверждается уменьшением количества трансформирующего фактора роста-β (TGF-β) и интерлейкина-10 (ИЛ-10) в сыворотке крови больных [11].
Лечение витилиго является сложнейшей задачей. Так как причины его возникновения неизвестны, в большинстве случаев заболевание развивается на фоне полного физического благополучия. Предлагается применять в основном топические стероиды и/или иммуномодуляторы при площади поражения до 20%, а также длительную фототерапию [12, 13]. В комплексную терапию включают ферментные препараты, гепатопротекторы, витамины и микроэлементы (цинк, медь) [14, 15]. В ряде рекомендаций содержатся сведения о применении седативных и антидепрессивных средств.
Цель настоящего исследования — изучение клинических особенностей течения витилиго и эффективности комплексной терапии, включающей иммуномодулирующий компонент — тимоген и наружно 1% пимекролимус, и коррекцию аффективных расстройств у больных разными формами витилиго с использованием препарата антидепрессивного действия агомелатин.
Материал и методы
Все больные разными формами витилиго были полностью обследованы (проведены клинические анализы крови и мочи, биохимический анализ крови, ультразвуковое исследование органов брюшной полости и щитовидной железы, гормоны щитовидной железы Т3, Т4, тиреотропный гормон — ТТГ и антитела к тиреоидной пероксидазе — АТ-ТПО по показаниям, консультация невропатолога по показаниям, консультация психиатра, иммунологические исследования — популяционный и субпопуляционный состав лимфоцитов, уровень провоспалительных и регуляторных цитокинов).
Результаты
Под нашим наблюдением с 2006 по 2011 г. находились 84 больных витилиго (46 женщин, 38 мужчин) в возрасте от 18 до 56 лет.

Давность заболевания варьировала от 6 мес до 30 лет, средняя продолжительность составила 6,5±4,8 года. Среди вероятных причин развития витилиго большинство больных называли перенесенный стресс (39 пациентов, 46%). Витилиго возникло после оперативных вмешательств у 3 (3,5%) пациентов, после травм — у 4 (4,5%). По мнению 4 (5%) женщин, впервые депигментированные пятна появились у них после родов, в период лактации, причем 1 пациентка отмечала, что после 2- и 3-х родов увеличивалась площадь поражения и появлялись свежие очаги. У 14 (17%) больных заболевание возникло после воздействия длительного ультрафиолетового излучения, 20 (24%) пациентов не могли связать появление депигментированных пятен с какими-либо значимыми причинами (рис. 1). Рисунок 1. Вероятные причины развития витилиго. У 21 больного среди ближайших родственников имелись проявления витилиго разной давности и степени распространенности, у 2 из них, помимо поражений кожи были обесцвечены участки волос.
При обследовании больных витилиго обнаружено, что наиболее часто (у 48 больных, 57,1%) встречаются дискинезия желчевыводящих путей и желчекаменная болезнь, хронический холецистит, жировой гепатоз. Гастрит обнаружен у 16 (19%) больных. В процессе обследования патология щитовидной железы (аутоиммунный тиреоидит, диффузный токсический зоб, кисты щитовидной железы) выявлена или подтверждена у 13 (15,4%) больных витилиго. Только у 4 больных из 13 с патологией щитовидной железы были обнаружены АТ-ТПО, что подтверждало диагноз аутоиммунный тиреоидит.

Гинекологические заболевания (дисфункциональные нарушения менструального цикла, миома) обнаружены у 5 (5,9%) женщин. У 10 (11,9%) больных подтверждена гипертоническая болезнь I—II степени, у 1 (1,2%) выявлен сахарный диабет 2-го типа, у 3 (3,5%) обнаружено алиментарное ожирение II—III степени. Достоверных отклонений от нормальных значений в клинических анализах крови не обнаружено. Тяжелых хронических заболеваний или декомпенсированных состояний у больных витилиго не выявлено (табл. 1).
Мы наблюдали за больными с разными формами витилиго (табл. 2). Среди них 7 (8,3%) больных имели сегментарную форму с площадью поражения 2% (рис. 2). Рисунок 2. Сегментарная форма витилиго. Вульгарная форма наблюдалась у 44 (52,3%) больных. В этих случаях площадь поражения составляла 3—70% площади кожного покрова (рис. 3, а, б). Рисунок 3. Пациентка (а) и пациент (б) с вульгарной формой витилиго. Отдельную группу составили больные с акрофациальной формой (31 человек, 36,9%) с депигментированными очагами на лице и конечностях (рис. 4, а—в). Рисунок 4. Акрофациальная форма витилиго (а—в). У 10 (11,9%) пациентов при клиническом обследовании обнаружены невусы Сеттона (рис. 5). Рисунок 5. Невусы Сеттона.
Витилиго является серьезной психологической проблемой [16, 17]. При исследовании уровня тревожности методом Спилбергера—Ханина низкий уровень реактивной тревожности наблюдается у 52 (61,9%) больных, а у 32 (38,1%) — умеренно выраженная реактивная тревожность. У 55 (77,4%) больных витилиго отмечен высокий уровень личностной тревожности, причем он не зависел ни от площади поражения, ни от давности заболевания. Наличие депрессивных расстройств подтверждены с помощью госпитальной шкалы Гамильтона (средний показатель 13,9±2,4 балла) и шкалы Бека (средний показатель 22,4±2,8 балла). У большинства обследованных выявлялись депрессивные расстройства невротического уровня, характеризующиеся подавленностью настроения, нарушением сна, тревожными и астеническими проявлениями.
Таким образом, в ходе обследования каких-либо тяжелых сопутствующих заболеваний не выявлено. По данным литературы, аффективные и вегетативные нарушения наблюдаются практически у всех больных витилиго и требуют адекватной коррекции.
При иммунологическом исследовании, проведенном 25 больным витилиго, обнаружены достоверные отклонения от контрольных значений в субпопуляционном составе Т-лимфоцитов и дисбаланс провоспалительных цитокинов (табл. 3; рис. 6). Рисунок 6. Содержание цитокинов в сыворотке больных витилиго. Примечание. ИЛ-2, ИЛ-8, ФНО-α, ИФН-γ, ИЛ-10 в пг/мл; TGFβ, в нг/мл. Так, содержание CD8+ в крови больных витилиго было достоверно выше, чем у здоровых, иммунорегуляторный индекс (ИРИ) также имел достоверные отличия от контрольных значений. В сыворотке крови больных витилиго обнаружено повышенное содержание ИЛ-2, ИЛ-6, ИЛ-8 и фактора некроза опухоли-α (ФНО-α), интерферона-γ (ИФН-γ) на фоне низкого уровня регуляторных цитокинов TGF-β и ИЛ-10 по сравнению с контролем.
Комплексное лечение больных проводили с учетом клинических особенностей витилиго, в том числе давности, распространенности и активности патологического процесса. Использовали направленную иммуномодулирующую терапию — тимоген (назальный спрей по 1 мл/сут в течение 20 дней) и пимекролимус (1% крем 2 раза в сутки в течение 4—6 мес). Психокорригирующую терапию проводили агомелатином, который является агонистом мелатонина (МТ1- и МТ2-рецепторов) и антагонистом 5НТ2с. Агомелатин больные витилиго принимали по 25 мг/сут 1 раз в день не менее 6 нед. После консультации психиатра 5 больным с умеренно выраженными признаками депрессии агомелатин был назначен в суточной дозе 50 мг на 12—24 нед.
Мы провели комплексное лечение 57 больным разными формами витилиго (3 пациента — с сегментарной формой, 25 — с акрофациальной, 29 — вульгарной).
У всех больных с сегментарной формой витилиго 100% репигментация наблюдалась через 4 мес после начала терапии.
У больных акрофациальной формой полная клиническая ремиссия отмечена в 16 (64%) случаях через 5 мес терапии. Значительное улучшение со 100% репигментацией большинства очагов и уменьшением площади очагов депигментации более чем на 60% имелось у 7 пациентов. Незначительная эффективность отмечена у 2 больных, причем полностью восстановилась нормальная окраска кожи в периорбитальных и периоральной областях, на тыльной поверхности кистей и в области фаланг площадь депигментированных очагов практически не изменилась, частично (до 40%) уменьшилась площадь очагов в области голеностопных суставов.
Положительные изменения после проведенной комплексной терапии наблюдались у всех больных вульгарной формой витилиго. Клиническая ремиссия отмечалась у 20 из 29 больных данной группы.
В течение первых 3 мес терапии (12 нед) у этих пациентов началась активная репигментация очагов, площадь которых сокращалась на 30—60%. К концу 6-го месяца цвет кожи восстановился полностью.

У 6 больных наблюдалось сокращение площади депигментированных очагов на 50—70% за счет полной репигментации отдельных очагов и частичного восстановления нормального цвета кожи отдельных участков. У 3 пациентов отмечались незначительные позитивные изменения, которые выражались в восстановлении пигментации свежих, небольших по площади участков (не более 2 см 2 ), сглаживании границ по периферии очагов депигментации (табл. 4).
Все больные хорошо переносили лечение, побочных эффектов, осложнений, отказов от терапии не было. В процессе терапии удалось изменить отношение пациентов к своему заболеванию, оценить позитивные изменения в процессе лечения. На фоне активной репигментации очагов нормализовались иммунологические показатели и произошла редукция признаков депрессивных расстройств.
Таким образом, полученные нами результаты свидетельствуют о возможности обоснованного эффективного и безопасного лечения витилиго.
Витилиго — хроническое мультифакториальное заболевание из группы дисхромий, обусловленное нарушением функционирования меланоцитов в эпидермальных клетках и волосяных фолликулах. Распространенность дерматоза в мире составляет 0,5% [1]. Заболевание одинаково часто встречается у мужчин и женщин во всех возрастных группах, при этом расовые различия отсутствуют [2].
На современном этапе развития науки трансплантация аутологичных меланоцитов является перспективным направлением лечения витилиго. Однако при проведении меланоцитарной трансплантации необходимо строго учитывать критерии отбора пациентов: возраст пациента, клиническую форму витилиго, стадию заболевания, наличие/отсутствие феномена Кебнера и эффекта от других методов лечения витилиго [3].
Установлено, что в процессах меланогенеза важную роль играют белки сигнального пути Wnt. Эти пептиды, открытые еще в начале 1980-х гг. в качестве маркеров многих видов раковых заболеваний, считаются ключевыми регуляторами эмбрионального развития, процессов регенерации, роста костей, дифференцировки стволовых клеток и других процессов, связанных с морфогенезом и определением клеточной судьбы [4—9]. Сигнальный путь Wnt представляет собой сложную цепь внутриклеточных взаимодействий, соответственно, блокировка пути Wnt останавливает рост стволовых клеток и их созревание в нормально функционирующие меланоциты. Путь Wnt имеет значение как для формирования, так и для созревания меланоцитов, что подтверждает значимость его изучения при витилиго.
Белки семейства Wnt могут выступать в роли «регенераторов» меланоцитов, дифференцировка которых должна пройти ряд этапов, начиная с формирования предшественников меланоцитов. Наибольший интерес представляют 2 белка этого семейства — Wnt1 и Wnt3. Wnt1 воздействует на меланобласты, стимулируя увеличение количества зрелых меланоцитов, тогда как Wnt3 и β-cadenin в большей мере воздействуют на развитие и формирование меланоцитов.
Считается что, индуцирование белка Wnt1 у больных витилиго связано с дифференцировкой стволовых клеток — меланобластов в волосяных фолликулах. Wnt1 передает сигналы тремя отдельными путями: каноническим, опосредуемым Wnt/β-cadenin; неканоническим, включающим путь Wnt/Ca2 + , и путем клеточной полярности. Этот белок кодируется одноименным геном, который впервые был открыт как протоонкоген в опухоли молочной железы.
Сигнальный путь Wnt стимулирует пигментацию как кожи, так и волос [2]. Он является регулятором популяции стволовых клеток меланоцитов (McSC) и участвует в их выживании. В процессе клеточной дифференцировки под действием сигнального пути Wnt образуются бипотентные глиально-меланоцитарные стволовые клетки, которые при миграции в эпидермис преобразуются в меланоциты, продуцирующие пигмент [4, 10]. Таким образом, в волосяных фолликулах есть резервуары меланоцитов, которые предопределяют эффективность трансплантации аутологичных меланоцитов, полученных из волосяных фолликулов, в очаги депигментации [5].
Необходимость изучения белков семейства Wnt объясняется также тем, что активация сигнального пути Wnt может служить дополнительной стратегией для стимуляции репигментации у больных витилиго. Активация этого пути способствует дифференцировке меланоцитов в процессе лечения.
Цель исследования — оценка эффективности применения в лечении витилиго методов трансплантации аутологичных некультивированных меланоцитов с учетом уровня экспрессии в коже сигнального белка Wnt1.
Материал и методы
Под наблюдением находились 113 больных витилиго в возрасте от 21 года до 50 лет, обратившихся в Республиканский специализированный научно-практический медицинский центр дерматовенерологии и косметологии. Среди больных было 45 (39,8%) мужчин и 68 (60,2%) женщин. Несегментарная форма витилиго диагностирована у 81 (71,7%) больного, сегментарная — у 32 (28,3%).
У 63 пациентов выполнена трансплантация суспензии некультивированных эпидермальных клеток (Non-Cultured Epidermal Cell Suspension — NCECS), у 50 больных — трансплантация NCECS и клеток наружного корневого влагалища волосяных фолликулов (Non-Cultured Outer Root Sheath Hair Follicle Cell Suspension — NCORSHFS). У 70 больных и 10 здоровых лиц проведены иммуногистохимические исследования экспрессии белка Wnt1 в биоптатах кожи. Забор материала для трансплантации производили из участка непораженной кожи методом шейв-биопсии (shave biopsy). Перед пересадкой в очаге витилиго осуществляли дермабразию кожи с использованием сканера углекислотного лазера, позволяющего проводить абляцию и испарение (фракционную и нефракционную абляцию) с минимальным повреждением кожи.
У 70 больных и 10 здоровых лиц (контрольная группа) проведены иммуногистохимические исследования экспрессии белка Wnt1 в биоптатах кожи. С целью сравнительного анализа экспрессии белка Wnt1 больные разделены на 4 группы. В 1-ю группу вошли 20 больных витилиго, у которых исследование экспрессии Wnt1 + -клеток проводили до лечения в очагах депигментированной кожи. Вторую группу составили 10 пациентов, у которых оценивали экспрессию белка Wnt1 в волосяных фолликулах, полученных из биоптатов кожи затылочной области волосистой части головы (биоптаты забирали методом панч-биопсии). В 3-ю и 4-ю группы вошли по 20 пациентов, у которых экспрессию данного белка изучали в биоптатах, полученных из зон трансплантации соответственно NCECS и NCECS + NCORSHFS.
Анализ экспрессии белка Wnt1 в коже с использованием иммуногистохимического метода проводили согласно протоколу фирмы-разработчика «Prestige Polyclonal and Monoclonal» (США), включавшему следующие этапы исследования.
1. Депарафинизация — парафиновые срезы толщиной 4 мкм высушивали в течение 8 ч при температуре 37 °С, после чего проводили депарафинизацию срезов в ксилоле и дегидратацию в этаноле. После дегидратации в течение 5 мин проводили блокировку эндогенной пероксидазы в 0,3% растворе перекиси водорода (H2O2) на 95% этаноле.
2. Стандартный метод демаскировки антигена выполняли путем кипячения срезов в цитратном буфере (pH 6,0) в условиях высокого давления, в качестве источника тепла использовали систему Decloakingchamber (Biocare Medical, Walnut Creek, CA, США). Срезы, полностью погруженные в цитратный буфер, кипятили в течение 4 мин при температуре 125 °C в условиях высокого давления. После завершения тепловой обработки препараты со срезами оставляли в растворе буфера и остужали до температуры 90 °C. Общее время обработки около 45 мин.
3. Иммуногистохимическое окрашивание проводили в аппарате Autostainer 480. Инкубацию с антителами выполняли при комнатной температуре в течение 60 мин.
Оценку уровня экспрессии белка Wnt1 выражали в баллах в зависимости от количества клеток, экспрессировавших белок Wnt1: 0 баллов — отсутствие Wnt1 + -клеток; 1, 2, 3 и 4 балла выставляли при наличии количества клеток, составлявших соответственно менее 10, 11—50, 51—80 и более 80%.
Данные, полученные при статистической обработке, представляли в формате M±m. Различия считали статистически значимыми при p
Результаты и обсуждение

Рис. 1. Очаг витилиго до трансплантации суспензии некультивированных эпидермальных клеток (NCECS).

Рис. 2. Очаг витилиго после трансплантации суспензии некультивированных эпидермальных клеток (NCECS).

Рис. 3. Очаги витилиго до трансплантации суспензии некультивированных эпидермальных клеток и клеток наружного корневого влагалища волосяных фолликулов (NCECS + NCORSHFS).

Рис. 4. Очаги витилиго после трансплантации суспензии некультивированных эпидермальных клеток и клеток наружного корневого влагалища волосяных фолликулов (NCECS + NCORSHFS).
Сравнительная характеристика экспрессии в коже белка Wnt1 в обследованных группах больных, процент Wnt1+-клеток, M±m
1-я группа — депигментированная кожа до лечения (n=20)
2-я группа — волосяные фолликулы до лечения (n=10)
3-я группа — кожа в участках пересадки NCECS (n=20)
4-я группа — кожа в участках пересадки NCECS + NCORSHFS (n=20)
Кожа здоровых лиц (n=10)
Примечание. * — pp>0,05 — достоверность различий по сравнению с 1-й группой.
После лечения в группе трансплантации NCECS изменений экспрессии белка Wnt1 в зоне пересадки не наблюдали, тогда как в группе трансплантации NCECS + NCORSHFS количество Wnt1 + -клеток в зоне пересадки в 20 раз превышало таковое в депигментированной коже больных, обследованных до лечения (соответственно 41 и 2%), однако статистически значимо отличалось от значения показателя в контрольной группе (p<0,01).
Заключение
В исследовании показана высокая эффективность применения в лечении витилиго методов меланоцитарной трансплантации с использованием некультивированных клеточных суспензий. Установлен более высокий уровень экспрессии белка Wnt1 в зоне трансплантации суспензии некультивированных эпидермальных клеток и клеток наружного корневого влагалища волосяных фолликулов (NCORSHFS + NCECS) по сравнению со значением этого показателя в депигментированной коже больных, обследованных до лечения. По нашему мнению, это связано с тем, что волосяные фолликулы содержат 3 типа стволовых клеток: эпителиальные стволовые клетки, меланоцитарные стволовые клетки (MelSCs) и стволовые клетки нервного гребня (NCSCs). По всей видимости, наличие в волосяных фолликулах меланоцитарных стволовых клеток обеспечило более высокий терапевтический эффект в группе трансплантации NCORSHFS + NCECS, чем в группе пациентов, получавших трансплантацию некультивированных эпидермальных клеток (NCECS).
Кроме того, результаты исследования показали значимость изучения при витилиго состояния регуляторных белков сигнального пути Wnt, поскольку контролируемая активация этого пути может стимулировать рост и дифференцировку меланоцитов. Дальнейшие исследования участия белков семейства Wnt позволят определить перспективность фармакологической регуляции Wnt-каскада при лечении витилиго. Применение клеточной трансплантации некультивированных кератиноцитов и меланоцитов является перспективным направлением в лечении больных витилиго. Необходимо проведение дальнейших исследований с целью разработки технологий применения и изучения отдаленных результатов хирургического лечения витилиго.
Участие авторов:
Концепция и дизайн исследования — Сабиров У.Ю., Азимова Ф.В., Тоиров Б.А.
Сбор и обработка материала— Тоиров Б.А.
Статистическая обработка данных — Тоиров Б.А.
Написание текста— Тоиров Б.А., Муминова С.Р.
Редактирование— Тоиров Б.А., Муминова С.Р.
Authors’ contributions:
The concept and design of the study: Sabirov U.Yu., Azimova F.V., Toirov B.A.
В статье приводятся сведения о витилиго, гетерогенном заболевании с полигенным типом наследования. За последние десятилетия отмечается значительный рост пациентов с витилиго. Приводятся патогенетические теории развития витилиго. В статье раскрываются данн
Витилиго — гетерогенное заболевание с полигенным типом наследования, представляет собой идиопатическую дисхромию кожи, характеризующуюся появлением депигментированных, часто симметрично расположенных пятен различных размеров, очертаний молочно-белого цвета с окружающей их зоной с умеренной гиперпигментацией и тенденцией к периферическому росту [1]. Для витилиго характерно хроническое, в большинстве случаев прогрессирующее течение, выражающееся в увеличении количества и размера очагов. Установлено, что появление очагов депигментации обусловлено разрушением меланоцитов в пораженной коже. Болезнь может появиться в любом возрасте, независимо от пола. Распространенность витилиго в зависимости от географического региона, в различных этнических группах разнообразна и составляет от 0,1 до 2 и более процентов населения. Витилиго может начаться в любом возрасте, однако чаще проявляется в возрастной группе 10–30 лет. Таким образом, данной патологией страдают преимущественно социально активные люди, у которых наличие косметического дефекта оказывает существенное влияние на качество жизни [2]. В то же время установлены предрасполагающие и провоцирующие факторы. Имеются данные о роли дисфункции нервной системы, стрессовых факторов, хронических воспалительных заболеваний урогенитального тракта, внутренних органов, дефицита цинка и меди в крови, интоксикаций, нарушений функций желез внутренней секреции, иммунной системы [3].
Наиболее признанными теориями патогенеза витилиго являются:
- теория иммунных нарушений (ведущая роль принадлежит клеточно-опосредованным реакциям);
- теория оксидативного стресса (свободные радикалы при недостаточности антиоксидантной защиты оказывают прямое повреждающее действие на кератиноциты и меланоциты);
- неврогенная теория (депигментация формируется вследствие функционального дефицита индоламиновой и катехоламиновой систем, возникающего в ответ на стресс, нарушений функционирования нейротрансмиттерной системы, пептидов и рецепторов), причем депигментация является одним из возможных симптомов соматизированных расстройств;
- генетическая теория (молекулярно-генетические исследования выявили значительное количество генов, которые могут быть вовлечены в молекулярный патогенез витилиго, однако назвать ключевые гены, ответственные за предрасположенность к заболеванию, пока невозможно) [4].
Вместе с тем, по мнению большинства экспертов, ведущее значение в повреждении меланоцитов и нарушении процессов меланогенеза в коже больных витилиго придается аутоиммунным механизмам [8].
Мультифакторная концепция патогенеза и выявленные нарушения при исследовании различных систем организма обосновывают необходимость применения в терапии данного заболевания широкого спектра традиционных лечебных мероприятий, так как течение и исход витилиго во многом зависят от правильного выбора фармакотерапии и методов лечения конкретного больного.
Актуальные подходы к терапии больных витилиго определены в отечественных и зарубежных клинических рекомендациях и включают следующие основные направления: системная терапия (глюкокортикоиды, иммунотерапия, антиоксиданты); фототерапия; наружная терапия (ингибиторы кальциневрина, кортикостероиды, антиоксиданты). Но несмотря на это в данном направлении проводятся активные научные исследования по разработке новых более рациональных и эффективных средств с высоким профилем безопасности, обладающих повышенной экономической эффективностью производимых затрат, учитывая, что данный дерматоз обусловлен длительным медикаментозным лечением. Основной целью лечения витилиго является остановка прогрессирования болезни, достижение стабилизации процесса, а затем и регресса клинических проявлений. В результате многочисленных исследований получены убедительные данные, свидетельствующие о том, что наиболее важным и значимым из указанных выше направлений терапевтического комплекса ведения больных витилиго является наружная терапия [5], что может быть связано не только с высокой эффективностью за счет непосредственного применения препарата на очаги витилиго, но и низкой абсорбцией лекарственных препаратов при местном применении, т. е. меньшей вероятностью развития системных побочных эффектов.
Топические кортикостероиды по-прежнему относятся к препаратам первой линии при поражении 10–20% кожного покрова. Характерной особенностью их является иммуносупрессивная активность, которая проявляется подавлением активности Т- и В-лимфоцитов, а также угнетением высвобождения цитокинов (ИЛ-1, ИЛ-2, интерферона-γ — 1 ККу) из лейкоцитов и макрофагов [7]. Кроме того, кортикостероиды снижают образование и увеличивают распад компонентов системы комплемента, блокируют Fc-рецепторы иммуноглобулинов, а также оказывают супрессивное действие на механизмы нарушения синтеза меланина в активную стадию заболевания. Но несмотря на столь высокую эффективность одновременно топические кортикостероиды имеют и местные побочные эффекты, такие как атрофия кожи, телеангиэктазии и вульгарные угри. В связи с этим с целью снизить риск развития местных побочных эффектов и достичь более быстрого процесса репигментации топические кортикостероиды комбинируют с различными терапевтическими методиками, среди которых выделяют физиотерапевтические методы, топические иммуномодуляторы и др. Известны также случаи применения топических кортикостероидов в сочетании с трансретиноевой кислотой (третиноин), способствующей не только предотвращению атрофии кожи, но и ингибированию апоптоза меланоцитов.
К числу современных препаратов для местного лечения относятся такие иммуносупрессивные средства, как такролимус и пимекролимус, принадлежащие к классу аскомициновых препаратов. Они являются препаратами выбора для иммуноопосредованных дерматозов благодаря их сравнимой эффективности, простоте применения и большей безопасности, чем их системные аналоги. Проведенные исследования in vitro показали, что взаимодействие между ингибиторами кальциневрина и кератиноцитами индуцирует высвобождение фактора стволовых клеток и повышение активности матриксной металлопротеиназы-9, что способствует меланогенезу.
Также в местном лечении витилиго с различным успехом применяют аналоги простагландинов. Известно, что простагландины участвуют в процессах пролиферации меланоцитов и меланогенеза, экспрессии тирозиназы, а также оказывают иммуномодулирующее действие. Сообщалось о топическом применении геля простагландина ПГ Е2 (0,5 мг динопростона в 3 г стерильного геля) на депигментированных участках кожи у 24 больных витилиго. Согласно результатам исследования, спустя примерно 6 мес выраженная репигментация наблюдалась у 15 пациентов.
Большие надежды возлагают на действие внутриочаговых инъекционных лекарственных препаратов, получивших широчайшее распространение в медицинской практике и имеющих большие достоинства, среди которых отмечают быстроту наступления и продолжительность эффекта, обеспечение максимальной биодоступности непосредственно в очаге поражения, что проявляется уменьшением длительности заболевания. Лекарственные средства, введенные внутрикожно, остаются в требуемой зоне на более продолжительный срок, чем при других парентеральных методах введения (внутримышечно и внутривенно), так как они медленнее эвакуируются из места введения, но при этом объем раствора не должен превышать 1–2 мл.
Одной из наиболее широко используемых форм инъекционного глюкокортикостероида является триамцинолон ацетонид, который характеризуется низкой растворимостью, медленной всасываемостью из места инъекции, при этом побуждая максимальное локальное действие, ограничивает диффузию и распространение через ткани, не порождая системных побочных эффектов при использовании в терапевтических дозах.
В последние годы в терапии восстановления нарушенной иммунной системы обоснованно применяют локальное (интрадермальное) введение иммунокорригирующих препаратов, которое является рациональным подходом особенно к лечению иммуноопосредованных заболеваний, в том числе и витилиго.
У больных распространенными формами витилиго с площадью поражения более 10–20% поверхности тела методами выбора являются узкополосная фототерапия с длиной волны 311 нм или широкополосная ультрафиолетовая средневолновая терапия с длиной волны 280–320 нм. У больных распространенными формами витилиго с площадью поражения более 10–20% поверхности тела методами выбора являются узкополосная фототерапия с длиной волны 311 нм или широкополосная ультрафиолетовая средневолновая терапия с длиной волны 280–320 нм [8, 9].
Таким образом, в последние годы возможности лечения витилиго расширились благодаря разработке новых способов введения препаратов. К сожалению, существующие методы показаны не при всех разновидностях витилиго, поэтому в настоящее время все еще остаются вопросы, касающиеся применения каждого метода, необходимого для создания стойких результатов и коррекции больших участков депигментации. Внедрение в практику терапии витилиго новых локальных современных технологий коррекции пораженной кожи, имеющих ряд преимуществ по сравнению с другими традиционными путями введения, способствует разработке более безопасных методов терапии, обладающих высокой терапевтической эффективностью [6].
Литература
- Юсупова Л. А., Юнусова Е. И., Гараева З. Ш., Мавлютова Г. И. Современные подходы к наружной терапии больных витилиго // Практическая медицина. 2014. № 8 (84). С. 24–26.
- Исмайлов Р. Г. Этиопатогенетические аспекты витилиго в современной интерпретации // Вестник проблем биологии и медицины. 2012. С. 14–17.
- Скрипкин Ю. К., Бутова Ю. С., Иванова О. Л. Дерматовенерология. Национальное руководство. М.: ГЭОТАР- Медиа, 2013. 917 с.
- Усовецкий И. А., Шарова Н. М., Короткий Н. Г. Клеточная дерматобиология — эффективный инструмент лечения витилиго // Лечебное дело. 2011. № 1. С. 76–79.
- Hossani-Madani A. R., Halder R. M. Topical treatment and combination approaches for vitiligo: new insights, new developments // G. Ital. Dermatol. Venerol. 2010; 145 (1): 57–78.
- Шарафутдинова Л. А., Ломоносов К. М. Современные аспекты топической терапии витилиго // Российский журнал кожных и венерических болезней. 2014. № 5, т. 17. с. 40–45.
- Юсупoвa Л. A. Иммунопатология хронических дерматозов. Казань: НБ КГМА. 2017. 108 с.
- Федеральные клинические рекомендации. Дерматовенерология 2015: Болезни кожи. Инфекции, передаваемые половым путем. 5-е изд., перераб. и доп. М.: Деловой экспресс. 2016. 768 с.
- Юнусова Е. И., Юсупова Л. А., Гараева З. Ш., Мавлютова Г. И., Климова Р. Н. Витилиго: современные концепции. Сборник материалов Всероссийской научно-практической конференции с международным участием «Казанские дерматологические чтения: синтез науки и практики». Казань, 2016. С. 66–70.
Е. И. Юнусова, кандидат медицинских наук
Л. А. Юсупова 1 , доктор медицинских наук, профессор
З. Ш. Гараева, кандидат медицинских наук
Г. И. Мавлютова, кандидат медицинских наук
ГБОУ ДПО КГМА МЗ РФ, Казань
Особенности патогенеза и терапии больных витилиго/ Е. И. Юнусова, Л. А. Юсупова, З. Ш. Гараева, Г. И. Мавлютова.
Для цитирования: Лечащий врач №11/2017; Номера страниц в выпуске: 24-25
Теги: кожные заболевания, дисхромия, качество жизни, иммунокррекция
Что такое меланома? Причины возникновения, диагностику и методы лечения разберем в статье доктора Беляниной Елены Олеговны, онколога со стажем в 25 лет.
Над статьей доктора Беляниной Елены Олеговны работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов и шеф-редактор Лада Родчанина

Определение болезни. Причины заболевания
Меланома (от греч. melanos – "чёрный", "тёмный") — это злокачественная опухоль, развивающаяся из меланоцитов (клеток, синтезирующих меланин). Чаще всего она образуется из кожных меланоцитов, то есть располагается на коже. В 7% случаев меланома локализуется на сетчатке глаза и в 1-3% случаев — на слизистых оболочках прямой кишки, полости рта, оболочках головного и спинного мозга. [1] [2]
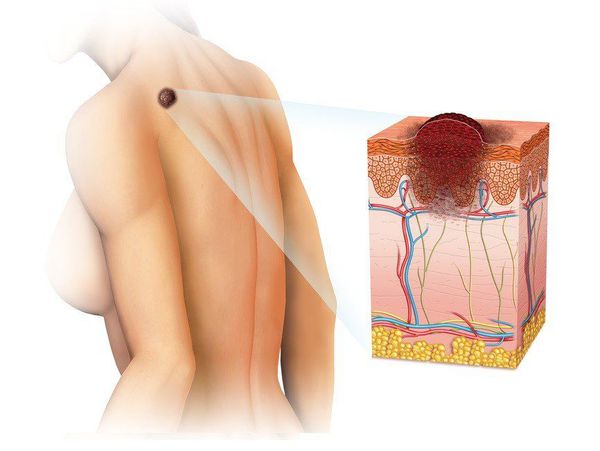
Эта болезнь — одна из наиболее злокачественных опухолей, которая часто метастазирует в разные органы.
Заболеваемость меланомой продолжает увеличиваться. По росту смертности эта патология занимает второе место после рака лёгкого. [3]
В настоящее время и звестно значительное количество факторов, которые повышают вероятность заболевания меланомой. Ни один из них не может быть признан главным или обязательным дл я возникновения заболевания. Однако современные исследования чётко установили, что основная причина меланомы — воздействие ультрафиолетовых лучей естественного солнечного света (а также излучения солярия) на кожу человека. [1] [4]
Другие факторы риска развития меланомы:
- светлая кожа (склонность к солнечным ожогам, светлые или рыжие волосы, голубой цвет глаз);
- большое количество невусов (родинок), в том числе наличие атипичных;
- меланома в личном анамензе, а также наличие меланомы у кровных родственников;
- солнечные ожоги с образованием пузырей, наличие солнечных ожогов в детстве;
- существование врождённого невуса (риск возрастает пропорционально увеличению его размера).
Особенности меланомы у детей
У детей меланома бывает редко. Однако беспигментная меланома у детей может выглядеть как обычная бородавка. Также часто встречается разновидность невусов — невус Шпитц (резко очерченная куполообразная розовато-красная папулу или бляшку), который также не всегда можно отличить от меланомы. Для уточнения необходимо наблюдение и цифровая дерматоскопия.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы меланомы
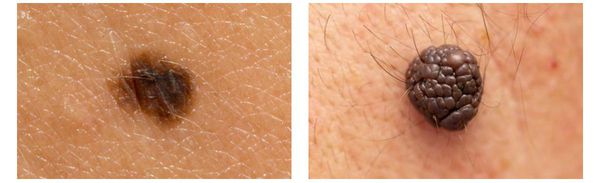
Первые признаки меланомы — появление на коже образования, непохожего на остальные по размеру, цвету и форме.
Меланома отличается от родинки следующими признаками: образование асимметричное по цвету и структуре, его края неправильные и зубчатые, оттенки в пределах одного образования отличаются, размер образования более 4 мм. С течением времени меланома изменяется по одному или нескольким ранее перечисленным критериям.
При обследовании важно учитывать, насколько пигментное образование отличается от остальных. Выявление "гадкого утёнка" среди родинок является причиной его более детального осмотра.
Клиническая картина меланомы достаточна разнообразна. Внешне она может представлять собой как незначительное пигментное пятно, так и узловое образование с изъязвлением. Цвет варьируется от светло-коричневого до чёрного.
Зачастую меланома возникает у взрослых, но иногда встречаются случаи врождённой формы заболевания. В детском возрасте меланома развивается редко.
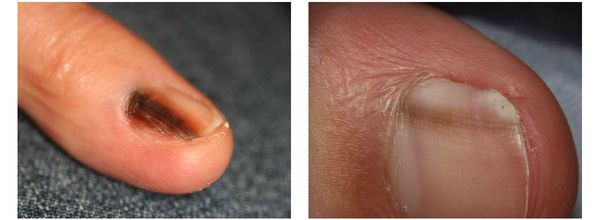
Меланома локализуется на любых участках кожи, в том числе и на ногтевой ложе.
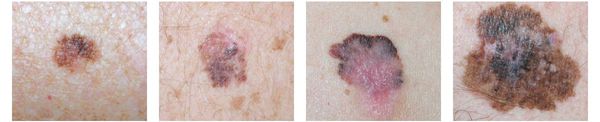
Различают четыре основных типа меланомы в зависимости от клинической картины, течения заболевания, анатомического расположения и гистологических параметров.
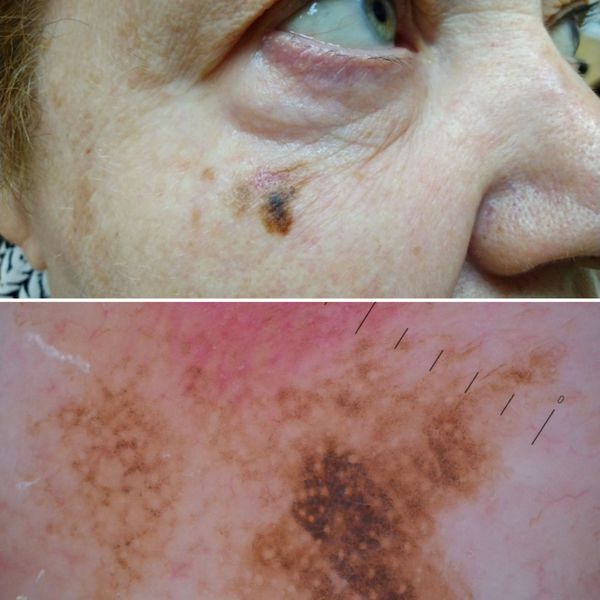
1. Поверхностно-распространяющаяся меланома встречается в 65-75% случаев. Для неё характерно длительное течение. Сначала это пятно коричневого цвета, которое постепенно растёт и становится асимметричным по структуре и цвету (появляются вкрапления тёмно-коричневого, чёрного и розового цвета). При переходе в вертикальную фазу роста на пятне появляется утолщение — бляшка. Наиболее часто встречаемая локализация у мужчин — на спине, а у женщин — преимущественно на нижних конечностях.
2. Лентиго-меланома представлена в виде пятна неправильной формы и окраски. Она развивается у лиц пожилого возраста. Чаще всего локализуется на лице, шее и тыле конечностей. Лентиго-меланома растёт на фоне длительно существующего злокачественного лентиго (предракового меланоза Дюбрейля). При инвазии клеток меланомы за пределы эпидермиса на пятне появляются возвышающиеся участки.
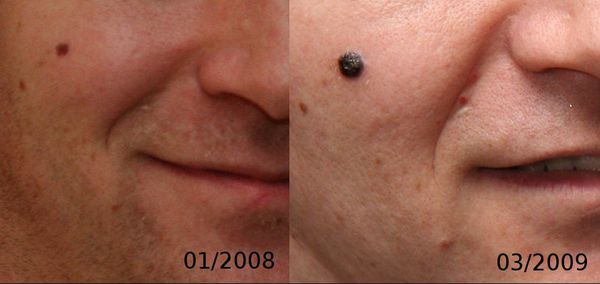
3. Узловая меланома представлена выступающим над поверхностью кожи образованием тёмно-коричневого или чёрного цвета. Часто эти образования симметричны и не вызывают подозрений. Однако, как правило, такая меланома характеризуется быстрым ростом и плотные на ощупь. С ростом опухоли она может изъязвляться. Чаще всего располагается на спине, голове и шее.
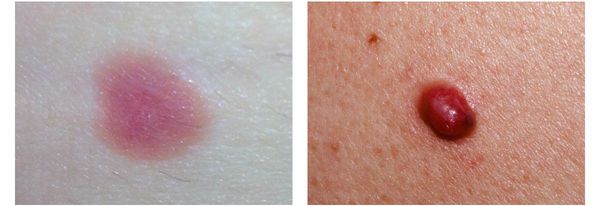
4. Во всех формах возможны беспигментные варианты (около 2%). Беспигментная (амеланотическая) меланома достаточно сложна для диагностики, так как сначала выглядит как безвредная розово-красная папула.
Поздние симптомы меланомы. Появление метастазов
Признаки метастазов зависят от того, в каком органе они появились:
- головной мозг — головные боли, неврологические симптомы (нарушение чувствительности к теплу, боли, расстройства памяти, координации и подвижности и т. п.);
- кости — боли в спине;
- лимфатические узлы — их увеличение и болезненность;
- на коже вблизи первичного очага — одновременное появление множества чёрных образований.
Патогенез меланомы
Патогенез меланомы, как и всех злокачественных опухолей, весьма сложный. Результат воздействия ультрафиолета на кожу человека (лучей А и В, длиной 280-340 нм) зависит от многих факторов, включающих дозу облучения и индивидуальный ответ организма (особенности иммунного ответа и генетическую предрасположенность).
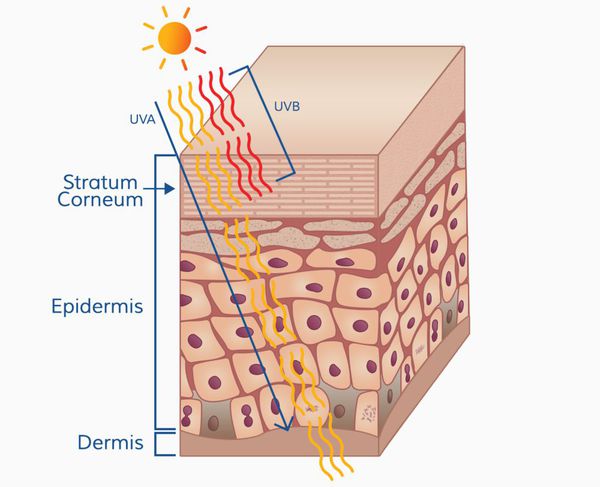
Ультрафиолетовое облучение вызывает:
- фотохимические реакции;
- повреждение молекулы ДНК (иногда повреждение восстанавливается);
- мутации (когда повреждение ДНК "не лечится" организмом);
- иммунные нарушения.
Образование пиримидиновых димеров (т. е. дефектов ДНК) под действием УФО — основная причина мутаций. [5]
Роль диспластических невусов в развитии меланомы недостаточно ясна. Проводимые исследования пока не ответили на вопрос, являются ли эти образования предраковым состояниям, или развитие меланомы в их зоне является статистически случайным событием.
По данным многочисленных гистологических исследований, около 30% меланом развиваются в области меланоцитарных невусов , остальные 70% развиваются на неизменённой коже. [6] [7] [8]
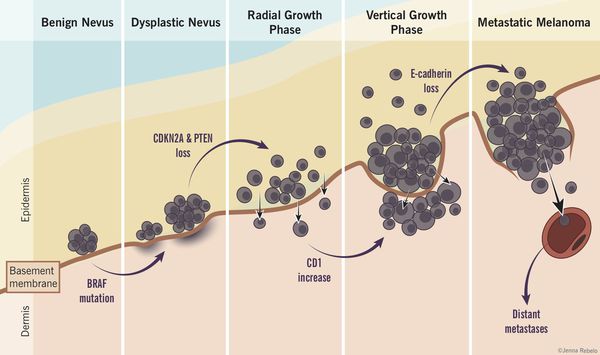
Таким образом, по имеющимся данным, на фоне невусов развивается небольшой процент всех случаев злокачественной меланомы. [4]
Атипичные невусы в первую очередь являются важными маркерами повышенного риска меланомы. При этом профилактическое удаление таких невусов нецелесообразно (они не являются 100% предшественником меланомы)
Пациенты с диспластическими невусами представляют собой группу повышенного риска и должны находиться под постоянным врачебным наблюдением.
В 7-15% всех случаев меланома является наследственной патологией. При этом обнаруживаются мутации в генах-супрессорах опухолевого роста.
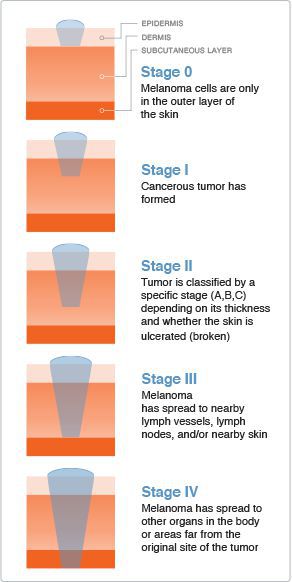
Классификация и стадии развития меланомы
Стадию опухолевого процесса меланомы определяют в соответствии с классификацией TNM. Она зависит от толщины первичной опухоли, а также наличия или отсутствия регионарных и/или отдалённых метастазов.
Для определения стадии меланомы необходимо гистологическое исследование. Оценку состояния лимфоузлов для установления стадии выполняют при помощи клинического осмотра и ультразвукового исследования.
Критерий Т говорит о распространённости первичной опухоли (для классификации по этому критерию необходимо удалить первичную опухоль и провести её гистологическое исследование):
- pТis — первичная (неинвазивная) меланома (I уровень инвазии);
- pТ1 — толщина опухоли ≤ 1 мм:
○ pТ1а — II уровень прорастания опухоли в соседние ткани или III уровень без изъязвления опухоли;
○ pТ1b — IV или V уровень прорастания опухоли в соседние ткани или присутствие её изъязвления;
○ pТ2а — без изъязвления опухоли;
○ pТ2b — с изъязвлением;
○ pТ3а — без изъязвления;
○ pТ3b — с изъязвлением;
○ pТ4а — без изъязвления;
○ pТ4b — с изъязвлением.
Критерий N говорит о существовании или отсутствии метастазов в регионарных лимфоузлах :
Читайте также:

