Мази с ретиноидами при кератодермии
Обновлено: 04.05.2024
РЕТИНОЕВАЯ МАЗЬ В ТЕРАПИИ ПСОРИАЗА ЛАДОНЕЙ И ПОДОШВ И КЛИМАКТЕРИЧЕСКОЙ КЕРАТОДЕРМИИ
Ярославская государственная медицинская академия, г.Ярославль
Цель исследования: изучить клиническую эффективность и переносимость 0,1% ретиноевой мази в комплексной терапии бляшечного псориаза и климактерической кератодермии ладоней и подошв, с учётом ее дерматопротективного, противовоспалительного и иммуномодулирующого действия.
Методы: под наблюдением находились 36 больных: 1 группа (16 чел.: мужчин-9, женщин-7) - с бляшечным псориазом ладоней и подошв в стационарной стадии процесса (изолированный псориаз только ладоней и подошв – 7 чел., преимущественное поражение ладоней и подошв – 9 чел) в возрасте от 25 до 47 лет, с длительностью заболевания в среднем 14,2+2,1 лет. 2 группу составили 16 женщин в возрасте 45-55 лет с климактерической кератодермией ладоней и подошв с давностью заболевания в среднем 2,3 ± 0,5 года. 0,1% ретиноевая мазь содержит 0,1 г изотретиноина (13-цис-ретиноевая кислота) на эмульсионной основе (дибунол; бутилоксианизол; воск эмульсионный; вазелиновое масло; глице-рин; спирт этиловый 95%; вода очищенная — до 100 г.), выпускается российской фирмой «Ретиноиды». 0,1% ретиноневую мазь наносили тонким слоем на сухую, предварительно очищенную кожу ладоней и подошв 2 раза в сутки ежедневно в течение 8 недель. Оценку результатов лечения проводили по дерматологической шкале клинических симптомов (ДИШС) до начала терапии и на 2, 4, 8 неделе лечения. Определяли выраженность эритемы, инфильтрации, шелушения и трещин в баллах (от 0 до 3).
В группе больных псориазом средний балл по всем тестируемым параметрам до лечения составил 10,2 – после лечения 5,9; в группе больных климактерической кератодермией 6,8 – 3,0. Динамика показателей ДИШС отражает выраженное снижение активности симптомов к концу лечения почти в 2 раза в обеих группах больных. После проведенной терапии у 10 (31,2%) (у 6 пациентов с псориатическим поражением центральной части ладоней и подошв, и у 4 больных с климактерической кератодермией в области пяток, тенара и гипотенара) было достигнуто полное клиническое излечение. У 9 (28,1%) (6 с псориазом и у 3–х с кератодермией) наблюдалось значительное улучшение с регрессом высыпаний на 60–70%. У 9 (28,1%) (2- с псориазом и 7- с кератодермией) проводимая терапия привела к улучшению – уменьшению симптомов на 30–40%.
4 пациента (12,5%) (по 2 из каждой группы) прекратили лечение спустя 5-7 дней в связи с интенсивным жжением и усилением красноты в очагах поражения после нанесения мази, при этом у них отмечался общий и локальный гипергидроз. Нежелательные эффекты регистрировались, как правило, при локализации поражения в центральной зоне ладоней и подошв у женщин: кратковременное жжение кожи и болезненность при попадании в трещины – у 4 пациентов (12,5%); усиление сухости и шелушения в первые 5-7 дней лечения отмечали 5 человек (15,6%). Этим больным было рекомендовано однократное использование мази на ночь, утром – нанесение смягчающего крема
Таким образом, выраженный терапевтический результат (клиническое излечение или значительное улучшение) был получен у 59,3% больных, (75% пациентов с псориазом, 25% - кератодермией). Регресс симптомов в той или мной степени, наблюдаемый у большинства пациенток (у 87,5%) с климактерической кератодермией, рассматриваем как хороший результат, учитывая торпидность данной формы к любой наружной терапии. Следует отметить, что заметная положительная динамика по всем оцениваемым критериям наблюдалась к концу 2-й недели лечения и терапевтический эффект нарастал в процессе терапии. В течение 10-14 дней очаги постепенно очищались от гиперкератотических наслоений и скопления чешуек, заживали поверхностные трещины и эпитализировались эрозии. В процессе лечения инфильтрация и шелушение снижалась и уменьшалась в конце терапии в 2–2,5 раза. Яркость эритемы, заживление глубоких трещин регрессировали более медленными темпами. Преходящие нежелательные явления в виде усиления сухости и шелушения отмечались у 28,1% больных, у 12,5% - потребовали отмены препарата.
Вывод: 0,1% ретиноевая мазь благодаря своему составу оказывает умеренное дерматопротектив-ное, эпителизирующее, противовоспалительное действие и является средством выбора в терапии ограниченного бляшечного псориаза ладоней и подошв и климактерической кератодермии вне обострения процесса.

Результаты клинического изучения Ретиноевой мази
Наиболее высокая эффективность ретиноевой мази отмечена у больных с комедонами, явлениями себореи и фолликулярного гиперкератоза, более низкая - при воспаленных угрях. Лечение угрей ретиноевой мазью можно рекомендовать, как подготовительный этап перед косметической чисткой.
Лечение ретиноевой мазью разной концентрации проведено у 60 больных:
- у 20 - 0,01%;
- у 18 - 0,05%;
- у 17 - 0,1%;
- 5 человек использовали сначала 0,05% ретиноевую мазь, а затем 0,1%.
Мазь применялась у больных:
- с открытыми и закрытыми комедонами (ретенционные кисты) на фоне папуло-пустулезных угрей - 39 человек;
- с фолликулярным гиперкератозом - 11 (из них с высыпаниями на коже лица - 6, рук и ног - 4, спины в области лопаток - 1);
- с сухой себореей кожи лица - 12 человек.
Длительность заболевания - от 4 до 12 лет. Возраст больных от 17 до 36 лет. Среди больных было 42 женщины и 18 мужчин.
Мазь назначали один раз в сутки вечером после умывания. Другие методы лечения одновременно не применяли, за исключением антисептических водно-спиртовых растворов при воспалительных изменениях. Продолжительность лечения в среднем 4 недели.
Положительный результат лечения отмечен у всех больных угрями с открытыми и закрытыми комедонами при слабо выраженном воспалении. Очищение камедонов происходило в течение 14-21 дней. Важно отметить, что даже очень глубоко расположенные закрытые комедоны, которые не устранялись во время косметической чистки, становились более поверхностными, доступными для удаления, что делало процедуру менее болезненной и травматичной. Наиболее эффективной при угрях была мазь, содержащая 0,1% ретиноевой кислоты, чуть слабее - 0,05%.
Лечебный эффект был незначительным или практически отсутствовал при воспаленных угрях (папулезных или пустулезных).
Препарат хорошо переносится. Аллергической реакции не отмечалось ни в одном случае. Эритема различной степени выраженности от применения препарата была у большинства больных. Лечебный эффект сопровождался также и шелушением кожи. После отмены препарата указанные явления проходили самостоятельно.
У всех 11 больных с фолликулярным гиперкератозом отмечалось полное очищение кожи в местах нанесения мази. Особенно быстрый и значимый эффект был получен при локализации высыпаний на коже лба. Хорошее очищение кожи отмечено и при локализации фолликулярного гиперкератоза на разгибательной поверхности рук и ног. Для достижения этого эффекта достаточно было ретиноевой мази 0,05%.
Неожиданно хороший эффект был получен при сухой себорее кожи лица с явлениями легкого гиперкератоза. Объективно: кожа шероховатая, неровная, сухая, серой окраски за счет снижения скорости слущивания роговых клеток. Ретиноевая мазь 0,01% очень нежно очищала такую кожу лица, не вызывая раздражения. Эффект наступал через 10-14 дней от начала лечения. Препарат значительно превосходит по эффективности другие средства, которые применялись ранее для такой кожи.
Заключение
Ретиноевая мазь 0,1% и 0,05% обладает хорошим терапевтическим эффектом при открытых и закрытых комедонах. Лечение данным препаратом можно рекомендовать, как подготовительный этап терапии глубоких закрытых комедонов перед косметической чисткой, а также как самостоятельной метод лечения камедонов.
Ретиноевая мазь 0,1% и 0,05% оказывает выраженный терапевтический эффект при фолликулярном гиперкератозе. При данной патологии кожи действие мази превосходит другие наружные препараты, не содержащие ретиноиды.
Ретиноевая мазь 0,01% эффективна при сухой себорее кожи лица, не вызывает раздражения, мягко очищает и разглаживает кожу.
Ретиноевая мазь обладает слабым противовоспалительным действием, в связи с чем ее не следует применять при выраженной воспалительной реакции.
Л.В. Силина 1 , Ю.Е. Харахордина 1 , Е.А. Есипова 1 , А.В. Карпова 2
1 – ФГБОУ ВО КГМУ Минздрава РФ, Курск, Россия;
2 – АО «Ретиноиды», Москва, Россия;
Резюме
Актуальность: кератодермии вследствие хронического прогредиентного течения формируют у пациентов физический и психоэмоциональный дискомфорт, торпидность и резистентность патологического процесса диктуют необходимость совершенствования системного и местного лечения.
Цель исследования – оценка клинической эффективности, обоснование целесообразности применения и перспектив использования в комбинированной терапии кератодермий «Ретинола пальмитата», мазей «Радевит ® Актив» и «Уродерм».
Материалы и методы: из 80 пациентов были сформированы четыре группы. Пациенты 1-й группы получали стандартную терапию. Больные 2–4-й групп – терапевтические дозы «Ретинола пальмитата» в течение двух месяцев, затем поддерживающие – наружно мази «Уродерм» и «Радевит ® Актив» 1 месяц.
Результаты. Выраженность воспалительного процесса в 1-й группе уменьшилась в 4 раза, во 2-й – в 10 раз, в 3-й и 4-й – полностью нивелировалась. Зуд кожи отсутствовал у больных 2-й – 4-й групп. Средний балл лечения в 1-й группе был неудовлетворительным, во 2-й группе – удовлетворительным, в 3-й и 4-й – хорошим, хотя в 4-й группе наблюдались аллергические реакции. Положительный эффект терапии сохранялся в 1-й группе 2 недели, во 2-й – 1 месяц, в 3-й и 4-й –2 месяца. Уровень рецидивов в 1-й и 2-й группах исследования был выраженным, в 3-й и 4-й – умеренным. Пациенты 1-й группы отмечали некоторое улучшение качества жизни, 2-й группы – удовлетворительное состояние, в 3-й и 4-й показатели дерматологический индекс качества жизни были высокими.
Ключевые слова: кератодермия, «Ретинола пальмитат», мазь «Уродерм», мазь «Радевит ® Актив»
Актуальность
Ладонно-подошвенные кератодермии представляют собой группу болезней наследственного или приобретенного характера, в клинической картине которых присутствуют диффузные или очаговые утолщения рогового слоя эпидермиса преимущественно в области ладоней и подошв, реже в сочетании с кератозами другой локализации [1–3]. Данная патология, являясь одной из наиболее распространенных среди дискератозов, занимает второе место в структуре наследственных заболеваний кожи. Заболевание чаще встречается у женщин, наследственная отягощенность колеблется от 1:1000 до 1:4000–9000 [5].
По происхождению различают наследственные и приобретенные кератодермии. Наследственные кератодермии обусловлены мутациями в генах, кодирующих образование кератина и белков клеточной оболочки. Они могут быть самостоятельными заболеваниями или сочетаться с разнообразными аномалиями, чаще всего эктодермального происхождения [1, 6]. В практике врача-дерматовенеролога довольно часто встречаются пациенты с приобретенными формами ладонно-подошвенных кератодермий, возникающими на фоне основного заболевания или вследствие внешних триггеров. Они сопровождают такие дерматозы, как красный волосяной лишай Девержи, красный плоский лишай, экзема, псориаз, ихтиоз. Кератодермии встречаются и при инфекционных заболеваниях – вторичном сифилисе, гонорейном кератозе, при синдроме Рейтера, дерматомикозах, норвежской чесотке, а также при нарушениях функции нервной и эндокринной систем (гипотиреоз, микседема), метаболических нарушениях, беременности, менопаузе [8]. Кератодермии могут быть маркерами паранеопластических процессов во внутренних органах. Описаны случаи, когда кератодермия сочеталась с такими онкологическими заболеваниями, как рак пищевода или желудка, когда развивается параонкологический кератоз ладоней и подошв. Возможно развитие профессиональных кератодермий, возникающих под воздействием лучевых, химических и механических факторов [9, 10].
По клиническим признакам выделяют две основные группы кератодермий – диффузные, при которых наблюдается сплошное поражение поверхностей ладоней и подошв, и очаговые, когда участки избыточного ороговения располагаются островками, линейно, точечно, а не распространяются на всю поверхность [11].
Все ладонно-подошвенные кератодермии, несмотря на многообразие клинических форм, имеют общие гистологические признаки: значительный гиперкератоз, реже акантоз, и мононуклеарная инфильтрация верхнего слоя дермы, преимущественно вокруг кровеносных сосудов [18]. Ладонно-подошвенные кератодермии наследственного характера также имеют общие гистологические признаки. Характерна эктодермальная дисплазия и воспаление, акантоз, гиперкератоз, иногда очаговый паракератоз. Встречаются небольшие периваскулярные инфильтраты в верхней части дермы. Гиперкератоз и гранулез отмечаются при подавляющем большинстве диффузных и ограниченных форм ладонно-подошвенных кератодермий [4].
Как наследственные, так и приобретенные кератодермии характеризуются хроническим прогредиентным течением, торпидным к терапии. У даннных пациентов имеются определенные затруднения при выборе профессии, устройстве на работу, а также сложности бытового характера. Больные кератодермиями, подавляющее большинство из которых женщины, испытывают выраженные психоэмоциональные расстройства, проблемы в личной жизни, у них значительно снижается самооценка. Все это приводит к ухудшению качества жизни и социального статуса, оказывает негативное влияние на материальное благосостояние, а в особо тяжелых случаях следствием заболевания может стать инвалидность [7, 12–15].
Терапевтические мероприятия при кератодермиях часто носят симптоматический характер. Для лечения всех форм кератодермий показано назначение ретиноидов, которые регулируют процессы роста и трансформации клеток, оказывают терапевтический эффект путем модуляции дифференцировки кератиноцитов, подавления гиперпролиферации и уменьшения инфильтрации воспалительными клетками. Для этого используются синтетические ретиноиды, фитоэстрогены [16–18].
Клинический эффект наблюдается не сразу, а по истечении 5–6 месяцев после начала приема препаратов и прекращается после их отмены. Однако они вызывают ряд побочных эффектов и имеют достаточно много противопоказаний. Наружное лечение кератодермий включает бальнеолечение, использование кератолитических и увлажняющих топических средств. Для наружной терапии также используют мази, содержащие витамины А, Е, регенерирующие препараты, а в ряде случаев – мази с глюкокортикоидами. Лечение назначают с учетом формы кератодермии и индивидуальных особенностей пациента. Важна профилактическая направленность, в частности применение топических антибактериальных и антимикотических средств [1].
Таким образом, в настоящее время ладонно-подошвенные кератодермии представлены гетерогенной группой дерматозов, что и диктует необходимость дальнейшего диагностического поиска и дифференцированного подхода к терапевтическим мероприятиям.
Цель работы – оценка клинической эффективности, обоснование целесообразности применения и перспектив использования в комбинированной терапии ладонно-подошвенных кератодермий «Ретинола пальмитата», мазей «Радевит ® Актив» и «Уродерм».
Практическая значимость заключается в разработке схем терапии кератодермий у взрослых пациентов.
Задачи
- Оценить клиническую эффективность комбинированной терапии ладонно-подошвенных кератодермий.
- Определить характер рецидивов и межрецидивного периода.
- Разработать оптимальные схемы лечения.
Материалы и методы
Под наблюдением находились 80 амбулаторных пациентов с диагнозом «диффузная ладонно-подошвенная кератодермия» (фото 1, 2). Диагноз устанавливался клинически и верифицировался обязательными лабораторными исследованиями, выполняемыми в соответствии с действующими рекомендациями.

Фото. 1. Ладонно-подошвенная кератодермия до лечения
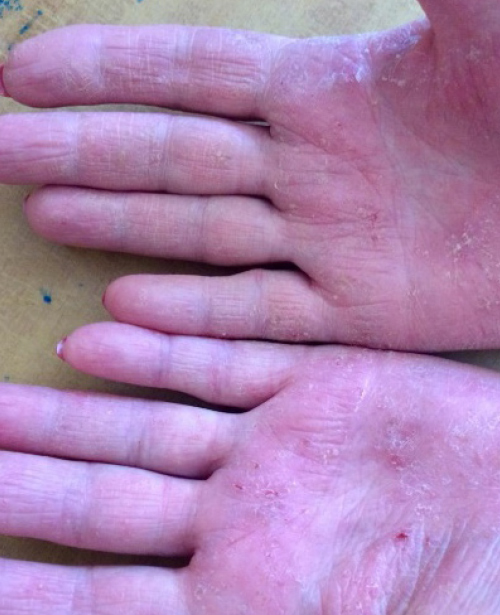
Фото. 2. Ладонно-подошвенная кератодермия до лечения
В план обследования входило определение показателей общего и биохимического анализа крови, общего анализа мочи. Контроль эффективности проводимой терапии осуществлялся путем сравнения показателей, полученных до начала лечения, через 30, 60 и 90 дней после начала терапии, и результат фиксировался в протоколе исследования пациента.
Основаниями включения пациентов в программу были:
- Добровольное информированное согласие на участие в исследовании.
- Подтверждение диагноза «ладонно-подошвенная кератодермия».
- Возраст от 25 до 75 лет включительно.
- Наличие показаний и отсутствие абсолютных противопоказаний к использованию комбинированной терапии.
- Возможность лечения пациента в амбулаторных условиях и выполнение медицинских рекомендаций.
Критериями исключения из групп были:
- Наличие в анамнезе аллергических реакций на «Ретинола пальмитат» и используемые наружные средства.
- Общее состояние пациента, обусловленное соматической патологией, не позволяющее ему следовать режиму, предписанному дизайном исследования.
- Отсутствие готовности к сотрудничеству со стороны пациента.
- Невозможность соблюдать условия протокола.
Все пациенты с учетом рандомизации были распределены по четырем группам. Средний возраст составил 45,5±7,4 года, добровольцы не имели признаков системности процесса, продолжительность заболевания варьировалась от 3 месяцев до 20 лет.
Группа 1 – контрольная. Пациенты получали стандартную терапию с наружным применением крема, обладающего увлажняющим, противовоспалительным и регенерирующим эффектом. Общий курс лечения составил 3 месяца.
Группа 2 – исследуемая. Пациенты принимали «Ретинола пальмитат» в дозе 100 000 МЕ в сутки (30 капель) в течение первых 2 месяцев. Затем 65 000 МЕ (20 капель) еще 1 месяц. В качестве наружной терапии утром была рекомендована мазь «Уродерм» под пленку на 30 минут, вечером – мазь «Радевит ® Актив». Общий курс лечения составил 3 месяца.
Группа 3 – исследуемая. Пациенты принимали «Ретинола пальмитат» в дозе 200 000 МЕ в сутки (60 капель) в течение 2 месяцев. Затем 130 000 МЕ (40 капель) еще 1 месяц. В качестве наружной терапии утром наносили мазь «Уродерм» под пленку на 30 минут, вечером – мазь «Радевит ® Актив». Общий курс лечения составил 3 месяца.
Группа 4 – исследуемая. Пациенты принимали «Ретинола пальмитат» в дозе 300 000 МЕ в сутки (90 капель) в течение 2 месяцев. Затем 200 000 МЕ (60 капель) еще 1 месяц. В качестве наружной терапии утром применяли мазь «Уродерм» под пленку на 30 минут, вечером – мазь «Радевит ® Актив». Общий курс лечения составил 3 месяца.
Для реализации цели исследования использовались следующие стандартные критерии оценки эффективности терапии:
- Влияние комбинированной терапии на выраженность основных клинических признаков кератодермий.
- Совокупный терапевтический эффект.
- Длительность терапевтического эффекта и характер ремиссий.
- Выраженность рецидивов.
- Качество жизни пациентов в группах сравнения.
- Комплаентность препаратов.
Влияние комбинированной терапии на выраженность основных клинических признаков оценивали по нескольким критериям:
– динамика степени выраженности зуда, рассчитываемая по 10-балльной шкале Visual Analogue Scale (VAS);
– динамика регресса площадей зон поражения (в процентном эквиваленте) – относительное изменение размера участков пораженной кожи, наблюдаемое в процессе лечения, в сравнении с исходным уровнем;
– динамика регресса объективных симптомов заболевания, оцениваемая по результатам изменения в каждой контрольной точке наблюдения показателя дерматологического индекса шкалы симптомов (ДИШС).
Все показатели оценивались на 1, 30, 60 и 90-е сутки наблюдения.
Оценка результатов в группах по числу пациентов, достигших клинического выздоровления (отличный результат лечения – уменьшение выраженности клиники на 75% и выше в сравнении с исходным уровнем), значительного улучшения (хороший результат лечения – уменьшение выраженности на 50–75% от исходного уровня), умеренного улучшения (удовлетворительный результат лечения – уменьшение на 25–50% в сравнении с клинической картиной при поступлении), отсутствия эффекта (неудовлетворительный результат лечения – уменьшение выраженности клинического признака менее 25% от исходного уровня). Представление результатов – балльная оценка степени выраженности изучаемых явлений до обращения и после лечения. Для достоверности полученных результатов при статистической обработке данных использовали метод ранжирования: отличному результату соответствовали 3 балла, хорошему – 2 балла, удовлетворительному – 1 балл, неудовлетворительному – 0 баллов.
Сравнительная оценка безопасности и переносимости комбинированной терапии определялась по субъективным (анкетные данные) и объективным (клинические наблюдения) параметрам.
Длительность терапевтического эффекта и характер межрецидивного периода оценивали по отсутствию субъективных признаков (0 баллов) или их наличию (1 балл). Продолжительность межрецидивного периода определяли в неделях.
Степень выраженности рецидивов ранжировали в баллах по сравнению с клинической картиной при первом обращении. Выраженная – соответствующая и превосходящая предыдущий клинический эпизод (75% и более) – 3 балла; умеренная (от 25% до 75%) – 2 балла; незначительная (менее 25% от клинической картины при первом обращении) – 1 балл.
Изменения в оценке качества жизни определялись на основании динамики Dermatology Life Quality Index. Оценка психосоматического статуса до и после лечения осуществлялась для анализа силы влияния комбинированной терапии на уровень и качество физического, психологического, социального и ролевого или функционально-ассоциированного образа жизни пациентов с помощью анкетирования. Пациент самостоятельно заполнял универсальную форму стандартного опросника, представляющего собой русифицированную версию Dermatology Life Quality Index, или дерматологический индекс качества жизни (ДИКЖ). Контрольные временные параметры фиксировались при поступлении, на 30, 60 и 90-е сутки наблюдения или при возникновении рецидивов.
Анализ итогов и качества лечения, потребительских свойств, исследование реакции и отношения пациентов к использованию нового для них средства наружной терапии проводились путем анкетирования. Методика представляла собой самостоятельное заполнение пациентами опросника, позволяющего оценить их комплаентность и дальнейшие перспективы применения препарата больными с ладонно-подошвенными кератодермиями.
Статистическая обработка проводилась с применением общепринятых методов параметрической и непараметрической статистики (программы Excel и Statistica 6.0). Для сравнения качественных, количественных и полуколичественных признаков использовали критерии χ2 и Вилкоксона–Манна–Уитни. Данные представлялись в виде абсолютных или относительных (%) величин, количественные – в виде M±SE, где M – среднее арифметическое, SE – ошибка средней величины. Разница значений считалась значимой при p 0,05).
Анализ влияния комбинированной терапии на выраженность основных клинических признаков мы проводили на 1, 30, 60 и 90-е сутки исследования (табл. 2).
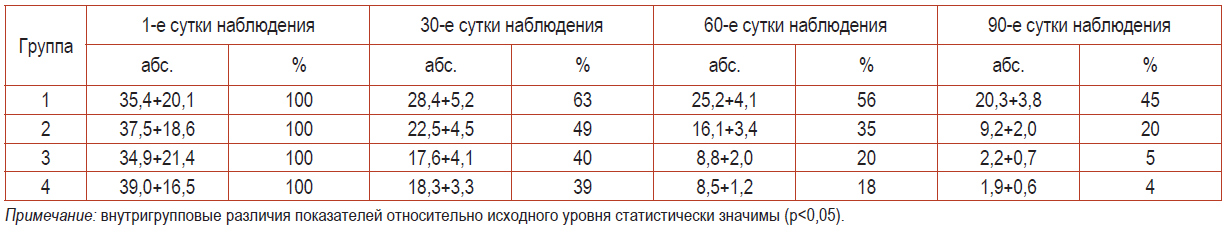
Таблица 2. Динамические характеристики площади очагов поражения кожного покрова на фоне терапии
Во всех группах исследования отмечалась общая тенденция регресса очагов поражения. В первой группе выраженность клинических проявлений за все время наблюдения уменьшилась более чем в 2 раза.
Во второй группе подобное нивелирование фиксировалось уже на 30-й день от начала лечения, а к 90-му дню наблюдения результаты были практически в два раза лучше, чем в 1-й группе. Максимальные показатели были достигнуты в 3-й 4-й группах. Статистически достоверных различий в них выявлено не было. К 30 дню лечения очаги поражения кожного покрова сократились более чем в 2 раза, а к окончанию терапии уменьшились до единичных процентов.
Динамические изменения субъективных и объективных параметров патологического процесса представлены на графиках 1 и 2.
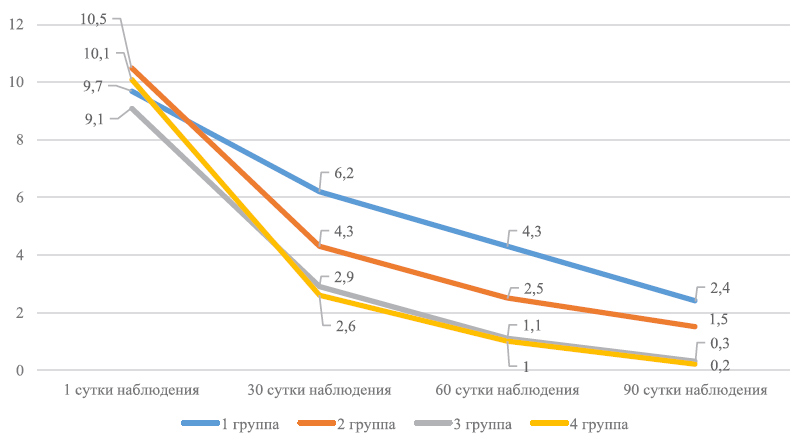
График 1. Динамика ДИШС на фоне лечения
Примечание: внутригрупповые различия показателей относительно исходного уровня статистически значимы (p ® Актив», признана клинически эффективной. В случае пациентов с ладонно-подошвенными кератодермиями она обладает высокими потребительскими характеристиками и может быть рекомендована к практическому применению по схеме, используемой в третьей группе исследования. Общий курс лечения – 3 месяца, с назначением «Ретинола пальмитата» в дозе 200 000 МЕ в сутки (60 капель) в течение 2 месяцев, затем 130 000 МЕ (40 капель) еще 1 месяц. В качестве наружной терапии применять утром мазь «Уродерм» под пленку на 30 минут, вечером мазь – «Радевит ® Актив» в течение 2 недель. Затем мазь «Радевит ® Актив» наносить утром и вечером в течение еще 2 недель.
Санкт-Петербургская государственная медицинская академия им. И.И. Мечникова
ЗАО «Ретиноиды», Москва, Россия, 111123
Научный дерматологический центр ЗАО "Ретиноиды", Москва
Актуальные тенденции в лечении ладонно-подошвенного псориаза и приобретенных ограниченных форм кератодермии
Журнал: Клиническая дерматология и венерология. 2017;16(6): 69‑76
Санкт-Петербургская государственная медицинская академия им. И.И. Мечникова
Кератодермии представляют собой группу заболеваний, объединенных общим признаком — повышенным ороговением за счет увеличения количества кератиноцитов при уменьшении их нормальной десквамации. Избыточное ороговение кожи ладоней препятствует тактильной чувствительности, что становится источником неприятных ощущений, а трещины приводят к утрате работоспособности. Цель исследования — изучить возможности применения препарата Уродерм для лечения пациентов с приобретенными ограниченными формами кератодермии. Материал и методы. Сформированы две равноценные по основным признакам группы: в 1-ю группу вошли 37 пациентов (10 мужчин и 27 женщин) с диагнозом псориаз ладонно-подошвенный, во 2-ю — 39 женщин с диагнозом климактерическая кератодермия. Участники обеих групп применяли мазь Уродерм 2 раза в сутки в течение 30 дней. Результаты. Установлено значительное сокращение площади очагов поражения от исходного уровня в обеих группах (до 44% в 1-й группе и до 19% во 2-й). Констатировано достоверное снижение величин показателей дерматологического индекса шкалы симптомов и Visual Analogue Scale в 1-й группе — с 9,64±3,71 и 3,39±1,08 до 2,13±1,04 и 1,19±0,83 балла соответственно, во 2-й группе — с 10,31±3,45 и 3,67±0,97 до 1,01±0,62 и 0,57±0,57 балла соответственно. Применение мази Уродерм позволило в течение относительно непродолжительного периода достичь клинического выздоровления участников 1-й группы — 16 (43,2%) из 37 или значительного улучшения состояния у представительниц 2-й — 31 (79,5%) из 39. Заключение. Мазь Уродерм оказывает достоверный положительный эффект на степень выраженности основных объективных клинических проявлений ограниченных форм кератодермии. Препарат обладает высокими показателями безопасности и переносимости: у представителей обеих групп отсутствуют случаи осложнений; ни у одного из участников исследования не зафиксированно эпизодов развития аллергии или индивидуальной непереносимости.
Санкт-Петербургская государственная медицинская академия им. И.И. Мечникова
ЗАО «Ретиноиды», Москва, Россия, 111123
Научный дерматологический центр ЗАО "Ретиноиды", Москва
Кератодермии представляют собой гетерогенную группу заболеваний, характеризующихся диффузным или очаговым утолщением рогового слоя эпидермиса ладоней и подошв, у части больных в сочетании с кератозами другой локализации, эктодермальной дисплазией и воспалением [1—3]. Ладонно-подошвенные кератодермии наследственного характера имеют общие гистологические признаки: акантоз, гиперкератоз, иногда очаговый паракератоз. Встречаются небольшие периваскулярные инфильтраты в верхней части дермы. Гиперкератоз и гранулез отмечаются при подавляющем большинстве диффузных и ограниченных формах ладонно-подошвенных кератодермий [4].
С симптоматической целью для лечения кератодермий применяют кератолитики, одним из которых является мочевина. Мочевина в высокой концентрации денатурирует и растворяет белки, оказывая тем самым кератолитический эффект, улучшает гидратацию кожи и увеличивает десквамацию, уменьшает зуд кожи. Достоинством мочевины является отсутствие токсического и аллергизирующего действия на организм. Положительные результаты при лечении препаратами с мочевиной пациентов с сухой шелушащейся кожей на фоне протекающего или предшествовавшего дерматита и пациентов с экземой рук получили F. Julia и соавт. [5]. P. Oztas и соавт. [6]. Установили, что при псориазе наружное лечение мочевиной уменьшает гиперпролиферацию эпидермиса и индуцирует дифференцировку кератиноцитов.
Отмечены успешные примеры использования препаратов с мочевиной для лечения кератодермий, но поскольку они еще недостаточно многочисленны и не находят широкого применения в практике, поиск оптимальных путей решения данной задачи остается актуальным. В этом смысле перспективным является применение отечественного препарата Уродерм, который по своим характеристикам, содержанию и свойствам близок к представлению об идеальном средстве для успешного лечения, контроля и профилактики приобретенных ограниченных кератодермий (ПОК).
Препарат Уродерм — мазь для наружного применения на эмульсионной основе, обладающая кератолитическим действием, смягчающая и увлажняющая кожу, повышающая ее эластичность. Эмульсионная основа мази легко впитывается роговым слоем кожи, способствуя размягчению кератина. Концентрация мочевины в мази Уродерм составляет 30% — это выше, чем в любом другом средстве, содержащим мочевину. В отличие от различных косметических средств с мочевиной, мазь Уродерм — лекарственный препарат с доказанным фармакологическим эффектом, производится из компонентов фармакопейного качества.
Цель настоящей работы — обоснование целесообразности применения препарата Уродерм как патогенетически оправданного, неинвазивного средства для лечения пациентов с ПОК.
Для реализации цели исследования использовались стандартные критерии оценки эффективности терапии: влияние используемого лечебного средства на выраженность основных клинических признаков патологического процесса (критерий 1), терапевтический эффект (критерий 2), частота возникновения побочных эффектов терапии (критерий 3), качество жизни пациентов в группах сравнения (критерий 4) и потребительские свойства препарата (критерий 5).
Основаниями включения больных в программу клинических испытаний были добровольное информированное согласие на участие в исследовании, подтверждение диагноза псориаз ладонно-подошвенный (ПЛП), климактерическая кератодермия (КК), возраст от 21 года до 69 лет включительно, наличие показаний и отсутствие абсолютных противопоказаний к использованию включенного в программу средства наружной терапии, возможность лечения пациента в амбулаторных условиях и соблюдение оговоренных условий испытания, подразумевающих неукоснительное выполнение медицинских рекомендаций и продолжение участия в исследовании, вплоть до его завершения.
Материал и методы
Объектом наблюдения стали амбулаторные 76 больных (10 мужчин и 66 женщин) в возрасте от 21 года до 69 лет (средний возраст 44,5±9,4 года), страдающие наиболее распространенными нозологическими формами ненаследственных ПОК, не имеющие признаков системности процесса, с продолжительностью заболевания от 3 мес до 20 лет. Диагноз ПОК первоначально устанавливался клинически. В целях его верификации в комплекс предварительных диагностических мероприятий, наряду со сбором анамнеза и физикальным обследованием, были включены обязательные лабораторные исследования, выполняемые в соответствии с рекомендациями по диагностике кератодермий [5].
Были сформированы две группы пациентов: в 1-ю группу вошли 37 пациентов (10 мужчин и 27 женщин) с диагнозом псориаз ладонно-подошвенный, во 2-ю — 39 женщин с диагнозом климактерическая кератодермия. Критериями анализа терапевтической эффективности используемого метода лечения в группах были следующие специфические и неспецифические показатели.
Критерий 1. Признак 1 — динамика регресса объективных симптомов заболевания, оцениваемая по результатам сравнения площадей зон поражения до и после лечения. Текущая оценка результатов — регистрация и сравнение площадей зон поражения до и после лечения в абсолютных величинах. Представление результатов — относительное изменение площадей зон поражения (уменьшение, увеличение), наблюдаемое в процессе лечения и выражаемое в процентной доле от исходного уровня. Признак 2 — динамика регресса объективных симптомов заболевания, оцениваемая по результатам изменения в каждой контрольной точке наблюдения показателя дерматологического индекса шкалы симптомов. Признак 3 — динамика субъективного показателя (индекса) степени выраженности зуда, рассчитываемого по 10-балльной шкале Visual Analogue Scale (VAS) — наиболее постоянного признака, характерного для обоих рассматриваемых заболеваний на 10-е, 20-е и 30-е сутки наблюдения.
Критерий 2. Глобальная оценка терапевтического эффекта (вариант адаптации применительно к условиям данного исследования). Сравнительный анализ эффективности лечения ПОК при использовании препарата Уродерм. Оценка результатов в группах по числу пациентов, достигших клинического выздоровления (отличный результат лечения — уменьшение выраженности клинического признака в процентном отношении от 75% и выше от исходного уровня), значительного улучшения (хороший результат лечения — уменьшение выраженности клинического признака в процентном отношении от 50 до 75% от исходного уровня), умеренное улучшение (удовлетворительный результат лечения — уменьшение выраженности клинического признака в процентном отношении от 25 до 50% от исходного уровня), отсутствие эффекта (неудовлетворительный результат лечения — уменьшение выраженности клинического признака в процентном отношении менее 25% от исходного уровня). Представление результатов — оценка степени выраженности изучаемых явлений до и после лечения (в баллах). Для достоверности полученных результатов при статистической обработке данных использовали метод ранжирования: отличному результату соответствовало 3 балла, хорошему — 2 балла, удовлетворительному — 1 балл, неудовлетворительному — 0 баллов. Контрольная точка оценки — 30-е сутки наблюдения.
Критерий 3. Частота развития нежелательных эффектов лечения, сравнительная оценка безопасности и переносимости препарата Уродерм при лечении ПОК. Методы получения информации: данные клинического наблюдения (объективный метод), анкетирование (субъективный метод).
Критерий 4. Изменения в оценке качества жизни на основании динамики индекса Dermatology Life Quality Index. Оценка психосоматического статуса у больных с ПОК до и после лечения. Анализ силы влияния единственно используемого в эксперименте средства наружной терапии на уровень и качество физического, психического, социального и ролевого или функционально-ассоциированного образа жизни на пациентов с различными по своей природе заболеваниями. Метод: анкетирование. Методика — самостоятельное заполнение универсальной формы стандартного опросника, представляющего собой русифицированную версию Dermatology Life Quality Index или дерматологический индекс качества жизни (ДИКЖ). Контрольные точки — 1-е и 30-е сутки наблюдения.
Критерий 5. Оценка итогов и качества лечения, анализ потребительских свойств, изучение реакции и отношения пациентов к использованию нового для них средства наружной терапии. Метод: анкетирование. Методика — самостоятельное заполнение несложного опросника, позволяющего оценить комплаентность пациентов и дальнейшие перспективы применения препарата пациентами с различными нозологическими формами ПОК.
Статистическая обработка проводилась с применением общепринятых методов параметрической и непараметрической статистики (программы Excel и Statistica 6.0). Для сравнения качественных, количественных и полуколичественных признаков использовали критерии χ 2 и Вилкоксона—Манна—Уитни. Данные представлялись в виде абсолютных или относительных (%) величин, количественные — в виде Х±х, где Х — среднее арифметическое, х — ошибка средней величины. Разница значений считалась значимой при p
Результаты и обсуждение

Значимых различий в степени выраженности оцениваемых клинических проявлений заболевания, а также существенных расхождений в оценке качества жизни на долечебном этапе у представителей обеих групп отмечено не было: исходные показатели в группах сравнения статистически неразличимы (p <0,05) (табл. 1). Таблица 1. Распределение больных по группам

Критерий 1. Сила влияния используемого средства терапии на выраженность основных клинических признаков патологического процесса (табл. 2). Таблица 2. Изменение площади очагов поражения в процессе лечения Примечание. Здесь и в табл.3, 6: * — в границах 95% ДИ, внутригрупповые различия показателей относительно исходного уровня статистически значимы (p<0,05); n — число участников в группе; N — абсолютное число измерений.
Несмотря на то что в результате лечения у пациентов обеих групп отмечалась положительная динамика, сила влияния терапии на оцениваемый клинический признак патологического процесса оказалась различной. Так, у пациентов 1-й группы использование заявленного препарата привело к сокращению площади поражения на 56%, которое к моменту окончания исследования составило 44% от исходного уровня, что может быть интерпретировано лишь как клинически значимый позитивный результат (p>0,05). В то же время у пациенток 2-й группы отмечалось более выраженное сокращение величины исследуемого параметра — до 19% от исходного уровня (p<0,001), что является не только клинически, но и статистически значимым свидетельством эффективности примененного лечения. Кроме того, во 2-й группе интенсивность снижения величины изучаемого параметра была более выраженной, чем в 1-й. Так, статистически значимое сокращение показателя площади поражения отмечалось уже к 20-му дню исследования.

Критерий 2. Глобальная оценка терапевтического эффекта (табл. 4). Таблица 4. Сравнительный анализ эффективности использования мази Уродерм как средства монотерапии у пациентов с псориазом ладонно-подошвенным и климактерической кератодермией
Сравнительный анализ данных, приведенных в табл. 4, демонстрирует различия результатов лечения у пациентов 1-й (рис. 1, а, Рис. 1. Больная О., 48 лет, с ладонно-подошвенным псориазом. а — выраженный гиперкератоз, трещины; б — клиническое улучшение— эпителизация трещин, уменьшение гиперкератоза, восстановление структуры эпидермиса. б) и 2-й (рис. 2, а, Рис. 2. Больная С., 52 года, с ограниченной формой климактерической кератодермии. а — клиническая картина выраженного гиперкератоза правой стопы до лечения; б — значительное уменьшение гиперкератоза в области правой стопы после терапии мазью Уродерм (через 2 нед ежедневного нанесения). б) групп. Преимущества использования препарата во 2-й группе вполне очевидны. Об этом свидетельствует тот факт, что совокупный удельный вес представительниц 2-й группы, достигших клинического выздоровления, — 8 (20,5%) из 39 и значительного улучшения — 23 (59%) из 39 составил 79,5%, в то время как в 1-й группе общая доля участников исследования, достигших подобного результата, оказалась почти в 2 раза меньше и составила лишь 43,2% (5,4 и 37,8% соответственно).

Критерий 3. Частота развития нежелательных побочных эффектов терапии (табл. 5). Таблица 5. Сравнительный анализ безопасности и переносимости использования мази Уродерм у пациентов с псориазом ладонно-подошвенным и климактерической кератодермией
Данные, приведенные в табл. 5, демонстрируют различия в частоте возникновения нежелательных эффектов лечения в группах при использовании изучаемого средства наружной терапии. Анализ представленных результатов свидетельствует как о большем числе возможных вариантов осложнений, возникших у представителей 1-й группы, так и о большей частоте случаев их регистрации, чем во 2-й.

Критерий 4. Оценка ДИКЖ (табл. 6). Таблица 6. Анализ силы влияния использованного метода терапии (препарата) на качество жизни пациентов по группам

Критерий 5. Оценка потребительских свойств мази Уродерм (табл. 7). Таблица 7. Различия в оценке потребительских качеств мази Уродерм по группам, абс. (%)
При сравнительном анализе потребительских свойств мази Уродерм были получены следующие данные: участницы 2-й группы значительно реже (в 12,8% случаев), чем представители 1-й группы (37,8%), акцентировали внимание на наличии побочных эффектов лечения. Существенно реже (в 7,7% против 48,6% соответственно) предъявляли претензии к удобству применения препарата. Объективно реже (17,9% против 43,2%) изъявляли дополнительные пожелания во время лечения. Значимо чаще (87,2 и 59,5% соответственно) позитивно оценивали результаты терапии и выражали готовность к ее продолжению в прежнем объеме (92,3% против 70,3% соответственно).
Выводы
Препарат Уродерм оказывает позитивное влияние на степень выраженности основных объективных клинических проявлений заболеваний. Препарат Уродерм действительно обладает высокими показателями безопасности и переносимости. Препарат Уродерм оказывает выраженное положительное влияние на качество жизни пациентов с ПОК, использующих его в качестве монотерапии своего заболевания. Препарат Уродерм обладает высокими потребительскими характеристиками.
ФГОУ Институт повышения квалификации Федерального медико-биологического агентства РФ, Москва
Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН, Москва, 117997, Российская Федерация
Современные возможности применения системных ретиноидов в дерматологической практике (обзор зарубежной литературы)
Журнал: Клиническая дерматология и венерология. 2018;17(5): 18‑23
ФГОУ Институт повышения квалификации Федерального медико-биологического агентства РФ, Москва
РЕЗЮМЕ В обзоре представлены данные зарубежных клинических исследований по изучению эффективности и безопасности применения системного изотретиноина (СИ) для лечения ряда дерматологических заболеваний. Рассмотрены механизмы действия ретинола и его производных, эффекты синтетических аналогов ретинола при заболеваниях, связанных с процессами кератинизации. В многоцентровых рандомизированных исследованиях показана эффективность СИ при лечении очаговой алопеции, генитальных папиллом, плоских бородавок, болезни Кирле и ряда других дерматозов. Определено место изотретиноина в системной терапии акне и розацеа. Даны рекомендации по ведению больных акне и розацеа в зависимости от формы и тяжести патологического процесса с применением СИ на основании современных отечественных и зарубежных рекомендаций. Широкий спектр активности (комедонолитический, противовоспалительный, себостатический, антипролиферативный, антиоксидантный) позволяет считать СИ препаратом первой линии в лечении тяжелых и резистентных форм акне и розацеа. Последние клинические исследования по СИ посвящены изучению влияния препарата на различные показатели безопасности терапии. Представлены данные о препаратах СИ нового поколения с повышенной биодоступностью, что позволяет снизить курсовую дозу и риск развития побочных эффектов. Показаны преимущества изотретиноина по технологии LIDOSE (комплаентность, эффективность, безопасность) при лечении акне и розацеа.
ФГОУ Институт повышения квалификации Федерального медико-биологического агентства РФ, Москва
Институт биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова РАН, Москва, 117997, Российская Федерация
Действующим веществом изотретиноина является синтетическая 13-цис-ретиноевая кислота, являющаяся аналогом одной из форм витамина А. Изотретиноин при системном приеме оказывает противовоспалительный, противоугревой, дерматопротективный и противосеборейный эффекты. Использование ретиноидов дает возможность качественно и своевременно проводить терапию различных форм акне и розацеа, что способствует предотвращению образования рубцов и снижает эмоциональную нагрузку на пациента, повышает качество жизни. Тактика лечения и выбор препарата определяются тяжестью патологического процесса и характером его течения. Эффективность системного изотретиноина (СИ) в терапии акне хорошо документирована. В многоцентровых рандомизированных исследованиях, проведенных в Англии, Германии и других странах, показана эффективность СИ в терапии средних и тяжелых форм акне. Применение С.И. эффективно для большинства пациентов с тяжелой и резистентной к лечению розацеа. На сегодняшний день сохраняет актуальность вопрос оптимального режима дозирования и выбора схемы применения СИ при лечении акне и розацеа.
Механизмы действия ретинола и его производных
Ретинол или витамин А синтезируется организмом человека в небольших количествах, взаимодействует с микрофлорой и превращается в транс-ретиноевую кислоту. В организме витамин А участвует во многих процессах, играет важную роль в эмбриогенезе, формировании костей и зубов, замедляет процесс старения, поддерживает ночное зрение, повышает иммунитет, усиливает барьерную функцию слизистых оболочек. Витамин А эффективен при лечении различных заболеваний кожи, ускоряет процессы заживления кожи, стимулирует синтез коллагена, является антиоксидантом. Витамин А и его предшественник β-каротин защищают мембраны клеток от действия свободных радикалов, что предотвращает нейродегенеративные, сосудистые, глазные заболевания, стимулируют противораковый иммунитет. Витамин А также принимает участие в синтезе стероидных гормонов, сперматогенезе, является антагонистом тироксина. До 90% витамина А и его производных депонированы в печени.
Ретинол в организме синтезируется из двух источников: эфиров ретинола, поступающих из животных продуктов (яйца, мясо, молоко, сыр), и провитамина А, поступающего из растительных продуктов (α-, β- и γ-каротин и β-криптоксантин). Предшественники ретинола, поступающие через пищеварительный тракт, быстро метаболизируются ферментами ретинол- и ретинальдегид-дегидрогеназами до ретинальдегида и затем до политрансретиноевой кислоты (ПТРК). В крови весь ретинол находится в связанной форме с белком RBP4 (retinol binding protein 4) или рядом других [1], который является лигандом клеточного рецептора STRA6 [2, 3]. После связывания комплекса ретинол-RBP4 с STRA6 ретинол перехватывают различные высокоаффинные цитоплазменные белки (cellular retinol-binding proteins CRBP1 и CRBP2, cellular retinic acid binding proteins CRABP1 и CRABP2, FABP5) [4]. Известно, что транспортный цитоплазменный белок, перехвативший ретинол, определяет дальнейшую активность ретинола [5, 6]. Основная часть комплексов с ретинолом доставляется к ядерной мембране, где перехватывается рецепторами RAR (α-, β- или γ-изотипами ядерного рецептора) [6, 7]. Под действием ретинола активируются различные факторы транскрипции, ретинол разрушается белками цитохромов (CYP26A1), а рецептор RAR инактивируется (фосфорилируется) или деградирует в протеосомах [1].
Кроме 9-cis-РК, 13-cis-РК и других метаболитов ПТРК, существуют и другие структурно отличающиеся молекулы, использующие тот же сигнальный путь и получившие наименование «ретиноидов», часть из которых взаимодействуют не с RAR, а со структурно отличным от RAR рецептором RXR [8, 9], названных «рексиноидами». Примером являются полиненасыщенные омега-3 жирные кислоты — докозагексаеновая и арахидоновая [10, 11].
Рецепторы RAR и RXR относятся ко второму типу ядерных рецепторов, для которых характерно постоянное их присутствие в ядре в комплексе с белком-репрессором [12]. К этому же классу относятся стероидные и тиреоидные гормоны. Все ядерные рецепторы II типа при связывании с лигандом формируют димеры (обычно с RXR), которые уже взаимодействуют с ДНК [12]. Рецептор RXR может образовывать гомодимеры или димеры с другими молекулами (PPARs, LXRs, THRs, FXR и др.), способными активировать транскрипцию генов, что получило название «permissive — взаимодействие». Рецепторы RAR для активации транскрипции должны димеризоваться с RXR, за что получили название «non-permissive».
Как рецепторы стероидных гормонов, так и рецепторы ретинола, могут оказывать как геномный эффект, так и внегеномный. Показано, что RAR-α и γ находятся не только в ядре, но и на внутренней поверхности клеточной мембраны в липидных рафтах [13—15]. При низкой физиологической концентрации ретиноевой кислоты (РК) доминирует геномный эффект, при повышении концентрации появляются внегеномные эффекты. Показано, что ПТРК активирует MAPK, ERK, (PKB)/AKT, PI3K киназы и другие сигнальные пути [13].
В настоящее время синтезированы аналоги различных производных ретинола: ПТРК (третиноин), 13-cis-РК (изотретиноин) и 9-cis-РК (алитретиноин). Следующее поколение синтетических аналогов включает моноароматические структуры (этритинат, ацитритин), а также препараты 3-го поколения — полиароматические препараты (адапален, тазоротен, бехсаротен).
Синтетические аналоги РК исключительно широко используются в косметологии, их добавляют в кремы и мази для предотвращения старения кожи. Системные препараты РК эффективны при патологиях кератинизации кожи, но могут оказывать токсическое и тератогенное действие, что требует подбора терапевтической дозы и адекватной схемы применения. Основной эффект РК наблюдается при терапии акне, псориаза, предраковых состояний, немеланомных форм рака кожи [13]. Изотретиноин, cis-изомер РК, нормализует дифференцировку эпидермальных кератиноцитов, снижает секрецию кожного сала и воспаление, обеспечивая длительную ремиссию. РК является первой линией терапии при пустулезном псориазе и псориатической эритродермии.
В настоящее время изотретиноин разрешен для системной терапии тяжелых форм акне и розацеа; этретинат для терапии псориаза и ацитретин для тяжелых форм псориаза. Третиноина токоферилацетат рекомендован для терапии кожного лишая, макулярного амилоидоза и кожных язв [16]. При избыточном приеме аналогов РК симптомы напоминают гипервитаминоз, выражающийся в повышенной сухости кожи и выпадении волос (из-за снижения синтеза кожного сала), конъюнктивита (из-за снижения синтеза слезной жидкости). При приеме РК у части больных наблюдают так называемый синдром ретиноевой кислоты (RAS), выражающийся в появлении одышки, повышении температуры, легочных проблемах, купируемых кортикостероидами. При назначении РК необходимо выявлять потенциальных RAS пациентов. Показано, что группой риска являются пациенты с высоким уровнем лейкоцитов крови [17]. В целом ретиноиды используются в дерматологии более 15 лет без значительных побочных эффектов [18]. Из-за высокой биологической активности ретиноидов не рекомендуется планирование беременности на фоне повышенной концентрации РК, поскольку РК участвует в регуляции дифференцировки клеток плода. Время выведения ретиноидов зависит от липофильности синтетических препаратов. Так, этретинат регистрируют в крови спустя 2—3 года после окончания терапии, что связано с его депонированием и высвобождением из жировых клеток [19]. Уровень Р.К. в крови после терапии изотретиноином или ацетритином возвращается к норме спустя 2 нед после окончания лечения.
Изотретиноин в дерматологии
СИ отличается от других аналогов РК своей исключительной способностью подавлять секрецию кожного сала [20, 21]. Причиной такого различия является отсутствие связывания изотретиноина с цитоплазменными рецепторами CRBP1 и CRBP2, что приводит к его накоплению в ядре, а не в цитоплазме [5, 22]. Неизвестно, связывается ли изотретиноин с RBP4 и как попадает в клетки. Поскольку показано, что терапия СИ не приводит к изменению уровня RBP4 в крови, можно предположить, что изотретиноин доставляется другим белком-переносчиком [23]. При избытке изотретиноина в ядре активируются механизмы, приводящие к репрессии генов, чем объясняется терапевтический эффект СИ.
СИ является «золотым стандартом» терапии тяжелых форм акне [24, 25]. Последние клинические исследования по СИ посвящены изучению влияния препарата на различные показатели безопасности терапии. Разрабатываются топические формы изотретиноина [26, 27]. СИ влияет на ряд биохимических параметров. Так, T. Sarkar и соавт. [28] показали на 60 пациентах повышение липидов крови (триглицериды — до 500—600 мг/дл, холестерин — до 250—300 мг/дл) у 25% больных после терапии СИ. В работе M. Kamal и M. Polat [29] влияния СИ на уровень витамина B12, фолата и печеночных ферментов не выявлено. По данным H. Ahmad [24], печеночные ферменты могут повышаться. G. Faghihi и соавт. [30] провели исследование на 60 больных акне средней и тяжелой формы по оценке эффективности стандартной (0,5 мг/кг/cут) и низкодозовой (0,25 мг/кг/сут) терапии СИ в течение 6 мес. Клинических различий между группами не выявили. В низкодозовой группе наблюдали меньше побочных эффектов (сухость слизистой носа у 17% больных, сухость губ — у всех) по сравнению со стандартной терапией (дополнительно наблюдали выпадение волос), что позволяет рекомендовать низкодозовую терапию. Дополнительного снижения побочных эффектов при применении СИ можно достичь при использовании сочетанной терапии. При 6-месячной терапии СИ в дозе 0,5—1 мг/кг/сут 27 больных с папулопустулезной и узловато-кистозной формами акне 2 раза в день использовали крем, содержащий омега-церамиды (8%), никотинамид (5%) и гидрофильные сахара (группа А). В группе контроля (группа Б) использовали плацебо-крем. В группе, А по сравнению с группой Б наблюдали снижение сухости, жжения и покраснения кожи, что влечет за собой повышение комплаентности терапии [31]. Проводятся исследования по разработке поддерживающей терапии после С.И. Одним из предложений является гель, в состав которого входят капсулированный в крахмальные наночастицы ретинол и стабилизированная форма ретинола гидроксипиноколона ретиноат. В данном исследовании 40 больным акне после терапии СИ до достижения ремиссии назначали топический препарат 2 раза в день на протяжении 12 мес. У 85% больных в течение года отсутствовали обострения, что авторы [32] сочли эффективной поддерживающей терапией.
В работе V. Mysore и соавт. [33] проведена ревизия ранних рекомендаций, в которых косметические процедуры (обработка кожи воском, дермабразия, химический пилинг, лазерная коррекция и т. д.) рекомендуется проводить не ранее, чем через 6 мес после С.И. На основе анализа клинических исследований авторы считают, что выполнение таких процедур безопасно для пациентов с одновременной или недавней терапией СИ.
СИ также применяется для терапии розацеа. Розацеа относится к хроническим воспалительным заболевания кожи лица с психосоциальным фактором. СИ рекомендован для терапии случаев розацеа, трудно поддающихся лечению стандартными препаратами.
Так, E. Sbidian и соавт. [34] в мультицентровом двойном слепом рандомизированном плацебо-контролируемом испытании на 156 пациентах сравнили эффективность СИ (0,25 мг/кг/сут) с плацебо для терапии сложных случаев папулопустулезной розацеа. Первичным критерием эффективности 4-месячного лечения было уменьшение числа папул/пустул на 90% по сравнению с исходным уровнем. Вторичным критерием была оценка качества жизни больных по шкале Skindex. Критерий эффективности после терапии СИ был достигнут у 57,4% по сравнению с 10,4% в группе плацебо. Показатели Skindex были значительно больше для СИ. В клинических рекомендациях глобального консенсуса розацеа (ROSCO) СИ представлен как препарат первой линии для лечения тяжелых форм папулопустулезного и фиматозного субтипов розацеа [35].
Эффективность CИ показана при очаговой алопеции, генитальных папилломах, плоских бородавках, болезни Кирле и других дерматологических заболеваниях [36—39].
Режим дозирования изотретиноина
Известен дозозависимый эффект уменьшения продукции кожного сала при применении изотретиноина. В большинстве исследований показано, что больным акне для достижения оптимального ответа на лечение и минимизации риска рецидивов необходимо назначать более высокие дозы изотретиноина и достигать более высокую кумулятивную дозу. Оптимальный режим дозирования при лечении тяжелых форм акне обычно составляет 0,5—1,0 мг/кг/сут. Курсовая доза изотретиноина должна составлять от 120 до 150 мг/кг [41]. СИ является эффективным и безопасным методом терапии и соответствует требованиям современных принципов лечения резистентных субтипов розацеа. Данные свидетельствуют о том, что применение изотретиноина в низких дозах (0,3 мг/кг) ежедневно — это эффективный и хорошо переносимый метод лечения, который в отдельных случаях может служить альтернативой терапии резистентных форм.
Для получения длительной ремиссии при лечении розацеа, в отличие от акне, требуется постоянное применение СИ. В нескольких исследованиях предлагают непрерывное применение СИ в минимальной дозе [42]. Опубликованы результаты нескольких исследований, в которых показана высокая эффективность СИ при лечении фиматоидной формы розацеа [43].
Вопросы безопасности лечения
В процессе терапии СИ следует контролировать лабораторные параметры — главным образом, показатели функции печени и липидограмму. Тератогенный эффект СИ и риск эмбриопатии, ассоциированной с приемом производных РК, — хорошо известные неблагоприятные последствия терапии ретиноидами. В связи с этим стоит принять во внимание программу управления риском iPLEDGE, утвержденную FDA (США), с целью предотвращения случаев приема изотретиноина во время беременности [44—47].
Выбор лекарственной формы изотретиноина
Одной из тенденций современной фармакологии является не столько получение новых биологических активных молекул или их модификаций, сколько создание новых фармакологических форм, способствующих увеличению биодоступности препарата. На фармацевтическом рынке появляются также и новые лекарственные формы изотретиноина, отвечающие данной задаче. В частности, в России последние несколько лет доступен изотретиноин, произведенный по технологии LIDOSE (Акнекутан). Технология LIDOSE повышает биодоступность препарата на 20% за счет увеличения растворенной фракции изотретиноина на 13,5%. Это позволяет снизить суточные и курсовые дозы изотретиноина LIDOSE на 20%: рекомендованный диапазон суточных доз CИ, произведенного по технологии LIDOSE, составляет 0,4—0,8 мг/кг, курсовых доз — 100—120 мг/кг. Уменьшение разовой и курсовой дозировки изотретиноина на 20% с полным сохранением терапевтической эффективности обусловливает уменьшение числа побочных эффектов [48, 49]. Изотретиноин плохо растворим в воде, поэтому всасывание препарата происходит лучше при его приеме с пищей. В состав лекарственной формы изотретиноина LIDOSE входят липидные компоненты, которые устраняют эту зависимость, благодаря чему комплаентность пациентов терапии изотретиноином LIDOSE значительно выше, чем при использовании традиционной лекарственной формы препарата.
Заключение
СИ широко применяется в дерматологической и косметологической практике при лечении целого ряда дерматологических заболеваний. Применение С.И. в терапии акне и розацеа с тяжелым резистентным течением является эффективным и безопасным и соответствует требованиям современных принципов лечения. В международных рекомендациях по лечению акне и розацеа СИ предложен как препарат первой линии терапии. Появление на фармацевтическом рынке РФ новых препаратов СИ, обладающих более высокой биодоступностью, позволяет повысить эффективность лечения и снизить риски появления побочных дозозависимых эффектов.
Сведения об авторах
Е.В. Матушевская — проф. каф. дерматовенерологии и косметологии, ФГБОУ ДПО «Институт повышения квалификации Федерального медико-биологического агентства»
Е.В. Свирщевская — ст.н.с. отд. клеточных взаимодействий, Институт биоорганической химии РАН
Читайте также:

