Маска на лице при болезни паркинсона
Обновлено: 23.04.2024
Назойливость при паркинсонизме. Личность при идиопатическом паркинсонизме
В литературе продолжает дискутироваться вопрос о специфических особенностях психических нарушений при разных этиологических формах паркинсонизма. Больные идиопатическим паркинсонизмом характеризуются однотипной, редуцированной по всем параметрам, тусклой аффективностью, в то время как пациенты с постэнцефалитическим паркинсонизмом отличаются выраженной аффективной неустойчивостью, повышенной эмоциональной реактивностью вплоть до неконтролируемых аффективных вспышек.
Между тем результаты исследования показали, что по большинству сопоставляемых параметров статистически значимые различия между указанными группами отсутствуют.
Достоверные отличия касались лишь двух психопатологических признаков, которые чаще встречались при постэнцефалитических формах: эйфории и своеобразной гиперсоциальности, которую партнеры по общению часто воспринимали как назойливость.
Назойливость как характерная особенность поведения при постэнцефалитическом паркинсонизме была подмечена еще в 1939 г. М. И. Авствацатуровым, который даже обозначил ее специальным термином (акайрия, «симптом приставания»). По-видимому, этот симптом при современных формах паркинсонизма встречается реже. В наших клинических наблюдениях симптом назойливости проявлялся в рамках более широкого синдрома своеобразной гиперсоциальности.

Предметом постоянных забот такого рода больных могут стать межличностные отношения в семье или ближайшем социальном окружении. Своим первейшим долгом они считают проявление участия й оказание помощи кому-либо. Гипертрофия этих черт приводит нередко к конфликтам, что дает повод к обидам и настойчивой борьбе за «справедливость», при этом больные ищут сочувствия и понимания у широкого круга окружающих. Таким образом, поведение, которое описывается термином «назойливость» у больных постэнцефалитическим паркинсонизмом, является результатом весьма специфической трансформации в системе ценностей больного с повышением субъективной значимости социальных мотивов. Поведение этих лиц, несмотря на упомянутую назойливость, часто характеризуется подчеркнутой вежливостью, предупредительностью, уступчивостью, мягкостью и сенситивностью.
Этот своеобразный поведенческий синдром в явном виде встречается в настоящее время достаточно редко.
По мнению Билленкампа, больные идиопатическим паркинсонизмом отличаются более стабильным и нейтральным настроением по сравнению с пациентами, имеющими постэнцефалитический синдром. Грубые аффективные нарушения у больных постэнцефалитическим паркинсонизмом обычно бывают максимально выражены в постэнцефалитическом периоде; но по мере формирования синдрома паркинсонизма они, как правило, постепенно сглаживаются и тускнеют в своей выраженности. По мнению М. О. Гуревича, с прогрессированием паркинсонизма также блекнут грубые психотические нарушения; галлюцинации, так же как и бредовые идеи, становятся отрывочными или исчезают совсем. В целом при постэнцефалитических формах паркинсонизма можно ожидать более разнообразных форм нарушения поведения, имеющих в своей основе изменения активности аффектов и влечений.
Челезия и Ваннамейкер на основе анализа довольно большого клинического материала пришли к выводу, согласно которому при любых формах паркинсонизма (постэнцефалитический, атеросклеротический и токсический) развиваются в основном сходные психические изменения (депрессия и деменция).
Своеобразным итогом современных психодиагностических исследований паркинсонизма являются представления о том, что нарушения психической сферы у больных паркинсонизмом «касаются в гораздо меньшей степени памяти, перцептивных, когнитивных и интеллектуальных функций, которые лишь в отдельных случаях могут подвергаться частичным нарушениям, по сравнению с энергетически-эмоционально-мотивационной сферой, которая характеризуется относительно однотипным снижением энергетического уровня, «редукцией побуждений, сужением эмоциональной экспрессии, повышенной зависимостью от окружающих» и т. д.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Акинетический криз — это остро возникающее расстройство двигательной активности в виде резкого затруднения произвольных движений, развивающееся при болезни Паркинсона. Клиническая картина характеризуется олигобрадикинезией, гипомимией, дизартрией, пластическим повышением тонуса мышц, дисфагией, вегетативными симптомами. Диагностика включает лабораторные исследования, МРТ, ПЭТ, ОФЭКТ мозга. Проводится комплексное лечение, включающее купирование неотложных состояний, устранение провоцирующего фактора, симптоматическую терапию, прием дофаминергических препаратов. Дополнительно применяются блокаторы глутаматной системы, глюкокортикостероиды.
МКБ-10



Общие сведения
Акинетический криз (острая акинезия) представляет собой опасное для жизни осложнение болезни Паркинсона (БП). Относится к неотложным состояниям, возникающим в результате выраженной гипофункции дофаминергической системы. Впервые подробно описан в 80-х годах ХХ столетия у больных в перерыве медикаментозной терапии. Острая акинезия является относительно редким явлением и возникает у 0,3% пациентов с БП, вторично по отношению к инфекционной патологии или другим факторам. Акинетический криз не характерен для ранних стадий паркинсонизма даже при отмене специфической терапии в течение 14 дней. Патология чаще отмечается при акинетико-ригидной форме заболевания.

Причины
Акинетический криз может быть спровоцирован рядом факторов, таких как лечебные манипуляции, отмена лечения, различные заболевания, возникающие на фоне БП. Наиболее частой причиной выступает прекращение пациентом необходимого лечения. Другими этиофакторами считаются:
- Изменение схемы лечения. Коррекция проводимой терапии, дозы, частоты приема, замена препарата могут спровоцировать акинетический криз.
- Прием отдельных фармпрепаратов. Нейролептики, резерпин, метоклопромид, циннаризин способны блокировать рецепторы дофамина, вызывая декомпенсацию.
- Заболевания желудочно-кишечного тракта. Инфекционные поражения, новообразования, состояния после резекции кишечника, острые и хронические формы гастроэнтеритов приводят к расстройству всасывания лекарственных препаратов. Возникает ситуация, схожая с прекращением приема антипаркинсонических медикаментов.
- Электролитные нарушения. Расстройства натриевого баланса и их неадекватная коррекция способны вызвать демиелинизацию на уровне моста мозга, усугубляющую дофаминные нарушения.
- Глубокая церебральная электростимуляция. Применяется как метод лечения БП. Разрядка батареи, сбой в работе стимулятора, его неправильное программирование влекут нарушение стимуляции, эквивалентное отсутствию медикаментозного лечения.
Патогенез
Патофизиологический механизм акинетического криза неясен. Патология является не просто отражением выраженной паркинсонической гипокинезии, а скорее специфическим состоянием с неизвестными факторами риска, которые не связаны напрямую со стадией заболевания, дозировкой лекарственных средств. Одной из основных особенностей выступает длительная (в среднем 11 дней) невосприимчивость к антипаркинсоническим препаратам.
Предположительно в основе патогенеза акинетического криза лежит временная блокировка дофаминовой системы, в результате чего она перестает отвечать на лечение, которое обычно дает быстрый двигательный эффект. В ходе исследований в 2014 году продемонстрировано резкое снижение способности стриатума к пресинаптическому накоплению меченого транспортера дофамина во время акинетического криза, ее последующее медленное восстановление.

Симптомы акинетического криза
Развитие симптоматики наблюдается в период от 18 часов до 7 суток от времени прекращения лечения, действия иного провоцирующего этиофактора. Типично значительное усиление гипокинезии и ригидности вплоть до полного отсутствия двигательной активности. Акинетический синдром сопровождается признаками вегетативной дисфункции: лабильностью АД, тахикардией, учащенным дыханием, потливостью. Характерны расстройства мочеиспускания. В отдельных случаях спустя 72 часа от развития акинезии возникает гипертермия центрального генеза, температура тела поднимается до 41°С.
Сознание нарушено. Часто наблюдается сопор, в тяжелых случаях — коматозное состояние. Больной дезориентирован во времени, ориентировка личности сохранена. Отмечается дисфагия, тихая невнятная речь, дизартрия. Возможны миоклонии, генерализованные судорожные припадки.
Осложнения
Плохо контролируемая высокая гипертермия в сочетании с дисфагией быстро приводит к обезвоживанию. Возникают водно-электролитные расстройства, изменяются реологические свойства крови, что приводит к тромбообразованию. На этом фоне вероятна эмболия легочной артерии. В ряде случаев наблюдается почечная недостаточность. Нарушения глотания осложняются попаданием пищи в дыхательные пути, развитием асфиксии, аспирационной пневмонии. Без оказания своевременной неотложной помощи состояние может привести к смертельному исходу.
Диагностика
При обследовании пациента врач-невролог выявляет олигобрадикинезию, повышение мышечного тонуса по пластическому типу. Адекватная оценка мышечной силы затруднена вследствие выраженного снижения двигательной функции. Сенсорная сфера остается сохранной. Уровень сознания может варьировать от ясного до сопора, комы. Лицо гипомимичное, симметричное. Отмечается дизартрия, дисфагия, рефлексы орального автоматизма. Перечень необходимых лабораторных обследований при акинетическом кризе включает:
- Клинический анализ крови. Позволяет выявить инфекционные осложнения, повышение количества тромбоцитов.
- Биохимический анализ крови. Необходим для диагностики электролитных нарушений, оценки функции почек.
- Биохимический анализ мочи. Решающее значение имеет при развитии почечной недостаточности. Назначается вместе с мониторингом суточного диуреза.
- Коагулограмма. Гематологический анализ позволяет определить состояние свертывающей системы, оценить угрозу тромбообразования.
Подтверждение диагноза проводится после получения результатов нейровизуализации и других дополнительных исследований. Инструментальные обследования также необходимы для осуществления дифференциальной диагностики. Пациентам рекомендованы:
- МРТ головного мозга. Характерно повышение интенсивности сигнала в церебральном веществе лобной и теменной локализации. Очаговые изменения, масс-эффект, перифокальный отек не визуализируются. Возможно диагностирование атрофии коры, среднего мозга.
- Церебральная ПЭТ. Необходима для оценки поглощения F-ДОФА в полосатом теле. Значительное снижение на фоне дофаминергического лечения свидетельствует в пользу акинетического криза.
- ОФЭКТ. Проводится с целью визуализации транспорта дофамина. Выявляет блок его связывания в стриатуме.
Дифференциальная диагностика
Акинетический синдром при БП следует отличать от двигательных ограничений при иных заболеваниях. Миастения характеризуется гипокинезией, обусловленной мышечной слабостью, пластический тонус отсутствует. Типичным симптомом миастенического криза выступает птоз. Проводится дифдиагностика с кататоническим ступором. Для последнего характерно наличие психических отклонений в анамнезе, гипокинезия обусловлена заторможенностью. Отличительной особенностью является сопротивление больного попыткам поменять принятую им позу.

Лечение акинетического криза
Первичные неотложные лечебные мероприятия направлены на поддержание жизненно важных функций и профилактику осложнений. При дыхательных расстройствах проводится интубация и подключение ИВЛ. Выраженная дисфагия является показанием к зондированию, предупреждающем асфиксию.
Инфузионная терапия направлена на нормализацию водно-электролитного состояния. Профилактика тромбоза осуществляется путем компрессионного бинтования нижних конечностей, назначения антитромбоксантов. При острой почечной недостаточности проводится гемодиализ. При подозрении на бактериальную инфекцию рекомендованы антибиотики.
Наряду с неотложной терапией пациентам необходима ранняя стимуляция метаболизма дофамина. Следует устранить спровоцировавший акинезию триггер, обеспечить эффективное всасывание вводимых фармпрепаратов. Базовыми в фармакотерапии акинетического криза выступают следующие группы лекарственных средств:
- Дофаминергические препараты. Применяются с увеличением исходной дозироки. Доза подбирается с учетом генеза криза. Введение внутрь осуществляется в растворенной в воде форме. Терапия продолжается независимо от наличия эффекта, поскольку он может наступить спустя 11 дней.
- Блокаторы глутамата. Гиперактивация глутаматной системы усугубляет дофаминовую декомпенсацию, поэтому необходимо ее купирование. Проводится внутривенное введение с последующим переходом на пероральную форму.
- Кортикостероиды. В современной неврологии рассматриваются в качестве дополнительной терапии острой акинезии, поскольку глюкокортикоидные рецепторы были обнаружены на дофаминергических нейронах. Применение глюкокортикостероидов в комплексной терапии позволяет добиться более раннего восстановления сознания, снижения температуры тела, нормализации вегетативных функций.
Прогноз и профилактика
Летальность больных с акинетическим кризом составляет около 15%. Смертельные исходы обусловлены преимущественно осложненными формами, отсутствием своевременной медицинской помощи. Своевременная постановка диагноза и проведение комплексного лечения обеспечивают благоприятный прогноз.
Профилактика акинетического криза заключается в постоянном приеме дофаминергических препаратов без периодов «лекарственных каникул», аккуратной смене медикамента и коррекции дозировки. Снижение дозы или замену лекарства при его кажущейся неэффективности должен производить только врач. Больным с БП необходимо избегать прием фармакологических средств, блокирующих ДОФА-рецепторы, своевременно обращаться за медицинской помощью при любой патологии со стороны органов пищеварения.
1. Двигательные функции и дискинезии при болезни Паркинсона: новые возможности терапии/ Нодель М.Р., Яхно Н.Н.// Неврологический журнал. - 2007. - 12 (2).
2. Острая декомпенсация при болезни Паркинсона/ И.В. Литвиненко, И.В. Красаков// Нервные болезни. - 2021. - 1.
3. Паркинсонизм: акинетический криз/ Левин О.С.// Экстренная медицинская помощь / под ред. В.И. Бородулина. - 2006.
Психомоторные функции при паркинсонизме. Мимика у больных при паркинсонизме
Специфические двигательные нарушения при паркинсонизме с неодинаковой степенью проявляются в разных звеньях моторной экспрессии у одного и того же больного. Все движения расстраиваются не только из-за гипокинезии, но и в связи с ригидностью и дрожанием. При этом дрожание, гипокинезия и ригидность резко различаются клиническими проявлениями, патогенезом и той ролью, которую каждый из этих симптомов играет в психомоторной дезорганизации при паркинсонизме.
В основе всех трех кардинальных симптомов паркинсонизма лежит патологический процесс на церебральном уровне. Однако если при ригидности и дрожании механизмы симптомообразования непосредственно связаны с периферическим сервомеханизмом спинального уровня, то гипокинезия является непосредственным отражением центральных нарушений, касающихся того уровня психомоторики, который ответствен за «опережающее программирование» и «стратегию» движения. Учет этих особенностей симптомообразования, свидетельствующих об одновременном участии в патогенезе паркинсонизма разных уровней нервной системы, необходим для правильного понимания клинических проявлений заболевания.
Нередко выявляется тенденция к противоположной динамике дрожания и проявлений акинетико-ригидного синдрома у одного и того же больного. Больные с незначительно выраженной гипокинезией, как правило, имеют дрожательную форму паркинсонизма.
При нарастании степени ригидности и акинезии дрожание как бы отступает в клинической картине на второй план. На ранних этапах заболевания нередко обнаруживается тенденция к разной локализации дрожания (преимущественно дистальные отделы) и ригидности (преимущественно проксимальные отделы) в руках. По мере нарастания степени тяжести заболевания эти различия постепенно сглаживаются.
Мимика у больных при паркинсонизме
Мимика относится к сложноорганизованным формам выразительных телодвижений и выполняет важные психологические и социальные функции. При паркинсонизме мимические нарушения в той или иной степени наблюдаются практически у всех больных. Степень мимических нарушений зависит в основном от выраженности гипокинезии, характера эмоциональных нарушений и скорости прогрессирования заболевания.
По мере развития болезни происходит постепенное сглаживание индивидуальных мимических особенностей, в связи с чем больные по динамике мимической выразительности становятся похожими друг на друга. Выпадают наиболее тонкие мимические нюансы, теряются многогранность и гармоничность мимической игры. Прогрессирующее обеднение мимики приводит к характерному «застывшему» выражению лица.
Выражение глаз, отражающее эмоциональное состояние, имеет у этих больных две довольно типичные тенденции, иногда закономерным образом сменяющие друг друга. У части больных лицо красноречиво отражает состояние сосредоточенной тревоги и беспокойства с выразительным напряженным взглядом. Когда же мимика особенно бедна и однотонна, мы говорим о ее ста-туеобразности.
У таких больных лицо малоподвижное, взгляд вялый и апатичный, «ледяное» выражение лица. Отмеченная динамика мимической экспрессии отражает, по-видимому, не только выраженность гипокинезии, но и эволюцию эмоционально-личностных особенностей этих больных.
При достаточно выраженной гипокинезии у больных можно выявить так называемую тоническую фиксацию мимической реакции, когда мимика после того или иного аффекта медленно, с большим запозданием, возвращается в исходное состояние. Редкое моргание (симптом Мари) — характерное проявление мимических нарушений, которое часто является манифестацией гипокинезии в мышцах лица.
В норме моргание совершается с частотой несколько раз в минуту. Его урежение может служить удобным и чувствительным тестом для обнаружения гипокинезии.
Маскообразность лица иногда легче заметить, если наблюдать за больным «со стороны», когда он находится наедине с собой или общается с другими лицами. В процессе эмоционального контакта с больным его мимические нарушения могут временно компенсироваться с той или иной степенью успешности. При выраженной акинезии мимический дефект может быть очень стабильным.
Мимические нарушения возникают прежде всего в связи с формированием акинезии и тесно с ней связанных эмоционально-волевых нарушений.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Болезнь Паркинсона — медленно прогрессирующее дегенеративное заболевание центральной нервной системы, основными проявлениями которого являются такие двигательные нарушения, как гипокинезия, ригидность мышц, тремор покоя, постуральные расстройства. Кроме этого при болезни Паркинсона развиваются вегетативные, аффективные и другие расстройства. Различают истинный паркинсонизм (болезнь Паркинсона) и синдром паркинсонизма, который может сопровождать многие неврологические заболевания (ЧМТ, опухоли головного мозга, инсульты, энцефалиты и пр.). При подозрении на болезнь Паркинсона пациенту необходимо пройти электроэнцефалографию, реоэнцефалографию, МРТ головного мозга.
МКБ-10
Общие сведения
Болезнь Паркинсона — медленно прогрессирующее дегенеративное заболевание центральной нервной системы, основными проявлениями которого являются такие двигательные нарушения, как гипокинезия, ригидность мышц, тремор покоя, постуральные расстройства. Кроме этого при болезни Паркинсона развиваются вегетативные, аффективные и другие расстройства.
Классификация болезни Паркинсона
Классификация болезни Паркинсона основывается на возрасте начала болезни:
- ювенильная (ювенильный паркинсонизм)
- с ранним началом
- с поздним дебютом
Также известны различные классификации синдрома паркинсонизма:
- дрожательные
- дрожательно-ригидные
- ригидно-дрожательные
- акинетико-ригидные
- смешанные
Однако данные классификации болезни Паркинсона и синдрома паркинсонизма не считаются безупречными. Поэтому на сегодня общепринятого подхода в этом вопросе не существует.
Этиология и патогенез болезни Паркинсона
Современной медициной достигнут определенный прогресс в понимании молекулярных и биохимических механизмов болезни Паркинсона. Не смотря на это, остается неизвестной истинная этиология спорадических форм этого заболевания. Большое значение имеют генетическая предрасположенность и факторы внешней среды. Сочетание и взаимодействие этих двух факторов инициируют процесс дегенерации в пигментсодержащих, а впоследствии и других нейронах ствола головного мозга. Такой процесс, однажды возникнув, становится необратимым и начинает экспансивное распространение по всему мозгу. Более других белковых субстанций нервной системы наибольшему разрушению подвергается альфа-синуклеин. На клеточном уровне механизм этого процесса выглядит как недостаточность дыхательных функций митохондрий, а также окислительный стресс — основная причина апоптоза нейронов. Однако в патогенезе болезни Паркинсона принимают участие и другие факторы, функции которых остаются не раскрытыми до сих пор.
Клиническая картина болезни Паркинсона
Существует тетрада двигательных симптомов болезни Паркинсона: тремор, ригидность, гипокинезия, нарушения постуральной регуляции. Тремор — самый очевидный и легковыявляемый симптом. Наиболее типичен для паркинсонизма тремор покоя, однако возможны и другие виды тремора, например: постуральный тремор или интенционный тремор. Мышечная ригидность может быть малозаметной на начальных стадиях, чаще при дрожательной форме болезни Паркинсона, но очевидной при выраженном синдроме паркинсонизма. Большое значение имеет ранее выявление минимальной асимметрии тонуса в конечностях, так как асимметрия симптомов — характерный признак всех стадий болезни Паркинсона.
Гипокинезия является облигатным симптомом паркинсонизма любой этиологии. На начальных стадиях болезни Паркинсона выявление гипокинезии может затруднено, поэтому прибегают к демонстративным приемам (например, быстро сжать и разжать кулак). Ранние проявления гипокинезии можно наблюдать в элементарных действиях, направленных на самообслуживание (бритье, чистка зубов, застегивание мелких пуговиц и др.). Гипокинезия — это брадикинезия (замедленность движений), олигокинезия (уменьшение количества движений), а также уменьшение амплитуды движений и снижение их скорости. По причине гипокинезии при болезни Паркинсона нарушается индивидуальный «язык тела», в том числе жесты, мимика, речь и пластичность моторики.
Постуральные нарушения при болезни Паркинсона проявляются довольно рано (например, ассиметрия вытянутых вперед рук). Однако чаще всего они привлекают внимание врачей уже в дезадаптационной стадии (III стадия). Объяснением этому может служить тот факт, что постуральные нарушения в сравнении с другими симптомами болезни Паркинсона менее специфичны для нее.
Кроме вышеупомянутых основных проявлений паркинсонизма, болезни Паркинсона сопутствуют и другие симптомы, которые в некоторых случаях могут выходить на первый план клинической картины. Причем степень дезадаптации пациента в таких случаях ничуть не меньше. Перечислим только некоторые из них: слюнотечение, дизартрия и/или дисфагия, запор, деменция, депрессия, нарушения сна, дизурические расстройства, синдром беспокойных ног и другие.
Различают пять стадий болезни Паркинсона, каждая из которых отражает степень тяжести заболевания. Наибольшее распространение получила классификация, предложенная в 1967 году Хеном и Яром:
- 0 стадия — двигательные проявления отсутствуют
- I стадия — односторонние проявления заболевания
- II стадия — двусторонние симптомы без постуральных нарушений
- III стадия — умеренная постуральная неустойчивость, но пациент не нуждается в посторонней помощи
- IV стадия — значительная утрата двигательной активности, но пациент в состоянии стоять и передвигаться без поддержки
- V стадия — в отсутствие посторонней помощи пациент прикован к креслу или постели
Диагностика
Клиническая диагностика болезни Паркинсона проходит в три этапа.
1-ый этап
Распознавание синдрома паркинсонизма и его синдромальная дифференциация от своих неврологических и психопатологических синдромов, так или иначе схожих с истинным паркинсонизмом. Истинный паркинсонизм — это гипокинезия в сочетании с одним из следующих симптомов: тремор покоя (4-6 Гц), мышечная ригидность, постуральная неустойчивость, не связанная с первичными вестибулярными, зрительными и мозжечковыми нарушениями.
2-ой этап
Исключение иных заболеваний, которые могут проявляться синдромом паркинсонизма. Существует несколько критериев исключения болезни Паркинсона:
- окулогирные кризы
- терапия нейролептиками перед дебютом заболевания
- наличие в анамнезе повторных инсультов со ступенеобразным прогрессированием симптомов паркинсонизма, достоверный энцефалит или повторные ЧМТ
- продолжительная ремиссия
- исключительно односторонние проявления в течение более 3 лет
- мозжечковые симптомы
- надъядерный паралич взора
- ранее яркое проявление деменции
- ранее яркое проявление вегетативной недостаточности
- симптом Бабинского
- опухоль головного мозга или открытая гидроцефалия
- неэффективность больших доз леводопы
- интоксикация МФТП
3-й этап
Выявление симптомов, подтверждающих болезнь Паркинсона. Для этого необходимо наличие как минимум трех из нижеперечисленных критериев:
- односторонние проявления в дебюте болезни
- наличие тремора покоя
- асимметрия симптомов (с большей степенью выраженности на стороне тела, с которой началось заболевание)
- 70-100%-реакция на терапию леводопой
- прогрессирующее течение заболевания
- эффективность леводопы в течение 5 лет и более
- продолжительность заболевания 10 лет и более
Для обследования пациентов с подозрением на болезнь Паркинсона применяют реоэнцефалографию, ЭЭГ, методы нейровизуализации: КТ головного мозга и МРТ.
Дифференциальный диагноз
Болезнь Паркинсона необходимо дифференцировать от всех заболеваний, которые сопровождаются синдромом паркинсонизма: вторичный паркинсонизм, псевдопаркинсонизм, «паркинсонизм плюс». Около 80% случаев синдрома паркинсонизма приходится на болезнь Паркинсона.
Следует помнить об определенных клинических особенностях паркинсонизма, которые должны вызывать сомнения в диагнозе болезнь Паркинсона, например: неэффективность леводопы, отсутствие тремора, симметричность двигательных нарушений, ранние проявления признаков периферической вегетативной недостаточности.
Лечение болезни Паркинсона
Пути лечения болезни Паркинсона существенно различаются на ранних и поздних стадиях заболевания, поэтому их стоит рассматривать раздельно.
Лечение болезни Паркинсона на ранних стадиях.
Ранее диагностирование болезни Паркинсона не всегда означает незамедлительное начало какой-либо лекарственной терапии. Для определения сроков начала лекарственного лечения необходимо учитывать тяжесть заболевания, продолжительность заболевания, темп его прогрессирования, любые сопутствующие заболевания, а также «личные факторы» (профессиональное, социальное и семейное положение пациента, психическое состояние, особенности личности и т. д.). Цель такой терапии — восстановление (достаточный регресс) нарушенных функций посредством минимально возможных доз.
Лекарственная терапия на ранней стадии болезни Паркинсона подразумевает использование препаратов, увеличивающих синтез дофамина в мозге, стимулирующих его выброс и блокирующих обратное его поглощение, угнетающих распад дофамина, стимулирующих дофаминовые рецепторы и препятствующие гибели нейронов. К таким препаратам относятся амантадин, селективные ингибиторы МАО-В (селегилин и др.), агонисты дофаминовых рецепторов (пирибедил, прамипексол и др.). Допускается применение вышеуказанных препаратов как в виде монотерапии (чаще), так и в различных комбинациях.
Вышеперечисленные препараты значительно уступают по эффективности препаратам леводопы, однако для лечения болезни Паркинсона на ранних стадиях они вполне подходят. Теоретически на ранних стадиях болезни Паркинсона агонисты дофаминовых рецепторов способны отсрочить назначение леводопы, а на поздних стадиях — снизить ее дозу. Однако не в их пользу говорит большое количество побочных эффектов (язва желудка, ортостатическая гипотензия, психические нарушения, эритромелалгия, ретроперитонеальный фиброз и др.) и способность снижать чувствительность постсинаптических дофаминовых рецепторов.
Четкие критерии, определяющие оптимальное время начала лечения препаратами леводопы, отсутствуют. Тем не менее, следует учитывать возраст пациента (по возможности после 60-70 лет), избегать раннего назначения леводопы, при подборе дозы ориентироваться на «откликаемость» пациента на препарат, улучшений в его профессиональной и социальной деятельности.
Лечение болезни Паркинсона на поздних стадиях.
В независимости от характера течения болезни Паркинсона обязательно происходит постепенная трансформация клинической картины заболевания. Со временем прогрессируют уже присутствующие нарушения и появляются новые, большинство из которых с трудом поддается терапии, оказывая тем самым сильное стрессорное воздействие на пациента. Кроме этого, меняется привычный эффект от леводопы — снижается эффективность препарата, нарастают лекарственные дискинезии (как результат гиперчувствительности дофаминовых рецепторов).
Снижение эффективности терапии проявляется снижением срока лечебного действия каждой лозы леводопы. Формируется феномен «включения-выключения», единственным способом борьбы с которым становится постепенное повышение дозы леводопы, а это в свою очередь запускает порочный круг, порождающий новые проблемы, бороться с которыми становится все тяжелее. Реальная помощь в данном случае может быть оказана двумя способами: назначением дополнительной дозы леводопы в целях сокращения интервалов между приемами; добавлением в схему лечения ингибитора КОМТ и переводом пациента на терапию комбинированным препаратом леводопы и энтакапона.
Побочные эффекты терапии леводопой. Одно из проявлений снижения порога чувствительности к некоторым побочным эффектам — тенденция к появлению оральных (или иных) гиперкинезов на фоне симптомов гиперкинезии. Таким образом, в клинической картине болезни Паркинсона парадоксальным образом сочетаются симптомы избытка дофамина (оральные гиперкинезы) и его дефицита (гипокинезия). Снижение дозы леводопы в такой ситуации дает только временное устранение гиперкинеза, через некоторое время он появляется вновь. Ортостатическая артериальная гипотензия при болезни Паркинсона проявляется обычно относительно резким снижением артериального давления вскоре после приема леводопы. Таким побочным эффектом обладают и леводопа, и агонисты дофаминовых рецепторов, поэтому после определения причины побочного эффекта необходимо уменьшить дозу соответствующего препарата.
Психические нарушения при болезни Паркинсона могут проявляться в виде депрессии, тревоги, апатии, зрительных галлюцинаций, ажитации. Кроме того, типично появление запоминающихся, ярких сновидений. Со временем все вышеперечисленные нарушения прогрессируют и рано или поздно проявляются и в состоянии бодрствования. Терапию таких психических нарушений необходимо проводить совместно с психиатром. Иногда достаточно избавить пациента от тревоги и страха, так как именно они провоцируют более грубые психические нарушения. Большинство лекарственных дискинезий проявляется на пике действия препарата. Наиболее надежный способ их устранения — уменьшение разовой дозы леводопы с сохранением суточной дозы препарата. Поэтому дробный прием малых доз леводопы — наилучший способ предотвращения дискинезий такого типа.
В терминальной стадии болезни Паркинсона основные сложности связаны с кахексией, утратой способности к стоянию, ходьбе и самообслуживанию. В это время необходимо проведение целого комплекса реабилитационных мероприятий, направленных на обеспечение оптимальных условий для повседневной бытовой деятельности пациента. Следует помнить, что на поздних стадиях болезнь Паркинсона становится тяжелым бременем не только для самого пациента, но и для его семьи, членам которой может потребоваться не только терапевтическая, но иногда и специализированная помощь.
Хирургическое лечение болезни Паркинсона заключается в проведении стереотаксической деструкции вентролатерального ядра таламуса и субталамического ядра, а также глубокой стимуляции мозга. В случае выраженного акинетико-ригидного синдрома рекомендована паллидотомия, а также глубокая электростимуляция бледного шара и субталамического ядра.
Прогноз
Для болезни Паркинсона характерно неуклонное нарастание выраженной симптоматики. В 25% случаев в течение первых пяти лет заболевания наступает инвалидизации или смерть. У 89% пациентов, переживших 15 лет течения болезни Паркинсона, неизбежно наступает тяжелая степень инвалидности или смерть. Отмечено снижение уровня смертности пациентов с болезнью Паркинсона в связи с началом применения леводопы, а также рост продолжительности жизни.
а) Терминология:
1. Сокращения:
• Идиопатическая болезнь Паркинсона (БП), дрожательный паралич
2. Определение:
• Прогрессирующее нейродегенеративное заболевание, преимущественно обусловленное первичной дезорганизацией компактной части черной субстанции (ЧСкч)
• Паркинсонизм: синдром, характеризующийся ригидностью, тремором, брадикинезией и постуральным дисбалансом:
о Идиопатическая болезнь Паркинсона (БП) (характерен ответ на терапию препаратом L-допа)
о Синдром «паркинсон-плюс»: паркинсонизм в сочетании с другими клиническими признаками:
- Например, деменция с тельцами Леви, множественная системная атрофия, прогрессирующий надъядерный паралич, кортикобазальная дегенерация
б) Визуализация болезни Паркинсона:
1. Общие характеристики:
• Лучший диагностический критерий:
о Истончение компактной части черной субстанции
• Локализация:
о Черная субстанция (ЧС), хвостатое ядро и скорлупа
• Размеры:
о Уменьшение (атрофия)
2. КТ признаки болезни Паркинсона:
• Бесконтрастная КТ:
о Неспецифическая атрофия больших полушарий
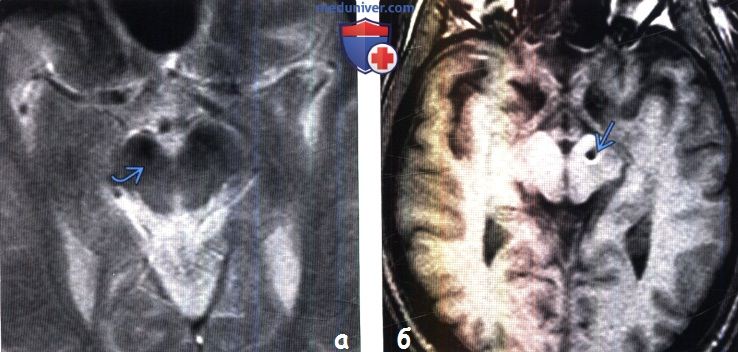
(а) MPT, T2*GRE, аксиальный срез: у пациента 61 года с болезнью Паркинсона определяется сужение компактной части черной субстанции, особенно справа, с утратой четкой дифференцировки между черной субстанцией и красным ядром.
(б) MPT, Т1 -ВИ, аксиальный срез: у пациента с болезнью Паркинсона визуализируется электрод глубокого стимулятора головного мозга. Правильное расположение электрода в субталамическом ядре: кончик электрода располагается на расстоянии 9 мм от срединной линии и находится непосредственно в структуре верхней границы ножек мозга.
3. МРТ признаки болезни Паркинсона:
• Т1-ВИ:
о Наиболее часто встречаются неспецифические признаки: распространенное расширение борозд, желудочков
о Воксел-базированная морфометрия:
- Неспецифическая потеря нейронов серого вещества (СВ) лимбической, паралимбической и префронтальной коры
• Т2-ВИ:
о У здоровых людей ЧС в верхних отделах среднего мозга представляет собой двухслойную структуру из СВ:
- Гипоинтенсивная зона в задних отделах ножек мозга = сетчатая часть черной субстанции (ЧСсч)
- Относительно гиперинтенсивная зона между ЧСсч и красным ядром (КЯ) = ЧСкч:
Некоторые авторы утверждают, что данные структуры лучше всего видны не на Т2-ВИ, а на PD-взвешенных изображениях
- Гипоинтенсивная зона, в норме наблюдаемая на аксиальных Т2-ВИ, соответствует передне-верхнему отделу ЧС, смежной ножке мозга (верхние отделы среднего мозга) и передне-медиальной части волокон ножки мозга (нижние отделы среднего мозга)
о При БП наблюдается сужение ЧСкч, трудно дифференцируемой от смежных ЧСсч и КЯ
о У некоторых пациентов с БП могут наблюдаться гиперинтенсивные на Т2-ВИ очаги в скорлупе и бледном шаре (БШ), а также уменьшение объема скорлупы
о При МРТ на ЗТ томографе у пациентов с БП в ЧСкч и каудальной части скорлупы наблюдается повышение скоростей релаксации R2, что указывает на увеличение содержания железа в них
• PD-ВИ:
о Аксиальные средневзвешенные SE-изображения у пациентов в норме: точная анатомическая локализация ЧС может быть точно определена:
- ЧС выглядит как зона гиперинтенсивного СВ, окруженного гипоинтенсивным КЯ и волокнами ножек мозга на уровне верхних отделов среднего мозга
- ЧСrx и ЧСсч неразличимы
о Аксиальные изображения со средним значением ТЕ у пациентов с БП:
- Прогрессирующая потеря нормального сигнала от ЧСкч в латеро-медиальном направлении; ЧСкч больше не определяется гиперинтенсивной
- Нечеткая граница между ЧСсч и КЯ, отражающая потерю нейронов и отложение железа
• STIR:
о «Быстрый» STIR-режим: такие же изменения, как и на PD-взве-шенных изображениях
• ДВИ:
о Значительное ↑ ИКД в скорлупе при паркинсоническом типе множественной системной атрофии (МСА-П) по сравнению с БП
о ↑ ИКД в скорлупе и хвостатом ядре:
- По сравнению с прогрессирующим надъядерным параличом (ПНП) и паркинсоническим типом множественной системной атрофии (МСА-П), при которых также определяется возрастание ИКД
о ↑ ИКД в обонятельных путях при БП по сравнению со здоровой контрольной группой
• МР-спектроскопия:
о Неспецифические изменения, ↓ отношений NAA/креатин и NAA/холин в базальных ганглиях
• DTI:
о ↓ ФА в ЧС и по ходу нигростриарного пути
- Значения ФА обратно коррелируют стяжестью клинического течения БП
о ↓ ФА в лобной доле (дополнительная моторная область (ДМО), преДМо, поясная извилина)
• Т2 или Т2*-картирование:
о Чувствительный к содержанию железа в мозговой ткани метод; ↑ ↑ скорости релаксации R2' коррелирует с наличием двигательных симптомов у пациента, а не с тяжестью протекания заболевания
4. УЗИ признаки болезни Паркинсона:
• УЗИ паренхимы мозга: гиперэхогенность ЧС при БП:
о В отличие от БП при синдромах «паркинсон-плюс» (ПНП, MCA) определяется снижение интенсивности сигнала от скорлупы (накопление железа)
5. Радионуклидная диагностика болезни Паркинсона:
• ПЭТ:
о Может использоваться для изучения функционального статуса допаминергических нейронов в ЧС, допаминовых Э2-рецепторов в базальных ганглиях или опиоидных рецепторов в базальных ганглиях
о Допаминергические нейроны в ЧС:
- ПЭТ с 18F-флюородопой: ↓ поглощения в полосатых телах пропорционально уменьшению количества допаминергических нейронов; коррелирует с тяжестью клинического течения заболевания:
Более выраженное уменьшение в скорлупе, чем в хвостатом ядре
Позволяет диагностировать раннюю/относительно бессимптомную стадию БП
о Допаминовые D2-рецепторы в базальных ганглиях
- ПЭТ с 11С-раклопрайдом; на ранних стадиях БП количество допаминергических терминалей скорлупы нормальное или повышенное, но нормализуется при прогрессировании БП, уменьшается при MCA
о Опиоидные рецепторы в базальных ганглиях:
- 11С-дипренорфин; уменьшение поглощения в скорлупе, таламусе и передних отделах поясной извилины у пациентов с дискинезиями при БП; нормальное поглощение у пациентов с БП без дискинезии
• ОФЭКТ: изменения аналогичны таковым при ПЭТ; может быть использована для изучения допаминергических нейронов ЧС или допаминовых D2-рецепторов в базальных ганглиях:
о Допаминергические нейроны черной субстанции:
- Изменения со стороны скорлупы по данным ОФЭКТ с I-123-ФП-КИФ сходны с таковыми по данным ПЭТ с 18F-флюородопой
о Допаминергические D2-рецепторы в базальных ганглиях:
- Изменения поданным ОФЭКТ с И 23-ФП-КИФ сходны с таковыми по данным ПЭТ с 11С-раклопрайдом
6. Рекомендации по визуализации:
• Лучший метод визуализации:
о МРТ с получением PD-взвешенных SE изображений и ПЭТ/ОФЭКТ
• Совет по протоколу исследования:
о PD-взвешенные SE изображения, «быстрый» STIR-режим позволяют отчетливо визуализировать ЧС как структуру из серого вещества
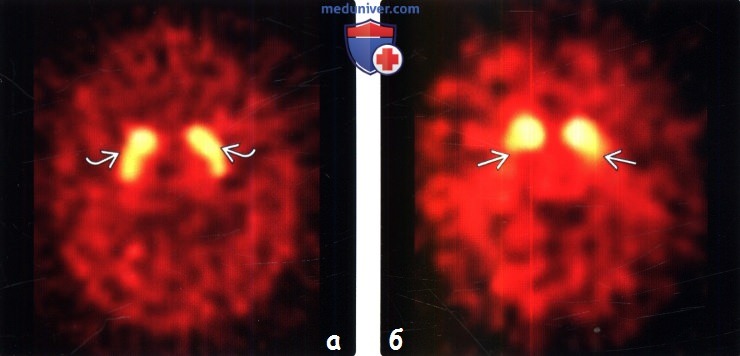
(а) ОФЭКТ с 123-ФП-КИФ с допаминовым транспортером (ДТ), аксиальный срез: наблюдается нормальное симметричное поглощение радиофармпрепарата в хвостатых ядрах и скорлупе билатерально с очень низко-интенсивной, практически незаметной, фоновой активностью.
(б) ДТ-ОФЭКТ с 123-ФП-КИФ, аксиальный срез: у пациента с идиопатической болезнью Паркинсона определяется асимметричное уменьшение накопления в скорлупе, больше справа. Обратите внимание на нормальное поглощение радиофармпрепарата в хвостатых ядрах.
в) Дифференциальная диагностика болезни Паркинсона:
1. Множественная системная атрофия (MCA):
• МСА-П: повышение интенсивности сигнала на Т2-ВИ от скорлупы и хвостатого ядра (патологическое отложение железа), в скорлупе может определяться гиперинтенсивный на Т2-ВИ ободок
• МСА-м (мозжечковый тип): t интенсивности сигнала на Т2-ВИ от средних ножек мозжечка, поперечных волокон моста (симптом «крестовой булочки»)
2. Прогрессирующий надъядерный паралич (ПНП):
• МРТ, сагиттальные Т1-ВИ: атрофия крыши среднего мозга с появлением структуры по типу «колибри»
• Вогнутость заднебоковых границ атрофированного среднего мозга с появлением структуры по типу «цветка ипомеи»
3. Кортикобазальная дегенерация:
• Истончение пред-/постцентральных извилин с расширением центральной борозды с заметным преобладанием изменений в парасагиттальных отделах
4. Деменция с тельцами Леви:
• Тельца Леви диффузно расположенные в веществе головного мозга
• Атрофия ствола мозга, ЧС и коры
5. Комплекс «паркинсонизм-деменция-боковой амиотрофический склероз»:
• Изменения со стороны кортикоспинальных трактов
г) Патология:
1. Общие характеристики болезни Паркинсона:
• Этиология:
о Изучаются различные генетические маркеры, которые увеличивают склонность к развитию БП
о Воздействие факторов окружающей среды: МФТИ (1-метил-4-фенил-1,2,3,6-тетрагидропиридин); вероятно, воздействие пестицидов
о Старение: процесс нормального старения связан с уменьшением количества нейронов в ЧСкч
• Генетика:
о Спорадический характер (в 3-5% случаев-семейный характер)
• Ассоциированные патологии:
о Увеличение содержания железа в ЧСкч
2. Макроскопические и хирургические особенности:
• Потеря пигментации ЧС и голубого пятна
3. Микроскопия:
• Потеря допаминергических нейронов в ЧС (особенно ЧСкс), голубом пятне, дорсальном ядре блуждающего нерва и безымянном веществе
• Патология Леви: дезорганизованные α-синуклеиновые конгломераты, которые формируют цитоплазматические включения внутри тел (тельца Леви) и отростков нейронов (нейриты Леви)
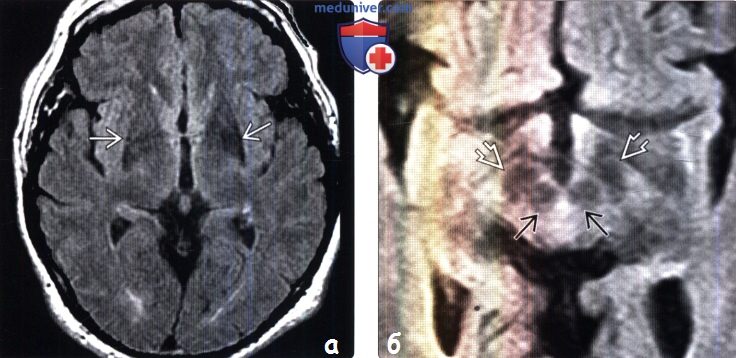
(а) MPT FLAIR, аксиальный срез: у пациента с болезнью Паркинсона отмечается патологическое уменьшение интенсивности сигнала от задних отделов базальных ганглиев, а также легкое уменьшение объема скорлупы билатерально.
(б) MPT FLAIR, аксиальный срез: у того же пациента: красное ядро и сетчатая часть практически соприкасаются друге другом, что говорит об истончении компактной части.
д) Клиническая картина:
1. Проявления болезни Паркинсона:
• Наиболее частые признаки/симптомы:
о Тремор покоя с частотой 3-5 Гц (тремор по типу «перекатывания пилюль»), ригидность по типу «зубчатого колеса», брадикинезия, шаркающая походка, «застывшее» лицо, позднее начало деменции в 40% случаев
• Другие признаки/симптомы:
о Автономная дисфункция, депрессия, нарушение сна
2. Демография:
• Возраст:
о Характерно начало заболевания между 50-60 годами
• Пол:
о М:Ж= 1,5:1
• Эпидемиология:
о Идиопатическая БП является наиболее частым двигательным расстройством
о БП является вторым по частоте встречаемости нейродегенеративным расстройством после болезни Альцгеймера
о Частота встречаемости: 1 % среди населения старше 50 лет
3. Течение и прогноз:
• Начальные проявления БП обычно асимметричны
• Медленное прогрессирование брадикинезии, мышечной ригидности и нарушений походки → в конечном итоге, инвалидность через несколько лет
4. Лечение болезни Паркинсона:
• Медикаментозное (преимущественно для молодых пациентов): леводопа, бромокриптин, амантадин, селегилин
• Хирургическое (рефрактерные к медикаментозному лечению случаи): стереотаксическая паллидотомия или глубокая стимуляция субталамического ядра, таламуса, бледного шара
е) Диагностическая памятка:
1. Обратите внимание:
• Существуют синдромы «паркинсон-плюс»
2. Советы по интерпретации изображений:
• Роль диагностической визуализации в паркинсонизме: исключить излечимую причину брадикинезии (опухоль, гематома, гидроцефалия)
• Минимальная взаимосвязь между гипоинтенсивными на Т2-ВИ зонами и отделами ЧС в патологических препаратах/на PD-взвешенных изображениях/на «быстрых» STIR-изображениях
ж) Список литературы:
1. Booth ТС et al: The role of functional dopamine-transporter SPECT imaging in parkinsonian syndromes, part 2. AJNR Am J Neuroradiol. 36(2):236—44, 2015
2. Goveas J et al: Diffusion-MRI in neurodegenerative disorders. Magn Reson Imaging. ePub, 2015
3. Kalia LV et al: Parkinson's disease. Lancet. ePub, 2015
4. Broski SM et al: Structural and functional imaging in parkinsonian syndromes. Radiographics. 34(5): 1273-92, 2014
5. Cosottini M et al: MR imaging of the substantia nigra at 7T enables diagnosis of Parkinson disease. Radiology. 271 (3):831 —8, 2014
6. Brooks DJ et al: Imaging biomarkers in Parkinson's disease. Prog Neurobiol. 95(4):614-28, 2011
Читайте также:

