Мацерация кожных покровов что это такое
Обновлено: 23.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Утолщение кожи: причины появления, при каких заболеваниях возникает, диагностика и способы лечения.
Определение
Гиперкератоз – это аномальное утолщение верхнего слоя кожи (эпидермиса) в результате избыточной инсоляции, воздействия химических веществ, частого трения или давления. Кроме того, гиперкератоз может возникать на фоне некоторых заболеваний.
Утолщение кожи происходит в роговом слое эпидермиса, который является конечной точкой процесса дифференцировки кератиноцитов - клеток, содержащих белок кератин. Именно в роговом слое кератиноциты теряют воду и ядро и превращаются в чешуйки рогового слоя – корнеоциты.
При гиперкератозе происходит ускоренная дифференцировка кератиноцитов, а физиологическое слущивание роговых чешуек с поверхности кожи, наоборот, замедляется.
Разновидности гиперкератоза
В зависимости от происхождения выделяют приобретенный и наследственный гиперкератоз.
По клиническим проявлениям.
- Мозоли – часто встречающаяся разновидность гиперкератоза. Различают несколько видов мозолей, но все они появляются вследствие утолщения кожи в местах, наиболее подверженных механическому воздействию. Причем такое изменение кожи может быть связано как с усиленными физическими нагрузками, так и с различными хроническими заболеваниями, что характерно для пожилых пациентов.
- Роговая (тилотическая) экзема проявляется гиперкератозом ладоней и подошв.
- Псориаз - аутоиммунное воспалительное заболевание, при котором на коже формируются гиперкератотические чешуйчатые бляшки.
- Актинический кератоз обычно представлен небольшими красноватыми чешуйчатыми выпуклостями, которые появляются после избыточной инсоляции. Актинический кератоз – серьезное состояние с высокой вероятностью озлокачествления и требует обязательной консультации врача.
- Себорейный кератоз характеризуется маленькими коричневыми или черными пятнами, обычно локализующимися на лице, шее, плечах и спине. Это одно из наиболее распространенных доброкачественных новообразований кожи у взрослых.
- Фолликулярный гиперкератоз («гусиная кожа») характеризуется закупоркой устьев фолликулов ороговевшими клетками эпидермиса.
- Эпидермолитический гиперкератоз - редкое наследственное заболевание, которое проявляется сразу при рождении. Новорожденные имеют красноватую кожу, иногда покрытую небольшими волдырями.
Гиперкератоз кожи может возникнуть у людей, которые пренебрегают регулярными процедурами по уходу за кожей, в результате чего отмершие клетки рогового слоя скапливают и формируют кератомы – доброкачественные новообразования.
Наша кожа постоянно подвергается воздействию неблагоприятных внешних факторов, таких как хлорированная вода и моющие средства, УФ-излучение. В результате повреждается защитный липидный слой кожи, и влага начинает интенсивно испаряться с ее поверхности, а корнеоциты теряют способность к физиологическому слущиванию.
При сахарном диабете гиперкератоз становится следствием нарушения обмена веществ и ухудшения микроциркуляции кожи.
Ношение тесной или неудобной обуви, особенно при плоскостопии, врожденных патологиях стоп, ожирении, может стать причиной утолщение кожи на стопах.
Развитию гиперкератоза шейки матки (лейкоплакии) способствует вирус папилломы человека.
Причиной гиперкератоза может стать хроническое грибковое поражение, а также опоясывающий лишай.
Считается, что симптомы утолщения и сухости кожи могут быть вызваны дефицитом витаминов А, Е, D и С.
Гиперкератоз нередко становится следствием недостатка гормона эстрогена у женщин в период менопаузы.
Заболевания и состояния, при которых развивается гиперкератоз
- Сахарный диабет.
- Ожирение.
- Плоскостопие.
- Ихтиоз.
- Псориаз.
- Экзема.
- Менопауза.
- Грибковое поражение кожи.
- Опоясывающий лишай.
- Эритродермия.
- Атопический дерматит.
- Себорейный кератоз.
Чаще всего за первой консультацией по поводу утолщения кожи обращаются к врачу-дерматологу. После тщательного осмотра, сбора жалоб, выяснения медицинской и семейной истории пациента, проведения лабораторных и инструментальных исследований может потребоваться консультация врача-эндокринолога , врача-онколога , врача-инфекциониста.
Диагностика и обследования при утолщении кожи
Тщательный сбор анамнеза с учетом всех жалоб пациента, осмотр и проведение дополнительных методов диагностики помогут установить причину гиперкератоза.
-
Клинический анализ крови с развернутой лейкоцитарной формулой для выявления воспалительных процессов в организме.
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Мацерация плода. Гемолитические болезни плода
Мацерация выражается в отслойке и отделении пластов пидермиса кожи, повышении подвижности суставов, отделении костей черепа от надкостницы и спадении черепа в результате лизиса мозга, резкой дряблости и обесцвечивании внутренних органов. Кровь разрушается путем лизиса, которому предшествует фрагментация эритроцитов. Все это стирает некоторые признаки патологических процессов.
Необходимо проводить гистологическое исследование органов мацерированного плода. В органах, где аутолиз выражен слабее, нередко можно видеть не только контуры клеток, но и ядра. Могут быть выявлены гигантские клетки в легких и почках при цитомегалии [I.iban E., 1966], признаки пневмонии эритробласты в сосудах легких, очаги эритробластоза в почках, гемосидерин в печени при окраске по Перлсу при ГБН [Гуревич П. С, 1970], изменения (в том числе обызвестления мозга) при токсоплазмозе, цитомегалии, листериозе и др. М. Becker и A. Becker (1976) по характеру распределения липидов в коре надпочечников мацерированных плодов судят о механизме внутриутробной смерти.
Обызвествлению может подвергнуться плод или только оболочки плода. Соли кальция при этом поступают из материнского организма.
Гемолитические болезни плода
Гемолитические и сходные с ними заболевания составляют значительную часть (не менее 20%) патологии перинатального периода. К числу причин, которые могут вызвать усиленное разрушение крови плода и новорожденного, следует прежде всего отнести изоиммунологический конфликт между плодом и беременной женщиной. В реультате возникает гемолитическая болезнь новорожденного (ГБН) — приобретенное гемолитическое заболевание. К этой же группе относятся чрезвычайно редкие в настоящее время врожденная малярия и экзогенные интоксикации гемолитическими ядами (свинец, мышьяк и др.).
Другую большую группу составляют наследственные гемолитические анемии. Их возникновение генетически обусловлено. Патология мембран эритроцитов вызывает развитие микросфероцитоза илиэллиптоцитоза. Патология ферментом эритроцитов может быть связана с дефицитом глюкозо-6-фосфадегидрогеназы, пируваткиназы или др. ферментов. Патология гемоглобина приводит к развитию талассемии, серповидно-клеточной анемии и др.
Внесосудистое разрушение крови при рассасывании крупных кровоизлияний (кефалогем атома, кровоизлияние в полость черепа, брюшную полость и другие) у новорожденных может привести к картине, сходной с гемолитической анемией.
Кроме того, в периоде новорожденности часты заболевания, при которых, хотя и не происходит усиления кроворазрушения, однако вследствие различных причин в организме ребенка задерживаются продукты естественного распада эритроцитов, в частности непрямой билирубин. Это приводит к тем же последствиям, что и патологический гемолиз. Причинами подобных процессов могут быть врожденная дефектность ферментных систем печени (синдром Криглера—Наджара и др.), временная незрелость этих систем (желтуха недоношенных) или нарушение процессов связывания билирубина (при врожденной микседеме, галактоземии и др.).
Инфекционные заболевания могут обусловить поражение печени или (и) привести к усилению кроворазрушения. В результате патология, имеющая черты гемолитических процессов, может развиться в некоторых случаях сепсиса, а также цитомегалии, листериоза, токсоплазмоза, ветряной оспы, герпетической инфекции и других.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Институт хирургии им. А.В. Вишневского, Москва
Институт хирургии им. А.В. Вишневского Минздравсоцразвития РФ, Москва
ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова» Минздрава России, Москва, Россия;
ГБОУ ВПО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, Москва, Россия
Патолого-анатомическая оценка давности внутриутробной гибели плода
Журнал: Архив патологии. 2017;79(6): 60‑65
Институт хирургии им. А.В. Вишневского, Москва
Представлен анализ данных литературы о возможности определения давности внутриутробной гибели плода при проведении аутопсийного исследования. Приведены макроскопические изменения внешнего вида и внутренних органов плода, а также гистологические изменения органов и плаценты, развивающиеся при мацерации. Дана микроскопическая характеристика развития ткани легких и почек в зависимости от срока гестации плода. Указаны особенности изменения массы внутренних органов в процессе мацерации, а также их нормативные показатели в зависимости от срока гестации и выраженности мацерации.
Институт хирургии им. А.В. Вишневского, Москва
Институт хирургии им. А.В. Вишневского Минздравсоцразвития РФ, Москва
ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова» Минздрава России, Москва, Россия;
ГБОУ ВПО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, Москва, Россия
Мертворождением (мертворожденным плодом), согласно определению Всемирной организации здравоохранения, является смерть продукта зачатия до его полного изгнания или извлечения из организма матери независимо от продолжительности беременности. Показатели мертворождаемости, определяемые как количество мертворожденных на 1000 рожденных живыми и мертвыми, имеют существенные отличия в различных странах и регионах, варьируя от 6,3 в Европе до 28,1 в Африке [1].
В Российской Федерации мертворождением является момент отделения плода от организма матери посредством родов при сроке беременности 22 нед и более при массе тела новорожденного 500 г и более (или менее 500 г при многоплодных родах) или в случае, если масса тела ребенка при рождении неизвестна, при длине тела новорожденного 25 см и более при отсутствии у новорожденного признаков живорождения.
Согласно Федеральному закону № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации», все мертворожденные подлежат патологоанатомическому вскрытию. Однако в ряде случаев проведение такого полноценного аутопсийного исследования может быть затруднено, в частности развитием процессов мацерации.
Мацерация — это размягчение и разрыхление плотных тканей вследствие длительного воздействия на них жидкости. В патологической анатомии термин «мацерация» используется для описания изменений тканей плода после его антенатальной гибели, обусловленных действием околоплодных вод. Поэтому в случае аутопсийного исследования тела мертворожденного перед патологоанатомом встает дополнительная задача: определение давности внутриутробной гибели плода.
Цель настоящей работы — анализ имеющихся данных литературы по морфологическим критериям оценки выраженности мацерации и определению давности внутриутробной гибели плода.
Прежде всего следует отметить, что проявления мацерации отмечаются как при внешнем визуальном осмотре тела плода, так и при микроскопическом изучении гистологических препаратов тканей и органов.
Считается, что мацерация начинается практически сразу после гибели плода, находящегося в неповрежденном околоплодном пузыре. Наиболее общими макроскопическими признаками гибели плода и последующей мацерации считаются исчезновение сыровидной смазки, отслоение эпидермиса, появление отеков, потемнение цвета органов и тканей, а также скопление красноватой жидкости в серозных полостях. Аналогичным образом изменяется и цвет амниотической жидкости, она приобретает вид «табачного сока», при этом количество амниотической жидкости уменьшается.

Характеризуя морфологические проявления процесса мацерации, необходимо отметить, что в литературе отсутствуют четкие однозначные показатели давности внутриутробной гибели плода. В связи с этим имеющиеся данные литературы о макроскопических характеристиках мацерации и давности гибели плода [4—8] представлены в виде сводной табл. 1. Таблица 1. Макроскопические изменения тела плода после его внутриутробной гибели Примечание. * — область тела: волосистая часть головы, лицо, шея, грудь, живот, спина, рука (плечо, предплечье), кисть, нога (бедро, голень), стопа, мошонка.
Наиболее ранние макроскопические признаки мацерации проявляются на коже в виде изменения ее цвета и десквамации (отслойки) эпидермиса. При этом десквамация развивается внутриутробно во время и вагинальных родов, и кесарева сечения. Кроме того, во время аутопсийного исследования доказательством развития мацерации является возможность отделения эпидермиса от дермы путем механического давления под углом на кожу. Так, примерно через 6 ч после внутриутробной гибели плода отмечаются небольшие, площадью не менее 1 см 2 , участки отслойки эпидермиса, через 18 ч площадь десквамации составляет уже порядка 5 см 2 [7]. Наиболее наглядно процессы десквамации эпидермиса визуализируются на участках кожи, расположенных над костными выступами, в частности в области суставов и крестца. Однако чем меньше срок гестации плода, тем более тесно связан эпидермис с дермой и тем позднее будут проявляться признаки десквамации [9].
Через 24 ч после гибели плода на коже определяются буллы, заполненные жидкостью. Примечательно, что выраженные процессы мацерации могут быть диагностированы и при ультразвуковом исследовании (УЗИ) погибшего плода у беременной, что требует от специалистов по УЗ-диагностике соответствующих знаний. Например, выявление признака Гало (отек мягких тканей свода черепа плода с формированием двойного контура) свидетельствует о давности внутриутробной гибели не менее 3—4 сут. В то же время обусловленное мацерацией увеличение толщины подкожной клетчатки необходимо дифференцировать от водянки плода.
Вместе с тем необходимо констатировать, что развитие мацерации, несомненно, сказывается на возможностях и качестве патолого-анатомического вскрытия и соответственно объективности заключения. Так, выраженные процессы мацерации отражаются на размере и массе как отдельных органов, так и тела плода в целом.
Действительно, смещение и захождение костей черепа сопровождается уменьшением окружности головы, размягчение соединительной ткани приводит, наоборот, к увеличению теменно-пяточного и теменно-копчикового размеров. Тем не менее во время аутопсии должны быть проведены все необходимые измерения (длина тела, теменно-пяточный и теменно-копчиковый размеры, длина стоп, окружность головы, плеч, грудной клетки). Наиболее независимой от выраженности мацерации считается длина стопы, поэтому размеры стоп обязательно должны быть отмечены в протоколе вскрытия.

Для определения нормативных показателей массы тела и внутренних органов плода рекомендуется использовать данные L. Maroun и N. Graem [10], полученные при анализе 408 мацерированных плодов (табл. 2). Таблица 2. Масса тела и внутренних органов плода (г) в зависимости от степени выраженности мацерации (M±SD) Примечание. Выраженность мацерации: 0 — отсутствие, 1 — слабая, 2 — умеренная, 3 — мацерация; в числителе среднее значение (M), в знаменателе — стандартное отклонение (SD). При этом степень выраженности мацерации оценивали только по макроскопическим признакам: слабая степень характеризовалась наличием булл на коже или небольшими участками десквамации эпителия на лице и/или туловище, умеренная — обширными участками десквамации эпителия и красным цветом кожных покровов, выраженная — коричневатым цветом кожи, перекрытием костей черепа и подвижностью суставов. В процессе исследования авторы установили, что при прогрессировании процессов мацерации отмечается значительное уменьшение массы печени и селезенки и незначительное снижение массы легких и почек (см. табл. 2). Масса сердца и головного мозга практически не зависела от выраженности мацерации.
По мнению ряда исследователей [11, 12], наиболее независимым от мацерации показателем гестационного возраста и задержки роста плода считается расчет соотношений массы органов и массы тела к теменно-пяточному размеру:
— задержка роста плода (в 30—36 нед) — масса тела (в г)∙100/теменно-пяточный размер (в см 3 ) менее 2;
— задержка роста плода (в 37—43 нед) — масса тела (в г)∙100/теменно-пяточный размер (в см 3 ) менее 2,3;
— асимметричная форма задержки роста плода (20—43 нед) — соотношение массы головного мозга и печени более 3.
Справедливости ради следует уточнить, что на основании внешних макроскопических признаков относительно корректная оценка давности гибели плода была установлена в 69% наблюдений [7].
Внутренние органы и ткани также видоизменяются вследствие процессов мацерации. Цвет органов становится темно-синюшным, а жидкость в полостях тела приобретает красноватый (геморрагический) оттенок (см. табл. 1). Подобные изменения обусловлены посмертным гемолизом, но, к сожалению, могут быть ошибочно приняты за проявление прижизненных кровоизлияний. Через 7 дней после гибели внутренние органы становятся коричневатыми, а в брюшной полости может определяться меконий.

Необходимо отметить, что даже в случаях выраженной мацерации микроскопическое исследования органов и тканей, а также плаценты позволяет определить давность внутриутробной гибели (табл. 3) Таблица 3. Гистологические изменения органов плода и плаценты после его внутриутробной гибели [13]. В связи с этим патолого-анатомическое вскрытие мацерированного плода всегда должно проводиться в полном объеме, включая взятие образцов тканей и органов для гистологического исследования.
Прогрессирующие процессы мацерации внутренних органов лежат в основе весьма специфичных их изменений, которые можно выявить при проведении так называемой виртуальной аутопсии. Действительно весьма перспективным методом посмертного исследования тела мертворожденного, является, на наш взгляд, проведение магнитно-резонансной томографии (МРТ) [14, 15]. По данным литературы [16], интенсивность МРТ-сигнала в ткани печени и легких при посмертной МРТ в Т2-режиме коррелировала с морфологическими показателями выраженности мацерации. Нами также были изучены возможности посмертной МРТ для оценки выраженности мацерации и времени наступления внутриутробной гибели плода, в результате чего выявлены прямые положительные корреляции рассчитанного МРТ-показателя мацерированности и данных аутопсии. Наиболее высокие значения показателей корреляции установлены для ткани легких (r=0,99, p=0,004), бедренной мышцы (r=0,95, p=0,003) и головного мозга (r=0,94, p=0,015) [17]. На основании проведенных исследований наиболее точно время смерти можно определить путем расчета MРТ-показателя мацерированности в ткани почки у мертворожденных с давностью смерти до 7 дней [18, 19].
Наиболее изученным и рекомендуемым микроскопическим критерием давности внутриутробной гибели плода является исчезновение базофильной окраски ядер клеток внутренних органов. Под исчезновением базофилии на препаратах, окрашенных гематоксилином и эозином, понимается изменение цвета окраски ядер с синеватого на розоватый [13]. Раньше всего (через 4 ч после гибели плода) потеря базофилии отмечается в нефроцитах канальцев почек, затем (через 8 ч) — в клетках эпителия кишечника и через сутки — в гепатоцитах и кардиомиоцитах внутреннего слоя миокарда. Увеличение времени после гибели плода сопровождается уменьшением количества клеток с базофильными ядрами: через 36 ч базофилия отсутствует во всех ядрах клеток поджелудочной железы, через 4 сут — во всех гепатоцитах и через 7 дней — во всех эпителиоцитах кишечника и надпочечников (см. табл. 3).
Проводя микроскопическое исследование органов и тканей мертворожденного на традиционных препаратах, окрашенных гематоксилином и эозином, необходимо проводить оценку степени зрелости или соответствия строения внутренних органов сроку гестации, что может использоваться для определения времени внутриутробной гибели плода.
В основе оценки степени зрелости легких лежит определение стадии развития легочной ткани:
— эмбриональная стадия (первые 7 нед гестации): примитивные бронхиальные почки, представляющие собой маленькие трубочки, расположенные в рыхлой строме и выстланные эндодермальным эпителием;
— псевдожелезистая (5—17 нед): большее количество простых трубочек, выстланных псевдомногорядным призматическим эндодермальным эпителием (в конце стадии с признаками вакуолизации);
— каналикулярная (17—26 нед): увеличение ветвления трубочек, окруженных рыхлой стромой, исчезновение вакуолизации клеток;
— мешотчатая (саккулярная) (24—37 нед): волнообразные контуры воздушных пространств, уменьшение количества стромы, увеличение сети капилляров;
— альвеолярная (с 32-й недели): зрелые альвеолы, выстланные плотно расположенными (спинка к спинке) эпителиальными клетками.
Аналогичным образом срок гестации оценивают по степени развития ткани почек:
— менее 23 нед: наличие 3 рядов клубочков, нефрогенной зоны и выраженной бластемы;
— 24 нед: наличие 5—7 рядов клубочков, нефрогенной зоны и выраженной бластемы;
— 28 нед: наличие 8—9 рядов клубочков и нефрогенной зоны, уменьшение бластемы;
— 32 нед: наличие 9—10 рядов клубочков и нефрогенной зоны;
— 36 нед: наличие 10—14 рядов клубочков, прерывистой нефрогенной зоны и отдельных фокусов незрелых нефронов.
Помимо традиционной окраски гематоксилином и эозином, применение которой может быть ограничено выраженными процессами мацерации, рекомендуется использовать трехцветную окраску или ретикулин. При помощи последних определяется строма органов и тканей, что существенным образом облегчает оценку стадии их развития. Кроме того, иммуногистохимическое исследование позволяет выявить вирусные включения [20], что способствует определению первоначальной причины смерти, в частности при неиммунной водянке.
Неотъемлемой частью патолого-анатомического вскрытия тела мертворожденного является макро- и микроскопическое изучение всех элементов последа, который должен доставляться на аутопсию без отделения пуповины. При этом выявленные патологические изменения плаценты и пуповины могут явиться причиной внутриутробной гибели плода [21]. С другой стороны, изменения плаценты после гибели плода зависят от длительности и выраженности процессов мацерации, что следует использовать для определения давности внутриутробной гибели (см. табл. 3) [13].
Считается, что после внутриутробной гибели плода плацента остается сохранной в течение первых 24 ч, после чего в ней начинают развиваться прогрессирующие морфологические изменения, достигающие максимума через 5—6 дней [13, 22]. К наиболее ранним изменениям плаценты относят увеличение количества клеток цитотрофобласта и синцитиальных почек, что необходимо дифференцировать от аналогичных проявлений преплацентарной гипоксии вообще и преэклампсии в частности [23]. Увеличение времени после гибели плода сопровождается спадением капилляров и более выраженным фиброзом стромы ворсин плаценты. Примерно через 5 дней после внутриутробной гибели плода в базальной мембране трофобласта отмечаются признаки обызвествления. Следует помнить, что дегенеративные изменения гладкомышечных клеток сосудов пуповины могут имитировать наличие нейтрофилов и соответственно вести к ошибочному заключению о васкулите сосудов пуповины [24].
Как мы уже отмечали, развитие мацерации может приводить к таким изменениям органов, которые могут быть ошибочно интерпретированы как патологические процессы. Так, размягчение ткани головного мозга может сопровождаться его перемещением в спинно-мозговой канал и выходом через межпозвонковое пространство, имитируя картину спинномозговой грыжи или нейрогенной опухоли. Снижение плотности передней брюшной стенки может сопровождаться выбуханием аутолизированной ткани печени, напоминая омфалоцеле [25].
Неспецифические изменения внутренних органов и тканей, обусловленные мацерацией, необходимо дифференцировать и при гистологическом исследовании. Микроскопические изменения в виде уменьшения и исчезновения базофилии ядер клеток внутренних органов не следует путать с некрозом. Выявление шелковицеподобных телец (тутовых ягод) в виде мелких округлых базофильных образований в просвете кровеносных сосудов отражает аномальную реакцию (окраску) эритроцитов в условиях мацерации [8]. Такие тельца наблюдаются, как правило, в течение первых 2—3 дней после внутриутробной гибели плода. Подтверждением процессов мацерации, а не циркулирующих микроорганизмов служит в таких случаях отсутствие морфологических признаков воспаления.
Таким образом, знание процессов мацерации и обусловленных ею макро- и микроскопических изменений органов и тканей погибшего плода позволяет с достаточно большой достоверностью определить момент внутриутробной гибели плода, а в ряде случаев и установить ее причину.

Мацерация кожи — это естественная реакция кожи на воздействие чрезмерного ее увлажнения или контакта с водой. Разберемся, может ли быть опасна мацерация.
Наверняка вы замечали, что от долгого пребывания в воде ваша кожа становится сморщенной и набухает. Наиболее это заметно на пальцах ног и рук, но такой процесс происходит по всей поверхности вашего тела. После длительного пребывания в воде кожа становится более мягкой, рыхлой и немного отекшей. По истечению некоторого времени все возвращается в норму. Это и есть естественный процесс — мацерация, который не несет опасности или вреда здоровью.
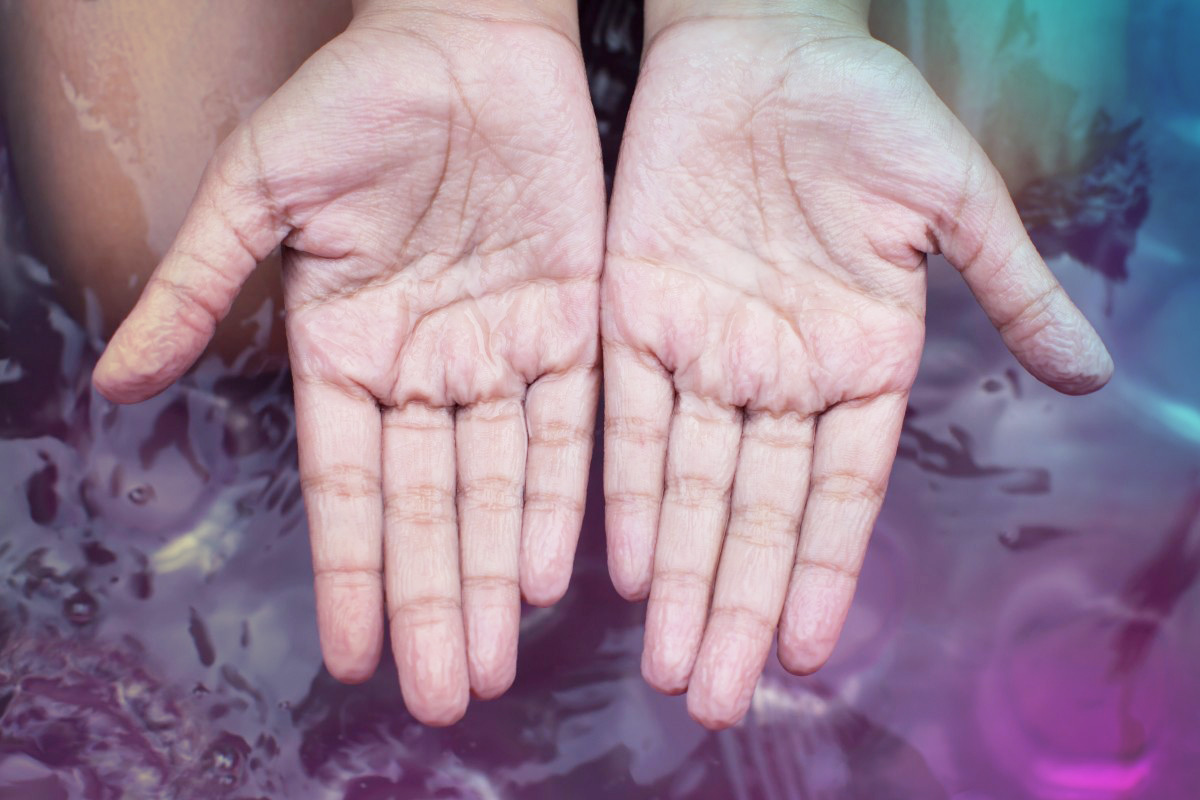
Но если вы увлекаетесь увлажнением кожи и постоянно используете различные кремы, сыворотки, гели, нанося их по нескольку раз в день на кожу лица и тела, то вы можете познакомиться с патологической мацерацией. Большой ошибкой станет использование различных косметических средств еще и перед сном. Это приведет к чрезмерному выделению кожного жира, расширению пор и воспалениям. Равно как и обезвоженная кожа, мацерация может стать спутником девушек с жирной, комбинированной и проблемной кожей — это называется “из крайности в крайность”. Именно поэтому подбирать домашний уход за кожей желательно с врачом-косметологом.

После проведения некоторых аппаратных процедур, когда нарушается целостность кожи, специалист может рекомендовать использовать необходимые заживляющие и увлажняющие средства. Важно прислушиваться к точным рекомендациям и не превышать без консультации количество раз нанесения средства, прописанных врачом. При желании как можно скорее добиться восстановления кожи можно случайно усугубить ситуацию. Чем больше раз вы наносите без необходимости средство, тем более высока вероятность того, что может начаться процесс мацерации кожи. Поэтому обязательно слушайте рекомендации врача и без консультации не нарушайте их, опираясь лишь на собственные ощущения.
Опасность мацерации
Если у вас нет проблем с кожей, то мацерация никак не опасна. Но при ее постоянном проявлении может произойти нарушение иммунитета кожи, присоединиться различные вирусы и бактерии, что может повлечь за собой возникновение разных дерматологических заболеваний и длительное лечение. Мацерация может привести к отслоению поверхности кожи, а это хорошая среда для различных инфекций. Если мацерация не проходит в течение часа — это повод обратиться к специалисту. К слову, современные технологии позволяют определить уровень увлажненности кожи, и если он близок к состоянию мацерации — врач непременно вам об этом сообщит.

Проявляться мацерация на коже лица может в виде различных шелушений, ощущения пленки или стянутости, а также желанием постоянно умываться.
Мацерацию лучше предупредить, чем лечить. Поэтому прежде чем скупать баночки, чтобы поскорее увлажнить свою кожу, потратьте свои средства и время на грамотную консультацию специалиста, который подберет только необходимое для вашей кожи и то, что действительно поможет решить проблему, а не создаст новую.
Подписывайтесь на наш Telegram-канал и не пропускайте самые полезные материалы от Beauty HUB !
ГУ "МОНИКИ им М.Ф. Владимирского", Москва
Комплексное лечение длительно незаживающих ран разной этиологии
Журнал: Клиническая дерматология и венерология. 2013;11(3): 101‑106
Третьякова Е.И. Комплексное лечение длительно незаживающих ран разной этиологии. Клиническая дерматология и венерология. 2013;11(3):101‑106.
Tret'iakova EI. Combination treatment for persistent wounds of various etiologies. Klinicheskaya Dermatologiya i Venerologiya. 2013;11(3):101‑106. (In Russ.).
ГУ "МОНИКИ им М.Ф. Владимирского", Москва
Представлены результаты наружного лечения 2% кремом Аргосульфан 47 больных с длительно не заживающими ранами разной этиологии. В результате комплексного лечения полная эпителизация трофических язв у больных с хронической венозной недостаточностью, облитерирующим эндоартериитом и липоидным некробиозом наступила у 10 (41,7%) пациентов, частичный регресс - у 14 (58,3%). Явления пиодермии разрешились у 7 (87,5%) больных, значительно уменьшились - у 1 (12,5%). Трещины в области ладоней и подошв на фоне разрешения тилотической экземы заэпителизировались у всех 15 (100%) пациентов. Крем Аргосульфан в комплексной терапии больных с длительно не заживающими ранами оказался высокоэффективным, отличался хорошей переносимостью, удобством в применении.
ГУ "МОНИКИ им М.Ф. Владимирского", Москва
Важнейшей медико-социальной проблемой является лечение длительно не заживающих ран разной этиологии. Трофические язвы и глубокие трещины кожи в области нижних конечностей, а также хронические язвенные пиодермии резко снижают качество жизни и надолго ограничивают активность больных. Особое место в лечении и профилактике этих заболеваний, предупреждающей развитие инфекционного процесса в ране и являющейся барьером на пути распространения инфекции, занимает местная терапия.
Современные высокоэффективные средства для местного лечения длительно не заживающих ран имеют ряд лечебных качеств, которые позволяют применять их с учетом фаз раневого процесса. Они должны обладать противовоспалительным и протеолитическим действием, иметь широкий антибактериальный спектр воздействия, сохранять активность в кислой среде, не вызывать явлений гипергрануляции и пигментации, иметь гипоаллергенные качества, быть нетоксичными и удобными в применении.
Существует много комбинированных препаратов для местного лечения, содержащих антибиотики или сульфаниламиды в сочетании друг с другом и/или разными антисептиками. Для таких препаратов характерно более медленное развитие микробной резистентности и более широкий охват бактериальных агентов — возбудителей инфекций.
Присутствующие в составе крема ионы серебра усиливают антибактериальное действие сульфаниламида — тормозят рост и деление бактерий путем связывания с дезоксирибонуклеиновой кислотой микробной клетки [1]. Постепенное высвобождение ионов серебра подавляет рост патогенной микрофлоры на протяжении длительного периода нахождения повязки на ране, что важно при высоком риске реинфекции госпитальными штаммами и является постоянным барьером на пути распространения инфекции.
Кроме того, ионы серебра ослабляют сенсибилизирующие свойства сульфаниламида. Существует мнение, согласно которому аппликация на кожу и слизистые оболочки сульфаниламидов нежелательна в связи с невысокой активностью и риском возникновения аллергической реакции. При нанесении такой мази на ожоговую или инфицированную поверхность могут наблюдаться жжение и боль [1]. Гидрофильная основа крема Аргосульфан, имеющая оптимальный рН и содержащая большое количество воды, обеспечивает его увлажняющее и аналгезирующее действие и приводит к уменьшению сроков заживления ран.
Благодаря минимальной резорбции Аргосульфан-крем, нанесенный даже на обширные раневые поверхности, не оказывает токсического действия, так как сульфатиазол серебра обладает небольшой растворимостью, благодаря чему концентрация лекарственного средства в ране длительно поддерживается на одинаковом уровне. Незначительное количество сульфатиазола серебра, оказавшегося в кровотоке, в печени подвергается ацетилированию и в моче находится в виде неактивных метаболитов и частично в неизмененном виде [1]. В связи с отсутствием системной абсорбции препарата можно использовать крем Аргосульфан в сочетании с другими препаратами. Повязки с кремом Аргосульфан, содержащие ионы серебра, безболезненны при наложении на раневую поверхность, не присыхают к ране и легко удаляются с ее поверхности, обладают мягким подсушивающим эффектом, хорошо проникают в некротизированную ткань и экссудат. Тканевый детрит, пропитанный препаратом, образует «защитную подушку», под которой идет форсированное образование грануляций и эпителизация.
Мы применяли крем Аргосульфан при длительно не заживающих ранах у больных с трофическими язвами разной этиологии, липоидном некробиозе, хронической язвенной и язвенно-вегетирующей пиодермиях, глубоких трещинах, осложняющих течение тилотической экземы.
Появление трофических язв может осложнить течение многих заболеваний – от болезней системы кровообращения до нарушений обмена веществ, причем развитие язвенного дефекта сопровождается как нарушением нормального кровообращения, так и изменением иннервации. Именно поэтому процесс выздоровления может потребовать применения комплексного воздействия и достаточно продолжительного лечения.
Различают варикозные, ишемические и нейротрофические язвы [2—5]. Наибольшую группу (1—2% взрослого населения) составляют больные с хронической венозной недостаточностью (ХВН) нижних конечностей, развивающейся при нарушении венозного оттока и повышении давления внутри капилляров. Основные причины ХВН — варикозное расширение вен и посттромбофлебитический синдром. При повреждении клапанов глубоких вен голени нарушается функция мышечно-венозной помпы и возникает ретроградный ток крови. Повреждение прободающих вен, которые соединяют поверхностные вены с глубокими, усугубляет венозную недостаточность. Из-за отложения фибрина в периваскулярном пространстве и угнетения тканевого фибринолиза развиваются склероз и облитерация лимфатических и мелких кровеносных сосудов. Периваскулярный фиброз нарушает доставку питательных веществ к эпидермису, что приводит к образованию варикозных трофических язв [2—5].
Ишемические язвы формируются при заболеваниях периферических артерий, в частности при облитерирующем атеросклерозе (ОАС). ОАС всегда сопровождается поражением кожи — от постепенно нарастающей ишемии до инфаркта, т.е. некроза, развивающегося при внезапном нарушении кровоснабжения в результате атероэмболии — закупорки мелких артерий фрагментами атеросклеротических бляшек. Ишемические язвы локализуются на часто травмируемых участках и местах сдавления, сопровождаются выраженными болевыми ощущениями. Смешанные язвы развиваются у больных, страдающих и ХВН, и ОАС, у которых клинически присутствуют черты обоих заболеваний [4, 5].
Причиной нейротрофических язв являются поражение чувствительных и двигательных нервов, нарушения кровообращения и атеросклероз при сахарном диабете и его осложнениях, вторичном гиперпаратиреозе, гранулематозном воспалении в ответ на дегенерацию коллагена при липоидном некробиозе [6, 7].
Липоидный некробиоз — редкий хронический дерматоз сосудисто-обменного характера, который обычно относят к группе локализованных липоидозов кожи. Провоцирующими факторами при липоидном некробиозе в 1 /3 случаев является сахарный диабет, еще у 1 /3 — нарушение толерантности к глюкозе, поэтому необходимы семейный анамнез и исследования для выявления скрытых форм сахарного диабета. Началу заболевания нередко предшествует травма. Дегенерация коллагена приводит к усиленной агрегации тромбоцитов, микроангиопатиям, поражению артериол, склерозированию и облитерации сосудов в очагах некробиоза. Сосудистые нарушения приводят к нарушению трофики и некробиотическим изменениям дермы с последующим отложением в ней липидов. Заболевание часто имеет длительное рецидивирующее течение, его выраженность не зависит от тяжести сахарного диабета, формирующиеся трофические язвы сопровождаются выраженными болевыми ощущениями и заживают, как правило, с формированием грубого рубца [6, 7].
Без специального лечения трофические язвы характеризуются низкой тенденцией к заживлению и длительным рецидивирующим течением [8, 9]. Общепризнано, что оперативное лечение ХВН и ОАС лучше выполнять после заживления трофической язвы или тщательной санации ее поверхности. Однако консервативное лечение с применением устаревших малоэффективных местных медикаментозных средств часто осложняется дерматитом, экземой, рожистым воспалением, что отодвигает сроки выполнения сосудистой операции. На выбор лекарственного препарата влияют фаза течения заболевания и выраженность воспалительной реакции (I фаза — предъязвенное состояние; II фаза — дистрофические изменения, некроз, воспаление кожи и прилежащих тканей; III фаза — очищение язвы и регенерация; IV фаза — эпителизация и рубцевание), осложнения (микозы, экзема, пиодермии, рожистое воспаление, рецидивирующий тромбофлебит, малигнизация и др.), видовой состав микрофлоры язвы. В многочисленных бактериологических исследованиях качественного состава микрофлоры поверхности трофических язв выявлена полирезистентная грампозитивная и грамнегативная микрофлора. Содержание микроорганизмов в индуративно измененных тканях, окружающих язву, иногда достигает 10 7 -10 9 микробных тел на 1 г ткани раны, что указывает на высокий риск генерализации инфекционного процесса [10]. Как правило, выделяемые микроорганизмы высокорезистентны не только к традиционным антибактериальным препаратам, но и к наиболее часто используемым в таких случаях местным средствам — растворам фурацилина, хлоргексидина, синтомициновой эмульсии, мазям с антибиотиками (тетрациклином, гентамицином) и др. На стадиях грануляции и эпителизации, для их ускорения, а также при осложнении ран дерматитом, экземой или другими проявлениями аллергии на традиционные препараты, средством выбора могут стать соли серебра, учитывая их высокую эффективность в подавлении как грампозитивной, так и грамнегативной микрофлоры, лучшую переносимость и редкость аллергических реакций даже у пациентов с отягощенным аллергоанамнезом.
Пиодермии (гнойничковые заболевания кожи) представляют собой группу дерматозов, в основе которых лежит гнойное воспаление кожи и ее придатков, а также подкожно-жировой клетчатки. На долю пиодермий приходится 1 /3 всех случаев заболеваний кожи [4, 5]. Развитию пиодермий способствуют микротравмы, мацерация и загрязнение эпидермиса, повышенное потоотделение, переохлаждение, перегревание, эндокринопатии (сахарный диабет), гипогаммаглобулинемия, недостаточное поступление белков, гиповитаминоз, нарушения иммунитета и тяжелые соматические заболевания, переутомление, хронические интоксикации, персистирующие очаги стафилококковой инфекции. Наиболее частыми возбудителями пиодермий являются золотистый и эпидермальный стафилококк (80—90% больных), в 10—15% случаев выявляется смешанная инфекция (стафилококк в сочетании со стрептококком, синегнойной палочкой, протеем, кишечной палочкой и др.) [1, 4, 10].
Хронические язвенная и язвенно-вегетирующая пиодермии относятся к глубоким стрептостафилококковым пиодермиям, характеризуются образованием плохо заживающих язвенных гнойных поражений кожи и подлежащих тканей. Нередко заболевание сопровождается ухудшением общего состояния, повышением температуры тела, слабостью, явлениями интоксикации, лимфангиитами и лимфаденитом. Язвенная пиодермия (стрептостафилококковое импетиго) проявляется фликтенами, эктимами, располагающимися на фоне эритемы. Высыпания, как правило, диссеминированные, захватывают обширные участки кожного покрова. Под корками характерно образование глубоких язв с вялыми грануляциями на дне и воспаленными мягкими краями. Стрептостафилококковое импетиго нередко является осложнением зудящих дерматозов (экземы, чесотки, атопического дерматита и др.). Хроническая язвенно-вегетирующая пиодермия характеризуется язвенными образованиями неправильной формы с выраженными вегетациями в области краев и дна. Нередко вокруг язвы присутствует застойно-розовый венчик гиперемии. Характерно хроническое течение с периодическими обострениями с появлением новых язв или серпигенизации основного язвенного образования.
Терапия пиодермий должна быть этиопатогенетической. При лечении хронических, рецидивирующих и глубоких форм пиодермий используют антибиотики (местно и системно), антисептические растворы, по показаниям глюкокортикостероиды, иммуномодуляторы, витамины, проводят вскрытие пустул и абсцессов, при необходимости — удаляют и выскабливают вегетации и некротические ткани.
Тилотическая (роговая) экзема — хроническое упорно рецидивирующее аллергическое заболевание кожи, разновидность истинной экземы. Тилотическая экзема проявляется гиперкератозом ладоней и подошв с образованием грубых роговых и корковых наслоений, сухостью кожи, а также глубокими болезненными длительно не заживающими, нередко кровоточащими трещинами. Данное заболевание характеризуется поливалентной сенсибилизацией и аутосенсибилизацией, протекает на фоне нейроэндокринных сдвигов, сопровождается изменениями в центральной и вегетативной нервной системе, нарушениями обменных процессов и трофики тканей [4, 5]. Поражение подошв и ладоней, как правило, симметричное, трещины формируются на фоне эритемы, шелушения, особенно на участках наибольшего давления и нагрузки, в том числе и на боковых поверхностях пальцев. Воспаление может быть выражено на ограниченном участке или занимать всю подошву и/или ладонь, боль в области трещин может быть более интенсивной, чем зуд. Тенденция к углублению трещин связана с возрастом пациента, длительностью болезни, холодным временем года и наличием фоновых заболеваний.
В трещины на подошвах легко может проникать пиогенная инфекция, развиваться рожистое воспаление или пиодермии. Тилотическая экзема резистентна к лечению, склонна к рецидивированию, к улучшению состояния приводят частое и сильное увлажнение кожи и немедленное прекращение ношения влажной обуви [11].
Под нашим наблюдением находились 47 больных (13 мужчин, 34 женщины) в возрасте 44—75 лет с трофическими язвами, развившимися на фоне ХВН и облитерирующего эндартериита, нарушениях кровоснабжения и трофики при липоидном некробиозе, а также с пиодермиями и тилотической экземой. Длительность заболевания составляла от 2 мес до 4 лет. Все больные в составе комплексной терапии наружно применяли крем Аргосульфан.
У 11 (23,4%) больных имелись варикозные, у 5 (10,6%) — смешанные трофические язвы, у 8 (17%) — трофические язвы при липоидном некробиозе; у 8 (17%) — хроническая язвенная и хроническая язвенно-вегетирующая пиодермии, у 15 (32%) — тилотическая экзема с глубокими трещинами на ладонях и подошвах.
У 22 (46,8%) больных дерматозы протекали на фоне эндокринных заболеваний: у 4 (8,4%) — сахарного диабета, у 2 (4,2%) — нарушений толерантности к глюкозе, у 5 (10,6%) — узлового зоба, у 1 (2,1%) — гипотиреоза, у 1 (2,1%) — патологии надпочечников. У 2 (4,2%) больных был выявлен хронический бронхит, у 3 (6,3%) — хронический гастрит, у 5 (10,6%) — хронический панкреатит, у 2 (4,2%) — вирусный гепатит С, у 10 (21,3%) — гипертоническая болезнь, у 9 (1%) — ишемическая болезнь сердца, у 2 (4,2%) — миома матки.
При бактериологических исследованиях качественного состава микрофлоры с поверхности очагов (язв, трещин) у 29 (61,7%) больных выявлен золотистый и эпидермальный стафилококк, у 18 (38,3%) — смешанная инфекция (стафилококки в сочетании со стрептококком, кишечной палочкой, бактероидами, протеем, дрожжевыми грибами) в количестве 104—105 микробных тел на 1 г ткани раны.
Всем пациентам назначался охранительный режим. Предлагалось ограничить пребывание в вертикальном положении с целью уменьшения статической нагрузки, размещать пораженную конечность в возвышенном положении. Рекомендовалось уменьшить потребление с пищей соли и экстрактивных продуктов, больным с тилотической экземой назначалась гипоаллергенная диета, пациентам с липоидным некробиозом — диета с ограничением углеводно-жировой нагрузки.
В составе комплексной терапии все больные получали сосудистые препараты и венопротекторы (пентоксифиллин, детралекс, эскузан), антиагреганты (курантил), десенсибилизирующие средства (глюконат кальция, тиосульфат натрия), улучшающие трофику (солкосерил, актовегин) и антигистаминные (супрастин, тавегил, лоратадин) препараты. Пациентам с трофическими язвами, липоидным некробиозом, пиодермиями проводилось лечение антибиотиками цефалоспоринового ряда, иммуномодуляторами (метилурацил, виферон, циклоферон), витаминами (мильгамма), с тилотической экземой — препаратами витамина А (аевит, ретинола пальмитат), с липоидным некробиозом — препаратами липоевой кислоты (берлитион).
В качестве наружного средства все больные использовали 2% крем Аргосульфан. После очищения 0,1% водным раствором хлоргексидина и/или хирургической обработки раневых поверхностей препарат слоем 2—3 мм ежедневно 2 раза в сутки наносили на очаги поражения на трещины или язвы с середины к краям до полного впитывания. На очаги, имеющие большую площадь, крем Аргосульфан наносили ежедневно под окклюзионную повязку на ночь. Рана во время лечения покрывалась препаратом полностью, если ее часть открывалась, крем наносили дополнительно. Курс комплексного лечения составлял 25—30 сут.
Болевых ощущений, а также местных и общих аллергических реакций при использовании крема Аргосульфан не наблюдалось.
Крем Аргосульфан при местном лечении длительно не заживающих ран позволил добиться улучшения у всех больных. В результате комплексной терапии полная эпителизация трофических язв у больных с ХВН, ОАС и липоидным некробиозом наступила в 10 (41,7%) случаях, частичный регресс (уменьшение размеров, воспалительных и дистрофических изменений кожи, появление зрелых грануляций и краевой эпителизации с минимально выраженной пигментацией) — в 14 (58,3%). Явления пиодермии разрешились у 7 (87,5%) пациентов, значительно уменьшились (с резким замедлением роста микрофлоры до 102 микробных тел на 1 г ткани раны) — у 1 (12,5%). Отсутствие под повязкой с кремом Аргосульфан гипергрануляций в ране способствовало формированию негрубых подвижных слабопигментированных рубцов. Трещины в области ладоней и подошв на фоне разрешения тилотической экземы эпителизировались у всех 15 (100%) пациентов.
Поскольку крем Аргосульфан — препарат длительного применения, что обусловлено медленным восстановлением физиологических процессов в эпидермисе и дерме, больным с трофическими язвами и пиодермией мы рекомендовали использовать его по ранее применяемой схеме амбулаторно в течение 1—2 мес после окончания курса лечения в стационаре (до полного заживления или пересадки кожи).
Таким образом, 2% крем Аргосульфан в комплексной терапии больных с длительно не заживающими ранами оказался высокоэффективным как на стадии формирования трофических язв, так и в период заполнения глубоких ран грануляционной тканью, что во многих случаях привело к самостоятельному заживлению их под повязкой. Препарат отличался хорошей переносимостью, удобством в применении, позволил значительно снизить стоимость лечения больного в стационаре и успешно продолжить лечение амбулаторно.
Читайте также:

