Лучевая терапия при лечении рубцов
Обновлено: 26.04.2024
Местные лучевые повреждения, развивающиеся преимущественно при лучевой терапии злокачественных опухолей, отличаются торпидностью к лечению различными медикаментозными средствами. Лучевые повреждения покровных тканей (кожи, слизистых) и внутренних органов
Местные лучевые повреждения, развивающиеся преимущественно при лучевой терапии злокачественных опухолей, отличаются торпидностью к лечению различными медикаментозными средствами. Лучевые повреждения покровных тканей (кожи, слизистых) и внутренних органов, как следствие воздействия ионизирующего излучения в суммарной очаговой дозе 60—70 Гр., проявляются в виде хронических эпителиитов и дерматитов, с прогрессированием их в лучевые язвы кожи, лучевые проктиты, циститы и т. п. В патогенезе таких повреждений, наряду с нарушением микроциркуляции, ведущее значение играет прямое воздействие излучения на клетки и подавление репаративных процессов. В дальнейшем на передний план выходят присоединение инфекции поврежденных тканей и усугубление негативных процессов заживления поврежденных тканей [1]. Вот почему в комплекс медикаментозных средств при лечении местных лучевых повреждений включаются вещества, воздействие которых направлено на улучшение тканевой микроциркуляции, повышение репараторных процессов и подавление инфекционного процесса. Для лечения местных лучевых повреждений апробированы практически все известные медикаментозные средства, удовлетворяющие перечисленным требованиям. Низкая терапевтическая эффективность имеющихся средств явилась основанием для поиска новых методов лечения. В отделении лечения лучевых повреждений МРНЦ РАМН ежегодно проходит лечение значительное число больных с лучевыми язвами конечностей и других областей тела, лучевыми повреждениями кишечника, мочевого пузыря и др. Основным компонентом местного лечения является препарат димексид (диметилсульфоксид, или ДМСО), применяющийся в виде перевязок раствора 5—10% или мази 10%. Это базовое лечение, назначаемое с учетом конкретных особенностей каждого больного, может дополняться назначением других антисептиков (диоксидин, хлоргексидин и др.), протеолитических ферментов, средств, стимулирующих репараторные процессы (куриозин, витаминизированные масла и др.). Разработанные схемы местного и общего лечения позволяют добиться благоприятных результатов у 57% пациентов [1, 2].
С сентября 2002 г. мы исследовали терапевтическую эффективность препарата гепон для лечения больных местными лучевыми повреждениями (см. таблицу 1).
Лучевые язвы у больных развились после лучевой терапии злокачественных опухолей (рак кожи — 16 пациентов, рак молочной железы — шесть, саркомы — четыре). Суммарная очаговая доза (СОД) составляла 45—70 Гр. Лучевые проктиты явились следствием лучевой терапии рака шейки и тела матки (13), рака мочевого пузыря (3) и прямой кишки (2). Лучевые циститы также наблюдались после лучевой терапии рака шейки и тела матки (13) и рака мочевого пузыря (4). Пневмофиброз — это следствие лучевой терапии лимфогранулематоза (6) и рака молочной железы (5 больных).
При лечении лучевых язв гепон применялся на первом этапе (7—10 дней) в виде орошения язвы раствором. Гепон (0,002) растворяли перед употреблением в 5 мл стерильного физиологического раствора. Орошение полученным раствором 0,04% гепона производилось ежедневно. На втором этапе, по мере развития грануляции, применялась мазь 0,04% (10—18 дней). Результаты лечения лучевых язв гепоном сопоставлялись с динамикой течения раневого процесса у более 800 больных, которым терапию проводили с принятыми в отделении методами лечения, состоящими в местном применении раствора 10% димексида (аппликации или электрофорез), электрофореза протеолитических ферментов и гепарина, использовании мазей левомиколя, ируксола, куриозина и эплана.
Эффективность применения гепона оценивалась клинически по состоянию раневой поверхности (уменьшение экссудации, скорости развития грануляций и скорости эпителизации язвы по Л. Н. Поповой (см. таблицу 2)), исчисляемой по формуле:
В оценке динамики заживления информативным оказалось изучение микрофлоры лучевых язв и чувствительности ее к антибиотикам. До применения гепона в раневом отделяемом у 67,5% посевов была установлена моноинфекция, преимущественно ассоциации стафилококка, а у 16,3% определялись и другие микробы (Escherichia coli, грамотрицательные ассоциации микробов и Candida). После 12–15-дневного применения гепона в 18,9% случаев выявлялась стерильность либо определялись сапрофиты (27%), характерные для нормальной кожи. По сравнению с исходным уровнем, 10 7-8 микробов на грамм ткани, к концу лечения гепоном обсемененность сокращалась до 10 2-3 , значительно повышалась чувствительность флоры к антибиотикам. Все вышеуказанное свидетельствует о несомненной эффективности проведенного лечения.
Положительный терапевтический эффект использования гепона мы склонны связывать в первую очередь с благоприятным его действием на микрофлору, что способствовало снижению воспалительного процесса и его негативных последствий (отек окружающих тканей, нарушение микроциркуляции и т. п.). Кроме того, важным аспектом действия гепона является его иммуномоделирующее действие, проявляющееся в активизации секреторного иммуноглобулина, снижении уровня противовоспалительных цитокинов, активизации a-интерферона, снижении адгезивной функции клеток и их апоптоза, прекращении вирусной репликации и повышении резистентности организма к бактериальной флоре.
В настоящее время, когда ранозаживляющее действие гепона доказано, лечение больных лучевыми язвами начинается с применения гепона, а затем дополняется, по показаниям, другими лекарственными средствами. Лечение лучевых ректитов (18 больных) и лучевых циститов (17 больных) проводилось в виде ежедневных двукратных микроклизм или инстилляций водного раствора 0,04% в течение 12—18 дней. Результаты применения гепона также сравнивались с результатами «традиционного» лечения, практиковавшегося в отделении в течение последних 25—30 лет (микроклизмы димексида 5—10%, эмульсии синтозона, витаминизированных масел и т. п.). Внутриполостное введение гепона уменьшало интенсивность болей и геморрагий и сокращало продолжительность лечения с 28—36 до 15—23 дней. Применение гепона активировало показатели иммунитета и у этой группы больных.
Таким образом, иммуномодулятор гепон в лечении больных с местными лучевыми повреждениями (лучевые язвы, лучевые ректиты и циститы) проявил себя как эффективное медикаментозное средство, способствующее быстрому снижению выраженности воспалительного процесса в поврежденных облучением тканях и ускорению репараторных процессов в них.
Литература
М. С. Бардычев, доктор медицинских наук, профессор
Медицинский радиологический научный центр РАМН (г. Обнинск)
Лучевая терапия опухоли. Значение лучевой терапии в дерматоонкологии.
До настоящего времени не утратила своего значения лучевая терапия эпителиальных новообразований кожи, обеспечивающая гибель опухолевых клеток путем повреждения хромосомного аппарата и торможения митотическои активности. При этом следует учитывать, что большинство пролиферирутощих клеток опухоли радиочувствительны на стадии митоза и сразу после нее, непролиферирующие же клетки отличаются очень низкой радиочувствительностью и легко восстанавливают повреждения, давая рост новым клеткам. Невозможность уничтожения 100% злокачественных клеток из-за нахождения их в разных периодах жизненного цикла требует фракционирования суммарной дозы облучения.
Применяют следующие методы лучевой терапии: использование электронного пучка, низковольтную или ортовольтную рентгенотерапию, а также близкофокусную рентгенотерапию и имплантацию радиевых игл. Показаниями для проведения лучевого лечения являются: плоскоклеточный рак кожи, базалиома (в частности, кистозная и язвенная формы), эритроплазия Кейра, болезнь Боуэна, рецидивные эпителиальные новообразования кожи, возникшие после других методов лечения и локализующиеся вблизи естественных отверстий (глаза, носа, ушные раковины и т.д.). Лучевое лечение проводят больным с наличием противопоказаний к хирургическому лечению, лицам пожилого возраста, а также при диаметре новообразования, не превышающем 20 мм. Оно также проводится в качестве адъювантной герапии при глубоких инвазивных и метастатических раках кожи.
Лучевая терапия обычно безболезненна и хорошо переносится больными. В то же время она сопровождается развитием местных лучевых реакций нормальных тканей в облучаемой зоне. Степень их выраженности зависит как от методики облучения (уровень разовых и суммарных поглощенных доз, ритм облучения, размер полей), так и от распространенности опухоли, состояния нормальных окружающих тканей и др. Существенное влияние на течение лучевых реакций оказывает и общее состояние больного. Острые лучевые реакции кожи, как правило, ограничиваются эритемой и явлениями сухого эпидермита, которые не требуют перерыва в лечении, проходят самостоятельно или купируются 5% метилурациловой или пар-мидиновой мазью. При проведении лучевой терапии нередко имеется и риск развития лучевых осложнений (лучевых дерматитов, конъюнктивитов, катаракты, перихондритов, трофических язв, общей слабости, потери аппетита, головных болей и головокружения, лейко- и лимфопении, тромбоцитопении идр.), наблюдающихся примерно в 18% случаев. Это требует постоянного контроля состояния периферической крови и коррекции осложнений путем назначения гемостимулирующих препаратов, витаминов, дезинтоксикационной терапии, симптоматического лечения и т.д. Лучевая терапия неэффективна при склерозирующих формах опухолей и малоэффективна при наличии фистул и рубцов.
В ряде случаев, особенно в зависимости от площади воздействия, период заживления кожи после лучевой терапии может продлиться до 8 недель. Ограничивает ее применение и развитие неудовлетворительных в косметическом отношении атрофических рубцов с депигментацией и телеангиэктазиями, особенно часто возникающих в области груди и конечностей, а также невозможность повторного использования при развитии рецидива опухоли. Рубец после лучевой терапии существенно затрудняет диагностику рецидива. Важно отметить, что лучевая терапия приводит к нарушению кровоснабжения кожи, костей и мягких тканей, ухудшая заживление ран, в связи с чем рецидив после применения лучевой терапии очень сложно поддается и хирургическому лечению. В таких случаях также затруднено проведение пластических реконструктивных операций.
Для лечения эпителиальных новообразований кожи наиболее широко применяется фракционная близкофокусная рентгенотерапия, которая осуществляется путем ежедневного воздействия на очаг; поглощенная разоваядоза составляет 3-5 Гр (300-500 рад), общая суммарная доза — 50-70 Гр (5000-7000 рад).
При опухолях, расположенных в области губ, ушных раковин, век, с выраженной инфильтрацией подлежащих тканей методом выбора является внутритканевая гамма-терапия.
По данным литературы, косметический эффект после проведения лучевой терапии в 57,2% случаев был хорошим, в 24,8% — удовлетворительным и в 11,1% — плохим; однако частота осложнений варьировала от 4,9 до 80% случаев; рецидивы же после лучевой терапии базалиомы отмечались в 5-20% случаев.
Частота рецидивирования выше при локализации опухоли на волосистой части головы, носу, в периорбитальной области, а также при большей площади очагов поражения.
Суммируя приведенные данные, необходимо отметить, что несмотря на появление новых, более эффективных и более безопасных методов, рентгенотерапия не утратила своего значения при ряде злокачественных новообразований кожи и может явиться методом выбора при лечении некоторых форм базалиомы, плоскоклеточного рака кожи, эритроплазии Кейра, болезни Боуэна.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Осложнения лучевой терапии головы, шеи и ее побочные эффекты
Все побочные эффекты лучевой терапии можно подразделить на острые и хронические. Их возникновение зависит от общей дозы облучения, однократной дозы облучения, предыдущего или сопутствующего лечения (хирургического вмешательства и/или химиотерапии), объема опухоли.
Одним из главных факторов, ограничивающих дозу лучевой терапии, является мукозит. Выраженный лучевой мукозит может стать причиной перерывов в лечении с последующим рецидивом опухолевого роста. Если иммунная система больного подорвана химиотерапией, слизистые оболочки могут инфицироваться. Наиболее распространенным хроническим побочным эффектом является ксеростомия.
С целью повышения вероятности успеха лучевой терапии пациент должен отказаться от курения (курение повышает сопротивляемость опухолевых клеток облучению), тщательно следовать схеме лечения, избегая перерывов более чем на пять дней, активно искать поддерживающей терапии. Перед началом лечения пациента должен обследовать фониатр/специалист по глотанию, диетолог, специалист по контролю боли и психолог.

а) Острые побочные эффекты лучевой терапии головы и шеи. Побочные эффекты обычно появляются на третьей неделе лечения. Развивается дерматит, снижается секреция слизи, появляются охриплость, боли в горле, дисфагия, утомляемость, нарушения вкуса, ксеростомия. В редких случаях на первой неделе может развиваться паротит (вследствие закупорки выводных протоков железы густой слизью).
Ближе ко второй половине курса, когда симптомы усиливаются, у пациентов появляется необходимость в использовании кремов и масел для кожи, муколитиков, наркотических анальгетиков, противорвотных препаратов, изменений в диете (переход на жидкую пищу и жидкие питательные смеси). Пациентам, которые не способны перенести весь курс лечения (особенно в сочетании с химиотерапией), может быть наложена гастростома.
Пациенты могут сильно терять в весе, у них нарушается заживление ран. Все это ведет к сложностям с завершением курса лечения. Важно минимизировать любые перерывы в лечении, поскольку подавление роста опухоли нарушается при прерывании лечения на пять дней и более.
б) Хронические побочные эффекты лучевой терапии головы и шеи. Полное восстановление после курса лучевой терапии занимает несколько недель или месяцев. Отказаться от приема дополнительных препаратов пациенты обычно могут спустя 4-6 недель после окончания лечения. Наиболее тяжелыми хроническими побочными эффектами являются фиброз мягких тканей шеи и жевательной мускулатуры, выпадение волос, хондронекроз, дисфагия, гипотиреоз, ксеростомия.
Избежать образования стриктур верхнего сфинктера пищевода и фиброза мышц, участвующих в глотании, можно при раннем начале специальных глотательных упражнений. Невозможность нормального глотания может вести к хронической аспирации и необходимости постоянного использования назогастрального зонда. Для предотвращения распада зубов и остеорадионекроза пациенты должны тщательно соблюдать гигиену полости рта, избегать удаления или имплантации зубов.
в) Направление будущих исследований. В рандомизированном исследовании RTOG-H5022 будет оценена эффективность добавления С225 к курсу химиолучевой терапии (ускоренный курс облучения с двумя курсами цисплатина).
С учетом того, что у пациентов с раком ротоглотки, ассоциированным с ВПЧ, удается достичь превосходных результатов при использовании традиционных методов лечения, многие лечебные учреждения и исследовательские группы занимаются поиском наименее агрессивного варианта. Аналогичных результатов можно достичь использованием меньших доз облучения и меньшим количеством курсов химиотерапии, снизив при этом общую токсичность.
У пациентов с крайне агрессивными опухолями, которым требуется более радикальное лечение, возможно применение нескольких подходов: использование индукционной химиотерапии, эскалация дозы облучения, подключение брахитерапии или биологической терапии.
С другой стороны, ведется поиск радиопротективных препаратов, которые помогут предотвратить развитие мукозита и других побочных эффектов и одновременно с этим увеличить вероятность сохранения функции пораженного органа, поскольку целью лечения является не только подавление опухолевого роста, но и поддержание общего качества жизни на достойном уровне.
Например, исследуется возможность использования лучевой терапии с модулированной интенсивностью (ЛТМИ) для снижения риска развития дисфагии и снижения дозы химиолучевой терапии. Это позволит сохранить пациентам глотание и устранит необходимость в использовании назогастрального зонда.
С целью дальнейшей персонализации лечения разрабатываются новые методы лучевой диагностики и молекулярной диагностики, с помощью которых, как мы надеемся, удастся найти сбалансированный способ излечения с использованием минимально допустимых доз и косметическими и функциональными результатами лечения.
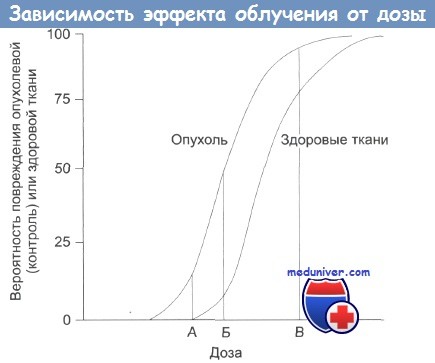
Зависимость терапевтического эффекта от дозы облучения.
А — нижняя безопасная доза;
Б — увеличение дозы: растет поражение здоровых тканей;
В — наивысшая вероятность успешного лечения, но и высокая вероятность поражения здоровых тканей, многочисленные побочные эффекты, некоторые из которых могут проявиться в отдаленном будущем
г) Ключевые моменты лучевой терапии:
• В основе лучевой терапии лежит нарушение способности опухолевых клеток к делению. Ионизирующее излучение вызывает формирование свободных радикалов, которые разрывают двухспиральную цепь ДНК.
• Здоровые ткани обладают большей репаративной активностью, чем опухолевые, поэтому они более устойчивы к действию ионизирующего излучения. Именно эта разница в репаративных свойствах нормальных и опухолевых тканей и позволяет убивать злокачественные клетки, сохраняя целостность и функциональность окружающих тканей.
• Как правило, для избирательной терапии используется доза в 50 Гр (грэй), для лечения остаточных микроскопических опухолей — 60 Гр, для лечения крупных новообразований — 70 Гр.
• В случае плоскоклеточного рака головы и шеи время и частота использования лучевых методов лечения имеют особое значение, т.к. данные опухоли способны к отложенной ускоренной репопуляции на фоне проводимой лучевой терапии. Феномен репопуляции во время терапии и способность раковых клеток к дифференциальной репарации часто обусловливает необходимость использования различных фракционных режимов подачи ионизирующего излучения.
Улучшить результаты лечения можно сокращением общего курса терапии и эскалацией дозы с гиперфракционированием.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
На сегодняшний день одним из актуальных вопросов эстетической хирургии остается лечение пациентов с рубцовыми деформациями кожных покровов. Этому способствует рост транспортного травматизма, насыщение жизни сложными и опасными бытовыми приборами, увеличение числа выживших после тяжелых травм и ожогов (Немсадзе В. 1999; Пахомов С.П., 1997; Abbas M.I., соавт. 2004 ; Nursal TZ, соавт. 2003).
Помимо увеличения абсолютного количества пациентов, изменились и стандарты внешнего вида, что привлекло еще больше больных, которых раньше не беспокоило наличие собственного рубцового косметического дефекта (Щепин О.П., 1999; Озерская О.С. 2001). Внешность человека приобретает не только эстетическое, но и социальное значение (Куринный Н.А. 1999; Воздвиженский С.И., соавт. 1999; Азолов В.В., соавт. 2001).
Хирургическая коррекция по-прежнему занимает важное место в структуре реабилитации с рубцовыми деформациями кожных покровов (Гришкевич В.М., 1999; Гусак В.К., соавт. 2000). Наличие значительных рубцовых массивов, тяжей, деформирующих окружающие ткани, контрактур суставов, микростомии, выворота век и других состояний однозначно трактуются всеми специалистами как показание к реконструктивной операции (Коновальская С.Б. 2004; Смирнов С.В. 2000).
Хирургическая коррекция дает возможность ремоделирования таких важных характеристик рубцов, как конфигурация, ширина основания, местоположение, в ряде случаев делая рубец практически незаметным для окружающих (Стенько А.Г., Ананян С.Г. 2006; Белоусов А.Е. 1998).
Обзор методов лечения
Большинство общепринятых методов лечения или не подавляют рост келоидных и гипертрофических рубцов, или не позволяют получить ожидаемый косметический результат, и ни один из них не позволяет избежать рецидивов. Рассмотрим наиболее распространенные методы лечения келоидных рубцов. Широкое применение получил один из первых методов лечения келоидных и гипертрофических рубцов — хирургический.
Большинство зарубежных исследователей, занимающихся пластической хирургией, считают нецелесообразным оперативное вмешательство ранее 6-12 мес после заживления ран (Пешкова Г., 1971; Larson, 1971; Marwali H.,1997). Существуют разные мнения по поводу методики иссечения келоидов. Одни авторы (Курбанов Г.Р., Давидян А.И., Мамедов Д.Я.,1961; Сибилёва К.Ф., 1964; Бондарь B.C., 1989; Каримов Ш.Н., Юнусов М.Ю., ФайзуллаевХ.С., АбдурахмановАД., 1992) считают, что келоидный рубец необходимо иссекать полностью в пределах здоровой ткани. Другие (Kitlowski E.A., 1953; Winkler E., 1958; Conwey H., 1960; Синеоков Н.П., Шахов В.Ю., Терентьева А.Б., 1992) рекомендуют оставлять узкий край келоидного рубца и считают это менее опасным, чем наложение швов на здоровую кожу, при котором возможно образование более обширного уродующего послеоперационного келоидного рубца.
Лучевая терапия является одним из наиболее старых способов лечения келоидных и гипертрофических рубцов. Впервые его применил Freund в 1898 году после хирургического иссечения келоидных рубцов. Механизм рентгенотерапии основан на воздействии ионизирующего излучения на соединительную ткань, при котором происходит деструкция коллагеновых волокон и вакуольная дистрофия и некроз фибробластов, уменьшение числа молодых фибробластов (Гаджиев Р.Т., 1969; Chen H.C., Ou S.Y., Lai Y.L., 1991).
Эффективно использование сверхмягких рентгеновских лучей (Букки) (Васильева Е.К., 1954; Крикун Л.И., 1959; Большакова В.Ф.,1970; Пахомов С. П., Кинячина О. Д., 1974), особенно при молодых рубцах. По данным Е.К. Васильевой выздоровление наступило у 17 % больных, улучшение у 21,5 % больных. Л. А. Крикун (1959) рекомендует в день снятия швов проводить однократное облучение лучами Букки в дозе 1500—2000 рентген. P. Clavere (1997) при лечении келоидных рубцов облучением отмечает хороший результат — близко к 63%, рецидив — в 14 % случаев.
Нельзя не отметить, что после лучевой терапии нередко возникают осложнения в виде телеангиоэктазий, атрофии кожи, часто — с депигментацией рубца. При повторном облучении не исключена возможность изъязвления рубца, развития лучевого дерматита (Венгеров А.Н., 1974). Более того, имеется опасность злокачественного перерождения кожи: описан случай возникновения рака кожи на месте келоидного рубца после лучевой терапии (Norris J.E., 1995).
Лучевая терапия не исключает рецидивов. Для ее проведения имеется ряд противопоказаний: заболевания крови, почек, декомпенсация кровообращения, дерматиты, изъязвления рубца. В процессе лечения противопоказано воздействие на организм ультразвуком и ультрафиолетовыми лучами. Все это обусловливает ограниченное использование метода лучевой терапии в последние годы при «таких доброкачественных формах как келоидные и гипертрофические рубцы» (Caiman и Copenhagen, 1967).
В последние годы большое внимание уделяется лазерной хирургии келоидных рубцов. Nd-YAG лазер при небольших мощностях (до 10 Вт) не приводит к некрозу тканей (Халмуратов А.М., Калиш Ю.И., Юлдашев Р.Ш., 1993), но вызывает лизис коллагена, снижение количества гигантских фибробластов и приводит к остановке роста и частичному рассасыванию келоидных рубцов. Иссечение келоидных рубцов углекислым лазером (СО2), по данным Norris J.E. (1991) эффективно. Напротив, W. Happak, R. Kuzbari, A. Flowers (1996) отмечали возникновение рецидивов келоидных рубцов после удаления их с помощью CO2-LASER. Отмечен эффект комбинированного использования двух и более источников лазерного излучения.

Рис. 1. Посттравматическая рубцовая деформация плеча. Объем лечения: Z-пластика встречными лоскутами. Фото ДО и ПОСЛЕ.
Проведено лечение 10 пациентов, которым иссекался рубец с использованием углекислотного или AYG-лазеров. В ближайшем послеоперационном периоде проводилось облучение послеоперационной раны, а в дальнейшем рубца инфракрасным полупроводниковым либо гелий-неоновым лазером. В 7 из 10 случаев удалось избежать рецидивов (Alster Т., West Т., 1997).
К осложнениям лазерного лечения можно отнести большое количество рецидивов, возможность оперативного вмешательства не ранее 6-12 месяцев после формирования рубца, образование краевых келоидов, необходимость сочетания с консервативными методами лечения.
Гормонотерапия широко используется для лечения больных с келоидными рубцами. Впервые данный метод был применен Asboe-Hansen (1956). Наибольшее распространение получили препараты гидрокортизон и триамцинолона ацетонид (кеналог) (С. Ragan, E. Howes, 1949; Murrey, 1993; Griffith, 1970; С. Boyadjiev, E. Popchristova, 1995). По данным Ketchum (1974), Яворского (1973), J. D. Russell, S. В. Russell, (1978), кортикостероиды могут потенцировать действие коллагеназы, что обусловлено инактивацией специального протеина, ингибирующего коллагеназу (Griffith В. Н., Monrof С. W., 1970).
Полагают, что глюкокортикоиды тормозят жизнедеятельность тучных клеток, образующих гликозаминогликаны, и оказывают токсическое действие на фибробласты, опосредованно замедляя коллагеногенез и задерживая формирование келоида (Loevy, 1962; Биров В.В., 1968; Lerner D., 1982; Coste E, Piquet В., 1953).

Рис. 2. Келоидный рубец грудной области. Объем лечения: криотерапия, стероиды. Фото ДО и ПОСЛЕ.
Несмотря на широкое применение кортикостероидов, гормонотерапия чревата многими осложнениями. Так, отмечаются сдвиги в системе гипофиз—надпочечник; изменение содержания в надпочечниках аскорбиновой кислоты, гиперплазия коркового слоя надпочечников, значительное повышение 17-ОКС в крови и увеличение выделения их с мочой.
При повторном введении препарата отмечается меньший терапевтический эффект (Джексенбаев О.Ш., 1964). Нередко возникают западение окружающих тканей, атрофия кожи, телеангиэктазии, стойкая розовая окраска рубца, нарушение пигментации, подкожная атрофия, появление сосудистых звездочек, а в ряде случаев развитие синдрома Кушинга, случаи аллергии на триамцинолона ацетонид. Надо всегда помнить, что кортикостероиды понижают иммунологическую резистентность организма. Это, в свою очередь, повышает чувствительность к инфекции, приводит к нарушению процессов регенерации и тем самым обусловливает возможность дисрегенерации и/или заживления вторичным натяжением с выраженным косметическим дефектом — бугристость при западении центра рубца, временный гипертрихоз. (Elliason А. и Rosenfeld I., 1959; Griffith В., Monrof С. W., Mokinney P., 1970).

Рис. 3. Келоидный рубец грудной области. Объем лечения: криотерапия, стероиды. Фото ДО и ПОСЛЕ.
Рецидивы после гормонотерапии наблюдаются через 1 год после лечения у 1/3 больных, а через 5 лет 50 % больных (Friedman S.J., Butler D.F., 1988; RitotaP.C, Lo A.K., 1996).
Из медикаментозных средств общего действия широко применялся пирогенал. Отечественный пирогенал, выделенный П.З. Будницкой (1957) из культур Ps. aeruginosa и Е. Typhosa, для лечения келоидов применяли О.Ш. Джексенбаев (1965), В. Ф. Большакова, С.П. Пахомов (1974), Н.А. Озерецковский (1964), В. А. Кожевников, Болховитинова, А.А. Осипов, Ю.В. Тен (1991).
Пирогенал обладает противовоспалительным, десенсибилизирующим действием, повышает проницаемость сосудов и основного вещества соединительной ткани, увеличивает содержание в ней гиалуронидазы и оказывает тормозящее влияние на процесс рубцевания, вызывает торможение развития соединительно-тканного рубца.
Из побочных действий пирогенала, наблюдается повышение температуры, головная боль, потеря аппетита и недомогание. Эффективность лечения пирогеналом зависит от многих факторов, среди которых большое значение имеет срок начала лечения. Пирогенал как ингибитор рубцевания эффективен лишь в течение года после начала роста келоидов, его терапевтическому воздействию поддаются только «молодые», растущие келоидные рубцы. Применение препарата через 2-3 года после ожога малоэффективно.
С.Н. Пимхасович (1959), Э.В. Уманский, В.А. Самарова (1953) для лечения келоидов применяли протеолитические ферменты: лидазу, ронидазу, трипсин, химотрипсин, вызывающие обратимую деполимеризацию гиалуроновой кислоты и уменьшение ее вязкости, повышая проницаемость тканей и улучшая переход жидкости через стенки капилляров, тканевых мембран в межтканевые пространства (Мордовцев В.Н., 1993).
Из побочных явлений могут наблюдаться раздражение кожи, аллергические реакции, экзематизация, эритемы, отек, стафилодермия. Может отмечаться общая слабость, сердцебиение, одышка, повышение температуры тела, учащение мочеиспускания. Большое количество побочных явлений при применении протеолитических ферментов ограничивает их назначение и уменьшает эффективность лечения келоидов.
К противопоказаниям относятся злокачественные опухоли, туберкулез, инфекционные заболевания, почечная недостаточность, язвенная болезнь желудка, геморрагический синдром. Лидаза противопоказана при лечении эстрогенами. Кроме того, ферментативные препараты действуют на структурные элементы ткани, и не на основные звенья патогенеза, и ферментотерапию можно считать не патогенетическим, а симптоматическим методом.
В последние годы появляется большое разнообразие препаратов нового поколения.
P. Teofoli, К. Motoki, Т. Lotti, (1997); Н. Inoue, H. Ohshima, II. Копо (1997) применяли для лечения келоидных и гипертрофических рубцов препарат траниласт (3,4-dimethoxycinnamoyl anthranilic кислота).
G.H. Willital, H. Heine (1998); J. Hera-nek (1997) для лечения келоидных рубцов использовали контратубекс (10% лукового экстракта, 50 ЕД гепарина, 1% аллантоин). Лечение препаратом длительное — в течение 12-18 месяцев. Учитывая механизм действия указанных препаратов и патогенез келоидов, мы полагаем, что их эффективность максимальна в случаях формирования гипертрофических рубцов, в первые 1-1,5 месяца, а при келоидных рубцах эти вещества не позволяют получить ожидаемого результата.
T.W. Wong, H.C. Chiu, K.M. Yip (1994) отмечали неэффективность лечение келоидных рубцов интерфероном.
T. Cronin в 1961 сообщил о целесообразности шинирования в сочетании с компрессией рубцов у больных, перенесших реконструктивные операции на шее с применением расщепленной кожи. Давление, оказываемое специально подогнанными шинами из термопластических материалов, предупреждало сморщивание трансплантантов и рост рубцов или вызывало обратное их развитие (Юденич В.В., 1980г. Larson D. Et al., 1971; Parks D. et al.; Lamberti B., Whitker J., 1981).
Как минимизировать образование рубцов после плановых операций и скорректировать неэстетичный вид зрелых рубцов с помощью инъекционных препаратов, прессо-, крио-, лазерной терапии, силиконовых повязок и других методов – в продолжении обзора.
Линейные гипертрофические рубцы
Согласно общим рекомендациям, превентивная терапия должна быть продолжена или усилена, если у пациента в период от 6 недель до 3 месяцев после операции или травмы наблюдаются ранние признаки гипертрофии линейного рубца. Также возможно применение компрессионных повязок, если ранее они не использовались.
Если созревание рубца происходит и спустя полгода после травмы или операции, необходимо продолжать применение силикона. В случае гипертрофии показаны инвазивные меры, например, инъекции кортикостероидов в рубцовую ткань. Наиболее часто применяемый для этой цели препарат – это триамцинолона ацетонид в дозировке 10-40мг/мл. Его инъекции делают в сосочковый слой дермы каждые 2-4 недели до уплощения рубца. Более 50% пациентов хорошо реагируют на такую терапию. Сильная боль во время введения препарата может говорить о его индивидуальном невосприятии. К прочим нежелательным эффектам относят атрофию кожи, депигментацию и телеангиэктазии. Введение кортикостероидов должно быть строго ограничено рубцовой тканью, в противном случае существует вероятность атрофии кожи.
К прочим инъекционным препаратам, которые могут быть применены для терапии гипертрофических рубцов, относят блеомицин, 5-фторурацил и верапамил, однако число клинических подтверждений их эффективности значительно уступает кортикостероидам. Считается, что блеомицин сокращает синтез коллагена, а в исследовании с участием 50 пациентов он продемонстрировал способность уплощать рубцы гипертрофические и келоидные в 80% случаев. 5-фторурацил замедляет пролиферацию фибробластов и демонстрирует эффективность в терапии воспаленных гипертрофических рубцов . Комбинированная терапия рубцов препаратами 5-фторурацил и триамцинолона ацетонидом в некоторых случаях оказывается более эффективной, чем применение этих препаратов по отдельности. Так, например, в 12-ти недельном двойном слепом исследовании с участием 40 пациентов комбинированная терапия показала лучшие результаты в сокращении размеров рубца и эритемы по сравнению с триамцинолона ацетонидом. Верапамил - антагонист кальция – сокращает синтез коллагена и ускоряет его распад. В рандомизированном слепом исследовании с участием 54 пациентов инъекции верапамила в рубцовую ткань сократили васкуляризацию, эластичность, высоту и ширину рубца, впрочем, в меньшей степени, чем инъекции триамцинолона ацетонида.
Контрактура рубца – это аномальное сжатие или сокращение незрелого рубца, которое часто наблюдается в сочетании с его гипертрофией. Для уменьшения гипертрофии и ослабления натяжения тканей рекомендована хирургическая коррекция методом Z-пластики.
Широкие гипертрофические рубцы
При наличии риска формирования у пациента широких гипертрофических рубцов вследствие ожога, механической травмы или некротической инфекции необходимы ранняя прессотерапия и применение силиконовых средств. Оба метода должны применяться в регулярном порядке к любой ране, заживающей более 2-3 недель, а также после трансплантации кожных лоскутов сразу после закрытия раны, и при условии нормальной переносимости пациентом.
Прессотерапия считается эффективной методикой терапии рубцов и активно применяется во всем мире. В основе действия компрессии окклюзия мелких кровеносных сосудов, благодаря которой снижается уровень поступающего в рубцовую ткань кислорода, что приводит к сокращению пролиферации фибробластов и синтеза коллагена.
Современные исследования указывают, что ключевую роль в успехе прессотерапии играют механорецепторы, вовлеченные в процесс клеточного апоптоза и связанные с внеклеточным матриксом. Вероятно, давление на матрикс влияет на процесс апоптоза фибробластов и замедляет процесс гипертрофии. Кроме того, в результате механотрансдукции через клетки чувствительных нервов оказываемое в результате прессотерапии давление влияет на экспрессию генов, что приводит к синтезу и высвобождению различных цитокинов, которые могут играть роль в физиопатогенезе роста рубцовой ткани.
Кроме того, прессотерапия может быть применена для симптоматического устранения отеков, зуда и болезненности.
В случае дальнейшей гипертрофии рубца необходимо продолжить прессотерапию и применение силиконовых средств.
Для терапии наиболее обширно разрастающихся участков рубца могут быть показаны локальные инъекции кортикостероидов, а также блеомицина, 5-фторурацила и/или верапамила.
Лазерная терапия – еще одна инвазивная методика коррекции поверхности гипертрофических шрамов и также может быть применена для терапии остаточного покраснения, телеангиэктазий или гиперпигментации5. В одном из недавних мета-анализов доказана эффективность импульсного лазера на красителе 585, но не для интенсивного импульсного света (IPL), для неаблятивного фракционного лазера 1550нм, углекислотного аблятивного фракционного лазера, эрбиевого лазера с длинами волны 532 и 2940нм. После этого эффективность импульсного лазера на красителе, особенно в сочетании с окклюзией/компрессией и инъекциями кортикостероидов в ткань рубца, была неоднократно подтверждена.
Положительные отклики также получили неаблятивный фракционный лазер 1550нм и углекислотный аблятивный фракционный лазер. Лечение гипертрофических рубцов возможно и с применением других лазеров: длинноимпульсного Nd:YAG 1064нм, Q-switch Nd:YAG, светодиодов и фотодинамической терапии . Лазерная терапия показана для профилактики или сокращения послеоперационных и травматических рубцов, а также в сочетании с препаратами ботулотоксина. Несмотря на необходимость дополнительных клинических данных о применении лазеров, их выборе и режимах терапии, появляется все больше публикаций о результатах успешной терапии гипертрофических рубцов с помощью лазеров, что повышает интерес к этой методике.
Как было упомянуто ранее, хирургическое вмешательство показано в случаях развития контрактур, которые могут появляться после ожогов в области шеи или подмышечных впадин. Для коррекции таких контрактур предпочтительно использовать кожные лоскуты, поскольку они, в отличие от трансплантации кожи, реже вызывают вторичное сокращение и позволяют добиться отличного функционального и эстетического результата.
Многолетние, или постоянные, широкие гипертрофические рубцы подлежат хирургическому лечению, иногда с использованием тех же методов, что и для линейных гипертрофических рубцов. Для более широких рубцов может быть показана серия иссечений или растяжение кожи со смещением прилегающих участков кожи после резекции центральной части рубца. Подкожные швы, участвующие в процессе растяжения кожи, необходимы для уменьшения натяжения ткани. Для эстетически неприемлемых широких рубцов также возможна трансплантация аутологичных кожных лоскутов. Заместители кожи могут применяться для лечения пациентов с обширными повреждениями, такими, как ожоги тяжелой степени.
Келоидные рубцы
Пациентам с формирующимися келоидными рубцами следует сначала проводить лечение силиконовыми средствами в сочетании с прессотерапией и инъекциями кортикостероидов. Возможны также инъекции 5-фторурацила, блеомицина или верапамила. В случае отсутствия результата описанной терапии в течение 12 месяцев, показано хирургическое иссечение в сочетании со вспомогательной терапией, поскольку только хирургическое иссечение связывают с рецидивом в 50-100% случаев и даже с увеличением площади келоидного рубца. Некоторые эксперты рекомендуют иссекать только центральную часть келоидного рубца, а латеральные части - соединить вместе и оставить in situ. Другие считают, что клетки латеральных участков келоидного рубца более активно синтезируют коллаген.
Сочетание резекции рубца и послеоперационной лучевой терапии предложено много лет назад, а облучение электронным пучком и брахитерапия иридием 192 могут применяться для снижения вероятности рецидива после иссечения рубца. Возможные побочные эффекты послеоперационной лучевой терапии являются предметом научных споров, особенно в вопросе потенциального риска повышения вероятности развития новообразований. Однако на основании обширного обзора литературы по данной проблеме сделан вывод, что риск развития новообразования в области келоидных рубцов под воздействием лучевой терапии является минимальным.
Лечение келоидных рубцов производится с помощью еще одного многообещающего инвазивного метода - криотерапии рубцовой ткани. Интенсивное охлаждение вводимого в келоид металлического стержня приводит к некрозу ткани. В ходе исследования с участием 10 пациентов объем рубца был уменьшен на 54% после одной процедуры криотерапии. В течение 18 месяцев рецидива не произошло.
И последнее, 5% имиквимод - это наружное средство-модификатор иммунного ответа, стимулирующий выработку интерферона, который, в свою очередь, приводит к повышению интенсивности распада коллагена. В результате некоторых исследований хирургическое иссечение келоидных рубцов и дальнейшая местная терапия 5% кремом имиквимод продемонстрировали низкую частоту рецидивов в диапазоне 0-29%. Однако другие исследования свидетельствуют, что 5% крем имиквимод не эффективен для предупреждения рецидивов формирования келоидных рубцов, частота которых составляет 89%.

Первичная неинвазивная терапия рубцов: роль силиконовых средств
Согласно современным принципам лечения рубцов, силиконовые средства показаны для профилактики и терапии как гипертрофических, так и келоидных рубцов. В действительности, среди неинвазивных методик силиконовые повязки и гели считаются золотым стандартом терапии рубцов и являются единственным неинвазивным методом их профилактики и лечения, эффективность которого имеет достаточное количество научно-обоснованных доказательств. Терапия с использованием силиконовых средств является прекрасной альтернативой инвазивным методам лечения, поскольку является гораздо более простой и связана с меньшим числом побочных эффектов, среди которых зуд, контактный дерматит и сухость кожи. Принято считать, что эффективность силиконовых средств в профилактике и терапии рубцов связана с окклюзией и увлажнением рубцовой ткани.
Силиконовые повязки состоят из мягких полуокклюзионных гелевых листов медицинского силикона, усиленных силиконовой мембраной, обеспечивающей прочность повязки и удобство в использовании. В некоторых повязках применяется сочетание силикона и тефлона (политетрафторэтилена), что позволяет добиться минимальной толщины, гибкости и прочности материала. Иногда пациенты неохотно применяют силиконовые повязки на открытых участках тела, что может быть причиной нарушения режима лечения.
В жидких силиконовых гелях используется тот же полимер, что и в повязках. Эта форма силиконовых средств разработана недавно, специально для решения проблем, возникающих при использовании силиконовых повязок, например, необходимости фиксации и трудности в применении повязок на обширных площадях, вблизи суставов и на открытых участках кожи, таких, как лицо или руки. После нанесения на кожу тонким слоем жидкий силиконовый гель высыхает и образует прозрачную, гибкую, воздухопроницаемую и водонепроницаемую пленку. Как и силиконовые повязки, силиконовые гели не наносят на открытые раны, а применяют до тех пор, пока наблюдаются улучшения.
Для определения роли силиконовых повязок в профилактике и терапии гипертрофических и келоидных рубцов после различных повреждений кожи, в том числе, ожогов и хирургических операций, было проведено множество клинических исследований. Результаты всех из них, кроме одного, были положительными. Согласно результатам мета-анализа, силиконовые повязки, по сравнению с отсутствием терапии, сокращают вероятность формирования гипертрофических рубцов у лиц из группы высокого риска их развития . Согласно последним данным, силиконовые повязки могут применяться в сочетании с прессотерапией, что позволяет добиться лучшего результата в терапии посттравматических гипертрофических рубцов, чем при использовании одной из методик по отдельности. Эти методики дополняют действие друг друга: терапия силиконовыми средствами уменьшает эритему и повышает эластичность рубца, а прессотерапия предотвращает его утолщение.
Эффективность силиконовых гелей в профилактике и терапии рубцов доказана в ходе нескольких клинических исследований. В ходе ряда сравнительных исследований доказано, что силиконовые повязки и гели обладают как минимум одинаковой эффективностью, однако пациенты отмечают, что гелевая форма более проста в использовании.
Заключение
Неэстетичный вид рубцов может способствовать развитию физических и психосоциальных нарушений. Пластические хирурги играют основную роль как в минимизации образования рубцов после плановой операции, так и в коррекции уже зрелых рубцов. При выборе метода терапии следует пользоваться клиническими рекомендациями, а также учитывать индивидуальные особенности пациента и характеристики раны.
Методы профилактики являются приоритетными и должны применяться до, во время и сразу после закрытия раны. Терапия гипертрофических и келоидных рубцов, а также контрактур, как правило, основана на снижении механического напряжения в области рубца, иссечении избыточной рубцовой ткани реконструктивными хирургическими методами и/или инъекциями препаратов, стимулирующих процесс разрушения коллагена in situ. Силиконовые повязки и гели признаны золотым стандартом среди неинвазивных методов профилактики и лечения гипертрофических и келоидных рубцов, но пациенты в большинстве своем отдают предпочтение гелям. Терапия силиконовыми средствами может применяться в сочетании с прочими неинвазивными, а также инвазивными методами для достижения оптимальных результатов.
Читайте также:

