Лопается кожа на ногах при сахарном диабете чем лечить
Обновлено: 17.04.2024
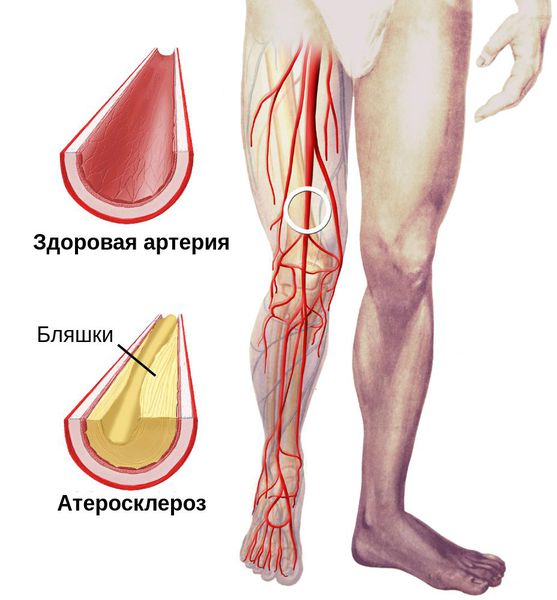
Синдром диабетической стопы (СДС) — очень серьезное осложнение сахарного диабета (СД). Это осложнение (в 85% случаев представленное трофическими язвами стоп разной тяжести) выявляется у 4—10% от общего числа пациентов с СД.
Синдром диабетической стопы (СДС) — очень серьезное осложнение сахарного диабета (СД). Это осложнение (в 85% случаев представленное трофическими язвами стоп разной тяжести) выявляется у 4—10% от общего числа пациентов с СД. Бытует мнение, что эффективность лечения язвенных дефектов стоп при СД низка, однако это не соответствует действительности. На самом деле при нейропатической форме (50—70% всех больных СДС) заживление трофической язвы происходит в 80—90% случаев. Для этого необходимо соблюдение нескольких обязательных условий (см. таблицу 1), тогда как низкая эффективность лечения часто связана с тем, что условия соблюдаются не полностью. Как показывает практика последних 10 лет, появление специализированных отделений и кабинетов «Диабетической стопы» значительно повысило эффективность лечения этих пациентов и снизило число ампутаций. Одна из не решенных пока проблем, актуальных для таких специализированных отделений, — низкая эффективность консервативного лечения диабетических язв при (нейро)ишемической форме СДС.
Ишемическая и нейроишемическая формы составляют менее половины всех случаев СДС (5—10% и 25—40%, соответственно) (Дедов, 1998, Shаw, 1996; Международная рабочая группа по диабетической стопе, 2000; Staroverova, 2001). Однако наличие выраженной ишемии принципиально меняет прогноз лечения у этих пациентов: вероятность заживления язвенных дефектов без восстановления магистрального кровотока составляет 10—30% (Международная рабочая группа по диабетической стопе, 2000). Следует помнить, что назначение большинства вазоактивных средств не повышает вероятность заживления язвенных дефектов. Согласно данным метаанализа (Loosemore, 1994), непростаноидные препараты (эффективные при II стадии хронической артериальной недостаточности, ХАН) неэффективны при III-IV стадиях. Простаниоды (алпростадил, илиопрост) влияют на прогноз при III-IV стадиях ХАН, но в основном — у больных с умеренными проявлениями критической ишемии (tcpO2>20 mmHg). Прогрессирование поражения и отсутствие заживления ран после малых ампутаций на фоне критической ишемии приводят к высокой ампутации у значительной части пациентов. Однако хорошо известно, что проведенное в таких условиях реконструктивное вмешательство на артериях нижних конечностей кардинально меняет прогноз лечения, позволяет избежать высокой, а в ряде случаев — и малой ампутации. Это привело к тому, что в последние годы хирургическая реконструкция артерий (путем шунтирования или эндоваскулярных вмешательств) рассматривается в качестве метода выбора при лечении как перемежающейся хромоты, так и язвенных дефектов ишемического происхождения при СД (American Diabetes Association, 1999; Международная рабочая группа по диабетической стопе, 2000). Была показана высокая эффективность реконструктивных операций у пациентов с СД, в ряде случаев сопоставимая с таковой у пациентов без нарушений углеводного обмена. Результатом широкого внедрения этих методов в зарубежных странах явилось значительное снижение числа ампутаций при ишемической форме синдрома диабетической стопы в Европе. Реконструктивные операции на артериях у больных сахарным диабетом проводятся и в России (Покровский, 2002; Гавриленко, 2002; Мухамадеев, 2002).
Еще один недавно вошедший в практику метод лечения — иммобилизирующая разгрузочная повязка (ИРП), в зарубежной литературе — Total Contact Cast. Такая фиксирующая повязка на голень и стопу представляет собой более или менее жесткий «сапожок» (из гипса или современных полимерных материалов, съемный или несъемный), переносящий нагрузку с области язвы на другие участки. Важно, что этот метод позволяет ходить по улице, работать и т. п., не подвергая при этом рану механической нагрузке. В большинстве зарубежных стран ИРП стал «золотым стандартом» разгрузки, но в России он практически не применялся из-за боязни возникновения осложнений (не всегда обоснованной). В нашей стране основным, хорошо себя зарекомендовавшим методом разгрузки сегодня является «полубашмак». Однако в ряде ситуаций «полубашмак» оказывается неэффективен либо существуют противопоказания к его применению. Это расположение язвы в средней части стопы или пяточной области, необходимость выходить на улицу, работать, а также несоблюдение пациентом предписанного режима разгрузки. В этих случаях требуется использование ИРП.
Пациент В., 57 лет, обратился за консультацией в отделение «Диабетическая стопа» ЭНЦ РАМН 15.04.2003. Диагноз: сахарный диабет 2 типа, тяжелого течения, декомпенсация. Диабетическая дистальная полинейропатия. Диабетическая макроангиопатия: атеросклероз артерий нижних конечностей, критическая ишемия левой нижней конечности (ХАН IV ст). Синдром диабетической стопы, нейроишемическая форма: инфицированный язвенный дефект левой пяточной области II-III cт. по Wagner. Диабетическая микроангиопатия: диабетическая нефропатия в стадии протеинурии с сохранной азотовыделительной функцией почек (IV ст. по Morgensen); диабетическая ретинопатия II ст. ИБС, стенокардия напряжения I ф. к. Многоузловой эутиреоидный зоб 0 ст. (ВОЗ).
СД 2 типа диагностирован в 1990 г. Пациент получал лечение диабетоном 80 мг 1-2 таб/сут (принимал препарат нерегулярно), контроль гликемии был нерегулярным. На момент осмотра уровень гликемии достиг 17,5 ммоль/л натощак.
Перемежающуюся хромоту не отмечал (однако вел малоподвижный образ жизни, редко проходил более 500 м).
23.02.2003 появился язвенный дефект левой пяточной области. Рана не заживала, несмотря на проводившееся амбулаторное и стационарное лечение (включавшее вазапростан 40 мкг/сут N 15), осложнилась раневой инфекцией (St. aureus, Enterococcus).
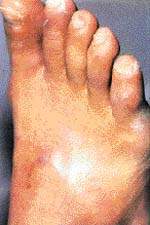
На момент осмотра: рана 4,5 х 3,5 см, глубиной до 3 см (см. рисунок 1). Стопа отечна, теплая на ощупь. Вибрационная чувствительность на стопах = 0-1 балл, пульсация на артериях правой стопы ослаблена, левой — не определяется.
Общее состояние: относительно удовлетворительное, температура тела в норме. ЧСС = 70 уд/мин, АД = 140—150/80—90 mmHg.
Рентгенологически: дефект мягких тканей пяточной области, признаков деструкции пяточной кости нет.
УЗДГ: справа — признаки стеноза ~50% бедренно-подколенного сегмента, артерий голени. Слева — стенотические изменения бедренно-подколенного сегмента (~50%), окклюзия передней тибиальной артерии, субтотальный стеноз задней большеберцовой артерии.
Дуплексное сканирование брюшного отдела аорты и артерий нижних конечностей (в ГКБ №81): сосудистая стенка неровная, утолщена в дистальных сегментах обеих задних большеберцовых артерий (ЗББА) с медиокальцинозом. Толщина комплекса «интима-медиа» до 1,2 мм. В просвете дистальных сегментов ЗББА — множественные микрокальцинаты, стенозирование ЗББА справа до 90%, слева до 80%.
Восстановление артериального кровотока
На основании данных обследования и с учетом неэффективности проводившейся консервативной терапии, пациент был направлен к ангиохирургу для проведения реконструктивного вмешательства на артериях нижней конечности. Указанное лечение осуществлялось в 25-м Центральном военном клиническом госпитале РВСН с 13.05.03 по 02.06.03.
При обследовании в стационаре были получены следующие данные.
Клинический анализ крови: гемоглобин — 128 г/л, эритр. — 4,36*10 12 /л, лейк. — 6,8*10 9 /л (пал. — 2%, сегм. — 62%, эоз. — 2%, лимф. — 28%, мон. — 6%), СОЭ — 23 мм/ч.
Клинический анализ мочи: уд. вес — 1014, белок — 1,22%, цил. — нет, лейк. — 2—4 в п/зр, эритр. — 3—5 в п/зр.
Биохимический анализ крови: общий белок — 69,0 ммоль/л, билирубин — 10,0 ммоль/л, креатинин — 120 мкмоль/л, мочевина — 6,1 ммоль/л, холестерин — 4,8 ммоль/л, β-липопротеиды — 40%, триглицериды — 1,0 ммоль/л, АЛТ, АСТ — в норме.
ЭКГ: ритм синусовый, правильный, 68 уд/мин. Горизонтальное положение электрической оси сердца.
Ro-графия органов грудной клетки: легочные поля прозрачны. Корни фиброзные, с петрификатами. Гипертрофия левого желудочка, уплотнена дуга аорты.
УЗИ органов брюшной полости: печень, селезенка, желчный пузырь, поджелудочная железа, почки — без патологических изменений.
Ангиография артерий нижних конечностей: абдоминальный отдел аорты с неровными контурами, просвет ее сохранен. Контуры магистральных артерий нижних конечностей неровные, просвет сохранен, выраженный кальциноз стенок артерий. Магистральные артерии обеих голеней с неровными контурами, резко истончаются ниже уровня щели голеностопных суставов. В дистальном отделе левой задней большеберцовой артерии определяются два тандемных критических стеноза. Подошвенные артериальные дуги разомкнуты.
Проведенное лечение
Антибиотикотерапия (офлоксацин 200 мг два раза в день), хирургическая обработка раны (иссечение некротизированных тканей из кармана глубиной до 3 см), дезинтоксикационная терапия, дезагреганты в/в. Пациент переведен на инсулинотерапию (актрапид 8 ЕД п/з, 6 ЕД п/о, 6 ЕД п/у; монотард 8 ЕД п/з, 8 ЕД — 22.00), достигнута компенсация углеводного обмена (гликемический профиль 25.06.03: 8,9–6,5–4,7–7,4–5,1 ммоль/л). В связи с диабетической нефропатией IV ст. пациент постоянно получает эналаприл 10 мг/сут.
20.05.03 произведена рентгеноэндоваскулярная ангиопластика задней большеберцовой артерии слева, восстановлен артериальный кровоток.
Операция проводилась под местной анестезией 0,5%—20,0 Sol. Novocaini, левосторонним чрезбедренным доступом антеградно пунктирована бедренная артерия. Через интродюсер диаметром 5F введен коронарный проводник в заднюю большеберцовую артерию дистальнее стенозов. В область критических стенозов подведен баллонный сегмент катетера размерами 2, 5x20, 0 мм. Выполнена ангиопластика под рабочим давлением до 5 атм. На контрольной ангиограмме стеноз устранен, препятствий для кровотока не определяется. Проводник удален. Интродюсер подшит к коже. Асептическая повязка. За период вмешательства больному внутриартериально введено 7 тыс. ЕД гепарина. Состояние пациента не изменилось.
После выписки: при допплеровском исследовании магистрального кровотока справа и слева в задних большеберцовых артериях — магистральный измененный кровоток (ЛПИ > 1), в тыльных артериях стопы — коллатеральный кровоток, но ЛПИ > 1 (возможно завышение лодыжечно-плечевого индекса, вследствие артериосклероза Менкеберга).
Чрескожное напряжение кислорода (tcpO2) на тыльной стороне левой стопы (через три месяца после ангиопластики): лежа — 19 mmHg, сидя — 20 mmHg (возможно занижение показателя вследствие отека стопы). По совокупности клинических данных, состояния раны и результатов инструментального обследования было сделано заключение, что явления критической ишемии устранены.
Применение индивидуальной разгрузочной повязки (Total Contact Cast)
Пациент был выписан для амбулаторного лечения, которое включало:
- ежедневные перевязки с промыванием раны раствором диоксидина, фурацилина, наложением атравматической повязки (Atrauman, Branolind);
- регулярное удаление гиперкератоза с краев раны;
- разгрузку пораженной конечности (костыли);
- компенсацию углеводного обмена (инсулинотерапия).
Признаков ишемии конечности не наблюдалось, рана заполнилась полноценной грануляционной тканью (см. рисунок 2), но скорость сокращения размеров раны оказалась ниже расчетной (см. рисунок 3).
Известно, что скорость заживления соответствует расчетной при отсутствии значимой ишемии, инфекции и механической нагрузки на рану. Учитывая, что разгрузка конечности с применением костылей не является оптимальной, было решено изготовить иммобилизирующую разгрузочную повязку.
Эквивалентный радиус раны рассчитывается как (d1+d2)/4, где d1 и d2 — соответственно максимальный и перпендикулярный ему минимальный диаметр раны.
Расчетная скорость заживления (черная линия) определяется по формуле Cavanagh: r = -0.74 + 1.04*r0 — 0.1*t — 0.012*r0*t, где r — эквивалентный радиус раны в данный момент, r0 — исходный эквивалентный радиус раны, а t — время с начала лечения (дни) (Cavanagh, 2001).
Реальные размеры раны наносились на график (красная линия) при каждом осмотре пациента (точка «0» — 1 месяц после баллонной ангиопластики). Из графика видно, что после изготовления ИРП скорость заживления (угол наклона графика) значительно выросла и достигла расчетной.
При применении этого метода разгрузки рана начала затягиваться гораздо быстрее, и к 10.09.03 было достигнуто заживление язвы (см. рисунок 4).
Основными методами реваскуляризации нижних конечностей являются шунтирующие операции и чрескожная транслюминальная баллонная ангиопластика (ЧТБА). Зачастую ЧТБА считают недостаточно эффективной и предлагают не использовать у пациентов с СД. Известно, что долговременный эффект шунтирования выше, чем у баллонной ангиопластики, причем у больных с СД эта разница выражена сильнее (Dyet, 2000). Но в критических ситуациях (язвенные дефекты, критическая ишемия) ангиопластика представляет собой малоинвазивный метод, позволяющий стабилизировать ситуацию и избежать ампутации, что зачастую более важно, чем отдаленные результаты вмешательства. Это так называемая limb-saving angioplasty — ангиопластика для спасения конечности.
История болезни, представленная выше, демонстрирует также, как важна постоянная оценка эффективности проводимого лечения (в нашем случае — сопоставление динамики размеров язвы с результатами расчета по формуле Cavanagh). Если эффект от лечения недостаточен, необходимо выявить причину, по которой это происходит. В нашем случае отсутствие оптимального режима разгрузки оказалось достаточной причиной для замедленного заживления раны, и эта проблема могла быть решена только с помощью нового метода — иммобилизирующей разгрузочной повязки. Следует особенно отметить, что для приближения к «идеальной» скорости заживления не потребовалось использования ни «стимуляторов заживления» (солкосерил, актовегин, метилурацил и т. п.), ни «сосудистых» средств. Эти препараты широко применяются, однако их эффективность в отсутствии необходимых условий для заживления (см. таблицу 1) крайне низка.
В настоящее время становятся доступными новые методы лечения СДС, внедрение которых в повседневную практику вполне возможно и крайне необходимо. Только адекватное комбинированное лечение позволяет достичь оптимальных результатов, особенно в сложных случаях, таких, как синдром диабетической стопы.
По вопросам литературы обращайтесь в редакцию
О. В. Удовиченко, кандидат медицинских наук
Г. Р. Галстян, кандидат медицинских наук
И. А. Ерошкин, кандидат медицинских наук
А. А. Ефимов, О. В. Носов
Ю. Г. Васильев, кандидат медицинских наук
Эндокринологический научный центр РАМН (Москва), 25-й Центральный военный клинический госпиталь РВСН (Одинцово)
Что такое сухая гангрена? Причины возникновения, диагностику и методы лечения разберем в статье доктора Манасяна К.В., сосудистого хирурга со стажем в 10 лет.
Над статьей доктора Манасяна К.В. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Гангрена — это некроз (омертвление) тканей живого организма, связанных с внешней средой, например, кожи, лёгких, кишечника и других. С древнегреческого данный термин переводится как "разъедающая язва".
Сухая гангрена — это опасное заболевание, требующее незамедлительного лечения. При этой патологии отмирание ткани происходит без выраженного инфекционного и воспалительного процесса. Иначе такой характер течения заболевания называют мумификацией, т. е. отсыханием органа.
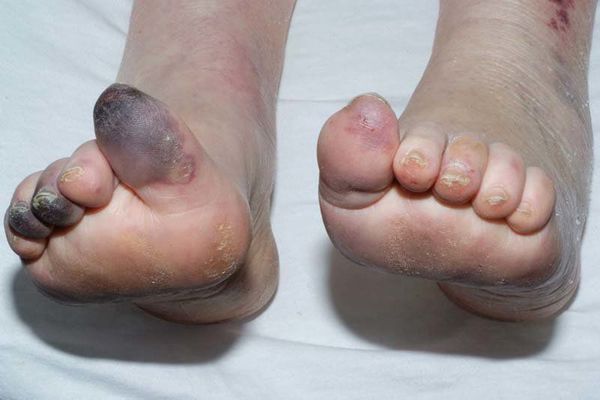
Механизмы возникновения гангрены бывают двух типов:
- прямыми (травматическими и токсическими) — появляются по причине непосредственного повреждения, иногда даже незначительного;
- непрямыми (ишемическими, аллергическими, трофоневрологическими) — происходит опосредованное отмирание тканей через анатомические каналы, в частности, при поражении сосудистой системы.
Исходя из этого факторы риска развития сухой гангрены можно также разделить на две группы:
- Внешние (экзогенные):
- переохлаждение (обмоорожение);
- химический ожог;
- удар током высокого напряжения.
- Внутренние (эндогенные): артерий нижних конечностей; ;
- курение;
- воспалительные заболевания артерий (васкулиты, в частности тромбангиит). [4][5][6]
Зачастую гангрена возникает при совокупности факторов, например, в результате механического повреждения кожи пациента с сахарным диабетом. По статистике, доля людей с мумификацией, развившейся на фоне подобных факторов и приведшей к ампутации конечности, составляет 4,2-6,4 на одну тысячу человек в год. В связи с этим люди с диабетической стопой относятся к группе риска развития гангрены. [10]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы сухой гангрены
К симптомам сухой гангрены относятся:
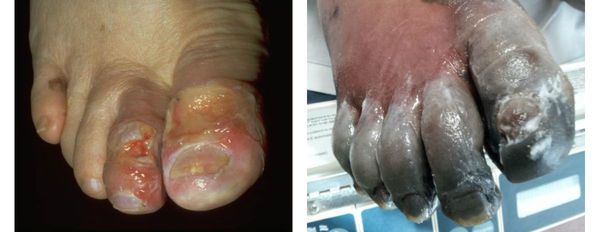
- потемнение кожного покрова (вначале кожа бледнеет, приобретает синюшный оттенок, затем постепенно становится чёрной);
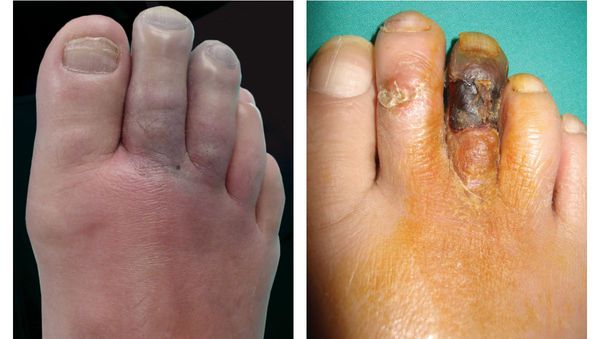
- уменьшение кожи в объёме, её высыхание, сморщивание и уплотнение;
- отслаивание эпидермального слоя кожи;
- снижение температуры конечности (зависимость от температуры окружающей среды);
- снижение чувствительности поражённых тканей (онемение);
- наличие специфического запаха отмирающего участка (хоть и не столь сильного);
- ощущение боли (простреливающие, жгучие и ноющие болевые ощущения, которые могут носить постоянный характер, а также усиливаться при минимальной нагрузке);
- покалывание, жжение или зуд в области поражения;
- нарушение функционирования конечности.
Болевой синдром отражает то, насколько сильно страдают окружающие ткани: чем сильнее боль в зоне некроза, тем больше в этой области живых клеток. Ослабление болезненных ощущений или их исчезновение указывает на прогрессирование заболевания, так как чувствительность отмирающей ткани пропадает в результате гибели нервных окончаний. В это время анатомические области, граничащие с сухой гангреной, остро нуждаются в артериальном кровотоке, которого им не хватает. В итоге в этих тканях вырабатываются продукты метаболизма и болевые импульсы.
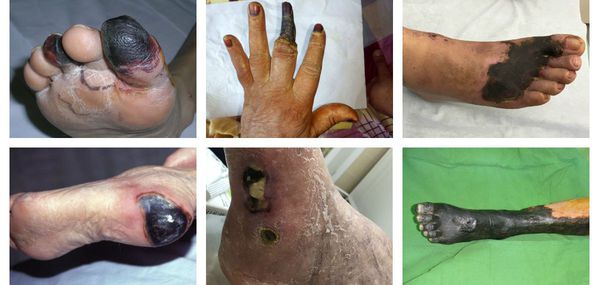
Сухая гангрена начинается с появления небольшого очага на конечности (как правило, расположенного на пальце). Далее она распространяется на прилегающие пальцы, подошвенную и тыльную поверхность стопы, захватывая всё больше тканей конечности.
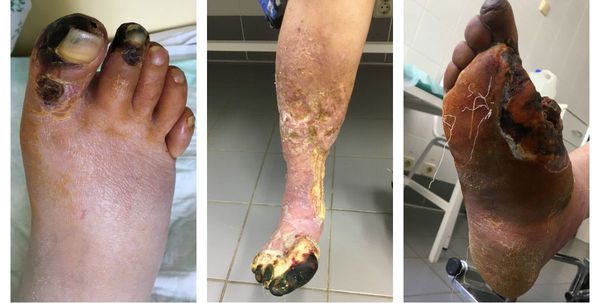
Изменения цвета отмирающих участков кожи связано с накоплением в них гемоглобина и выделением эритроцитарного железа, которое в результате соединения с сероводородом воздуха превращается в сульфид железа.
Зона, которая находится на границе гангрены и здоровой ткани называется демаркацией. Обычно она не оформлена. В исключительно редких случаях при естественном течении болезни она может самостоятельно ограничиться, что приведёт к самоампутации отмирающей конечности. [3] [5] [6]
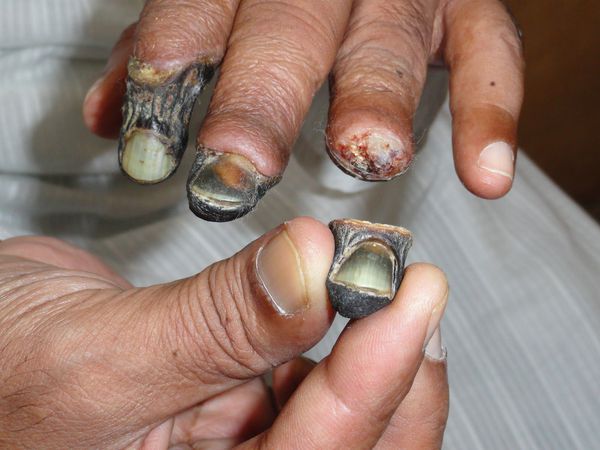
К первым признакам сухой гангрены относятся следующие состояния:
- замерзание конечности даже в тепле;
- боль в ногах и утомляемость после длительной ходьбы;
- наличие долго не заживающих ран и язв на коже конечности.
ВАЖНО: Возникновение одного из этих проявлений при наличии таких предрасполагающих факторов, как сахарный диабет или атеросклероз, — веский повод для скорейшего обращения к врачу-флебологу или хирургу. Промедление как минимум может обернуться для пациента утратой конечности.
Патогенез сухой гангрены
Процесс возникновения и развития сухой гангрены конечностей можно условно разделить на семь этапов:
При естественном течении сухой гангрены признаков инфекции не наблюдается (в отличие от влажной гангрены), однако в омертвевших тканях не исключено наличие возбудителей условно-патогенной инфекции. При этом в зонах некроза не происходит бурного развития инфекции.
Процесс развития сухой гангрены ног и рук может длится от нескольких дней до нескольких месяцев в зависимости от уровня поражения артерий и компенсаторных механизмов саморегуляции. [3] [4] [5] [6] Если некроз уже развился, то заживление без удаления некоторой части конечности невозможно.
Классификация и стадии развития сухой гангрены
В зависимости от распространения некроза на конечности можно выделить следующие виды заболевания:
- гангрена пальцев;
- гангрена дистального сегмента стопы (кисти);
- гангрена пяточной области;
- тотальная гангрена стопы (кисти) или голени (предплечья);
- гангрена бедра (встречается крайне редко, так как пациенты просто не доживают до столь массивного гангренозного поражения). [3][5][6]
По механизму развития различают два вида гангрены:
- Первичная гангрена — это некроз, развившийся в результате ишемии тканей. Иначе говоря, она связана с нарушением проходимости артериального сосуда, кровоснабжающего определённый участок организма.
- Вторичная гангрена — это некроз тканей, возникающий в результате острого гнойного воспаления клетчаточных пространств и фасциальных футляров. Чаще всего развивается при флегмоне стопы, затрагивая пальцы, а также при или глубоком абсцессе на фоне нейроптической формы синдрома сахарного диабета.
По распространённости выделяют три степени гангрены:
- поверхностную — поражается лишь дерма;
- глубокую — проникает в сухожилия, полости суставов, фасции и кости;
- тотальную — затрагивает все отделы органа или конечности.
Помимо сухой гангрены существует ещё влажная и газовая.
Влажная гангрена протекает с преобладанием инфекционного компонента, т. е. гнилостного расплавления. В процесс вовлекаются все без исключения ткани — кожа, подкожно-жировая клетчатка, фасции, связки, мышцы, сухожилия и кости. Кожные покровы местами приобретают багрово-синюшный, чёрный или серо-зелёный цвет. Характерно появление эпидермальный пузырей, наполненных вначале бурым, а затем зеленоватым содержимым с выраженным неприятным гнилостным запахом.
В отличие от сухой гангрены при влажной ткани не уплотняются, а распадаются, становятся рыхлыми и разжижаются. Отёк и гиперемия кожи быстро распространяются. Кожа голени может быть напряжена, лосниться. Без активного лечения демаркационная линия не появляется, так как процесс стремится к генерализации.
Газовая гангрена отличается возникновением вокруг очага некроза лёгкой крепитации газа под кожей, т. е. ощущением хруста, которое появляется из-за лопающихся пузырьков газа в тканях. Крепитация не слышна, но осязается пальцами как "скрип" крахмала или снега под ногами. Объективно газ в мягких тканях может быть обнаружен при рентгенографии конечности на достаточно "мягких" снимках. [11]
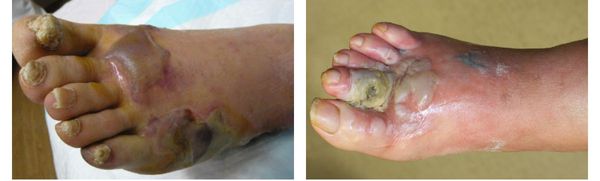
Осложнения сухой гангрены
Само по себе наличие гангрены указывает на полную нежизнеспособность и омертвление тканей, предполагая крайнюю степень патологического процесса. Поэтому отсутствие своевременного лечения может привести к потере поражённой конечности.
Сухая гангрена не может перерасти во влажную или газовую гангрену, как ошибочно утверждают многие источники, потому что изначально при возникновении некроза становится очевиден механизм развития гангрены. [1] [2] [3] [4] [7]
Редкими осложнениями сухой гангрены являются сепсис и септический шок. Они возникают в связи с токсическим действием продуктов распада при проникновении их в системный кровоток. Данные осложнения способны привести к полиорганной недостаточности и, как следствие, летальному исходу.
К проявлениям сепсиса относятся:
- ознобы;
- высокая или очень низкая температура тела (больше 38°C или меньше 36°C);
- одышка (частота дыхания более 20 в минуту);
- артериальная гипотензия (пульс более 90 ударов в минуту);
- аритмия;
- олигурия (объём мочи менее 0,5 мл/кг/ч);
- вялость, заторможенность;
- наличие различных лабораторные показания, не поддающаяся коррекции — низкий уровень белка, тромбоцитов и красных кровяных телец, а также высокий уровень билирубина, остаточного азота, мочевины, сахара в крови и ацетона в моче.
В случае септического шока давление становится крайне низким, даже на фоне интенсивного вливания внутривенных растворов. В связи с этим около 30-40 % пациентов умирает несмотря на оказываемое лечение. [12]
Диагностика сухой гангрены
Диагностика сухой гангрены достаточно проста, так как на некроз указывает внешний вид поражённого органа:
- его сухость;
- уменьшение участка кожи в объёме;
- тёмный, вплоть до чёрного, цвет кожи;
- наличие слабого неприятного запаха и болей непосредственно в мёртвом участке;
- наличие прохладных на ощупь окружающих тканей с выраженным болевым синдромом в них. [1][2][3][4][7]
При осмотре необходимо диагностировать причину сухой гангрены (например, атеросклероз артерий и тромбангиит). Для этого нужно проверить пульсацию артерий как поражённой, так и здоровой ноги на уровне паховых и подколенных областей, позади медиальной лодыжки и на тыле стопы. В дальнейшем необходимо подтвердить причинный диагноз с помощью ультразвукового исследования.
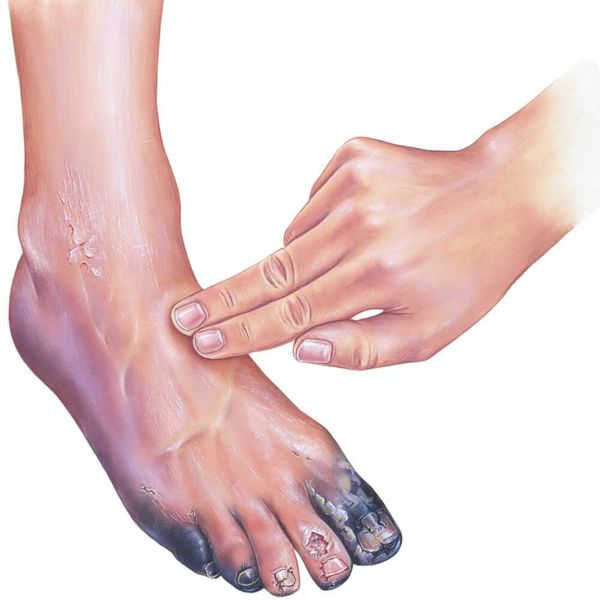
В качестве предоперационной подготовки для определения вида оперативного лечения выполняется ангиография нижних конечностей:
- при протяжённых поражениях артерий выполняется хирургическая операция — аутовенозное шунтирование;
- при коротких поражениях более предпочтительно выполнить эндоваскулярную операцию (наименее травматичное лечение). [1][2]
Для предоперационной подготовки нужно сдавать общий и биохимический анализ крови, а также бактериальный посев. Эти лабораторные исследования помогут выяснить, не является ли причиной сухой гангрены сахарный диабет.
Лечение сухой гангрены
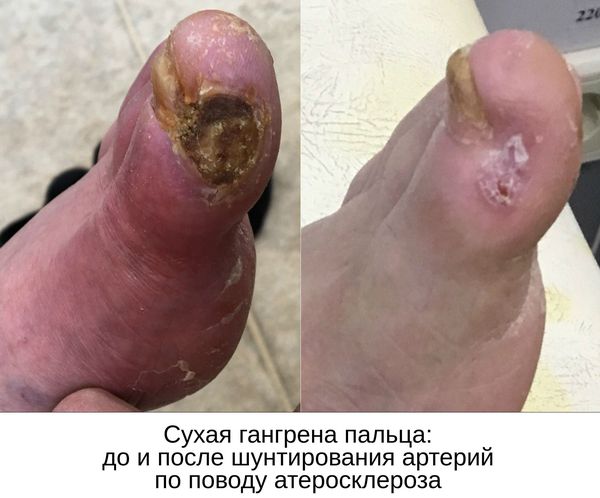
С целью предотвращения гангрены и максимально возможного сохранения конечности требуется восстановить кровоток в тканях, окружающих гангренозный участок.
Нормализовать кровообращение в органе можно при помощи оперативного вмешательства:
- Реконструктивные операции на артериях конечности (как правило, руки):
- аутовенозное шунтирование;
- эндартерэктомия (удаление закупорки артерии) с аутовенозной пластикой;
- шунтирование артерий аорто-подвздошно-бедренного сегмента синтетичсекими протезами.
- Рентгенэндоваскулярные операции (не показаны пациентам с тромбангиитом):
- стентирование;
- баллонная ангиопластика артерий.
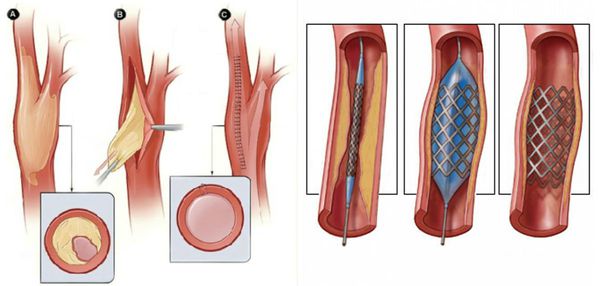
Паллиативные операции (поясничная симпатэктомия и остеотрепанация), проводящиеся для улучшения качества жизни, и другие нехирургические методы лечения (генная и физиотерапия) не способны предотвратить прогрессирование сухой гангрены.
Саму гангренозную ткань необходимо убрать. Для этого проводят:
- малые ампутации — удаление пальцев или части стопы с некрозом;
- некрэктомию — поверхностное удаление некротического струпа до пределов тканей с удовлетворительным кровотоком.
В случаях обширного гангренозного поражения с потерей опороспособной стопы прибегают к ампутации голени либо бедра. Чтобы избежать подобного печального исхода, важно при первых же признаках гангрены без промедления обратиться к врачу: потерять конечность куда страшнее, чем её лечить. Особенно это относится к людям с сахарным диабетом и атеросклерозом: нельзя ждать, когда гангрена начнёт прогрессировать, иначе удаление поражённой конечности будет неизбежным.
Если всё же обширная гангрена стопы привела к потере её опороспособности, то в таких случаях целесообразно выполнение ампутации голени на уровне границы средней и верхней трети. В дальнейшем это позволит подобрать и использовать удобный протез.
Даже после ампутации гангрены, возникшей из-за закупорки артерий ноги, необходимо выполнить реконструктивную (шунтирующую) или рентгенэндоваскулярную операцию на артериях нижней конечности. Делается это с целью обеспечения кровотока для успешного заживления постампутационной культи голени.
При физических причинах гангрены (отморожение) или химических (внутриартериальное введение синтетичсеких наркотиков) лечение заключается в нормализации вязкости крови. Для этого проводится:
- антикоагулянтная и инфузионная терапия;
- профилактика синдрома полиорганной недостаточности;
- хирургическое удаление участка, поражённого сухой гангреной. [1][2][3]
Прогноз. Профилактика
Прогноз зависит от степени гангренозного поражения:
- при гангрене пальцев или небольших участков стопы конечность можно восстановить при реставрации кровотока, удалении омертвевших тканей и создании благоприятных условий для заживления;
- при тотальной сухой гангрене стопы показана ампутация на уровне голени, но с условием, что кровоток в голени достаточен для заживления постампутационной культи;
- при обширной гангрене голени пациенту показана ампутация ноги на уровне бедра.
Пятилетняя выживаемость при сухой гангрене сравнима с выживаемостью при злокачественных новообразованиях (например, раковой опухолью кишечника): к концу первого года после подтверждения диагноза "Критическая ишемия" (критическое снижение кровоснабжения) лишь 45 % пациентов имеют шанс сохранения конечности, а около 30 % продолжают жить после ампутации бедра или голени, а 25 % — умирают.
Тем не менее число больших ампутаций остаётся высоким, а их исходы — крайне тяжёлыми. Риск смертности в течение 30 дней после таких ампутаций составляет 4-30 %, а риск развития осложнений, таких как инфаркт миокарда, инсульт, инфекция, — 20-37 %. [1] [7] [10]
Реабилитация и протезирование
Трудности в реабилитации пациентов после ампутаций и протезирования у многих пожилых пациентов отрицательно влияют на отдалённые результаты и качество их жизни.
Период реабилитации зависит от объёма гангренозного поражения, качества заживления дефекта, сопутствующих соматических заболеваний, возраста пациента и его желания вернуться к полноценной жизни. Как правило, при успешном лечении и соблюдении всех рекомендаций врача длительность реабилитации составляет 3-6 месяцев.
На качество реабилитации также влияет питание. Поэтому в период восстановления рацион должен состоять из белковой и калорийной (но не жирной) пищи: из мяса индейки, рыбы, фасоли, творога и яиц. От жирной пищи во время реабилитации лучше отказаться.
Первичный протез подбирается после заживления раны культи. Затем, когда сформирована мышца культи, пациенту подбирают вторичный протез. Этим занимается врач-реабилитолог совместно с протезистом. [7] [8] [9]
Профилактика
Для предупреждения развития гангрены у предрасположенных к этому людей (например, лиц с сахарным диабетом, атеросклерозом), важно соблюдать меры профилактики:
- отказ от курения — эта пагубная привычка может привести к ухудшению кровообращения и закупорке сосудов;
- контроль уровня сахара в крови;
- проверка тела на наличие повреждений, их лечение и ежедневное наблюдение за их заживлением;
- незлоупотребление алкоголем.
Также для профилактики гангрены нужно избегать обморожений и иных внешних причин образования некроза.
Что такое диабетическая стопа? Причины возникновения, диагностику и методы лечения разберем в статье доктора Есипенко И. А., сосудистого хирурга со стажем в 37 лет.
Над статьей доктора Есипенко И. А. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Диабетическая стопа (синдром диабетической стопы, СДС) — это тяжёлое осложнение сахарного диабета в виде инфекции, язв или разрушения глубоких тканей, которое возникает в связи с нарушением макроструктуры стопы и микроциркуляции крови, по причине разрушения нервных окончаний и нервных волокон. [10]
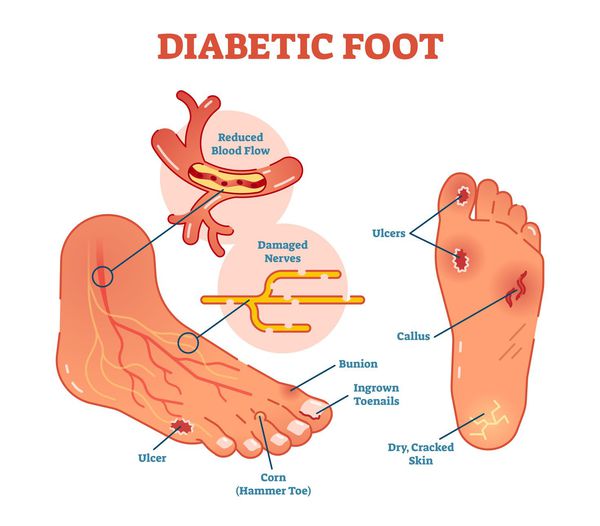
Главная причина ДС — это сахарный диабет (СД). И хотя синдром диабетической стопы не развивается с первого дня увеличения уровня глюкозы в крови более 7,0-8,0 ммоль/л, каждый пациент с диагнозом «сахарный диабет» должен помнить о таком грозном возможном осложнении.
Хронические раны на ногах у людей с сахарным диабетом встречаются в 4-15 % случаев. В некоторых случаях они становятся первым признаком развившегося диабета [10] .
Основные «пусковые механизмы» развития язв при СДС:
1. Ношение неудобной обуви. К изменению нагрузки на суставы стопы, сдавливанию или потёртости кожи, локальной микроишемии, инфильтрату, или некрозу могу привести любые дефекты обуви:
- несоответствующий размер обуви (меньше или больше, чем нужно);
- стоптанные и/или высокие каблуки;
- рубец на стельке;
- дефект подошвы;
- мокрая обувь;
- несоответствие обуви времени года.
2. Увеличенный вес тела. Учитывая площадь стоп, при увеличении веса тела (даже на 1 кг) увеличивается и нагрузка на каждый сустав стопы. Самая уязвимая область — подошвенная поверхность.
3. Разрастание эпидермиса (поверхности) кожи. Этот процесс происходит из-за нарушенных обменных процессов в коже на фоне СД (под утолщённым эпидермисом-"мозолью" в слоях кожи нарушается микроциркуляция, что приводит к микроишемии и некрозу).
4. Микротравмы:
- укусы животных;
- уколы шипами растений;
- порезы при педикюре и т. п.
5. Стенозы (сужение) и окклюзии (закупорка) магистральных артерий. В результате отсутствия кровоснабжения в стопах и голенях к микроишемии присоединяется макроишемия и развитие гангрены конечности.
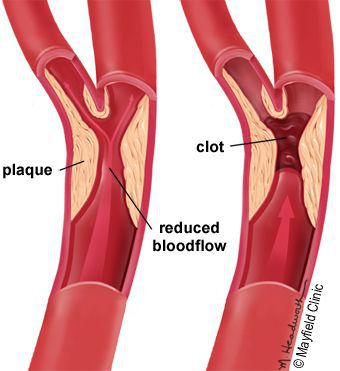
6. Условно патогенная или патогенная микрофлора. Активизация флоры (микробов и других микроорганизмов) на поверхности кожи в условиях СД приводит к воспалению кожного покрова, а в условия ишемии или микротравмы значительно ускоряется развитие гангрены.
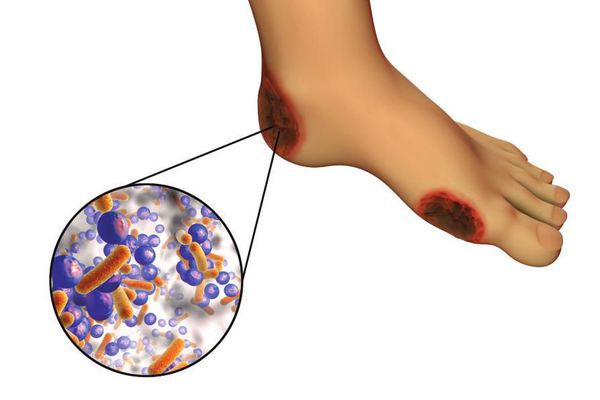
Часто наблюдается сочетание нескольких причин возникновения язв при СДС.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы диабетической стопы
Отправной точкой развития СДС считается не дата установления диагноза «Сахарный диабет», а время, когда были выявлены первые симптомы СД (однократные подъёмы глюкозы крови, сухость во рту и другие).
Симптомы СДС:
- онемение, зябкость, жжение, отёки в стопах и другие неприятные ощущения;
- выпадение волос на на стопах и голенях, потливость стоп;
- изменение окраски кожи (гиперемия, гиперпигментация, цианоз);
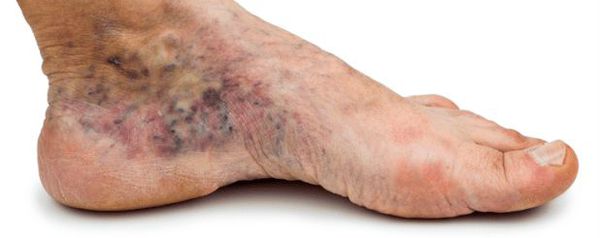
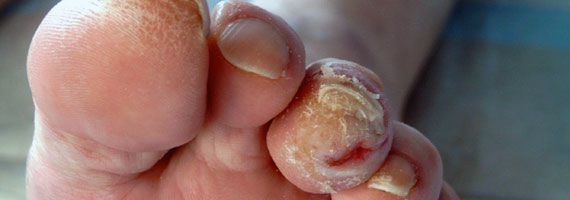
- утолщение, расслаивание, изменение формы и цвета ногтевых пластинок;
- кровоизлияния под ногтевой пластинкой в виде «синяков» под ногтями;
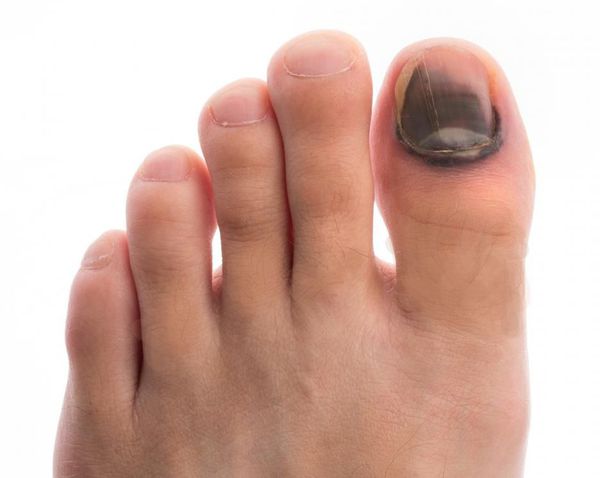
- деформация стоп;
- снижение чувствительности стоп — вибрационного, температурного, болевого и тактильного восприятия;
- боль в области стопы и язвы, возникающая как в покое или ночью, так и при ходьбе на определённые расстояния;
- истончение кожи, шелушение;
- понижение или увеличение температуры стоп и голеней;
- длительная эпителизация (заживление) микротравм — до двух месяцев, при этом остаются коричневые рубцы;
- трофические язвы, длительно не заживающие на стопах.
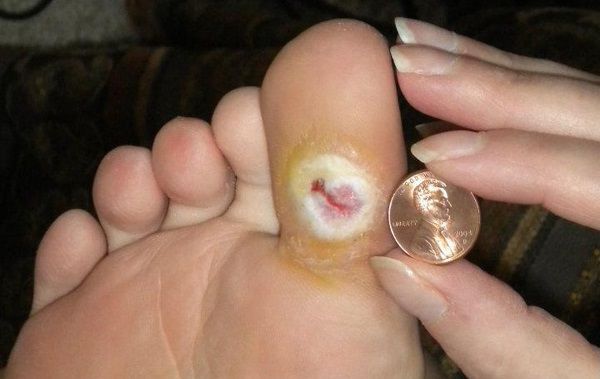
Чаще всего трофическим изменениям подвержены дистальные отделы конечности: пальцы и подошвенная поверхность стопы в проекции головок плюсневых костей. Зона образования трофической язвы зависит от причины её возникновения.
Патогенез диабетической стопы
Механизм развития СДС представляет собой следующую последовательность нарушений:
- Снижается выработка гормона инсулина.
- Увеличивается уровеь глюкозы в крови — развивается гипергликемия.
- Блокируется кровоток в мелких сосудах, через сосудистую стенку перестаёт поступать кислород и другие микроэлементы.
- Разрушаются нервные волокна и рецепторы.
- Наступает микро- и макроишемия тканей стопы.
- Образуются трофические язвы.
Таким образом, при СДС происходит повреждение всех тканей ноги.
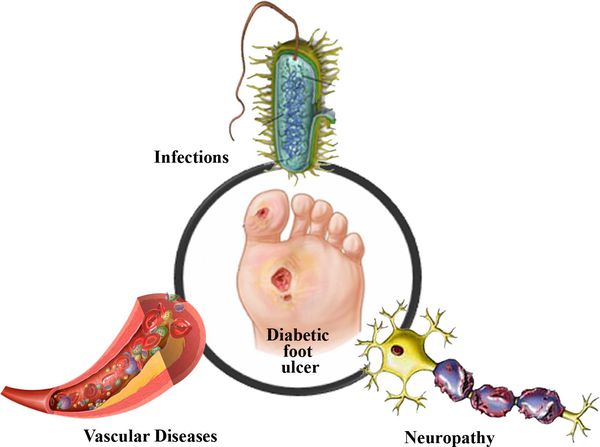
В результате дефицита инсулина в организме диабетика количество глюкозы в крови увеличивается. Это в свою очередь негативно сказывается на состоянии как мелких, так и крупных сосудов:
- на стенках сосудов скапливаются иммунологические вещества;
- мембраны становятся отёчными;
- просвет сосудов сужается.
В результате этих изменений кровообращение нарушается и образуются небольшие тромбы. Эти изменения в организме препятствуют поступлению достаточного количества микроэлементов и кислорода в клетки и тем самым приводят к нарушениям обменного процесса. Кислородное голодание тканей замедляет процесс деления клеток и провоцирует их распад.
Увеличение уровня глюкозы в крови также становятся причиной поражения нервных волокон — снижается чувствительность.
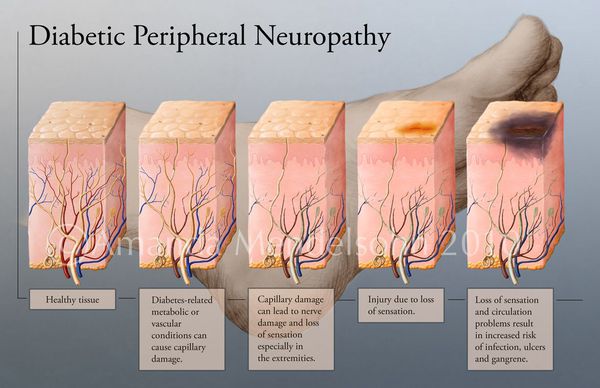
Все деструктивные процессы, происходящие в тканях стопы приводят к тому, что любое повреждение кожи становится лёгким процессом, а заживление — длительным. Усугубить состояние стопы могут присоединившиеся инфекции, которые способны привести к образованию гангрены — некрозу тканей. [9]
Классификация и стадии развития диабетической стопы
Классификация I Международного симпозиума по диабетической стопе
В 1991 году в Нидерландах на I Международном симпозиуме была принята классификация СДС, которая является наиболее распространённой. [1] Она предполагает разделение заболевания на три типа в зависимости от преобладающего патологического процесса:
- нейропатическая инфицированная стопа:
- длительное течение сахарного диабета;
- позднее возникновение осложнений;
- отсутствие болевого синдрома;
- цвет и температура кожи не изменены;
- уменьшение всех видов периферической чувствительности;
- наличие периферического пульса.
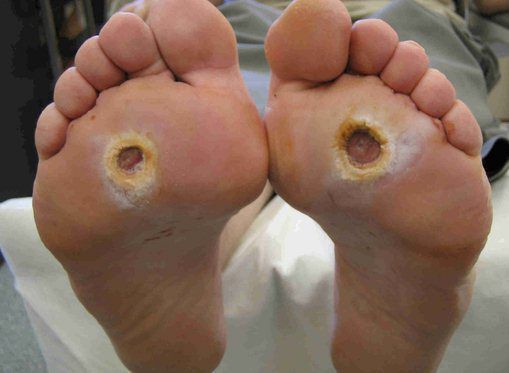
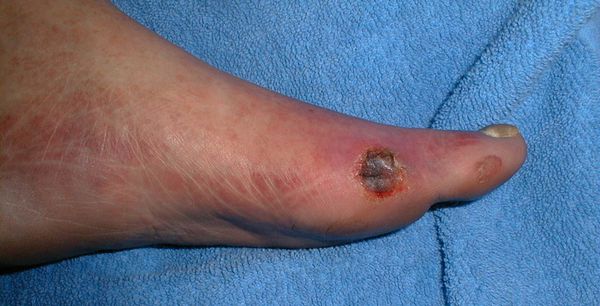
Классификация Вагнера
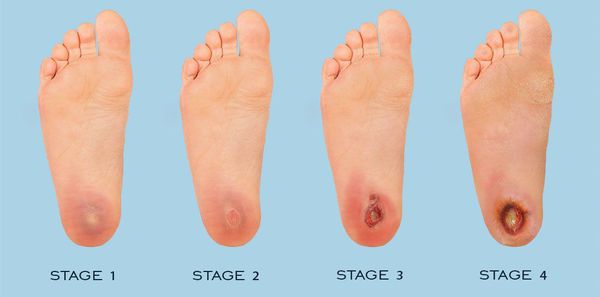
По степени выраженности поражений тканей стопы выделяют следующие стадии СДС: [6] [7]
- Стадия 0 — изменение костной структуры стопы — артропатия;
- Стадия 1 — изъязвление (язвы) кожи;
- Стадия 2 — изъязвление всех мягких тканей, дном язвы являются кости и сухожилия;
- Стадия 3 — абсцедирование и остеомиелит (воспаление костной ткани);
- Стадия 4 — образование гангрены дистальных отделов стопы (пальцев);
- Стадия 5 — образование гангрены стопы и отделов голени.
Классификация Техасского университета
Данная классификация была разработана в 1996-1998 годах. [8] В её основе лежит оценка язвы по глубине, наличию инфицирования и ишемии — риска ампутации конечности.
Диабетическая стопа Cиндром диабетической стопы (СДС) объединяет патологические изменения периферической нервной системы, артериального и микроциркуляторного русла, явления остеоартропатии, представляющие непосредственную угрозу развития я
 |
| Диабетическая стопа |
Cиндром диабетической стопы (СДС) объединяет патологические изменения периферической нервной системы, артериального и микроциркуляторного русла, явления остеоартропатии, представляющие непосредственную угрозу развития язвенно-некротических процессов и гангрены стопы. СДС — одно из наиболее грозных осложнений сахарного диабета (СД), развивающееся более чем у 70% больных. Несмотря на то что поражение нижних конечностей достаточно редко является непосредственной причиной смерти пациентов, оно в большинстве случаев ведет к инвалидизации. Частота ампутаций конечностей у больных СД в 15 — 30 раз превышает данный показатель в общей популяции и составляет 50 — 70% общего количества всех нетравматических ампутаций. Однако следует особо отметить, что при СД II типа (инсулин-независимом) уже на момент постановки диагноза от 30% до 50% больных имеют признаки поражения нижних конечностей той или иной степени.
Достаточно велики и экономические затраты, необходимые для проведения адекватного лечения этой большой категории пациентов, но следует помнить, что при использовании оперативных методов эти затраты возрастают в 2 — 4 раза. Это связано как с более высокой стоимостью самого хирургического лечения, так и с увеличением затрат на последующую реабилитацию (протезирование, полная потеря трудоспособности). Ампутация одной конечности ведет к возрастанию нагрузки на другую, и, как следствие этого, многократно увеличивается риск развития язвенных дефектов и на контралатеральной конечности.
 |
| Алгоритм обследования больных с синдромом диабетической стопы |
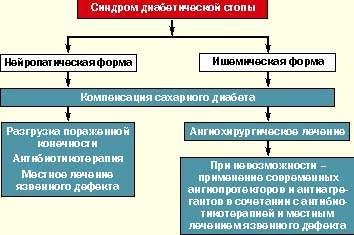
В мировой клинической практике как терапевтов, так и хирургов принята единая классификация синдрома диабетической стопы, согласно которой различают три основные клинические формы:
- нейропатическую;
- ишемическую;
- нейроишемическую (смешанную).
В основу данной классификации положены современные представления о патогенезе СДС и преобладании одного из его основных звеньев (нейропатия, микро- и макроангиопатия) в конкретном клиническом случае. Каждая клиническая форма СДС требует различных терапевтических подходов.
Одним из проявлений диабетической нейропатии является диабетическая остеоартропатия. Наиболее выраженные изменения костных структур и связочного аппарата стопы называются суставом или стопой Шарко. Кроме собственно сустава Шарко выделяют и другие формы костно-суставных поражений при СД: остеопороз, гиперостоз, остеолиз, патологические переломы и спонтанные вывихи. На практике наблюдаются различные сочетания вышеуказанных форм у одного и того же пациента, что связано с общностью их патогенетических и реализующих факторов. Учитывая этот момент, многие авторы предлагают объединить разновидности патологических изменений костей и суставов под термином «стопа Шарко».
Для раннего выявления поражения нижних конечностей у больных СД необходимо проведение определенного комплекса диагностических мероприятий, состоящих из следующих этапов.
1. Тщательный сбор анамнеза. Имеют значение длительность заболевания, тип СД ( I тип или II тип), проводимое ранее лечение, а также наличие у больного на момент осмотра или ранее таких симптомов нейропатии, как колющие или жгущие боли в ногах, судороги в икроножных мышцах, чувство онемения, парастезии. Жалобы больного на перемежающуюся хромоту являются характерным признаком макроангиопатии. Учитываются время появления болей, расстояние, которое больной проходит до появления первых болей, наличие болей в покое. В отличие от ишемических болей, которые могут также возникать ночью, нейропатически обусловленный болевой синдром купируется при ходьбе. Ишемические боли несколько ослабевают при свешивании ног с края постели. Наличие в анамнезе язв или ампутаций является важным прогностическим признаком в плане развития новых поражений стоп. При имеющихся других поздних осложнениях СД, таких как ретинопатия и нефропатия (особенно ее терминальная стадия), высока вероятность развития язвенного дефекта. Наконец, при сборе анамнеза необходимо определить информированность больного о возможности поражения стоп при СД, ее причинах и мерах профилактики.
2. Осмотр ног — наиболее простой и эффективный метод выявления поражений стопы. При этом важно обратить внимание на такие признаки, как цвет конечности, состояние кожи и волосяного покрова, наличие деформаций, отеков, участков гиперкератоза и их расположение, язвенных дефектов, состояние ногтей, особенно в межпальцевых промежутках, зачастую остающихся незамеченными. Пальпаторно определяется пульсация на артериях стопы.
 |
| Алгоритм лечения больных с различными клиническими формами синдрома диабетической стопы |
3. Оценка неврологического статуса включает:
а) Исследование вибрационной чувствительности, проводимое с помощью градуированного камертона. Для нейропатического поражения характерно повышение порога вибрационной чувствительности, для ишемической — показатели соответствуют возрастной норме.
б) Определение болевой, тактильной и температурной чувствительности по стандартным методикам. В последние годы большую популярность приобрели неврологические наборы монофиламентов, позволяющих с большой степенью точности определить степень нарушения тактильной чувствительности.
в) Определение сухожильных рефлексов.
г) Электромиография является наиболее информативным методом оценки состояния периферических нервов, однако ее применение ограничено из-за трудоемкости и высокой стоимости исследования.
4. Оценка состояния артериального кровотока. Наиболее часто используются неинвазивные методы оценки состояния периферического кровотока — допплерометрия, допплерография. Проводится измерение систолического давления в артериях бедра, голени и стопы — по градиенту давления определяется уровень окклюзии. Показатели лодыжечно-плечевого индекса (ЛПИ) отражают степень снижения артериального кровотока (ЛПИ = РАГ/РПА, где PАГ — систолическое давление в артериях стоп или голеней, PПА — систолическое давление в плечевой артерии). Показатели систолического давления и ЛПИ определяют дальнейший ход диагностического поиска. При необходимости проводится определение насыщения тканей кислородом, а для решения вопроса о возможности проведения ангиохирургического лечения — ангиография. Показатели систолического давления могут служить определенным ориентиром в плане возможности консервативного лечения, они также позволяют прогнозировать вероятность заживания язвенных дефектов стоп.
 |
| Диабетическая стопа: рентгенограмма |
5. Рентгенография стоп и голеностопных суставов позволяет выявить признаки диабетической остеоартропатии, диагностировать спонтанные переломы мелких костей стопы, заподозрить наличие остеомиелита, исключить или подтвердить развитие газовой гангрены.
6. Бактериологическое исследование имеет первостепенное значение для подбора адекватной антибиотикотерапии.
В группу риска развития СДС входят следующие категории пациентов:
- страдающие дистальной полинейропатией;
- страдающие заболеваниями периферических сосудов;
- имеющие язвы стоп в анамнезе;
- перенесшие ампутации;
- страдающие гипертонией и гиперхолестеринемией;
- слабовидящие и слепые;
- страдающие диабетической нефропатией, особенно на стадии ХПН;
- одинокие пожилые люди;
- злоупотребляющие алкоголем, курильщики.
Пациенты, входящие в группу риска, должны проходить указанные выше обследования не реже одного раза в шесть месяцев. Обследование должно проводиться специально обученным эндокринологом или группой специалистов (эндокринолог, хирург, рентгенолог, специалист функциональной диагностики) в поликлиниках по месту жительства. Больные, имеющие различные клинические формы синдрома диабетической стопы, должны направляться в специализированные отделения стационаров или в центры «Диабетическая стопа», организованные на базе городских многопрофильных больниц и специализированных центров. Тактика лечения каждого конкретного больного определяется в зависимости от формы и тяжести СДС, наличия других осложнений СД и сопутствующих заболеваний.
Таблица 1. Дифференциальная диагностика основных клинических форм синдрома диабетической стопы
В случае нейропатической формы СДС должно проводиться консервативное лечение больного с использованием разгрузки пораженной конечности (постельный режим, костыли, кресло-каталка, ношение специальной разгрузочной обуви), массивной антибиотикотерапии (с учетом данных бактериологического исследования отделяемого), проводимой до полной эпителизации дефекта, ежедневного местного лечения язвенного дефекта, включая хирургическую обработку раны с удалением гноя и некротических масс, орошением растворами антисептиков, применением современных перевязочных средств (в зависимости от стадии раневого процесса). Лечение проводится под строгим контролем гликемии с ежедневной коррекцией дозы инсулина и пероральных сахароснижающих препаратов. Большинству больных СД I типа требуется интенсификация инсулинотерапии, а больным СД II типа — перевод с приема таблетированных препаратов на инсулинотерапию. При наличии диабетической остеоартропатии в комплекс лечебных средств включаются препараты кальция, витамина Д, бифосфонаты.
При ишемической форме СДС предпочтение должно отдаваться современным методам сосудистых реконструкций для восстановления нормального кровотока в поврежденной конечности. Лечение таких больных должно проводиться совместно ангиохирургом и эндокринологом. В случае невозможности проведения оперативного лечения рекомендуется медикаментозная терапия (ангиопротекторы в эффективных дозах, вазапростан). Абсолютно необходимым является поддержание хорошей компенсации сахарного диабета.
В случае диагностики нейроишемической (смешанной) формы синдрома диабетической стопы должна проводиться комплексная терапия, влияющая на оба патогенетических звена.
Вопросы реабилитации особенно важны для больных, перенесших ампутации пальцев или части стопы по поводу диабетической гангрены, а также для пациентов с выраженными деформациями стоп. Для таких больных в обязательном порядке должны изготавливаться ортопедическая обувь и другие ортопедические приспособления.
Диспансерное наблюдение за больными с нейропатической формой синдрома осуществляется районными эндокринологами или специалистами кабинетов и центров «Диабетическая стопа». Наблюдение за пациентами с ишемической и смешанной формами синдрома должно осуществляться совместно эндокринологами и ангиохирургами центров «Диабетическая стопа» или профильных отделений городских больных. Профилактика развития поражений стоп при СД обязательно должна включать обучение пациентов правилам подбора обуви и ухода за ногами.
Проведение лечебных и профилактических мероприятий по приведенному плану позволяет снизить риск ампутации конечности у больных СД в два и более раза.

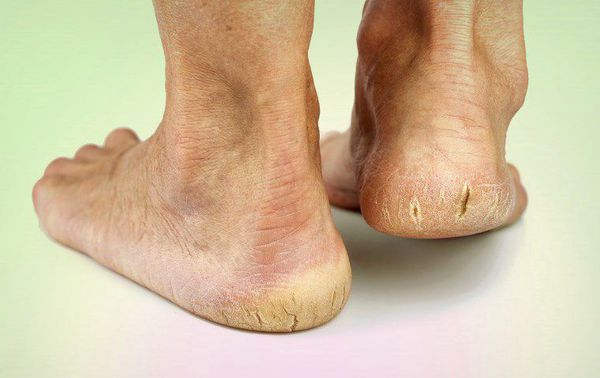
Трещины на ступнях – это частичное нарушение целостности кожного покрова на подошвенной части стопы. Чаще образуются на пятках, более подвержены их возникновению женщины. Глубокие трещины неприятны тем, что вызывают боль, долго заживают, затрудняют ходьбу, физические нагрузки. Как другие повреждения они облегчают проникновение в кожу патогенных бактерий, грибка и чреваты инфекционным воспалительным процессом. Почему они возникают?
Нарушение целостности кожного покрова бывает разной глубины. Если трещины задевают только верхние слои кожи или эпидермис, то их называют поверхностными. Они быстро заживают, не оставляя следов. Повреждения, которые затрагивают не только эпидермис, но и верхние слои дермы, относят к глубоким. Они довольно болезненны. При их заживлении нередко формируются рубцы.
Появляются обычно трещины стопы между пальцами, в области суставов больших пальцев, пяток, плюсны.
Почему образуются?
Многие уверены, что трещины на стопах бывают только у пожилых людей. Действительно, у 25 – 30 % людей старше 40 лет они присутствуют. Но также встречаются у мужчин, женщин моложе этого возраста и даже у ребенка.
Причины трещин на стопах состоят в нарушении гидролипидного баланса кожи, снижении выработки коллагена, эластина, уменьшении защитной жировой прослойки. Внешне это проявляется в сухости, утолщении, потере эластичности, упругости. Каждый день стопы испытывают огромное давление, удерживая тело в положении стоя, контролируя баланс при ходьбе или беге. При такой нагрузке кожа неизбежно растягивается, расширяется. Если она будет сухой, утратит эластичность, то вероятность разрыва при растяжении под весом тела повысится.
- ношение тесной обуви;
- грибковые инфекции, дерматиты;
- деформации стопы, плоскостопие, пяточная шпора;
- неправильная гигиена, недостаточное увлажнение или питание;
- контакт кожи с сухим, жарким воздухом, солёной морской или хлорированной водой в бассейне, ультрафиолетовыми лучами;
- неправильное питание, приводящее к дефициту важных для здоровья кожи витаминов A, E, группы B, микроэлементов;
- эндокринные расстройства, включающие болезни щитовидной железы, сахарный диабет;
- нарушения обмена веществ;
- избыточный вес, подвергающий кожу подошвенной части стопы чрезмерному давлению, растяжению;
- проблемы с кровообращением в нижних конечностях, провоцирующие недостаток питания тканей;
- ходьба босиком по жесткой поверхности (песок, камни, асфальт).
Трещины на ступнях – это следствие сухой и утолщенной кожи или по-другому кератоза. Кератоз развивается, когда ороговевшие или отмершие клетки верхнего слоя кожи не успевают отшелушиваться, наслаиваются друг на друга. В тяжелых случаях пласт утолщенной кожи составляет 1 – 2 см.
Какие симптомы трещин на стопах и на пятках?
Кроме очевидного симптома – больших щелей, окруженных толстым слоем сухой, потрескавшейся, шелушащейся кожи, трещины на ступнях ног вызывают боль при ходьбе. Боль локализуется в области повреждения, имеет жгучий характер, усиливается при надавливании. Некоторые испытывают психологический дискомфорт, так как такие ранки, особенно если их много, портят вид стоп.
Трещины на пятках отличаются по глубине, длине. Бывают единичными или множественными, на одной пятке или одновременно на обоих. Обычно все начинается с появления сухости, отвердения, утолщения кожи по краю пятки. Такие участки выглядят как мозоль, по цвету желтые, темно-коричневые или серо-белые. Вначале видны небольшие трещинки. Но если их не лечить и дальше нагружать пятку, они будут углубляться, начинают кровоточить.
При болезнях, приводящих к снижению притока крови к стопам, высок риск инфекционных осложнений, воспаления, формирования долго незаживающих язв.
Как лечить трещины на ступнях?
- выяснение причины появления трещин на стопах ног;
- правильный уход;
- подбор смягчающих, питательных мазей, кремов для стоп от трещин;
- ванночки для ног, парафинотерапию;
- кератолитические средства для удаления омертвевшей кожи;
- аппаратный педикюр.
Часто трещины на стопах – это результат неполадок внутри организма. Например, эндокринных, сосудистых или нервных нарушений, недостатка витаминов, минералов. Важно установить и по возможности устранить причины трещин на ступнях ног вначале лечения. Это облегчит восстановление здоровой структуры кожи, поможет предупредить формирование новых разрывов в будущем. Если трещины на стопах появляются регулярно, нужно проверить состояние здоровья.
Одно из основных лечений – аппаратный педикюр.
- без травм удалит ороговевшие участки;
- истончит жесткие края трещин;
- ускорит регенерацию тканей;
- сделает кожу мягче, эластичнее.
Рекомендуется выполнять процедуру регулярно, раз в 3 – 4 недели.
Для лечения трещин на стопах и подошвах ног как вспомогательные средства используют парафинотерапию, ванночки для ног. Парафин создает на поверхности кожи пленку, которая обеспечивает защиту, увлажнение. Ванночки способствуют размягчению загрубелой кожи, но возможность их применения и состав надо обсудить с врачом, так как не всегда они разрешены.
Для ухода за кожей несколько раз в день наносят питательные, увлажняющие, лечебные кремы от трещин в ступнях. Отзывы о таких средствах разных фирм есть в интернете, но выбирать их нужно по совету врача. В сложных случаях рекомендуют купить мази и кремы от трещин в ступнях с заживляющим, противовоспалительным, антисептическим, регенерирующим действием. При инфекции применяют антибактериальную или противогрибковую терапию в зависимости от типа возбудителя.
При слишком толстом слое грубой, сухой кожи, распространяющейся на большие участки стопы, применяют средства с ретиноидами, кератолитиками. Они удаляют омертвевшие частицы кожи, ускоряют ее обновление.
- мочевина;
- салициловая, молочная кислота;
- альфа-гидроксикислоты;
- фруктовые кислоты.
При глубоких трещинах нужно временно ограничить ходьбу, занятия спортом, чтобы уменьшить давление, трение, которое оказывается на травмированный участок. Если ограничить физическую активность не получается, используют ортезы, супинаторы, стельки или пластыри. Они помогают перераспределить нагрузку, защитить проблемную зону.
Как предупредить?
Если у вас сухие стопы вероятность трещин высока, поэтому позаботьтесь об их профилактике.
- раз в месяц посещать подолога для аппаратной обработки кожи стоп, удаления потенциально опасных зон – утолщений, натоптышей, мозолей, на которых формируются разрывы;
- позаботиться о полноценном рационе с достаточным содержанием витаминов, минералов;
- ежедневно после мытья ног перед сном наносить на кожу стоп увлажняющие, питательные кремы;
- регулярно делать массаж стоп для улучшения кровообращения, обменных процессов;
- контролировать вес;
- использовать специальные стельки, супинаторы, ортопедическую обувь, если есть плоскостопие или другие деформации стопы;
- периодически обрабатывать стопы пемзой с мелким абразивом для удаления отмерших клеток.
При появлении трещин не стоит пытаться устранить их самостоятельно, так как это может ухудшить ситуацию, привести к осложнениям. Здесь важен грамотный подход, который включает не только лечение трещин на ступнях, но и анализ возможных причин, рекомендации по профилактике рецидива. Если вы столкнулись с такой проблемой, обратитесь к подологу. Это специалист узкого профиля, который занимается лечением болезней ногтей и кожи стоп.
Центр Подологии Евы Корнеевой занимается лечением грибка на ногах, удалением вросшего ногтя, мозолей, натоптышей, обработкой диабетической стопы и медицинским педикюром в г. Москва.
Читайте также:

