Лепра поражение кожи при лепре
Обновлено: 03.05.2024
ФГБУ «Научно-исследовательский институт по изучению лепры» Минздрава России, Астрахань, Россия, 414057
ФГБУ «Научно-исследовательский институт по изучению лепры» Минздрава России, Астрахань, Россия, 414057
ФГУ Научно-исследовательский институт по изучению лепры Министерства здравоохранения и социального развития Российской Федерации, Астрахань
Научно-исследовательский институт по изучению лепры, Астрахань
Случай семейной лепры
Журнал: Клиническая дерматология и венерология. 2018;17(5): 47‑52
ФГБУ «Научно-исследовательский институт по изучению лепры» Минздрава России, Астрахань, Россия, 414057
РЕЗЮМЕ Несмотря на спорадический характер заболеваемости лепрой в России, появление новых случаев может быть связано не только с увеличением потока мигрантов из высоко эндемичных по лепре стран, но и с развитием болезни у лиц, имеющих длительный контакт с больными лепрой. Вероятность заболевания лепрой находится в прямой зависимости от длительности и близости контакта с источником болезни. По сравнению с общей популяцией у лиц, длительно проживающих совместно с больными лепрой, риск заражения выше. Среди членов семей больных лепрой чаще заболевают кровные родственники. Описано клиническое наблюдение развития лепроматозной лепры у пациентки, имеющей родителей, больных лепрой. При проведении бактериоскопического и гистологического исследований у пациентки обнаружены кислотоустойчивые микобактерии в биоптате и скарификатах кожи (БИН=3,67). Идентификацию Mycobacterium leprae проводили методом полимеразной цепной реакции (ПЦР) с гибридизацией на основе DNA-STRIP технологии с использованием праймеров GenoType Leprae DR («Hain Lifescience», Германия). Во всех образцах были идентифицированы M. leprae, чувствительные к основным противолепрозным препаратам (рифампицин, офлоксацин, дапсон). При серологическом исследовании сыворотки крови методом ИФА на наличие антител классов IgM, IgG к специфическому антигену M. leprae (DIS-BSA) было обнаружено значительное превышение оптической плотности антител как класса IgM, так и класса IgG. Кроме того, при HLA-генотипировании у больной, так же, как и у ее матери, выявлен гаплотип HLA-DRB1-*15-DQA1-*0102- DQB1-*0602/08, ранее определенный как маркер предрасположенности к лепре в русской популяции. Таким образом, внедрение при обследовании больных лепрой и контактных лиц, помимо стандартных бактериоскопических и гистологических методов, молекулярно-генетических, серологических и иммуногенетических, позволяет подтвердить диагноз лепры на ранних сроках заболевания.
ФГБУ «Научно-исследовательский институт по изучению лепры» Минздрава России, Астрахань, Россия, 414057
ФГБУ «Научно-исследовательский институт по изучению лепры» Минздрава России, Астрахань, Россия, 414057
ФГУ Научно-исследовательский институт по изучению лепры Министерства здравоохранения и социального развития Российской Федерации, Астрахань
Научно-исследовательский институт по изучению лепры, Астрахань
Лепра — генерализованное хроническое инфекционное заболевание человека, поражающее кожу, слизистые оболочки, нервную систему и внутренние органы; возбудителем является Mycobacterium leprae, открытая Хансеном в 1874 г. [1]. Несмотря на давность открытия возбудителя, патогенез заболевания до конца не выяснен. Это в первую очередь связано с уникальными особенностями лепры, к числу которых относятся длительный инкубационный период, невозможность культивирования возбудителя на искусственных питательных средах, трудности экспериментального моделирования на животных [2]. По данным ВОЗ, при ежегодном выявлении в мире более 200 тыс. новых случаев заболевания лепрой около 2 млн больных имеют инвалидизирующие осложнения даже на фоне комбинированной лекарственной терапии (MDT) [3].
Несмотря на то что лепру считают «малоконтагиозной» инфекцией, вероятность заболевания находится в прямой зависимости от длительности и характера контакта, интенсивность передачи возбудителя (инфицированность) намного превышает уровень клинической заболеваемости [4]. Это объясняется высокой степенью резистентности населения к лепрозной инфекции. По сравнению с общей популяцией, у лиц, длительно проживающих совместно с больными лепрой, в зависимости от типа заболевания риск заражения гораздо выше [5, 6]. В настоящее время общепризнано, что среди членов семей больных лепрой чаще заболевают кровные родственники [7]. Однако при лепре в условиях спорадической заболеваемости, длительного инкубационного периода, при наличии субклинических, стертых и малобактериальных формах сложно проследить родословную семейной заболеваемости. До момента заболевания детей многие родители умирают, поэтому обследовать ядерные семьи (включающие родителей и их детей) при лепре проблематично [8]. Кроме того, сложность в постановке диагноза заключается в том, что в клинической практике диагноз ставится на оценке кожных проявлений, положительном бактериоскопическом индексе (БИН), основанном на подсчете микобактерий при окраске мазка по Цилю—Нильсену, и гистологическом исследовании образцов кожи. Однако чувствительность стандартных методов (в частности бактериоскопии) невелика. Возможности современных молекулярно-генетических методов позволяют идентифицировать ДНК возбудителя заболевания в клинических образцах с высокой степенью чувствительности и специфичности и в короткие сроки.
Ниже представлено клиническое наблюдение развития заболевания лепрой у больной, имеющий длительный семейный контакт (рис. 1, 2). Рис. 2. Пациентка Р. Лепроматозная лепра (вид сзади). Рис. 1. Пациентка Р. Лепроматозная лепра (вид спереди).
Больная Р., 1967 г. р., жительница Астрахани, обратилась в клинику НИИЛ в сентябре 2015 г., заподозрив у себя лепру. Больной себя считает с января 2015 г., когда впервые заметила в области нижней части спины изменения на коже в виде отдельных пятен бледно-красного цвета. В марте 2015 г. появились онемение, покалывание и ощущение ползания «мурашек» в области рук и ног, изменения на коже прогрессировали — увеличилось их количество и размеры, появились пятна на конечностях, животе, изменился цвет элементов (красная окраска стала более насыщенной). В июле 2015 г. с вышеописанными жалобами больная обратилась в городскую поликлинику по месту жительства. Была осмотрена врачами-специалистами, однако диагноз лепры установлен не был.
Учитывая отсутствие положительной динамики от лечения, самостоятельно обратилась в НИИЛ в связи с тем, что ее родители были больными лепроматозной лепрой, однако они были переведены на амбулаторное лечение еще до ее рождения. Больная была осмотрена врачом-дерматовенерологом и 23.09.15 госпитализирована в клиническое отделение НИИЛ. При поступлении на коже груди и живота имелись поверхностные инфильтраты без четких границ, местами сливающиеся между собой, красноватого цвета. В поясничном отделе инфильтрация красновато-синюшного цвета с переходом на ягодицы. На правой ягодице отмечались лепромы диаметром до 0,3—0,5 см, эластичной консистенции. На кистях и стопах поверхностная инфильтрация красновато-синюшного цвета, сухость и шелушение ладоней и подошв. Разреженность бровей. Неврологический статус: пациентка хорошо дифференцирует разницу между болевой и тактильной чувствительностью (за исключением дистальных отделов, где дифференциация нарушена, в результате чего дает путаные ответы при повторении раздражения). На нижних конечностях от колена до стопы участки гипестезии чередуются с участками полной потери чувствительности. На верхних конечностях в области предплечья и кисти участки гипестезии преимущественно на разгибательных поверхностях. На некоторых элементах, характеризующих поражение кожного покрова (область спины, груди, правого предплечья), отмечается гипестезия (снижение болевой чувствительности). Нейротрофических язв нет.
У пациентки взяты соскобы со слизистой носа, биопсии и скарификаты кожи для проведения бактериоскопического, гистологического исследований и постановки полимеразно-цепной реакции (ПЦР). При бактериоскопическом исследовании в соскобе со слизистой поверхности носа микобактерии лепры не обнаружены, а во всех скарификатах кожи обнаружены гомогенные и зернистые микобактерии лепры (БИН=3,67).
Заключение патолого-морфологического исследования биоптатов кожи из лепром с левого бедра и правой ягодицы: фрагменты кожи с участками атрофии эпидермиса, умеренно выраженный кератоз. В толще дермы и вокруг придатков кожи в большом количестве периваскулярные, периневральные инфильтраты из эпителиоидных лимфоидных клеток и гистиоцитов, образующие гранулемы, отдельные из которых с некрозом в центре. Очаги склероза. При окраске по Цилю−Нильсену в инфильтратах обнаружено большое количество кислотоустойчивых палочковидных микобактерий в виде групп из 5—7 микобактерий.
Молекулярно-генетическую идентификацию микобактерий проводили методом ПЦР с дальнейшей гибридизацией с использованием праймеров набора GenoType Leprae DR («HainLifescience», Германия). Метод основан на DNA-STRIP технологии и позволяет идентифицировать M. leprae и ее устойчивость к основным противолепрозным препаратам (рифампицину, офлоксацину, дапсону). Определение устойчивости к рифампицину обеспечивается выявлением наиболее значимых мутаций гена rpoB, кодирующего β-субъединицу РНК-полимеразы. Определение устойчивости к офлоксацину или другим фторхинолонам обеспечивается обнаружением наиболее значимой мутации в гене gyrA, кодирующем α-субъединицу ДНК-гиразы. Для исследования устойчивости к дапсону изучалась соответствующая область гена folP1, кодирующая синтез дигидроптеората. Амплификацию проводили в термоциклере Терцик (ООО «НПО ДНК-Технология», Россия). Гибридизацию ДНК выполняли на автоматическом приборе GT-Blot-48 («HainLifescience», Германия). Учет результатов осуществляли визуально с помощью прилагаемого к каждому набору шаблона и в автоматическом сканирующем устройстве GenoScan («HainLifescience», Германия), принцип работы которого заключается в автоматическом анализе параметров сканированных стрипов. При молекулярно-генетическом исследовании во всех стрипах были обнаружены M. leprae, чувствительные ко всем трем антимикобактериальным препаратам.
Кроме того, у больной было проведено серологическое исследование сыворотки крови методом ИФА на наличие антител классов IgM, IgG к специфическому антигену M. leprae – DIS-BSA. Была значительно превышена оптическая плотность (ОП) антител класса IgM — 1,15 при норме 0,20±0,05. ОП антител класса IgG составила 0,66 (норма 0,25±0,05). Учитывая тот факт, что пациентка происходит из семьи больных лепрой, и у матери ранее было проведено иммуногенетическое исследование и определен HLA-гаплотип, у больной была взята кровь для HLA-генотипирования по 14 группам аллелей гена DRB1, 8 аллелям гена DQA1 и 12 аллелям гена DQB1. У больной был установлен такой же, как и у матери, гаплотип HLA-DRB1-*15-DQA1-*0102-DQB1-*0602/8, ранее выявленный как маркер предрасположенности к лепре в русской популяции [9].
Таким образом, применение различных методов исследования, как стандартных (бактериоскопического и гистологического), так и молекулярно-генетических (ПЦР с дальнейшей гибридизацией, HLA-генотипирование) и серологических с учетом данных анамнеза и клинической картины, позволило установить диагноз: «Лепра, лепроматозный тип, активная стадия. cопутствующий диагноз: нейропатия локтевого и срединного нервов с двух сторон с чувствительными нарушениями».
С 29.09.15 больная получает комбинированную противолепрозную терапию (дапсон 100 мг 2 таблетки ежедневно, рифампицин 4 таблетки по 150 мг 1 раз в месяц). Лечение получает в полном объеме, переносит удовлетворительно, побочных эффектов на данные лекарственные препараты не выявлено. Также проводится комплексная метаболическая терапия, включающая нейропротекторы, гепатопротекторы и физиолечение, на фоне которых отмечается положительная клиническая и клинико-лабораторная динамика со стороны лепрозного процесса. В период лечения лепрозный процесс соответствует стационарной фазе, обострений не отмечалось. Изменения на коже регрессируют. Отмечается снижение БИН до 0,53. При бактериоскопии скарификатов кожи единичные гомогенные M. leprae и зернистые формы обнаруживаются только на двух участках, что также подтверждено результатами ПЦР-анализа. Кроме того, отмечается отчетливая положительная динамика в уровне специфических антимикобактериальных антител класса IgМ до ОП=0,43, что свидетельствует об эффективности терапии. Однако сохраняющаяся серопозитивность, положительный БИН и обнаружение единичных M. leprae не позволяют утверждать о наступлении клинико-лабораторного регресса заболевания. На данный момент больная продолжает получать специфическую противолепрозную терапию, симптоматическую терапию (коррекция АД), курсы гепатопротекторов (гептрал, хофитол, резалют), нейропротекторов (цитофлавин, тиолипон), а также физиотерапию — скенар-терапию на область голени, магнитотерапию и лазеротерапию на область нижних конечностей, амплипульс-терапию, УЗ-терапию на поясничную область.
Эпидемиология лепры характеризуется неоднородностью в восприимчивости к заболеванию, в том числе и среди лиц семейного контакта. В основе такой гетерогенности могут лежать разные механизмы. В большом эпидемиологическом исследовании, проведенном в Бангладеш, описаны до шести таких механизмов [10], основными из которых в разной ассоциации являются бытовые контакты и генетический фактор. Бытовые контакты подразумевают длительность контакта и тип лепры больного члена семьи. Кроме того, к ним можно отнести и такой общий фактор, особенно характерный для высоко эндемичных по лепре стран, как бедность [11]. К генетическим факторам относится индивидуальная наследственная предрасположенность. Так, в семьях больных лепрой даже при условии максимального риска заражения заболеваемость не превышает 35% [12]. Исследования целого генома, проведенные во Вьетнаме и Бразилии, показали, что генетический механизм при лепре может быть двухступенчатым, т. е. восприимчивость к заболеванию и развитие типа лепры определяются группой аллелей генов на разных хромосомах [13, 14]. Восприимчивость к инфекционным заболеваниям, в первую очередь, ассоциирована с полиморфизмом генов иммунного ответа (HLA), в том числе и при лепре [15, 16]. В описанном нами клиническом случае мать больной была выписана на амбулаторное лечение в 1963 г. и, несмотря на то, что оставалась бактериоскопически негативной, на протяжении всего времени вплоть до своей смерти в 2014 г. лечилась по поводу трофических язв. Кроме того, нужно отметить, что при отрицательной бактериоскопии скарификатов с кожи и соскобов из носа у больной отмечались повышенные титры специфических антител. Так, уровень IgM периодически повышался до 0,65 ед. ОП, а IgG — до 0,88 ед. О.П. Ранее было показано, что у части больных лепрой, находящихся в стадии клинического регресса, трофические язвы колонизированы различными микобактериями, в том числе и M. leprae [17]. Кроме того, у матери сохранялась длительная серопозитивность. Все это свидетельствует о персистенции M. leprae в организме. Исходя из вышесказанного, можно предположить, что при длительном контакте с матерью, при наличии HLA-гаплотипа предрасположенности к развитию лепры и при возникновении различных провоцирующих факторов (стресс, заболевания, вредные привычки) у больной могла развиться лепра.
Заключение
Заболеваемость лепрой в России сведена до спорадического уровня, благодаря проводимым долгие годы планомерным противоэпидемическим мероприятиям. Встречающиеся в настоящее время новые случаи заболевания в своем большинстве выявляются в семьях больных лепрой. Следует отметить, несмотря на то, что инкубационный период при лепре лишен четко определенных сроков, считается, что он может длиться от нескольких месяцев до 20 лет и более. Какова длительность инкубационного периода в описанном нами случае, трудно сказать, так как у больной был не кратковременный контакт с инфектом, а длительный, практически на протяжении всей жизни. Выявленный ранее в НИИЛ в 2009 г. больной М., 58 лет, также был из семьи больных лепрой, находящихся длительное время на амбулаторном лечении. Все это диктует необходимость при обследовании амбулаторных больных и контактных лиц, помимо стандартных бактериоскопических и гистологических методов исследования включать серологические и иммуногенетические. А внедрение таких молекулярно-генетических методов как ПЦР позволяет подтвердить диагноз лепры на самых ранних сроках заболевания.
Сведения об авторах
V.Z. Naumov — Academic Secretary, Candidate of Medical Science Leprosy Research Institute, Astrakhan, Russia.
Сбор и обработка материала — Л.В. Сароянц, В.В. Дуйко, К.Ш. Арнаудова
Написание текста – Л.В. Сароянц, К.Ш. Арнаудова
Редактирование — В.З. Наумов, Л.В. Сароянц
Collecting and interpreting the data — L.V. Saroyants, K.Sh. Arnaudova, V.V. Duiko
Drafting the manuscript — L.V. Saroyants, K.Sh. Arnaudova
Revising the manuscript — L.V. Saroyants, V.Z. Naumov

Лепра – хроническая инфекция, обычно вызываемая кислотоустойчивой бациллой Mycobacterium leprae, которая обладает уникальным тропизмом к периферическим нервам, коже и слизистым оболочкам верхних респираторных путей. Симптомов много и они включают анестезирующие полиморфные поражения кожи и периферическую невропатию. Диагноз является клиническим и подтверждается биопсией. Лечение, как правило, проводят дапсоном в сочетании с другими противомикобактериальными препаратами. После начала терапии пациенты быстро становятся неконтагиозными.
До 2008 года M. leprae был единственным известным возбудителем лепры, пока в Мексике не был выявлен второй вид, M. lepromatosis.
Несмотря на то, что лепра не является очень контагиозной, редко вызывает смерть и может эффективно лечиться антибиотиками, она продолжает оставаться серьезным социальным клеймом. Вероятно, остается определенное непонимание этиологии болезни, потому что лепра была неизлечима до появления эффективных антибиотиков в 1940 году. Люди с этим заболеванием выглядели изуродованными и часто имели значительные признаки инвалидности, вызывая страх и стремление избежать с ними контактов со стороны других людей. Из-за этой социальной стигматизации психологическое воздействие лепры часто является значительным.
Эпидемиология проказы
Лепра может развиться в любом возрасте, но проявляется чаще всего у людей в возрасте 5–15 лет или > 30 лет.
Ссылки на эпидемиологию
Патофизиология проказы
Люди – это главный естественный резервуар M. leprae. Армадил (броненосец) – единственный подтвержденный источник, кроме людей, хотя могут быть и другие животные и источники окружающей среды.
Считается, что лепра распространяется от человека к человеку воздушно-капельным путем. Случайный контакт (например, просто касание кого-то с данной болезнью) или краткосрочный контакт, как правило, не опасен. Приблизительно половина людей, больных проказой, заразились непосредственно через близкий, длительный контакт с зараженным человеком. Даже после контакта с бактериями большинство людей не заболевают проказой; работники системы здравоохранения, работающие много лет с больными, у которых есть проказа, не заболевают. У большинства (95%) иммунокомпетентных людей, которые заражены M. leprae, из-за эффективного иммунитета проказа не развиваются. У людей, которые все-таки заболевают проказой, вероятно, есть определенная неблагоприятная генетическая склонность.
Бациллы M. leprae растут медленно (количество удваивается через 2 недели). Инкубационный период колеблется от 6 месяцев до 10 лет. При прогрессировании инфекции происходит ее гематогенное распространение.
Классификация
Лепра может быть классифицирована по типу и числу пораженных областей кожи:
Олигобациллярность: ≤ 5 поражений кожи без выявления бактерий на образцах, взятых из этих областей
Мультибациллярность: ≥ 6 поражений кожи, бактерии выявляются на образцах поражений кожи
Лепра может также быть классифицирована по клеточному ответу и клиническим результатам:
У людей с туберкулоидной лепрой, как правило, отмечается сильный опосредованный клеткой ответ, который ограничивает болезнь несколькими поражениями кожи (олигобациллярность), и болезнь является более умеренной, менее распространенной и менее заразной. Пациенты лепроматозной или пограничной лепрой обычно имеют слабый клеточный иммунитет к M. leprae, и у них развивается более тяжелая системная инфекция с широко распространенным бактериальным проникновением в кожу, нервы и другие органы (например, нос, яички, почки). У таких людей больше (мультибациллярность) поражений кожи, и болезнь является более заразной.
В обеих классификациях тип проказы определяет:
Симптомы и признаки проказы
Симптомы лепры обычно не проявляются до > 1 года после заражения (в среднем 5–7 лет). Как только симптомы начинают проявляться, они медленно прогрессируют.
Лепра поражает главным образом кожу и периферические нервы. Поражение нерва вызывает нечувствительность и слабость в тех областях, которые контролируются пораженными нервами.
Туберкулоидная лепра:поражения кожи состоят из одного или нескольких неэстетичных пятен с яркой пигментацией по центру и с острыми приподнятыми границами. Сыпь, как и при всех формах лепры, не вызывает зуда. Участки, пораженные этой сыпью, являются нечувствительными из-за поражения основных периферических нервов, которые могут быть осязаемо увеличенными.
Лепроматозная лепра: большая часть кожи и многие области тела, включая почки, нос и яички, могут быть поражены. У пациентов на коже расположены пятна, папулы, узелки или бляшки, которые часто бывают симметричными. Периферическая невропатия более тяжелая, чем при туберкулоидной лепре, с большим количеством областей без чувствительности; определенные группы мышц могут быть слабыми. Пациенты могут заболеть гинекомастией или потерять ресницы и брови.
Пограничная лепра: имеются особенности и туберкулоидной, и лепроматозной лепры. Без лечения пограничная лепра может стать менее тяжелой и больше похожей на туберкулоидную форму или может ухудшиться и стать похожей на лепроматозную форму.
Осложнения
Самые тяжелые осложнения являются следствием периферической невропатии, которая вызывает ухудшение осязания и неспособность чувствовать боль и температуру. Пациенты могут, не осознавая этого, обжечься, порезаться или причинить себе вред. Повторное повреждение может привести к потере пальцев. Слабость мышц может привести к уродствам (например, захват 4-ми и 5-ми пальцами, что вызвано поражением локтевого нерва, отвислая стопа ноги, что вызвано поражением малоберцового нерва).
Папулы и узелки могут особенно уродливо выглядеть на лице.
Другие области тела, которые могут быть поражены:
Ноги: язвы подошв ног с вторичной инфекцией – причина сильных болей при ходьбе.
Нос: повреждение слизистой оболочки носа может привести к хронической заложенности носа и кровотечениям из носа и, если не лечить, к эрозии и провалу носовой перегородки.
Половая функция: у мужчин с лепроматозной лепрой могут быть проблемы с эрекцией и бесплодие. Инфекция может уменьшить выработку тестостерона и выработку спермы яичками.
Реакции иммунной системы при проказе
В процессе развития нелечённой или даже лечённой лепры иммунная система может вырабатывать воспалительные реакции. Существует 2 типа.
Реакции типа 1 связаны с непосредственным усилением клеточного иммунитета. Эти реакции могут вызвать лихорадку и воспаление существующих ранее поражений кожи и периферических нервов, что приводит к отеку кожи, эритеме и болезненности и ухудшает функцию нерва. Эти реакции, особенно если нет лечения на раннем этапе, значительно способствуют поражению нервов. Поскольку иммунная реакция усилена, эти реакции называют обратными реакциями, несмотря на очевидное клиническое ухудшение.
Реакции типа 2 (эритема nodosum leprosum) являются системными воспалительными реакциями, которые напоминают васкулит или панникулит и, вероятно, включают отложение циркулирующих иммунных комплексов или увеличенную функцию клеток T-хелперов. Они стали менее распространенными, т.к. клофазимин был добавлен к схеме приема препарата. У пациентов могут появиться эритематозные и болезненные папулы или узелки, которые переходят в пустулы и язвочки и вызывают лихорадку, неврит, лимфаденит, орхит, артрит (особенно в больших суставах, обычно коленных) и гломерулонефрит. Гемолиз или подавление костного мозга может вызвать анемию, а воспаление печени может вызвать легкие отклонения в анализах функции печени.
Диагностика лепры
Микроскопическое исследование образцов биопсии кожи
В США диагноз проказы часто несвоевременный из-за того, что врачи незнакомы с клиническими проявлениями.
Диагноз проказы устанавливается на основании наличия поражений кожи и периферической невропатии и подтверждается микроскопированием биоптата. Mycobacterium leprae и M. lepromatosis не растут на искусственной культуральной среде. Материалы биопсии должны быть взяты из переднего края туберкулоидных поражений или, в случае лепроматозной лепры, из узелков или бляшек.
Антитела сывороточного IgM к M. leprae являются специфическим показателем, но с низкой чувствительностью (есть только у двух третьих пациентов с туберкулоидной лепрой). Диагностическая ценность ограничена в эндемичных областях вследствие того, что такие антитела могут быть и при бессимптомной инфекции.
Лечение проказы
Долгосрочные, со множеством лекарств схемы, включающие дапсон, рифампин и иногда клофазимин
Иногда поддерживающие антибиотики в течение всей жизни
Антибиотики могут остановить развитие лепры, но не приводят к полному восстановлению пораженных нервов или уродств. Таким образом, раннее выявление и лечение жизненно важны.
Из-за резистентности к антибиотикам используются схемы с применением многих препаратов. Выбранные препараты зависят от типа проказы; мультибациллярная проказа требует более интенсивных режимов и более длительной продолжительности, чем олигобациллярная.
Консультацию по диагностике и лечению данного заболевания можно получить в Национальной программе по лепре в Батон-Руже (National Hansen’s Disease Program in Baton Rouge), Луизиана (1-800-642-2477) или Управлении здравоохранения и медицинского обслуживания США (US Health Resources and Services Administration) при HRSA. Стандартные схемы, рекомендуемые ВОЗ, несколько отличаются от используемых в США.
Мультибациллярность
Стандартные схемы, рекомендуемые по ВОЗ, включают дапсон, рифампин и клофазимин. ВОЗ предоставляет эти лекарства бесплатно всем больным лепрой во всем мире. Пациенты принимают рифампин 600 мг перорально и клофазимин 300 мг перорально 1 раз в месяц под наблюдением врача, и дапсон 100 мг перорально плюс клофазимин 50 мг перорально 1 раз/день без наблюдения. Эта схема лечения продолжается в течение 12 мес.
В США предлагается схема лечения, включающая рифампин 600 мг перорально 1 раз/день, дапсон 100 мг перорально 1 раз/день и клофазимин 50 мг перорально 1 раз/день в течение 24 мес.
Олигобациллярность
Стандартная схема, рекомендуемая ВОЗ, включает рифампин 600 мг перорально раз в месяц с наблюдением и дапсон 100 мг перорально 1 раз/день без наблюдения в течение 6 мес. Людям, у которых имеется только одиночное поражение кожи, дают перорально одноразовую дозу рифампина 600 мг, офлоксацина 400 мг и миноциклина 100 мг.
В США предлагается схема лечения, включающая рифампин 600 мг перорально 1 раз/день и дапсон 100 мг перорально 1 раз/день в течение 12 мес.
Препараты при лепре
Дапсон относительно недорог и в общем безопасен для использования. Нежелательные реакции включают гемолиз и анемию (которые являются обычно легкими) и аллергический дерматоз (который может быть тяжелым); редко проявляется синдром дапсона (эксфолиативный дерматит, высокая температура, соотношение белых клеток крови как при мононуклеозе).
Рифампицин является в первую очередь бактерицидным для M. leprae и даже более эффективным, чем дапсон. Однако, если давать его в рекомендуемой в США дозировке 600 мг перорально 1 раз/день, это слишком дорогостоящее лечение для многих развивающихся стран, но ВООЗ обеспечивает его бесплатно. Отрицательные воздействия включают гепатотоксичность, подобные гриппу синдромы и изредка тромбоцитопению и почечную недостаточность.
Клофазимин абсолютно безопасен. Основной нежелательной реакцией является обратимая пигментация кожи, но устранение изменения цвета может занять несколько месяцев. Клофазимин может быть получен только в США от Управление здравоохранения и медицинского обслуживания в качестве исследуемого нового препарата. Запросить дополнительную информацию или статус исследователя, чтобы иметь возможность использовать клофазимин, клиницисты могут обратиться в Национальную программу по болезни Хамсона (проказе) (National Hansen's Disease (Leprosy) Program)по телефону 1-800-642-2477 .
Реакции иммунной системы при проказе
Пациентам с реакциями 1-го типа (кроме незначительного воспаления кожи) изначально дают преднизон 40–60 мг перорально 1 раз/день, что сопровождается более низкими дозами (часто до 10–15 мг 1 раз/день) в течение нескольких месяцев. Незначительное воспаление кожи не требует лечения.
Первый и второй эпизоды эритемы nodosum leprosum, если они легкие, можно лечить аспирином или, при более выраженной форме, преднизоном 40–60 мг перорально 1 раз/день в течение недели плюс антибактериальные препараты. Для случаев рецидива – талидомид 100–300 мг перорально 1 раз/день – является предпочитаемым препаратом (в США доступен через Национальную программу по лепре). Однако из-за его тератогенности талидомид нельзя давать женщинам, которые могут забеременеть. Отрицательные воздействия – умеренный запор, умеренная лейкопения и седативный эффект.
Профилактика проказы
Поскольку лепра не является очень контагиозной, то риск ее распространения низок. Только невылеченная лепроматозная форма является контагиозной, но даже и тогда инфекция не распространяется легко. Тем не менее, при развитии симптомов и признаков лепры должны контролироваться бытовые контакты (особенно с детьми) больных лепрой. Как только лечение началось, больной лепрой не может быть источником распространения болезни.
Лучшей профилактикой является
Избегание контактов с жидкостями человеческого организма и сыпью зараженных людей
Вакцина БЦЖ, используемая для профилактики туберкулеза, обеспечивает определенную защиту против лепры, но с этой целью используется редко. Химиопрофилактика не играет никакой роли.
Основные положения
Лепра является хроническим инфекционным заболеванием и, как правило, вызывается кислото-устойчивыми бациллами Mycobacterium leprae.
Лепра не является очень контагиозной у пациентов, не проходивших лечение, и совсем не контагиозна после начала лечения.
Лепра поражает главным образом кожу и периферические нервы.
Наиболее тяжелые осложнения связаны с потерей чувств осязания, боли и температуры; мышечная слабость, которая может привести к деформации; и уродующие поражения кожи и слизистой оболочки носа.
Могут возникнуть воспалительные реакции, называемые лепрозными реакциями и требующими лечения кортикостероидами.
Диагностика основывается на результатах биопсии; М. leprae или M. lepromatosis не растут на питательных средах.
Лечение зависит от формы лепры, но включает в себя схемы комбинированного лекарственного лечения, обычно использующие дапсон, рифампин и клофазимин для полибактерий и дапсон и рифампицин для олигобацилл.

Лепра – хроническая инфекция, обычно вызываемая кислотоустойчивой бациллой Mycobacterium leprae, которая обладает уникальным тропизмом к периферическим нервам, коже и слизистым оболочкам верхних респираторных путей. Симптомов много и они включают анестезирующие полиморфные поражения кожи и периферическую невропатию. Диагноз является клиническим и подтверждается биопсией. Лечение, как правило, проводят дапсоном в сочетании с другими противомикобактериальными препаратами. После начала терапии пациенты быстро становятся неконтагиозными.
До 2008 года M. leprae был единственным известным возбудителем лепры, пока в Мексике не был выявлен второй вид, M. lepromatosis.
Несмотря на то, что лепра не является очень контагиозной, редко вызывает смерть и может эффективно лечиться антибиотиками, она продолжает оставаться серьезным социальным клеймом. Вероятно, остается определенное непонимание этиологии болезни, потому что лепра была неизлечима до появления эффективных антибиотиков в 1940 году. Люди с этим заболеванием выглядели изуродованными и часто имели значительные признаки инвалидности, вызывая страх и стремление избежать с ними контактов со стороны других людей. Из-за этой социальной стигматизации психологическое воздействие лепры часто является значительным.
Эпидемиология проказы
Лепра может развиться в любом возрасте, но проявляется чаще всего у людей в возрасте 5–15 лет или > 30 лет.
Ссылки на эпидемиологию
Патофизиология проказы
Люди – это главный естественный резервуар M. leprae. Армадил (броненосец) – единственный подтвержденный источник, кроме людей, хотя могут быть и другие животные и источники окружающей среды.
Считается, что лепра распространяется от человека к человеку воздушно-капельным путем. Случайный контакт (например, просто касание кого-то с данной болезнью) или краткосрочный контакт, как правило, не опасен. Приблизительно половина людей, больных проказой, заразились непосредственно через близкий, длительный контакт с зараженным человеком. Даже после контакта с бактериями большинство людей не заболевают проказой; работники системы здравоохранения, работающие много лет с больными, у которых есть проказа, не заболевают. У большинства (95%) иммунокомпетентных людей, которые заражены M. leprae, из-за эффективного иммунитета проказа не развиваются. У людей, которые все-таки заболевают проказой, вероятно, есть определенная неблагоприятная генетическая склонность.
Бациллы M. leprae растут медленно (количество удваивается через 2 недели). Инкубационный период колеблется от 6 месяцев до 10 лет. При прогрессировании инфекции происходит ее гематогенное распространение.
Классификация
Лепра может быть классифицирована по типу и числу пораженных областей кожи:
Олигобациллярность: ≤ 5 поражений кожи без выявления бактерий на образцах, взятых из этих областей
Мультибациллярность: ≥ 6 поражений кожи, бактерии выявляются на образцах поражений кожи
Лепра может также быть классифицирована по клеточному ответу и клиническим результатам:
У людей с туберкулоидной лепрой, как правило, отмечается сильный опосредованный клеткой ответ, который ограничивает болезнь несколькими поражениями кожи (олигобациллярность), и болезнь является более умеренной, менее распространенной и менее заразной. Пациенты лепроматозной или пограничной лепрой обычно имеют слабый клеточный иммунитет к M. leprae, и у них развивается более тяжелая системная инфекция с широко распространенным бактериальным проникновением в кожу, нервы и другие органы (например, нос, яички, почки). У таких людей больше (мультибациллярность) поражений кожи, и болезнь является более заразной.
В обеих классификациях тип проказы определяет:
Симптомы и признаки проказы
Симптомы лепры обычно не проявляются до > 1 года после заражения (в среднем 5–7 лет). Как только симптомы начинают проявляться, они медленно прогрессируют.
Лепра поражает главным образом кожу и периферические нервы. Поражение нерва вызывает нечувствительность и слабость в тех областях, которые контролируются пораженными нервами.
Туберкулоидная лепра:поражения кожи состоят из одного или нескольких неэстетичных пятен с яркой пигментацией по центру и с острыми приподнятыми границами. Сыпь, как и при всех формах лепры, не вызывает зуда. Участки, пораженные этой сыпью, являются нечувствительными из-за поражения основных периферических нервов, которые могут быть осязаемо увеличенными.
Лепроматозная лепра: большая часть кожи и многие области тела, включая почки, нос и яички, могут быть поражены. У пациентов на коже расположены пятна, папулы, узелки или бляшки, которые часто бывают симметричными. Периферическая невропатия более тяжелая, чем при туберкулоидной лепре, с большим количеством областей без чувствительности; определенные группы мышц могут быть слабыми. Пациенты могут заболеть гинекомастией или потерять ресницы и брови.
Пограничная лепра: имеются особенности и туберкулоидной, и лепроматозной лепры. Без лечения пограничная лепра может стать менее тяжелой и больше похожей на туберкулоидную форму или может ухудшиться и стать похожей на лепроматозную форму.
Осложнения
Самые тяжелые осложнения являются следствием периферической невропатии, которая вызывает ухудшение осязания и неспособность чувствовать боль и температуру. Пациенты могут, не осознавая этого, обжечься, порезаться или причинить себе вред. Повторное повреждение может привести к потере пальцев. Слабость мышц может привести к уродствам (например, захват 4-ми и 5-ми пальцами, что вызвано поражением локтевого нерва, отвислая стопа ноги, что вызвано поражением малоберцового нерва).
Папулы и узелки могут особенно уродливо выглядеть на лице.
Другие области тела, которые могут быть поражены:
Ноги: язвы подошв ног с вторичной инфекцией – причина сильных болей при ходьбе.
Нос: повреждение слизистой оболочки носа может привести к хронической заложенности носа и кровотечениям из носа и, если не лечить, к эрозии и провалу носовой перегородки.
Половая функция: у мужчин с лепроматозной лепрой могут быть проблемы с эрекцией и бесплодие. Инфекция может уменьшить выработку тестостерона и выработку спермы яичками.
Реакции иммунной системы при проказе
В процессе развития нелечённой или даже лечённой лепры иммунная система может вырабатывать воспалительные реакции. Существует 2 типа.
Реакции типа 1 связаны с непосредственным усилением клеточного иммунитета. Эти реакции могут вызвать лихорадку и воспаление существующих ранее поражений кожи и периферических нервов, что приводит к отеку кожи, эритеме и болезненности и ухудшает функцию нерва. Эти реакции, особенно если нет лечения на раннем этапе, значительно способствуют поражению нервов. Поскольку иммунная реакция усилена, эти реакции называют обратными реакциями, несмотря на очевидное клиническое ухудшение.
Реакции типа 2 (эритема nodosum leprosum) являются системными воспалительными реакциями, которые напоминают васкулит или панникулит и, вероятно, включают отложение циркулирующих иммунных комплексов или увеличенную функцию клеток T-хелперов. Они стали менее распространенными, т.к. клофазимин был добавлен к схеме приема препарата. У пациентов могут появиться эритематозные и болезненные папулы или узелки, которые переходят в пустулы и язвочки и вызывают лихорадку, неврит, лимфаденит, орхит, артрит (особенно в больших суставах, обычно коленных) и гломерулонефрит. Гемолиз или подавление костного мозга может вызвать анемию, а воспаление печени может вызвать легкие отклонения в анализах функции печени.
Диагностика лепры
Микроскопическое исследование образцов биопсии кожи
В США диагноз проказы часто несвоевременный из-за того, что врачи незнакомы с клиническими проявлениями.
Диагноз проказы устанавливается на основании наличия поражений кожи и периферической невропатии и подтверждается микроскопированием биоптата. Mycobacterium leprae и M. lepromatosis не растут на искусственной культуральной среде. Материалы биопсии должны быть взяты из переднего края туберкулоидных поражений или, в случае лепроматозной лепры, из узелков или бляшек.
Антитела сывороточного IgM к M. leprae являются специфическим показателем, но с низкой чувствительностью (есть только у двух третьих пациентов с туберкулоидной лепрой). Диагностическая ценность ограничена в эндемичных областях вследствие того, что такие антитела могут быть и при бессимптомной инфекции.
Лечение проказы
Долгосрочные, со множеством лекарств схемы, включающие дапсон, рифампин и иногда клофазимин
Иногда поддерживающие антибиотики в течение всей жизни
Антибиотики могут остановить развитие лепры, но не приводят к полному восстановлению пораженных нервов или уродств. Таким образом, раннее выявление и лечение жизненно важны.
Из-за резистентности к антибиотикам используются схемы с применением многих препаратов. Выбранные препараты зависят от типа проказы; мультибациллярная проказа требует более интенсивных режимов и более длительной продолжительности, чем олигобациллярная.
Консультацию по диагностике и лечению данного заболевания можно получить в Национальной программе по лепре в Батон-Руже (National Hansen’s Disease Program in Baton Rouge), Луизиана (1-800-642-2477) или Управлении здравоохранения и медицинского обслуживания США (US Health Resources and Services Administration) при HRSA. Стандартные схемы, рекомендуемые ВОЗ, несколько отличаются от используемых в США.
Мультибациллярность
Стандартные схемы, рекомендуемые по ВОЗ, включают дапсон, рифампин и клофазимин. ВОЗ предоставляет эти лекарства бесплатно всем больным лепрой во всем мире. Пациенты принимают рифампин 600 мг перорально и клофазимин 300 мг перорально 1 раз в месяц под наблюдением врача, и дапсон 100 мг перорально плюс клофазимин 50 мг перорально 1 раз/день без наблюдения. Эта схема лечения продолжается в течение 12 мес.
В США предлагается схема лечения, включающая рифампин 600 мг перорально 1 раз/день, дапсон 100 мг перорально 1 раз/день и клофазимин 50 мг перорально 1 раз/день в течение 24 мес.
Олигобациллярность
Стандартная схема, рекомендуемая ВОЗ, включает рифампин 600 мг перорально раз в месяц с наблюдением и дапсон 100 мг перорально 1 раз/день без наблюдения в течение 6 мес. Людям, у которых имеется только одиночное поражение кожи, дают перорально одноразовую дозу рифампина 600 мг, офлоксацина 400 мг и миноциклина 100 мг.
В США предлагается схема лечения, включающая рифампин 600 мг перорально 1 раз/день и дапсон 100 мг перорально 1 раз/день в течение 12 мес.
Препараты при лепре
Дапсон относительно недорог и в общем безопасен для использования. Нежелательные реакции включают гемолиз и анемию (которые являются обычно легкими) и аллергический дерматоз (который может быть тяжелым); редко проявляется синдром дапсона (эксфолиативный дерматит, высокая температура, соотношение белых клеток крови как при мононуклеозе).
Рифампицин является в первую очередь бактерицидным для M. leprae и даже более эффективным, чем дапсон. Однако, если давать его в рекомендуемой в США дозировке 600 мг перорально 1 раз/день, это слишком дорогостоящее лечение для многих развивающихся стран, но ВООЗ обеспечивает его бесплатно. Отрицательные воздействия включают гепатотоксичность, подобные гриппу синдромы и изредка тромбоцитопению и почечную недостаточность.
Клофазимин абсолютно безопасен. Основной нежелательной реакцией является обратимая пигментация кожи, но устранение изменения цвета может занять несколько месяцев. Клофазимин может быть получен только в США от Управление здравоохранения и медицинского обслуживания в качестве исследуемого нового препарата. Запросить дополнительную информацию или статус исследователя, чтобы иметь возможность использовать клофазимин, клиницисты могут обратиться в Национальную программу по болезни Хамсона (проказе) (National Hansen's Disease (Leprosy) Program)по телефону 1-800-642-2477 .
Реакции иммунной системы при проказе
Пациентам с реакциями 1-го типа (кроме незначительного воспаления кожи) изначально дают преднизон 40–60 мг перорально 1 раз/день, что сопровождается более низкими дозами (часто до 10–15 мг 1 раз/день) в течение нескольких месяцев. Незначительное воспаление кожи не требует лечения.
Первый и второй эпизоды эритемы nodosum leprosum, если они легкие, можно лечить аспирином или, при более выраженной форме, преднизоном 40–60 мг перорально 1 раз/день в течение недели плюс антибактериальные препараты. Для случаев рецидива – талидомид 100–300 мг перорально 1 раз/день – является предпочитаемым препаратом (в США доступен через Национальную программу по лепре). Однако из-за его тератогенности талидомид нельзя давать женщинам, которые могут забеременеть. Отрицательные воздействия – умеренный запор, умеренная лейкопения и седативный эффект.
Профилактика проказы
Поскольку лепра не является очень контагиозной, то риск ее распространения низок. Только невылеченная лепроматозная форма является контагиозной, но даже и тогда инфекция не распространяется легко. Тем не менее, при развитии симптомов и признаков лепры должны контролироваться бытовые контакты (особенно с детьми) больных лепрой. Как только лечение началось, больной лепрой не может быть источником распространения болезни.
Лучшей профилактикой является
Избегание контактов с жидкостями человеческого организма и сыпью зараженных людей
Вакцина БЦЖ, используемая для профилактики туберкулеза, обеспечивает определенную защиту против лепры, но с этой целью используется редко. Химиопрофилактика не играет никакой роли.
Основные положения
Лепра является хроническим инфекционным заболеванием и, как правило, вызывается кислото-устойчивыми бациллами Mycobacterium leprae.
Лепра не является очень контагиозной у пациентов, не проходивших лечение, и совсем не контагиозна после начала лечения.
Лепра поражает главным образом кожу и периферические нервы.
Наиболее тяжелые осложнения связаны с потерей чувств осязания, боли и температуры; мышечная слабость, которая может привести к деформации; и уродующие поражения кожи и слизистой оболочки носа.
Могут возникнуть воспалительные реакции, называемые лепрозными реакциями и требующими лечения кортикостероидами.
Диагностика основывается на результатах биопсии; М. leprae или M. lepromatosis не растут на питательных средах.
Лечение зависит от формы лепры, но включает в себя схемы комбинированного лекарственного лечения, обычно использующие дапсон, рифампин и клофазимин для полибактерий и дапсон и рифампицин для олигобацилл.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Лепра: причины появления, симптомы, диагностика и способы лечения.
Определение
Лепра, более известная как проказа, – хроническое инфекционное заболевание, являющееся одним из видов гранулематоза и вызываемое кислотоустойчивой палочковидной бациллой Mycobacterium leprae или Mycobacterium lepromatosis.
Болезнь поражает в основном кожный покров, периферические нервы, слизистую оболочку верхних дыхательных путей и органы зрения.
Лепра известна с давних пор и упоминается в письменных источниках древних цивилизаций Египта, Индии и Китая. В древних рукописях говорилось, что больные лепрой часто подвергались гонениям.
Проказа, из-за которой у людей западают носы, выпадают брови и деформируются пальцы, кажется сегодня архаизмом Средневековья. Но «болезнь дьявола», как ее нередко называли, до сих пор никуда не делась, хотя в мире и достигнуты значительные успехи в борьбе с ней. Начиная с 2000 года заболевание ликвидировано в глобальных масштабах (достигнут показатель распространенности менее одного случая заболевания на 10 000 человек). На начало 2020 года в Российской Федерации состояло на учете 202 больных лепрой, более 60% из которых жители Астраханской области.
Несмотря на медицинские успехи в лечении лепры, во многих странах люди, страдающие этой болезнью, живут в изоляции и подвергаются различным формам дискриминации.
Причины появления лепры
Проказу считают малозаразным заболеванием, поскольку решающим фактором является длительный, повторный и непосредственный контакт с больным человеком, во время которого происходит сенсибилизация организма.
Таким образом, вероятность заболевания находится в прямой зависимости от длительности и характера контакта с больным человеком.
Врачи называют группы риска, то есть лиц, наиболее подверженных заражению: к ним относятся аллергики, больные СПИДом и люди, проживающие в районах с плохими условиями жизни.
Коварство лепры состоит в том, что она может «дремать» в организме и год, и пять, и сорок лет. Характеризуется затяжным течением с периодическими обострениями и способна маскироваться под другие болезни, чаще всего кожные.
Патогенез заболевания до конца не выяснен в связи с невозможностью культивирования возбудителя на искусственных питательных средах и трудностями экспериментального моделирования на животных. Нет четкого понимания, возможно ли полное излечение болезни или остается скрытая возможность ее рецидива на фоне ослабления иммунитета.
Классификация заболевания
В зависимости от течения заболевания выделяют 4 формы:
- недифференцированная лепра,
- туберкулоидная лепра,
- лепроматозная лепра,
- пограничная (диморфная) лепра.
При хорошем иммунном статусе у пациента развивается относительно благоприятная туберкулоидная форма, неблагоприятной считается лепроматозная форма проказы.
Клинические разновидности лепры различаются симптоматикой и сферой поражения внутренних органов. Течение болезни в каждом случае проходит четыре стадии: стационарную, прогрессирующую, регрессивную и в завершение болезни – резидуальную.
Симптомы лепры
Во время первых двух стадий очаги заболевания могут обостряться, несмотря на интенсивность терапии. Для лепроматозной формы характерны преимущественно кожные поражения, а при туберкулоидной – поражение периферических нервных стволов. Недифференцированная и пограничная формы могут трансформироваться в лепроматозную или туберкулоидную.
Лепра является генерализованным заболеванием, то есть распространяется на кожу, слизистые оболочки носа и ротоглотки, переднюю камеру глаз, кожные и другие периферические нервы, тканевые макрофаги, надпочечники и яички.
Изменения кожи выглядят как красно-бурые пятна на лице, руках, ногах и спине. Вначале кожа гладкая и блестящая, но спустя несколько лет уплотняется и становится бугристой. В дальнейшем бугристая поверхность начинает шелушиться, покрываться язвами и теряет чувствительность. На лице формируется характерная «львиная маска». По мере развития патологии у больного выпадают брови и ресницы, западает спинка носа, нос проседает и приобретает седловидную форму, носовые ходы искривляются, в результате чего нарушается функция дыхания, наблюдаются частые носовые кровотечения, свисают мочки ушей, голос становится хриплым и гнусавым.
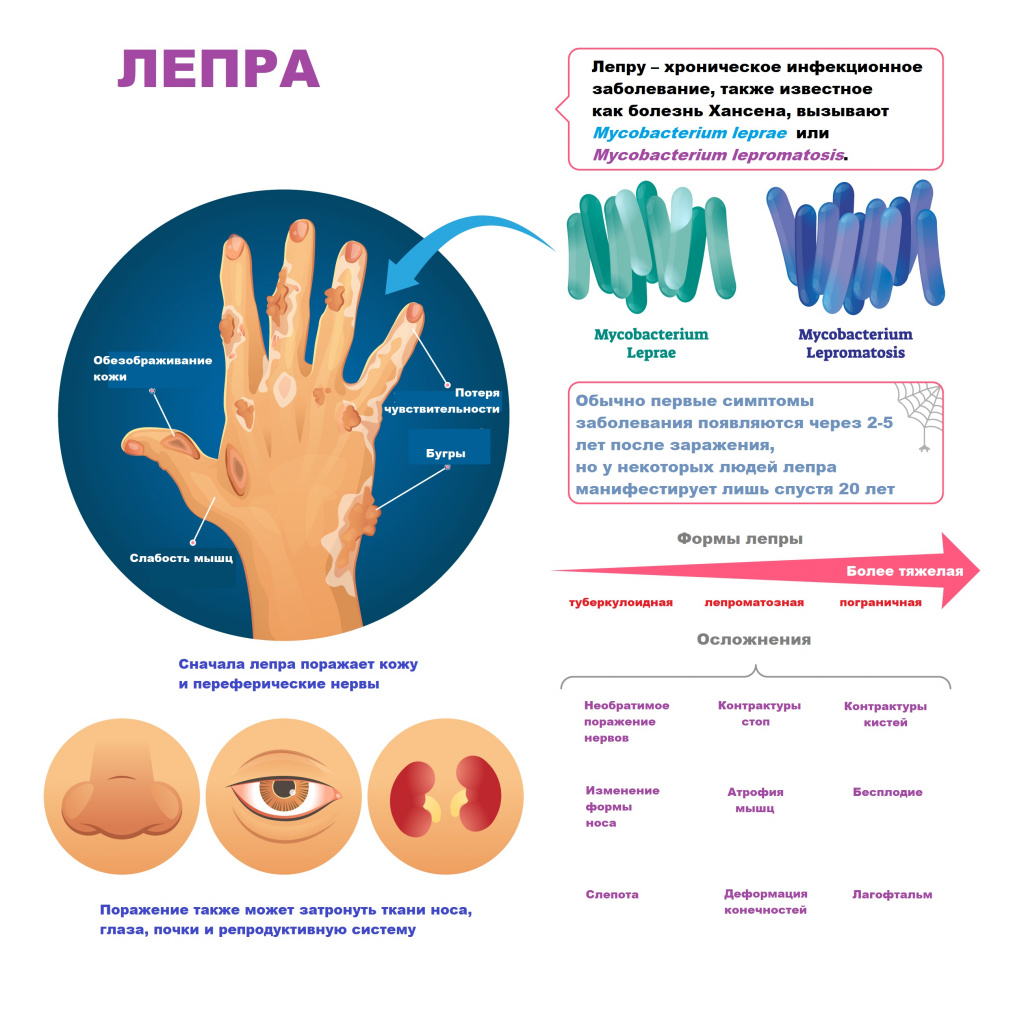
Нередко наблюдаются невриты локтевого, срединного, лицевого, ушного и других нервов. Из-за поражения нервных окончаний кода теряет чувствительность, позже у больного может развиваться парез или паралич конечностей, на стопах появляются трофические язвы и контрактуры, атрофируются мышцы. Внутренние органы обычно не поражаются.
Ухудшается зрение, а при отсутствии адекватного лечения может наступить полная слепота. Лимфатические узлы, особенно бедренные, паховые и локтевые, часто увеличены, отмечаются лепроматозные периоститы и оститы, приводящие к остеопорозу и остеомаляции. У мужчин вследствие инфильтрации и рубцевания яичек развивается бесплодие.
Диагностика лепры
Диагноз устанавливают по факту контакта с больными лепрой в анамнезе. Поставить достоверный диагноз можно только после выделения микобактерии M. leprae. Материал для исследования получают путем соскоба с пораженного участка кожи, предварительно сделав небольшой разрез глубиной 2-3 мм. Также можно взять пункцию из увеличенных лимфоузлов. Полученный материал окрашивают по Цилю-Нильсену (окрашивает кислотоустойчивые бактерии).
При сомнительных результатах проводят биопробу на морских свинках (резистентных к M. leprae и неустойчивых к M. tuberculosis).
Кроме того, для дифференциации формы заболевания проводят кожную пробу с аллергеном M. leprae. При туберкулоидной лепре проба положительная, при лепроматозной форме – отрицательная.
Определить разновидность лепры позволяет лепроминовый тест, дающий резко положительный результат при туберкулоидной форме болезни и отрицательный – при лепроматозной форме. Пограничные формы дают слабоположительный либо отрицательный ответ.
Общий анализ крови демонстрирует незначительную анемию, увеличение СОЭ.
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Читайте также:

