Лейкоцитарная формула при герпесе
Обновлено: 18.04.2024
Важно помнить! Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Другие названия: лейкограмма, формула крови, Leukocyte differential count, WBC differential.
Код услуги для заказа 4036 Мануальный подсчет лейкоцитарной формулы в медицинской лаборатории Синэво.
Общая информация
Лейкоциты (белые кровяные тельца) — это форменные элементы крови, основной функцией которых является защита организма от чужеродных агентов (токсинов, вирусов, бактерий, отмирающих клеток собственного организма и др.).
Лейкоцитарная формула – процентное соотношение различных видов лейкоцитов в сыворотке крови. Мануальный подсчет – это подсчёт клеток в окрашенном мазке крови под микроскопом. Лейкоциты делятся на 5 типов: нейтрофилы, лимфоциты, моноциты, эозинофилы, базофилы. Они отличаются по внешнему виду и выполняемым функциям.
Важно! Существует такое понятие, как сдвиг лейкоцитарной формулы влево и вправо. Сдвиг лейкоцитарной формулы влево – это когда в ответ на инфекцию сильно увеличивается продукция нейтрофилов, и в кровь выходят их незрелые палочкоядерные формы («палочки»). Сдвиг лейкоцитарной формулы вправо – увеличение количества зрелых сегментоядерных нейтрофилов с измененным строением ядер, что встречается при мегалобластных анемиях, заболеваниях печени и почек.
Показания к назначению исследования:
- плановое профилактическое обследование;
- обследование перед госпитализацией и оперативным вмешательством;
- диагностика инфекционных, воспалительных и гематологических заболеваний;
- мониторинг эффективности проводимой терапии или течения заболевания;
- аллергические реакции;
- опухоли.
Метод: ручной
Единицы измерения: %
Материал для исследования: венозная (капиллярная) кровь
Рекомендации по подготовке к анализу:
Интерпретация результатов:
Результат лабораторных исследований не является достаточным основанием для постановки диагноза. Интерпретация результатов и постановка диагноза осуществляется только лечащим врачом.
Нейтрофилы (NEUT), Neutrophils
Нейтрофилы — наиболее многочисленная разновидность лейкоцитов, составляют 50-75% от общего количества белых клеток. При развитии инфекционного или воспалительного процесса внутри нейтрофилов активируются особые вещества, необходимые для разрушения возбудителя или собственных пораженных клеток. Нейтрофилы активно движутся к месту инфекции и выполняют свою защитную функцию.
Выделяют сегментоядерные (зрелые) нейтрофилы и небольшое количество (1-5% от общего количества) палочкоядерных (более молодых) нейтрофилов.
Расшифровка у детей и взрослых
Референтные значения (норма)
Дети
2 недели-1 год: 16-45;
Взрослые: 40-72.
Возможные причины повышения уровня нейтрофилов:
- острые локализованные бактериальные инфекции (абсцессы, остеомиелит, острый аппендицит, отит, пневмония, острый пиелонефрит, сальпингит, менингиты (гнойные и туберкулёзный, др.), ангина, острый холецистит, тромбофлебит и др.);
- острые генерализованные бактериальные инфекции (сепсис, перитонит, эмпиема плевры, скарлатина, холера и др.);
- воспаление или некроз ткани: инфаркт миокарда, обширные ожоги, гангрена, быстро развивающаяся злокачественная опухоль с распадом, узелковый полиартериит, острая ревматическая лихорадка;
- интоксикации экзогенные: свинец, змеиный яд, вакцины, бактериальные токсины;
- интоксикации эндогенные: уремия, диабетический ацидоз, подагра, эклампсия, синдром Кушинга;
- миелопролиферативные заболевания (хронический миелолейкоз, эритремия);
- острые геморрагии.
Возможные причины понижения уровня нейтрофилов:
- бактериальные инфекции (тиф, паратиф, туляремия, бруцеллёз, подострый бактериальный эндокардит);
- вирусные инфекции (инфекционный гепатит, грипп, корь, краснуха);
- миелотоксические влияния и супрессия гранулоцитопоэза:
- ионизирующее излучение;
- химические агенты (бензол, анилин и др.);
- дефицит витамина В12 и фолиевой кислоты;
- острый лейкоз;
- апластическая анемия;
- иммунный агранулоцитоз:
- гаптеновый (гиперчувствительность к медикаментам);
- аутоиммунный (СКВ, РА, хронический лимфолейкоз);
- изоиммунный (у новорождённых, посттрансфузионный);
- перераспределение и секвестрация нейтрофилов в органах:
- анафилактический шок;
- спленомегалия различного происхождения;
- наследственные формы нейтропении (циклическая нейтропения, семейная доброкачественная нейтропения и др.).
Вещества и препараты, влияющие на повышение уровня нейтрофилов: стероиды, препараты дигиталиса
Вещества и препараты, влияющие на понижение уровня нейтрофилов: пенициллин, антитиреоидные препараты, карбамазепин, вальпроевая кислота, мышьяк, ртуть, индометацин, ибупрофен, ацетилсалициловая кислота, барбитураты, диазепам, галоперидол, каптоприл, пропранолол, гидралазин, метилдопа, диазоксид, нифедипин, нитрофурантоин, гризеофульвин, метронидазол, рифампицин, изониазид, стрептомицин, сульфаниламиды, имипенем, противомалярийные препараты, противовирусные препараты, антидиабетические препараты, диуретики, противоопухолевые препараты (цитостатики, иммуносупрессанты).
Лимфоциты (LYMPH), lymphocytes
Лимфоциты — это важнейшие клеточные элементы иммунной системы. Они выполняют различные функции: распознают возбудителей болезни, изменения и уничтожения клеток собственного организма, а также дают гуморальный ответ в виде синтеза антител – специальных защитных белков. Лимфоциты участвуют в формировании иммунологической памяти – способности организма к ускоренному и усиленному иммунному ответу при повторной встрече с чужеродным агентом.
Референтные значения (норма)
Дети
0-2 недели: 22-55;
2 недели-1 год: 25-70;
1-2 года: 30-65;
2-5 лет: 30-60;
6-7 лет: 30-50;
9-11лет: 30-46;
12-15 лет: 20-50;
16-18 лет: 20-50.
Взрослые: 20-40.
Возможные причины повышения уровня лимфоцитов:
- вирусные инфекции (инфекционный мононуклеоз, цитомегаловирус, краснуха, ветряная оспа);
- токсоплазмоз;
- некоторые бактериальные инфекции (туберкулёз, коклюш);
- онкологические заболевания костного мозга (хронический лимфолейкоз) и лимфоузлов (неходжкинская лимфома);
- острый вирусный гепатит;
- макроглобулинемия Вальденстрема;
- травматические повреждения тканей;
- злокачественные опухоли (особенно карцинома бронхов);
- уремия;
- эклампсия;
- заболевания щитовидной железы;
- острое кровотечение;
- постспленэктомия.
Возможные причины понижения уровня лимфоцитов:
- тяжёлые вирусные заболевания (грипп);
- острые бактериальные инфекции;
- системная красная волчанка;
- некоторые врожденные заболевания новорождённых (синдром Ди Джорджа);
- гиперспленомегалия;
- интоксикация тяжелыми металлами, при ионизирующем излучении;
- заболевания костного мозга — первичные и вторичные (гранулемы, метастазы);
- мегалобластная, апластическая анемия;
- миелодиспластические синдромы;
- наследственные заболевания (анемия Фанкони, наследственный дискератоз);
- почечная недостаточность;
- недостаточность кровообращения;
- вторичный иммунодефицит;
- ВИЧ/СПИД;
- злокачественные новообразования.
Вещества и препараты, влияющие на повышение уровня лимфоцитов:
аминосалициловая кислота, цефтазидим, дексаметазон, галоперидол, леводопа, офлоксацин, тиоурацил, спиронолактон, вальпроевая кислота.
Вещества и препараты, влияющие на понижение уровня лимфоцитов: аспарагиназа, бензодиазепины, цефтриаксон, циклоспорин, фолиевая кислота, фуросемид, ибупрофен, левофлоксацин, литий, офлоксацин, глюкокортикоиды.
Моноциты (MONO), Monocytes.
Моноциты — это самые крупные клетки, циркулирующие в крови, мигрируя в очаг воспаления они поглощают микробы, погибшие лейкоциты, а также поврежденные клетки воспаленной ткани, очищая этим очаг воспаления и подготавливая его для восстановления. За эту функцию моноциты называют «дворниками организма». Также моноциты синтезируют большое количество биологически активных веществ, необходимых для жизненно важных процессов в организме.
Референтные значения
Дети
2 недели-1 год: 5-20;
1года -18 лет: 2-10.
Взрослые: 2-10.
Возможные причины повышения уровня моноцитов:
- подострый бактериальный эндокардит, период выздоровления после острых инфекций, вирусные (мононуклеоз), грибковые, риккетсиозы и протозойные инфекции (малярия, лейшманиоз);
- туберкулёз, особенно активный, сифилис, бруцеллёз, саркоидоз, язвенный колит;
- острый монобластный и миеломоноцитарный лейкозы, хронический моноцитарный, миеломоноцитарный и миелолейкоз, лимфогранулематоз;
- системная красная волчанка, ревматоидный артрит, узелковый полиартериит.
Вещества и препараты, влияющие на повышение уровня моноцитов: ампициллин, гриеофульвин, галоперидол, пеницилламин, преднизолон.
Эозинофилы, эозинофильные гранулоциты (ЕОS), Eosinophils
Это клетки, которые захватывают чужеродный материал, слишком крупный для нейтрофилов. Эозинофилы присутствуют в очагах воспаления, вызванных аллергическими заболеваниями, например, при бронхиальной астме. Высвобождение биологически активных веществ из эозинофила — составная часть механизма развития аллергических реакций. Так же их выработка увеличивается при заражении гельминтами.
Референтные значения (норма)
Дети
Взрослые: 0-6.
Возможные причины повышения уровня эозинофилов:
- аллергические заболевания (бронхиальная астма, сенная лихорадка, аллергический дерматит, лекарственная аллергия);
- инвазии паразитов (аскаридоз, токсокароз, трихинеллез, эхинококкоз, шистосомоз, филяриоз, стронгилоидоз, описторхоз, лямблиоз, анкилостомидоз);
- гемобластозы (острый лейкоз, хронический миелолейкоз, эритремия, лимфомы, лимфогранулематоз), другие опухоли, особенно с метастазами или некрозом;
- иммунодефициты (синдром Вискотта-Олдрича);
- болезни соединительной ткани (узелковый полиартериит, ревматоидный артрит);
- эозинофильный эзофагит, эозинофильный гастроэнтерит, эозинофильный колит (связан с аллергией на коровье молоко, хотя может возникнуть у детей, которых кормили соевыми детскими смесями или грудью);
- инфекционные заболевания на стадии выздоровления при других инфекциях;
- наследственная эозинофилия;
- неаллергический эозинофильный ринит.
Возможные причины понижения уровня эозинофилов:
- начальная фаза инфекционно-токсического процесса;
- тяжёлое состояние у пациентов в послеоперационном периоде.
Вещества и препараты, влияющие на повышение уровня эозинофилов: аллопуринол, аминосалициловая кислота, амоксициллин, амфотерицин В, ампициллин, каптоприл, цефотаксим, цефтазидим, цефтриаксон, доксициклин, эналаприл, гентамицин, галоперидол, вакцина от гепатита А, офлоксацин, пеницилламин, ранитидин, рифампицин, спиронолактон, стрептомицин.
Вещества и препараты, влияющие на понижение уровня эозинофилов: амитриптилин, аспирин, каптоприл, кортикотропин, индометацин, рифампицин, сульфаметоксазол.
Базофилы (базофильные гранулоциты, «тучные клетки», BASO), Basophils
Главная функция базофилов — участие в аллергических реакциях немедленного типа. Основной компонент этих клеток – белок гистамин, который запускает аллергические процессы.
Референтные значения (норма)
у взрослых и детей: 0-1,0
Возможные причины повышения уровня базофилов:
- аллергические заболевания (аллергический ринит, назальные полипы, хронический синусит, бронхиальная астма, атопический дерматит, лекарственная аллергия);
- мегакариобластная лейкемия при синдроме Дауна (трисомия 21);
- хронический миелолейкоз и другие хронические миелопролиферативные синдромы (истинная полицитемия, миелоидная метаплазия с миелофиброзом);
- системный мастоцитоз, пигментная крапивница (педиатрическая форма ограниченной мастоцитарной пролиферации, с кожной локализацией);
- базофильная лейкемия;
- болезнь Ходжкина;
- хроническая гемолитическая анемия, постспленэктомия;
- последствия ионизирующего облучения;
- инфекции различной этиологии (туберкулез, ветряная оспа, грипп);
- гипотиреоз.
Возможные причины понижения уровня базофилов:
- острая фаза инфекционных заболеваний;
- реакция на стресс (беременность, инфаркт миокарда);
- результат длительного лечения стероидами, химиотерапии, облучения;
- врожденное отсутствие базофилов;
- острая ревматическая лихорадка у детей;
- гипертиреоз;
- крапивница;
- бронхиальная астма;
- анафилактический шок;
- системный мастоцитоз, пигментная крапивница, мастоцитарная лейкемия;
- макроглобулинемия, лимфомы с медуллярной инвазией;
- кортикосупраренальная недостаточность;
- хронические заболевания печени и почек;
- остеопороз.
Дополнительные субпопуляции клеток
Атипичные мононуклеары – клетки лимфоидной природы, возникающие в ответ на вирусные инфекции, чаще всего на инфицирование вирусом Эпштейна-Барр (инфекционный мононуклеоз), но могут обнаруживаться и при других вирусных заболеваниях.
Плазматические клетки – антителообразующие клетки лимфоидной природы. Обычно находятся в лимфатических узлах и селезенке. Могут появляться в кровотоке при инфекционных заболеваниях. Присутствие 1-2% плазматических клеток можно считать вариантом нормы. Присутствие большого количества плазматических клеток (более 10%) характерно для ряда онкогематологических заболеваний.
Палочкоядерные нейтрофилы – «молодые» нейтрофилы с несегментированным ядром. В норме их количество составляет 1-6% от общего количества лейкоцитов. Повышенное содержание палочкоядерных нейтрофилов обычно свидетельствует о наличии инфекционного или воспалительного процесса.
Юные миелоциты – незрелые клетки гранулоцитарного ряда, предшественники палочкоядерных нейтрофилов. Их присутствие также может свидетельствовать о наличии инфекционного или воспалительного процесса. Могут появляться при приеме некоторых лекарственных препаратов. В небольшом количестве в норме могут присутствовать у беременных женщин и новорожденных детей.
Миелобласты, промиелоциты и миелоциты — клетки-предшественники взрослых нейтрофилов. Могут появляться в мазке крови в исключительных случаях, например, при тяжелых инфекционных заболеваниях, а также при хроническом миелолейкозе (злокачественном заболевании кроветворной системы).
Где сдать мануальный подсчет лейкоцитарной формулы
Сдать анализ крови на мануальный подсчет лейкоцитарной формулы можно в любом пункте Синэво в Минске, Барановичах, Бобруйске, Борисове, Бресте, Витебске, Ганцевичах, Гомеле, Гродно, Жлобине, Лиде, Могилеве, Мозыре, Молодечно, Новогрудке, Новополоцке, Орше, Пинске, Полоцке, Речице, Светлогорске, Слуцке, Сморгони, Солигорске.
Подробную информацию по ценам и срокам выполнения анализов Вы можете получить в разделе "Анализы" или по телефонам:
7766 звонок бесплатный для абонентов МТС и life:) звонок платный для абонентов A1 (по тарифам оператора) +375 (17) 338 88 88 звонок платный, тарифицируется как исходящий вызов на фиксированную сеть
Режим работы колл-центра понедельник-пятница: с 07:00 до 19:00 суббота: с 07:00 до 16:00 воскресенье: с 8:00 до 16:00
В статье приведен обзор существующих подходов к оценке гематологических показателей у детей с острыми респираторными вирусными инфекциями и представлен инновационный метод их оценки, позволяющий наиболее точно определить степень тяжести заболевания у дете
Characteristics of hematological indices in acute respiratory diseases in children of different age groups
The article gives a review of the present approaches to the evaluation of hematological indices in children with acute respiratory viral infections. An innovative method of their evaluation which allows to define the level of severity of the disease in children of different age groups, was presented.
С целью оптимизация тактики лечения актуальными являются: стандартизация методик оценки клинико-лабораторных показателей при ОРИ; установление особенностей лабораторных показателей при ОРИ различной этиологии; оценка риска развития бактериальных осложнений и разработка прогностических критериев.
Традиционно в клинической практике проводится оценка гематологических показателей, в том числе в динамике. Особую значимость такая оценка приобретает при ведении пациентов с инфекционной патологией, учитывая выраженную реакцию гемограммы на инфекционный процесс и ее изменчивость в процессе лечения. В остром периоде заболевания, как правило, отмечаются существенные изменения показателей лейкоцитарной формулы, некоторых биохимических и серологических данных, при этом эти изменения могут носить разнонаправленный характер в зависимости от вида возбудителя, формы тяжести заболевания и возраста пациента.
Одним из наиболее перспективных направлений анализа гематологических показателей является приведение множества отдельных параметров к единому математическому значению, что позволяет стандартизировать и унифицировать клинико-лабораторные данные. Использование интегральных оценок гематологических показателей пациентов в динамике представляется перспективным для выявления клинико-лабораторных особенностей ОРИ различной этиологии, а также для определения формы тяжести, риска развития бактериальных осложнений. При этом статистически значимые отклонения в показателях гемограммы в динамике, как полученных рутинными методами, так и интегральных, позволят оценить эффективность и безопасность терапии при ОРИ у детей, что позволит создать алгоритмы динамического мониторинга качества проводимой терапии.
Применительно к оценке результатов клинических исследований одним из направлений интегральной оценки лабораторных данных является расчет лейкоцитарных индексов. Большой научно-практический потенциал использования подобных индексов подчеркивают многие авторы [3, 6], показывая их применимость в широком диапазоне нозологических форм, от инфекционных болезней до острой хирургической патологии. Наиболее изученными являются лейкоцитарные индексы интоксикации (ЛИИ) по Я. Я. Кальф-Калифу [5], по В. К. Островскому [8, 9], по Б. А. Рейсу [10], ядерный индекс по Г. Д. Даштаянц [1], индекс сдвига лейкоцитов крови [13], интегральный коэффициент ухудшения крови [11], энтропия лейкоцитарной формулы [12]. При их расчете используют относительные (выраженные в процентах) величины компонентов лейкоцитарной формулы, определение которых входит в рутинную клинико-лабораторную практику всех лечебно-профилактических учреждений. Использование интегральных показателей лейкоцитарной формулы крови позволяет повысить информативность традиционных диагностических тестов и качество оценки эффективности терапии, а в клинической практике — оптимизировать прогнозирование исходов заболевания и индивидуализировать схемы лечения и реабилитации. Применение оптимальных стандартизированных подходов к оценке гематологических показателей перспективно при компьютерной оценке результатов клинических исследований и разработке экспертных диагностических систем.
Однако эффективность использования лейкоцитарных индексов для оценки течения заболевания, эффективности и безопасности терапии у инфекционных больных до настоящего времени в достаточной степени изучена не была. Также существует необходимость разработки границ нормальных значений показателей лейкоцитарных индексов в педиатрической практике для различных возрастных групп.
Новыми перспективными комплексными способами анализа формы тяжести заболевания, риска развития бактериальных осложнений, эффективности и безопасности терапии при ОРИ, которые требуют дальнейшего изучения, являются методы оценки динамики относительных частот отклонений гематологических показателей, расчета их Z-оценок и комплексной Z-оценки.
Таким образом, разработка алгоритмов использования адекватных оценочных критериев и маркеров течения острого респираторного заболевания, применимых в широкой лечебной практике и не являющихся экономически обременительными для лечебно-профилактических учреждений, актуальна, так как позволит повысить точность оценки формы тяжести заболевания, риска развития бактериальных осложнений, эффективности и безопасности используемой терапии острых респираторных инфекций у детей.
Целью настоящего исследования было изучение особенностей изменения и клинической значимости рутинных показателей гемограммы, лейкоцитарных индексов и современных математических методов оценки гемограммы при острых респираторных вирусных инфекциях у детей разного возраста.
Пациенты и методы исследования
В исследовании были проанализированы клинико-лабораторные данные 44 пациентов в возрасте от 1 месяца до 14 лет с ОРВИ в остром периоде (на 1–3 сутки от начала заболевания). У всех пациентов собирался клинический и эпидемиологический анамнез, проводился клинический осмотр по общепринятым методам, осуществлялась термометрия, оценка жизненно важных показателей (ЧСС, ЧД, АД). Учитывая наличие возрастных особенностей гемограммы, в частности лейкоцитарной формулы, пациенты были разделены на три группы: 13 больных в возрасте до 1 года, 15 детей от 1 до 5 лет и 16 пациентов от 5 до 14 лет. У пациентов всех групп была проведена оценка показателей гемограммы, расчет лейкоцитарных индексов (табл. 1), а также Z-оценок основных показателей гемограммы. Оценка степени корреляции показателей гемограммы, лейкоцитарных индексов и Z-оценок основных показателей гемограммы осуществлялась с уровнем лихорадочной реакции, как одного из объективных маркеров тяжести острой респираторной вирусной инфекции, и формами тяжести основного заболевания путем расчета коэффициента корреляции Пирсона (ККП). Расчет Z-оценок компонентов лейкоцитарной формулы осуществлялся по формуле:
где Z — Z-оценка, X — значение показателя, m — среднее нормальное значение показателя, σ — среднеквадратичное отклонение данного показателя.
Установление этиологии острых респираторных инфекций осуществлялось методом ПЦР на базе ФБУН ЦНИИ эпидемиологии Роспотребнадзора.
Результаты исследования и обсуждение
В табл. 2 представлены формы тяжести в группах пациентов разного возраста. В этом отношении группы были сравнимы, лишь у детей старше 5 лет преобладало развитие ОРИ в легкой форме по сравнению с группой в возрасте от 1 до 5 лет.
Было проведено изучение корреляции между степенью лихорадочной реакции в °С (одного из основных объективных маркеров тяжести острой респираторной вирусной инфекции) и значением показателей гемограммы и лейкоцитарных индексов.
Анализ показал следующие результаты:
- суммарное содержание лейкоцитов в периферической крови, процентное содержание палочкоядерных и сегментоядерных нейтрофилов, эозинофилов, моноцитов — очень слабый (ККП от 0,1 до 0,3) и слабый (ККП от 0,3 до 0,38) уровень корреляции;
- лимфоциты — средний уровень корреляции (ККП 0,53) у пациентов до 1 года;
- базофилы — высокий уровень корреляции (ККП 0,7) у детей в возрасте от 1 года до 5 лет.
Эти данные свидетельствуют о низкой чувствительности прямой оценки показателей гемограммы при установлении степени тяжести острых респираторных вирусных инфекций.
Анализ средних значений лейкоцитарных индексов выявил для большинства из них зависимость от возраста: индекс соотношения лейкоцитов и СОЭ, индекс соотношения лимфоцитов и моноцитов, индекс соотношения лимфоцитов и эозинофилов, лейкоцитарные индексы интоксикации, индексы сдвига лейкоцитов крови, индекс Кребса, кровно-клеточный показатель, индекс соотношения нейтрофилов и моноцитов — прямая зависимость; индекс аллергизации, индекс эндотоксикоза, индекс Гаркави, индекс резистентности организма, лимфоцитарно-гранулоцитарный индекс, лейкоцитарный индекс — обратная зависимость (табл. 3).
Это объясняется тем, что все лейкоцитарные индексы не учитывают особенности лейкограммы детей — наличие перекреста между нейтрофилами и лимфоцитами, а также возрастную динамичность референсных значений моноцитов, палочкоядерных нейтрофилов и эозинофилов.
Оценка корреляции лейкоцитарных индексов с уровнем лихорадочной реакции продемонстрировала умеренную чувствительность этих показателей:
- ЛИИ по Я. Я. Кальф-Калифу — средний уровень корреляции (ККП 0,5) в группе пациентов от 1 года до 5 лет;
- индекс сдвига лейкоцитарной формулы по Н. И. Яблучанскому — отрицательная корреляция (ККП 0,5) в группе детей до 1 года;
- ядерный индекс степени эндотоксикоза по Г. Д. Даштаянц был связан с уровнем лихорадочной реакции у больных первого года жизни (ККП 0,8), у пациентов от 1 года до 5 лет (ККП 0,7).
Оценка доли пациентов с отклонениями от нормальных значений Z-оценок показателей гемограммы более 2SD (в %) у пациентов разного возраста показала наличие значимых отличий от других возрастных групп в отношении:
- лейкоцитов (у пациентов до 1 года);
- сегментоядерных нейтрофилов (у пациентов от 1 года до 5 лет);
- лимфоцитов (у пациентов старше 5 лет);
- СОЭ (у пациентов до 1 года) (табл. 4).
Проведенный анализ средних значений отклонений от нормальных значений Z-оценок показателей гемограммы более 2SD у пациентов разного возраста показал, что наиболее выраженные отклонения характерны для лимфоцитов у пациентов старше 5 лет и сегментоядерных нейтрофилов у пациентов до 1 года (табл. 5).
Проведенный ранговый корреляционный анализ продемонстрировал высокий уровень прямой корреляции между формой тяжести заболевания (легкая, средняя, тяжелая) и степенью отклонений от 2SD Z-оценок показателей гемограммы (табл. 6). Оценка производилась для всех возрастных групп, вместе взятых, что диктуется сутью метода Z-оценок.
Для оценки клинической эффективности метода Z-оценок был проведен анализ специфичности, чувствительности и точности данного метода при тяжелой форме острой респираторной инфекции.
Клиническая специфичность характеризуется числом клинически истинно отрицательно классифицированных пациентов, деленных на сумму клинически правильно отрицательно классифицированных плюс клинически ложноположительно классифицированных. Специфичность теста отражает вероятность отрицательного результата в отсутствие патологии, что при высокой специфичности позволяет адекватно отсеивать здоровых из популяции с предполагаемой патологией.
Клиническая чувствительность характеризуется числом клинически истинно положительно классифицированных пациентов, деленных на сумму клинически истинно положительно классифицированных плюс клинически ложноотрицательно классифицированных. Чувствительность теста отражает вероятность его положительного результата в присутствии патологии, что при высокой чувствительности теста позволяет с его помощью эффективно выявлять больных в общей популяции.
Комбинация клинической чувствительности и клинической специфичности теста характеризует клиническую эффективность теста [7].
Установление баланса между специфичностью и чувствительностью необходимо для определения прогностической значимости теста в установлении форм тяжести острой респираторной инфекции. Максимально специфичным явилось определение степени отклонения Z-оценок лейкоцитов и палочкоядерных нейтрофилов. Высокая чувствительность метода Z-оценок выявилась в отношении сегментоядерных нейтрофилов, моноцитов и лимфоцитов, что позволяет говорить о значимости данного метода в идентификации именно вирусных инфекций (рис. 1).
Показатель точности (диагностическая эффективность теста) Z-оценок показателей гемограммы отражает клиническую значимость данных показателей для выявления тяжелой формы заболевания (рис. 2). Применительно к острым респираторным инфекциям можно сказать, что оптимальная точность расчета отклонений Z-оценок отмечена для всех показателей гемограммы (0,7 и более).
Также было установлено, что проведение анализа распределения Z-оценок показателей гемограммы позволяет оценить норму реагирования гемограммы при воздействии определенных этиологических факторов.
Как видно из рис. 3, 4 и табл. 7, экстремумы парабол распределения Z-оценок лейкоцитов при этих инфекциях достоверно отличались: при гриппе он составлял 0,32 ± 0,02 ЕД, при респираторно-синцитиальной (РС) вирусной инфекции — 0,17 ± 0,01 ЕД (р < 0,01). При этом экстремумы отличались величиной изменений, которая имела более выраженный характер при гриппе.
При рино- и аденовирусных инфекциях экстремумы парабол распределения Z-оценок лейкоцитов также достоверно отличались между собой и находились, в отличие от аналогичного распределения при гриппе и РС-вирусной инфекции, в зоне отрицательных значений Z. Установление данных закономерностей реагирования гемограммы под воздействием различных этиологических факторов позволяет установить типичность отклонений в гемограмме для каждой из данных инфекций, что имеет большое дифференциально-диагностическое значение.
Достоверных различий в распределении Z-оценок лейкоцитов при гриппе и аденовирусной инфекции выявлено не было.
Таким образом, проведение анализа Z-оценок показателей гемограммы у детей с острыми респираторными инфекциями позволяет практическому врачу определять форму тяжести заболевания и оценивать соответствие гематологических показателей пациента этиогенным особенностям гемограммы.
Литература
М. Л. Абрамович
А. А. Плоскирева 1 , кандидат медицинских наук
ФБУН ЦНИИ эпидемиологии Роспотребнадзора, Москва
1 ГОУ ВПО «Красноярский государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого» Минздравсоцразвития России
Вирусы герпеса широко распространены в человеческой популяции, они способны поражать практически все органы и системы организма-хозяина, вызывая латентную, острую и хроническую формы инфекции. Вирусами герпеса инфицировано 65-90 % населения планеты. По данным ВОЗ, смертность, обусловленная герпесвирусами, занимает второе место после гриппа. Считается, что на территории России различными формами герпетической инфекции страдают около 20 млн человек. Особую актуальность герпетическая инфекция приобрела в связи с одновременной циркуляцией в организме человека нескольких серотипов вирусов одновременно. При герпесе, как и при других заболеваниях с персистенцией вируса, часто развиваются иммунодефицитные состояния, обусловленные недостаточностью различных звеньев иммунной системы и её неспособностью полностью элиминировать вирус из организма. По данным ряда исследователей, у больных с хронической герпесвирусной инфекцией в сравнении с контролем обнаружено достоверное повышение цито-токсических клеток (CD8), лейкоцитарного индекса интоксикации, снижение содержание Т-хелперов (CD4), T-клеток (CD3), иммуно-регуляторного индекса в периоде обострения заболевания. Изменения клеточного иммунитета зависело от периода заболевания и степени тяжести патологического процесса, то есть чем тяжелее протекало заболевание, тем выраженнее были иммунологические изменения. При наличии микст-инфекции (герпес 1, 2 типов в комплексе с цитомегаловирусом) авторы отмечали увеличение количества активированных T-лимфоцитов и клеток T-хелпера, тогда как смешанная инфекция (цитомегаловирусная инфекция и ВЭБ-инфекция) сопровождалась острым уменьшением в лимфоцитах CD3+/CD95+. Спектр клинических проявлений герпесвирусных инфекций отличается значительным разнообразием, однако все более характерным для данных инфекций становится атипичное течение с преобладанием первично-хронических и рецидивирующих форм. Все чаще хронические герпесвирусные инфекции ассоциируются с формированием у больных синдрома хронической усталости. В последние годы при изучении патогенеза герпесвирусных инфекций были получены доказательства ключевой роли иммунной системы и неспецифической резистентности организма в развитии особенностей течения заболевания. Это связано с тем, что нарушения иммунного реагирования являются немаловажным фактором, определяющим течение болезни и ее исход. Знание особенностей иммунопатогенеза хронической формы герпесвирусных инфекций позволит предупредить развитие активного непрерывно-рецидивирующего варианта заболевания и позволит наиболее эффективно определить тактику терапии, особенно у пациентов с часто рецедивирующими формами.

1. Воробьев А.А. Иммунология и аллергология. / А.А. Воробьев, А.С. Быков, А.В. Караулов. – 2006. – 287 с.
2. Герпесвирусные инфекции человека: руководство для врачей / В.А Исаков, Е.И. Архипова, Д.В. Исаков / под ред. В.А. Исакова – СПб.: СпецЛит, 2006. – 303 с.
4. Камбачокова З.А. Состояние клеточного и гуморального иммунитета у больных рецедивирующим генитальным герпесом // Медицинский вестник Башкорстана 2012. – № 1 (7). – С. 46–49.
5. Нагоев Б.С., Камбачокова З. А. Состояние клеточного иммунитета у больных герпесвирусными инфекциями // Вестник новых медицинских технологий. – 2011. – № 3 (18). – С. 325–327.
6. Синдром хронической усталости: диагностика и лечение / под ред. Ю.В. Лобзина. – СПб.: СпецЛит, 2005. – 79 с.
7. Соколова Т.Ф., Минакова Е.Ю., Долгих Т.И. Изучение иммунофенотипа лимфоцитов у пациентов с микст-инфекцией, вызванной вирусами семейства HERPESVIRIDAE // Медицинская иммунология. – 2010. – № 4–5 (12). – С. 433–436.
8. Черевко Н.А., Попова И.С., Климов В.В. и др. Особенности изменения популяционного иммунитета населения на фоне гепрес-инфицирования // Российский аллергологический журнал. – 2010. – № 1 (1). – С. 207–208.
9. Fatahzadeh M., Schwartz R.A. Human herpes simplex virus infections: epidemiology, pathogenesis, symptomatology, diagnosis, and management // J. Am. Acad. Dermatol. – 2007. – № 57 (5). – Р. 737–63; quiz 764–6.
10. Loutfy S.A., Alam El-Din H.M., Ibrahim M.F., Hafez M.M. Seroprevalence of herpes simplex virus types 1 and 2, Epstein-Barr virus, and cytomegalovirus in children with acute lymphoblastic leukemia in Egypt Kundi // Saudi Med J. – 2006. – № 27 (8). – Р. 1139–45.
11. Koelle D.M., Corey L. Herpes Simplex: Insights on Pathogenesis and Possible Vaccines // Annu Rev Med. – 2008. – № 59. – Р. 381–395.
12. Manchini, G. Immunochemical quantitation of antigens by single radical immunodiffusion / G. Manchini, A.O. Carbonara, J.F. Heremas // Immunochemistry. – 1965. – Vol. 2. – P. 235–254.
13. Wozniak M.A., Mee A.P., Itzhaki R.F. (January). Herpes simplex virus type 1 DNA is located within Alzheimer’s disease amyloid plaques // J Pathol. – 2009. – № 217 (1). – Р. 131–8.
Вирусы герпеса широко распространены в человеческой популяции, они способны поражать практически все органы и системы организма-хозяина, вызывая латентную, острую и хроническую формы инфекции [1, 2, 9]. Вирусами герпеса инфицировано 65–90 % населения планеты. По данным ВОЗ, смертность, обусловленная герпесвирусами, занимает второе место после гриппа. Считается, что на территории России различными формами герпетической инфекции страдают около 20 млн человек. Особую актуальность герпетическая инфекция приобрела в связи с одновременной циркуляцией в организме человека нескольких серотипов вирусов одновременно. При герпесе, как и при других заболеваниях с персистенцией вируса, часто развиваются иммунодефицитные состояния, обусловленные недостаточностью различных звеньев иммунной системы и её неспособностью полностью элиминировать вирус из организма [1, 9, 10]. По данным ряда исследователей, у больных с хронической герпесвирусной инфекцией в сравнении с контролем обнаружено достоверное повышение цито-токсических клеток (CD8), лейкоцитарного индекса интоксикации, снижение содержание Т-хелперов (CD4), T-клеток (CD3), иммуно-регуляторного индекса в периоде обострения заболевания. Изменения клеточного иммунитета зависело от периода заболевания и степени тяжести патологического процесса, то есть, чем тяжелее протекало заболевание, тем выраженнее были иммунологические изменения [3, 4, 11, 12]. При наличии микст-инфекции (герпес 1, 2 типов в комплексе с цитомегаловирусом) авторы отмечали увеличение количества активированных T-лимфоцитов и клеток T-хелпера, тогда как смешанная инфекция (цитомегаловирусная инфекция и ВЭБ-инфекция) сопровождалась острым уменьшением в лимфоцитах CD3+/CD95+ [5,10].
Спектр клинических проявлений герпесвирусных инфекций отличается значительным разнообразием, однако все более характерным для данных инфекций становится атипичное течение с преобладанием первично-хронических и рецидивирующих форм [1, 9]. Все чаще хронические герпесвирусные инфекции ассоциируются с формированием у больных синдрома хронической усталости [6, 13].
В последние годы при изучении патогенеза герпесвирусных инфекций были получены доказательства ключевой роли иммунной системы и неспецифической резистентности организма в развитии особенностей течения заболевания. Это связано с тем, что нарушения иммунного реагирования являются немаловажным фактором, определяющим течение болезни и ее исход. Знание особенностей иммунопатогенеза хронической формы герпесвирусных инфекций позволит предупредить развитие активного непрерывно-рецидивирующего варианта заболевания и позволит наиболее эффективно определить тактику терапии, особенно у пациентов с часто рецедивирующими формами.
Целью настоящей работы явилось изучение особенностей иммунного ответа при хронической герпетической инфекции и оценка эффективности сочетанной противовирусной и иммуномодулирующей терапии (Панавир и Глутоксим).
Материалы и методы исследования
Основную группу составили 30 пациентов обоего пола с хронической рецидивирующей инфекцией, вызванной вирусом простого герпеса (ВПГ), вирусом Эпштейна-Барр (ВЭБ), цитомегаловирусом (ЦМВ) или их сочетанием (микст-инфекция) возрастом от 20 до 50 лет. Отбор больных в группы осуществлялся методом сплошного наблюдения при обращении в консультативную поликлинику Красноярской краевой клинической больницы. Анализ результатов проводился при обострении заболевания.
Контрольную группу составили 36 практически здоровых на момент обследования человек, идентичных по полу и возрасту, без острых патологических процессов в течение 2-х месяцев, предшествующих обследованию, а также хронических заболеваний в анамнезе.
Для иммунологического исследования в утренние часы натощак согласно стандартной методике у всех пациентов проводилось взятие периферической крови из локтевой вены в вакуумные пробирки Green Vac-Tube (Южная Корея) с консервантом, содержащим раствор Li-гепарин и этилендитетрамин (ЭДТА).
Лимфоциты периферической крови выделяли в градиенте плотности фиколл-верографина по методу А. Boyum (1968). Определение в крови регуляторных субпопуляций лимфоцитов проводилось методом проточной цитофлуориметрии с помощью Epics XL («Beckman Coulter», США) с использованием панели сертифицированных моноклональных антител, меченных флуоресцеинизотиоционатом (FITC – Fluorescein Isothyocyanate, англ.), фикоэритрином (PE – Phycoerythrin, англ.), фикоэритрином-Техасским красным (ECD – Energy Coupled Dye или PE-TxR, англ.) линии IOTest («Beckman Coulter», США). Данным методом определялись соответственно кластеры клеточной дифференцировки (CD – Cluster of Differentiation, англ.) клеток человека: Т-лимфоциты, несущие CD3+, – маркер всех зрелых Т-клеток крови, CD4+ – маркер Т-хелперных клеток, CD8+ – цитотических Т-лимфоцитов. Рассчитывали соотношение CD4+/CD8+. Для удаления эритроцитов подготовку проб крови проводили по безотмывочной технологии с использованием следующих лизирующих растворов: OptiLyse C («Beckman Coulter», США). Для корректного исключения из зоны анализа всех частиц, которые не соответствовали по размерам и гранулярности живым лимфоцитам, вводили необходимые логические ограничения в гистограммы распределения частиц по малоугловому, боковому светорассеянию. Математическую обработку цитометрических данных проводили при помощи программ EXPO-32 и CXP v. 2.2 («Beckman Coulter», США). В каждой пробе анализировали не менее 104 клеток, используя трёхцветный цитометрический анализ.
Определение концентрации циркулирующих иммунных комплексов проводилось после инкубации сыворотки крови с раствором ПЭГ-6000 и последующим учетом результатов на фотоэлектроколориметре фильтр № 1 (длина волны 315 нм). Концентрация сывороточных иммуноглобулинов IgA, IgM, IgG измерялась методом Mancini [12]. Определение количественных показателей фагоцитарного звена производилась методом латексной агглютинации [7].
Иммуноферментным методом с использованием тест-систем фирмы «HUMAN» (Германия) определялись титры специфических антител (IgM и IgG) в сыворотке крови к указанным возбудителям и авидности специфических антител IgG к ВПГ, ЦМВ и IgG к VCA, EA, NA-антигенам ВЭБ.
Статистическая обработка результатов исследования проводилась с помощью непараметрического критерия Манна–Уитни (T) [8].
Результаты исследования и их обсуждение
Все пациенты с хронической формой герпесвирусной инфекции при осмотре предъявляли жалобы на наличие у них без видимых причин выраженной утомляемости, усталости и снижения работоспособности, которые отмечались в течение последних 1–3 лет. У 7 больных (23,33 %) на протяжении этого срока отмечалась постоянная температура до 37,2–37,5 °С с периодическими повышениями до 38 °С и ознобами. Значительная часть обследованных (21 человек; 70,00 %) предъявляли жалобы на эпизоды повышения температуры до 38°С, повторяющиеся 2–4 раза в год и продолжающиеся до 2–3 недель. Практически все пациенты (93,33 %) отмечали частые периодические боли в горле или повторные ОРВИ (5 и более раз в год). У большинства имели место разной степени выраженности головные боли, нарушения сна и ухудшение памяти (17 человек; 56,67 %), миалгия (66,67 %), артралгия (26,67 %) и мышечная слабость с быстрой утомляемостью (83,33 %). При осмотре у 22 больных (73,33 %) определялись увеличение и легкая болезненность лимфатических узлов, чаще – шейных, затылочных и нижнечелюстных, а у 7 человек (23,33 %) установлено наличие гепатоспленомегалии. Учитывая данную симптоматику, больным был выставлен диагноз СХУ (по МКБ 10 – G93.3).
В качестве стандартной терапии назначался Панавир – высокомолекулярный полисахарид, относящийся к классу гексозных гликозидов, обладающий противовирусным действием за счёт индукции интерферонов всех субклассов, а также Глутоксим, являющийся иммуномодулятором и системным цитопротектором за счёт влияния на внутриклеточные процессы тиолового обмена.
После лечения субфебрильная температура тела и боли в горле сохранялись лишь у 5 пациентов (16,7 %). Лимфаденопатия отмечалась всего у 8 пациентов (26,7 %), миалгии – у 7 (23,3 %), слабость, утомляемость – у 10 (33,3 %), а нарушения памяти и расстройства сна – у 9 (30 %).
Таким образом, после комбинированной противовирусной и иммуномодулирующей терапии отмечается значительная регрессия основных симптомов заболевания.
По сравнению с контрольной группой отмечалось уменьшение содержания IgА в сыворотке крови и увеличение уровня ЦИК, уровни же других классов иммуноглобулинов достоверно не различались. Также было отмечено уменьшение количества активно-фагоцитирующих клеток и подавление их поглотительной способности.
После лечения в группе больных с хронической герпесвирусной инфекцией наблюдалось стремление к нормализации иммунорегуляторного индекса за счёт роста процентного содержания CD4 и снижения уровня CD8, что связано с уменьшающейся вирусной нагрузкой. Отмечалась тенденция к увеличению уровня IgА в сыворотке крови и достоверное увеличение уровня IgG по сравнению с группой контроля, несколько уменьшался уровень ЦИК. По фагоцитарному звену отмечена нормализация показателей поглотительной активности (фагоцитарный индекс достоверно с контролем не различался).
По маркёрограмме герпесвирусных инфекций при сравнении групп между собой (табл. 2) значительно снижалось содержание Ig G EBNA к ВЭБ, практически не встречались маркёры активации ВЭБИ (Ig G EA к ВЭБ – у 3,33 %, Ig M VCA к ВЭБ – у 3,33 %), увеличивалась авидность Ig G VCA к ВЭБ. Отмечено снижение титра IgG к ВПГ и ЦМВ и увеличение авидности этих антител.
Показатели иммунного статуса больных хроническими герпесвирусными инфекциями до и после лечения (M ± m)
Гематология: Лейкоцитарная формула в норме и при болезнях
При морфологическом исследовании окрашенных мазков периферической крови производится дифференцированный подсчет различных видов лейкоцитов, основанный на физических и биохимических характеристиках этих клеток.
В таблице ниже приведена нормальная лейкоцитарная формула и абсолютное содержание различных видов лейкоцитов.
Абсолютное и относительное содержание различных видов лейкоцитов в норме
| Виды лейкоцитов | Относительное количество (%) лейкоцитов | Абсолютное количество (10 9 /л) лейкоцитов |
| Нейтрофилы палочкоядерные | 1-6 | 0,04-0,3 |
| Нейтрофилы сегментоядерные | 47-72 | 2,0-7,5 |
| Эозинофилы | 0,5-5 | 0,02-0,3 |
| Базофилы | 0-1 | 0-0,1 |
| Лимфоциты | 19-37 | 1,5-3,5 |
| Моноциты | 2-10 | 0,02-0,8 |
Лейкоцитарная формула дает представление только об относительных величинах (процентное содержание). Необходимо также вычислять абсолютное количество клеток каждого вида (в 10 9 /л). Это имеет значение при лейкопениях и умеренных лейкоцитозах. Например, общее количество лейкоцитов — 3,0 • 10 9 /л, из них 50% составляют лимфоциты (относительный лимфоцитоз). Абсолютное количество лимфоцитов = 50% • 3,0 • 10 9 /л : 100% = 1,5 • 10 9 /л (т. е. в пределах нормы).
При подсчете лейкоцитарной формулы важна также качественная оценка лейкоцитов (наличие гипер- или гипосегментации, гигантских форм, токсической зернистости нейтрофилов, размер и окраска цитоплазмы, форма и структуры ядра).
Клиническое значение изменений лейкоцитарной формулы
Изменения лейкоцитарной формулы могут встречаться при негематологических заболеваниях и в этих случаях неспецифичны. Лейкоцитарная формула имеет большое значение для диагностики многих онкогематологических заболеваний, оценки их тяжести и определения эффективности проводимой терапии.
Сдвиг в лейкоцитарной формуле влево — увеличение количества незрелых нейтрофилов в периферической крови (миелоцитов, метамиелоцитов, палочкоядерных нейтрофилов; при гемобластозах нередко появляются промиелоциты и бластные клетки). Появление в крови сегментоядерных нейтрофилов увеличенных размеров, с гиперсегментированными ядрами (6 и более сегментов) называется сдвигом в лейкоцитарной формуле вправо.
Полисегментированные нейтрофилы встречаются при мегалобластных анемиях, миелодиспластических синдромах, лучевой болезни, солидных опухолях, врожденной гиперсегментации нейтрофилов. Полисегментированные и гигантские нейтрофилы появляются также на фоне терапии некоторыми цитостатическими средствами (литалир, цитозар, метотрексат).
Гипосегментация и асегментация нейтрофилов встречается при наследственной пельгеровской аномалии (это нередко ошибочно расценивается как палочкоядерный сдвиг).
При миелодиспластических синдромах, неходжкинских лимфомах, хронических миелопролиферативных заболеваниях наблюдается так называемая пельгеризация нейтрофилов (псевдопельгеровская аномалия).
Снижение числа нейтрофилов менее 1,5 • 10 9 /л (нейтропения) обычно сочетается с лейкопенией и наблюдается при вирусных инфекциях, хронических воспалительных заболеваниях, многих гемобластозах, после лучевой терапии, приема ряда лекарственных препаратов. Агранулоцитоз (нейтрофильных гранулоцитов в крови менее 0,5 • 10 9 /л) — тяжелая степень нейтропении.
При выраженной лейкопении подсчет лейкоцитарной формулы и обнаружение патологических элементов (например, бластов при острых лейкозах) резко затрудняется. В этих случаях необходимо исследовать лейкоконцентрат.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Поражения вирусом простого герпеса (ВПГ) гематологических больных - эпидемиология, частота
Вирус простого герпеса (ВПГ) является антропонозным, широко распространенным в человеческой популяции (даже в изолированных от остального человечества племенах он встречается очень часто). Согласно генетическим характеристикам, различают вирусы простого герпеса типов 1 и 2, имеющие неодинаковые эпидемиологические, культуральные характеристики и способные вызывать различные клинические синдромы.
Вирус герпеса типа 1 (ВПГ-1) поражает верхнюю половину туловища (кожа, слизистые оболочки, гораздо реже головной мозг, легкие, печень и кишечник), в то время как вирус герпеса типа 2 (ВПГ-2) обычно вызывает поражение слизистых оболочек половых путей (генитальный, анальный герпес). Механизм передачи герпеса контактный. Главным источником заражения является слюна серопозитивного индивидуума, поэтому неудивительно, что самая высокая частота первичной герпетической инфекции приходится на ранний детский возраст (поцелуи родителей и родственников, общие игрушки и посуда).
Кроме того, заражение может произойти при контакте поврежденных кожных покровов с вирусом герпеса («ожоговый» герпес, «герпес борцов», экзема Капоши и т. д.). К 5-летнему возрасту примерно 50 % детей из неблагоприятной социоэкономической среды контаминировано ВПГ-1, в юношеском возрасте эта цифра приближается к 100 %, из чего становится ясным, что большинство герпетических поражений у онкогематологических больных является следствием реактивации латентного вируса.
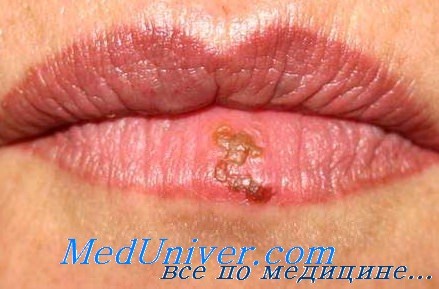
Латентное состояние вируса (непродуктивная инфекция) представляет собой неустойчивое равновесие, легко нарушаемое при неблагоприятных воздействиях (стресс, инсоляция, перегревание, переохлаждение). В этом случае вирус покидает место латенции — периферические ганглии и по нейрональному пути достигает покровов.
Факторами, благоприятно влияющими на реактивацию ВПГ у онкогематологических больных, являются гранулоцитопения и поражение слизистых оболочек, вызванные цитотоксической химиотерапией, гипогаммаглобулинемия, лимфопения, нарушения питания. Следует отметить, что с наибольшей частотой к реактивации ВПГ приводит терапия, вызывающая поражение слизистых оболочек, поэтому, например, при острых лимфоидных лейкозах частота реактивации выше, чем при острых миелоидных лейкозах.
Тяжесть проявлений и длительность герпесвирусной инфекции зависят от степени и продолжительности иммуносупрессии, которая может сильно варьировать в зависимости от основного заболевания (например, при иммунодефицитных синдромах, хронических лимфоидных лейкозах повышен риск развития тяжелых герпесвирусных поражений) и терапии (самые тяжелые поражения отмечаются после аллогенной ТКМ, высок риск тяжелой ВПГ-инфекции у больных, получавших антитимоцитарный глобулин и флударабин).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

