Лазерная абляция при ожогах
Обновлено: 28.04.2024
Отделение хирургической стоматологии ФГБУ "Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии" Минздрава РФ, Москва
Отделение патологии слизистой оболочки рта ФГБУ ЦНИИС и ЧЛХ Минздрава России, Москва
Отделение клинической и экспериментальной имплантологии Центрального НИИ стоматологии и челюстно-лицевой хирургии, Москва
Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии Минздрава РФ, Москва, Россия
Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии Минздрава России, Москва, Россия
Анализ хирургического лечения пациентов с лейкоплакией слизистой оболочки рта методом абляции
Журнал: Стоматология. 2016;95(6): 33‑35
Отделение хирургической стоматологии ФГБУ "Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии" Минздрава РФ, Москва
В статье приведены данные статистики хирургического лечения лейкоплакии методами лазерной абляции за 2014 г. Были обследованы и прооперированы 12 пациентов с веррукозной и эрозивной формами лейкоплакии слизистой оболочки рта с использованием диодного лазера. Только у 5 (42%) наблюдался положительный результат, в 7 (58%) случаях отмечался рецидив заболевания, чаще при локализации очага поражения на языке. Нельзя исключить, что рецидив заболевания может быть связан с неполным иссечением очага поражения из-за анатомо-морфологических особенностей слизистой оболочки рта в различных топографических зонах. Исследование подчеркивает необходимость поиска современных альтернативных методов хирургического иссечения, одним из которых может быть радиочастотное иссечение.
Отделение хирургической стоматологии ФГБУ "Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии" Минздрава РФ, Москва
Отделение патологии слизистой оболочки рта ФГБУ ЦНИИС и ЧЛХ Минздрава России, Москва
Отделение клинической и экспериментальной имплантологии Центрального НИИ стоматологии и челюстно-лицевой хирургии, Москва
Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии Минздрава РФ, Москва, Россия
Центральный научно-исследовательский институт стоматологии и челюстно-лицевой хирургии Минздрава России, Москва, Россия
Лейкоплакияотносится к одной из разновидностей кератозов, характеризующихся хроническим течением и поражающих слизистую оболочку и красную кайму губ [5]. Ороговение слизистой оболочки рта (СОР), сопровождается воспалением стромы и возникает, как правило, в ответ на хронические экзо- и эндогенные раздражения [2, 4, 8]. Для этого заболевания характерно наличие очагов гиперкератоза с явлениями хронического воспаления в зонах, в норме не подвергающихся ороговению [1]. Большинство клинических форм лейкоплакии характеризуется патологическим ороговением покровного эпителия, что является потенциалом к развитию плоскоклеточного рака [3, 6].
Единого мнения о причинах возникновения лейкоплакии на данный момент нет. На возникновение очага гиперкератоза оказывают влияние химические, термические и механические факторы. Также установлена взаимосвязь между возникновением лейкоплакии и наличием патологии ЖКТ, недостатком витаминов [9], стрессом, гормональными расстройствами, а также генетической предрасположенностью к гиперкератозу [12]. В ряде исследований установлена взаимосвязь между возникновением лейкоплакии СОР и хронической кандидозной инфекцией и вирусом папилломы человека [10, 11, 13—16].
Различают следующие формы лейкоплакии: плоскую (простую), веррукозную и эрозивную. На различных участках СОР возможно сочетание этих форм лейкоплакии у одного и того же пациента.
Хирургическийметод лечения является важным звеном в комплексном лечении веррукозной и эрозивной форм лейкоплакии [7].
Цель исследования — анализ эффективности метода лазерной абляции при лечении пациентов с лейкоплакией.
Материал и методы
В отделении заболеваний СОР ЦНИИСиЧЛХ в 2014 г. были обследованы и прооперированы 12 пациентов с веррукозной и эрозивной формами лейкоплакии СОР (К13.2 МКБ-10) с использованием диодного лазера.
Данный метод был применен в качестве монотерапии пациентов, в число которых входили 10 мужчин в возрасте от 52 до 84 лет (7 пациентов с веррукозной формой лейкоплакии, 3 — с эрозивной формой) и 2 женщины с веррукозной формой лейкоплакии в возрасте 58 и 63 лет.
Очаги веррукозной лейкоплакии располагались на дорсальной поверхности языка, на боковой поверхности языка слева и справа, на нижней поверхности языка, на слизистой щек слева и справа, на альвеолярном отростке верхней и нижней челюстей, а также по десневому краю в области зубов верхней и нижней челюстей.
Очаги эрозивной формы лейкоплакии располагались на дорсальной поверхности языка, на альвеолярном отростке нижней и верхней челюстей.
Хирургическое лечение проводилось методом лазерного аблирования очагов поражения. Лазерную абляцию проводили с использованием диодноголазерного скальпеля с длиной волны 0,97 мкм. После проведения инфильтрационной анестезии Sol. Ubistesini 4% проводили лазерную абляцию ткани по контактной и бесконтактной методике с расстояния 1—2 мм над оперируемой поверхностью. Все манипуляции были проведены в непрерывномрежиме генерации излучения. Мощность излучения составляла 2—3 Вт.
Всем пациентам проводили оценку эффективности терапии на основании изучения клинической картины, длительности ремиссии и частоты рецидивов.
Результаты и обсуждение
У 5 пациентов отмечался положительный результат, который заключался в том, что в течение года после хирургического лечения новых очагов поражения в области аблированных участков не возникало. Клинически отмечалась полная эпителизация очагов поражения, слизистая оболочка в данных участках соответствовала норме, признаков воспаления не наблюдалось. Состояние пациентов оставалось стабильным, жалоб не предъявлялось.
В это число вошли 3 пациента с веррукозной формой лейкоплакии: 2 мужчин в возрасте 65 и 56 лет с локализацией очагов поражения на альвеолярном отростке верхней челюсти и на слизистой оболочке щеки и 1 женщина в возрасте 60 лет с локализацией очагов поражения на альвеолярном отростке нижней челюстей.
Также в число пациентов с положительным результатом вошли 2 пациента с эрозивной формой лейкоплакии: 2 мужчин в возрасте 71 и 59 лет с локализацией очагов лейкоплакии на дорсальной поверхности языка и на альвеолярном отростке верхней челюсти. У 7 пациентов отмечался рецидив заболевания, т. е. в течение года после хирургического вмешательства в области проведенной абляции вновь появлялись очаги гиперкератоза, возвышающиеся над уровнем слизистой в виде бляшек или папул, сгруппированных вместе. В это число вошли 6 пациентов с веррукозной формой лейкоплакии: 5 мужчин в возрасте от 53 до 80 лет с локализацией очага поражения на дорсальной поверхности языка, на боковой поверхности языка, на нижней поверхности языка и по десневому краю в области зубов верхней челюсти, а также 1 женщина в возрасте 52 лет с локализацией очага лейкоплакии на боковой поверхности языка.
Кроме того, рецидив отмечался у 1 пациента с эрозивной формой лейкоплакии: мужчина в возрасте 64 лет с локализацией очага поражения на альвеолярном отростке нижней челюсти.
В заключении можно констатировать, что из 12 пациентов с веррукозной и эрозивной формами лейкоплакии, оперированных с применением метода лазерной абляции, только у 5 (42%) наблюдался положительный результат. В 7 (58%) случаях отмечался рецидив заболевания, наибольшее количество которого наблюдалось при локализации очага поражения на языке (см. рисунок и таблицу). Допустимо предположение, что рецидив заболевания может быть связан с неполным иссечением очага поражения. Этот факт определяется анатомо-морфологическими особенностями СОР в различных топографических зонах. Так, в частности, при локализации очага поражения там, где имеется подслизистый слой, а именно боковые участки языка, дно полости рта, губы, ретромолярное пространство, необходимо более глубокое лазерное воздействие. При несоблюдении данных особенностей создаются условия неполного удаления патологического очага, что и является основой рецидива. В связи с этим возникает необходимость поиска современных альтернативных методов хирургического иссечения. Одним из таких методов является радиочастотное иссечение.

Результаты лечения пациентов с лейкоплакией методом лазерной абляции (рисунок)

Результаты лечения пациентов с лейкоплакией методом лазерной абляции
Результаты радиочастотного метода будут представлены в последующих наших публикациях.
БЕСПЛАТНАЯ КОНСУЛЬТАЦИЯ: поможем врачам и владельцам клиник выбрать оборудование для лечения ожоговых рубцов
Оглавление
Ожоговые рубцы — это плотные соединительнотканные образования на коже, возникающие при нарушении нормального заживления ожоговых ран, а также при обширном и/или глубоком поражении тканей. Основную проблему для врачей и их пациентов представляют гипертрофические и келоидные ожоговые рубцы.
В нашей компании Вы можете приобрести следующее оборудование для лечения ожоговых рубцов:
По данным обследования 100 пациентов с ожогами (включая 59 детей), гипертрофические и келоидные рубцы зафиксированы в 38% случаев, включая 34% у взрослых и 41% у детей. В другом исследовании были проанализированы пациенты ожогового отделения Окружного госпиталя Солсбери — в 1968 году гипертрофические рубцы отмечены в 51% случаев, тогда как в 1984 году уже в 63% случаев.
Вероятность развития ожоговых рубцов повышают следующие факторы:
- молодой возраст;
- женский пол;
- локализация повреждения на шее и верхних конечностях;
- более одного хирургического вмешательства в травмированной области;
- трансплантация сетчатого кожного лоскута в область ожога.
Этиология и патогенез
В обычной жизни большинство ожогов происходят при температуре 100–200 °С с воздействием на кожу более 1 секунды. В горячих цехах и зонах боевых действий возможны ожоги при температуре более 1000 °С и времени воздействия менее 1 секунды. Критическим уровнем, при котором развивается термическое повреждение тканей, считается 43 °С — температура ниже этого значения не вызывает ожогов вне зависимости от длительности контакта с кожей.
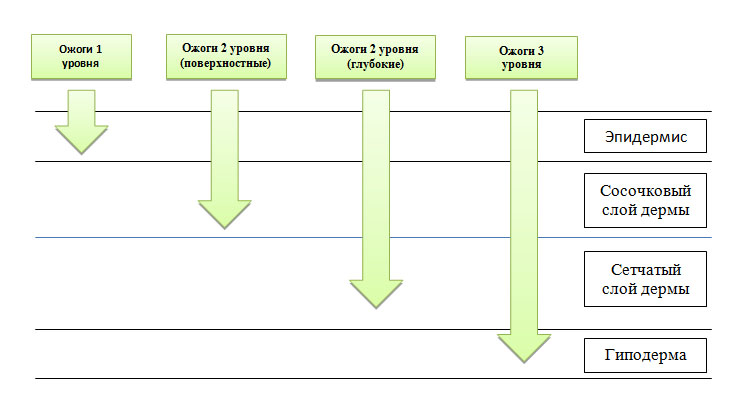
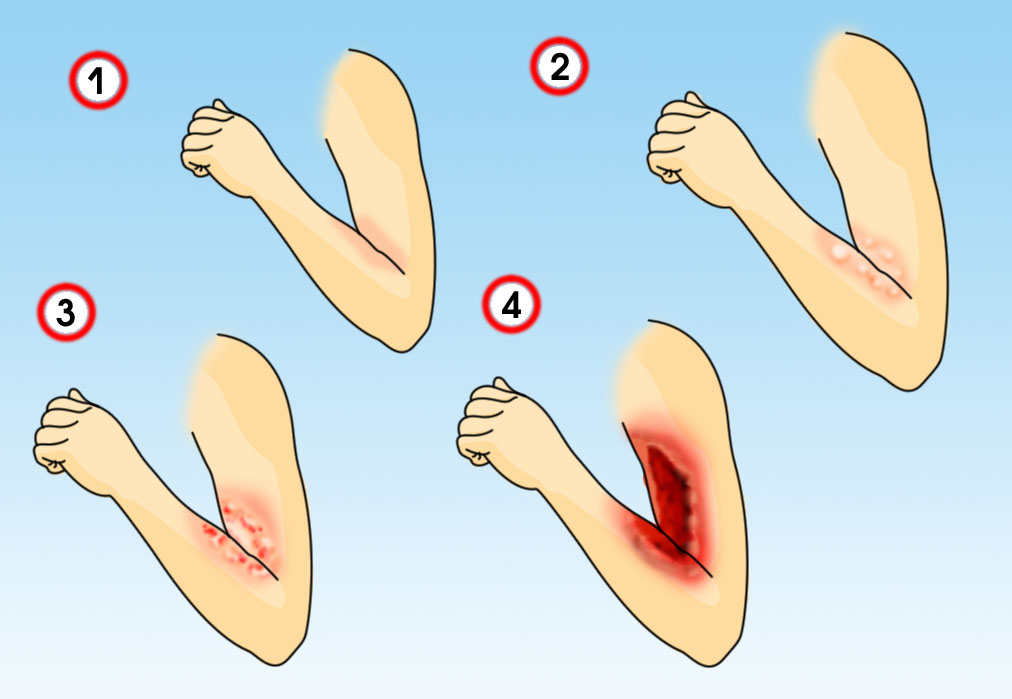
Уровень локального повышения температуры в тканях зависит от их теплопроводности — у дермы она выше, чем у подкожно-жировой клетчатки, поскольку жир является хорошим изолятором. Поэтому термическое повреждение, приводящее к полному некрозу дермы, может почти не затрагивать нижележащий липидный слой. Хотя при очень высокой температуре полностью разрушаются не только дерма и гиподерма, но также скелетные мышцы, фасции, внутренние органы и кости (рис. 1).
Волосяные фолликулы простираются глубоко в подкожно-жировую клетчатку, но это не всегда защищает их от высокой температуры. Хотя их сохранение критически важно для быстрого и качественного заживления травмированной области.
Поверхностные ожоги (первый уровень) — это термическое повреждение одного или нескольких слоев эпидермиса, за исключением базальной мембраны. Нетронутой также остается подлежащая дерма вместе с волосяными фолликулами. Заживление поверхностных ожогов обычно происходит без образования рубцов, поскольку со дна волосяных фолликулов поступает много свежих кератиноцитов, которые помогают быстро восстанавливать пораженную область.
Средние ожоги (второй уровень) — в этом случае поражается весь эпидермис и сосочковый (поверхностные ожоги 2 уровня) или сетчатый слой дермы (глубокие ожоги 2 уровня). После термического воздействия активируются макрофаги, которые начинают очищать рану от некротического мусора. Далее под отмершей тканью образуется свежая грануляционная, формируя так называемый ожоговый струп. Все это способствует восстановлению эпидермиса и образованию тонкого нормотрофического рубца.
При средних ожогах глубокие части волосяных фолликулов остаются жизнеспособными. Выстилающие их дно кератиноциты начинают активно делиться и мигрировать в пораженную область, способствуя реэпителизации. В тяжелых случаях потеря волосяных фолликулов может привести к недостаточной регенеративной активности для эффективного закрытия области повреждения. Если присоединяется инфекция, восстановление ожоговой раны затягивается и может завершаться образованием гипертрофического или келоидного рубца.
Глубокие ожоги (третий уровень) — термическое повреждение распространяется достаточно глубоко в дерму и частично в подкожно-жировую клетчатку, где полностью разрушает волосяной фолликул, включая его основание. Быстрая регенерация кожи фолликулярными кератиноцитами в этом случае невозможна — новые клетки поступают только с краев раны, поэтому такое повреждение заживает медленно. Плюс для удаления больших объемов некротизированной ткани требуется длительная работа макрофагов. В итоге растет вероятность присоединения инфекции, что еще больше осложняет и затягивает регенерацию, способствуя образованию гипертрофических или келоидных рубцов.
Основные исходы ожогов:
- Заживление ожоговой раны с полным восстановлением функции поврежденного органа или области.
- Заживление ожоговой раны с частичной утратой функции поврежденного органа или области.
- Заживление ожоговой раны со значительной утратой функции поврежденного органа или области, вплоть до ее полной потери.
- Образование гипертрофических или келоидных рубцов, сопровождающихся зудом, болезненностью, изъязвлениями и выраженным косметическим дефектом.
Рис. 1. Уровни ожогов и глубина повреждения тканей
Клинические проявления
Наиболее тяжелыми формами ожоговых рубцов являются гипертрофические и келоидные. Гипертрофические рубцы формируются в результате избыточного образования коллагена — они плотные, возвышаются над уровнем кожи, но не выходят за пределы первоначального повреждения и со временем могут подвергаться инволюции. Келоидные рубцы представляют собой опухолеподобное разрастание незрелой соединительной ткани за счет неконтролируемой пролиферации фибробластов. Их особенностью является быстрый рост, сопровождающийся парестезиями, зудом и болевыми ощущениями. Келоиды могут активно увеличиваться в размерах, выходя за пределы ожогового повреждения кожи в виде периферических тяжей. Они почти никогда не уменьшаются и не рассасываются.
Гипертрофические и келоидные рубцы обычно возникают у пациентов с серьезными (глубокими и/или обширными) ожогами (рис. 2). Отягчающим фактором является присоединение инфекции, которая значительно замедляет эвакуацию некротического содержимого и дальнейшую реэпителизацию. В области гипертрофических и келоидных рубцов часто наблюдаются нарушения пигментации — локальное потемнение или побледнение вплоть до обесцвечивания.
Ожоговые рубцы могут увеличиваться в размерах в течение нескольких месяцев, а затем постепенно регрессировать в течение нескольких лет, превращаясь в плоские рубцы без каких-либо дополнительных симптомов. Однако такой сценарий реализуется не у всех пациентов.
Точная оценка состояния ожогового рубца необходима для диагностики и выбора стратегии лечения. Среди различных классификаций, предложенных в последние годы, чаще всего используется Ванкуверская шкала оценки рубцов (Vancouver Scar Scale, VSS). В России была разработана ее модификация, представленная в табл. 1.
Табл. 1. Модифицированная Ванкуверская шкала для оценки ожоговых рубцов
Лазерный луч представляет собой сфокусированный пучок света, обладающий высокой энергией, который может быть направлен в определенную зону или к определенным клеткам кожи. Лазерные лучи отличаются как по длине волны, так и по режиму воздействия, они также могут иметь различные точки приложения (структуры-мишени). Процесс взаимодействия между лазерным лучом, имеющим заданные параметры, и определенными структурами кожи известен как селективный фототермолиз. Суть его состоит в избирательном термическом разрушении клеток или тканей, являющихся мишенью для данного вида лазерных лучей. Сегодня в косметологии применяют аблятивные и неаблятивные лазеры.
Аблятивные лазеры
При воздействии на кожу аблятивного лазера (процедура получила название аблятивная лазерная шлифовка кожи) интенсивные, но кратковременные лазерные импульсы разогревают воду, содержащуюся в поверхностных слоях кожи (эпидерме). В результате этого вода, а вместе с ней и клетки эпидермиса, испаряются. Каждый раз, когда луч лазера проходит по поверхности кожи, он разрушает определенное количество клеток эпидермиса на строго контролируемой глубине. Омолаживающий эффект процедуры связан с реорганизацией клеток кожи и межклеточного матрикса.
После выполнения лазерной шлифовки с применением аблятивного лазера требуется некий восстановительный период, в течение которого в коже синтезируются новые коллагеновые волокна, что сопровождается улучшением внешнего вида кожи. После процедуры кожа выглядит посвежевшей, обновленной и более здоровой. Различают два основных вида аблятивных лазеров – углекислотный (СО2) и эрбиевый (Er:YAG).
Аблятивный лазер лучше всего подходит для разглаживания мелких поверхностных морщин, а также для лечения диспигментаций на коже лица, шеи и других областей тела. Данный тип лазера может быть полезен при лечении постакне, для уменьшения выраженности шрамов и растяжек. Аблятивный лазер может применяться на таких чувствительных участках кожи лица, как зона вокруг губ или веки.
Неаблятивные лазеры
Лазеры данного типа работают с более низким уровнем световой энергии, поэтому их воздействие вызывает меньший объем повреждений в коже. Основное действие лазерных лучей реализуется в глубоком дермальном слое кожи, при этом эпидермис остается нетронутым. Это сокращает сроки восстановления после процедуры лазерной шлифовки кожи и уменьшает количество возможных осложнений.
Тепло, выделяемое при взаимодействии неаблятивного лазера с элементами дермы, вызывает дозированное разрушение ее коллагеновых волокон. Процесс самовосстановления волокон коллагена сопровождается улучшением внутренней структуры кожи и ее внешнего вида. Механизм омолаживающего действия этого типа лазерных аппаратов связан с активизацией обменных процессов в глубоких слоях кожи и обновлением ее клеточного каркаса. Видимые изменения в коже после процедуры неаблятивной лазерной шлифовки менее заметны, чем после обработки ее аблятивным лазером с удалением части клеток эпидермиса.
Неаблятивный лазер лучше всего подходит для уменьшения выраженности возрастных изменений кожи, появление которых связано с естественным старением клеток: глубоких морщин, поверхностных диспигментаций, телеангиэктазий. Современные лазерные аппараты для неаблятивного омоложения кожи работают таким образом, чтобы обеспечить максимальный эффект с минимальным риском появления осложнений и коротким периодом восстановления.
Fraxel: молодость вашей кожи
Фракционный фототермолиз на аппарате Fraxel может проводиться с помощью обоих видов лазера — и аблятивного, и неаблятивного, при этом воздействие на кожу может быть глубоким или поверхностным. Процедура позволяет разрушить старые поврежденные клетоки кожи и одновременно стимулирует образование новых клеточных элементов. Для достижения выраженного омолаживающего эффекта оптимальным является комбинирование упомянутых видов лазера. Fraxel отлично сочетается с другими процедурами для омоложения кожи и усиливает их эффект.
Ожоги нуждаются в неотложной помощи независимо от степени и площади поражения. Даже при незначительном бытовом ожоге нужно предпринять усилия, чтобы предотвратить осложнения. Для оказания помощи важно учитывать степень ожога и оценить повреждения.
Какими бывают ожоги
1-я степень — повреждается только верхний кожный слой, наблюдается покраснение, сухость, небольшие припухлости, болевые ощущения на протяжении нескольких дней.
Ожоги 1-й степени не требуют обращения к врачу. Участок тела необходимо поместить в прохладную воду, можно использовать холодные компрессы. Возможен прием обезболивающих общего спектра действия.
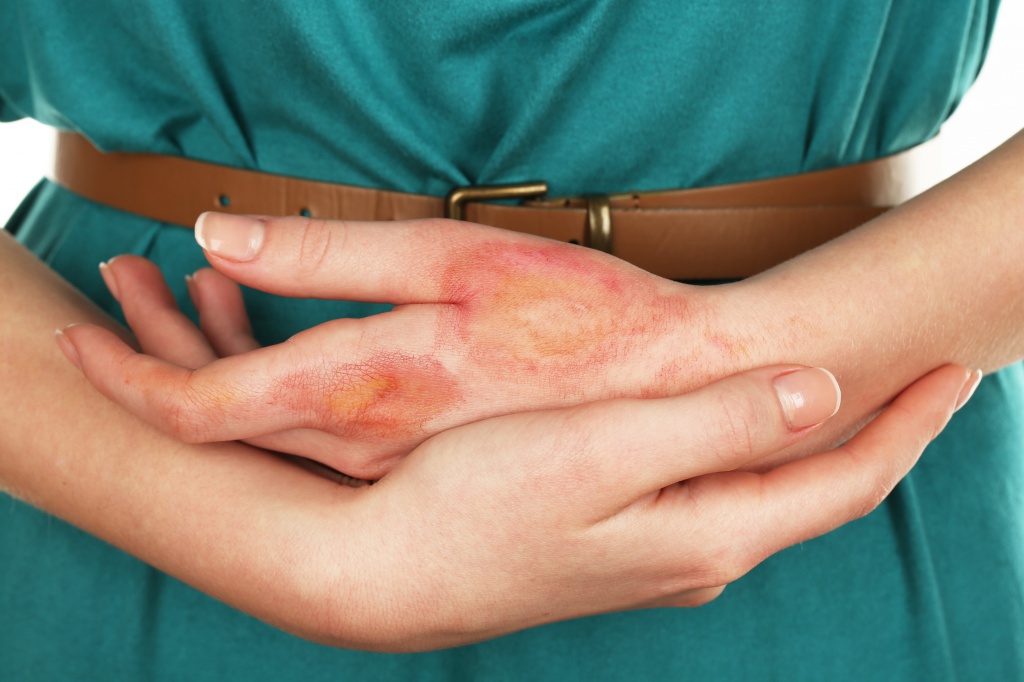
2-я степень — повреждается два кожных слоя - верхний слой эпидермис и дерма. Образуются волдыри, боль очень сильная. Если есть признаки инфекционных процессов и другие осложнения, требуется помощь медиков. Сложное течение может проявляться у пожилых людей, детей, лиц, страдающих хроническими заболеваниями.
При ожогах 3-й и 4-й степени повреждаются внутренние ткани, мышцы, органы, нарушается нормальное функционирование некоторых систем организма, появляются сильные боли, обезвоживание. Из-за того, что многие ткани отмирают, через некоторое время начинается интоксикация всего организма.
Эти ожоги требуют немедленной медицинской помощи. Перед приездом врачей пламя на теле гасится плотным покрывалом. Снимается вся одежда, кроме прилипших участков. Пострадавшему нужно дать пить, чтобы блокировать процесс обезвоживания организма.
Лечение лазером ожогов 1-2 степени
Лазерная терапия применяется при ожогах разных степеней у детей и взрослых. При ожогах 1-2 степени проводится лазерная обработка всей поврежденной поверхности и 2 сантиметров кожи, находящейся рядом. Если поражение более серьезное, захватывается до 5 сантиметров кожного покрова рядом с ожогом.
Стандартный курс терапии составляет 5-7 процедур, проводимых ежедневно. После каждого сеанса накладывается компресс с заживляющей мазью и повязка.
Лечение лазером ожогов 3-4 степени
Если ожог глубокий и обширный, его лечение не обойдется без пересадки кожных лоскутов. Кожа может браться у самого пациента или у донора. Также в некоторых случаях используют искусственные материалы.
При лечении нужно также обязательно следить за состоянием почек, селезенки, печени и других органов - они могли пострадать в результате интоксикации после сильного ожога и отмирания тканей.
Так, в одной из клиник проводилось исследование. Под наблюдением находилось 112 детей от 1 до 14 лет, которые проходили реабилитацию после пересадки кожи. Более 70% детей относились к младшей возрастной группе до 5 лет. Все исследуемые пациенты получили хорошие результаты: в результате лазерной терапии заживление тканей проходило в среднем на 5,5 суток раньше, чем при традиционных методах лечения.
Заключение
Лазерное воздействие стимулирует синтез белка, стабилизирует обновление клеток, оказывает общее укрепляющее воздействие на кожу, возвращает ей нормальную структуру, цвет. Происходит многовекторное и глубинное восстановление эпидермиса, улучшается кровоток, обменные процессы в клетках. Поэтому сокращается время приживления тканей и длительность реабилитационного периода после ожога.







Современную медицину невозможно представить без применения высокотехнологичной медицинской техники, в основе работы которой используются сложные физические явления. Одним из таких физических явлений является лазерное излучение (ЛИ), которое производят оптические квантовые генераторы (лазеры). ЛИ — это световой поток (электромагнитное колебание) в очень узком спектральном диапазоне, который характеризуется такими уникальными физическими свойствами, как монохроматичность, поляризация, когерентность и направленность. В зависимости от физического состояния активной среды выделяют следующие типы лазеров: твердотельные (на кристаллах или стеклах); газовые (He-Ne, Ar, Kr, Xe, Ne, He-Cd, CO2 и др.); жидкостные; полупроводниковые и др. В качестве резонатора обычно используются параллельные зеркала с высоким коэффициентом отражения, между которыми размещают активную среду [1].
На сегодняшний день различают тепловые, энергетические, фотохимические и механические (ударно-акустические) эффекты воздействия Л.И. Вид взаимодействия с тканями человеческого организма и возникающие при этом эффекты определяют область практического применения того или иного лазера в медицине. Биологические ткани (БТ) способны поглощать кванты ЛИ, при этом вызванные эффекты зависят от физических свойств излучения и свойств биологического объекта воздействия [2]. Биологические эффекты воздействия ЛИ на ткани человеческого организма во многом зависят от таких физических параметров, как энергия излучения в импульсе, поверхностная плотность мощности (энергии), длина волны, длительность импульса, частота повторения импульсов, поток излучения и длительность облучения (время экспонирования). При взаимодействии с тканями живых организмов энергия ЛИ вызывает органические (первичные эффекты) и неспецифические функциональные изменения (вторичные эффекты) [3]. В зависимости от характера взаимодействия ЛИ с БТ различают 3 вида фотобиологических эффектов: 1) фотодеструктивное воздействие, при котором тепловой, гидродинамический, фотохимический эффекты света вызывают деструкцию тканей (этот вид лазерного взаимодействия используется в лазерной хирургии); 2) фотофизическое и фотохимическое воздействие, при котором поглощенный биотканями свет возбуждает в них атомы и молекулы, вызывает фотохимические и фотофизические реакции (применяется в терапевтическом лечении); 3) невозмущающее воздействие, при котором оцениваются такие эффекты, как рассеивание, отражение и проникновение Л.И. При этом БТ не меняет своих свойств (применяется в диагностике заболеваний) [4].
Действие лазера в хирургии в качестве режущего инструмента или коагулятора базируется на превращении электромагнитной энергии ЛИ в тепловую энергию. ЛИ удаляет нагретую до нескольких сотен градусов ткань и проникает в более глубокие слои, где вызывает коагуляцию белков. Коагуляция сосудов происходит в результате поглощения кровью ЛИ, ее сильного нагрева до вскипания и образования тромбов [5]. Но необходимо отметить, что не все виды ЛИ одинаково коагулируют кровоточащие сосуды. Так, хорошим коагулирующим действием обладают лазеры, работающие в оранжево-зеленом (КТР-лазер, на парах меди) и инфракрасном (неодимовый, гольмиевый, эрбиевый в стекле, СО2-лазер) спектрах [6].
При работе с хирургическим лазером необходимо учитывать динамику изменения свойств ткани, которые и определяют особенности термического эффекта от воздействия Л.И. При непрерывном ЛИ в динамике изменения температуры облучаемой БТ можно выделить несколько фаз. Сначала происходит линейный рост температуры от 37 до 100 °C, так как в этом диапазоне температур термодинамические свойства БТ остаются практически неизменными. При достижении 100 °C начинается выпаривание тканевой жидкости, и до окончания этого процесса температура остается постоянной. После выпаривания воды температура вновь начинает медленно расти, так как обезвоженная БТ поглощает энергию слабее нормальной. При достижении температуры 150 °C начинается процесс обугливания, приводящий к повышению поглощающих свойств БТ, и, как следствие, нелинейно ускоренный рост температуры. При достижении температуры 300 °C начинается процесс испарения обезвоженной обугленной БТ, при этом рост температуры вновь прекращается [7]. При воздействии непрерывных лазеров из-за постоянного нарастания разности температур между облучаемой и окружающей тканью возрастает перенос тепла из области нагрева в соседние участки ткани. В этом случае при больших уровнях энергии излучения могут быть повреждены значительные объемы ткани, а при малых — ожидаются потери тепла в нагреваемых областях. При мощном импульсном ЛИ происходит очень быстрый нагрев тканевой жидкости, которая переходит в метастабильное состояние и не закипает даже при температуре, превышающей 100 °C. Этот перегрев будет тем выше, чем больше интенсивность Л.И. Затем происходит быстрое взрывное вскипание с повышением внутриклеточного давления, что приводит к выбрасыванию «клеточного каркаса» ткани [8]. Этот эффект воздействия ЛИ на БТ получил название «абляция» — быстрое взрывное удаление вещества. При импульсном нагреве потери тепла обычно существенно меньше за счет того, что поглощение света является очень быстрым процессом, а тепло распространяется существенно медленнее [9]. Таким образом, лазерная абляция не вызывает обугливание облучаемой Б.Т. При этом необходимо отметить, что внутриклеточный «взрыв», возникающий во время абляции, приводит к генерации механической ударной волны, распространяющейся по направлению ЛИ, которая может вызвать повреждение более глубоких слоев БТ [10]. Эту особенность необходимо учитывать в практическом применении хирургических лазеров, работающих в импульсном режиме.
Несмотря на накопленные знания в биофизике ЛИ, на наш взгляд, все же остаются до конца не решенные вопросы, напрямую связанные с безопасностью применения лазерных технологий в хирургическом лечении патологии ЛОР-органов. Так, более глубокое изучение термического эффекта при высокочастотной абляции позволит разработать клинически эффективные методики удаления поврежденных тканей при помощи хирургических лазерных систем, работающих в импульсном режиме.
Цель работы — изучить в условиях эксперимента особенности термического воздействия Ho: YAG на биологическую ткань в режиме абляции и на основании полученных данных разработать методику удаления глоточной миндалины с помощью гольмиевого лазера.
Материал и методы (экспериментальная часть)
Эксперимент проводился совместно с сотрудниками кафедры «Лазерных и оптико-электронных систем» Московского государственного технического университета им. Н.Э. Баумана.
Биологический объект (БО) — мясо индейки.
Оборудование и методика эксперимента

Кремниевый световод хирургической лазерной системы LUMENIS VersaPulse PowerSuite 20 («Lumenis Ltd.», США) мы закрепляли в штативе таким образом, чтобы его дистальный конец находился на расстоянии 5 мм от поверхности Б.О. Универсальный тепловизор FLIR SC7000 («FLIR Systems Inc», США) устанавливали на расстоянии 1 м от БО и подключали к ПК. В течение 6 с точечно воздействовали гольмиевым лазером на Б.О. Компьютерная программа FLIR Altair («Minserv Mineral Services») позволяла записывать тепловизионное изображение с частотой 50 кадров/с (Гц), выбирать локус тепловизионного контроля (5×5 мм) и измерять максимальные значения температуры (Tmax, °С) в исследуемой зоне, которая менялась в реальном времени (рис. 1). Рис. 1. Рабочая панель компьютерной программы FLIR Altair. Левая половина экрана: синим цветом отображается тепловизионное изображение биологического объекта с красной зоной в центре – локус воздействия лазерного излучения. Правая половина экрана: значения температуры в локусе воздействия лазерного излучения. В нижней части экрана: счетчик времени. Учитывая короткое время эксперимента и быстрое изменение значений Tmax, запись тепловизионного изображения мы замедляли в 10 раз с помощью видеоредактора Movavi Video Editor 5. Это позволило нам точно фиксировать малейшие изменения средней по области температуры, усредненной во временно́м масштабе 20 мс, что соответствует времени регистрации кадра тепловизором. Температурные показатели мы соотносили с прямой визуальной оценкой состояния БО в зоне лазерного воздействия, при этом ключевая точка соответствовала началу появления признаков карбонизации.
Экспериментальное исследование повторяли 6 раз. Анализ полученных результатов проводили по вычислению средних значений.
На начальном этапе под визуальным контролем установили параметры работы хирургического лазера, позволяющего проводить абляцию БТ с «первого импульса». В результате было установлено, что при E=0,9 Дж и R=12 Гц абляционный эффект совпадает с началом работы гольмиевого лазера. С данными параметрами ЛИ гольмиевого лазера в дальнейшем проводили эксперимент.
Результаты эксперимента
Динамический тепловизионный контроль точечного воздействия ЛИ гольмиевого лазера с абляционным эффектом в интактной БТ свидетельствовал о постепенном подъеме температуры, которая достигает значения 100,63 °С на 3,48 с. Продолжение воздействия ЛИ вызывает карбонизацию облучаемого участка без абляционного удаления БТ, при этом температура на поверхности обугленного БО оставалась на постоянном уровне, так называемом «плато», ее колебания находятся в пределах от 106,29 до 111,05 °С (рис. 2, а).

Рис. 2. Динамика термического эффекта при воздействии Ho: YAG-лазера. а – облучение интактной ткани.

Рис. 2. Динамика термического эффекта при воздействии Ho: YAG-лазера. б – облучение карбонизированной ткани. Красный участок графика – абляция, черный – карбонизация.
Далее мы приостанавливали работу гольмиевого лазера на 1 мин и давали возможность облученной ткани остыть. После этого продолжали воздействовать ЛИ на карбонизированный участок Б.О. Нами было установлено, что повторное лазерное воздействие на карбонизированный участок БТ вызывает резкий подъем температуры до 111,24 °С за 0,7 с эксперимента. Дальнейшее воздействие Ho: YAG-лазера не вызывает «удаления» обугленной БТ, а поверхностный термический эффект в этой области не приводит к дальнейшему повышению температуры (см. рис. 2, б).

Изучив все результаты исследования, мы отметили, что во всех исследованиях на 5,16-й секунде эксперимента мы фиксировали тепловизионные признаки локального нагрева БО вдали от облучаемой зоны (рис. 3). Рис. 3. Тепловизионная картина термического эффекта при длительном воздействии гольмиевого лазера в условиях карбонизации. Это явление свидетельствует о том, что под карбонизированной «коркой» продолжается прогрев более глубоких слоев БТ.
Результаты проведенного нами эксперимента по изучению особенностей развития термического эффекта при облучении БТ гольмиевым лазером послужили базисом для разработки методики лазерной абляции глоточной миндалины.
Методика лазерной абляции глоточной миндалины

Хирургическое лечение аденоидных вегетаций проводили под визуальным эндоскопическом контролем. Кремниевый световод Ho: YAG-лазера подводили к глоточной миндалине и на расстоянии 5 мм начинали абляционное удаление лимфоидной ткани по всей поверхности глоточной миндалины (рис. 5, а, Рис. 5. Абляция глоточной миндалины при помощи Ho: YAG-лазера. а – абляция аденоидов, б – карбонизированный участок аденоидов в зоне проведения абляции, в – механическое удаление обугленных тканей, г – продолжение лазерной абляции после удаления карбонизированной ткани, д – состояние носоглотки по окончании лазерной абляции аденоидов. б). Участки поверхностного обугливания аденоидов механически удаляли и продолжали лазерную абляцию глоточной миндалины (см. рис. 5, в, г, д).
Заключение
Проведенный нами эксперимент показал, что дистанционное облучение БТ в течение 6 с высокочастотным хирургическим Ho: YAG-лазером, работающим в импульсном режиме с E=0,9 Дж и R=12 Гц, характеризуется следующими биофизическим эффектами:
1. Лазерная абляция БТ сопровождается повышением температуры облучаемой поверхности до критических значений, равных 100,07—111,24 °С, после чего поверхностный слой БТ обугливается, и процесс лазерного «удаления» прекращается.
2. Время развития карбонизации зависит от состояния облучаемой ткани: интактная БТ достигает критического нагрева через 3,48 с; при воздействии высокочастотного лазера на ранее облученную БТ срок развития карбонизации сокращаются на 58% и составляет 1,46 с.
Важно отметить, что для корректной интерпретации полученных нами данных необходимо учитывать инерционность как тепловизора, так и процессов распространения тепловой энергии. Так, при частоте кадров 50 Гц время усреднения тепловизора каждого кадра (время накопления) составляет около 20 мс. Это означает, что при быстром скачке температуры, например до 300 °C, при абляции за время 100 мкс от одного импульса тепловизор покажет среднее увеличение температуры всего на

от начального значения температуры поверхности Б.Т. При этом необходимо учитывать, что параллельно процессу лазерной абляции идет процесс отведения тепла от поверхностного слоя к подлежащим слоям БТ. В результате мы наблюдаем, как от импульса к импульсу температура поверхности БО нарастает.
На наш взгляд, результаты проведенного эксперимента имеют большое практическое значение и определяют безопасное применение хирургического лазера, работающего в импульсном режиме. Хирургу необходимо учитывать тот факт, что при лазерном облучении карбонизированного участка продолжается неконтролируемый нагрев более глубоких слоев органа, что в практическом отношении, несомненно, опасно с точки зрения развития серьезных ятрогенных осложнений.
Разработанная нами методика лазерной абляции ткани глоточной миндалины, в основе которой лежат результаты проведенного эксперимента, является перспективным направлением в хирургическом лечении патологии ЛОР-органов и требует дальнейшего изучения.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts interest.
Сведения об авторах
Читайте также:

