Кожный зуд при полицитемии
Обновлено: 19.04.2024
Полицитемия у новорожденных – синдром увеличенной концентрации клеточных элементов крови (в большей степени эритроцитов) [1].
Код(ы) МКБ-10:
| МКБ-10 | |
| Код | Название |
| Р61.1 | Полицитемия новорожденного |
Дата разработки/пересмотра протокола: 2017 год.
Сокращения, используемые в протоколе:
| ВПС | – | Врожденный порок сердца |
| ЭхоКГ | – | Эхокардиография |
| ОПН | – | Острая почечная недостаточность |
| ОЦК | – | Объем циркулирующей крови |
| РКИ | – | Рандомизированное контролируемое испытание |
| МКБ | – | Международной классификации болезней |
Пользователи протокола: неонатологи, педиатры, акушеры-гинекологи.
Категория пациентов: новорожденные дети.
Шкала уровня доказательности:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или высококачественное (++) когортное или исследование случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное, или исследование случай-контроль, или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+), результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов. |
| GPP | Наилучшая клиническая практика. |

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
Классификация
Первичная (истинная) полицитемия
связана с поражением гемопоэтического ростка, из-за чего наблюдается неадекватно высокий рост количества эритроцитов, лейкоцитов и тромбоцитов;
Вторичная полицитемия является реакцией на изменения в среде
Вторичная к трансфузии:
• отсроченное пережатие пуповины;
• трансфузия от плода к плоду;
• тансфузия от матери к плоду;
• перинатальная асфиксия;
• нахождение ребенка ниже матери сразу после рождения.
Вторичная к внутриутробной гипоксии:
• задержка внутриутробного развития;
• гипертензия вызванная беременностью;
• диабет матери;
• курение матери;
• ВПС матери;
• переношенность.
Причины, связанные с плодом:
• трисомия 13,18,21;
• гипотироидизм, тиротоксикоз;
• врожденная гиперплазия надпочечной железы;
• синдром Беквита-Видемана.
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Диагностические критерии
Скрининг на полицитемию новорожденных рекомендуется при следующих ситуациях:
• новорожденный маленький к гестационному возрасту;
• новорожденный от матери с сахарным диабетом;
• новорожденный большой к гестационному возрасту;
• монохориальная двойня, особенно с одним большим ребенком;
• морфологическая картина задержки развития.
Физикальные данные:
Наиболее частые симптомы неонатальной полицитемии:
• изменения цвета кожных покровов: преимущественно периферический вишневый цианоз;
• изменения со стороны центральной нервной системы: ранние признаки: гипотония, сонливость, раздражительность, беспокойство.
Метаболические нарушения:
• гипогликемия;
• желтуха;
• гипокальциемия.
Нарушения со стороны сердечно-легочной системы:
• тахикардия, тахипное, респираторный дистресс;
• цианоз, плетора.
Нарушения со стороны желудочно-кишечного тракта:
• рвота, слабая сосание, некротически энтероколит.
Нарушения со стороны мочевыделительной системы:
• олигоурия.
Гематологические изменения:
• умеренная тромбоцитопения;
• тромбоз.
NB! Примерно в 40% случаев симптомы полицитемии слабо выражены или отсутствуют (бессимптомная гипогликемия).
Лабораторные исследования:
• важным показателем является центральный венозный гематокрит, который при полицитемии превышает 65%;
• биохимические анализы крови всегда обнаруживают гипогликемию, (уровень глюкозы снижается менее 2,2 ммоль/л.); гипокальциемию, (снижение уровня кальция в сыворотке крови до менее 1,74 ммоль/л или снижение уровня ионизированного кальция до менее 0,75 ммоль/л), гипомагниемию (снижение уровня магния менее 0,62 ммоль/л).
NB! Остальные диагностические мероприятия нацелены на выявление причины полицитемии у новорожденных. При подозрении на каждую конкретную нозологию используются свои методы диагностики.
Инструментальные исследования:
• рентгенография грудной клетки: кардиомегалия, отек легких (при развитии дыхательных нарушений, сердца (других частей тела по необходимости);
• ЭхоКГ: повышение резистентности легочных сосудов, снижение сердечного выброса (при подозрении на кардиопатию и ВПС).
Показания для консультации специалистов: консультация кардиолога, невролога, нефролога для обсуждения тактики ведения при обнаружении врожденных пороков сердца, легких, почек.

Диагностический алгоритм:
Алгоритм ведения новорожденных с полицитемией
Диагностика истинной полицитемии - критерии
Критерии диагностики истинной полицитемии (ИП) разрабатывались и уточнялись в течение многих лет группой по изучению истинной полицитемии (PVSG, США) и другими авторами. Результатом этой работы явились критерии ВОЗ, изложенные в Классификации опухолей (World Health Organisation Classification of Tumors), которая представлена на рисунке ниже.
По мере накопления опыта стало ясно, что и новые методы исследования не всегда разрешают проблему диагностики. Так, в пользу истинной полицитемии расценивается спонтанный рост эритроидных колоний, но этот рост часто очень слаб и нередко его трудно оценивать. С помощью данного признака нельзя провести дифференциальный диагноз с первичными эритроцитозами, поскольку и при них наблюдается та же спонтанность роста.
Определение уровня эритропоэтина (ЭП) в сыворотке крови уже давно используется в целях дифференциальной диагностики истинной полицитемии с вторичными эрит-роцитозами. Для истинной полицитемии характерно низкое содержание ЭП, отсутствие или малая степень его изменений в ответ на кровопускание, для гипоксических эритроцитозов — увеличение содержания ЭП, а при нормальном его уровне — увеличение в ответ на кровопускание, для паранеопластических и почечных — повышение содержания ЭП, но отсутствие ответа на кровопускание.
Исследование эритропоэтина долго считалось строго доказательным даже для тех случаев истинной полицитемии, которые протекали с нормальными показателями гемоглобина и гематокрита.
Высокая оценка диагностических возможностей исследования эритропоэтина была дана в период использования биологического метода. В настоящее время возможности исследования ЭП обогатились радиоиммунным (RIA), иммуноэнзимным (ELIZA) и иммунорадиометрическим (1АМА) методами исследования, что имеет не только позитивные (простота и скорость исследования), но и негативные последствия.
Обнаружен большой разброс в показателях исследования эритропоэтина этими методами, поэтому некоторые авторы сомневаются в его диагностической значимости, а другие предлагают считать низкий уровень сывороточного ЭП лишь малым диагностическим критерием.
Критерии ВОЗ по диагностике истинной полицитемии

Диагностическое значение нейтрофильного лейкоцитоза, палочкоядерного сдвига, тромбоцитоза, увеличения содержания щелочной фосфатазы в нейтрофилах хорошо известно. Частота последнего признака, однако, составляет примерно 80 %, т. е. он не абсолютен. Повышение ненасыщенной витамин-В12-связывающей способности сыворотки крови при истинной полицитемии обусловлено усилением синтеза белков—носителей витамина В12 гранулоцитами, но этот критерий редко используется на практике и не включен в классификацию ВОЗ.
В классификации ВОЗ в число диагностических признаков включен гистоморфологический критерий диагноза, которому отечественная гематология придает большое значение. По достоверности и практической доступности это исследование превышает значение культурального метода исследования. Важно подчеркнуть, что оно является адекватным методом диагностики ранней доклинической стадии заболевания, протекающей с близкими к норме показателями красной крови.
Европейская группа по исследованию ХМПЗ обозначила гистоморфологические признаки истинной полицитемии, по которым можно проводить дифференциальную диагностику как с вторичными эритроцитозами, так и с другими ХМПЗ — эссенциальной тромбоцитемией и хроническим идио-патическим миелофиброзом. Согласно этим критериям, для ранней стадии истинной полицитемии характерны лишь легкое увеличение клеточности и количественная и качественная патология мегакариоцитов и их кластерное расположение. Такая же картина наблюдается и при ЭТ, поэтому дифференциальный диагноз между этими заболеваниями по морфологическим данным на этой стадии затруднителен.
Для развернутых стадий (авторы выделяют 6 стадий истинной полицитемии) характерны гиперклеточность, гиперплазия мегакариоцитарного ростка с преобладанием крупных полиплоидных форм, возможным наличием микромегакариоцитов, дилатация синусов.
Недавно появившиеся новые возможности диагностики истинной полицитемии и ее дифференциальной диагностики с вторичными эритроцитозами, такие как определение Mpl-рецептора к тромбопоэтину на тромбоцитах, экспрессия гена PRV-1 на гранулоцитах, различия в чувствительности эритроидных предшественников к ЭП и SGF, несомненно, найдут применение в ближайшем будущем.
Для практического врача полезно ознакомиться с причинами трудностей диагностики истинной полицитемии. Возможно смешение истинной полицитемии с вторичными эртроцитозами в тех 30—35 %, когда истинная полицитемия протекает без лейкоцитоза, тром-боцитоза и спленомегалии, являющихся опорными диагностическими признаками. Внешние признаки истинной полицитемии (покраснение кожных покровов и слизистых оболочек) могут быть нивелированы дефицитом железа, очень характерным для истинной полицитемии. Анализ крови при желе-зодефицитной истинной полицитемии характеризуется нормальными или сниженными показателями гемоглобина и гема-токрита при повышенном числе эритроцитов, снижением цветового показателя, гипохромией и микроцитозом эритроцитов.
МЦЭ при этом не увеличена, поэтому клинические симптомы плеторы обычно отсутствуют. В подобных случаях рекомендуется пробная терапия препаратами железа на срок в 1 мес и более, и если после этого показатели красной крови повысятся, диагноз истинной полицитемии становится очевидным.
Внешние проявления истинной полицитемии иногда нивелирует и его осложнение портальной гипертонией (ПГ) в ранней стадии истинной полицитемии и нередко еще до постановки диагноза. Большие размеры селезенки при развитии ПГ являются причиной усиления депонирования и деструкции клеток крови, сводящих на нет их гиперпродукцию.

Затрудняет установление правильного диагноза назначение лечения до уточнения природы красно-кровия: кровопускания нивелируют плетору, а цито-статическая терапия смягчает или устраняет все диагностически важные клинические и гематологические признаки.
Дифференциальный диагноз очень сложен при синдроме Бадда—Киари у лиц молодого возраста, преимущественно женщин, когда он сопровождается не только эритроцитозом, но лейкоцитозом и тромбоцитозом. Лейкемоидные реакции этого типа наблюдаются и при раковых заболеваниях, а также изредка при реноваскулярной гипертонии, обусловленной аномалией развития почечных артерий у лиц молодого возраста (мы имеем несколько подобных наблюдений). Исследование эритроидной культуры помогает расшифровке первичного заболевания.
Диагностические возможности прижизненной трепанобиопсии велики, но они зависят от качества получения биоптата, толщины срезов и применяемых окрасок. На практике редко используются окраски, дифференцирующие мелкие клетки, и методы импрегнации серебром. Результаты исследования могут зависеть от места забора костного мозга, допускается возможность отсутствия морфологических изменений костного мозга при достоверной истинной полицитемии.
В отечественной гематологии не нашло применения исследование содержания железа в костном мозге, имеющее большое диагностическое значение.
Современные достижения в диагностике истинной полицитемии все еще не внедрены в полном объеме в практику отечественной гематологии. При неустановленной причине краснокровия больные не должны подвергаться цитостатической терапии. Они должны быть взяты под диспансерное наблюдение и периодически подвергаться повторному исследованию, пока диагноз не будет поставлен.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Клиника истинной полицитемии - стадии, осложнения
Начало истинной полицитемии довольно вариабельно.
В отдельных случаях развивается нефрогенная АГ, предпосылкой к которой является осложнение уратовым диатезом и хроническим пиелонефритом, а также нарушение микроциркуляции в почках.
Между тяжестью плеторы при истинной полицитемии и величиной АГ нет прямого параллелизма. Поскольку истинная полицитемия чаще болеют лица пожилого и старого возраста, высока вероятность сопутствующей эссенциальной АГ, особенно в случаях, когда эксфузионная терапия не приводит к нормализации АД.
Для истинной полицитемии очень характерен кожный зуд, связанный с приемом водных процедур, который наблюдается у 50—55 % больных. Его объясняют повышенным образованием гистамина, однако, антигистаминные препараты неэффективны при данном синдроме, что вызывает сомнение в достоверности этого объяснения. Устранить его частично или полностью удается с помощью терапии ИФН-а.
К висцеральным осложнениям истинной полицитемии относят язвы желудка и двенадцатиперстной кишки, частота которых составляет 10—17 %, если ее рассчитывать по клиническим данным, и значительно выше, если это делать по результатам поисковой гастроскопии. Помимо язв при истинной полицитемии почти постоянно находят гиперемию слизистой оболочки и эрозии желудка и двенадцатиперстной кишки.
Нефролитиаз иногда становится главной клинической проблемой, приводит к обструкции мочеточников, вызывает осложнение хроническим пиелонефритом с последующим развитием острой и хронической почечной недостаточности (одна из реальных причин смертельного исхода в эру, предшествующую широкому применению аллопуринола с лечебной и профилактической целями).
Статистика сосудистых осложнений широко варьирует в отдельных публикациях, что объясняется различиями отбора больных, сроков наблюдения, особенностями предшествующего лечения, возрастом больных и значением дополнительных факторов риска.

По данным группы по исследованию истинной полицитемии (PVSG, США), у леченных кровопусканиями частота тромботических осложнений составила 29,2 % за все время наблюдения. У 35 % больных они явились причиной смерти. У леченных цитостатическими препаратами риск тромботических осложнений уменьшился, но не исчез полностью. В исследовании Gruppo Italiano Study Policitemia (GISP), основанном на ретроспективном анализе течения заболевания у 1213 больных, частота тромбозов сосудов составила 3,4 % в год; в 30 % они явились причиной смерти.
Тромбоз мозговых сосудов составил 70 % всех артериальных тромбозов. Частота микроциркуляторных нарушений при нелеченой истинной полицитемии составила, по данным GISP, 68—80 % всех тромбофилических осложнений.
Микроциркуляторные тромбофилические осложнения чаще всего и наиболее наглядно проявляются клинической картиной эритромелалгии. Этим термином обозначаются приступы острых жгучих болей в кончиках пальцев верхних или нижних конечностей, сопровождающиеся их резким покраснением или посинением и отеком. Боль снимается приемом аспирина, что подтверждает патогенетическую связь этого синдрома с внутрисосудистой агрегацией тромбоцитов, к которой в дальнейшем добавляются тромбообразование в артериолах, воспаление и пролиферация эндотелия.
Упорная эритромелалгия может быть предвестником тромбоза более крупного сосуда с развитием некроза пальцев ног, стоп, голеней. Они не являлись редкостью в период, предшествующий широкому применению цитостатиков и дезагрегантов тромбоцитов.
Тромбозы коронарных сосудов в процессе динамического наблюдения отмечаются у 7—10 % больных. Инфаркт миокарда может быть первым проявлением нераспознанной ИП, в том числе и у женщин, не имеющих других факторов риска. Это подтверждают и данные GISP: 30 % инфарктов миокарда пришлись на период, предшествующий постановке диагноза. Достаточно часты безболевые формы инфаркта миокарда или его атипическое течение. ЭКГ-признаки инфаркта миокарда нередко со временем полностью нивелируются.
Обращает на себя внимание высокая частота асимметрии пульсации a. dorsalis pedis на стопах, достигающая 40 %. Она не зависит от возраста. Чаще всего это тромбофилическое нарушение артериального кровообращения, протекающее клинически бессимптомно, что можно объяснить постепенным развитием окклюзии. Если боли на стороне нарушения пульсации артерии имеются, им свойствен ряд клинических особенностей, по которым можно проводить дифференциальную диагностику с атеросклеротическим поражением сосудов.
Боли жгучие, усиливаются в опущенном положении конечностей и ослабевают в приподнятом. Тепловые процедуры усиливают боль, холод и прием аспирина их уменьшают.
Симптоматика перемежающейся хромоты может наблюдаться у больных истинной полицитемией пожилого возраста, у которых тромбофилические процессы сочетаются с окклюзирующим атеросклерозом этих же сосудов. Причиной внезапных острых болей в стопе может быть эмболия из высоко расположенного артериального тромба, например из подвздошной артерии, как это было в одном нашем наблюдении.
Тромбозы поверхностных и глубоких венозных сосудов нижних конечностей обычно протекают с клинической картиной тромбофлебита, т. е. с элементами воспаления, отека, гиперемии кожи. У нелеченых больных тромбофлебит «склонен» рецидивировать и оставлять после себя бурые пятна, которые как бы «метят» больных эритремией. Нередко развиваются меланодермия нижней трети или всей голени, трофические язвы.
Тромбозы вен верхних конечностей наблюдаются редко, обычно после внутривенных инъекций или кровопусканий, т. е. после травмы сосудистой стенки. Тромбоэмболия легочной артерии, источником которой являются тромбы в глубоких венах нижних конечностей, относится к числу наиболее опасных.
При осложнении тромбозом в системе воротной вены развивается синдром портальной гипертонии с выраженной спленомегалией, варикозным расширением вен пищевода, а со временем и асцитом. Аналогичны проявления и внутрипеченочной портальной гипертонии.
К редким осложнениям истинной полицитемии относится тромбоз надпеченочных вен — синдром Бадда — Киари. Для него характерны резистентный к лечению асцит, выраженная гепатомегалия, умеренное увеличение селезенки, кровотечения из варикозно-расширенных вен пищевода и желудка, желтуха, печеночная недостаточность, резкое общее истощение больных. Возможно острое и подострое течение данного осложнения. Молодой возраст больных с данной патологией, внезапность ее развития при отсутствии анамнеза ХМПЗ у большинства пациентов в подобных случаях вызывают подозрение на реактивную природу изменений крови, что в принципе возможно. Разрешают вопрос об их происхождении культуральные исследования, и часто в пользу истинной полицитемии.
Эпизоды ишемии, особенно церебральной, обычно связаны с временной блокадой капилляров и артериол клеточными агрегатами: эритроцитарнотромбоцитарными, лейкоцитарными и смешанно-клеточными. Тромбоцитоз увеличивает риск развития всех тромбофилических осложнений, хотя прямого параллелизма между степенью тромбоцитоза и частотой сосудистых осложнений обычно не отмечают. Более чем у половины больных выявляется спонтанная агрегация тромбоцитов в кровяном русле. При числе тромбоцитов свыше 900*109/л подобный феномен является скорее правилом, чем исключением. Внутрисосудистая агрегация тромбоцитов составляет основу для микротромбообразования, при этом усиливается контакт тромбоцитов с сосудистым эндотелием.
Тромбоциты больных истинной полицитемии часто находятся в состоянии активации, о чем свидетельствует увеличение содержания в плазме крови пластиночного фактора-4, b-тромбоглобулина и тромбоксана. Ее наиболее вероятной причиной является, «болезнь хранения» (storage pool disease) с немотивированным высвобождением индукторов агрегации. В пользу эндогенной дефектности тромбоцитов свидетельствуют многочисленные функциональные нарушения тромбоцитов, в том числе и снижение индуцированной эпинефрином агрегации тромбоцитов у 80 % больных. Этот дефект характерен и для других ХМПЗ.
Снижение индуцированной адреналином, коллагеном и АДФ агрегации тромбоцитов, по нашим данным, наблюдается у 50 % больных. Данная тромбоцитопатия наряду со склонностью тромбоцитов к спонтанной агрегации, множественными дефектами структуры мембраны тромбоцитов находит объяснение в происхождении тромбоцитов из неопластического клона мегакариоцитов.
Отметим, что при истинной полицитемии наблюдается расхождение в результатах исследования функции тромбоцитов in vivo и in vitro.
По мере удлинения продолжительности заболевания дефектность тромбоцитов возрастает. Очевидно, у части больных тромбоцитопатия носит приобретенный характер. Связь частоты и характера сосудистых осложнений с числом тромбоцитов при истинной полицитемии не столь прямолинейна, как при другом ХМПЗ — эссенциальной тромбоцитемии. Это определяется более многоплановым патогенезом сосудистых осложнений при истинной полицитемии и участием в нем плеторических нарушений гемодинамики, эритроцитов и тромбоцитов.
Эритроциты оказывают стимулирующее воздействие на агрегацию тромбоцитов, что доказывает использование в качестве индуктора агрегации гемолизата собственных эритроцитов: по нашим данным, у 54 % больных с неосложненной истинной полицитемией она повышена даже при применении субпороговых доз этого индуктора.
Роль эритроцитов в гемостазе определяется следующими факторами:
• они содержат и адсорбируют из плазмы вещества и соединения, а также белковые молекулы, влияющие на агрегацию клеток, свертывание крови и фибринолиз; набор этих компонентов почти идентичен содержимому гранул тромбоцитов;
• они определяют реологические свойства крови, особенно в зонах микроциркуляции; в местах сосудистых стазов эритроциты могут агрегировать; они являются мощными индукторами агрегации тромбоцитов, причем этим свойством обладают как разрушенные, так и цельные эритроциты; эритроцитам также свойственны «реакции высвобождения».
Лейкоциты тоже принимают активное участие в гемостазе, определяемое многими факторами, в том числе их способностью взаимодействовать с тромбоцитами (феномен адгезии тромбоцитов к нейтрофильным лейкоцитам, розеткообразование). Клиническим эквивалентом усиленных клеточных взаимодействий с образованием агрегатов могут быть эпизоды периферической сосудистой ишемии, нестабильной стенокардии, нарушений зрения и др. При лейкоцитозе 50 • 109/л и более лейкоцитарно-тромбоцитарную агрегацию можно видеть в мазке периферической крови. Выявляются следующие типы клеточных взаимодействий:
1) адгезия тромбоцитов к единичному лейкоциту (клетки-"наездники");
2) попарная агрегация: 2—3 лейкоцита связываются между собой мостиками из тромбоцитов;
3) клеточная агломерация — большие скопления лейкоцитов и тромбоцитов.
Нарушение клеточной агрегации, очевидно, лежит в основе геморрагического отека.
Этим термином можно обозначить рожеподобную воспалительную гиперемию нижней трети нижних конечностей, происхождение которой неясно. Исследование агрегационной способности тромбоцитов у больных с острой стадией этого осложнения показало ее повышение при стимуляции субпороговыми дозами гемолизата эритроцитов (161 %) и ристомицином (154 %) при повышенном содержании пластиночного фактора-4 (от 52 до 82 % после агрегации тромбоцитов). Отмечено также ускоренное образование пороговых доз тромбина в аутокоагулоло-гическом тесте (АКТ), умеренное замедление Хаге-ман-зависимого фибринолиза, нормальное содержание продуктов деградации фибриногена.
Подобные изменения можно трактовать как вариант локального клеточного микротромбообразования с умеренным повышением агрегационной функции тромбоцитов.
Подтверждением клеточно-агрегационного механизма развития геморрагического отека является быстрый клинический эффект приема аспирина в суточной дозе 1 г или 0,5 г, сопровождавшийся нормализацией уровня пластиночного фактора-4. Таким образом, это также тромбофилическое микроциркуляторное осложнение истинной полицитемии. Оно всегда сопровождается мощной воспалительной реакцией, дающей повод предполагать рожу.
Развитию тромбозов артериальных сосудов способствуют дополнительные факторы. К ним относятся:
1) возраст старше 60 лет;
2) тромбоз сосудов в анамнезе;
3) артериальная гипертония (она учащает риск церебрального инсульта и инфаркта миокарда);
4) сопутствующий окклюзирующий атеросклероз любой локализации;
5) эксфузии крови, если они совершаются без предшествующего введения реополиглюкина и приема аспирина;
6) тромбоцитаферез, производимый без назначения антикоагулянтной и дезагрегантной терапии.
Кровотечения, спонтанные и спровоцированные оперативными вмешательствами, обусловлены нарушениями свертывания крови, фибринолиза и ретракции кровяного сгустка. Наблюдаются:
• замедление превращения фибриногена в фибрин пропорционально увеличению показателя гематокрита; наибольшие сдвиги наблюдаются при Ht свыше 75 %; гипокоагуляционные сдвиги в конечном звене коагуляции обусловлены антикоагулянтным эффектом увеличенной МЦЭ; потенцирует подобное действие эритроцитов относительная гипофибриногенемия, свойственная истинной полицитемии;
• нарушение ретракции кровяного сгустка, зависящее от нескольких факторов, в том числе и от функции тромбоцитов; образующаяся в процессе свертывания фибринтромбоцитарная сеть, рыхлая и крупнопетлистая, не в состоянии удерживать всю массу эритроцитов, попадающих в сгусток (известный феномен ускользания эритроцитов), этому способствует ригидность и плохая приспособляемость красных клеток к структуре сгустка при его сжатии.
Патогенез микроциркуляторной кровоточивости, клиническими проявлениями которой являются кровоточивость десен, экхимозы на коже, носовые кровотечения, определяется преимущественно снижением агрегации тромбоцитов. Наибольшая корреляция в наших исследованиях выявлена между степенью снижения агрегации на максимальные дозы гемолизата эритроцитов и выраженностью кровоточивости. Последней способствует и снижение прямого активирующего воздействия тромбоцитов на фактор X. Этот тест может быть использован для прогнозирования геморрагических осложнений у больных истинной полицитемией и другими ХМПЗ.
Многие гемостазиологические лаборатории нашей страны систематически совершают методологическую ошибку, исследуя свертывание крови в образцах цельной крови. Получаемый при этом результат всегда один: гипокоагуляция даже в момент тромботических осложнений. Исследуемую кровь нужно разводить до нормального уровня гематокрита. Малый объем плазмы и антикоагулянтный эффект увеличенных в числе эритроцитов в цельной крови объясняют неинформативность данного исследования.
Поскольку истинной полицитемией болеют и женщины молодого возраста, представляет интерес переносимость беременности и ее конечные результаты — судьба плода. Наблюдения над 14 беременными женщинами, страдающими истинной полицитемией, показали высокий риск для плода при данном заболевании матери: только 20 % рождается живыми, а в остальных случаях происходит внутриутробная гибель плода, связанная с нарушением плацентарного кровоснабжения. У принимавших аспирин в дозе 75 мг в сутки и периодическом применении низкомолекулярных гепаринов число живых новорожденных повысилось до 86 %.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Течение истинной полицитемии - гематологические исходы
Наиболее часто истинная полицитемия завершается развитием миелофиброза с миелоидной метаплазией (МММ) селезенки. Частота этого исхода составляет 15—20 %, но у проживших более 20 лет она увеличивается до 30 % и более. МММ завершает эритремическую стадию истинной полицитемии. Это естественная эволюция заболевания для всех больных, если они не умирают от тромбозов сосудов, острого лейкоза, других неоплазий, сопутствующих заболеваний и висцеральных осложнений. Продолжительность эритремической стадии в среднем составляет 10—15 лет, но не являются редкостью и более короткие, и более продолжительные ее сроки (в отдельных собственных наблюдениях до 20—25 лет).
Патоморфодинамика этого исхода хорошо изучена с помощью прижизненной трепанобиопсии подвздошной кости и пункции селезенки, патофизиология — с помощью радиологических методов исследования.
Миелоидная метаплазия селезенки (ММС) развивается еще в эритремической (2Б) стадии заболевания и со временем приводит к значительной сплено-мегалии. Обычно она носит трехростковый характер с преобладанием эритропоэза. ММС по времени возникновения опережает развитие миелофиброза.
Развитию коллагенового, определяемого при окраске гематоксилин-эозином миелофиброза предшествует ретикулиновый, для обнаружения которого используются методы импрегнации серебром по Футу и Гомори. На стадии ретикулинового миелофиброза клеточный костный мозг еще весьма гиперплазирован. Коллагеновый миелофиброз вначале сосуществует с клеточной пролиферацией, а потом подавляет ее. Дополнительное развитие остеомиелосклероза наблюдается реже, чем при ХИМФ. Патоморфологическая картина этого периода напоминает изменения костного мозга, наблюдаемые при ХИМФ в 3—4-й стадии его развития.
Это относится и к резко измененному состоянию микро- и макрососудов, мелких артерий и артериол, синусов и синусоидов стромы костного мозга.
При миелофиброзе с миелоидной метаплазией (МММ), развивающемся после истинной полицитемии, значительно меняется топография гемопоэза, что имеет диагностическое значение. Наблюдается падение захвата коллоидного 99mТс осевым скелетом и усиление захвата изотопа эпифизами трубчатых костей, селезенкой и печенью. Возможны различные варианты в степени этих изменений.
Развитие постэритремического миелофиброза происходит под влиянием фиброгенных цитокинов, главным источником которых являются патологические мегакариоциты, тромбоциты и моноциты.
Общность происхождения постполицитемического и ХИМФ отражают и данные цитогенетического исследования.

По данным A. Tefferi и соавт., частота нарушений кариотипа составила 62 % на момент первого исследования, 73 % в динамике заболевания, 90—100 % в период развития острого лейкоза. Характер выявленной цитогенетическои патологии при постполицитемическом МММ был таким же, как и при ХИМФ: 13q-, 20q-, +8, +9. В динамике любого МММ частота 13q- и 20q- значительно возрастает.
Авторы пришли к выводу, что 13q-, 20q- и +8 цитогенетическая патология не имеет плохого прогностического значения. Появление другой цитогенетическои патологии и новых субклонов обычно индуцировано предшествующей цитостатической терапией и имеет плохое прогностическое значение: определены связь между частотой развития острого лейкоза при МММ и обнаружением 5q- в 50 %, 7q- - в 30 %, 12р- — в 25 %, нарушения в хромосоме 1 — в 25 %. Случаев развития острого лейкоза у имевших 13q- не обнаружено.
Клиническая и гематологическая динамика процесса развития миелофиброза с миелоидной метаплазией (МММ) характеризуется прогрессирующим увеличением селезенки, а часто и печени (в единичных случаях гепатомегалия выходит на передний план), потерей массы тела вплоть до кахексии, нередко — появлением субфебрилитета и более высоких подъемов температуры телы у отдельных больных, повышением частоты инфекционных осложнений, проявлениями уратового диатеза, портальной гипертонии, сохранением склонности к тромбозам сосудов и экхимозам.
Большая величина селезенки определяет симптом компрессии желудка и дисфункцию кишечника, смещение левой почки. Возникновение острых болей в области селезенки определяется инфарктами селезенки с возможным развитием периспленита.
Показатели красной крови в процессе развития миелофиброза с миелоидной метаплазией (МММ) постепенно нормализуются, а затем возникает анемия с морфологическими изменениями в эритроцитах, присущими ХИМФ: пойкилоцитоз с грушевидной формой эритроцитов, анизоцитоз и нормобластемия. Характерно нарастание числа лейкоцитов и левого сдвига в лейкоцитарной формуле крови; у отдельных больных развивается лейкопения. Число тромбоцитов варьирует от высоких до низких значений.
На поздних этапах миелофиброза с миелоидной метаплазией (МММ) нередко возникает макроцитарная анемия с токсигенной зернистостью в эритроцитах, шизоцитами и кольцами Кэбота. Причиной ее развития является относительный дефицит фолиевой кислоты, а не витамина В12.
Основные причины развития анемии при постполицитемическом МММ — повышенный гемолиз эритроцитов в резко увеличенной селезенке, неэффективный эритропоэз с гибелью части эритроидных предшественников и коммитированных клеток в костном мозге, доказанной радиологическими исследованиями, подавление эритропоэза диффузным миелофиброзом и лейкемизированным миелопоэзом. К ним добавляются такие факторы, как гидремия, дефицит железа, оставшийся от эритремической стадии, относительный дефицит фолиевой кислоты. Отдельные причины часто сочетаются у одного и того же больного.
В зависимости от причин развития анемический синдром имеет различную тяжесть и прогноз от вполне благоприятного при железодефицитной до тяжелого при рефрактерной анемии и миелодисплазии, одним из вариантов которой является сидеробластная анемия.
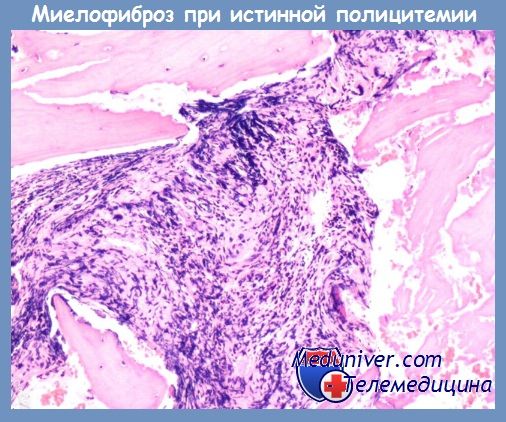
Течение постэритремической миелоидной метаплазии селезенки и миелофиброза необычайно вариабельно. У некоторых больных оно вполне доброкачественное с медленными темпами роста размеров селезенки и печени, нормальными показателями красной крови, умеренным лейкоцитозом и тромбоцитозом или без них. Подобную многолетнюю благополучную динамику заболевания можно обозначить как период стабилизации. У других больных отмечается быстрое прогрессирование спленомегалии, анемический синдром, нарастающий лейкоцитоз с малопроцентной бластемией.
Эти варианты лейкоцитоза, зрелоклеточного или напоминающего хронический миелолейкоз, с высокой вероятностью предвещают развитие миелодисплазии или острого лейкоза. Это стандартный исход истинной полицитемии, протекающей с лейкоцитозом выше 30•109/л.
Плохое прогностическое значение имеет и лейкопения меньше 3•10 9 /л, особенно если она сочетается с выраженной анемией и омоложением лейкоцитарной формулы. Подобного рода состояние, как и лейкоцитозные формы при наличии рефрактерной к лечению анемии, сопровождающееся повышением температуры тела и/или появлением геморрагического синдрома, рассматривается как миелодиспла-зия, предстадия острого лейкоза. Так же трактуются и случаи сидеробластной анемии. В этих случаях можно ожидать прогностически неблагоприятных цитогенетических находок.
Итальянские авторы рассматривают всю стадию постполицитемического МММ как предостролейкозную с вероятностью развития острого лейкоза через 3 года после ее диагностики. Если с первым положением условно можно согласиться, то это не относится к обозначенному авторами сроку, поскольку у многих больных он достаточно высокий, а часть больных и не доживает до его развития.
Манифестации острого лейкоза предшествует помимо рефрактерной анемии и нарастающего лейкоцитоза ряд признаков:
• асептическая лихорадка, продолжительность которой до диагностики острого лейкоза может составить 1—2 года;
• глубокая цитопения, в том числе и тромбоцитопения, немотивированная большой величиной селезенки и предшествующей цитостатической терапией;
• быстрый рост размеров селезенки, особенно если он сочетается с лихорадочным синдромом.
• тромбоцитемия на позднем этапе заболевания, если ее раньше не было (2 собственных наблюдения).
Манифестации острого лейкоза могут предшествовать трудно квалифицируемые дерматиты лица, глосситы, резистентность к прежде адекватному лечению. Подозрение на острый лейкоз возникает и в случаях захвата осевым скелетом 99mТс при наличии выраженного миелофиброза в гистоморфологическом препарате.
Развитие острого лейкоза возможно как в эритремической стадии заболевания, так и в стадии постэритремической ММС и миелофиброза. В последнем случае преобладают лейкоцитозные варианты с частичным вызреванием, в крови встречаются эритрокариоциты, осколки ядер мегакариоцитов. Чаще всего имеет место миелобластный вариант острого лейкоза, но возможны и наблюдались нами эритромиелоз, миеломоноцитарный и лимфобластный варианты. Для клинических проявлений острого лейкоза во всех случаях были характерны мучительные оссалгии.
К настоящему времени уже нет сомнений в том, что естественные тенденции к завершению заболевания острым лейкозом при истинной полицитемии имеются, но они выражены незначительно. У леченных цитостатическими препаратами частота развития острого лейкоза существенно возрастает, как и заболеваемость раком и злокачественными лимфомами.
По мере получения доказательств лейкозогенности цитостатической терапии стимулировались поиски новых методов лечения.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
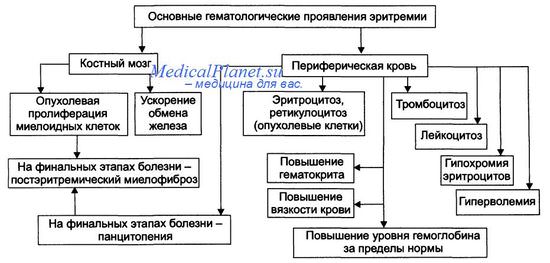
Полицитемия – хронический гемобластоз, в основе которого лежит неограниченная пролиферация всех ростков миелопоэза, преимущественно эритроцитарного. Клинически полицитемия проявляется церебральной симптоматикой (тяжестью в голове, головокружением, шумом в ушах), тромбогеморрагическим синдромом (артериальными и венозными тромбозами, кровотечениями), микроциркуляторными расстройствами (зябкостью конечностей, эритромелалгией, гиперемией кожи и слизистых). Основные диагностические сведения получают при исследовании периферической крови и костного мозга. Для лечения полицитемии применяются кровопускания, эритроцитаферез, химиотерапия.

Общие сведения
Полицитемия (болезнь Вакеза, эритремия, эритроцитоз) – заболевание группы хронических лейкозов, характеризующееся повышенной продукцией эритроцитов, тромбоцитов и лейкоцитов, увеличением ОЦК, спленомегалией. Заболевание является редкой формой лейкемии: ежегодно диагностируется 4-5 новых случаев полицитемии на 1 млн. населения. Эритремия развивается преимущественно у пациентов старшей возрастной группы (50-60 лет), несколько чаще у мужчин. Актуальность полицитемии обусловлена высоким риском развития тромботических и геморрагических осложнений, а также вероятностью трансформации в острый миелобластный лейкоз, эритромиелоз, хронический миелолейкоз.
Причины полицитемии
Развитию полицитемии предшествуют мутационные изменения полипотентной стволовой гемопоэтической клетки, дающей начало всем трем клеточным линиям костного мозга. Наиболее часто выявляется мутация гена тирозинкиназы JAK2 с заменой валина фенилаланином в 617 позиции. Иногда наблюдается семейная заболеваемость эритремией, например, среди евреев, что может свидетельствовать в пользу генетической корреляции.
При полицитемии в костном мозге присутствуют 2 вида клеток-предшественников эритроидного кроветворения: одни из них ведут себя автономно, их пролиферация не регулируется эритропоэтином; другие, как и положено, являются эритропоэтинзависимыми. Считается, что автономная популяция клеток представляет собой не что иное, как мутантный клон – основной субстрат полицитемии.
Патогенез
В патогенезе эритремии ведущая роль принадлежит усиленному эритропоэзу, следствием которого служит абсолютный эритроцитоз, нарушение реологических и свертывающих свойств крови, миелоидная метаплазия селезенки и печени. Высокая вязкость крови обусловливает склонность к сосудистым тромбозам и гипоксическому повреждению тканей, а гиперволемия вызывает повышенное кровенаполнение внутренних органов. В финале полицитемии отмечается истощение кроветворения и миелофиброз.
Классификация
В гематологии различают 2 формы полицитемии - истинную и относительную. Относительная полицитемия развивается при нормальном уровне эритроцитов и снижении объема плазмы. Данное состояние носит название стрессовой или ложной полицитемии и не рассматривается в рамках данной статьи.
Истинная полицитемия (эритремия) по происхождению может быть первичной и вторичной. Первичная форма является самостоятельным миелопролиферативным заболеванием, в основе которого лежит поражение миелоидного ростка кроветворения.
Вторичная полицитемия обычно развивается при повышении активности эритропоэтина; данное состояние является компенсаторной реакцией на общую гипоксию и может встречаться при хронической легочной патологии, «синих» пороках сердца, опухолях надпочечников, гемоглобинопатиях, при подъеме на высоту или курении и т. д. Истинная полицитемия в своем развитии проходит 3 стадии: начальную, развернутую и терминальную.
I стадия (начальная, малосимптомная) – длится около 5 лет; протекает бессимптомно или с минимально выраженными клиническими проявлениями. Характеризуется умеренной гиперволемией, небольшим эритроцитозом; размеры селезенки в норме.
II стадия (эритремическая, развернутая) подразделяется на две подстадии:
- IА – без миелоидной трансформации селезенки. Отмечается эритроцитоз, тромбоцитоз, иногда – панцитоз; по данным миелограммы – гиперплазия всех ростков кроветворения, выраженный мегакариоцитоз. Длительность развернутой стадии эритремии 10-20 лет.
- IIВ – с наличием миелоидной метаплазии селезенки. Выражены гиперволемия, гепато- и спленомегалия; в периферической крови – панцитоз.
III стадия (анемическая, постэритремическая, терминальная). Характерны анемия, тромбоцитопения, лейкопения, миелоидная трансформация печени и селезенки, вторичный миелофиброз. Возможны исходы полицитемии в другие гемобластозы.
Симптомы полицитемии
Эритремия развивается длительно, постепенно и может быть обнаружена случайно при исследовании крови. Ранние симптомы, такие как тяжесть в голове, шум в ушах, головокружение, ухудшение зрения, зябкость конечностей, расстройство сна и др., часто «списываются» на преклонный возраст или сопутствующие заболевания.
Наиболее характерной чертой полицитемии служит развитие плеторического синдрома, обусловленного панцитозом и увеличением ОЦК. Свидетельством полнокровия служат телеангиэктазии, вишнево-красная окраска кожи (особенно лица, шеи, кистей рук и других открытых участков) и слизистых (губ, языка), гиперемия склер. Типичным диагностическим признаком служит симптом Купермана – окраска твердого нёба остается нормальной, а мягкое нёбо приобретает застойный цианотический оттенок.
Другим отличительным симптомом полицитемии является кожный зуд, усиливающийся после водных процедур и иногда имеющий нестерпимый характер. К числу специфических проявлений полицитемии также относится эритромелалгия – болезненное жжение в кончиках пальцев, которое сопровождается их гиперемией.
В развернутой стадии эритремии могут возникать мучительные мигрени, боли в костях, кардиалгия, артериальная гипертензия. У 80% пациентов обнаруживается умеренная или выраженная спленомегалия; печень увеличивается несколько реже. Многие больные полицитемией замечают повышенную кровоточивость десен, появление синяков на коже, длительные кровотечения после экстракции зубов.
Следствием неэффективного эритропоэза при полицитемии является повышение синтеза мочевой кислоты и нарушение пуринового обмена. Это находит клиническое выражение в развитии так называемого уратового диатеза - подагры, мочекаменной болезни, почечной колики.

Осложнения
Результатом микротромбозов и нарушения трофики кожи и слизистых оболочек служат трофические язвы голени, язвы желудка и двенадцатиперстной кишки. Наиболее часты в клинике полицитемии осложнения в виде сосудистых тромбозов глубоких вен, мезентериальных сосудов, портальных вен, церебральных и коронарных артерий. Тромботические осложнения (ТЭЛА, ишемический инсульт, инфаркт миокарда) выступают ведущими причинами смерти больных полицитемией. Вместе с тем, наряду с тромбообразованием, больные полицитемией склонны к геморрагическому синдрому с развитием спонтанных кровотечений самой различной локализации (десневых, носовых, из вен пищевода, желудочно-кишечных и др.).
Диагностика
Гематологические изменения, характеризующие полицитемию, являются определяющими при проведении диагностики. При исследовании крови выявляется эритроцитоз (до 6,5-7,5х10 12 /л), повышение гемоглобина (до 180-240 г/л), лейкоцитоз (свыше 12х10 9 /л), тромбоцитоз (свыше 400х10 9 /л). Морфология эритроцитов, как правило, не изменена; при повышенной кровоточивости может обнаруживаться микроцитоз. Достоверным подтверждением эритремии служит увеличение массы циркулирующих эритроцитов более 32-36 мл/кг.
Для исследования костного мозга при полицитемии более информативно проведение не стернальной пункции, а трепанобиопсии. При гистологическом исследовании биоптата выявляется панмиелоз (гиперплазия всех ростков кроветворения), в поздних стадиях полицитемии - вторичный миелофиброз.
Для оценки риска развития осложнений эритремии проводятся дополнительные лабораторные тесты (функциональные печеночные пробы, общий анализ мочи) и инструментальные исследования (УЗИ почек, УЗДГ вен конечностей, ЭхоКГ, УЗДГ сосудов головы и шеи, ФГДС и др.). При угрозе тромбогеморрагических и метаболических нарушений необходимы консультации соответствующих узких специалистов: невролога, кардиолога, гастроэнтеролога, уролога.
Лечение полицитемии
С целью нормализации объема ОЦК и снижения риска тромботических осложнений первой мерой являются кровопускания. Эксфузии крови проводятся в объеме 200-500 мл 2-3 раза в неделю с последующим восполнением удаленного объема крови физиологическим раствором или реополиглюкином. Следствием частых кровопусканий может явиться развитие железодефицитной анемии. Кровопускания при полицитемии могут быть успешно заменены эритроцитаферезом, позволяющим извлечь из кровотока только эритроцитарную массу, вернув плазму.
В случае выраженных клинико-гематологических изменений, развития сосудистых и висцеральных осложнений прибегают к миелодепрессивной терапии цитостатиками (бусульфан, митобронитол, циклофосфамид и др.). Иногда проводится терапия радиоактивным фосфором. Для нормализации агрегатного состояния крови назначаются гепарин, ацетилсалициловая кислота, дипиридамол под контролем коагулограммы; при геморрагиях показаны трансфузии тромбоцитов; при уратном диатезе - аллопуринол.
Прогноз
Течение эритремии носит прогрессирующий характер; заболевание не склонно к спонтанным ремиссиям и самопроизвольному излечению. Больные пожизненно вынуждены находиться под наблюдением гематолога, проходить курсы гемоэксфузионной терапии. При полицитемии высок риск тромбоэмболических и геморрагических осложнений. Частота трансформации полицитемии в лейкоз составляет 1% у пациентов, не проходивших химиотерапевтическое лечение, и 11-15% у получавших цитостатическую терапию.
Читайте также:

