Кожные заболевания у животных чем лечить
Обновлено: 24.04.2024
Рассмотрена проблема возникновения демодекоза, обсуждена роль клеща Demodex в формировании папул и пустул на коже лица, приведены методы диагностики и подходы к лечению пациентов, меры профилактики.
The problem of demodecosis occurrence was considered, the role of Demodex tick in formation of papula and pustula on the skin of the face was discussed, methods of the diagnostics and approaches to the treatment of the patients were given, as well as the preventive measures.
Папулопустулезные дерматозы, основной локализацией которых является кожа лица (акне, розацеа, периоральный дерматит), остаются актуальной проблемой в дерматовенерологии. Среди различных причин возникновения этих заболеваний определенная роль отводится паразитарной теории [1]. Согласно ей, формированию папул и пустул на коже лица способствует клещ-железница (Demodex). Клещ принадлежит роду Demodex, семейству Demodicidae, подотряда Trombidiformes, отряда Acariformes. Впервые клеща выявил F. Berger в ушной сере слухового прохода человека в 1841 году, в том же году F. Henle обнаружил клеща на коже человека. Через год, в 1842 году, G. Simon установил наличие паразита в волосяных фолликулах и впервые описал морфологические свойства, назвав их Acarus folliculorum (от греч. — «сальное животное»). Позже G. Simon (1842) и R. Owen (1843) отнесли найденных клещей к роду Demodex. Намного позднее, более чем через полвека, английский акаролог S. Hirst (1917–1923) выделил 21 вид и несколько подвидов клещей рода Demodex у животных. Впоследствии, изучая паразитирование клеща на коже человека, Л. Х. Акбулатова (1970) обнаружила и описала две формы: Demodex folliculorum longus и Demodex folliculorum brevis [2].
Демодекоз (Demodecosis) — распространенное хроническое заболевание, преимущественно кожи лица. По разным данным, заболеваемость демодекозом составляет от 2% до 5% и стоит на седьмом месте по частоте среди кожных болезней [3, 4]. В структуре акнеформных дерматозов демодекоз составляет 10,5% [5]. Частота осложнений демодекозом у больных розацеа встречается в 88,7%, а периоральным дерматитом в 58,8% случаев [6].
Клещи рода Demodex одинаково распространены среди всех рас и всех возрастных групп [7]. Описаны редкие случаи обнаружения клеща у новорожденных [8], и в целом у детей регистрируется невысокий уровень обсемененности. По всей вероятности, это связано с более низкой выработкой кожного сала у детей по сравнению с взрослыми людьми [9]. Так, у пациентов моложе 20 лет распространенность клещей Demodex составляет 13–20%, а к 70 годам увеличивается до 95–100% [6]. У больных после 45 лет активность клещей поддерживается возрастными изменениями кожи и желез, климактерическими гормональными перестройками, а также различной соматической патологией. Наибольшее количество случаев поражения демодекозом отмечается у людей в возрастной группе 20–40 лет [10]. В лабораторных исследованиях Demodex folliculorum longus выявляется чаще, чем Demodex folliculorum brevis [1], в соотношении у мужчин — 4:1, у женщин — 10:1 [11].
Этиология и патогенез демодекоза
Как демонстрируют многие исследования, даже при наличии на кожном покрове клещей, клиническая картина заболевания развивается не всегда. Исходя из этого, можно утверждать, что клещи рода Demodex являются условно-патогенными паразитами [7]. До настоящего времени не установлены точные причины, приводящие к патогенности клещей рода Demodex, существующие теории разнообразны и противоречивы [12].
Самое распространенное мнение, что одним из пусковых факторов развития заболевания является нарушение микрофлоры кожного покрова. Следуя данной теории, развитию патогенности клеща благоприятствуют изменения функций сальных желез с последующим изменением состава кожного сала и микробиоценоза, что приводит к дисбактериозу кожи. Пусковым фактором для развития заболевания является нарушение симбиоза коринобактерий и условно-патогенной микрофлоры [5], а также усиление микробной колонизации вследствие изменения количества поверхностных липидов [13].
Согласно мнению многих авторов, успех терапии метронидазолом, не обладающим прямым антипаразитарным действием, связан с тем, что Demodex проявляет свои патогенные свойства в качестве переносчика микробов и вирусов в более глубокие отделы волосяных фолликулов и сальных желез [14]. Дополнительным фактором для развития воспалительного гнойно-некротического процесса является возможность занесения патогенных пиококков и Pityrosporum spp. в глубокие слои фолликул и сальных желез при перемещении клещей [14, 15].
Заслуживают внимания и другие теории развития воспаления в коже при демодекозе. Бацилла (Bacilluss oleronius), найденная на поверхности клеща, в результате своей жизнедеятельности способна повышать активность самих клещей, а также стимулировать другие микроорганизмы (стрептококки, стафилококки, Propionibacterium acnes, грибы рода Malassezia) [16], вырабатывать провоспалительные белки 62-Da и 83-Da, запуская каскад иммунных реакций [17].
Благоприятным фактором для возникновения демодекоза является наличие очагов хронической инфекции, нарушения функций желудочно-кишечного тракта, печени, нервной системы, эндокринных желез, длительного применения топических кортикостероидов [18–20]. Многими авторами отмечена связь подъема заболеваемости в весенне-летний период с повышенной инсоляцией, изменением температуры внешней среды [18]. Скорее всего, это можно объяснить тем, что выработка витамина D под действием ультрафиолетового излучения вызывает повышенный синтез кателицидинов (LL-37), поддерживающих активность воспалительного процесса [21, 22].
Большую роль в развитии инвазии клещами рода Demodex играет реактивность иммунной системы. Ряд авторов показали, что Demodex folliculorum встречается чаще у пациентов декретированных групп, например, при гемодиализе и Т-клеточных лимфомах [23], первичном или вторичном иммунодефиците [24], вирусе иммунодефицита человека, острой лимфобластной лейкемии и других злокачественных новообразованиях [25], после кортикостероидной [26] или цитостатической терапии [27].
Фактором для развития клещевой инвазии, поддержания активности патологического процесса, а также неэффективности проводимой терапии, по мнению большинства авторов, является дисбаланс в цитокиновом каскаде [3, 13, 28–30]. Обнаружено наличие инфильтратов вокруг клещей Demodex из эозинофилов и типичных гранулем, состоящих из CD4+ Т-хелперов [31], повышение готовности лимфоцитов к апоптозу и увеличенное количество NK клеток с Fc-рецепторами [32], снижение абсолютного числа лимфоцитов и увеличение уровня IgM [33].
Клиническая картина заболевания
Источником заражения демодекозом является человек (больной или носитель) и домашние животные. Клещи паразитируют у собак, лошадей, крупного рогатого скота. Демодекоз может быть первичным и протекать как самостоятельное заболевание и вторичным, как следствие уже имеющихся болезней кожи (розацеа, периоральный дерматит, себорейный дерматит и др.) [34].
Основная локализация клещей — сальные железы кожи лица, ушных раковин, спины, груди, мейбомиевые железы, фолликулы кожи в области сосков, редко — в области спины [2]. Атипичные локализации, где может быть найден Demodex, — половой член, ягодицы, эктопические сальные железы, слизистая оболочка рта. N. Stcherbatchoff (1903), обнаружив клещей в ресничных фолликулах век человека, доказала роль клеща в развитии блефаритов и блефароконъюнктивитов. Этиопатогенетическое влияние клещей при заболеваниях глаз достаточно велико и в настоящее время описывается многими авторами [35].
Заболевание возникает внезапно. Субъективно у больных появляются ощущения зуда, жжения, ползания, распирания и жара. Патологический кожный процесс локализуется преимущественно в области Т-зоны лица. Классические клинические проявления демодекозной инфекции — Pityriasis folliculorum, сопровождаются ощущениями зуда и жара, кожа становится истонченной, приобретая вид папирусной бумаги [1]. Акнеформный тип характеризуется преобладанием папул на коже лица, а наличие папулопустулезных элементов и диффузной эритемы говорят о розацеоподобном типе [1]. Клиническая картина demodicosis gravis имеет схожесть с гранулематозной формой розацеа, также характеризующейся наличием гранулем в дерме [1].
Интересно, что разные виды клеща вызывают различную клиническую картину, что связано, предположительно, с размерами самих клещей. При обнаружении Demodex folliculorum чаще наблюдается эритема и десквамация эпителия, при выявлении Demodex brevis — симметричные папулопустулезные элементы [36].
При поражении глаз отмечается гиперкератоз с наличием чешуек на ресничном крае и «воротничка» вокруг ресниц [37, 38]. Пациенты жалуются на чувство зуда и ощущение инородного тела в глазах [39].
В научной литературе существует предположение о роли Demodex в формировании андрогенной алопеции [40]. Возможно, механизм развития облысения связан с формированием инфильтрата в волосяном фолликуле, вызванным присутствием клещей Demodex. Активированные воспалением Т-лимфоциты индуцируют синтез коллагена, что, в конечном счете, приводит к фиброзному перерождению волосяного фолликула [35].
Длительное хроническое течение демодекоза характеризуется утолщением кожи, чувством стягивания, уменьшением эластичности и мягкости, наличием серозных или кровянисто-гнойных корочек. Присоединение вторичной пиококковой инфекции сопровождается возникновением крупных пустул, нодулярных элементов, макроабсцессов, что может приводить к обезображиванию лица [34].
Диагностика демодекоза
Диагностика демодекоза может проводиться несколькими методами. Лабораторная диагностика является наиболее простым методом. В ходе нее составляется акарограмма, которая основывается на подсчете личинок, нимф, яиц и имаго. Клеща возможно обнаружить на поврежденном участке кожи, при экстракции содержимого фолликула или извлечении ресниц или бровей без повреждения волосяных фолликулов [41]. Исследуемый материал помещают на предметное стекло с 10% раствором щелочи (с целью определения активности клещей применяют глицерин), накрывают предметным стеклом и просматривают под малым увеличением микроскопа. Для более точного микроскопического подсчета обнаруженных клещей рекомендуется добавлять в исследуемый материал раствор красителя флюоресцеина [42]. Микроскопический метод является единственным для определения наличия клещей в волосяных фолликулах. Критерием клещевой активности служит количество более 5 взрослых особей, личинок или яиц на 1 см2 [34]. При диагностике демодекоза ресниц нормой считается обнаружение одного клеща на 2–4 ресницах [43].
Преимущество методики заключается в возможности анализа сразу нескольких участков поражения, а также извлечении клещей не только с поверхности кожного покрова, но и непосредственно из сальных желез. Здесь возникает другая проблема — не всегда удается добраться до клещей в глубине сальных желез. В связи с этим соскоб не является высокоинформативным методом и не доказывает отсутствие клещей [44]. К недостаткам метода также относятся травматизация эпителия, обследование небольших по величине участков поражения, относительная болезненность процедуры и дискомфорт пациентов после эпиляции [45].
Для оценки проводимой терапии делают повторные акарограммы, с целью подсчета количества и определения активности клещей [45]. Если в соскобе обнаружены исключительно продукты жизнедеятельности и пустые яйцевые оболочки, проводят повторное исследование, т. к. в процессе лечения Demodex перемещается в зоны, необработанные акарицидными средствами. В таких случаях чаще всего клещи локализуются у кромки волосистой части головы [5].
Другим модифицированным методом диагностики является проведение поверхностной биопсии («скотч-проба») [44]. На обезжиренное покровное стекло наносят каплю клея цианокрилата (БФ-6, сульфакрилат), затем приклеивают к пораженной поверхности на 1 минуту. Во втором варианте используют скотч, размером 1 см 2 , который после снятия приклеивается к покровному стеклу. При удалении покровного стекла или скотча на их поверхности остается слой эпидермиса, содержимое сальных желез с имеющимися там клещами. Затем наносится раствор щелочи, накрывается поверх покровным стеклом и рассматривается под микроскопом на малом увеличении. В сравнении с прямым микроскопическим исследованием данный метод позволяет диагностировать демодекоз в большем числе случаев [46]. Преимущество метода — это проведение процедуры на любом участке кожного покрова, а также простота применения. Травматизация эпителия, трудность получения материала с крыльев носа, неполная стерильность получаемых препаратов являются недостатками метода [45].
М. В. Камакина (2002) выявила достоверную статистическую вероятность отрицательного результата лабораторного анализа на наличие клещей на коже при выраженной клинической картине заболевания, которая составила 1,5% [47]. Следовательно, лабораторные методы не являются абсолютно достоверными.
Более информативным методом диагностики демодекоза является проведение кожной биопсии с последующей гистологией полученных препаратов. С этой целью пункционным (панч) или эксцизионным (скальпель) методом берут небольшой участок кожи, фиксируют его в течение суток 10% нейтральным раствором формалина, уплотняют парафином и окрашивают гематоксилин-эозином. Гистологическое исследование дает массу преимуществ. В частности, можно полностью посмотреть сальную железу и окружающие ее участки. При ретроспективном патоморфологическом исследовании биоптатов кожи головы в 15% случаев наблюдалось сочетание демодекоза с грибковыми, воспалительными поражениями, невусами, фиброзом [48]. Главным недостатком метода является травматизация кожи с образованием рубца, а также невозможность обследования большой поверхности кожного покрова [45].
В качестве диагностического инструмента для выявления Demodex R. Segal и соавт. (2010) предложили использовать дерматоскоп. Метод дерматоскопии позволяет визуализировать клещей на поверхности кожного покрова, а также расширенные сосуды кожи [49]. Другим неинвазивным методом оценки наличия клещей Demodex является применение оптической когерентной томографии, позволяющей в режиме реального времени оценить состояние кожи больных в двух проекциях [50].
С появлением конфокального лазерного микроскопа стал доступен новый метод обследования больных на наличие клещей Demodex. Конфокальная лазерная сканирующая микроскопия позволяет визуализировать поверхностные слои кожного покрова in vivo, а также получить объемное четырехмерное изображение [51]. Преимуществами метода является высокая информативность, неинвазивность и, как следствие, отсутствие дискомфорта у пациентов.
Лечение демодекоза
При выборе терапии демодекоза необходимо учитывать клиническую картину заболевания, тяжесть процесса, а также сопутствующую патологию пациента [52, 67–69].
До сих пор на протяжении многих лет самым эффективным препаратом в терапии демодекоза остается метронидазол, являющийся производным нитроимидазольной группы [53]. Метронидазол обладает выраженным противовоспалительным [22], противоотечным [54], иммуномодулирующим действием [55]. Стандартная схема лечения метронидазолом — 250 мг 3 раза в день в течение 2–4 недель [52].
Другим препаратом выбора является орнидазол, назначаемый по схеме 500 мг два раза в день курсами по 10 дней [52]. Препарат имеет как противопаразитарное, так и бактериостатическое действие, повышает активность нейтрофилов, стимулирует адренергические структуры, усиливает репаративные процессы [52, 56].
Наружная терапия также должна включать антипаразитарные средства. Наиболее часто используется метронидазол (Клион, Метрогил) в виде мази или геля 2%, применяемый в течение 14 дней. В качестве альтернативной терапии возможно применение мази бензилбензоат [1, 10, 43, 57].
С целью достижения элиминации клещей назначают акарицидные препараты. Из фармакологической группы пиретроидов, обладающих антипаразитарными свойствами, доказал свою эффективность перметрин [4, 58]. Небольшое количество мази тонким слоем наносят на пораженные участки кожи. Мазь смывают водой через 24 часа. В большинстве случаев достаточно однократного применения, но при недостаточной эффективности (появление новых элементов сыпи, сохранение зуда) процедуру рекомендуется повторить через 14 дней.
Хорошо переносится и не вызывает серьезных нежелательных лекарственных реакций препарат Спрегаль, содержащий раствор эсдепалетрина и пиперонила бутоксида [18, 59].
При наличии папулопустулезных высыпаний показано назначение классических редуцирующих мазей и паст (цинк-ихтиоловая [60], 1–2% дегтярная и 1–2% ихтиоловая мази, 1% ихтиол-резорциновая паста) [61].
Некоторые авторы высоко оценивают терапевтическую эффективность геля Демотен (сера, гиалуроновая кислота, сок алоэ вера, поливинилпирролидон) [62].
Однако, несмотря на успешную терапию с применением классических средств, в практике дерматовенеролога все чаще встречаются резистентные к терапии и рецидивирующие формы демодекоза. В связи с этим разрабатываются новые методы и методики лечения. Например, Л. Р. Беридзе (2009) рекомендует использовать сочетанную методику криотерапии с кремом Розамет (метронидазол 1%) [57].
В случае акнеформного типа демодекоза или резистентности к антипаразитарным препаратам целесообразно использовать системные ретиноиды (изотретиноин) в дозировке 0,1–0,5 мг/кг массы тела в сутки в течение 2–4 месяцев [63].
При лечении демодекоза глаз используются антихолинэстеразные средства (холиномиметики): физостигмин, 0,02% фосфакол, 0,01% армин, 0,5% тосмилен [38]. Хорошие результаты лечения наблюдаются при применении Блефарогеля 1 и 2, Блефаролосьона [64].
Из физиотерапевтических методик рекомендуется использовать свойства узкополосного синего света (405–420 нм). Длины волн голубого света несколько больше длин волн ультрафиолетового излучения, поэтому узкополосный синий свет достигает сетчатого слоя дермы, проникая на глубину до 2,5 мм, соответствующей расположению сальных желез. Единичные наблюдения свидетельствуют о высокой эффективности данного метода при лечении акне, осложненных демодекозом [65].
Меры профилактики сводятся к соблюдению общегигиенических правил, адекватного и рационального ухода за кожей лица, полноценного питания и отдыха. Важно применение защитных средств против ультрафиолетового излучения, а также ограничение пребывания на солнце [66].
Таким образом, несмотря на то, что демодекоз часто встречающееся заболевание, до сих пор не раскрыты этиологические факторы, приводящие к патогенности клеща, и не установлен точный механизм развития воспаления кожи, не оценена роль Demodex в возникновении воспалительных дерматозов на коже лица. Противоречивость мнений различных авторов вызывает много споров и вопросов, требующих дальнейшего исследования. Лечение антипаразитарными средствами не всегда эффективно и часто провоцирует развитие хронически резистентных к терапии форм.
Литература
А. А. Кубанов, доктор медицинских наук, профессор
Ю. А. Галлямова, доктор медицинских наук, профессор
А. С. Гревцева 1

Кожные заболевания животных – частая проблема владельцев. Любое изменение в рационе питомца, уходе, условиях содержания может негативно сказаться на состоянии его кожи и шерсти. Многие кожные болезни кошек сходны между собой по симптомам, но различаются по причине возникновения.
Основные симптомы кожных болезней:
- Кожный зуд;
- Покраснения и шелушения;
- Выпадение шерсти;
- Перхоть;
- Гнойники и язвы.
Кожные заболевания разнообразны, и к каждому нужен свой подход в лечении. На первый взгляд трудно определить, что за причина вызвала болезнь у любимца. Перед тем, как назначить лечение, питомца обследуют. В этом вам поможет ветеринарный врач-дерматолог. А мы в свою очередь расскажем о часто встречающихся заболеваниях кошек, которые сопровождаются кожными проявлениями.
Дерматиты у кошек
Дерматиты – наиболее распространённые заболевания кожи у кошек. Дерматит проявляется на коже в виде маленьких плотных узелков и корочек, вызывающих зуд у питомца. Причинами поражения кожи могут стать:
- Эктопаразиты (блохи, власоеды, чесоточные клещи);
- Грибковые инфекции (микроспория, трихофития);
- Бактериальные инфекции;
- Аллергические реакции;
- Нарушение обмена веществ.
Далее расскажем о видах дерматитов, способах их диагностики и лечения.

Блошиный дерматит
При укусе животного блохи выделяют слюну, содержащую большое количество антигенов. Антигены способны вызвать у кошки аллергическую реакцию в виде дерматита. Многие животные заражены блохами, но дерматит у них не развивается. Однако некоторые питомцы чувствительны к компонентам слюны паразитов, поэтому у них проявляются симптомы заболевания.
Обычно блошиный дерматит развивается у кошек в возрасте до трёх лет. Питомцы постоянно чешутся, разлизывают и выкусывают поражённые места. На коже кошки заметны покраснения, нарывы, язвочки, можно заметить самих паразитов. Если блох не видно, то с помощью щётки с частыми зубьями расчешите шерсть питомца над мокрой белой тканью или бумагой, таким способом вы сможете обнаружить экскременты паразитов, которые оставляют отпечатки в виде красных точек.
При лечении этой болезни применяются специальные средства, которые удаляют блох с животного и защищают его от повторного заражения. Кроме того, следует обработать помещение, в котором живёт питомец, а также всех животных в квартире. Также для снятия зуда назначают антигистаминные и гормональные препараты.
Атопический дерматит
Атопический дерматит – это хроническое воспалительное поражение кожи. Его вызывают аллергены из окружающей среды. Это заболевание связано с усиленной реакцией организма на какие-то определённые вещества (пыль, пыльцу растений, плесень). При атопическом дерматите у кошек наблюдается сильный зуд, расчёсы, сыпь на коже, выпадение шерсти. В случае занесения в рану инфекции возникают гнойнички. Кожные проявления находятся в области головы, шеи, ушей или в нижней части живота, между бёдрами, на груди. Данный вид дерматита проявляется сезонно и чаще всего поражает питомцев в возрасте от 1 до 3 лет.
Есть ли у питомца атопический дерматит, определит ветеринарный врач после проведения аллергических тестов. После определения вида аллергена следует оградить питомца от него, что иногда сделать невозможно. В таком случае хозяева замечают, что питомцу стало лучше лишь после переезда в другую местность, например, за город.
Лечение назначает ветеринарный врач после осмотра питомца и постановки диагноза. Оно сводится к устранению или уменьшению кожного зуда и воспаления. Если оградить питомца от аллергена нет возможности, то лечение ведётся всю жизнь.
Экзема у кошек
Экзема – это заболевание поверхностных слоёв кожи воспалительного характера. Экзема бывает сухая и мокрая, острая и хроническая.
Причин возникновения экземы множество:
- Травмы, укусы, расчёсы;
- Ожоги и обморожения;
- Загрязнение кожи;
- Несбалансированное питание;
- Аллергические реакции;
- Гормональные нарушения;
- Наследственная предрасположенность;
- Болезни обмена веществ;
- Заболевания внутренних органов (почек, печени, ЖКТ).
В начале заболевания наблюдается покраснение кожи и зуд. Кожа в месте поражения горячая. Питомец начинает расчёсывать болячку, оставляя царапины, в которые проникают бактерии. Эти бактерии вызывают образование узелков, пузырьков, заполненных жидкостью. При сухом виде экземы пузырьки рассасываются и подсыхают, кожа начинает шелушиться, образуются корочки. При мокнущем виде экземы пузырьки лопаются, жидкость вытекает наружу, эти участки инфицируются гноеродными бактериями, в результате образуются гнойники. Поражённое место опухает, воспаляется, становится болезненным и постоянно мокнет. Часто кожа больного животного имеет неприятный запах.
Сухая экзема встречается при хронической форме заболевания и трудно поддаётся лечению. Мокнущая экзема протекает в острой форме, на начальном этапе лечится довольно легко. Однако иногда болезнь возвращается вновь и вновь, если хозяин питомца пренебрегает советами лечащего врача.
Лечение экземы следует начинать как можно скорее, для этого при малейших признаках поражения кожи обратитесь к ветеринарному специалисту. Шерсть вокруг поражённых участков выстригают, кожу обрабатывают антисептиками и специальными мазями. Применяют гормональные препараты, иммуностимуляторы, седативные средства, антибиотики. Огромную роль в избавлении от этого заболевания играет правильный рацион, в который включают витаминно-минеральные комплексы.
Грибковые заболевания кожи
Грибковые заболевания кожи называются дерматомикозами. Причина дерматомикозов – микроскопические грибки, которые поражают кожу, шерсть и когти животного. У кошек паразитируют несколько видов возбудителей. Наиболее часто кошек поражают грибки, которые вызывают микроспорию и трихофитию. Общее название этих заболеваний – стригущий лишай.
Стригущий лишай у кошек
Стригущий лишай – это инфекционное грибковое заболевание, опасное для человека и других животных.
Кошка заражается через контакт с больным животным, через общие предметы ухода, миски, игрушки. Споры грибка можно принести на обуви, на одежде, поэтому даже у кошек, не выходящих на улицу, существует риск заражения. Чаще всего болезнь поражает молодых животных с ослабленным иммунитетом, питомцев, переболевших вирусными или онкологическими заболеваниями. Также способствует развитию болезни некачественный несбалансированный рацион.
Лишай выглядит как небольшие облысевшие пятна чаще всего округлой формы. Эти участки обычно располагаются на голове, конечностях, хвосте питомца. В центре пятна облысения кожа краснеет и начинает шелушиться. Кошка вылизывает и расчёсывает поражённые места, тем самым разнося грибок по всему телу. Иногда на поражённом участке появляются гнойнички, корочки, чешуйки, напоминающие перхоть. Если вовремя не начать лечение, то лишай может охватить большую часть тела животного.
Стригущий лишай у кошек диагностируют на основании клинических признаков, осмотра мест поражения в свете ультрафиолетовой лампы, а также при помощи микроскопии соскобов кожи и посева грибковой культуры.
Если очагов поражения на животном мало, применяют местное лечение противогрибковыми мазями и антисептическими растворами. Если лишай перешёл в тяжёлую форму, лечение проводят с применением оральных противогрибковых препаратов, антибиотиков, лечебных вакцин.
Основой профилактики стригущего лишая является ежегодная вакцинация питомцев. Особенно важны прививки для животных, которые содержатся группами, так как одна заболевшая кошка может заразить остальных. Также большое значение для профилактики заражения болезнью имеет соблюдение правил гигиены и полноценный рацион.
Чесотка у кошек
Чесотка у кошек – это заразное заболевание, возбудителем которого является микроскопический клещ. Заболевание сопровождается сильным зудом, выпадением шерсти, появлением ранок и нарывов на коже. Больное животное становится беспокойным.
Чесоточные клещи сначала поражают область головы и шеи. Паразиты, попадая на кожу питомца, формируют ходы, в которых самка клеща откладывает яйца. Клещи активно размножаются и со временем могут поразить всё тело питомца. Молодые животные с ослабленным иммунитетом, а также сильно истощённые – наиболее подвержены заболеванию.
Диагноз ставит ветеринарный врач после осмотра животного и взятия глубокого соскоба кожи, после постановки диагноза ветеринар назначает лечение.
Прежде всего, больную кошку изолируют от других животных и членов семьи, чтобы предотвратить распространение заболевания. Далее питомца следует вымыть, при необходимости выстричь шерсть. Для лечения применяют антипаразитарные препараты, антибиотики, курсы витаминов для укрепления иммунитета.
Профилактика кожных заболеваний у кошек
Несмотря на большое количество видов кожных заболеваний у кошек, можно выделить несколько общих профилактических мероприятий, направленных против их возникновения:
- Следите за гигиеной питомца, поддерживайте в чистоте место отдыха животного, тщательно мойте миски и предметы ухода;
- Кормите кошку качественными сбалансированными кормами, включайте в рацион витаминно-минеральные добавки;
- Своевременно обрабатывайте питомца противопаразитарными препаратами.
Соблюдайте эти правила, и ваша кошка всегда будет иметь здоровый внешний вид и не заболеет. Желаем вашему питомцу здоровья!

Заболевания кожного покрова питомца доставляют дискомфорт не только животному, но и владельцу. Некоторые виды инфекционных заражений представляют опасность для всех членов семьи. Поэтому если ваш питомец заболел, рекомендуем незамедлительно обратиться в специальное утверждение. Ветеринарная клиника в Симферополе предлагает широкий спектр услуг по лечению различных видов нарушений кожного покрова у животных
Наиболее распространенные кожные заболевания у домашних животных:
- Стригучий лишай, вызываемый грибком.
- Чесотка или демодекоз, появляется в результате заражения животного микроскопическим клещом.
- Дерматит – воспаление поверхностных слоев кожи, появляется в результате ожогов, обморожения, травмы, воздействия химических веществ и др.
- Экзема – воспаление кожи в виде красной сыпи, пузырьков и папул.
- Перхоть или себорея, чаще возникает из-за неправильно подобранного средства по уходу за шерстью питомца
Важно помнить, что симптомы при дерматологических заболеваниях очень схожи, поэтому не следует лечить животное самостоятельно и спешить покупать препараты, которые могут навредить вашему питомцу. Установить точный диагноз может только ветеринар – дерматолог, при помощи несложных манипуляций и лабораторных исследований.
Типичные симптомы нарушений кожных покровов у животных
- Наличие зуда, язвочек, рубцов, облысение на участках кожного покрова.
- Снижение аппетита, апатия, и наоборот, чрезмерная возбудимость в поведении.
- Причины возникновения:
- Раздражение или травмирование кожи.
- Наличие паразитов, кровососов (блохи, клещи, власоеды и др.)
- Аллергические реакции, несбалансированное питание, нехватка витаминов.
- Контакт с другим заражённым животным.
- Укусы насекомых, носящих стрептококки.
Ветеринарная клиника AVVA всегда готова помочь вашему питомцу, круглосуточно и без выходных. Диагностика и лечение может занять некоторое время. Будьте готовы пройти необходимые процедуры и анализы, их результат поможет ветеринару диагностировать заболевание. Далее специалист даст правильные рекомендации как лечить домашнее животное и назначит эффективные препараты.
Не занимайтесь лечением питомцев самостоятельно.
Обратитесь к нашим специалистам, которые правильно поставят диагноз
и назначат лечение.
Что такое болезнь кошачьих царапин (фелиноз)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Агапова Сергея Анатольевича, дерматолога со стажем в 39 лет.
Над статьей доктора Агапова Сергея Анатольевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов
Определение болезни. Причины заболевания
Болезнь кошачьих царапин (лихорадка от кошачьих царапин, фелиноз или регионарный небактериальный лимфаденит) — это острая бактериальная зоонозная инфекция, передающаяся преимущественно от кошек. Она характеризуется региональным лимфаденитом (воспалением лимфоузлов), кожной сыпью и иногда поражением глаз, нервной системы и внутренних органов. [1]
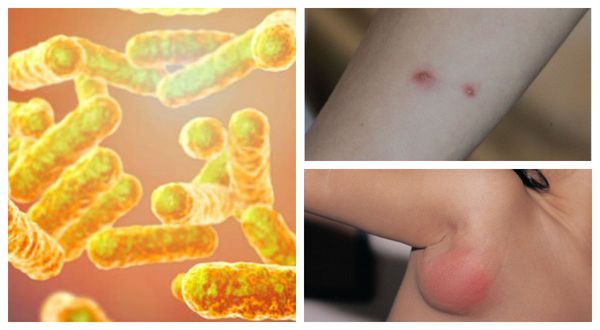
Причиной заболевания является инфицирование бактерией Bartonella henselae (бартонелла хенсели), которая была выделена у людей и млекопитающих и представляет собой мелкую плеоморфную, факультативную, грамотрицательную и внутриклеточную бациллу.
Источники инфекции
Кошки являются естественным резервуаром и переносчиком B. henselae, при этом сами животные от этого не страдают. В ряде исследований, проведённых в США, у 28% обследованных кошек были обнаружены антитела против причинной бактерии, причём из них 56% котят моложе года и 34% кошек от года и старше обладали иммунитетом к бациле. Также исследование показало, что у бездомных кошек (61%) B. henselae в крови выявлялись гораздо чаще, чем у домашних (21%). [2]
Котята моложе 12 месяцев в 15 раз чаще передают инфекцию, чем взрослые кошки, из-за наличия бактерии B. henselae в крови и большей склонностью к нанесению царапин.
Передача инфекции между кошками происходит при укусах кошачьей блохи Ctenocephalides felis или заглатывании их продуктов жизнедеятельности. Поэтому люди, у которых дома есть хотя бы один котёнок с блохами, имеют в 29 раз больше шансов заразиться бацилой, чем те, у чьих животных в шерсти не было блох. [3]
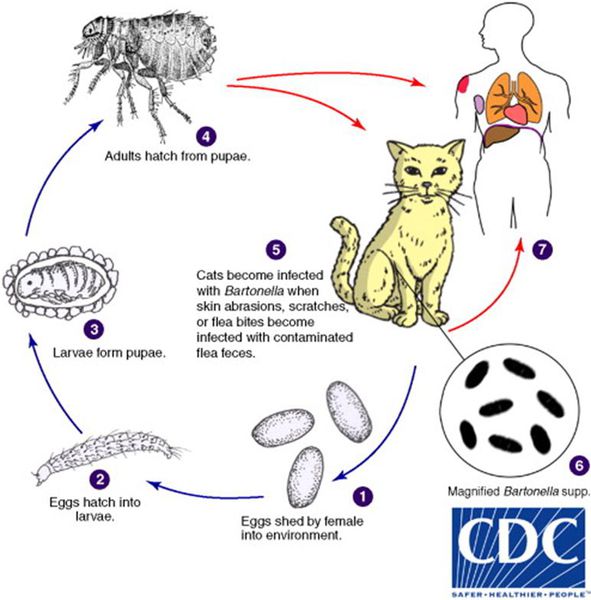
Собаки также являются источником заражения, но гораздо реже, чем кошки — всего в 5% случаев. [4] Также сообщается о единичных случаях возникновения заболевания при контактах людей с морскими свинками, кроликами и обезьянами. [1]
Помимо прочего, доказана роль в передачи инфекции иксодового клеща Ixodes ricinus (собачий клещ), который часто нападают и на людей. [5] Описан случай семейного заражения бартонеллами при их укусах. [6]
Варианты передачи инфекции человеку при укусах кошачьих блох и от человека к человеку не подтверждены. [2]
Пути передачи инфекции:
- Царапины. 75-90% пациентов с фелинозом незадолго до появления заболевания отмечали поверхностную травму кожи при контакте с кошкой. Дело в том, что блохи, находясь на животном, выделяют экскременты, которые содержат бактерии. Когда кошка царапает свою кожу (например, при почёсывании), её коготь загрязняется отходами жизнедеятельности, и в дальнейшем при нанесении травмы человеку происходит передача инфекции. [1]
- Укусы и ослюнения травмированной кожи — связаны с нахождением бактерий в слюне животных. [1]
Распространенность заболевания в мире и в Российской Федерации не известна. Заболеваемость в США среди амбулаторных пациентов составляет приблизительно 9,3 случая на 100 000 человек в год, причём ежегодно регистрируется до 20 000 новых случаев. [7] Примерно 70-90% случаев заболевания происходят в осенние и ранние зимние месяцы. Предполагается, что сезонность связана с повышением рождаемости котят в середине лета и с увеличением заражённости блохами. [8]
Группы риска
Заболевания чаще встречается у людей моложе 18 лет (от 55 до 80% случаев). Это связывают с тем, что именно дети и подростки чаще всего играют с котятами. [9]
Также стоит отметить, что заболевание чаще встречается у мужчин, чем у женщин, в соотношении 3:2. Одной из гипотез, объясняющих более высокую заболеваемость среди мужчин, является тенденция к более грубой игре с котятами и кошками и, следовательно, повышенному риску укусов и царапин. [1]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы болезни кошачьих царапин
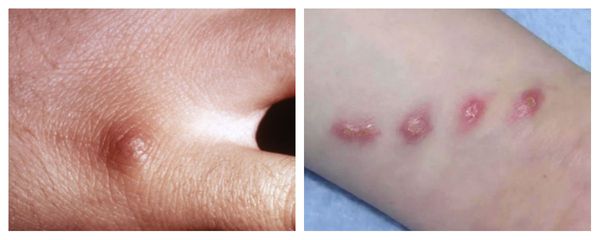
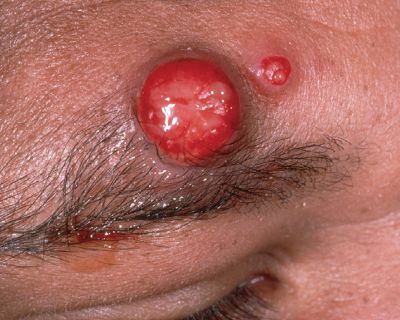
Первичный очаг (инокуляция) — наблюдается в 90% случаев и возникает на месте зажившей царапины. В основном располагается на кистях и предплечьях, реже на лице, туловище и ногах. Вначале отмечается эритематозное пятно, которое существует совсем недолго и трансформируется в плоскую папулу синюшно-красного или телесного цвета с чёткими неровными границами. Размером возникшая папула может быть от нескольких мм до 1-2 см в диаметре. Иногда несколько папул расположены линейно по ходу царапины. В некоторых случаях в основании папулы имеется болезненный инфильтрат до 3-5 см в поперечнике. У отдельных пациентов вместо папул возникают пузыри или пустулы. Примерно в половине случаев в последующем формируется эрозивный или язвенный дефект, заживающий с образованием рубца. [10]
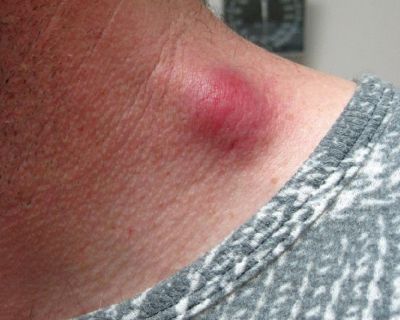
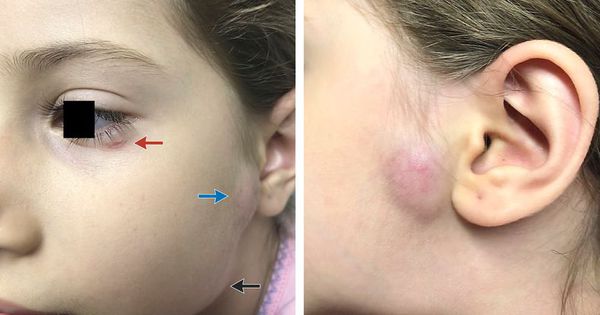
Региональный лимфаденит — основной симптом заболевания. При классической болезни кошачьих царапин регионарная лимфаденопатия возникает через 1-3 недели после появления первичного очага и продолжается до нескольких месяцев. У 85% пациентов поражается одна группа лимфоузлов: чаще всего подмышечные и эпитрохлеарные (46%), в области головы и шеи (26%), а также в паховой области (17,5%). В большинстве случаев воспаляются одиночные лимфоузлы, реже множественные, они могут располагаться как в границах одной анатомической области, так и в нескольких (генерализованная лимфаденопатия — редкое явление).
Поражённый лимфатический узел плотный, подвижный, при пальпации умеренно болезненный, в диаметре может достигать 1-5 см. Кожа над ним гиперемированна. В 10-50% случаев происходит спаивание лимфоузлов с окружающими тканями, их нагноение с образованием густого жёлто-зелёного гноя и последующим вскрытием с образованием язвенного дефекта. [11]
Окулогландулярный синдром Парино — одновременное образование одностороннего гранулематозного конъюнктивита (возникновение гранулём в виде жёлто-белых узелков от 1 до 5 мм) и увеличенного лимфатического узла перед ушной раковиной на той же стороне лица. Встречается в 2-8% случаев и связан с попаданием на конъюнктиву глаза слюны заражённых животных или фекалий блох. Конъюнктивит в течение нескольких недель регрессирует без рубцевания. [12]
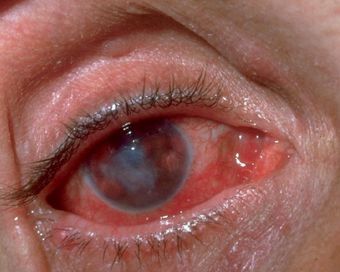
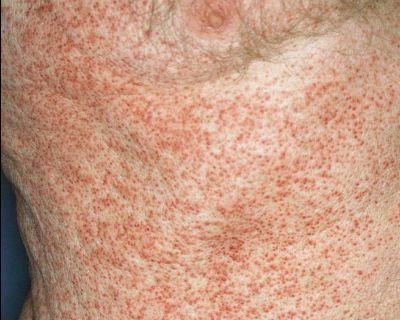
Генерализованная сыпь — скарлатино-, кореподобная или уртикарная сыпь на туловище, реже на конечностях. Наблюдается на фоне общих проявлений. В редких случаях возникает пятнисто-папулёзная сыпь или элементы по типу узловатой эритемы. Высыпания держатся от 2-5 дней до 2-5 недель. [10]
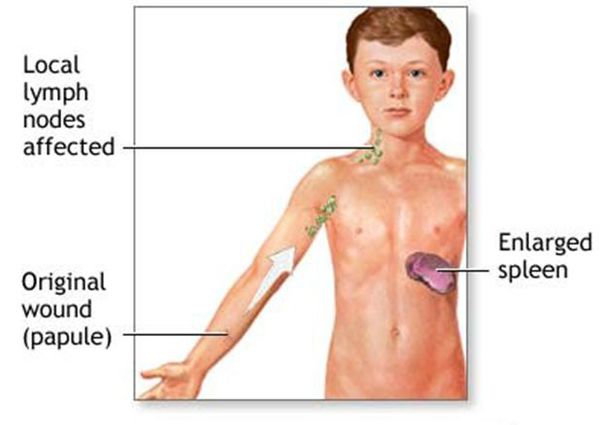
Патогенез болезни кошачьих царапин
При попадании в организм иммунокомпетентных пациентов Bartonella в местах инокуляции (заражения) вызывает гранулематозный и лейкоцитарно-лимфоцитарный ответ. Инфекция распространяется через лимфатические пути, вызывая воспаление в лимфатических узлах. В некоторых случаях происходит проникновение бактерий в кровь с развитием бактериемии и поражения нервной системы и внутренних органов.
Основным вирулентным агентом считается белок наружной мембраны OMP 43 кДа, который способен связывать эндотелиальные клетки.
Как показывают исследования, B. henselae проявляет более низкую биологическую активность по сравнению с классическими грамотрицательными микробами, что объясняет выживание, внутриклеточный рост и размножение бактерий внутри фагоцитарных клеток.
У пациентов с ослабленным иммунитетом (в частности, ВИЧ-инфицированных) ответ организма на заражение может привести к бациллярному ангиоматозу (избыточному разрастанию сосудов). Стимулировать ангио пролиферацию (появление новых кровеносных сосудов) бактерия B. henselae способна благодаря функции белка адгезина А, который может сцеплять поверхности клеток. [13]
Классификация и стадии развития болезни кошачьих царапин
Международная классификация болезней 10 пересмотра кодирует заболевание как A28.1 Лихорадка от кошачьих царапин.
Клиническая классификация предполагает выделение трёх форм болезни: [10] [14]
- классическая форма (кожно-железистая) — поражение кожи и лимфатических узлов;
- атипичные формы:
- глазной вариант (окуло-гландулярная форма) — поражение глаз;
- неврологический вариант (нейро-гландулярная форма) — поражение нервной системы;
- висцеральный вариант — поражение печени, селезёнки, сердца, реже лёгких и кишечника;
- бациллярный ангиоматоз — тяжёлое течение заболевания у лиц с ослабленным иммунитетом.
Стадии развития заболевания:
- инкубационный период — длится от 5 до 60 дней (в среднем — две недели);
- инокуляция — появление первичного очага, который существует на протяжении нескольких недель;
- стадия регионального лимфаденита — наступает через 1-3 недели после появления первичного очага и длится от нескольких недель до нескольких месяцев;
- регрессирование симптомов — может продолжаться около 3-6 месяцев, иногда дольше.
Осложнения болезни кошачьих царапин
Бациллярный ангиоматоз
Наблюдается у людей с ВИЧ-инфекцией, после трансплантации сердца и почек и очень редко — у иммунокомпетентных лиц. Характеризуется длительной лихорадкой, болями в суставах, снижением массы тела и спленомегалией (увеличением селезёнки). На фоне этих проявлений возникает сыпь в виде: множественных распространённых ангиоматозных (сосудистых) и подкожных узлов, папул, похожих на пиогенную гранулёму, и эритематозных инфильтрированных бляшек диаметром от 1 мм до нескольких см. Течение тяжёлое, часто с летальным исходом. [15]
Подострый эндокардит
У части пациентов наблюдается поражение одного или несколько сердечных клапанов, эндокарда на внутренней поверхности стенок сердца или межжелудочковой перегородке, причем культуральное исследование крови не выявляет бактерий. [16] Это осложнение может сопровождаться повышением температуры, сердечной недостаточностью и одышкой.
Офтальмологические осложнения
Поражения глаз отмечаются у 2-6% пациентов и включают:
- нейроретинит — воспаление сетчатки глаза и зрительного нерва;
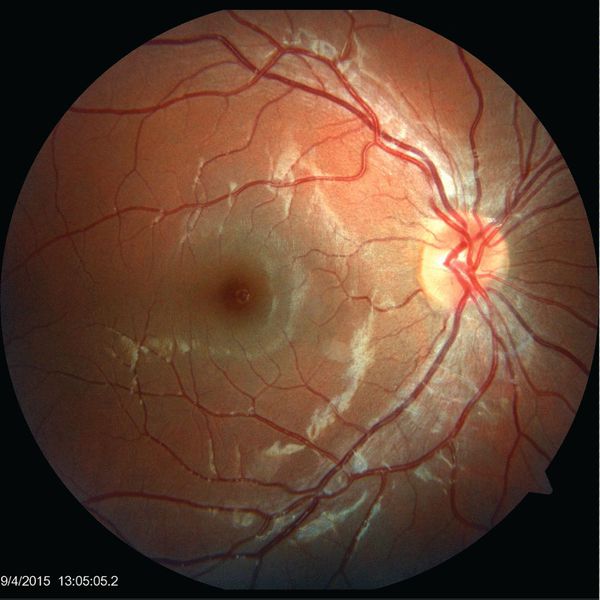
- папиллит — воспаление части зрительного нерва;
- неврит зрительного нерва;
- очаговый или многоочаговый ретинохориоидит — воспаление сосудистой оболочки глаза и сетчатки;
- панувеит — воспаление всех частей сосудистой оболочки галаза;
- окклюзию вен и артерий сетчатки, приводящую к её отслоению. [17]
Неврологические осложнения
Нарушения центральной нервной системы встречаются у 1-2% пациентов и включают атаксию, паралич черепных нервов и деменцию у пожилых людей. У детей обычно возникает энцефалит или асептический менингит. [18]
Гранулематозный гепатит и спленит (острое воспаление селезёнки)
Поражение печени и селезёнки, сопровождается генерализованной лимфаденопатией, длительной волнообразной лихорадкой, повышением уровней аминотрансфераз и множественными и диффузными гипоэхогенными зонами, определяемыми во время ультразвукового исследования и томографии. [19]
Диагностика болезни кошачьих царапин
Постановка диагноза основывается на данных анамнеза (наличие контакта с кошкой), клинических данных (присутствие первичного очага и регионального лимфаденита) и, при необходимости, данных лабораторных исследований:
- Общий анализ крови — при болезни кошачьи царапин обнаруживаются лейкоцитоз, лимфоцитоз и повышенная СОЭ.
- Полимеразная цепная реакция (ПЦР) — определение ДНК возбудителя на основе материала, взятого из первичного очага поражения или при биопсии лимфатического узла и крови. Специфичность данного обследования составляет почти 100%, но его чувствительность колеблется от 43% до 76%. [20]
- Культуральное исследование — посев материала из очагов поражения, аспирата из лимфатических узлов и крови. Специфичность анализа — 100%, чувствительность — 70-80%. [2] Метод требует специальных сред и времени (более трёх недель).
- Серологическое исследование — определение антител к B. henselae в крови методом ИФА (иммуноферментного анализа). Титры IgG менее 1:64 свидетельствуют о том, что у пациента нет текущей инфекции. Титры от 1:64 до 1:256 предполагают возможное наличие инфекции — рекомендовано повторное тестирование через 10-14 дней. Титры, превышающие 1:256, указывают на присутствие активной или недавней инфекции. Положительный тест на IgМ предполагает острое заболевание. [21]
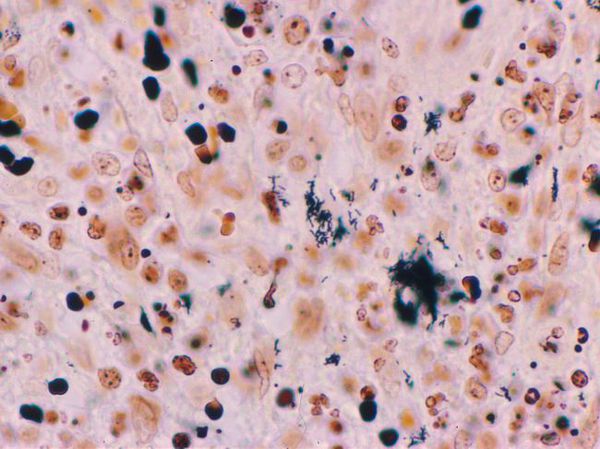
- Биопсия материала из первичного очага поражения — показывает выраженные очаги некроза в дерме, окружённые эпителиоидными и гигантскими клетками и эозинофилами. При окраске по Уортину — Старри определяются мелкие бактерии разной формы.
- Рентгенологическое исследование лимфатических узлов, УЗИ и томография печени и селезёнки — проводятся по показаниям.
- Исследование на ВИЧ-инфекцию и подсчёт количества СD4 клеток в крови — проводят при подозрении на бациллярный ангиоматоз.
Дифференциальная диагностика проводится со следующими заболеваниями:
- бактериальный гнойный лимфаденит, вызванный другими микроорганизмами;
- инфекция, вызванная атипичными микобактериями; ;
- споротрихоз;
- туляремия; ;
- саркоидоз;
- злокачественные новообразования.
Лечение болезни кошачьих царапин
Иногда в случаях стандартного течения заболевания применяют тепловой местный компресс или прибегают к физиотерапевтическому воздействию на область изменённых лимфоузлов (диатермии и УВЧ-терапии). Однако особого терапевтического эффекта эти метода не оказывают, так как большинство случаев фелиноза проходят самостоятельно, без лечения. Поэтому при классической форме болезни никаких действий предпринимать не нужно.
У некоторых пациентов могут развиться осложнения от распространения процесса. В таком случае рекомендовано назначение азитромицина, при применении которого лимфаденит регрессирует быстрее по сравнению с отсутствием лечения: [22]
- для взрослых и детей с весом > 45,5 кг: 500 мг в день, затем по 250 мг в течение четырёх дней;
- для детей с весом ≤ 45,5 кг: 10 мг/кг в первый день, затем по 5 мг/кг в течение четырёх дней.
При необходимости и наличии осложнений могут применяться другие антибиотики: пенициллины, тетрациклины, цефалоспорины и аминогликозиды и их комбинации.
Если есть нагноение, который сопровождается общими симптомами и лихорадкой, то показана аспирация гноя. Это позволит облегчить течение заболевания.
Прогноз. Профилактика
Прогноз благоприятный: при отсутствии осложнений заболевание спонтанно регрессирует без лечения в течение 3-4 месяцев. Тяжёлые формы заболевания встречаются крайне редко.
Меры профилактики, рекомендованные Центрами по контролю и профилактике заболеваний США: [23]
Несмотря на то что первое клиническое описание болезни кошачьей царапины (БКЦ) было дано R. Debre и соавт. более 50 лет назад, до сих пор вопрос об этиологии этого заболевания остается предметом дискуссий и специальных исследований.
Несмотря на то что первое клиническое описание болезни кошачьей царапины (БКЦ) было дано R. Debre и соавт. более 50 лет назад, до сих пор вопрос об этиологии этого заболевания остается предметом дискуссий и специальных исследований. Поскольку выделить возбудитель от больных не удавалось в течение длительного времени, первоначально предполагалась вирусная или хламидийная этиология заболевания. Первые убедительные сведения об идентификации возбудителя БКЦ были получены только в 1983 г., когда исследователи, используя метод окраски по Warthin-Starry (метод серебрения), обнаружили в ткани пораженных лимфатических узлов у 29 из 34 больных БКЦ мелкие полиморфные грамотрицательные бациллы, которые удалось культивировать лишь в 1988 г. Именно этот микроорганизм первоначально был признан возбудителем БКЦ и получил название Alipia felis.
Тем не менее многочисленные последующие исследования не подтвердили четкой взаимосвязи развития БКЦ с A. felis: в большинстве случаев у больных в пораженных тканях не только не обнаруживался указанный возбудитель, но и в сыворотке крови не выявлялись антитела к нему. Более того, из ткани пораженных лимфоузлов был изолирован еще один возбудитель — Bartonella henselae. Методом ПЦР с применением специфических праймеров к Bartonella spp. и A. felis у больных, у которых кожный тест на БКЦ оказался положительным, было установлено, что в 96% случаев у них обнаруживалась ДНК Bartonella, тогда как ДНК A. felis не выявлялась ни в одном случае (A. Bergmans et al., 1995). Сходные данные, подтверждающие ключевую роль B. henselae в развитии БКЦ, были получены и другими исследователями при использовании непрямой реакции флюоресцирующих антител.
В то же время первоначальный факт обнаружения A. felis в пораженных лимфатических узлах игнорироваться не должен. На сегодняшний день некоторые исследователи допускают, что A. felis способен вызывать заболевание, которое по своей клинической картине может напоминать БКЦ.
Болезнь кошачьей царапины (лимфоретикулез доброкачественный) относится к группе бартонеллезов и характеризуется как нетяжелое самокупирующееся заболевание с развитием одностороннего лимфаденита, регионарного по отношению к месту инокуляции возбудителя, и только в редких случаях возможна диссеминация возбудителя с поражением центральной нервной системы и висцеральных органов.
B. henselae характеризуется как небольшая плеоморфная, грамотрицательная бацилла, весьма требовательная к условиям культивирования (растет только на средах с 5% кровяного агара при температуре от 35 до 37°С, с 5—10% углекислого газа и 40-процентной влажностью). Кроме этого, колонии первичной культуры растут медленно и становятся видимыми только после 9—15 дней роста. При последующем пассаже рост колоний ускоряется. Идентификация выделенного возбудителя проводится с использованием специфических антисывороток, определением профиля жирных кислот клеточной стенки или молекулярно-генетическим методом. С помощью этого метода было идентифицировано два генотипа B. henselae, хотя до сих пор четкой зависимости между генотипами возбудителя и особенностями клинического течения вызываемых ими заболеваний не установлено.
B. henselae на сегодняшний день рассматривается как основной возбудитель БКЦ, однако у 5—15% больных с диагнозом, установленным на основании клинико-эпидемиологических данных, даже с помощью существующих современных методов лабораторной диагностики этиологическое значение B. henselae в развитии заболевания не подтверждается.
Один из необъяснимых парадоксов, связанных с B. henselae: в последние годы установлено, что данный возбудитель ответственен за развитие не только БКЦ, но и некоторых других заболеваний.
БКЦ имеет широкое географическое распространение и встречается практически повсеместно. Основным естественным резервуаром B. henselae являются кошки, инфицированность которых в значительной степени определяет распространенность БКЦ (K. M. Zangwill et al., 1993). По данным некоторых исследователей, у более чем 50% домашних и диких кошек обнаруживается бактериемия, обусловленная B. henselae. В ходе исследования, проведенного в США, установлено, что наиболее высокий процент инфицированности кошек и, соответственно, заболеваемости БКЦ среди людей регистрируется в южных штатах. Большинство исследователей подчеркивают особую роль котят в передаче возбудителя, указывая, что у взрослых кошек редко выявляется бактериемия B. henselae за счет наличия у них специфических антител, свидетельствующих о длительности их инфицирования. Особенностью течения бартонеллеза у кошек является его продолжительность (месяцы, годы) и бессимптомность (даже в случае подтверждаемой бактериемии).
В циркуляции B. henselae среди кошек исключительную роль играют блохи (Ctenocephalides felis). Экспериментальным путем было установлено, что при отсутствии блох инфицирования здоровых кошек не происходит.
B. henselae обнаруживается в кишечнике блох и их испражнениях в течение 9 дней после инфицирования, что свидетельствует о его репликации и персистенции в организме блох. Кроме этого, экспериментально была установлена возможность инфицирования кошек путем внутрикожной инокуляции инфицированных испражнений блох, в то же время оральное введение кошкам инфицированных блох и их испражнений к сероконверсии не приводило. Роль блох в передаче возбудителя от кошек к человеку в настоящее время категорически не отрицается. В последние годы исследователями в США и Италии (Y. O. Sanogo et al., 2003) молекулярно-генетическими методами было продемонстрировано, что ДНК B. henselae может обнаруживаться в иксодовых клещах, хотя их роль в качестве вектора передачи возбудителя БКЦ по-прежнему не изучена.
«Травматический» контакт с кошками (царапины, укусы) весьма характерен для БКЦ и отмечается более чем у 90% заболевших. Установлено, что «резервуаром» B. henselae могут быть и собаки, однако достоверно подтвержденных случаев заражения от них людей пока не описано.
Эпидемиологические исследования показывают, что в сыворотке крови около 20% владельцев кошек и 3–4% общей популяции людей обнаруживаются антитела к B. henselae. Семейные случаи заболевания БКЦ не столь типичны и регистрируются менее чем у 5% пациентов. Хотя БКЦ может развиваться в любом возрасте, чаще заболевают молодые люди (до 18 лет).
Передача возбудителя БКЦ реализуется главным образом контактным путем через царапины, укусы или слюну инфицированных кошек. Подъем заболеваемости, как правило, отмечается с конца лета, что объясняется особенностями жизненного цикла у кошек и блох.
Поскольку возбудитель БКЦ был идентифицирован относительно недавно, многие аспекты, касающиеся патогенеза заболевания, до сих пор недостаточно изучены. Характер развивающегося инфекционного процесса, обусловленного действием B. henselae, в значительной степени зависит от иммунного статуса человека: в тех случаях, когда заболевание развивается у иммунокомпетентных пациентов, диссеминация возбудителя отсутствует, и процесс преимущественно ограничивается локальными или регионарными поражениями. В частности, БКЦ в большинстве случаев проявляется развитием регионарной лимфаденопатии. Поражение висцеральных органов описано только в отдельных случаях (Dunn et al., 1997), а бактериемия у иммунокомпетентных пациентов регистрируется исключительно редко (Slater et al., 1990). Напротив, у иммунокомпрометированных пациентов для инфекции B. henselae типично развитие бактериемии и других системных поражений, включая бациллярный ангиоматоз и бациллярный пелиозный гепатит, а у лиц с врожденными и приобретенными аномалиями клапанов сердца — эндокардит (Raoult et al., 1996).
Гистологические изменения в пораженных лимфатических узлах характеризуются пролиферацией гистиоцитов и B-лимфоцитов, приводящей к образованию гранулем с последующей нейтрофильной инфильтрацией и развитием центрального или звездчатого некроза.
Хотя B. henselae и считается одним из наиболее вероятных возбудителей БКЦ, тем не менее, согласно современным наблюдениям, данный возбудитель ответственен за развитие ряда других патологических состояний человека (табл. 1). При этом иммунный статус больных рассматривается как ключевой фактор, определяющий характер формирующегося заболевания, хотя известны случаи, когда даже у лиц с ВИЧ-инфекцией в стадии СПИДа БКЦ протекала в типичной форме.
Инкубационный период у больных с БКЦ может варьировать в достаточно широких пределах — от 3 до 20 дней и более, составляя в среднем 1–2 нед. Хотя общепринятой клинической классификации БКЦ нет, чаще всего выделяют типичную и атипичные формы заболевания (табл. 2), что определяется по доминирующему в клинической картине болезни синдромокомплексу.
В типичных случаях БКЦ проявляется развитием первичного аффекта и регионарного (к месту входных ворот инфекции) лимфаденита. Локализация первичного аффекта определяется местом первичной инокуляции возбудителя, а именно местом нанесения кошкой царапин и укусов. По истечении нескольких дней (от 3 до 10), когда нанесенные кошкой повреждения кожи уже заживают, в месте входных ворот формируется папула, которая, как правило, трансформируется в везикулу и далее в пустулу, а после вскрытия — в язвочку, покрытую корочкой. В некоторых случаях пустула может подсыхать без образования язвочки. В диаметре размер формирующейся папулы, как правило, составляет от 1–2 до 5 мм. Частота выявления первичного аффекта у больных БКЦ, по данным различных исследователей, может колебаться от 25 до 94%. Кожные проявления сохраняются в течение 1—3 нед и спонтанно разрешаются.
Регионарный лимфаденит является одним из наиболее постоянных и характерных клинических признаков БКЦ (табл. 3) и сохраняется в течение длительного времени: от 7 до 60 дней, а в отдельных случаях до 1 года и даже 3 лет. В большинстве случаев лимфаденит разрешается в течение 1—4 мес. Нередко он оказывается практически единственным проявлением БКЦ. В большинстве случаев (85%) у больных выявляются одиночные лимфатические узлы, реже множественные, в границах одной анатомической области. Несмотря на то что у больных регистрируется увеличение лимфатических узлов, осуществляющих дренаж места первичной инокуляции возбудителя, развитие лимфангоита не характерно для БКЦ. У 1/3 пациентов могут определяться увеличенные лимфатические узлы разных анатомических областей, хотя генерализованная лимфаденопатия встречается достаточно редко. Размером увеличенные лимфатические узлы чаще бывают от 1 до 5 см, в некоторых случаях до 8—10 см. При пальпации лимфатические узлы умеренно болезненные. Хотя они и не спаяны с окружающими тканями, нередко определяется гиперемия кожных покровов над ними. В 10—50% случаев у больных БКЦ развивается нагноение пораженных лимфатических узлов с образованием густого желто-зеленого гноя. В отдельных случаях при посеве гноя на питательные среды удается получить рост стафилококков и другой флоры, хотя роль условно-патогенной флоры (суперинфекция) в нагноении пораженных лимфатических узлов пока не установлена.
Общее состояние больных в большинстве случаев остается удовлетворительным. Только в трети случаев у больных отмечается повышение температуры тела свыше 38,3°С, которое сохраняется около недели и лишь иногда может затягиваться до месяца и более. Среди других клинических проявлений БКЦ могут отмечаться: слабость и недомогание (30%), головная боль (14%), тошнота и рвота (15%), спленомегалия (11%). В случае длительного течения заболевания у больных может наблюдаться потеря веса. Нередко заболевание приобретает волнообразное течение.
Поражение глаз (глазной вариант) при БКЦ регистрируется в том случае, когда местом инокуляции возбудителя служит слизистая оболочка глаз. Клинические проявления заболевания в этом случае будут включать развитие одностороннего поражения в виде язвенно-гранулематозного конъюнктивита, отека век и преаурикулярной лимфаденопатии (синдром Парино). Одновременно у больных могут определяться умеренно увеличенные и болезненные околоушные и шейные лимфатические узлы. К числу других глазных проявлений БКЦ относятся нейроретинит, неврит зрительного нерва и папиллит. Для нейроретинита типично одностороннее острое нарушение остроты зрения, развивающееся на фоне умеренно выраженных явлений интоксикации. При осмотре глазного дна могут выявляться геморрагии, множественные дискретные повреждения, ватоподобные образования, отек и экссудация соска зрительного нерва (симптом «макулярной звезды») (J. B. Reed et al., 1998).
Поражение нервной системы (неврологический вариант) у больных БКЦ выявляется редко (~2% случаев), хотя диапазон клинических проявлений весьма разнообразен: у больных могут выявляться радикулиты, полиневриты, миелит, энцефалопатия, энцефалит, менингит и церебральная атаксия. Характерным признаком поражения нервной системы при БКЦ является то, что они развиваются спустя 1—6 нед (чаще 2–3 нед) от момента появления лимфаденопатии. Для развития энцефалита и менингита типично внезапно возникающее ухудшение состояния больного, сопровождающееся лихорадкой, головной болью, спутанностью сознания и дезориентацией. В некоторых случаях состояние может прогрессивно ухудшаться, вплоть до развития комы. В ликворе у таких больных определяется мононуклеарный плеоцитоз. Только в отдельных случаях у больных после перенесенного энцефалита могут отмечаться резидуальные явления.
Некоторые авторы (P. M. Delahoussaye, B. M. Osborne, 1990), указывая на возможность поражения печени и селезенки при БКЦ, выделяют висцеральный вариант заболевания, для которого характерны длительная волнообразная лихорадка, увеличение размеров печени и селезенки, повышение в сыворотке крови уровней аминотрансфераз, с определением при УЗИ и компьютерной томографии множественных, диффузных, гипоэхогенных дефектов. Довольно часто у таких больных отмечается генерализованная лимфаденопатия.
Кроме этого, в более редких случаях у больных БКЦ могут выявляться абсцесс селезенки, плеврит, эндокардит, пневмония, узловатая эритема, тромбоцитопеническая пурпура, остеомиелит (B. Dzelalija et al., 2001, C. V. Hulzebos et al., 1999).
В типичных случаях первичная диагностика БКЦ не представляет больших сложностей, поскольку основывается на характерных клинико-эпидемиологических данных (табл. 4).
Определенные сложности имеются при лабораторной верификации диагноза, что связано с отсутствием соответствующей лабораторной базы. В зарубежной практике длительное время в качестве основного диагностического критерия БКЦ использовался кожный тест, в котором в качестве аллергена применялся термоинактивированный пунктат, полученный из лимфоузлов больных с установленным (в соответствии с принятыми критериями) диагнозом БКЦ. По данным многих авторов, результативность такого теста достигала 95—98%, однако из-за риска передачи гемоконтактных инфекций использование данного теста ограничено, а кожного теста с использованием очищенных антигенов B. henselae пока не описано.
Микробиологические исследования в широкой практике не применяются ввиду длительности (от 2 до 6 нед) и сложности проведения анализа.
Достаточно информативным способом установления диагноза является биопсия папул и/или пораженных лимфатических узлов с последующим гистологическим исследованием (окрашивание срезов гематоксилин-эозином и серебром — метод Warthin-Starry), позволяющим выявить характерные гистологические признаки поражения и скопление мелких плеоморфных бактерий.
В последние годы большое внимание уделяется разработке специфических иммунологических (ИФА) и молекулярно-генетических (идентификация гена 16S рибосомальной РНК B. henselae) методов обнаружения возбудителя БКЦ в биопсийном материале больного, хотя пока для широкой практики они по-прежнему недоступны.
Дифференциальный диагноз необходимо проводить с заболеваниями, сопровождающимися развитием лимфаденопатии (табл. 5).
Несмотря на то что в редких случаях отмечаются варианты тяжелого течения БКЦ, у иммунокомпетентных лиц прогноз заболевания благоприятный. Повторных случаев и летальных исходов не описано.
Многочисленные клинические наблюдения показывают, что в большинстве случаев БКЦ протекает как самокупирующаяся инфекция, и применение антибактериальной терапии не оказывает существенного влияния на ее течение. Традиционные рекомендации по применению эритромицина (эритромицин-тева, зинерит) и доксициклина (юнидокс солютаб, медомицин, вибрамицин, тетрадокс) основаны на эффективности этих препаратов у больных с ВИЧ-инфекцией при развитии бациллярного ангиоматоза, вызываемого Bartonella quintana, тогда как у больных БКЦ терапевтическая эффективность указанных препаратов не подтверждена ни в одном исследовании. Весьма противоречивыми остаются данные по соответствию чувствительности in vitro возбудителя БКЦ к антибактериальным препаратам и их клинической эффективности. Единственным антибактериальным препаратом, клиническая эффективность которого была установлена в ходе рандомизированного плацебо-контролируемого исследования, является азитромицин (сумамед, хемомицин, азивок, сумазид), назначаемый в течение 5—10 дней. В неконтролируемых исследованиях (A. M. Margileth, 1992) из 18 антимикробных препаратов клиническая эффективность была установлена только при применении рифампицина (бенемицин, р-цин), ципрофлоксацина (ципросан, цифран, ципрова), гентамицина (гентамицин К, гентамицина сульфат) и триметопримсульфаметоксазола (бактрим, септрин). Антибактериальные препараты при БКЦ следует применять у иммунокомпрометированных лиц и при тяжелом течении заболевания, сопровождающегося поражением нервной системы и висцеральных органов.
В случае выявления флуктуации в пораженном лимфатическом узле требуется его пункция и аспирация гноя, что ускоряет последующий процесс склерозирования и рубцевания ткани лимфатического узла и влияет в конечном итоге на выздоровление пациента.
По вопросам литературы обращайтесь в редакцию.
В. А. Малов, доктор медицинских наук, профессор
А. Н. Горобченко, кандидат медицинских наук, доцент
ММА им. И. М. Сеченова, Москва
Читайте также:

