Кожные заболевания при ослабленном иммунитете
Обновлено: 22.04.2024
Инфекции кожи и мягких тканей: причины, диагностика, лечение, профилактика
Бактериальные инфекции кожи. Передача кожных инфекций осуществляется посредством контактного механизма. Заболевания быстро распространяются в местах скопления людей и в условиях антисанитарии. Возбудителями кожных инфекций могут быть многие микроорганизмы. Наиболее распространены Staphylococcus aureus и Streptococcus pyogenes.
Бактерии возбудители инфекций кожи и мягких тканей:
- S. aureus: импетиго, фурункулёз, невскрывающийся фурункул, токсический эпидермальный некролиз, острая паронихия
- S. pyogenes: целлюлит, рожа, импетиго
- С. diphtheriae: дифтерия (кожная форма)
- М. tuberculosis: волчанка обыкновенная
- М. marinum: хронические язвенные поражения кожи
- М. ulcerans: деструктивные язвы (язва Бурули)
- С. minutissimum: эритразма
- Pseudomonas aeruginosa: колонизация ожогов
- Erysipelothrix rhusiopathiae: эризипелоид
При целлюлите, вызванном S. pyogenes, S. aureus, Pasteurella multocida, реже вибрионами, обитающими в морской воде, и грамотрицательными бациллами, происходит поражение всех слоев кожи. Микроорганизмы проникают в организм человека через повреждённые участки кожи, раны и места укусов насекомых. Эмпирическое лечение флуклоксациллином необходимо начинать до получения результатов бактериологического исследования. В тяжёлых случаях применяют внутривенные антибактериальные препараты (бензилпенициллин и флуклоксациллин).
Некротизирующий фасцит — быстро прогрессирующая инфекция, поражающая также кожу и подкожную клетчатку. Заболевание развивается в результате микст-инфекции, вызванной аэробными и анаэробными микроорганизмами, а также вследствие моноинфекции S. pyogenes. Болезнь быстро прогрессирует и может привести к смерти пациента за очень короткое время. Большую роль в лечении играет успешное иссечение инфицированных некротических тканей, проводимое на фоне лечения бензилпенициллином, цефалоспоринами третьего поколения и метронидазолом.
Эритразма — поверхностная инфекция, возникающая на сгибательных поверхностях конечностей и вызываемая Corynebacterium minutissimum. Очаги поражения флюоресцируют в ультрафиолетовом свете. Возбудитель может быть выделен при посеве. Для лечения применяют эритромицин или тетрациклин.
Рожа — стрептококковая инфекция, поражающая органические участки кожи на лице или голенях. При обследовании отмечают обычно повышение количества лейкоцитов в периферической крови. Для лечения назначают приём внутрь амоксициллина и флуклоксациллина; в тяжёлых случаях может потребоваться внутривенное введение антибиотиков.
Эризипелоид — зоонозная инфекция, вызываемая Erysipelothrix rhusiopathiae. Местный очаг (обычно пальцы рук) характеризуется развитием эритемы красно-фиолетового цвета. В группу риска входят мясники (поражаются пальцы рук при работе с инфицированным мясом, чаше свиньи) и рыбаки. В большинстве случаев заболевание разрешается самостоятельно, но применение внутрь пенициллина или тетрациклина позволяет ускорить процесс выздоровления, назначение антибиотиков обязательно при развитии вторичной бактериемии.
Ожоги могут стать причиной инфекции, вызванной Pseudomonas aeruginosa, S. aureus, S. pyogenes и иногда бактериями кишечной группы. Возможно заражение антибиоти-коустойчивыми формами микроорганизмов. Бактериальное поражение может привести к отторжению пересаженной кожи и вторичной бактериемии.
Паронихия. Паронихия, или воспаление околоногтевой ткани, — распространённое заболевание, возникающее вследствие бактериальной инвазии (например, S. aureus) в местах повреждения кутикулы. При этом возникают боль, отёчность с последующим формированием небольшого абсцесса. Абсцесс дренируют и назначают антибактериальную терапию (флуклоксациллин и др.).
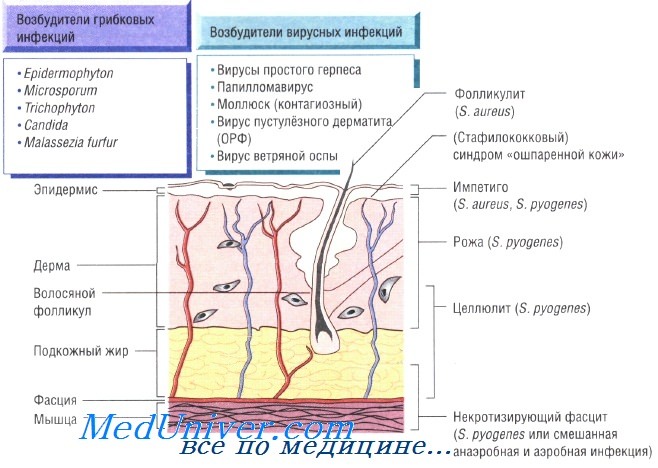
Причины инфекций кожи
Кожные проявления системных инфекций
На коже могут отражаться проявления системных инфекций. Ярким примером может служить петехиальная сыпь при менингококковой септицемии — несомненный признак тяжёлого сепсиса. У пациентов с синегнойной септицемией на коже возникают гангренозные очаги (гангренозная эктима). Менее выражены кожные изменения при эндокардите (кровоизлияния у оснований ногтей). При стафилококковой септицемии возникают участки инфаркта кожи, а при некоторых вирусных заболеваниях высыпания на коже становятся частью характерной клинической картины (ветрянка и корь).
Для вируса простого герпеса кожные покровы — первичный очаг инфекции. Некоторые штаммы Staphylococcus aureus и бета-гемолитических стрептококков вызывают системные заболевания, обусловленные действием токсинов и сопровождающиеся различными кожными изменениями: при синдроме токсического шока — генерализованная и сыпь на ладонях, при скарлатине — сыпь с бледностью носогубного треугольника, а при синдроме ошпаренной кожи у новорождённых — сильное шелушение.
Бородавки как инфекция кожи
Папилломавирус человека поражает клетки кожи и усиливает их репликацию, в результате чего формируется бородавка (папиллома). Существуют папулёзные, пятнистые и мозаичные виды папиллом, а также подошвенная (роговая) бородавка. Заболевание передаётся при непосредственном контакте с больным, а также через предметы общего пользования особенно при повышенной влажности (при совместном купании в бассейне).
Передача генитальных бородавок (остроконечных кондилом) осуществляется половым путём. Диагноз устанавливают на основании клинических признаков. Для определения вируса остроконечных кондилом применяют реакцию иммунофлюоресценции и полимеразную цепную реакцию.
Папилломавирусы вызывают злокачественные новообразования шейки матки (тип 16 и 18) и гортани (тип 6 и 11). В настоящее время существуют вакцины против виусов типа 16 и 18, которые формируют продолжительный иммунитет.
Папилломы со временем самостоятельно исчезают, не оставляя рубцов (за исключением случаев у людей со сниженным иммунитетом). Очень часто для самолечения применяют местные кератолитические вещества (салициловая кислота). При генитальных бородавках используют подофил щитовидный*. В качестве альтернативы применяют криотерапию, ускоряющую исчезновение папиллом. Прижигание в настоящее время не рекомендуют для частого использования у одного пациента.
Некоторые штаммы поксвирусов поражают кожный покров и вызывают возникновение характерных симптомов (например, контагиозный моллюск и контагиозный пустулёзный дерматит).
Дерматофитозы - грибковые инфекции кожи
Клинические признаки дерматофитозов. При дерматофитии (стригущем лишае) возникают бляшки, сопровождаемые зудом и покраснением. Со временем их диаметр увеличивается, а в центре образуется бледное пятно. При хроническом поражении ногтей наблюдают обесцвечивание и истончение ногтей, а при заболеваниях кожи головы — облысение и рубцевание. В основе названия заболевания лежит место заражения, например дерматофития головы (tinea capitis — стригущий лишай), дерматофития туловища (tinea corporis).
Лабораторная диагностика грибковых инфекций кожи. При инфекции кожного покрова отмечают свечение поражённых участков в ультрафиолетовом свете.
В лабораторию доставляют сухие соскобы с поражённых участков кожи, образцы ногтей и волос. При нагревании в растворе натрия гидроксида они обесцвечиваются, и во время микроскопии становятся видны гифы грибов. Дерматофиты растут на декстрозосодержащем агаре Сабурада при температуре 30 °С в течение четырёх недель.
В основе идентификации лежат морфологические свойства колоний, особенности микроскопической картины (окраска лактофеноловым синим), биохимическое исследование, а также секвенирование 18S рибосомальной РНК гена.
Лечение грибковых инфекций кожи. При дерматофитозах применяют местные препараты группы имидазола (миконазол, клотримазол, тиоконазол или аморолфин). При некоторых формах инфекции назначают тербинафин (внутрь) в течение нескольких недель.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021

Студент медицинского факультета УЛГУ. Интересы: современные медицинские технологии, открытия в области медицины, перспективы развития медицины в России и за рубежом.
- Запись опубликована: 12.12.2019
- Reading time: 3 минут чтения
Ученые выяснили, что аутоиммунные заболевания вызываются стрессом.
Среди множества заболеваний эти патологии считаются наиболее слабоизученными. При их возникновении по каким-то неизвестным причинам организм вдруг начинает «атаковать» собственные ткани или клетки, принимая их за чужие.
Это приводит к возникновению воспалительных процессов, поражающих практически все органы – кожу, суставы, сердце, печень, почки, репродуктивную систему, кишечник, щитовидную железу.
Механизм возникновения аутоиммунных патологий
Иммунную систему можно сравнить с армией, охраняющей организм от вирусов, микробов, простейших и других «названных гостей». Иммунитет также уничтожает раковые и другие патологические клетки.
Любой инородный белок, попавший в организм, оценивается по принципу свой-чужой. При обнаружении угрозы иммунная система приступает к уничтожению. Для этого плазматические клетки, вырабатывают особые вещества – антитела- иммуноглобулины (Ig). Их задача – связать «пришельцев» и «пометить» их для последующего уничтожения. Возникают комплексы антиген-антитело, которые распознаются и уничтожаются специальными белками или клетками-фагоцитами.
Уничтожением чужеродных белков занимается ещё один вид иммунных клеток Т-лимфоциты. Они отыскивают « пришельцев» по специфическим комплексам, образующимся в организме в ответ на их внедрение. Т- лимфоциты уничтожают даже собственные клетки, если они заражены.
Образующиеся при иммунном ответе иммуноглобулины Ig сохраняются после выздоровления. При повторном заражении они быстро нейтрализуют возбудителей и болезнь не возникает. Поэтому краснухой, свинкой, ветрянкой, корью и некоторыми другими инфекциями можно переболеть всего один раз.
Здоровая иммунная система умеет отличать «своих» от «чужих», давая команду на уничтожение только болезнетворных микроорганизмов и не трогая нужные белки, соединения и ткани. Такое свойство называют толерантностью.

Уничтожение болезнетворных микроорганизмов
Однако, в некоторых случаях, по каким-то причинам толерантность иммунной системы нарушается. Она начинает атаковать ткани собственного организма, ферменты и белки, принимая их за чужеродные компоненты.
В результате образуется аутоантитела к собственным клеткам и нужным веществам, вырабатываемым организмом. У больного развивается аутоиммунное заболевание. В крови обнаруживаются патологические антитела и маркеры воспаления– С-реактивный белок, ускоренное СОЭ.
Эти патологии могут затрагивать самые разные органы и ткани:
- Суставы, с возникновением множественных воспалений – полиартритов.
- Сердце, с возникновением сердечных пороков.
- Поджелудочной железы, с развитием юношеского диабета.
- Нервной системы с возникновением рассеянного склероза.
- Кожи. При аутоиммунных патологиях на ней появляются высыпания, корочки, язвы.
- Почек, с развитием аутоиммунного нефрита- поражения, приводящего к почечной недостаточности.
- Репродуктивной системы, с возникновением аутоиммунного оофорита.
- Щитовидной железы, с развитием воспаления – тиреоидита Хашимото.
- Надпочечников, с развитием болезни Аддисона, при которой эти органы не могут вырабатывать достаточное количество гормонов.
- Слюнных и слёзных желез с развитием синдрома Шегрена, сопровождающегося сухостью глаз и слизистых оболочек.
- Кишечника с развитием болезни Крона. При этой патологии на его стенке образуются язвы и уплотнения (инфильтраты). Больные страдают от боли в животе, нарушений пищеварения и кровотечений.
Некоторые аутоиммунные заболевания, например, красная волчанка, поражают весь организм, вызывая изменения в сосудах, суставах, почках, коже.
Лечатся аутоиммунные заболевания очень тяжело. Больным назначают гормоны, а иногда даже химиопрепараты, которые обычно применяются при раке. Причины этих заболеваний доподлинно неизвестны, но недавно ученые выяснили, что они чаще развиваются на фоне стрессов.
Стресс нарушает работу иммунной системы
Чтобы понять взаимосвязь между стрессом и аутоиммунными заболеваниями в Швеции провели исследование, в котором участвовали 106 464 пациента, подвергшихся воздействию стрессовых ситуаций, и 1 064 640 лиц, не подвергшихся такому воздействию. Обследовали 126 652 братьев и сестер пациентов, перенёсших серьезные нервные потрясения.
Средний возраст пациентов составил 41 год, а всего в исследовании участвовали лица в возрасте 30-50 лет, 40% из них которых были мужчинами. В течение 10 лет заболеваемость аутоиммунными патологиями в группе лиц, переживших стрессовую ситуацию, составила 9,1 на 1000 чел. / год.
У лиц, не подвергавшихся стрессовым ситуациям количество аутоиммунных патологий было гораздо ниже – 6 на 1000 чел./ год. Примерно такой же показатель наблюдался у братьев и сестёр пациентов, перенёсших стресс и заболевших аутоиммунными болезнями. Это указывает на слабую связь заболеваний с наследственностью и высокую – с отрицательными воздействиями на нервную систему.
Особенно высоким было число аутоиммунных заболеваний у пациентов, подвергшихся посттравматическому стрессовому расстройству. Так называется состояние, возникшее на фоне выраженных психотравмирующих обстоятельств – военных действий, природных катаклизмов, дорожно-транспортных происшествий, насилия, террористических актов.
Заболеваемость аутоиммунными патологиями надпочечников у больных после посттравматического стрессового расстройства превышала средние показатели более, чем в 2 раза. Сахарный диабет и аутоиммунный тиреоидит у них возникали на нас 40-50% чаще.

Сахарный диабет
У пострадавших в ходе террористических актов, произошедших в Париже 13.11.15 года, была описана настоящая «эпидемия» болезни Крона и рассеянного склероза . Это еще раз показывает связь аутоиммунных патологий и стрессовых ситуаций.
Поэтому после перенесенных тяжелых психотравмирующих ситуаций нужно обратиться к врачу и обследоваться. Следует сдать кровь на общий анализ, на С-реактивный белок, антитела и основные биохимические показатели. Нужно также сдать общий анализ мочи. Так можно выявить аутоиммунные патологии на самых ранних стадиях, чтобы вовремя начать их лечение.
Инфекционные заболевания у пациентов со сниженным иммунитетом. Инфекции при иммунодефиците
Различные методы лечения или наследственная патология иммунной системы могут способствовать развитию инфекционного заболевания, обусловленного слабовирулентными штаммами микроорганизмов, или возникновению тяжёлых инфекций, связанных с патогенными возбудителями.
Недостаточность иммунной системы обычно возникает в результате воздействия нескольких факторов. Например, при нейтропении, развивающейся у пациентов, перенёсших пересадку костного мозга, повышена восприимчивость организма к бактериальным инфекциям, в то время как внутривенная катетеризация способствует развитию инфекции, вызванной Staphylococcus epidermidis.
Медицинские манипуляции часто нарушают физические барьеры на пути инфекции (например, катетеризация).
Нейтропения как причина инфекции при иммунодефиците
Гранулоцитопению обычно наблюдают при острой лейкемии или её лечении. Риск развития инфекции зависит от длительности и тяжести нейтропении. Бактериемию у таких больных обнаруживают в 40—70% случаев. Наиболее часто выделяют гра-мотрицательные бациллы (бактерии семейства Enterobacteriaceae и рода Pseudomonas). Они распространяются по организму в результате повреждения кишечника противоопухолевыми препаратами и облучением.
Кроме того, в этиологии сепсиса важную роль играют фамположительные микроорганизмы (S. epidermidis, S. mitis, S. oralis, S. aureus, Corynebacterium jeikeium и представители рода Enterococcus).
Несмотря на то что в большинстве случаев развитие кандидоза обусловлено приёмом антибактериальных препаратов, у пациентов с нейтропенией грибковые инфекции могут возникать de novo. В последнее время всё чаше сообщают о микозах, вызванных дрожжевыми грибами, такими как Candida krusei (характерна природная устойчивость к действию противогрибковых средств), различными видами родов Aspergillus (вызывают инвазивные заболевания) и Fusarium, а также Pseudallescheria boydii и Trichosporon beigelii.
Лечение лихорадки у пациентов с нейтропенией. Эмпирическая терапия включает карбапенем (или цефтазидим) и амикацин. Если лихорадка не исчезает, то дополнительно назначают гликопептидный антибиотик. Позже, если лихорадка сохраняется, высока вероятность развития микозов, поэтому для лечения используют амфотерицин В и итраконазол.
Профилактика инфекции у пациентов с нейтропенией. Вероятность развития инфекции у пациентов с нейтропенией заметно снижается, если в больнице их помещают в индивидуальный бокс и снабжают стерилизованной пищей и водой. Большое значение имеет соблюдение стерильного режима не только медицинским персоналом (мытьё рук и использование одноразовых резиновых перчаток), но и посетителями (ношение халатов и масок). Воздух, поступающий в палату, необходимо пропускать сквозь фильтр специальной очищающей от грибковых спор системы.
Приём нистатина и амфотерицина В внутрь позволяет снизить вероятность развития грибковой инфекции. Достаточно эффективные препараты — флуконазол и итраконазол. В некоторых медицинских центрах применяют профилактическую терапию 4-фторхинолонами, действие которых направлено против факультативных анаэробов кишечника (при сохранении анаэробной флоры).
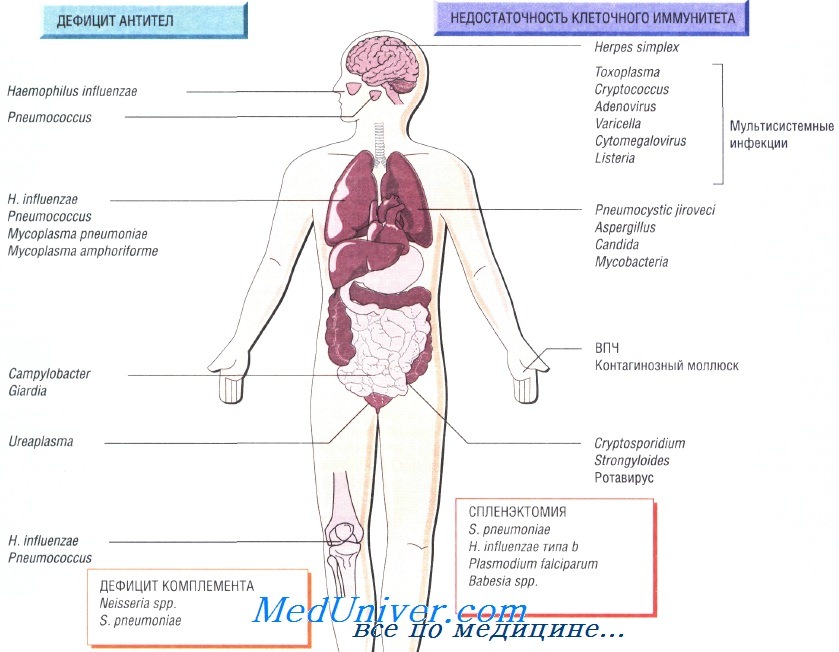
Причины инфекций при иммунодефиците
Недостаточность Т-клеточного иммунитета как причина инфекции при иммунодефиците
Недостаточность Т-клеточного иммунитета может быть обусловлена ВИЧ-инфекцией, противоопухолевой химиотерапией, приёмом глюкокортикоидных препаратов или трансплантацией органов. Врождённый дефицит обнаруживают достаточно редко. Он может быть связан только с недостаточностью функции Т-лимфоцитов или сопровождаться гипогаммаглобулинемией.
Возбудители инфекции при недостаточности Т-клеточного иммунитета. Основные возбудители — внутриклеточные патогенные микроорганизмы и паразиты:
• Toxoplasma gondii, Strongyloides stercoralis;
• Mycobacterium tuberculosis, M. avium-intracellulare;
• Listeria monocytogenes, Cryptococcus neoformans, Pneumocystis jiroveci;
• вирусы простого герпеса, цитомегаловирус, вирус опоясывающего герпеса и кори.
При осложнении кори гигантоклеточной пневмонией и энцефалитом у таких больных заболевание может приобрести угрожающий жизни характер.
Диагностика инфекции при недостаточности Т-клеточного иммунитета. Для диагностики инфекционных заболеваний применяют различные методы исследования. Для посева у пациентов отбирают не менее, чем два образца крови, взятых из разных мест.
Гиппогаммаглобулинемия как причина инфекции при недостаточности Т-клеточного иммунитета
Пациенты, страдающие сцепленной с Х-хромосомой агамма-глобулинемией, входят в группу повышенного риска заражения различными инфекциями в первые 6 мес своей жизни, в то время как люди с другим иммунодефицитом имеют повышенный риск на протяжении всей жизни. Функциональная гипогаммаглобулинемия возникает у больных с множественной миеломой.
Возбудителями рецидивирующих респираторных заболеваний у таких людей считают Streptococcus pneumoniae, недавно открытую Mycoplasma amphoriforme и не имеющего капсулы Haemophilus influenzae (вызывает бронхоэктазию). Персистирующие инфекции вызывают представители родов Giardia, Cryptosporidium и Campylobacter. Снизить частоту возникновения рецидивирующих инфекций помогает внутривенное введение иммуноглобулина.
Недостаточность комплемента как причина инфекции при недостаточности Т-клеточного иммунитета
Врождённую недостаточность комплемента наблюдают достаточно редко. Недостаточность последних компонентов системы комплемента (С7—С9) вызывает потерю способности лизировать грамотрицательные бактерии, в связи с чем повышается восприимчивость пациента к рецидивирующим инфекциям, вызванным микроорганизмами рода Neisseria. Недостаточность альтернативного пути системы комплемента приводит к развитию тяжёлых стрептококковых инфекций (S. pneumoniae), например менингита.
Приобретённая недостаточность системы комплемента часто возникает при системной красной волчанке.
Маннозасвязывающий лектин путь активации комплемента. Широкий спектр бактерий, грибов, вирусов и простейших прикрепляются к клеткам организма хозяина посредством маннозасвязывающего лектина. Есть данные, что при некоторых видах его недостаточности именно эти микроорганизмы вызывают наиболее частые и тяжёлые заболевания у людей с определёнными генотипами.
Инфекции возникающие после спленэктомии
Ежегодно после удаления селезёнки в 1% случаев наблюдают развитие тяжёлого сепсиса, при этом чаще всего заболевание возникает у младенцев и детей. Самую высокую смертность отмечают после спленэктомии, выполненной по поводу лимфомы и талассемии. У пациентов с серповидно-клеточной анемией развивается функциональная аспления. Риск развития сепсиса может со временем снизиться, но никогда не исчезнет окончательно.
Наиболее распространённый возбудитель инфекций (две трети всех случаев) — Streptococcus pneumoniae, но Н. influenzae и Е. coli также играют важную роль в этиологии инфекционных заболеваний у таких пациентов. Кроме того, спленэктомия повышает восприимчивость организма к инфекции, вызванной Capnocytophaga canimorsis (особенно после укусов собак). Малярия также может протекать крайне неблагоприятно (фульминантная форма).
Профилактика инфекции после спленэктомии. После удаления селезёнки всем пациентам необходимо провести вакцинацию, направленную против S. pneumoniae, менингококков и Н. influenzae типа В. Более эффективна иммунизация с использованием белковых конъюгированных вакцин. В некоторых случаях для профилактики применяют пенициллин V (в низких дозах).
Пациентов следует предупреждать о том, чтобы они сообщали своему лечащему врачу о любых признаках лихорадки, а также проинструктировать их относительно приёма антибиотиков (во избежание задержки лечения).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
С конца прошлого века аллергия превратилась в глобальную медико-социальную проблему. По данным ВОЗ, каждый пятый житель Земли сталкивался с аллергическими реакциями разной тяжести — от легкого конъюнктивита до анафилактического шока. Во всех случаях иммунная система реагирует на вещества и воздействия экзогенного типа. Пополняя ряды аллергиков, пациенты вынуждены ограничивать себя в еде, прогулках, посещении салонов красоты, общении с животными. Им приходится пить антигистаминные препараты, пользоваться противоаллергическими средствами для наружного применения. О том, как связана работа иммунной системы с развитием аллергии, почему снижается иммунитет, читайте в нашей статье.

Что такое иммунитет?
Это защита, которую обеспечивает сложная, но слаженная работа иммунной системы. Она отвечает за адаптацию организма к воздействиям извне, за сохранение антигенного равновесия. Потенциально угрожающие антигены (чужеродные агенты) бывают экзогенными (бактерии, вирусы, внутриклеточные паразиты, яды, аллергены, попавшие в организм из внешней среды) и эндогенными (атипичные клетки, появившиеся в организме под воздействием негативных факторов или из-за изменения внутренних биохимических процессов).
Первая линия защиты — естественный неспецифический иммунитет, с которым человек появляется на свет. Врожденные защитные силы представляют антитела, полученные от матери, а также лимфоциты кожи и слизистых, белки плазмы крови, нейтрофилы, макрофаги, наделенные функцией фагоцитоза (захвата, переваривания антигенов), антигенпрезентирующие клетки, nk-клетки — цитотоксические Т-лимфоциты, убивающие клеточных «врагов».
Вторая линия защиты — приобретенный специфический иммунитет. Он отвечает за формирование иммунологической памяти (способности системы молниеносно реагировать на повторные встречи с «чужаками»). Также специфический иммунитет регулирует иммунологическую реактивность. Механизм действия обеспечивают Т-лимфоциты клеточного ответа, В-лимфоциты гуморального ответа. Т-лимфоциты вступают в «бой» с антигенами, а из В-лимфоцитов образуются защитные антитела — иммуноглобулины. IgA — защищают слизистые оболочки, IgG и IgM — направленно работают против инфекций, IgE — отвечают за аллергические реакции.
Что такое иммунопатологии?
Самое поразительное, что чрезмерное «усердие» защитных сил может привести к развитию иммунопатологий:
- Иммунодефицит — экстремально низкий иммунитет. Первичные (врожденные) иммунодефициты обусловлены генетическими дефектами. Вторичные иммунодефициты возникают на фоне истощения организма, сильнейшей интоксикации, тяжелых вирусных инфекций (ВИЧ, цитомегаловируса, вирусов Эпштейна-Барр, герпеса, гепатита), хирургических повреждений органов иммунной системы.
- Аутоиммунные процессы, при которых запускается производство аутоантител. Патология развивается в результате того, что система перестает отличать «чужаков» от «родных» клеток.
- Иммунологическая толерантность — инертность иммунитета к определенным видам антигенов (толерогенам) из-за потери способности их идентифицировать. Если при аутоиммунных нарушениях иммунная система агрессивно настроена против «всех подряд», то при толерантности она просто перестает реагировать, например, на инфекции, раковые клетки.
Еще одно нарушение иммунологической реактивности — аллергия. Это неадекватный ответ системы на воздействия внешней среды, контакты с веществами, которые не представляют опасности.
Причины аллергии
С одной стороны, причину аллергии связывают с увеличением потенциальных раздражителей (аллергенов). Иммунитет просто не успевает адаптироваться к новым компонентам косметики, бытовой химии, а также к изменению климатических условий. С другой стороны, ученые полагают, что сенсибилизация (гиперчувствительность) вызывается стремлением человека создать стерильные условия жизни. Постоянная борьба с бактериями не дает иммунной системе работать в полную силу, а когда она встречается с незнакомым веществом, то обрушивает на него весь свой защитный потенциал. Кроме того, доказана наследственная предрасположенность к аллергическим реакциям. Если у одного из родителей развилась иммунопатология, то ребенок может унаследовать поврежденный ген. Предрасположенность не гарантирует обязательное развитие аллергии, но повышает риск приблизительно на 70%.
Виды и типы аллергии
Видовая классификация основана на факторах-провокаторах:
- Пищевая. В большинстве случаев гиперчувствительность провоцируют животные, растительные белки, содержащиеся в молоке, рыбе, морепродуктах, яйцах, сое, орехах, пшенице.
- Фармакологическая — иммунологический ответ на медицинские препараты. Среди лекарственных антигенов лидируют антибиотики, сульфаниламиды, нестероидные противовоспалительные препараты.
- Пыльцевая — поллиноз. Сезонная реакция возникает во время цветения аллергенных растений — полыни, амброзии, тополя, лебеды. Симптомы проявляются аллергическим ринитом (насморком), конъюнктивитом, кашлем.

- Инсектная — на укусы насекомых. В роли антигена выступают высокомолекулярные белки-ферменты, биогенные амины, пептиды, содержащиеся в ядах насекомых — пчел, ос, шершней, муравьев.
- Бытовая. Включает две группы аллергенов. Первая — шерсть животных, библиотечная пыль, плесневые грибы, синантропные клещи, живущие в домашней пыли и постельных принадлежностях. Вторая — компоненты косметики, парфюмерии, бытовой химии.
Отдельный вид иммунных реакций — это гиперчувствительность к климатическим условиям. Основные симптомы — зуд, темные пятна, шелушение кожи. Сенсибилизация к холоду считается псевдоаллергией, поскольку иммунная система реагирует не на определенное вещество, а на изменение белков организма под воздействием низких температур.
Схожая картина наблюдается при фотодерматите — аллергии на солнце. Под воздействием ультрафиолета фотосенсибилизаторы выделяют свободные радикалы, которые при контакте с белками преобразуются в новые вещества, являющиеся чужеродными для организма.
Классификация Джелла и Кумбса (1975 год) включает такие реакции:
- Анафилактические. Обусловлены выбросом гистамина при контакте IgE с антигеном. Возникают у детей и взрослых с пищевой, пыльцевой, лекарственной, бытовой гиперчувствительностью.
- Цитотоксические. Вызваны образованием цитотоксических иммуноглобулинов, которые уничтожают собственные клетки. Развиваются в ответ на лекарства, переливание несовместимой крови, резус-конфликт матери и плода.
- Иммунокомплексные. Спровоцированы формированием избыточного количества комплексов «антиген-антитело», что приводит к повреждению окружающих тканей. Подобные реакции характерны для сывороточной болезни, аутоиммунных заболеваний (анапластической анемии, ревматоидного артрита, системной красной волчанки).
- Клеточно-опосредованные. Представляют собой ответ Т-лимфоцитов на контакт с возбудителями инфекций, раковыми клетками.
Первый, второй, третий типы относятся к немедленному иммунному ответу, четвертый — к замедленной сенсибилизации.
Взаимосвязь иммунитета и аллергии
Рецепторы IgE расположены в мембранах базофилов — белых кровяных клеток. Изначально антитела Е были ориентированы на борьбу с паразитами. По мере социального развития «занятость» иммуноглобулинов Е заметно снизилась. Они «переключились» на раздражители, что стало причиной иммунологического нарушения. При контакте с аллергеном антитела Е дифференцируют его принадлежность к иммунной системе. Если агент признается «чужим», IgE будут стараться его уничтожить. В результате образуется иммунный комплекс «антиген-антитело», появляется аллергическая реакция с выбросом большого количества медиаторов воспаления — гистамина, интерлейкина-1, других цитокинов.
Гиперчувствительность и иммуносупрессия (снижение иммунитета) связаны между собой. Аллергики более восприимчивы к инфекционным заболеваниям, которые ослабляют защитные силы организма. И наоборот, ослабленный иммунитет уязвим перед развитием иммунопатологических реакций.
Причины сниженного иммунитета
Основные симптомы иммуносупрессии:
- хроническая сонливость, слабость, низкая работоспособность;
- частые ОРВИ, герпетические высыпания, кандидоз слизистых рта, половых органов;
- ломкие волосы и ногти, потрескавшиеся уголки рта;
- нарушение терморегуляции — беспричинное повышение температуры, озноб;
- нарушение пищеварения, чередование запора с диареей, метеоризм;
- тусклая сухая кожа, акне, слабая регенерация кожных покровов.
У человека с хроническими заболеваниями при снижении иммунного статуса учащаются и плохо поддаются купированию рецидивы болезни.

Существуют экзогенные и эндогенные причины снижения возможностей защитных сил. К первой группе относятся особенности образа жизни:
- Нездоровый рацион, основанный на быстрых углеводах, обилии животных жиров. При таком питании возникает дефицит витаминов, антиоксидантов, минералов, что приводит к развитию иммуносупрессивного состояния.
- Никотиновая, алкогольная зависимости. Перманентное или периодическое отравление токсинами изменяет состав крови. Повышается содержание эритроцитов, снижается количество клеток-защитников — лейкоцитов.
- Гиподинамия. Отсутствие физической активности ухудшает кровообращение, нарушает терморегуляцию, работу вегетативной нервной системы. Все это отражается на уровне иммунного статуса.
- Некорректное или бесконтрольное самолечение антибиотиками. Антибактериальные препараты убивают не только вредных организмов, но и полезную микрофлору, защищающую организм.
- Неправильный режим труда и отдыха, недостаток сна. Во-первых, организм просто не успевает восстановиться, из-за чего развивается синдром хронической усталости. Во-вторых, только во время сна вырабатываются гормоны, цитокины, участвующие в иммунологических реакциях.
Эндогенные причины снижения иммунного статуса — это хронические патологии и болезни, перенесенные с осложнениями:
- нарушение обмена веществ — сахарный диабет, подагра;
- заболевания крови — малокровие (анемия) различного генеза, геморрагический диатез;
- онкопатологии внутренних органов, кроветворной и лимфоидной ткани (гемобластозы);
- дисбактериоз, тяжелые кишечные инфекции, интоксикации.
Иммуносупрессия сопровождает постоперационные состояния, для которых характерна белково-энергетическая недостаточность — причина дисфункции фагоцитоза, ослабления гуморального и клеточного ответа.
Как повысить иммунитет?
Восстановить и поддержать защитные функции организма помогают:
- Нормализация сна. Ложиться спать лучше до полуночи, а просыпаться — не позднее 7 часов утра.
- Коррекция рациона. Рекомендуется ввести в меню больше овощей, фруктов, ягод, свежей зелени, продуктов, богатых железом, аминокислотами.

- Витаминотерапия. Повышенное внимание стоит уделить витамину D, аскорбиновой кислоте.
- Преодоление никотиновой зависимости, отказ от спиртных напитков.
- Регулярные прогулки. Свежий воздух насыщает кровь, ткани, органы кислородом.
- Усиление физической активности. Врачи советуют не пренебрегать ежедневной утренней зарядкой. Параллельно 2-3 раз в неделю следует посещать бассейн, тренажерный зал, заниматься йогой, пилатесом, фитнесом.
- Прием препаратов, повышающих иммунитет. Перед покупкой средств желательно проконсультироваться с врачом. Некоторые лекарства имеют противопоказания.
Нужно позаботиться и о психоэмоциональной стабильности — избегать конфликтов, не волноваться по пустякам.
От проникновения чужеродных бактерий, вирусов и белков организм защищает иммунная система. Она уничтожает собственные дефектные клетки, которые могут дать начало онкологии. Иммунитет имеет сложную структуру. Его работа изучена не полностью, но давно известно, что нормальное функционирование зависит от витаминов.
Как витамины влияют на иммунитет
Витамины – это биологически активные вещества с небольшой молекулярной массой. Они необходимы человеку для поддержания обменных процессов. Витамины участвуют в биохимических реакциях, протекающих в клетках, и выступают в качестве катализаторов или коферментов. Их роль – ускорение или поддержание скорости реакции между другими веществами. Поэтому от их присутствия зависит синтез белков и производство многих компонентов клеток.
Белки – это важный компонент иммунитета, они:
- это часть антитела, которые блокируют чужеродные микроорганизмы;
- помогают формировать зону воспаления, чтобы инфекция не попадала в другие ткани;
- регулируют скорость воспроизведения иммунных клеток;
- участвуют в аллергических реакциях;
- защищают органы от атаки иммунной системы и развития аутоиммунных реакций.

Если человек не получает нужное количество витаминов, белков становится меньше, и эти функции нарушаются.
Почему возникает гиповитаминоз
Дефицит витаминов называется гиповитаминоз, а полное отсутствие нужного вещества – авитаминоз. Эти состояния возникают при недостаточном поступлении или при повышенной потребности организма в биологически активных веществах.
Гиповитаминоз может возникать при неправильном питании, нехватке в рационе овощей и фруктов. Страдает иммунитет у людей, которые длительно придерживаются монодиеты и ограничивают употребление определенных групп продуктов. Не все учитывают изменение потребности в витаминах при определенном рационе. Увеличивая в меню количество белковой пищи, нужно дополнительно повышать содержание витамина В6, а придерживаясь вегетарианства, дополнительно принимать витамин В12. Иначе иммунная система даст сбой и увеличится количество простудных заболеваний, чаще напомнят о себе хронические болезни.
Развитию гиповитаминоза способствуют:
- длительные инфекционные заболевания;
- период выздоровления;
- беременность и кормление грудью;
- болезни пищеварения;
- нехватка солнечного света;
- тяжелый физический труд.
Поэтому врачи назначают всем людям из группы риска препараты для повышения иммунитета.
Можно ли укрепить иммунитет питанием
Если человек ищет способ, как повысить иммунитет, часто он начинает с народных методов или пробует корректировать питание. Некоторые лекарственные растения способны улучшить неспецифические факторы защиты, повышают выработку белков-интерферонов. Такими свойствами обладают средства на основе эхинацеи (например, Найрин эхинацея), березового гриба, ромашки, элеутерококка (например, экстракт элеутерококка) и тимьяна. В народной медицине есть много рецептов приготовления отваров, настоев из этих растений в домашних условиях. Но нет научных данных, подтверждающих высокую эффективность этих средств.
Экстракты трав, которые использует народная медицина, но в точных дозировках, можно приобрести в виде таблеток и готовых растворов. Эти препараты относятся к группе иммуностимуляторов. Они обеспечивают поддержку организма в сезон респираторных заболеваний, помогают быстро восстановиться после болезни и улучшают общее самочувствие.

Основной источник поступления витаминных соединений – продукты питания. Считается, что здоровый взрослый человек сможет обеспечить организм нужными компонентами и укрепить иммунитет, если рацион будет разнообразным и сбалансированным.
Существуют нормы потребления каждого типа витаминов для взрослых и детей, а также беременных женщин. В специальных таблицах можно найти сведения о содержании полезных веществ в 100 г определенных продуктов. После подсчета определяют, какую пищу и в каком количестве нужно употреблять в день, чтобы усиливать свой иммунитет.
Недостаток способа в том, что содержание полезных веществ отличается от стандартных таблиц, а некоторые витамины разрушаются после приготовления продуктов. Поэтому взрослому человеку потребуется съедать несколько килограмм капусты или смородины в день, чтобы получить нужное количество аскорбиновой кислоты.
Когда нужно принимать витамины
Ухудшение функции иммунной системы связывают с окончанием зимнего сезона, но организм нуждается в поддержке круглый год. Витаминные препараты не нужно пить постоянно, достаточно укреплять иммунитет в критические периоды:
- осенью до подъема заболеваемости простудами и зимой;
- после перенесенного ОРВИ или другой инфекции;
- при планировании беременности или в период лактации;
- перед длительным путешествием и сменой часовых поясов или климатических зон;
- после лечения хронического заболевания;
- при длительном или частом употреблении алкоголя;
- при соблюдении строгой диеты.
Иммунитет страдает при гормональных изменениях, которые происходят у женщин в разные периоды жизни. Его укрепление зависит не только от правильно подобранного основного лечения, но и использования витаминных средств.
ТОП-5 витаминов для укрепления иммунитета
Поднятию функции защитной системы помогают не все препараты. Исследования позволили выделить витамины, повышающие иммунитет и укрепляющие здоровье. Они выпускаются в виде отдельных лекарственных препаратов, которые можно использовать самостоятельно дома. Но чтобы эффективное средство не принесло вред, перед тем как потратить на него деньги, нужно посоветоваться с врачом. Он поможет определить, каких веществ не хватает и в какой дозировке их лучше принимать.
Витамин D
На первом месте среди средств для укрепления иммунитета витамин Д, или кальциферол. Его выработка происходит в коже под влиянием ультрафиолета у всех взрослых людей. Но в зимний сезон, в северных широтах, где солнечного света мало, организму не хватает кальциферола. Из-за гиповитаминоза снижается иммунитет, ухудшается всасывание кальция, может развиться остеопороз. У детей нехватка витамина приводит к рахиту. Фукции витамина Д различны.При его участии осуществляется противоопухолевый имунитет;проведено несколько клинических исследований, согласно которым,при нормальном содержании витаминов Д риск развития, например, рака кишечника снижается, практически, вчетверо. В настоящее время,исследуется возможность применения витаминов этой группы в лечении псориаза, остеопороза,избыточной массы тела, сердечно-сосудистых заболеваний; Витамин Д применяется для снижения возрастных изменений в тканях, профилактики таких тяжелейших болезней,как болезнь Альцгеймера, различных видов деменций и заболеваний,разрушающих оболочку нерва, состояний мышечной слабости и т.д.
В самостоятельно(в домашних условиях)можно повышать содержание кальциферола рыбьим жиром, употребляя большое количество морской рыбы,выращенной в диких условиях, яица(желток),молочные продукты,водоросли,икра,кукурузное масло, некоторые виды лесных грибов.Самое большое содержание в лососине и печени трески. Взрослым можно применять комплексы, которые содержат холекальциферол и кальций, чтобы улучшать иммунитет и поддерживать минеральную плотность костей.
Группа В
Витаминные средства группы В включают несколько типов веществ. Доказано, что повышение иммунитета обеспечивают витамины В2, В6, В12. В домашних условиях их можно получить из животных продуктов: молока, яиц, печени,злаковые, бобовые, орехи,мясо, морепродукты, картофель.
Влияние на иммунитет заключается в способности улучшать противомикробную защиту, увеличивать выработку Т и В-лимфоцитов, которые борются с патогенными микроорганизмами.

Красивая и здоровая кожа, нормальное зрение, в сочетании с В9 он улучшает процессы кроветворения. он стимулирует образование аденозитрифосфорной кислоты- «бензин» для работы клеток. Нехватка витамина В2 (рибофлавина) проявляется в виде нарушений пищеварения, развития конъюнктивита, стоматита, себорейного дерматита. Если в организме мало В2, это проявляется склонностью к частым инфекционным заболеваниям.У больных ВИЧ гиповитаминоз ускоряет переход болезни в более тяжелую стадию.
Для укрепления иммунитета витаминные препараты группы В выпускаются в виде отдельных средств каждого вида или готовых комплексов из 2 и более компонентов (например, Суперум). В некоторых случаях для быстрого эффекта врач может назначить раствор для уколов.
Токоферол, или витамин Е
Эффективный способ получить суточную дозу токоферола – ежедневно употреблять в пищу семечки, орехи и растительные масла. Но потребность в витамине усиливает большое количество в рационе полиненасыщенных жирных кислот, которые содержатся в морской рыбе и морепродуктах.
Укрепление иммунной функции при помощи токоферола происходит за счет увеличения антиоксидантной защиты клеточных оболочек. Он усиливает способность организма противостоять разрушительному влиянию вредных экологических факторов, вирусов. Этот витамин помогает повысить выработку антител, а также блокирует размножение опухолевых клеток. Чаще всего его эффект усиливают аскорбиновая кислота и ретинол, которые вместе формируют антиоксидантный комплекс.
Аскорбиновая кислота
При появлении первых признаков простуды быстро укрепить иммунитет помогает аскорбиновая кислота, или витамин С. Ее можно найти в большинстве продуктов растительного происхождения:
- квашеной капусте;
- смородине;
- шпинате;
- сладком перце;
- томатах;
- шиповнике;
- цитрусовых.
Но аскорбиновая кислота разрушается при нагревании до 60°С, поэтому термически обработанная пища, чай уже не способны поддержать иммунную систему. Хороший способ – использовать готовые препараты, в которых точно известна дозировка активного вещества.

Витамин С усиливает выработку всех типов антител, увеличивает активность клеток-макрофагов, которые поглощают чужеродные микроорганизмы и опасные вещества. Он помогает укрепить сосудистую стенку, нормализует обменные процессы в печени и обезвреживание в ней токсинов.
Витамин А
Исследования показали, что ретинол, или витамин А, усиливает синтез белков-интерлейкинов. Они стимулируют деление Т-лимфоцитов. Эти клетки являются активными участниками иммунных реакций, они выявляют и уничтожают вирусы и бактерии, борются с опухолевыми клетками. Использование препаратов ретинола позволяет увеличить устойчивость к инфекциям, ускорить выздоровление и обеспечить антиоксидантную защиту.
Ретинол можно найти в привычных продуктах. В большом количестве он содержится в моркови, яйцах, печени трески, молоке и сливочном масле. Его много в шалфее, базилике, паприке и боярышнике.
Комплекс или по отдельности
Если врач заметит признаки гиповитаминоза, он назначит витаминный препарат определенного типа. Например, при остеопорозе нужен кальциферол, но для улучшения эффекта его используют вместе с кальцием. Людям, часто страдающим вирусным конъюнктивитом назначат пиридоксин. Но некоторые вещества работают лучше, если их используют в одной таблетке. Это относится к антиоксидантному комплексу из витаминов А, Е и С. Его можно использовать как для профилактики снижения иммунитета, так и на этапе выздоровления.
Потребность в биологически активных веществах изменяется в зависимости от возраста, пола, сопутствующих патологий. Поэтому врачи могут рекомендовать готовые поливитаминные комплексы. Они имеют сбалансированный состав, учитывают индивидуальные особенности организма и помогут противостоять многим болезням.
Читайте также:

