Кожные покровы при кетоацидозе
Обновлено: 26.04.2024
Для цитирования: Лукьянчиков В.С. Кетоз и кетоацидоз. Патобиохимический и клинический аспект. РМЖ. 2004;23:1301.
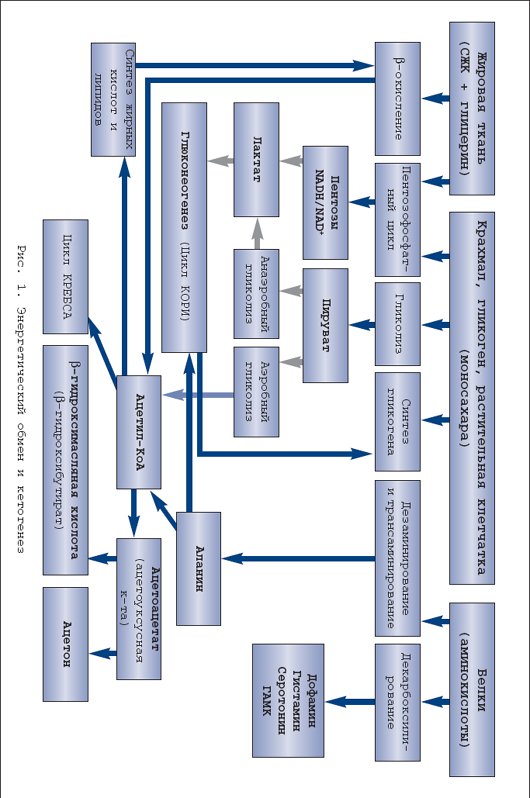
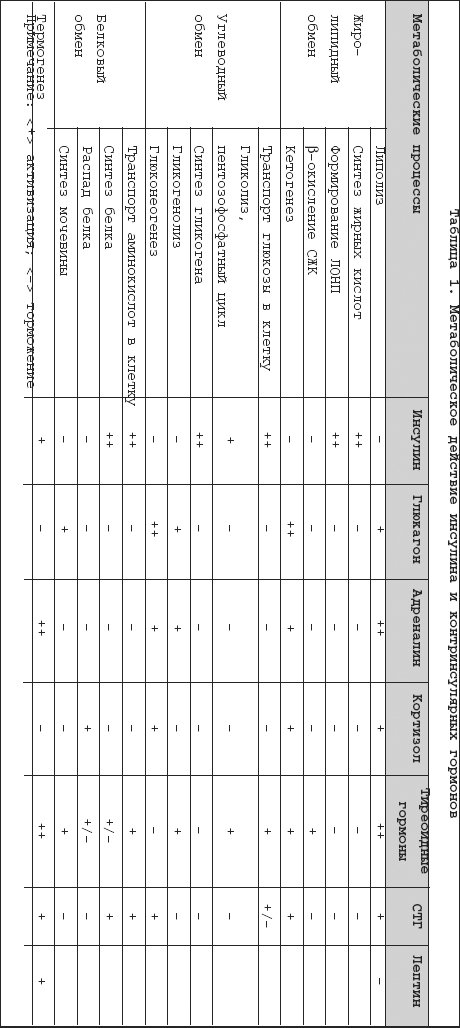
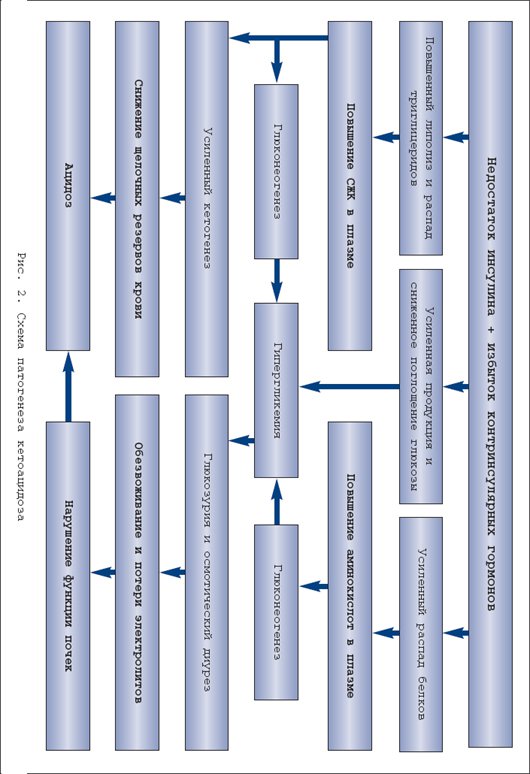
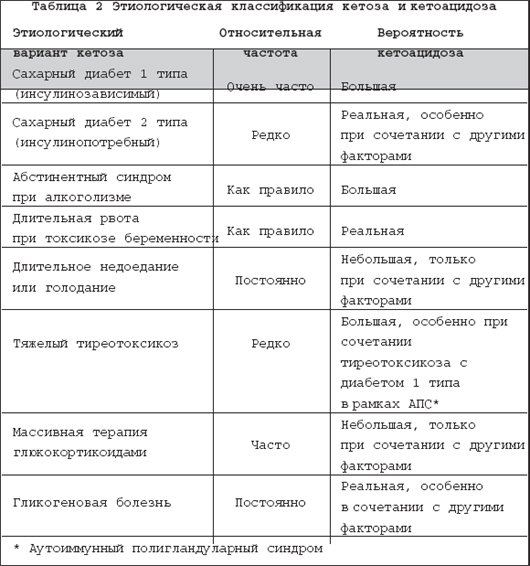
Избыток массы тела и ожирение представляют одну из самых актуальных медико–социальных проблем современности. Это наиболее значимые факторы риска, вернее причина сердечно–сосудистой патологии, сахарного диабета и ряда других болезней и синдромов. Острота этой проблемы повсеместно нарастает в связи с общей тенденцией к старению населения, а во многих странах еще из–за низкого уровня жизни, что, как известно, негативно влияет на структуру питания и способствует ожирению. С точки зрения главных медицинских требований – безопасности и эффективности – наиболее приемлемым методом борьбы с ожирением является ограничение приема пищи . В этом плане лучшие результаты дает низкокалорийная белковосберегающая диета с энергетической ценностью порядка 800 ккал за сутки и содержанием белка не меньше 50 г [2,8]. Однако некоторые исследователи просматривают связь подобных диет с определенными нежелательными и даже опасными последствиями, такими как гипогликемия, гиперурикемия, гиперлипидемия, кардиоаритмия, желчекаменная болезнь, остеопороз и др. [3,5,9,11]. Среди этих последствий едва ли не самую большую тревогу врачей и пациентов вызывает кетоз (очевидно, по ассоциации с диабетической кетоацидотической комой). Определение, биохимия и патобиохимия кетоза Кетоновые тела – группа органических соединений, являющихся промежуточными продуктами энергетического обмена, т.е. метаболизма жиров, белков и углеводов. Термином кетоновые тела обозначают три соединения: ацетоуксусную кислоту (ацетоацетат). ? –гидроксимасляную кислоту ( ? –гидроксибутират) и ацетон [1]. Образование кетоновых тел, или кетогенез, является физиологическим процессом, иными словами непременной частью энергетического обмена. В процессе этого обмена происходит «сгорание» и взаимотрансформация углеводов, жиров, белков и других энергосубстратов с образованием энергии, которая либо превращается в тепло, с целью поддержания оптимальной температуры тела, либо аккумулируется в виде АМФ, АДФ и АТФ. Эти соединения в качестве энергетических аккумуляторов имеют малую емкость, поскольку расположены внутри клеток, к тому же непрерывно расходуются на обеспечение клеточной жизни. Более того, синтез этих энергоносителей требует больше энергии, чем та, которая запасена в них. Поэтому реальными энергетическими резервами организма служат гликоген, жировая ткань и белковые структуры. Биологическая целесообразность отводит гликогену последнее место в рейтинге запасных энергосубстратов. Во–первых, потому, что в организме гликоген никаких других функций, кроме энергетических, не имеет. Во–вторых, гликоген трудно стабилизировать, т.е. сохранять в живой ткани, причем для хранения требуется большое количество воды, что сильно снижает энергоемкость гликогена, и без того меньшую, чем у белка и жира. Очевидно, по этим причинам запасы гликогена у человека невелики, составляя примерно 500–700 г. Энергетический эквивалент этих запасов составляет 2–3 тыс. ккал, что не покрывает даже суточную энергетическую потребность человека. Наибольшим энергетическим потенциалом обладают белки тела. У взрослого человека их общая масса достигает 35–40 кг, что эквивалентно 150–170 тыс. ккал. Но по понятным причинам использовать в качестве энергоисточника собственные белки крайне нежелательно. В итоге самым оптимальным способом сохранения запаса энергии является синтез и отложение жира . По всей видимости, именно в этом кроется главная причина склонности людей к ожирению и его большой распространенности. Количество жировой ткани у взрослого человека – очень вариабельная и сугубо индивидуальная характеристика. По приблизительным подсчетам масса жировой ткани у человека средней упитанности составляет 15–18 кг. С учетом высокой энергоемкости (9 ккал на 1 г), общая энергетическая ценность этого количества жира практически не уступает энергоемкости белков тела. При этом жировая ткань выполняет в организме множество других важных функций: синтез и метаболизм гормонов и биоактивных субстанций, теплопродукция, изоляция и сохранение тепла, придание эластичности мягким тканям, фиксация органов, и многое другое. Таким образом, у человека есть веские основания заботиться о поддержании жировых запасов. И не случайно система регуляции энергетического обмена в большей мере ориентирована на создание запасов жира, чем на их растрату. Такой приоритет является второй существенной причиной большой частоты ожирения и того, почему с ожирением так трудно бороться. Принципиальная схема энергетического обмена, в том числе образование кетоновых тел, представлена на рисунке 1. Основные регуляторы энергообмена приведены в таблице 1. Анализируя схему и таблицу следует выделить два ключевых момента. Во–первых, энергообмен условно разделяют на анаболическую фазу (синтез жира и гликогена) и катаболическую фазу (гликолиз – окисление жирных кислот, мобилизация и дезаминирование аминокислот). При этом главным стимулятором анаболической части обмена является инсулин, в то время как катаболические процессы усиливают многочисленные контринсулярные гормоны. Во–вторых, ключевым субстратом энергетического обмена и одновременно исходной субстанцией для синтеза кетокислот служит ацетил–КоА. Именно содержание ацетил–КоА определяет направление клеточного метаболизма в данный момент , а именно – будет происходить синтез и накопление гликогена, жира и синтез белков или, напротив, будут расходоваться ранее накопленные энергозапасы. А это, в первую очередь, зависит от количества пищи, поступающей в организм. Если пищи много и ее количество превышает текущие энерготраты, часть пищевых энергоносителей преобразуется преимущественно в жир, так как запасы гликогена, как уже отмечалось, невелики, и эта «кладовая» быстро наполняется. Если пищи мало или ее нет, организм восполняет дефицит, расходуя ранее сделанные запасы – сначала гликоген, затем жир. Известно, что некоторые ткани и органы, в частности, корковое вещество почек, эритроциты и, что особенно важно, мозг используют в качестве источника энергии только углеводы (точнее, глюкозу). В сутки для этого требуется около 200 г глюкозы, которую организм получает путем расщепления гликогена. Правда, при распаде 100 г жировой ткани тоже выделяется около 10 г глицерина, но этого слишком мало. В результате липолиз и ? –окисление продуктов распада жира, являющиеся основным источником энергии в условиях недостатка пищи, не в состоянии обеспечить энергией ряд важнейших структур организма. Для решения этой задачи есть два альтернативных способа. Во–первых, глюконеогенез, т.е. эндогенный синтез гликогена. Во–вторых, синтез кетокислот, которые успешно усваиваются мозгом и другими тканями с ограниченными метаболическими возможностями и тем самым служат заменой глюкозе. Напомним, что кетокислоты – это продукт метаболизма ацетил–КоА, который при дефиците пищи образуется либо из собственных белков, либо из жира. Из двух названных эндогенных источников энергоснабжения мозга предпочтительным является кетогенез. Дело в том, для что глюконеогенеза необходима аминокислота аланин, которую в условиях дефицита пищи организм получает только за счет разрушения собственных белков, осуществляемого глюкокортикоидными гормонами надпочечников (табл. 1). Поэтому вполне закономерно, а правильнее сказать, в соответствии с законом биологической целесообразности энергообмен при дефиците пищи сопровождается усиленным образованием кетокислот и повышением их концентрации в крови, т.е. кетозом. Нужно заметить, что эти метаболические события не только целесообразны, но даже предпочтительны для организма, и при этом рационально организованы. Накапливаясь в крови, кетокислоты подавляют секрецию и специфическую активность глюкокортикоидов [10], тем самым препятствуя протеолизу, т.е. разрушению структурных белков организма. Наряду с этим кетоз угнетает секрецию и действие глюкагона [1,6], основного стимулятора глюконеогенеза и кетогенеза. Таким образом, сдерживая протеолиз и глюконеогенез, кетокислоты сберегают структурные белки организма, а подавляя глюкагон, предотвращают чрезмерное образование и опасное накопление в крови кетоновых тел. К сожалению, интенсивность кетогенеза и скорость поглощения кетокислот тканями – величины крайне вариабельные, индивидуальные, не поддающиеся прогнозу и количественной оценке. Дополнительно затрудняет оценку кетоза то, что главная из трех кетокислот, а именно ? –гидроксибутират, синтезируется как из ацетоацетата, так и непосредственно из ацетил–КоА (рис. 1). Между тем применяемыйв клинике нитропруссидный метод определения кетокислот выявляет только ацетоацетат, причем когда его концентрация достигает 2,5–3 ммоль/л. Очевидно, поэтому нет четких лабораторных критериев верхней границы нормального содержания кетокислот в крови, т.е. физиологического кетоза, который является компенсаторно–приспособительной реакцией, призванной устранить недостаток глюкозы, необходимой для питания мозга. По этой же причине в клинической практике термины кетоз и кетоацидоз нередко отождествляют, что, конечно же, неправильно. Ацидоз, в том числе кетоацидоз, это однозначно патологическое состояние, а именно форма нарушения кислотно–щелочного состояния организма, когда происходит сдвиг соотношения между анионами кислот и катионами оснований в сторону увеличения анионов [7]. По определению ацидоз – лабораторный термин. Его лабораторными критериями служат рН крови ниже 7,35 и концентрация стандартного бикарбоната сыворотки крови менее 21 ммоль /л. Для верификации метаболического ацидоза , к которому относится кетоацидоз, используют показатель анионной разницы [1,7]. В норме анионная разница сыворотки крови не превышает 14 ммоль/л, а при кетоацидозе увеличивается до 15–20 ммоль/л. Таким образом, усиленный кетогенез и умеренный кетоз, сопровождающие длительное голодание или хроническое недоедание, изначально представляют собой не патологическое расстройство энергетического обмена, а компенсаторно–приспособительную реакцию. Вместе с тем нельзя не признать, что в клинической практике известно много случаев, когда чрезмерно выраженные компенсаторные реакции пробретают вполне патологический характер, превращаясь в так называемые болезни адаптации. Применительно к обсуждаемой проблеме такая возможность рассмотрена ниже. Клинические формы кетоза и кетоацидоза С учетом компенсаторно–приспособительной роли кетогенеза, очевидно, имеется множество клинических ситуаций, которые могут сопровождаться развитием кетоза и кетоацидоза. Наиболее частые из них, иными словами, этиологическая классификация кетоза и кетоацидоза с оценкой вероятности перехода кетоза в кетоацидоз представлена в таблице 2. Самой частой причиной кетоза и кетоацидоза является декомпенсация сахарного диабета 1 типа . Усиленный кетогенез в этом случае обусловлен, с одной стороны, дефицитом инсулина, с другой, избытком контринсулярных гормонов: глюкагона, катехоламинов, кортизола и гормона роста (СТГ). Как уже отмечалось, контринсулярные гормоны активизируют в основном катаболическую часть энергообмена, поэтому в условиях недостатка инсулина усиливается гликолиз, гликогенолиз, глюконеогенез и липолиз. Массивный липолиз сопровождается ростом в крови уровня свободных жирных кислот (СЖК), из которых в печени под действием глюкагона в избытке синтезируются кетоновые кислоты. А так как при недостатке инсулина замедляются все анаболические процессы, в том числе утилизация кетокислот, последние накапливаются в крови с неизбежным развитием метаболического ацидоза, т.е. кетоацидоза (рис. 2). Кетоз, тем более кетоацидоз при сахарном диабете 2 типа – явление редкое, так как при этом типе диабета нет дефицита инсулина. Правильнее сказать, имеется относительная инсулиновая недостаточность, что подразумевает ослабленное действие инсулина в органах и тканях. При этом надо принять во внимание, что действие инсулина на жировую ткань в десятки раз сильнее, чем на другие ткани, поэтому при декомпенсации сахарного диабета 2 типа происходит (в основном) рост гликемии, а липолиз и кетогенез почти не усиливаются [1]. Вместе с тем, если декомпенсация сахарного диабета 2 типа протекает на фоне кетогенных факторов или условий (табл. 2), кетоз и даже кетоацидоз вполне вероятны. Гиперпродукция кетокислот и кетоацидоз при хронической алкогольной интоксикации, точнее, спустя 1–2 дня после чрезмерного потребления спиртного – явления настолько частые, что принят даже специальный термин «алкогольный кетоацидоз». Метаболизм этанола в организме осуществляет печеночный фермент алкогольдегидрогеназа. Этот фермент превращает этанол в ацетальдегид, который, в свою очередь, активизирует образование НАД –Н, а последний способствует синтезу ацетоацетата и особенно ? –гидроксибутирата. Еще одним последствием алкогольной интоксикации является торможение глюконеогенеза и снижение уровня глюкозы в крови. Гипогликемия стимулирует липолиз, что также способствует усиленному кетогенезу. Кроме того, для абстинентого синдрома характерна дегидратация, которая также способствует развитию кетоацидоза. В отличие от кетоацидоза другой природы пациенты с алкогольным кетоацидозом обычно пребывают в сопорозном состоянии. При этом вследствие преимущественного образования. ? –гидроксибутирата, нитропруссидный тест определения кетокислот у них обычно дает отрицательный результат. Все это сильно затрудняет диагностику алкогольного кетоацидоза. Кетоз при длительной рвоте, недоедании или голодании представляет классический компенсаторный процесс, призванный восполнить энергетический дефицит, точнее, недостаток углеводов, за счет альтернативных энергосубстратов – кетокислот. Этот механизм обсуждался выше. Здесь уместно повторить, что кетокислоты тормозят собственную продукцию по принципу аллостерического механизма, поэтому их чрезмерное накопление и развитие кетоацидоза в этой ситуации маловероятно. Вместе с тем, если при токсикозе беременности или неукротимой рвоте другой природы возникает тяжелая дегидратация, то кетоацидоз возможен [4]. Патогенез кетоза при тиреотоксикозе, избытке глюкокортикоидов или дефиците ферментов глюконеогенеза,в сущности, аналогичен уже рассмотренным механизмам гиперпродукции кетокислот вследствие избытка контринсулярных гормонов или из–за дефицита эндогенного синтеза глюкозы. Интерес к кетогенным диетам не ослабевает, т.к. именно кетоз является наиболее эффективным механизмом катаболизма жировой ткани. Учитывая популярность диетотерапии и одновременно острую проблему ожирения, Европарламент поручил своей комиссии по безопасности продуктов питания рассмотреть наиболее популярные и научно обоснованные диеты на территории Европы. Была сформирована группа из 18 ученых, представляющих 12 европейских стран. Эта группа всесторонне рассмотрела около 15 низкокалорийных диет (НКД) с точки зрения безопасности использования, показаний, абсолютных и относительных противопоказаний, побочных эффектов, осложнений и другие аспекты [12]. Три главы из этого доклада были посвящены кетозу; кетоз и катаболизм белка при использовании НКД (6.4), кетоз и баланс кальция при НКД (6.5) и кетоз и гиперурикемия при НКД (глава 6.6). В сентябре 2002 года экспертный доклад был одобрен на заседании комиссии Европарламента [12]. В отчете указано, что несмотря на очевидные противопоказания, большинство диет распространяется через продуктовые универмаги или аптеки. Четыре диеты распространяются через медицинских консультантов, а одна используется только под медицинским наблюдением. Выписать эту низкокалорийную диету может только врач. Этой диетой является французская Insudiet – в Европе более известная, как Евродиета [13,14]. По заявлению производителей, первые две фазы этой диеты являются кетогенными, следовательно, диета не должна сопровождаться чувством голода и должна быть достаточно эффективной. Как любая медицинская технология, процедура либо лекарственное средство, любая методика избавления от лишнего веса должна проходить регистрацию, сертификацию и клинические испытания на территории Российской Федерации. В отделении клинической диагностики и профилактики алиментарных нарушений Клиники лечебного питания ГУ НИИ питания РАМН летом 2003 года были проведены клинические испытания высокобелковых продуктов «Евродиета ® » по методу «Евродиета ® », производства компании «Евродиета ® », Франция [15]. Клинический анализ мочи пациентов подтвердил появление кетоновых тел на фоне проводимой диетотерапии, что подтверждает механизм снижения массы тела за счет липолиза на фоне приема гипокалорийных высокобелковых продуктов «Евродиеты ® ». Образовавшиеся кетоновые тела, воздействуя на центр голода, способствуют проявлению их двойного действия. Анорексигенное действие заключалось в том, что кетоновые тела, помимо стимулирования центра насыщения в гипоталамусе, вызывали эффект физиологического подавления аппетита. Кетоновые тела обеспечивают около 80% всей потребности мозга в энергии и обладают психотоническими свойствами в виде антидепрессивного эффекта. В заключение нужно еще раз подчеркнуть, что кетоз – явление изначально компенсаторное, значит – физиологическое. Обычно при голодании или гипокалорийной диете кетоз опасности не представляет, т.к. не достигает степени кетоацидоза. Такое развитие кетоза возможно только в результате действия дополнительных кетогенных факторов, например, дегидратации или алкогольной интоксикации. Точное соблюдение условий диетотерапии в сочетании с квалифицированным лабораторным и врачебным мониторингом гарантируют безопасность гипокалорийной диеты, по крайней мере, в отношении кетоацидоза.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Ацетонемический синдром – симптомокомплекс, обусловленный нарушением обменных процессов и накоплением в крови ребенка кетоновых тел. Ацетонемический синдром проявляется ацетонемическими кризами: многократной рвотой, дегидратацией, интоксикацией, запахом ацетона изо рта, абдоминальным синдромом, субфебрилитетом. Ацетонемический синдром диагностируется на основании клинических данных и лабораторных показателей (выявления кетонурии, нарушения электролитного баланса, повышения уровня мочевины и др.). При ацетонемическом кризе показана инфузионная терапия, постановки очистительной клизмы, оральная дегидратация, диета с включением легкоусвояемых углеводов.
Общие сведения
Ацетонемический синдром (синдром циклической ацетонемической рвоты, недиабетический кетоацидоз) – патологическое состояние, сопровождающееся повышением содержание в крови кетоновых тел (ацетона, b-оксимасляной кислоты, ацетоуксусной кислоты), образующихся вследствие нарушения обмена аминокислот и жиров. Об ацетонемическом синдроме у детей говорят в случае повторяющихся ацетонемических кризов.
В педиатрии различают первичный (идиопатический) ацетонемический синдром, являющийся самостоятельной патологией, и вторичный ацетонемический синдром, сопровождающий течение ряда заболеваний. К развитию первичного ацетонемического синдрома склонны около 5% детей в возрасте от 1 года до 12-13 лет; соотношение девочек к мальчикам составляет 11:9.
Вторичная гиперкетонемия может возникать при декомпенсированном сахарном диабете у детей, инсулиновой гипогликемии, гиперинсулинизме, тиреотоксикозе, болезни Иценко-Кушинга, гликогеновой болезни, ЧМТ, опухолях мозга в области турецкого седла, токсических поражениях печени, инфекционном токсикозе, гемолитической анемии, лейкемии, голодании и др. состояниях. Поскольку течение и прогноз вторичного ацетонемического синдрома определяется основным заболеванием, в дальнейшем речь пойдет о первичном недиабетическом кетоацидозе.

Причины
В основе развития ацетонемического синдрома лежит абсолютная или относительная недостаточность углеводов в рационе питания ребенка либо преобладание жирных кислот и кетогенных аминокислот. Развитию ацетонемического синдрома способствует недостаточность ферментов печени, участвующих в окислительных процессах. Кроме этого, особенности метаболизма у детей таковы, что имеет место снижение кетолиза - процесса утилизации кетоновых тел.
При абсолютной или относительной недостаточности углеводов энергетические потребности организма компенсируются усиленным липолизом с образованием избытка свободных жирных кислот. В условиях нормального метаболизма в печени происходит трансформация свободных жирных кислот в метаболит ацетил-коэнзим А, который в дальнейшем участвует в ресинтезе жирных кислот и образовании холестерина. Лишь небольшая часть ацетил-коэнзима А расходуется на образование кетоновых тел.
При усиленном липолизе количество ацетил-коэнзима А избыточно, а активность ферментов, активизирующих образование жирных кислот и холестерина, недостаточна. Поэтому утилизация ацетил-коэнзима А происходит в основном путем кетолиза.
Большое количество кетоновых тел (ацетона, b-оксимасляной кислоты, ацетоуксусной кислоты) вызывает нарушение кислотно-основного и водно-электролитного равновесия, оказывает токсическое действие на ЦНС и желудочно-кишечный тракт, что находит свое выражение в клинике ацетонемического синдрома.
Факторами, провоцирующими ацетонемический синдром, могут выступать психоэмоциональные стрессы, интоксикации, боль, инсоляция, инфекции (ОРВИ, гастроэнтерит, пневмония, нейроинфекции). Важную роль в развитии ацетонемического синдрома играют алмиментарные факторы - голодание, переедание, чрезмерное употребление белковой и жирной пищи при дефиците углеводов. Ацетонемический синдром у новорожденных обычно связан с имевшим место у беременной поздним токсикозом – нефропатией.
Симптомы ацетонемического синдрома
Ацетонемический синдром часто встречается у детей с аномалиями конституции (нервно-артритическим диатезом). Таких детей отличает повышенная возбудимость и быстрая истощаемость нервной системы; они имеют худощавое телосложение, часто излишне пугливы, страдают неврозами и беспокойным сном. В то же время у ребенка с нервно-артрической аномалией конституции быстрее сверстников развиваются речь, память и другие познавательные процессы. Дети с нервно-артрическим диатезом склонны к нарушению обмена пуринов и мочевой кислоты, поэтому в зрелом возрасте подвержены развитию мочекаменной болезни, подагры, артритов, гломерулонефрита, ожирения, сахарного диабета 2 типа.
Типичными проявлениями ацетонемического синдрома служат ацетонемические кризы. Подобные кризы при ацетонемическом синдроме могут развиваться внезапно или вслед за предвестниками (так называемой аурой): вялостью или возбуждением, отсутствием аппетита, тошнотой, мигренеподобной головной болью и др.
Типичная клиника ацетонемического криза характеризуется многократной или неукротимой рвотой, которая возникает при попытке покормить или напоить ребенка. На фоне рвоты при ацетонемическом синдроме быстро развиваются признаки интоксикации и дегидратации (мышечная гипотония, адинамия, бледность кожи с румянцем).
Двигательное возбуждение и беспокойство ребенка сменяются сонливостью и слабостью; при тяжелом течении ацетонемического синдрома возможны менингеальные симптомы и судороги. Характерны лихорадка (37,5-38,5°С), спастические боли в животе, диарея или задержка стула. Изо рта ребенка, от кожных покровов, мочи и рвотных масс исходит запах ацетона.
Первые приступы ацетонемического синдрома обычно появляются в возрасте 2-3-х лет, учащаются к 7 годам и полностью исчезают к 12-13-летнему возрасту.
Диагностика ацетонемического синдрома
Распознаванию ацетонемического синдрома способствует изучение анамнеза и жалоб, клинической симптоматики, результатов лабораторных исследований. Обязательно следует различать первичный и вторичный ацетонемический синдром.
При объективном обследовании ребенка с ацетонемическим синдромом во время криза выявляются ослабление тонов сердца, тахикардия, аритмия; сухость кожи и слизистых, снижение тургора кожи, снижение слезовыделения; тахипноэ, гепатомегалия, уменьшение диуреза.
Клинический анализ крови при ацетонемическом синдроме характеризуется лейкоцитозом, нейтрофилезом, ускорением СОЭ; общий анализ мочи – кетонурией различной степени (от + до ++++). В биохимическом анализе крови может наблюдаться гипонатриемия (при потере внеклеточной жидкости) или гипернатриемия (при потере внутриклеточной жидкости), гипер- или гипокалиемия, повышение уровня мочевины и мочевой кислоты, нормо- или умеренная гипогликемия.
Дифференциальная диагностика первичного ацетонемического синдрома проводится с вторичным кетоацидозом, острым животом (аппендицитом у детей, перитонитом), нейрохирургической патологией (менингитом, энцефалитом, отеком мозга), отравлениями и кишечными инфекциями. В связи с этим ребенок должен быть дополнительно проконсультирован детским эндокринологом, детским инфекционистом, детским гастроэнтерологом.
Лечение ацетонемического синдрома
Основными направлениями лечения ацетонемического синдрома служат купирование кризов и поддерживающая терапия в межприступные периоды, направленная на снижение количества обострений.
При ацетонемических кризах показана госпитализация ребенка. Производится диетическая коррекция: строго ограничиваются жиры, рекомендуются легкоусвояемые углеводы и обильное дробное питье. Целесообразна постановка очистительной клизмы с раствором гидрокарбоната натрия, нейтрализующим часть кетоновых тел, попавших в кишечник. Оральная регидратация при ацетонемическом синдроме производится щелочной минеральной водой и комбинированными растворами. При выраженном обезвоживании проводится инфузионная терапия – внутривенное капельное введение 5% глюкозы, солевых растворов. Симптоматическая терапия включает введение противорвотных препаратов, спазмолитиков, седативных препаратов. При правильном лечении симптомы ацетонемического криза стихают на 2-5 день.
В межприступные периоды наблюдение ребенка с ацетонемическим синдромом осуществляется педиатром. Необходима организация правильного питания (растительно-молочная диета, ограничение продуктов, богатых жирами), профилактика инфекционных заболеваний и психоэмоциональных перегрузок, проведение водных и закаливающих процедур (ванн, контрастного душа, обливаний, обтираний), достаточный сон и пребывание на свежем воздухе.
Ребенку с ацетонемическим синдромом показаны профилактические курсы поливитаминов, гепатопротекторов, ферментов, седативной терапии, массажа; контроль копрограммы. Для контроля ацетона мочи рекомендуется самостоятельно исследовать мочу на содержание кетоновых тел с помощью диагностических тест-полосок.
Дети с ацетонемическим синдромом должны состоять на диспансерном учете у детского эндокринолога, ежегодно проходить исследование глюкозы крови, УЗИ почек и УЗИ брюшной полости.
Алкогольный кетоацидоз – это метаболическое расстройство, возникающее в результате употребления алкоголя во время голодания. Характеризуется повышением кетоновых тел, накоплением кислот в крови, отсутствием гипергликемии. Проявляется тошнотой, рвотой, болями в животе, чрезмерной жаждой, приступами глубокого и частого дыхания. Диагноз устанавливается на основании данных анамнеза, клинической картины, результатах анализов крови, выявляющих высокое содержание кетонов и кислоты, низкий уровень глюкозы. Лечение включает внутривенные инфузии раствора натрия хлорида и глюкозы.
МКБ-10
Общие сведения
Проблема алкогольного кетоацидоза известна с 1940-х годов, но активные исследования специалисты начали проводить лишь в 1970-х. Долгое время было принято считать, что этому осложнению подвержены лица с хронической формой алкоголизма. В действительности ключевым условием для его развития является употребление алкоголя, включая однократный прием. Патология с одинаковой частотой выявляется у мужчин и женщин среднего возраста, у юношей и девушек, а также у лиц, впервые употребивших алкоголь при дефиците питания. Распространенность алкогольного кетоацидоза неизвестна, поскольку многие случаи остаются недиагностированными. В клинической практике на долю данного расстройства приходится 20% от всех видов кетоацидозов.

Причины
Развитие алкогольного кетоацидоза обусловлено поступлением большого количества алкоголя при отсутствии пищи как источника углеводов и жиров. Этиология этого острого осложнения достаточно изучена, все три перечисленных ниже фактора обуславливают поэтапное развитие патогенетических процессов. Причинами кетоацидоза на фоне алкогольного опьянения являются:
- Голодание. Обязательным условием является недостаток питательных веществ. При неполноценном питании усиливается всасываемость алкоголя, возникают метаболические сдвиги в жировом и углеводном обмене.
- Употребление алкоголя. В процессе метаболизма этанол превращается в ацетальдегид, образуется излишек НАДН. Повышается скорость производства кетонов.
- Обезвоживание. Из-за рвоты и недостаточного поступления жидкости развивается олигурия. Снижается экскреция кетонов через почки, увеличивается их содержание в кровотоке.
Патогенез
Рвота и голодание, продолжающиеся более 12-24 часов, приводят к истощению запасов глюкозы в клетках печени. Возникает гипогликемия – сниженный уровень сахара крови. Сокращается производство инсулина, клетки не получают энергию из глюкозы. Организм переходит на запасной энергетический путь: усиливается выход свободных жирных кислот из жировых клеток, возрастает способность печени метаболизировать эти субстраты до ацетоацетата и β-гидроксибутирата. Алкоголь изменяет цепочку реакций бета-окисления в гепатоцитах, в итоге образуется большое количество кетонов.
Кетоны становятся источником энергии для клеток, но при этом повышают кислотность крови, вызывая кетоацидоз. В отличие от кетоацидоза у диабетиков, при алкогольном варианте уровни глюкозы низкие. Гипогликемия стимулирует синтез кортизола, адреналина, гормона роста и глюкагона. Такое гормональное состояние усиливает липолиз. Мобилизуются свободные жирные кислоты, концентрация кетонов становится еще выше.
Симптомы алкогольного кетоацидоза
Клиническая картина метаболического расстройства развивается в течение 24-72 часов. После приема алкоголя быстро нарастает тошнота, возникает упорная рвота, диффузные или локальные абдоминальные боли. Прием пищи становится невозможным, обезболивающие препараты выходят вместе с рвотными массами. Нарастают признаки обезвоживания: артериальная гипотензия, ортостатические изменения кровяного давления, учащенное сердцебиение, урежение позывов к мочеиспусканию и уменьшение объема мочи. Температура тела часто повышается до субфебрильных значений. Наблюдается глубокое и быстрое дыхание, являющееся компенсаторной реакцией на повышение кислотности крови. У отдельных больных появляется моторное и психическое беспокойство, страх смерти, дезориентация в пространстве и местоположении.
Осложнения
У большинства больных хроническим алкоголизмом кетоацидоз возникает при наличии сопутствующих заболеваний, таких как гастрит, гепатит, панкреатит, абстинентный синдром и жировая инфильтрация печени, Нарушение углеводно-жирового обмена провоцирует обострения и осложнения перечисленных патологий, например, кровотечения из верхних отделов ЖКТ. Попадание большого объема рвотных масс в дыхательные пути потенцирует воспаление – аспирационную пневмонию. Дефицит тиамина при хроническом алкоголизме повышает риск энцефалопатии Вернике. Без срочной медицинской помощи кетоацидотическое гипогликемическое состояние может приводить к развитию сонливости, спутанности сознания, комы и смерти.
Диагностика
Обследование больных осуществляет врач-эндокринолог, нарколог или терапевт. Диагноз алкогольного кетоацидоза предполагается у пациентов с эпизодами злоупотребления алкогольными напитками, недоеданием или голоданием на протяжении нескольких дней. До обращения за медицинской помощью в течение 1-3 суток наблюдается рвота, препятствующая приему пищи, боли в области живота. В ходе дифференциальной диагностики исключаются наиболее вероятные причины подобного состояния: диабетический кетоацидоз, молочнокислый ацидоз, алкогольная интоксикация. С целью уточнения диагноза проводятся лабораторные исследования:
- Биохимическое исследование крови.Концентрация глюкозы ниже 300 мг/дл, это является основанием для исключения диабетического кетоацидоза. pH крови ацидотичен (менее 7,35), анионная щель увеличена, уровень кетонов повышен, количество магния, калия и фосфора снижено. На фоне обильной рвоты возможно развитие алкалоза, приближающего pH к нормальным значениям.
- Тест с нитропруссидом. Используется для обнаружения кетонов в моче и сыворотке крови. В большинстве случаев определяется умеренная или выраженная кетонемия и/или кетонурия. Редко, при высоком уровне бета-гидроксибутирата, реакция оказывается слабоположительной или отрицательной вне зависимости от наличия кетоацидоза. По этой причине тест не используется изолированно.
- Анализ крови на алкоголь. Как правило, исследование этанола в крови определяет его повышенное содержание (более 0,5 промилле). Однако кетоацидоз продолжается развиваться и после выведения алкоголя из организма, поэтому результат может быть отрицательным. Если из анамнеза неясно, что употреблял пациент, производится исследование этиленгликоля и метанола в сыворотке.
Лечение алкогольного кетоацидоза
Терапию начинают с внутривенного введения витамина B1 (тиамина). Он предотвращает развитие корсаковского психоза, болезни Вернике. После этой процедуры внутривенно вливают раствор декстрозы 5% и раствор хлорида натрия 0,9%. Дополнительно назначают инъекции водорастворимых витаминов, магния и калия. Процесс обратного развития метаболических нарушений занимает 12-18 часов. По мере уменьшения ацидоза повышается уровень ацетоацетата, что сопровождается искусственной гиперкетонемией, создающей видимость обострения кетоацидоза. При этом водородный показатель крови возрастает, восстанавливается водно-электролитный баланс, устраняется гипогликемия, клиническое состояние больного улучшается.
Прогноз и профилактика
По данным специалистов в сфере клинической наркологии и эндокринологии, выживаемость пациентов с алкогольным кетоацидозом достаточно высока, случаи летального исхода обычно связаны не с метаболическим нарушением, а с другими осложнениями длительного алкоголизма. Профилактические меры включают отказ от злоупотребления алкоголем, адекватное лечение хронического алкоголизма, полноценное питание в ситуациях, предполагающих употребление алкогольных напитков. Несмотря на простоту и очевидность предупреждающих мероприятий, повторные эпизоды алкогольного кетоацидоза довольно часто встречаются у лиц с эпизодическим пьянством.
Диабетический кетоацидоз – декомпенсированная форма сахарного диабета, протекающая с повышением уровня глюкозы и кетоновых тел в крови. Характеризуется жаждой, усиленным мочеиспусканием, сухостью кожи, ацетоновым запахом изо рта, болями в животе. Со стороны ЦНС отмечается появление головных болей, заторможенность, раздражительность, сонливость, вялость. Кетоацидоз диагностируется по данным биохимического исследования крови и мочи (глюкоза, электролиты, кетоновые тела, КОС). Основой лечения являются инсулинотерапия, регидратационные мероприятия и коррекция патологических изменений в электролитном обмене.
Общие сведения
Диабетический кетоацидоз (ДКА) – острый срыв механизмов регуляции обмена веществ у больных сахарным диабетом, сопровождающийся гипергликемией и кетонемией. Является одним из самых часто встречаемых в эндокринологии осложнений сахарного диабета (СД). Регистрируется примерно в 5-8 случаях на 1000 пациентов с СД 1 типа в год, напрямую связан с качеством оказания медицинской помощи больным сахарным диабетом. Смертность от кетоацидотической комы колеблется в пределах 0,5-5% и зависит от современности госпитализации пациента в стационар. В основном данное осложнение встречается у людей до 30 лет.

Причины диабетического кетоацидоза
Причиной развития острой декомпенсации выступает абсолютная (при сахарном диабете 1 типа) или выраженная относительная (при сахарном диабете 2 типа) инсулиновая недостаточность. Кетоацидоз может являться одним из вариантов манифестации СД 1 типа у пациентов, не знающих о своем диагнозе и не получающих терапию. Если больной уже получает лечение по поводу СД, причинами для развития кетоацидоза могут стать:
- Неадекватная терапия. Включает случаи неправильного подбора оптимальной дозировки инсулина, несвоевременного перевода пациента с таблетированных сахароснижающих препаратов на инъекции гормона, неисправность инсулиновой помпы или шприц-ручки.
- Несоблюдение рекомендаций врача. Диабетический кетоацидоз может возникать, если пациент неправильно корректирует дозировку инсулина в зависимости от уровня гликемии. Патология развивается при использовании просроченных препаратов, утративших свои лечебные свойства, самостоятельном снижении дозировки, самовольной замене инъекций таблетками или полном отказе от сахароснижающей терапии.
- Резкое возрастание потребности в инсулине. Обычно сопровождает такие состояния, как беременность, стресс (особенно у подростков), травмы, инфекционные и воспалительные заболевания, инфаркты и инсульты, сопутствующие патологии эндокринного происхождения (акромегалия, синдром Кушинга и др.), хирургические вмешательства. Причиной кетоацидоза может быть использование некоторых медикаментов, из-за которых возрастает уровень глюкозы в крови (например, глюкокортикостероидов).
В четверти случаев достоверно установить причину не представляется возможным. Развитие осложнения не удается связать ни с одним из провоцирующих факторов.
Патогенез
Основная роль в патогенезе диабетического кетоацидоза отводится недостатку инсулина. Без него глюкоза не может утилизироваться, вследствие чего возникает ситуация, называемая «голодом среди изобилия». То есть глюкозы в организме достаточно, но ее использование невозможно. Параллельно происходит выброс в кровь таких гормонов, как адреналин, кортизол, СТГ, глюкагон, АКТГ, которые только усиливают глюконеогенез, еще сильнее повышая концентрацию углеводов в крови. Как только происходит превышение почечного порога, глюкоза поступает в мочу и начинает выводиться из организма, а вместе с ней выводится значительная часть жидкости и электролитов.
Из-за сгущения крови развивается тканевая гипоксия. Она провоцирует активацию гликолиза по анаэробному пути, из-за чего возрастает содержание лактата в крови. Из-за невозможности его утилизации формируется лактатацидоз. Контринсулярные гормоны запускают процесс липолиза. В печень поступает большое количество жирных кислот, выступающих в качестве альтернативного энергетического источника. Из них образуются кетоновые тела. При диссоциации кетоновых тел развивается ацидоз метаболического типа.
Классификация
По тяжести течения диабетический кетоацидоз разделяют на три степени. Критериями оценки служат лабораторные показатели и наличие или отсутствие сознания у пациента.
- Легкая степень. Глюкоза плазмы 13-15 ммоль/л, pH артериальной крови в пределах от 7,25 до 7,3. Сывороточный бикарбонат от 15 до 18 мэкв/л. Наличие кетоновых тел при анализе мочи и сыворотки крови +. Анионная разница выше 10. Нарушений сознания нет.
- Средняя степень. Глюкоза плазмы в пределах 16-19 ммоль/л. Диапазон кислотности артериальной крови от 7,0 до 7,24. Сывороточный бикарбонат - 10-15 мэкв/л. Кетоновые тела в моче, сыворотке крови ++. Нарушения сознания отсутствуют или отмечается сонливость. Анионная разница более 12.
- Тяжелая степень. Глюкоза плазмы выше 20 ммоль/л. Показатель кислотности артериальной крови менее 7,0. Сывороточный бикарбонат менее 10 мэкв/л. Кетоновые тела в моче и сыворотке крови +++. Анионная разница превышает 14. Есть нарушения сознания в виде сопора или комы.
Симптомы диабетического кетоацидоза
Для ДКА не характерно внезапное развитие. Симптомы патологии обычно формируются в течение нескольких суток, в исключительных случаях возможно их развитие в период до 24 часов. Кетоацидоз при диабете проходит стадии прекомы, начинающейся кетоацидотической комы и полной кетоацидотической комы.
Первыми жалобами пациента, свидетельствующими о состоянии прекомы, являются неутолимая жажда, частое мочеиспускание. Больного беспокоит сухость кожных покровов, их шелушение, неприятное чувство стянутости кожи. При пересыхании слизистых оболочек появляются жалобы на жжение и зуд в носу. Если кетоацидоз формируется в течение длительного времени, возможна сильная потеря веса. Слабость, усталость, потеря работоспособности и аппетита являются характерными жалобами для пациентов, находящихся в состоянии прекомы.
Начинающаяся кетоацидотическая кома сопровождается тошнотой и приступами рвоты, которые не приносят облегчения. Возможно появление болей в животе (псевдоперитонит). Головная боль, раздражительность, сонливость, заторможенность свидетельствуют о вовлечении в патологический процесс ЦНС. Осмотр пациента позволяет установить наличие ацетонового запаха из ротовой полости и специфического дыхательного ритма (дыхание Куссмауля). Отмечаются тахикардия и артериальная гипотензия. Полной кетоацидотической коме сопутствуют утрата сознания, снижение или полное отсутствие рефлексов, выраженная дегидратация.
Осложнения
Диабетический кетоацидоз может привести к развитию отека легких (в основном вследствие неправильно подобранной инфузионной терапии). Возможны артериальные тромбозы различной локализации в результате чрезмерной потери жидкости и повышения вязкости крови. В редких случаях развивается отек мозга (в основном встречается у детей, часто оканчивается летально). Из-за снижения объема циркулирующей крови формируются шоковые реакции (их развитию способствует ацидоз, сопровождающий инфаркт миокарда). При длительном нахождении в коме нельзя исключать присоединение вторичной инфекции, чаще всего в виде пневмонии.
Диагностика
Диагностика кетоацидоза при СД может представлять сложности. Пациенты с симптомами перитонита, тошнотой и рвотой часто попадают не в эндокринологические, а в хирургические отделения. Чтобы избежать непрофильной госпитализации пациента, проводятся следующие диагностические мероприятия:
- Консультация эндокринолога или диабетолога. На приеме специалист оценивает общее состояние пациента, если сознание сохранено, уточняет жалобы. Первичный осмотр дает информацию о дегидратации кожных покровов и видимых слизистых, снижении тургора мягких тканей, наличии абдоминального синдрома. При осмотре выявляется гипотония, признаки нарушения сознания (сонливость, заторможенность, жалобы на головные боли), запах ацетона, дыхание Куссмауля.
- Лабораторные исследования. При кетоацидозе концентрация глюкозы в кровяной плазме выше 13 ммоль/л. В моче пациента определяется наличие кетоновых тел и глюкозурия (диагностика проводится с использованием специальных тестовых полосок). При исследовании крови выявляется понижение кислотного показателя (менее 7,25), гипонатриемия (менее 135 ммоль/л) и гипокалиемия (менее 3,5 ммоль/л), гиперхолестеринемия (более 5,2 ммоль/л), повышение осмолярности плазмы (более 300 мосм/кг), повышение анионной разницы.
ЭКГ важна для исключения инфаркта миокарда, к которому могут приводить электролитные нарушения. Рентгенография грудной клетки необходима для исключения вторичного инфекционного поражения дыхательных путей. Дифференциальную диагностику диабетической кетоацидотической комы проводят с молочнокислой комой, гипогликемической комой, уремией. Дифдиагностика с гиперосмолярной комой редко имеет клиническое значение, так как принципы лечения пациентов сходны. Если быстрое установление причины потери сознания у больных с сахарным диабетом невозможно, рекомендуется введение глюкозы, чтобы купировать гипогликемию, которая встречается гораздо чаще. Быстрое улучшение или ухудшение состояния человека на фоне введения глюкозы позволяет установить причину потери сознания.
Лечение диабетического кетоацидоза
Лечение кетоацидотического состояния проводится только в условиях стационара, при развитии комы - в условиях палаты интенсивной терапии. Рекомендован постельный режим. Терапия состоит из следующих составляющих:
- Инсулинотерапия. Обязательна коррекция дозы гормона или подбор оптимальной дозировки при первично выявленном сахарном диабете. Лечение должно сопровождаться постоянным контролем уровня гликемии и кетонемии.
- Инфузионная терапия. Проводится по трем основным направлениям: регидратация, коррекция КОС и электролитных нарушений. Используют внутривенное введение хлорида натрия, препаратов калия, гидрокарбоната натрия. Рекомендуется раннее начало. Количество вводимого раствора рассчитывается с учетом возраста и общего состояния больного.
- Лечение сопутствующих патологий. Усугублять состояние пациента с ДКА могут сопутствующие инфаркт, инсульт, инфекционные заболевания. Для лечения инфекционных осложнений показана антибиотикотерапия, при подозрении на сосудистые катастрофы – тромболитическая терапия.
- Мониторинг жизненно-важных показателей. Осуществляется постоянная электрокардиография, пульсоксиметрия, оценка уровня глюкозы и кетоновых тел. Первоначально мониторинг проводят каждые 30-60 минут, а после улучшения состояния пациента каждые 2-4 часа в течение последующих суток.
Сегодня ведутся разработки, направленные на снижение вероятности развития ДКА у больных сахарным диабетом (разрабатываются препараты инсулина в таблетированных формах, совершенствуются способы доставки лекарства в организм, ведется поиск методов, которые позволили бы восстановить собственную продукцию гормона).
Прогноз и профилактика
При своевременной и эффективной терапии в условиях стационара кетоацидоз удается купировать, прогноз благоприятный. При задержке оказания медицинской помощи патология быстро переходит в кому. Летальность составляет 5%, а у пациентов в возрасте старше 60 лет - до 20%.
Основа профилактики кетоацидоза – это обучение пациентов, страдающих от сахарного диабета. Больные должны быть ознакомлены с симптоматикой осложнения, информированы о необходимости правильного использования инсулина и приборов для его введения, обучены основам контроля над уровнем глюкозы в крови. Человек должен быть максимально осведомлен о своем заболевании. Рекомендуется ведение здорового образа жизни и соблюдение диеты, подобранной эндокринологом. Если развивается симптоматика, присущая диабетическому кетоацидозу, необходимо обратиться к врачам, чтобы избежать негативных последствий.
Для цитирования: Торшхоева Х.М., Городецкий В.В., Верткин А.Л. Неотложные состояния при сахарном диабете на догоспитальном этапе. РМЖ. 2003;6:350.
Национальное научно-практическое общество скорой медицинской помощи, МГМСУ им. Н.А. Семашко
К омы являются острыми осложнениями сахарного диабета (СД) и часто приводят к летальным исходам. Это прямой результат изменений содержания глюкозы в крови в виде гипергликемии или гипогликемии и сопутствующими метаболическими нарушениями. Если не произвести коррекцию, то гипергликемия может привести к диабетическому кетоацидозу (ДКА) или некетоновой гиперосмолярной коме. Они характеризуются разными степенями инсулиновой недостаточности, избыточной продукцией контринсулиновых гормонов и обезвоживанием. В некоторых случаях признаки диабетического кетоацидоза и гиперосмолярной комы могут развиваться одновременно.
Гипогликемия связана с нарушением равновесия между лекарственным средством, применяемым в лечении диабета (инсулин или таблетированные сахороснижающие средства), и приемом пищи или физической нагрузкой. Резкое падение концентрации глюкозы приводит к потере сознания, так как нормальное функционирование головного мозга почти полностью зависит от глюкозы. У больных сахарным диабетом могут развиться следующие коматозные состояния, непосредственно связанные и специфически обусловленные основным заболеванием, – кетоацидотическая, гиперосмолярная и гипогликемическая.
Быстрота и своевременность оказания помощи больным в коматозном состоянии во многом определяют прогноз. Поэтому с этих позиций правильное ведение пациентов на догоспитальном этапе представляется наиболее важным.
Гипогликемическая кома занимает третье место (5,4%) в структуре ком на догоспитальном этапе, а диабетическая (3%) – пятое (данные ННПОСМП).
Диабетическая кетоацидотическая кома
Диабетическая кетоацидотическая кома (ДКА) – грозное осложнение сахарного диабета, характеризующееся метаболическим ацидозом (рН меньше 7,35 или концентрация бикарбоната меньше 15 ммоль/л), увеличением анионной разницы, гипергликемией выше 14 ммоль/л, кетонемией. Чаще развивается при СД 1 типа. Частота от 5 до 20 случаев на 1000 больных в год (2/100). Смертность 5–15%, для больных старше 60 лет – 20%. От кетоацидотической комы погибает более 16% пациентов с СД 1 типа. Причина развития ДКА – абсолютный или резко выраженный относительный дефицит инсулина вследствие неадекватной инсулиновой терапии или повышения потребности в инсулине.
Провоцирующие факторы:
- Недостаточная доза инсулина или пропуск инъекции инсулина (или приема таблетированных сахароснижающих средств).
- Самовольная отмена сахароснижающей терапии.
- Нарушение техники введения инсулина.
- Присоединение других заболеваний (инфекции, травма, операции, беременность, инфаркт миокарда, инсульт, стресс и др.).
- Нарушения в диете (слишком большое количество углеводов).
- Физическая нагрузка при высокой гликемии.
- Злоупотребление алкоголем.
- Недостаточное проведение самоконтроля обмена веществ.
- Прием некоторых лекарственных препаратов (кортикостероиды, оральные контрацептивы, тиреоидные гормоны, кальцитонин, салуретики, этакриновая кислота, ацетазоламид, b -блокаторы, дилтиазем, адреналин, добутамин, диазоксид, никотиновая кислота, изониазид, аспарагиназа, циклофосфамид, дифенин, морфин, лития карбонат и др.).
Часто этиология ДКА остается неизвестной. Следует помнить, что до 25% случаев ДКА отмечается у пациентов с вновь выявленным сахарным диабетом.
Клиническая картина и классификация
Различают три стадии диабетического кетоацидоза (табл. 1):
1. Умеренный кетоацидоз.
2. Прекома, или декомпенсированный кетоацидоз.
3. Кома.
Осложнения кетоацидотической комы – тромбозы глубоких вен, легочная эмболия, артериальные тромбозы (инфаркт миокарда, инфаркт мозга, некрозы), аспирационная пневмония, отек мозга, отек легких, инфекции, редко – ЖКК и ишемический колит, эрозивный гастрит, поздняя гипогликемия. Отмечается тяжелая дыхательная недостаточность, олигурия и почечная недостаточность. Осложнения терапии – отек мозга и легких, гипогликемия, гипокалиемия, гипонатриемия, гипофосфатемия.
Диагностические критерии
1. Особенность ДКА – постепенное развитие, обычно на протяжении нескольких суток.
2. Наличие симптомов кетоацидоза (запах ацетона в выдыхаемом воздухе, дыхание Куссмауля, тошнота, рвота, анорексия, боли в животе).
3. Наличие симптомов дегидратации (снижение тургора тканей, тонуса глазных яблок, мышечного тонуса, сухожильных рефлексов, температуры тела и АД).
Следует помнить, что при СД 2 типа всегда надо искать интеркуррентное заболевание, как причину декомпенсации СД.
Перечень вопросов, обязательных при диагностике ДКА на догоспитальном этапе:
– страдает ли пациент сахарным диабетом?
– была ли ДКА в анамнезе?
– получает ли пациент сахароснижающую терапию, какую, последний прием препарата?
– когда был последний прием пищи или неадекватный прием пищи или ее пропуск?
– была ли слишком тяжелая физическая нагрузка или прием алкоголя?
– какие недавно перенесенные заболевания предшествовали коме (инфекционные заболевания)?
– Была ли полиурия, полидипсия и слабость?
Возможные ошибки терапии и диагностики на догоспитальном этапе:
1. Инсулинотерапия на догоспитальном этапе без возможности определения уровня гликемии и ее контроля.
2. Акцент в лечении на интенсивную инсулинотерапию при отсутствии эффективной регидратации.
3. Введение недостаточного объема жидкостей.
4. Введение гипотонических растворов, особенно в начале лечения. Это может привести к отеку головного мозга и к внутрисосудистому гемолизу.
5. Применение форсированного диуреза вместо регидратации. Применение диуретиков одновременно с введением жидкостей только замедлит восстановление водного баланса, а при гиперосмолярной коме назначение мочегонных средств категорически противопаказано.
6. Начало терапии с введения бикарбоната натрия может привести к смерти больного. Доказано, что адекватная инсулинотерапия в большинстве случаев помогает устранить ацидоз. Коррекция ацидоза бикарбонатом натрия сопряжена с исключительно большим риском осложнений. Введение щелочей усиливает гипокалиемию, нарушает диссоциацию оксигемоглобина; углекислота, образующаяся при введении бикарбоната, усиливает внутриклеточный ацидоз (хотя рН крови при этом может повышаться); парадоксальный ацидоз наблюдается и в спинномозговой жидкости, что может способствовать отеку мозга; не исключено развитие «рикошетного» алкалоза. Быстрое введение бикарбоната натрия (струйное) может вызвать смерть в результате быстрого развития гипокалиемии.
7. Введение раствора бикарбоната натрия без дополнительного введения препаратов калия, что обусловливает резко выраженную гипокалиемию, которая и становится причиной смерти больных.
8. Отмена или неназначение инсулина при ДКА больному, который не в состоянии принимать пищу.
9. Подкожное введение инсулина больным в диабетической коме, у которых всасывание инсулина нарушено вследствие нарушения микроциркуляции.
10. Внутривенно струйное введение инсулина. Период полураспада инсулина при внутривенном введении составляет 3–5 мин, и лишь первые 15–20 мин концентрация его в крови поддерживается на достаточном уровне, и поэтому такой путь введения неэффективен.
11. 3–4–х–кратное назначение инсулина короткого действия (ИКД) подкожно (на начальных этапах ДКА, когда состояние средней тяжести и нет потери сознания, возможно назначение инсулина подкожно). Эффективная продолжительность действия ИКД составляет 4–5 ч, особенно в условиях кетоацидоза. Поэтому ИКД надо назначать не менее 5–6 раз в сутки без ночного перерыва.
12. Применение для борьбы с коллапсом симпатотонических препаратов. Они, во–первых, являются контринсулиновыми гормонами и, во–вторых, у больных диабетом их стимулирующее влияние на секрецию глюкагона выражено значительно сильнее, чем у здоровых лиц.
13. Неправильная диагностика ДКА. При ДКА нередко встречается так называемый «диабетический псевдоперитонит», который симулирует симптомы «острого живота» – напряжение и болезненность брюшной стенки, уменьшение или исчезновение перистальтических шумов, иногда повышение сывороточной амилазы. Одновременное обнаружение лейкоцитоза может навести на ошибочный диагноз и больной попадает в инфекционное («кишечная инфекция») или хирургическое («острый живот») отделения. Во всех случаях «острого живота» или диспепсических явлений у больного сахарным диабетом необходимо определение гликемии и ке тонурии.
14. Неизмерение гликемии любому больному, находящемуся в бессознательном состоянии, нередко приводит к постановке ошибочных диагнозов – «нарушение мозгового кровообращения», «кома неясной этиологии», в то время как у пациента имеется острая диабетическая декомпенсация обмена веществ.
Терапия на догоспитальном этапе представлена в таблице 2.
Гиперосмолярная кетоацидотическая кома
Гиперосмолярная кетоацидотическая кома характеризуется выраженной дегидратацией, значительной гипергликемией (часто выше 33 ммоль/л), гиперосмолярностью (более 340 мосм/л), гипернатриемией выше 150 ммоль/л, отличающееся отсутствием кетоацидоза (максимальная кетонурия (+)). Чаще развивается у пожилых больных СД 2 типа. Встречается в 10 раз реже, чем ДКА. Характеризуется более высокой летальностью (15–60%). Причина развития гиперосмолярной комы – относительный дефицит инсулина и факторы, сопровождающиеся дегидратацией.
Гиперосмолярная кетоацидотическая кома характеризуется выраженной дегидратацией, значительной гипергликемией (часто выше 33 ммоль/л), гиперосмолярностью (более 340 мосм/л), гипернатриемией выше 150 ммоль/л, отличающееся отсутствием кетоацидоза (максимальная кетонурия (+)). Чаще развивается у пожилых больных СД 2 типа. Встречается в 10 раз реже, чем ДКА. Характеризуется более высокой летальностью (15–60%). Причина развития гиперосмолярной комы – относительный дефицит инсулина и факторы, сопровождающиеся дегидратацией.
Провоцирующие факторы:
- недостаточная доза инсулина или пропуск иньекции инсулина (или приема таблетированных сахароснижающих средств);
- самовольная отмена сахароснижающей терапии;
- нарушение техники введения инсулина;
- присоединение других заболеваний (инфекции, острый панкреатит, травма, операции, беременность, инфаркт миокарда, инсульт, стресс и др.);
- нарушения в диете (слишком большое количество углеводов);
- прием некоторых лекарственных препаратов (диуретики, кортикостероиды, b -блокаторы и др.);
- охлаждение;
- невозможность утолить жажду;
- ожоги;
- рвота или диарея;
- гемодиализ или перитонеальный диализ.
Следует помнить, что одна треть пациентов с гиперосмолярной комой не имеет предшествующего диагноза сахарного диабета.
Клиническая картина
Нарастающая в течение нескольких дней или недель сильная жажда, полиурия, выраженная дегидратация, артериальная гипотония, тахикардия, фокальные или генерализованные судороги. Если при ДКА расстройства функции ЦНС и периферической нервной системы протекают по типу постепенного угасания сознания и угнетения сухожильных рефлексов, то гиперосмолярная кома сопровождается разнообразными психическими и неврологическими нарушениями. Кроме сопорозного состояния, также нередко отмечаемого при гиперосмолярной коме, психические нарушения часто протекают по типу делирия, острого галлюцинаторного психоза, катотонического синдрома. Неврологические нарушения проявляются очаговой неврологической симптоматикой (афазией, гемипарезом, тетрапарезом, полиморфными сенсорными нарушениями, патологическими сухожильными рефлексами и т. д.).
Диагностические критерии
1. Развивается более медленно (в течение 5–14 дней), чем ДКА.
Более выраженная дегидратация (снижение тургора тканей, тонуса глазных яблок, мышечного тонуса, сухожильных рефлексов, температуры тела и АД).
2. Часто полиморфная неврологическая симптоматика, исчезающая при купировании гиперосмолярной комы.
3. Отсутствие кетоацидоза (запаха ацетона в выдыхаемом воздухе, отсутствие дыхания Куссмауля, тошноты, рвоты, анорексии, болей в животе).
4. Отсутствие или невыраженная кетонурия.
5. Раньше возникает анурия и азотемия.
6. Пожилой и старческий возраст.
Среди возможных ошибок в терапии и диагностике выделяются:
1. Введение гипотонических растворов на догоспитальном этапе.
2. Длительное введение гипотонических растворов.
3. Гиперосмолярный синдром нередко ошибочно расценивается, как реактивный психоз, цереброваскулярный пароксизм или другое острое психическое или неврологическое заболевание.
Терапия рассмотрена в таблице 3.
Гипогликемическая кома
Гипогликемическая кома развивается вследствие резкого снижения уровня глюкозы в крови (ниже 3–3,5 ммоль/л) и выраженного энергетического дефицита в головном мозге.
Гипогликемическая кома развивается вследствие резкого снижения уровня глюкозы в крови (ниже 3–3,5 ммоль/л) и выраженного энергетического дефицита в головном мозге.
– пропуск или неадекватный прием пищи
– повышенная физическая нагрузка
– избыточный прием алкоголя
– прием лекарственных средств ( b -блокаторы, салицилаты, сульфаниламиды, фенилбутазон, анаболические стероиды, препараты кальция, тетрациклин, литий карбонат, пиридоксин, ингибиторы MAO, клофибрат).
Клиническая картина
Симптомы гипогликемии делятся на ранние (холодный пот, особенно на лбу, бледность кожи, сильный приступообразный голод, дрожь в руках, раздражительность, слабость, головная боль, головокружение, онемение губ), промежуточные (неадекватное поведение, агрессивность, сердцебиение, плохая координация движений, двоение в глазах, спутанность сознания) и поздние (потеря сознания, судороги).
Диагностические критерии
1. Внезапное развитие, обычно на протяжении нескольких минут, реже часов.
2. Наличие характерных симптомов гипогликемии.
3. Гликемия ниже 3–3,5 ммоль/л.
Следует помнить, что отсутствие симптомов не исключает гипогликемии и у пациентов с сахарным диабетом симптомы гипогликемии могут быть при нормальной концентрации глюкозы в крови.
Стандартные вопросы врача на догоспитальном этапе:
– страдает ли пациент сахарным диабетом, его продолжительность;
– получает ли сахароснижающую терапию (какую, последний прием препарата);
– неадекватный прием пищи или ее пропуск, последний прием пищи;
– любые эпизоды гипогликемии в прошлом;
– слишком тяжелая физическая нагрузка;
– прием чрезмерного количества алкоголя.
Следует помнить – самой частой причиной потери сознания при сахарном диабете 1 типа является тяжелая гипогликемия.
После выведения больного из гипогликемической комы рекомендуется применять средства, улучшающие микроциркуляцию и метаболизм в клетках головного мозга в течение 3–6 недель. Повторные гипогликемии могут привести к поражению головного мозга.
Возможные ошибки диагностики и терапии:
1. Попытка ввести углевод–содержащие продукты (сахар и т.п.) в ротовую полость пациенту без сознания. Это часто приводит к аспирации и к асфиксии.
2. Применение для купирования гипогликемии непригодных для этого продуктов (хлеб, шоколад и т.п.). Эти продукты не обладают достаточным сахароповышающим действием или повышают сахар крови, но слишком медленно.
3. Неправильная диагностика гипогликемии. Часть симптомов гипогликемии может имитировать эпилептический припадок, инсульт, «вегетативный криз» и др. У больного, получающего сахароснижающую терапию, практически при любом неясном пароксизмальном состоянии целесообразно экстренно определить сахар крови. При отсутствии возможности определения уровня гликемии или относительно медленном выполнении этого анализа экспресс–лабораториями (30–40 мин), при обоснованном подозрении на гипогликемию ее купирование следует начинать сразу же, еще до получения ответа лаборатории.
4. Часто не учитывают опасность рецидива после выведения из тяжелой гипогликемии. При передозировке препаратов инсулина продленного действия и препаратов сульфонилмочевины гипогликемия может повториться и поэтому больной требует интенсивного наблюдения, контроля уровня гликемии и при необходимости ее коррекции в течение нескольких суток.
Терапия гипогликемической комы представлена в таблице 4. Дифференциально–диагностические критерии коматозных состояний при СД представлены в таблице 5.
У пациентов, находящихся в коматозном состоянии неизвестного генеза, всегда необходимо исследовать гликемию. Если достоверно известно, что у пациента сахарный диабет и в то же время трудно дифференцировать гипо– или гипергликемический генез коматозного состояния, рекомендуется внутривенно струйное введение глюкозы в дозе 20–40–60 мл 40% раствора в целях дифференциальной диагностики и оказания экстренной помощи при гипогликемической коме. В случае гипогликемии это значительно улучшит симптоматику и таким образом позволит дифференцировать эти два состояния. В случае гипергликемической комы такое количество глюкозы на состоянии пациента практически не скажется.
У пациентов, находящихся в коматозном состоянии неизвестного генеза, всегда необходимо исследовать гликемию. Если достоверно известно, что у пациента сахарный диабет и в то же время трудно дифференцировать гипо– или гипергликемический генез коматозного состояния, рекомендуется внутривенно струйное введение глюкозы в дозе 20–40–60 мл 40% раствора в целях дифференциальной диагностики и оказания экстренной помощи при гипогликемической коме. В случае гипогликемии это значительно улучшит симптоматику и таким образом позволит дифференцировать эти два состояния. В случае гипергликемической комы такое количество глюкозы на состоянии пациента практически не скажется.
Во всех случаях, когда невозможно измерение гликемии немедленно эмпирически надо ввести высококонцентрированную глюкозу. Эстренно некупированная гипогликемия может быть смертельна.
Базисными препаратами для пациентов в коме при отсутствии возможности уточнения диагноза и скорой госпитализации считаются тиамин 100 мг в/в, глюкоза 40% 60 мл и налоксон 0,4–2 мг в/в. Эта комбинация эффективна и безопасна во многих случаях.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Читайте также:

