Кожа меньше чем скелет
Обновлено: 17.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Боль в костях: причины появления, при каких заболеваниях возникает, диагностика и способы лечения.
Определение
Боль в костях, или оссалгия, как правило, является симптомом основного заболевания, если не связана с травмой - ушибом или переломом.
Разновидности боли в костях
Боль в костях может возникать остро, в течение короткого промежутка времени, или нарастать постепенно и носить хронический характер.
Боль может носить локальный характер или иррадиировать (отдавать) в другие части тела.
Возможные причины боли в костях
Самая очевидная причина оссалгии - травмы. Как правило, такая боль носит острый характер и усиливается при движении. Ее продолжительность зависит от объема травмы и течения процесса восстановления.
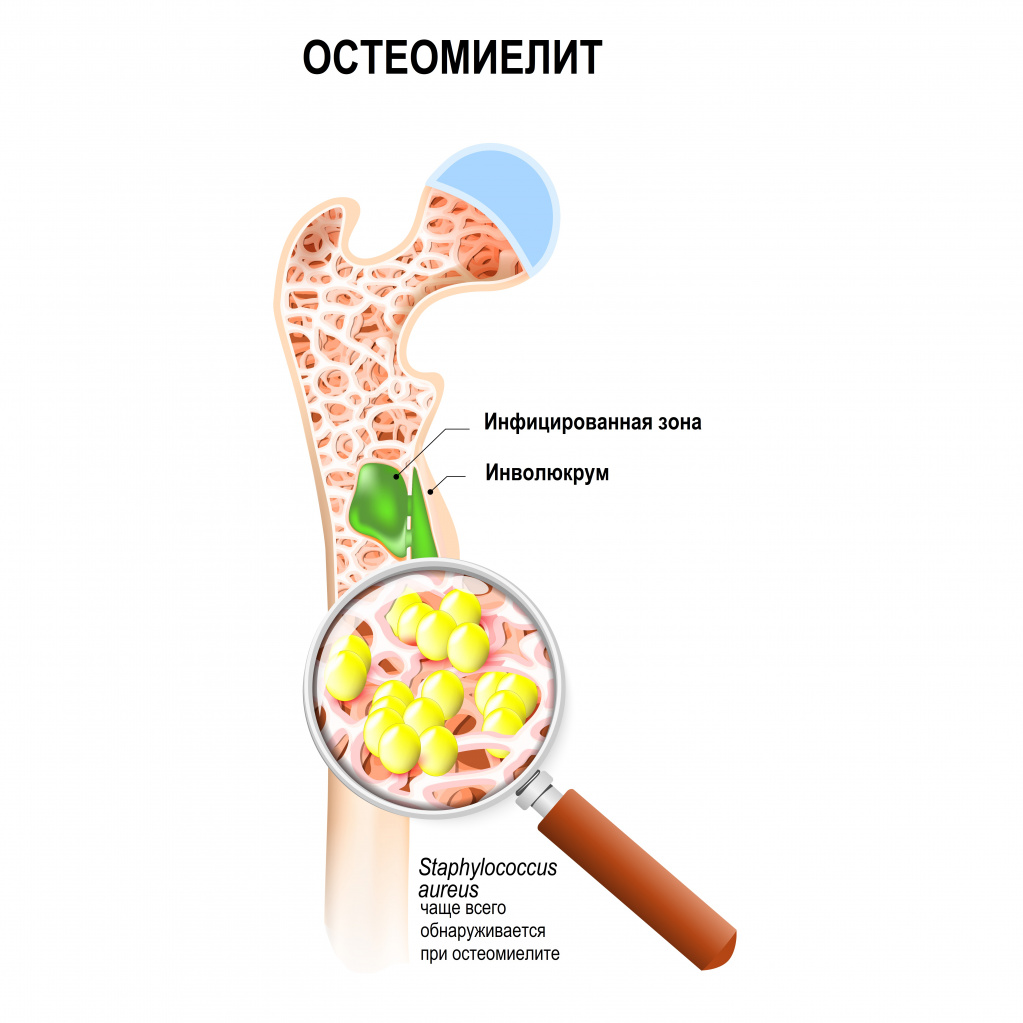
Другая причина – воспалительное поражение кости, которое может быть следствием или травмы, или распространения инфекционного агента с током крови из других очагов в организме. Одним из самых тяжелых заболеваний является остеомиелит, для которого характерно гнойное повреждение костной ткани.
Риск развития болевого синдрома присутствует при недостатке в организме кальция и фосфора. Такое состояние может развиться как и из-за недостаточного поступления этих микроэлементов с пищей, так и в результате патологий паращитовидной и щитовидной желез, поскольку именно они отвечают за регуляцию фосфорно-кальциевого обмена, а также из-за дефицита витамина D.
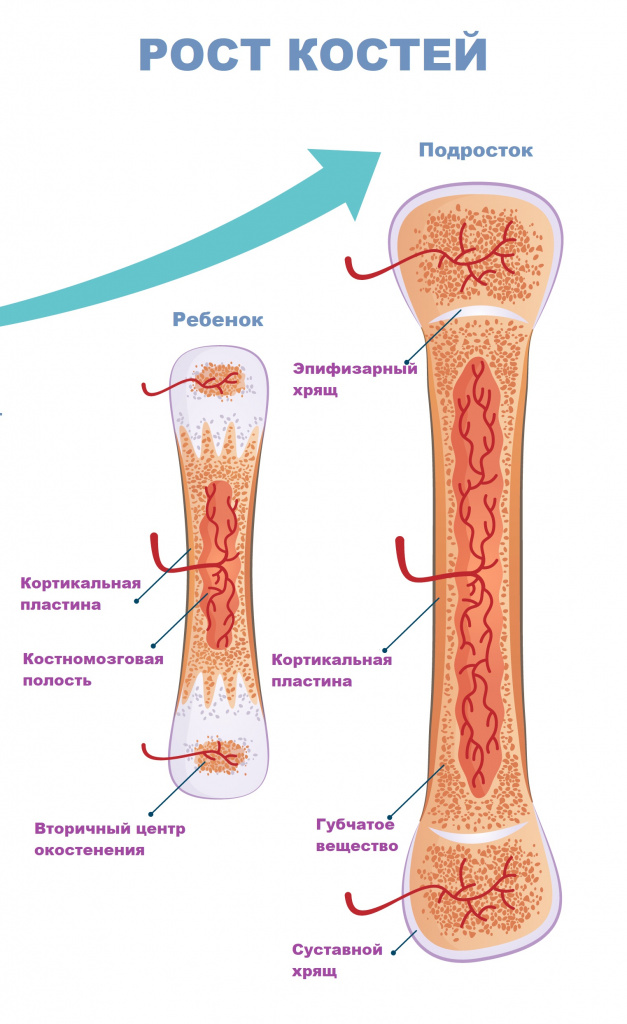
Отдельного внимания заслуживают наследственные и опухолевые заболевания, поражающие красный костный мозг, который располагается в губчатом веществе костей и костномозговых полостях и содержит стволовые кроветворные клетки.
При нарушении деления стволовых клеток возможно увеличение объема костного мозга, образование специфических продуктов обмена, перестройка структуры кости с развитием болевого синдрома.
Помимо опухолей, развивающихся из кроветворных клеток, существуют новообразования, происходящие из клеток костной ткани (саркомы), а также метастазы злокачественных опухолей других локализаций.
Костная ткань часто становится объектом развития метастатических очагов, поскольку имеет богатое кровоснабжение.
Существует еще одна причина боли в костях – «ростовой скачок» ребенка (так называемая ночная боль роста). Она связана с резким увеличением длины костных структур, когда мышечная ткань не успевает за костной, и проявляется, как правило, в ночное время.
При каких заболеваниях возникает боль в костях
Среди травматических поражений, приводящих к боли в кости, наиболее частыми являются переломы, трещины, ушибы.
Стоит сказать, что боль при вывихах суставов и артритах (воспалении суставов) может иррадиировать и имитировать поражение кости.
Из заболеваний кроветворных органов, а именно костного мозга, упомянем лейкозы (злокачественные опухоли, развивающиеся из предшественников клеток крови), талассемии (наследственное заболевание, характеризующееся нарушением образования гемоглобина – белка, содержащегося в эритроцитах). Несколько особняком стоит опухоль из плазмоцитов (клеток, синтезирующих антитела) - миеломная болезнь, для которой также характерно поражение костей с выраженным болевым синдромом.
Остеомиелиты (воспаление костной ткани) различаются по локализации, возбудителю, бывают острые и хронические. Поздняя диагностика остеомиелита связана с тем, что воспаление развивается и распространяется внутри кости, а не на поверхности. Острые остеомиелиты характеризуются возникновением боли еще тогда, когда внешних признаков воспаления нет.
К злокачественным новообразованиям, происходящим из костной ткани, относится остеосаркома. А к доброкачественным – остеохондрома, остеобластома, остеоид-остеома.
В кости часто метастазирует рак легких, щитовидной железы, молочной железы.
Гиперпаратиреоз, заболевания почек, приводящие к хронической болезни почек, заболевания желудочно-кишечного тракта, нарушающие всасывание кальция, витамина D, приводят к усиленному вымыванию кальция из костей и к развитию остеопороза, характеризующегося развитием болевого синдрома при повышенной нагрузке.
Диагностика и обследования при боли в костях
Как правило, диагностика заболеваний, протекающих с костным болевым синдромом, требует визуализации патологического очага. Для этого проводят рентгенографию костей соответствующей области и прилежащих суставов.
Рентгенологическое исследование тазобедренного сустава и окружающих тканей для оценки патологических изменений и травматических повреждений.
Данный метод позволяет выявить переломы, трещины, признаки остеомиелита. У детей широко используется метод ультразвуковой диагностики мягких тканей при подозрении на остеомиелит и с целью исключения патологии мягких тканей. Для уточнения диагноза прибегают к компьютерной томографии (КТ) и магнитно-резонансной томографии (МРТ).
Сканирование костей и окружающих тканей плечевого пояса для выявления патологий.
Особенность данных исследований состоит в получении послойного изображения интересующих врача структур, а также в выявлении зон отека, кровоизлияний и т.д. в зависимости от применяемого метода.
С целью диагностики остеомиелита, туберкулезного поражения кости, опухолевого процесса применяют сцинтиграфию - введение в кровь безопасных для организма радиоизотопных препаратов (радионуклидов), которые имеют свойство накапливаться в патологических очагах.
При подозрении на метастатическое поражение костей может потребоваться томографическое исследование других областей тела, например, КТ органов грудной клетки, с целью выявления первичного злокачественного очага.
Исследование, позволяющее получить данные о состоянии органов грудной клетки и средостения.
Из лабораторных исследований назначают клинический анализ крови с определением лейкоцитарной формулы и обязательной микроскопией мазка, а также биохимический анализ крови (щелочная фосфатаза, ионизированный кальций, фосфор и др.).
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Синонимы: Общий анализ крови (ОАК); Гемограмма; КАК; Развернутый анализ крови. Full blood count; FBC; Complete Blood Count (CBC); Hemogram; CBC with White Blood Cell Differential Count; Peripheral Blood Smear; Blood Film Examination; Complete blood count (CBC) with differential white blood cell coun.
Синонимы: Анализ крови на щелочную фосфатазу; Фосфатаза щёлочная. ALK PHOS; ALKP; ALPase; Alk Phos. Краткое описание определяемого вещества Щелочная фосфатаза Щелочная фосфатаза катализирует щелочной гидролиз сложных эфиров фосфорной кислоты и органических соединений. Понятие «щелоч.
Ионизированный кальций – физиологически активная часть кальция крови. Синонимы: Анализ крови на ионизированный кальций; Свободный кальций; Ионы кальция. Ionized Calcium Test; Calcium, Ionized Serum; Dialyzable Calcium; Calcium Free; Calcium Filterable; Сalcium Unbound. .
Неорганический фосфор – один из основных анионов организма. Синонимы: Анализ крови на фосфор; Неорганический фосфор в крови; Сывороточный фосфор; Сывороточный фосфат. Inorganic Phosphate; Phosphorus; Serum P; PO4; Phosphate. Краткое описание определяемого .
Что делать при развитии боли в костях
Как правило, неотложная помощь требуется только в случае травматического повреждения кости. До приезда врачей необходимо обеспечить ее неподвижность наложением шины. Шину можно сделать из подручных материалов - плотного картона, журнала, гладкой доски и т.д. При наложении шины нужно помнить некоторые правила: нужно зафиксировать два близлежащих к месту подозреваемого перелома сустава, шина должна быть достаточно плотно зафиксирована.
К месту перелома необходимо приложить холод, чтобы уменьшить боль и выраженность отека.
Лечение боли в костях
Лечение травматических повреждений может проводиться как хирургическим путем, так и консервативным.
Переломы подлежат иммобилизации (созданию неподвижности отломков кости друг относительно друга), что может быть достигнуто наложением гипсовой повязки, установкой металлоконструкций и другими методами.
Тактика лечения остеомиелитов зависит от фазы заболевания. В острую фазу врач может принять решение о проведении антибактериальной, противовоспалительной терапии, хирургической перфорации кости.
Терапия злокачественных заболеваний кости, костного мозга, а также метастатического повреждения кости, как правило, комплексная и может включать лучевую, химиотерапию, а также хирургическое лечение. При отдельных видах лейкозов показана трансплантация костного мозга.
- Мухин Н.А., Моисеев B.C. Пропедевтика внутренних болезней: Учебник. – 2-е изд., доп. и перераб. – М.: ГЭОТАР-Медиа, 2008. – 848 с.
- Неотложная педиатрия: национальное руководство / под ред. Б.М. Блохина. – М.: ГЭОТАР-Медиа, 2017. – 832 с.
- Клинические рекомендации «Остеопороз». Разраб.: Российская ассоциация эндокринологов, Российская ассоциация по остеопорозу, Ассоциация ревматологов России, Ассоциация травматологов-ортопедов России, Ассоциация гинекологов – эндокринологов России, Российская ассоциация геронтологов и гериатров. – 2021.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Скелет (skeletos, греч. - высушенный) представляет комплекс плотных образований, развивающихся из мезенхимы, имеющих механическое значение. Он состоит из отдельных костей, соединенных между собой при помощи соединительной, хрящевой или костной ткани, вместе с которыми и составляет пассивную часть аппарата движения.
Значение скелета
Костная система выполняет ряд функций, имеющих или преимущественно механическое, или преимущественно биологическое значение. Рассмотрим функции, имеющие преимущественно механическое значение. Для всех позвоночных характерен внутренний скелет, хотя среди них встречаются виды, которые наряду с внутренним скелетом имеют еще и более или менее развитый наружный скелет, возникающий в коже (костная чешуя в коже рыб).
В начале своего появления твердый скелет служил для защиты организма от вредных внешних влияний (наружный скелет беспозвоночных). С развитием внутреннего скелета у позвоночных он сначала стал опорой и поддержкой (каркасом) для мягких тканей. Отдельные части скелета превратились в рычаги, приводимые в движение мышцами, вследствие чего скелет приобрел локомоторную функцию. В итоге механические функции скелета проявляются в его способности осуществлять защиту, опору и движение.
Опора достигается прикреплением мягких тканей и органов к различным частям скелета.
Движение возможно благодаря строению костей в виде длинных и коротких рычагов, соединенных подвижными сочленениями и приводимых в движение мышцами, управляемыми нервной системой.
Наконец, защита осуществляется путем образования из отдельных костей костного канала - позвоночного, защищающего спинной мозг; костной коробки - черепа, защищающего головной мозг; костной клетки - грудной, защищающей жизненно важные органы грудной полости (сердце, легкие); костного вместилища - таза, защищающего важные для продолжения вида органы размножения.
Биологическая функция костной системы связана с участием скелета в обмене веществ, особенно в минеральном обмене (скелет является депо минеральных солей - фосфора, кальция, железа и др.). Это важно учитывать для понимания болезней обмена (рахит и др.) и для диагностики с помощью лучистой энергии (рентгеновские лучи, радиоактивные изотопы). Кроме того, скелет выполняет еще кроветворную функцию.
При этом кость не является просто защитным футляром для костного мозга, а последний составляет органическую часть ее. Определенное развитие и деятельность костного мозга отражаются на строении костного вещества, и, наоборот, механические факторы сказываются на функции кроветворения: усиленное движение способствует кроветворению; поэтому при разработке физических упражнений необходимо учитывать единство всех функций скелета.
Развитие скелета
На низших ступенях организации, а также в эмбриональном периоде у всех позвоночных первым зачатком внутреннего скелета является спинная струна - chorda dorsalis, происходящая из мезодермы. Хорда является характерным признаком низшего представителя типа хордовых - ланцетника (Amphioxus lanceolatus), у которого скелет состоит из вытянутой вдоль тела с его дорсальной стороны спинной струны и окружающей ее соединительной ткани.
У низших видов позвоночных [круглоротые, селахии (акулы) и хрящевые ганоиды] соединительнотканный скелет вокруг хорды и на остальном протяжении замещается хрящевым скелетом, который в свою очередь у более высокоорганизованных позвоночных, начиная с костистых рыб и кончая млекопитающими, становится костным.
С развитием последнего хорда исчезает, за исключением ничтожных остатков (студенистое ядро межпозвоночного диска). Водные формы могли обходиться хрящевым скелетом, так как механическая нагрузка в водной среде несравненно меньше, чем в воздушной. Но только костный скелет позволил животным выйти из воды на сушу, поднять свое тело над землей и прочно стать на ноги.
Таким образом, в процессе филогенеза как явление приспособления к окружающей среде происходит последовательная смена 3 видов скелета. Эта смена повторяется и в процессе онтогенеза человека, в течение которого наблюдаются 3 стадии развития скелета:
1) соединительнотканная (перепончатая),
2) хрящевая и
3) костная.
Эти 3 стадии развития проходят почти все кости, за исключением костей свода черепа, большинства костей лица, части ключицы, которые возникают непосредственно на почве соединительной ткани, минуя стадию хряща.
Эти, как их называют, покровные кости можно рассматривать как производные некогда бывшего наружного скелета, сместившиеся в глубь мезодермы и присоединившиеся в дальнейшей эволюции к внутреннему скелету в качестве его дополнения.

Синдром Марфана — наследственное заболевание, которое проявляется системным поражением соединительной ткани в организме человека. В результате болезни происходят нарушения строения скелета и кожи, работы глаз, сердечно-сосудистой, дыхательной и других систем организма. Эту генетическую мутацию нельзя предотвратить или вылечить, но правильно подобранное лечение способно продлить пациентам жизнь и предупредить развитие опасных осложнений.
Причины синдрома Марфана
Данное генетическое заболевание вызвано дефектом гена FBN1 в длинном плече 15 хромосомы. Этот ген кодирует белок гликопротеин фибриллин-1, который отвечает за прочность и эластичность соединительной ткани. Соответственно, все проявления патологии связаны с тем, что соединительнотканные структуры в организме человека теряют свои нормальные свойства.
Наследуется мутация по аутосомно-доминантному признаку, то есть дети получают патологический ген от родителей, которые страдают от патологии. При этом шанс ребенка получить мутацию от одного из родителей составляет 50% (рис. 1). Синдром не передается через поколение: здоровые дети больных родителей не могут передать ген своим потомкам.
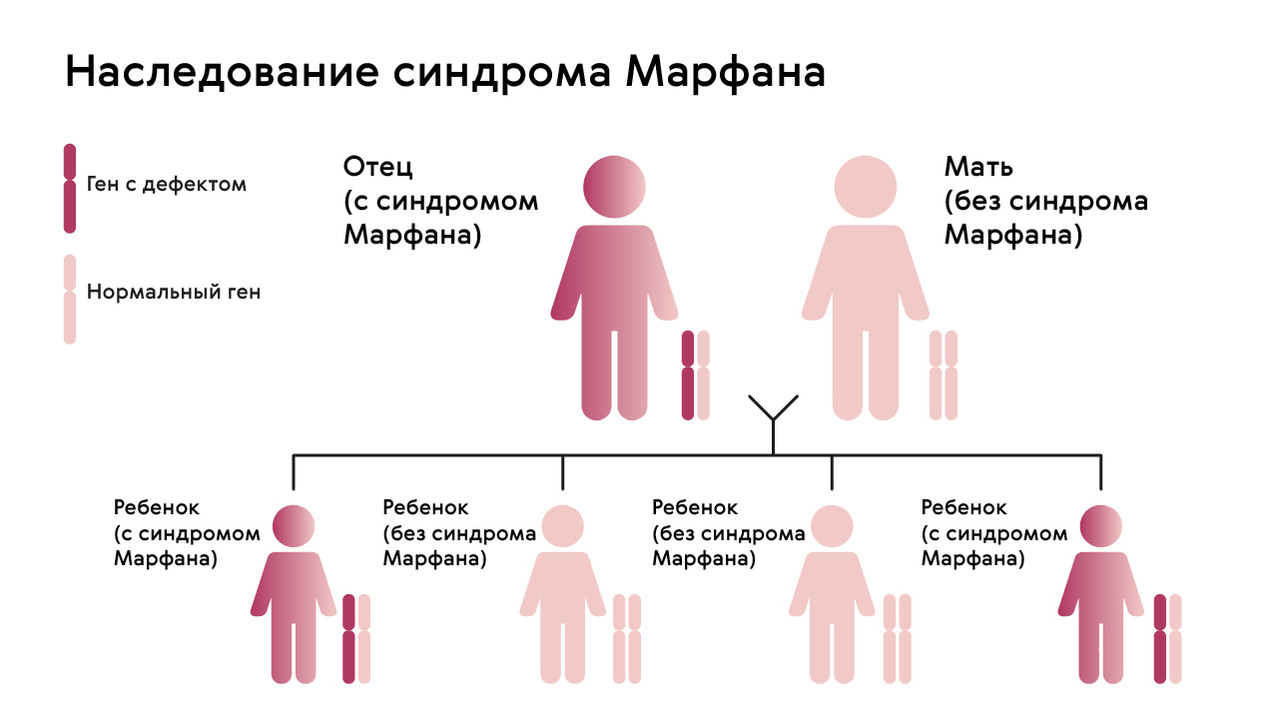
Рисунок. 1. Схема наследования синдрома Марфана. Источник: МедПортал
Однако примерно у 25% людей с синдромом Марфана никто из родителей не оказывается носителем аномалии гена FBN1: в таком случае мутация развивается спонтанно.
До сих пор не выявлено определенных факторов риска развития этого генетического нарушения: заболевание встречается одинаково часто среди мужчин и женщин, а его распространенность не зависит от расы или этнической группы. Частота заболеваемости у этой патологии составляет примерно 1 случай на 5–10 тысяч.
Если клинические признаки мутации ярко выражены, заподозрить болезнь можно уже в первые месяцы жизни ребенка, но стертые формы заболевания часто проявляются уже во взрослом возрасте, когда пациент обращается к врачам по поводу различных проявлений синдрома.
Важно! Не стоит записываться на генетическое обследование в качестве медосмотра. Поиски «поломки» гена FBN1 оправданы только в случае, если болезнь проявляет себя характерными признаками: бессимптомное носительство этой мутации невозможно. Если у одного из родителей установлен этот диагноз, будущей маме следует пройти генетическое обследование еще до родов. Это позволит заранее узнать, передалась ли аномалия ребенку.
Классификация синдрома Марфана
Выделяют несколько форм заболевания в зависимости от особенностей клинических проявлений генетической мутации.
Существуют две основные клинические формы патологии:
- Стертая. Таким пациентам «везет» больше: аномалия у них проявляется поражениями только одной-двух систем организма, а симптомы выражены незначительно. Люди могут жить практически нормальной жизнью, несмотря на болезнь.
- Выраженная. В таких случаях поражаются три и более систем организма, либо значительно нарушается функционирование одной из систем.
В зависимости от степени проявления выделяют легкие, среднетяжелые и тяжелые формы синдрома Марфана. Тяжелые патологии встречаются гораздо реже: частота их выявления составляет примерно 1 на 25–50 тысяч человек.
Принципиальную роль в определении прогноза болезни играет характер ее течения:
- Прогрессирующий. В этом случае постоянно появляются новые симптомы заболевания, степень тяжести увеличивается, а с каждым годом жизни пациента возрастают риски фатальных осложнений.
- Стабильный. Такой характер считается наиболее благоприятным: у пациентов со стабильными проявлениями синдрома Марфана клиническая картина практически не меняется на протяжении жизни.
Выделяют три разных, но похожих заболевания:
- Синдром Марфана — стертая форма патологии с положительным результатом генетического тестирования.
- Болезнь Марфана — классическая клиническая картина с подтвержденным семейным наследованием.
- Марфаноподобный синдром — проявление патологии соединительной ткани без генетической мутации.
Первые признаки заболевания чаще всего проявляются еще в детском возрасте. К подростковому периоду становится понятно, насколько быстро у пациента прогрессирует болезнь, вызванная мутацией гена FBN1.
Симптомы синдрома Марфана
Проявления генетического дефекта могут быть выражены в разной степени: от легкого изменения строения соединительной ткани до тяжелых нарушений жизненно важных функций организма. Иными словами, внешние признаки аномалии у разных пациентов могут значительно отличаться, несмотря на одинаковый генетический дефект.
Классической триадой синдрома Марфана считаются: скелетные нарушения, смещение хрусталика и расслоение аорты (рис. 2). Также системное поражение соединительной ткани у пациентов становится причиной развития нарушений работы практически всех органов и систем организма.
Костно-мышечная система
Выраженность симптомов поражения опорно-двигательного аппарата зависит от тяжести случая и особенностей организма пациента.
Для людей с синдромом Марфана характерен чрезвычайно высокий рост: обычно дети «перерастают» всех членов семьи. При этом часто, особенно в детском возрасте, привлекает внимание нестандартная длина рук: их размах оказывается больше, чем длина тела.
Яркий симптом болезни — патологически удлиненные и тонкие пальцы, так называемые «пальцы паука» (арахнодактилия) (рис. 3).
Проверить наличие симптома можно с помощью теста большого пальца кисти — у пациентов с арахнодактилией часть большого пальца (дистальная фаланга) выступает за край сжатой в кулак ладони (рис. 4).
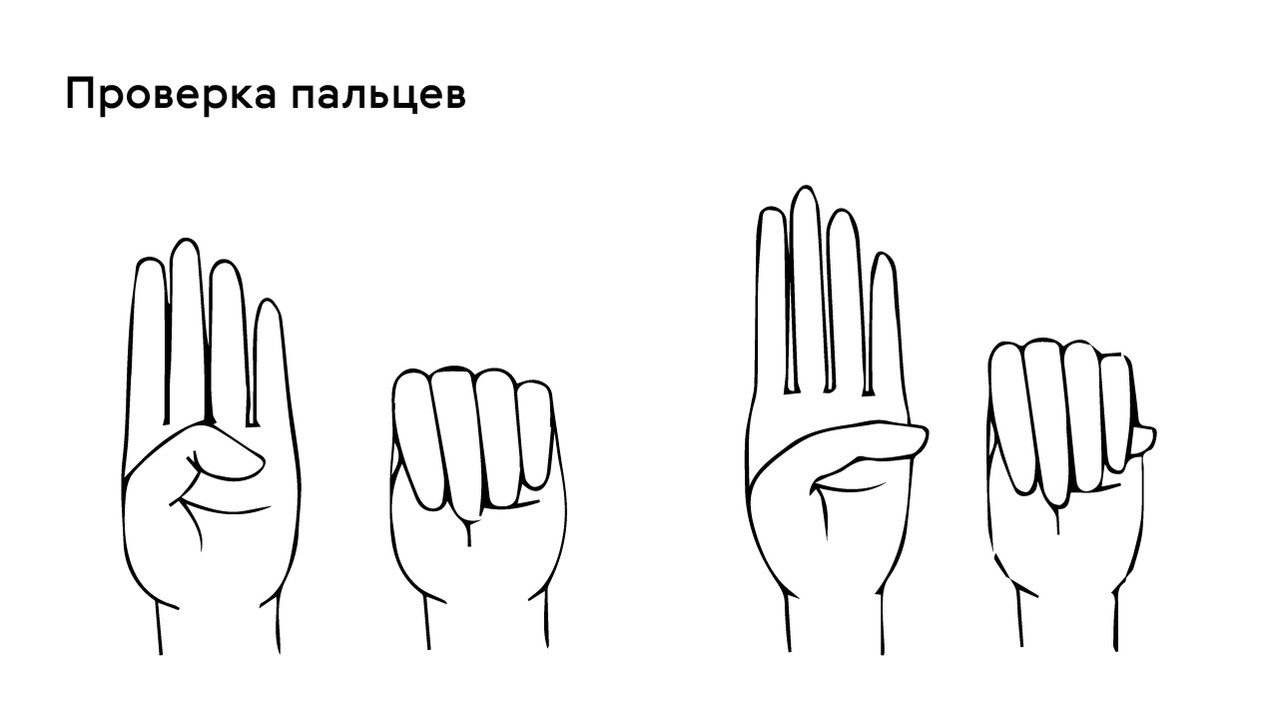
Рисунок 4. Проверка на арахнодактилию. Источник
Лицо людей с синдромом Марфана обычно вытянутое и худое. Этому способствует высокое положение свода верхнего неба, удлиненный череп и патологическая худоба.
Также для таких пациентов характерны деформации грудной клетки, которые могут быть в двух вариантах: смещение грудины внутрь (воронкообразная грудь) или наружу (килевидная грудь, рис. 5).
Осанка пациентов с синдромом Марфана в большинстве случаев нарушена. Чаще всего определяются различные степени выраженности сколиоза (отклонение позвоночного столба в сторону) или кифоза (формирование «горба»).
Кроме того, пациенты с FBN1 мутацией часто страдают от:
- плоскостопия;
- повышенной подвижности всех суставов;
- слабости связочного аппарата.
У пациентов с синдромом Марфана часто плохо развиты мышечные структуры и практически нет подкожно-жирового слоя. Движения пациентов с этой патологией неловкие, они часто получают различные травмы.
Высокий темп роста и нарушения выработки белков соединительной ткани определяют патологии кожи у людей с мутацией гена FBN1. Клинически это проявляется в виде повышенной растяжимости кожных структур с образованием светлых полос — «растяжек» (стрий).
Зрение
Дефекты гена FBN1 определяют склонность к патологиям зрительной системы. Чаще всего повреждения глаз у пациентов с синдромом Марфана включают в себя:
- выраженную близорукость;
- подвывих или изменение положения хрусталика;
- высокий риск внезапной отслойки сетчатки глаза.
Кроме того, у таких пациентов гораздо раньше может развиться катаракта или глаукома: те патологии органа зрения, которые считаются возрастными у здоровых людей.
Органы дыхания
В легких пациентов с синдромом Марфана может патологически разрастаться соединительная ткань. Это приводит к формированию сужения бронхов и легочного фиброза. Нередко на фоне генетической мутации развивается бронхиальная астма или хроническое обструктивное заболевание легких. Генетическая аномалия также определяет возможность развития спонтанного пневмоторакса — неотложной ситуации, в которой в полость вокруг легких попадает воздух, и легкое резко уменьшается в размерах («спадается»).
Желудочно-кишечный тракт
Процессы пищеварения у людей с FBN1 мутацией меняются: нарушается моторика кишечника, появляются патологии желчного пузыря, часто развиваются гастриты, язвенные дефекты, дисбиоз.
Почечный аппарат
У пациентов с синдромом Марфана чаще находят аномалии почек: опущение органов, расширение почечных лоханок, патологическую подвижность почек.
Нервная система и психическая сфера
Хотя в большинстве случаев у пациентов с синдромом Марфана не происходит нарушений работы мозговых структур, некоторые патологические изменения нервной системы могут присутствовать. Например, расширение соединительнотканной капсулы, которая окружает спинной мозг, может приводить к нарушениям движений в нижних конечностях, работы мочевого пузыря и кишечника. Для таких пациентов характерно развитие синдрома хронической усталости — астения, склонность к депрессии. Интеллектуальная деятельность в большинстве случаев не нарушена, даже наоборот: среди пациентов с синдромом Марфана есть люди с интеллектом значительно выше среднего.
Сердечно-сосудистая система
Кардиологи выявляют нарушения ритма сердца у людей с синдромом Марфана. У пациентов с этой патологией часто нарушается структура аортального клапана — соединительнотканной перегородки, которая предупреждает обратный ток крови из аорты в сердце. Это приводит к развитию порока сердца — аортальной недостаточности. Также могут развиваться другие пороки сердца, например, пролапс или недостаточность митрального клапана, а на пораженных участках часто развивается инфекционно-воспалительный процесс — бактериальный эндокардит.
Самую большую опасность представляют патологические изменения в главном сосуде организма — аорте. У 65–100% людей с синдромом Марфана есть большой риск поражения луковицы (наиболее близкая к сердцу часть аорты) и восходящей дуги этой артерии — тех частей, которые непосредственно выходят из сердца. Поскольку внутренний слой стенки сосудов также содержит волокна соединительной ткани, они склонны к износу, а давление крови в аорте выше, чем в других участках сосудистого русла. Это приводит к тому, что сосуд постепенно расширяется, и может произойти патологическое скопление крови между сосудистыми стенками с формированием мешковидного выпячивания (аневризмы) или спонтанный разрыв артерии.
Почему при определении признаков синдрома Марфана нужно обратиться к врачу?
Сама по себе генетическая аномалия совместима с жизнью. Однако опасны последствия болезни, вызванной FBN1 мутацией:
- разрывы крупных сосудов, чаще всего — аорты;
- хроническая сердечная недостаточность — неспособность сердца обеспечивать необходимую работу для кровоснабжения всех органов;
- снижение остроты зрения или полная потеря зрительной функции.
Разрыв аневризмы аорты или другого магистрального сосуда часто заканчивается моментальным летальным исходом. Хроническая сердечная недостаточность может перейти в острую форму, а без экстренной медицинской помощи также привести к фатальным последствиям — внезапной коронарной смерти. Именно эти осложнения чаще всего приводит к гибели детей с синдромом Марфана. Особая опасность ждет женщину с синдромом мутации гена FBN1 во время беременности: повышенная нагрузка на аорту в разы увеличивает риск ее разрыва.
Чтобы предупредить развитие опасных осложнений и компенсировать возникающие нарушения, родителям нужно как можно раньше обратиться за медицинской помощью при первом подозрении на синдром Марфана у ребенка. При этом важно не только однократно провести обследование, но и стать на учет к врачам, которые занимаются коррекцией проявлений синдрома:
- специалисту по генетическим болезням;
- кардиологу;
- ортопеду-вертебрологу;
- дерматологу;
- офтальмологу;
- гастроэнтерологу.
Список специалистов зависит от степени выраженности заболевания, при этом регулярно необходимо проходить комплексные профилактические осмотры для раннего выявления новых нарушений.
Синдром Марфана — болезнь гениев?
С синдромом Марфана связаны не только многочисленные поводы для обращения к врачам. Часто люди с мутацией гена FBN1 компенсируют физические проявления болезни интеллектуальными способностями, поэтому это генетическое заболевание даже называют «синдромом гениев». Считается, что повышенный выброс адреналина из-за патологических изменений в надпочечниках определяет высокий тонус умственной и психической активности у таких пациентов. Именно поэтому в числе людей с синдромом Марфана можно найти известных личностей. Например, Юлию Цезарю, Аврааму Линкольну и Шарлю де Голлю патология не помешала стать известными политическими деятелями; Ганс Христиан Андерсен и Корней Чуковский создали уникальные литературные произведения, а Никколо Паганини прославился как гениальный музыкант.
Современные знаменитости также не скрывают свои недостатки и становятся еще более популярными из-за генетического дефекта. Например, солисту американской рок-группы Deerhunter Брэдфорду Коксу нетипичная внешность придает особый шарм, а испанский актер Хавьер Ботет очень востребован, поскольку правдоподобно и талантливо играет отрицательных героев в голливудских фильмах ужасов (рис. 6).
Диагностика синдрома Марфана
Диагностика генетической аномалии включает в себя комплекс мероприятий по определению всех симптомов болезни, а также изучению вероятности развития мутации:
- Сбор жалоб — детальное изучение всех патологических признаков.
- Определение анамнеза — выяснение состояния здоровья родителей.
- Тщательный осмотр, измерение роста, размаха рук и других антропометрических показателей. Скрининговый тест для детей в возрасте 7–18 лет — это измерение длины среднего пальца руки. У пациентов с синдромом Марфана показатель превышает отметку в 10 см.
Генетическое обследование включает в себя выявление генотипа ДНК — идентификацию мутаций в гене FBN1. При возможности назначают специфические лабораторные тесты — определение выведения с мочой метаболитов соединительной ткани, таких как оксипролин и гликозаминогликаны.
Чтобы подтвердить нарушения развития соединительной ткани и оценить степень выраженности мутации гена FBN1, пациентам с подозрением на синдром Марфана назначают:
- ЭКГ;
- УЗИ сердца;
- КТ-ангиографию аорты и других сосудов;
- КТ грудной и брюшной полостей;
- МРТ позвоночника и головного мозга;
- специфические обследования на осмотре у офтальмолога;
- биопсию кожи.
Для окончательного определения диагноза используют общепринятые Гентские критерии 2010 года, согласно которым диагноз устанавливают в случаях:
- подтвержденной мутации гена FBN1 и расширения корня аорты или эктопией хрусталика;
- подтвержденного расширения корня аорты в сочетании с эктопией хрусталика;
- подтвержденной эктопии хрусталика в сочетании с любыми признаками системного поражения соединительной ткани.
Важно! Существует группа «марфаноподобных» синдромов, при которых внешне пациенты очень напоминают больных с аномалией гена FBN1, но причина их патологии скрывается в других нарушениях. К примеру, гомоцистинурия — это обменное заболевание, которое проявляется системными изменениями соединительной ткани, но может приводить к внезапным инсультам и существенно замедляет умственное развитие ребенка. Поэтому важно точно определить причину заболевания соединительной ткани и своевременно начать лечение.
Лечение синдрома Марфана
К сожалению, на сегодняшний день лекарственные методы терапии этой генетической патологии еще не разработаны. Однако пациентам с синдромом Марфана важно соблюдать все назначения врачей, чтобы устранить симптомы патологии и замедлить темпы ее развития.
Лечение зависит от клинических проявлений болезни:
- при аневризме аорты назначают препараты, которые снижают частоту и силу сердечных сокращений, снимая избыточную нагрузку на сосуды;
- пациентам с синдромом Марфана часто назначают антигипертензивные препараты для снижения артериального давления;
- хондроитин и глюкозамин относятся к естественным компонентам соединительной ткани — их прием улучшает структуру хрящей и предупреждает патологии суставов;
- для стимуляции образования коллагена выписывают специальные БАДы — L-карнитин, витамины из групп С, D, Е, В, а также кальций, цинк и другие пищевые добавки.
Пациентам противопоказаны физические нагрузки, постоянная активность, травмоопасные игры. Рацион питания людей с синдромом Марфана должен быть насыщен белками, полезными жирными кислотами, микро- и макроэлементами. Для поддержки структур скелета пациентам с мутацией в гене FBN1 показано ношение корсетов, укрепление мышц с помощью ЛФК и оздоровительного массажа.
В некоторых случаях может помочь только хирургическое лечение — операции по замене части аорты, клапанов, исправлению костных патологий или коррекции патологий глаза, которые существенно снижают риски опасных осложнений.
Прогноз
Современные методы исследования в медицине позволяют выявлять заболевание у детей в раннем возрасте. Это помогает повысить качество жизни таких пациентов и предупредить раннюю смертность. Продолжительность жизни людей с синдромом Марфана при бережном отношении к своему здоровью достигает 70 лет. Прогноз болезни во многом зависит от выраженности сердечно-сосудистых патологий, поскольку выживание пациентов с этой генетической аномалией определяет состояние аорты и риск ее спонтанного разрыва. Такие люди требуют постоянного наблюдения у врачей различных специальностей для своевременной коррекции проявлений синдрома.
Заключение
Конечно, жизнь с этой генетической мутацией становится сложнее, но при правильном подходе к собственному здоровью и своевременному обследованию у врачей пациентам с синдромом Марфана удается компенсировать все проявления заболевания и не допустить развития фатальных осложнений.
Активисты с синдромом Марфана создают тематические сообщества по всему миру: мощная поддержка людей с такой же генетической аномалией позволяет пациентам не чувствовать себя одинокими.
Что такое эксфолиативный кератолиз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Похлебкиной Алевтины Алексеевны, педиатра со стажем в 6 лет.
Над статьей доктора Похлебкиной Алевтины Алексеевны работали литературный редактор Вера Васина , научный редактор Владимир Горский и шеф-редактор Маргарита Тихонова
Определение болезни. Причины заболевания
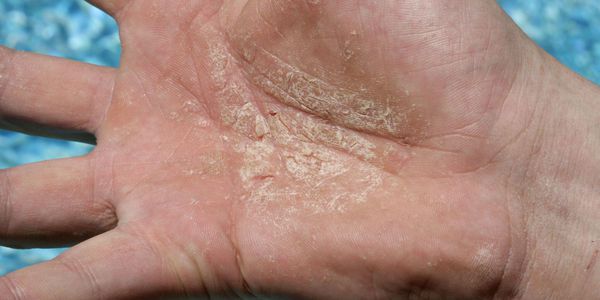
Эксфолиативный кератолиз — это очаговое симметричное шелушение кожи на ладонях, поверхности пальцев и, реже, на подошвах. Заболевание характеризуется сухостью кожи и поверхностными пузырями, заполненных воздухом.
Также эксфолиативный кератолиз называют рецидивирующей фокальной ладонной десквамацией, сухим пластинчатым дисгидрозом и рецидивирующей ладонной десквамацией.
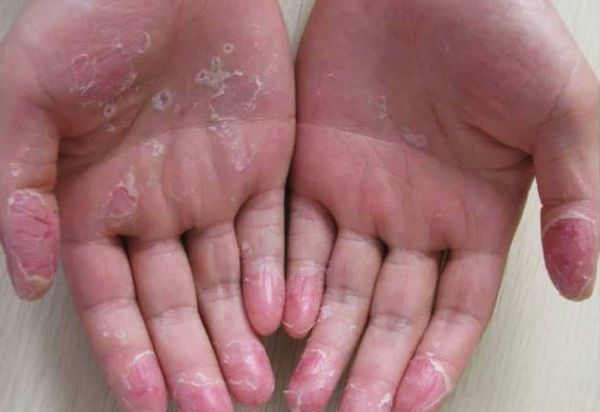
Заболевание широко распространено и часто носит хронический, но доброкачественный характер. Эксфолиативный кератолиз чаще встречается у детей и подростков, реже у взрослых. Нередко его ошибочно принимают за псориаз, экзему или хронический контактный дерматит. У людей с повышенной потливостью рук состояние ухудшается в тёплую погоду и может быть связано с гипергидрозом — усиленным потоотделением [1] .
Ранее эксфолиативный кератолиз называли дисгидротической экземой , и считалось, что заболевание вызвано нарушением работы потовых желёз. Эта связь уже опровергнута, но термин "дисгидротическая экзема" всё ещё используется [2] .
Дисгидротическая экзема, также называемая помфоликсом, может предшествовать эксфолиативному кератолизу. При этом состоянии на пальцах рук, ног, ладонях и подошвах образуются волдыри, наполненные жидкостью, и возникает сильный зуд [2] . Причина дисгидротической экземы неизвестна, но, вероятно, на развитие заболевания влияет множество факторов. В большинстве случаев причину и предрасполагающий фактор выделить невозможно [17] .
Причины эксфолиативного кератолиза
Предполагалось, что экфолиативный кератолиз может быть вызван грибковым поражением, но в дальнейших исследованиях эта гипотеза не подтвердилась.
Возможные провоцирующие факторы эксфолиативного кератолиза:
- трение и контакт с водой[3][6];
- мыло, моющие средства и растворители: химические вещества, содержащиеся в них, могут привести к появлению трещин и пузырей на руках;
- аллергия: продукты питания, загрязнение воздуха и другие вещества могут спровоцировать появление аллергии на коже;
- стресс: может не только вызвать, но и усугубить течение болезни;
- жаркий климат: при тёплой погоде потоотделение усиливается, что может привести к шелушению кожи;
- воздействие солёной воды;
- сухость кожи.
Эксфолиативный кератолиз не связан с дефицитом какого-либо витамина . Встречаются семейные случаи заболевания, однако генетическая роль в развитии эксфолиативного кератолиза изучена недостаточно [14] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы эксфолиативного кератолиза
Эксфолиативный кератолиз часто протекает без выраженных симптомов и проявляется незначительным поражением кожи ладонно-подошвенной области [5] . Отшелушиванию кожи предшествует появление наполненных воздухом пузырей, которые никогда не бывают заполнены жидкостью [3] . В некоторых случаях заболевание начинается только с очагового шелушения кожи, без образования пузырей.
После вскрытия пузырей остаются широкие сетчатые, круглые или овальные очаги. Они шелушатся, распространяются по периферии и образуют большие округлые участки, напоминающие кружева.
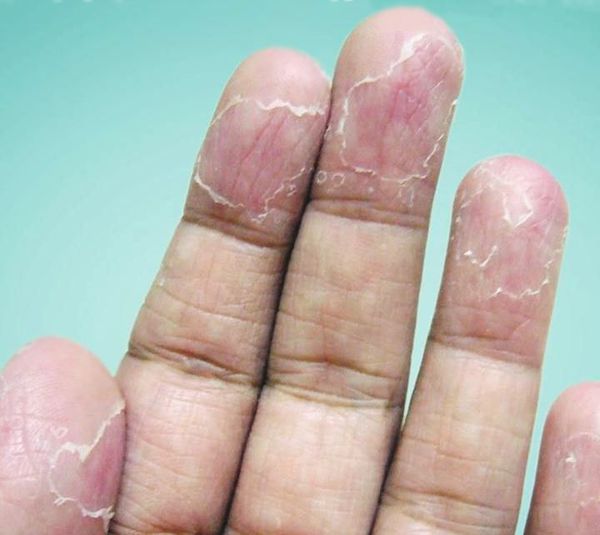
Участки слущенного эпителия теряют защитную функцию, становятся красными, сухими и покрываются трещинками. Шелушению может предшествовать небольшой зуд или жжение, в некоторых случаях область слущенного эпителия становится болезненной [3] .
Высыпания всегда симметричные. Иногда на кончиках пальцев образуются глубокие трещины, кожа становится жёсткой и немеет — в таком случае для полного заживления потребуется 1—3 недели. Эксфолиативный кератолиз может повториться через несколько недель после того, как на месте отшелушивания образовалась новая кожа.
Патогенез эксфолиативного кератолиза
Эпидермис — верхний наружный слой кожи, состоящий из кератиноцитов. Эти клетки содержат белок кератин, необходимый для прочности и эластичности кожи. Когда кератин разрушается, прочность кожи снижается, из-за чего она начинает шелушиться.
Также в эпидермисе содержатся корнеодесмосомы — белковые структуры, которые соединяют кератиноциты в сеть. В верхнем роговом слое кожи количество таких структур обычно уменьшается. Это нормальный физиологический процесс. Он называется десквамацией. Благодаря нему клетки кожи отшелушиваются, при этом поддерживается постоянная толщина рогового слоя [8] .
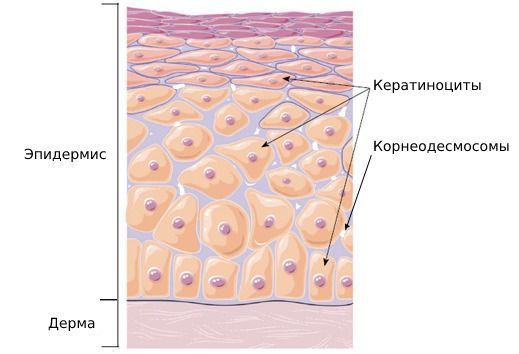
Исследование 24 пациентов с эксфолиативным кератолизом показало, что заболевание может возникать из-за дисбаланса активности ферментов, участвующих в процессе десквамации, особенно на коже ладоней [3] .
Точный механизм развития эксфолиативного кератолиза неизвестен. Прояснить возможные генетические или приобретённые причины заболевания помогут дальнейшие исследования десквамационных ферментов и ингибиторов — веществ, подавляющих или задерживающих течение ферментативных процессов. К таким веществам относятся ингибитор секреторной лейкоцитарной протеазы (SLPI), альфа-2 макроглобулин-1 (A2ML1), сульфат холестерина и ион цинка.
Классификация и стадии развития эксфолиативного кератолиза
По МКБ-10 (Международной классификации болезней) дерматологи часто кодируют эксфолиативный кератолиз как L26, относя заболевание к "другим эксфолиативным состояниям".
Классификации и стадийности эксфолиативный кератолиз не имеет. Заболевание иногда может приобретать хроническое течение с периодами ремиссии и обострения.
Осложнения эксфолиативного кератолиза
Эксфолиативный кератолиз не вызывает системных проявлений или осложнений. При заболевании может повреждаться кожа, в результате чего присоединяется бактериальная инфекция. Её признак — красные пятна, которые превращаются в гнойнички и пузырьки. Пузырьки безболезненные и легко вскрываются, образуются желтоватые чешуйки, так называемые "медовые корочки". При этом может возникать зуд.
Диагностика эксфолиативного кератолиза
Диагноз "эксфолиативный кератолиз" ставится на основании данных клинического обследования и сбора анамнеза [15] . Некоторые пациенты отмечают, что состояние усугубляется после воздействия химических или физических раздражителей, таких как вода, мыло и моющие средства. Другие ассоциируют шелушение кожи с повышенным потоотделением.
Эксфолиативный кератолиз, вероятно, распространён, но часто протекает бессимптомно, поэтому врачи его наблюдают редко.
При осмотре отмечаются симметричные округлые участки шелушения на ладонях и, реже, на стопах. При этом воспаление на коже отсутствует.
Обычно дополнительное диагностическое тестирование не требуется. Однако в более сложных случаях, при подозрении на грибковое поражение, может потребоваться исследование с гидроксидом калия (KOH).
Биопсия кожи при кератолизе показывает расщепление и частично разрушенные корнеодесмосомы в роговом слое.
Патч-тесты , оценивающие потенциальную контактную аллергию , при эксфолиативном кератолизе отрицательны.
Дифференциальную диагностику проводят со следующими заболеваниями:
- различные формы дерматита рук, включая контактный дерматит, — для него характерен зуд, воздействие провоцирующих факторов в анамнезе, положительный ответ на гормональные мази;
- дисгидроз — сопровождается зудом, появлением трещин и везикул, наполненных жидкостью; — бляшки с чёткими границами бордово-красного цвета, выступающие над поверхностью кожи;
- дерматофития рук — изменение ногтей на руках и ногах, положительный ответ на противогрибковые препараты, не всегда симметричное поражение;
- простой буллёзный эпидермолиз — пузыри на разных участках кожи младенцев, возникающие после трения;
- ограниченный ладонный гипокератоз — редкое состояние, характеризуется центральной розовой областью с тонкой кожей на ладонях или подошвах стопы, по краям резкий переход к нормальной коже;
- пальмоплантарная кератодерма — возникает на коже стоп и кистей, характеризуется выраженным утолщением кожи [11] ;
- синдром акрального шелушения кожи — генетическое заболевание с пожизненным отслаиванием кожи.
Лечение эксфолиативного кератолиза
Причин возникновения эксфолиативного кератолиза может быть несколько, и не всегда они очевидны. Поэтому лечение болезни направлено на устранение симптомов и усугубляющих факторов. Это достигается защитой рук от физических или химических раздражителей ношением перчаток, когда это возможно.
Активное увлажнение кожи — важный, безопасный и эффективный метод лечения [10] . Наиболее подходящим способом для большинства пациентов являются кератолитические кремы, содержащие мочевину, молочную кислоту, лактат аммония или салициловую кислоту. Кремы с мочевиной увлажняют кожу и предотвращают её сухость. Кремы могут содержать мочевину 20 % или 40 %, 12 % лактата аммония, 6 % салициловой кислоты и 12 % молочной кислоты. Любой из них применяют до двух раз в день.

Приём наружных гормональных препаратов (стероидов) не требуется, так как воспаление отсутствует.
В некоторых исследованиях упоминается использование фотохимиотерапии с псораленом и ультрафиолетовым светом (PUVA), но только при тяжёлых случаях, так как риски этой терапии превышают пользу [9] .
PUVA-терапия заключается в приёме пациентом фотоактивного материала псоралена с последующим воздействием на кожу UVA лучей. Данных, подтверждающих пользу фототерапии при эксфолиативном кератолизе, на сегодняшний день недостаточно.
Возможные побочные эффекты PUVA-терапии: покраснение кожи вплоть образования пузырей, зуд; к редкими побочными эффектам относятся головная боль, головокружение, учащённое сердцебиение и слабость [4] .
Также в литературе встречаются данные о лечении эксфолиативного кератолиза ацитретином [7] [14] . Но для рутинного применения ацитретина в качестве лечения кератолиза информации пока недостаточно. Ацитретин — это производное витамина А, которым лечат псориаз.
Прогноз. Профилактика
Прогноз благоприятный. Обычно симптомы эксфолиативного кератолиза проходят самостоятельно или после прекращения контакта с провоцирующим фактором. Спустя несколько недель или месяцев формируется здоровая кожа. Однако через несколько недель может возникнуть рецидив.
Иногда кератолиз приобретает хронический характер и длится много лет подряд. В таком случае заболевание трудно поддаётся лечению. С возрастом эксфолиативный кератолиз возникает реже [2] .
Меры профилактики:
- избегать веществ, которые способствуют шелушению, например растворителей, антибактериального мыла и некоторых тканей;
- соблюдать гигиену рук и ног с частой стрижкой ногтей — это поможет избежать вторичного инфицирования;
- использовать перчатки при контакте с химическими веществами;
- наносить увлажняющие кремы для рук, особенно полезны кремы, содержащие мочевину, молочную кислоту или силикон.

Роль продуктов питания в развитии эксфолиативного кератолиза не доказана, поэтому соблюдать диету не нужно.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Бледность кожи: причины появления, при каких заболеваниях возникает, диагностика и способы лечения.
Определение
Бледностью называют такое состояние, когда кожа человека становится светлее, чем обычно. Так называемое побледнение кожных покровов может быть как физиологической реакцией на стресс или погодные условия, так и симптомом развития тех или иных патологических процессов в организме.
Бледность кожи, сопровождающаяся быстрой утомляемостью, слабостью, головокружением, потерей аппетита и снижением веса, - весомый повод для обращения за медицинской помощью.
Разновидности бледности кожи
Общепринятой классификации бледности кожи не существует, поэтому специалисты ориентируются на причины, вызывающие данное состояние.
Возможные причины бледности кожи
Кожа может бледнеть под влиянием ряда факторов.
- Стресс. У некоторых людей психоэмоциональное напряжение, сильное волнение вызывает побледнение кожных покровов, что объясняется спазмом сосудов.
- Климат. Недостаток солнца чреват снижением выработки меланина и дефицитом витамина Д, которые не в последнюю очередь влияют на здоровье кожи.
- Возраст. С возрастом снижается эластичность кожи и сосудов, ухудшается кровоснабжение кожных покровов, и они бледнеют.
- Малоподвижный образ жизни вызывает замедление кровотока, в результате чего все органы, включая кожу, испытывают недостаток кислорода.
- Анемия – снижение уровня гемоглобина и количества эритроцитов, красных кровяных телец.
В группе риска - вегетарианцы, люди, придерживающиеся строгой диеты или злоупотребляющие алкоголем, беременные, пожилые люди, пациенты после операции на кишечнике.
Бледность кожных покровов – один из основных симптомов анемии, кроме того, пациенты отмечают ломкость волос и ногтей, сухость кожи, слабость, головокружение.
- Анемия может наблюдаться при хронической кровопотере у больных с язвенной болезнью и гинекологическими патологиями. По сути, любой воспалительный процесс в желудочно-кишечном тракте приводит к нарушению всасывания питательных веществ, что, в свою очередь, становится причиной анемии и авитаминоза.
- Болезни сердечно-сосудистой системы приводят к нарушению кровообращения в органах и тканях и снижению тонуса сосудов, в результате чего наблюдается бледность кожи.
- Снижение гормональной активности щитовидной железы влияет на всасывание железа в кишечнике, что вызывает анемию и бледность кожи.
- Интоксикация организма на фоне инфекционных заболеваний может вызывать побледнение кожных покровов.
- Онкологические заболевания часто сопровождаются бледностью кожи вследствие анемии. Опухоль может вызывать кровотечение или увеличивать потребление организмом железа и витаминов. Онкологические заболевания крови часто начинаются c анемии и выраженной бледности вследствие вытеснения нормальных клеток крови, в том числе эритроцитов, раковыми клетками.
- анемия;
- гастрит, язвенная болезнь желудка;
- болезни кишечника (колит, болезнь Крона, состояние после удаления части кишечника, болезнь Уиппла);
- хронические болезни почек;
- сердечно-сосудистые заболевания;
- цирроз печени;
- гипотиреоз;
- миома матки, эндометриоз, нарушения менструального цикла;
- геморрой;
- лейкоз.
Диагностика и обследования при бледности кожи
Тщательный сбор анамнеза с учетом всех жалоб пациента, осмотр и проведение дополнительной диагностики помогут установить точную причину бледности кожи.
-
Клинический анализ крови с развернутой лейкоцитарной формулой (для диагностики анемии).
Читайте также:

