Когда будет победа над герпесом
Обновлено: 24.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Генитальный герпес: причины появления, классификация, симптомы, диагностика и способы лечения.
Определение
Генитальный герпес – хроническое рецидивирующее заболевание вирусной этиологии, передающееся преимущественно половым путем. Герпес считается крайне распространенным эрозивно-язвенным заболеванием половых органов - ежегодно в мире регистрируется 500 000 новых случаев обращений по этому поводу. В Российской Федерации у лиц старше 18 лет инфицированность вирусом, вызывающим генитальный герпес, составляет 17,2 случая на 10 000 населения.
В 70% случаев заболевание протекает бессимптомно, что и обусловило широкое распространение этой патологии.
Причины появления генитального герпеса
Генитальный герпес вызывает вирус простого герпеса (ВПГ) I и/или II типов. Вирус герпеса I типа чаще всего поражает слизистую оболочку рта и носит название орального (лабиального) герпеса. При заражении этим вирусом очаги поражения локализуются на лице в области губ.
Вирус герпеса II типа чаще вызывает генитальный герпес, однако оба типа могут провоцировать развитие патологии оральной и генитальной локализации. Для ВПГ II типа более характерно рецидивирующее течение, чем для ВПГ I.
- Половой путь – самый часто встречающийся путь передачи генитальной герпетической инфекции.
- Передача вируса бытовым путем является самой редкой.
- Аутоинокуляция – перенос вируса с зараженных участков слизистой на здоровые самим больным.
- Трансплацентарный – через плаценту от инфицированной матери плоду.
- Перинатальный – в процессе родов.
- Контактно-бытовой (при несоблюдении правил ухода и гигиены).
- Аутоинокуляция (см. выше).
- Беспорядочная половая жизнь без использования барьерной контрацепции (презервативов).
- Нарушение правил личной и бытовой гигиены.
- Снижение иммунитета (в силу наличия длительно текущих хронических заболеваний, несбалансированного питания, подверженности частым стрессам, нарушения режима сна).
- Первый эпизод развития клинической симптоматики генитального герпеса.
- Рецидивирующая герпетическая инфекция.
- Инфекция мочеполовых органов.
- у мужчин,
- у женщин.
- Инфекция прямой кишки и перианальной кожи.
- Герпес с типичной клинической картиной.
- Атипичное течение.
Если иммунная система справляется с вирусом на этом этапе, то формируется иммунитет и носительство вируса, не исключающее рецидива заболевания при ослаблении защитных функций организма.
Если у организма нет ресурсов противостоять ВПГ, то вирус проникает во внутренние органы и фиксируется на них. При снижении иммунитета, прочих вирусных инфекциях или при обострениях хронических заболеваний ВПГ из органов вновь выходит в кровь и с ее током разносится по организму.
Симптомы генитального герпеса
При первичном инфицировании инкубационный период составляет от 1 до 10 дней, а клинические проявления длятся от 18 до 24 дней с нарастанием симптоматики в течение недели. До возникновения очагов повреждения у 50% больных появляются продромальные симптомы - парестезии, чувство жжения в генитальной области, невралгии в ягодичной, паховой бедренной областях, дизурия - и продолжаются до 24 часов. В последующем вирусное повреждение эпителия проявляется в виде везикул на эритематозном фоне с дальнейшим характерным разрешением (образованием корочек). Симптомы общей интоксикации, свойственные любой вирусной инфекции, – недомогание, слабость, субфебрилитет, головная боль - развиваются, как правило, при первичном инфицировании, при рецидиве они минимальны.
Непервичная генитальная герпетическая инфекция протекает менее выраженно: длительность клинических проявлений составляет до 15 дней, реже наблюдается бессимптомное выделение вируса, длительность слущивания поврежденного эпителия составляет всего 4-5 дней.
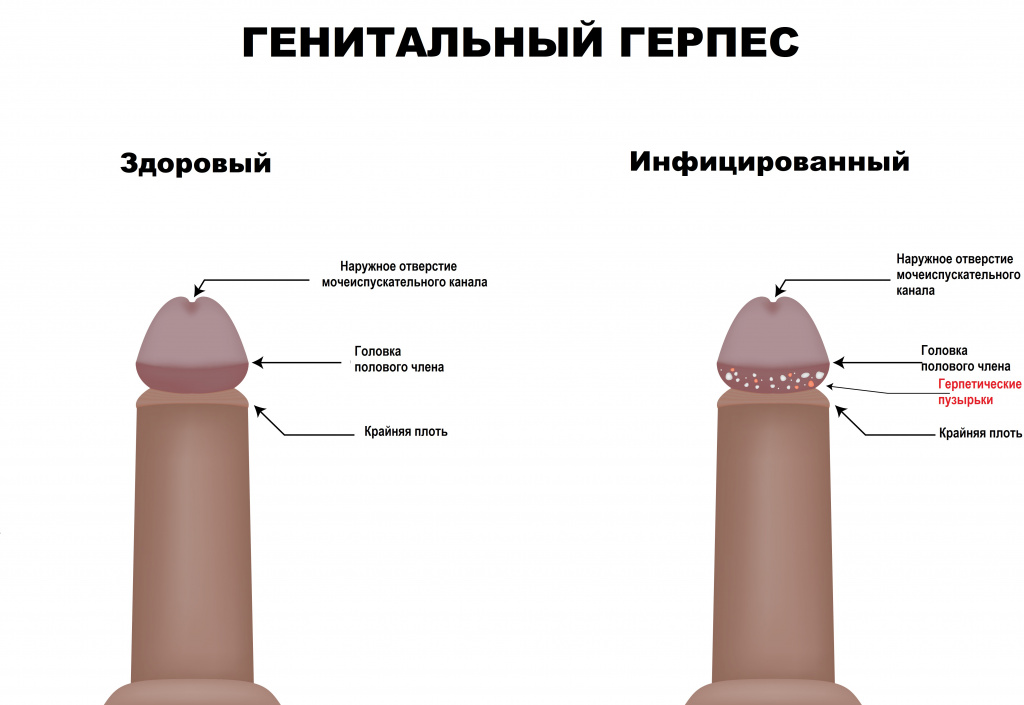
Высыпания на половых органах и/или в перианальной области всегда носят пузырьковый характер, содержимое прозрачное, основание пузырьков гиперемировано (красного цвета); могут быть множественными и единичными.
Пораженная область слизистой оболочки отечная. У мужчин самая частая локализация высыпаний – мошонка, половой член, лобок, промежность, перианальная область.
У женщин – клитор, влагалище, вульва, лобок, шейка матки, перианальная область. В случае присоединения вторичной (чаще бактериальной) инфекции появляются гнойные и слизисто-гнойные выделения.
В случае обострения генитального герпеса присутствует боль при половом контакте.
Диагностика генитального герпеса
Диагностика этого заболевания строится на характерной клинической картине высыпаний и на выявлении ДНК вируса в крови или в отделяемом с пораженных тканей.
Необходимо сдать анализы крови для подтверждения инфицированности вирусом герпеса и определения активности процесса, для выявления ДНК вируса в эякуляте, секрете простаты, в соскобе клеток урогенитального тракта, а также в соскобах с конъюнктивы, кожи, слизистой оболочки носа, ротоглотки.
Раздельное определение ДНК-вируса простого герпеса 1 типа (губного или лабиального) и 2 типа (генитального) в сыворотке крови методом полимеразной цепной реакции (ПЦР) с детекцией в режиме реального времени. Термин "герпес" (от древнегреч. – ползти, ползучи.
Появилась надежда, что в скором времени герпес может быть побежден.
Ученые из Корнелла начали наступление на вирус герпеса, не самый опасный, но достаточно неприятный, а в тяжелых случаях даже способный довести свою жертву до летального исхода.
До сих пор врачам удавалось только убирать симптомы болезни, но о полном выздоровлении речи не шло: герпес считался неизлечимой инфекцией. А все потому, что, помимо активных вирусных частиц, в зараженном организме хранятся и спящие копии, надежно спрятанные в местах, куда лекарствам проникнуть пока не удавалось.
Исследователи вооружились технологией CRISPR, используемой для внесения изменений в цепочки ДНК.
CRISPR работает по принципу «вырезать-вставить»: специальная РНК определяет нужное место в ДНК, и то, чем будет заменен вырезанный кусочек. Белок Cas3, вырезает нужную последовательность аминокислот и вставляет (при необходимости) другую, «правильную». Технология работает довольно надежно, и широко применяется в генной инженерии.
Для эксперимента были получены фибробласты человека, являющегося носителем вируса герпеса. Инструментами CRISPR, помещенными в фибробласты, удалось разрушить не только активные вирусы, но и их спящие копии, что до сих пор не удавалось ни одному лекарственному препарату.
Осталось найти способ поместить инструменты CRISPR в нейроны, где находится «резервное хранилище» герпеса. Если это удастся, можно будет говорить о победе над вирусом, от которого страдает значительная часть человечества. Особенно — люди с ослабленным иммунитетом. Обострение болезни может вызвать у них серьезное поражение головного мозга, потерю зрения и даже смерть.
Исследователи предполагают, что разрабатываемый метод позволит также успешно бороться и с другими вирусами: Эпштейн-Барр, гепатита В.
Интересно, будут ли противники генной инженерии против излечения от этих болезней, или предпочтут продолжать болеть? А как думаете вы?
Делитесь своим мнением с нами, а нашими публикациями — с друзьями. И, конечно, подписывайтесь на наш канал, чтобы быть в курсе новостей.

Половой или генитальный герпес — широко распространенное иммунодефицитное заболевание, передаваемое половым путем. Наблюдается приблизительно у 20% взрослых людей. Имеет рецидивирующее течение. Заболевание вызывает вирус простого герпеса II или I типа (ВПГ-II или ВПГ-I). В случае, если заболевание вызвано ВПГ-1, то рецидивы бывают реже, чем при ВПГ-2. ВПГ-2 широко распространен в мире. По данным ВОЗ, в мире около 417 миллионов человек в возрасте от 15 до 50 лет (11% населения планеты) инфицированы ВПГ-2.
В России больных генитальным герпесом около 8 миллионов; число лиц, вновь инфицированных ВПГ-2, ежегодно возрастает более чем на 10%.
Женщины инфицируются ВПГ-2 чаще, чем мужчины. Это объясняется тем, что ВПГ-2 передается половым путем более эффективно от мужчины к женщине, чем от женщины к мужчине.
ВПГ-2, как и другие герпесвирусы, вызывает пожизненное инфицирование. При снижении иммунитета может часто рецидивировать, т.е. давать обострения. Рецидив (обострение) – это показатель нарушения баланса сил между организмом и вирусом в пользу вируса. Источником инфекции являются больные с явными или стертыми формами заболевания, а также вирусоносители (бессимптомно выделяющие вирус в окружающую среду).
Факт:Инфицирование человека ВПГ-2 происходит, в основном, в постпубертатном периоде — после начала половой активности. Инфицирование человека вирусом простого герпеса 2 типа происходит при тесном физическом контакте с больным или вирусоносителем при генитальном, орально-генитальном, оральном контактах.
Вирус проникает как через неизмененные, так и через травмированные, воспаленные слизистые оболочки половых органов, уретры, прямой кишки или кожи.
После инфицирования вирус попадает в «депо». При генитальном герпесе «депо» вируса находится в крестовых ганглиях, которые расположены в малом тазу, рядом с позвоночником. При рецидиве вирус, по нервам от крестцового ганглия спускается к коже и слизистым гениталий, ягодиц, бедер.
Возможно аутозаражение — механический перенос вируса из герпетического очага в другие места, например, занос руками вируса из области гениталий при генитальном герпесе в полость рта, на конъюнктиву глаза, на любые участки тела через микроповреждения кожи.
Заражение через предметы обихода или личной гигиены, инфицированные ВПГ-2, реализуется редко. Однако может встречаться у детей младшего возраста как следствие инфицирования контактным путем, например, от родителей через инфицированные руки, предметы личной гигиены.
Герпес 2 типа может передаваться гемотрансфузионным (после переливания крови и ее компонентов), трансплантационным путем (при пересадке органов и тканей).
В продромальный периоде — за 1-2 дня до появления высыпаний обычно отмечаются субъективные ощущения в виде болей, жжения, зуда, покалывания, чувства дискомфорта на участках слизистых оболочек и кожи, где в дальнейшем появятся высыпания.
В первые дни болезни, особенно при первичном поражении герпесом в интимной зоне, местным проявлениям предшествуют также признаки общей интоксикации: повышение температуры тела, озноб, недомогание, мышечные, суставные и головные боли. Затем высыпания периодически возникают повторно. Частота их возникновения различна у разных людей и зависит от состояния иммунитета человека. Место высыпаний каждый раз одно и то же и носит название «Locus minoris».
Период регресса — через 2-3 дня содержимое пузырьков мутнеет, они вскрываются и образуются эрозии с мелкофестончатыми очертаниями. Через 3–5 дней на месте эрозий образуются корочки, после отпадения которых происходит заживление. Через 7–9 дней корочки отторгаются.
Следует отметить, что после первичного инфицирования вирус остается в организме, Особенностью полового герпеса является многоочаговость. В патологический процесс нередко вовлекаются нижний отдел мочеиспускательного канала, слизистая оболочка ануса и прямой кишки, что может происходить вторично, вслед за возникновением герпеса наружных гениталий.
Диагностика полового герпеса.
Диагностические и лечебные мероприятия проводятся для обоих супругов. При наличии клинических показаний у обоих половых партнеров необходимо исследовать титры IgM и IgG к ВПГ-2. В вульвовагинальном секрете, в отделяемом цервикального канала, в отделяемом уретры, в простатической жидкости показано определение наличия и типа вируса (ДНК ВПГ-2).
Чтение результатов диагностики.
Антитела вируса простого герпеса 2 типа: Вирус простого герпеса 2 IgG — ниже нормы, IgM нет. Организм не встречался с вирусом. Герпес тип 2 IgG выше нормы, IgM — нет. Организм уже перенес инфекцию, вирус, вероятно, находится в латентной стадии. Вирус простого герпеса 2 IgM «обнаружено» — превышает нормальные показатели (произошло первичное инфицирование вирусом простого герпеса, либо его рецидив.
Планировать беременность при таких показателях категорически нельзя, до тех пор, пока не пропадут IgM.
Наиболее «древний», так называемый культуральный метод. Суть его заключается в том, что капилляром, шприцем или тампоном из герпетических высыпаний или пузырьков забирают содержимое и подсаживают его на растущий куриный эмбрион. По характеру гибели эмбриона, на котором вирус герпеса оставляет специфические «оспины», делают заключение о наличии заболевания.
В дополнение к нему не так давно появился метод Полимеразной Цепной Реакции или сокращённо — ПЦР.
К сожалению, на сегодняшний день не существует лабораторных анализов, позволяющих со 100% достоверностью установить или опровергнуть диагноз. Случается так, что анализы не дают конечных результатов. На лицо картина герпеса, а подтверждения этому в анализах нет. Бывает, что вирус погибает в соскобе до того, как он попадёт в лабораторию. Анализ вроде бы отрицательный, а на самом деле вирус и болезнь есть. Поэтому нужно быть готовым к тому, что анализ придётся пересдать.
Повторяющиеся боль, зуд, жжение, возникновение пузырьковой сыпи в области половых органов должно насторожить Вас. С этими симптомами нужно обратиться к врачу. На основании данных внешнего осмотра и специфических анализов врач может поставить диагноз «половой герпес».
Опытному врачу для того, чтобы поставить правильный диагноз достаточно одного взгляда на внешний вид высыпаний и оценки характера жалоб больного. Но в ряде случаев могут пройти годы до того момента, когда диагноз «генитальный герпес» будет установлен.
Психологическая реакция на заражение
Герпес на гениталиях приносит страдания больному во время обострения, снижает трудоспособность, изменяет психологическое и эмоциональное состояние. После осознания и принятия диагноза некоторые больные замыкаются в себе, их гнетёт одиночество, страх быть исключёнными из сексуальной жизни. Они испытывают гнев по отношению к заразившему их партнёру и негативное отношение к себе. До 50% людей, страдающих генитальным герпесом, впадают в депрессию, до 53% — испытывают одиночество, до 10% посещают суицидальные мысли.
Они испытывает чувство горя, считают, что иметь такое заболевание позорно. При этом страдалец проходит три стадии принятия болезни, описанные ещё в прошлом веке психиатром, профессором Чикагского университета Элизабет Кублер-Росс (Elisabeth Kubler-Ross).
Первая стадия — стадия отрицания. Эта стадия может длиться от нескольких секунд до нескольких недель. Она связана с эмоциональной растерянностью больного. Заболевший человек думает: «Этого не может быть».
Вторая стадия — стадия борьбы — фаза поиска и отчаяния. Она наиболее тяжела для пациента и длится от 3х недель до 2-3х месяцев. В отдельных случаях может затягиваться на годы. Человек говорит: «я найду средство или метод, который поможет перебороть болезнь. Победа будет за мной!» Он или она в эту фазу обращается к врачу, ищет лекарство, которое поможет. Во время этой фазы появляется чувство вины и стыд, пациент склонен к самообвинению: «какая я была дура, что переспала с ним», Злость может быть направлена на врача, общество, семью и даже себя. Столкнувшись с тем, что генитальный герпес — пожизненное заболевание, отдельные пациенты начинают обвинять врачей в выколачивании денег, а фармацевтические компании в сговоре с целью саботажа изобретения лекарства, полностью излечивающего герпес.
Тревога за будущее и страх потери здоровья пробуждает в человеке внутреннюю агрессию. Зачастую, когда человек не может определить виновного в своих неприятностях, агрессия пере адресуется на более слабых и безответных окружающих или предметы интерьера (битьё посуды).
В это время начинается переход к следующей стадии — примирению с мыслью о болезни. Человек начинает рационально осмысливать произошедшее: «Почему заразился именно я?», «В наказание или для испытания мне дан генитальный герпес». На данном этапе возможно обращение к Богу, к окультным ритуалам и т.п.
Без лечения вирус разрушает жизнь пациентов. Следует отдавать отчёт, что герпес гениталий облегчает заражение ВИЧем и может провоцировать переход ВИЧ в СПИД.
Образ жизни людей с генитальным герпесом
Генитальный герпес в большинстве случаев влечёт за собой изменение образа жизни. Риск передать при сексуальных контактах болезнь здоровым людям, заставляет пациентов отказываться от случайных связей.
Рецидивы — расплата за наш неправильный образ жизни: малую подвижность, курение, излишнюю страсть к алкоголю.
Один из главных страхов герпетических больных — страх возникновения рецидива, очень часто подсознательный. Ожидание повторного возникновения болевых ощущений обостряет чувство страха. Страх вызывает повышенное выделение ряда гормонов, угнетающих иммунную систему, что приводит к новому рецидиву.
Повод для беспокойства — страх заразить партнера. Больные половым герпесом стоят между двух огней: с одной стороны совесть требует раскрыть душу близкому человеку, с другой — страх быть отвергнутым и брошенным останавливает нас.
Что же делать?…Кроме того, что во время рецидива, как бы ни хотелось, нельзя вступать с партнером в половые контакты даже с использованием презерватива и обязательно нужно рассказать! Конечно, это трудное решение, но в итоге к нему нужно прийти. Подумайте сами, кто мы такие и имеем ли право определять судьбу другого человека. Затем следует Нарушение половой функции: ослабление эрекции, отсутствие оргазма и желания половой близости как у мужчин, так и у женщин. Формируется условный рефлекс:возбуждение=>контакт=>боль=>нарушение половой функции.
ФАКТ! Так было раньше!
Препараты снижают иммунитет.
Используя противовирусные препараты, больные только подавляют остроту рецидивов. Эти препараты не предупреждают рецидивы, и больные были обречены страдать всю оставшуюся жизнь.
Ученые и медики всего мира заявляли, что лечение герпесвирусных инфекций – «глобальная проблема человечества, требующая поиска эффективных средств лечения». При современном лечении противовирусными препаратами (ацикловир, валцикловир и др.) вирус подавляется только во время обострения (рецидива) болезни. Но эти препараты губительно действуют на иммунитет, снижая его еще больше, у вируса быстро возникает привыкание к ним и болезнь бумерангом возвращается, причем с каждым разом чаще и тяжелее.
Уже 15 лет в РФ существует эффективный метод лечения этого тяжелого заболевания — прививка от герпеса (метод иммунопрофилактики)!
С появлением антигерпетической вакцины ситуация радикально изменилась. Вакцина Витагерпавак восстанавливает собственный противовирусный иммунитет и вирус может быть подавлен на всегда.
Результаты лечения вакциной «Витагерпавак» оказались высокими (более 86%): многие забыли о том, что они болеют (63%), другие вспоминают редко (23%), так как болезнь после вакцинации протекает в легкой форме (высыпания на 1 – 3 дня вялые и сами проходят).
Это оказалось прорывом в лечении герпеса!
При генитальном герпесе восстанавливается нормальная личная жизнь, прекращаются страдания людей, появляется возможность иметь здоровых детей.
Кроме того, вакцина «Витагерпавак» восстанавливает собственный иммунитет человека. Активируется клеточный иммунитет: усиливается активность лейкоцитов и лимфоцитов, тем самым подавляется вирус и в большинстве случаев (более 86%) – навсегда. Уже при первой вакцинации «Витагерпавак» дает значительный иммунокоррегирующий эффект, снижая степень иммунных расстройств с 3-й и 2-й до 1-й степени. Через 6 месяцев после вакцинации иммунные расстройства соответствуют 0 –1-й степени. Лечение вакциной формирует длительный клеточный иммунитет, снижает количество рецидивов и уменьшает их длительность. Но самое главное – иммунизация приводит к укреплению здоровья!
«Русский метод»
Исследования вакцины проводились в авторитетных медицинских учреждениях (более 3 000 исследуемых), что позволило в 2010 году Минздраву РФ издать методические рекомендации по лечению герпесвирусных инфекций методом иммунопрофилактики вакциной «Витагерпавак» (МР 3.3.1.0002-10). На Западе наш метод иммунопрофилактики больных с герпетическими инфекциями признан наиболее эффективным и получил название «русского метода лечения».
Нетоксична и безопасна
При выраженной активности вакцины она антиаллергенная, нетоксичная, безопасная. За 15 лет ее использования подтверждено, что она не вызывает выраженных местно-раздражающих или любых других реакций, в том числе токсических и аллергических. Таким образом, проведенные многолетние клинико-вирусологические исследования по разработке и внедрению в практику инактивированной формалином дивакцины против ВПГ-1 и ВПГ-2 показали её выраженную активность в профилактики рецидивов ХГИ, обусловленную активацией реакция клеточного иммунитета и специфической десенсибилизацией.
Более 20 лет назад — в 1993 году — в Российской Федерации была введена обязательная регистрация случаев генитального герпеса. Тем не менее гиподиагностика этого заболевания до сих пор остаётся актуальной практической проблемой, и таким же образом дело обстоит не только у нас, но и в странах ближнего зарубежья.
Просто сравним цифры: в США заболеваемость составляет 200 случаев на 100 тыс. жителей в год. В Западной Европе поменьше — в среднем 80 на 100 тыс. населения. И это в целом вполне можно принять на веру. Но можно ли поверить официальной статистике Украины — 15 случаев на 100 тыс. — или России — 21,7 случаев (данные 2005 года) 7,9,10 ? А недооценка этого заболевания опасна, особенно в акушерстве, поскольку неонатальный герпес способен уносить жизни до 80% инфицированных новорождённых, оставляя выживших инвалидами с нарушением работы центральной нервной системы 5 .
Если рассматривать заболеваемость герпесом на карте мира, то сразу видны два правдоподобных полюса. Место наивысшего накала — конечно, Африка: до 80% взрослых женщин и до 50% мужчин серопозитивны по ВПГ-2. Кстати, независимо от географии, наиболее высокие показатели инфицированности ВПГ-2 отмечены у ВИЧ-позитивных лиц, что отражает как проблемность социального поведения этой группы населения, так и взаимопотенцирующее действие обеих инфекций 7 . Не менее высока доля серопозитивных лиц среди пациентов клиник, специализирующихся на лечении и профилактике заболеваний, передаваемых половым путём, — до 86%8. Самый спокойный на карте уголок — Испания, в которой серопозитивны 4% женского и 3% мужского населения соответственно. Если взять эту страну за эталон, то наиболее близки к нему Италия и Великобритания со своими одинаковыми показателями — 7 и 5% женского и мужского населения. В среднем же в Западной Европе показатель серопозитивности держится на уровне 16,5%.
По данным ВОЗовской глобальной оценки распространённости (общее количество случаев) и заболеваемости (число новых случаев) ВПГ-2, в мире инфицированы более чем полмиллиарда людей, и каждый год к ним прибавляются ещё по 24 млн 5 . Существует мнение, что в развитых странах генитальным герпесом может страдать 10–20% взрослого населения 7 . В многочисленных популяционных исследованиях показано, что уровень заболеваемости генитальным герпесом повышается с возрастом: единичные случаи выявляют в возрасте до 14 лет, а самая высокая заболеваемость — у 20–29-летних. Второй пик приходится на 35–40 лет. Основными факторами риска генитального герпеса выступают большое количество половых партнёров на протяжении жизни, раннее начало половой жизни, мужской гомосексуализм, принадлежность к негроидной расе, женский пол (!) и наличие в анамнезе инфекций, передаваемых половым путём 2,7,8 .
Что же касается России, то эпидемиология генитального герпеса у нас изучена явно недостаточно. Известно, что доля серопозитивных людей в популяции увеличивается с возрастом: от 1% у подростков 14–17 лет до 19–38% в возрасте 55–64 года. Более точных достоверных цифр, которые можно было бы сравнить с зарубежными, за последние 10–15 лет найти не удаётся 32 . При этом регистрируемая заболеваемость (чуть менее 22 на 100 тыс.) сравнительно с развитыми странами подозрительно низка.
Вероятно, мы наблюдаем недорегистрацию, и причины этого явления довольно легко обозначить. Первая — низкая обращаемость вследствие недостатка информированности населения. Часть больных с такой симптоматикой, как зуд, жжение или выделения из половых путей не считают её достаточным поводом, чтобы обращаться к врачу, а значит, не получают лечения, не заботятся о предохранении и длительное время выступают резервуаром генитального герпеса в популяции. Вторая причина — частные клиники, не всегда добросовестно подающие сведения в органы регистрирующие инстанции.
И всё же к какому «полюсу» наша страна действительно более близка — к Испании или к Африке? Истинную распространённость инфекции в Сибири взялась определить команда профессионалов-энтузиастов, осуществив одно из тех многолетних эпидемиологических исследований, который в России сегодняшнего дня — действительно большая редкость.
Штрихи к портрету
ДНК-содержащие вирусы семейства Herpesviridae персисти-руют в организме хозяина пожизненно — генетический материал вируса встраивается в ДНК нервных клеток человека: ВПГ-1 обычно осваивает ганглии тройничного нерва, ВПГ-2 — тазовые ганглии (а также клетки слизистых оболочек половых путей, например цервикального эпителия). Это едва ли не самые распространённые в популяции патогенные микро-организмы 1–3 . Сегодня известны восемь типов герпесвирусов, однако орофациальные и генитальные поражения вызывают только два типа: ВПГ-1 (преимущественно лабиальный герпес) и более опасный последствиями ВПГ-2 4,7 . Передача ВПГ-2, как правило, происходит половым путём, но возможен и вертикальный путь передачи — от матери ребёнку во время родов.
У 70–80% больных генитальным герпесом заболевание вызвано ВПГ-2, а у остальных 20–30% — ВПГ-1. Однако в последние годы ВПГ-1 в мочеполовом тракте выявляют всё чаще 6 . Скорее всего, происходит это по двум причинам: во-первых, в социуме всё большее распространение получают орогенитальные контакты, а во-вторых (и эта причина гораздо прозаичнее), с внедрением высокоточных методов диагностики вирусные инфекции стали лучше выявлять.
Инфицирование ВПГ-1, как правило, не препятствует заражению человека ВПГ-2, однако вследствие чрезвычайно высокой гомологии вирусных геномов, а значит, и кодируемых ими белков-антигенов, бoльшая часть антител у инфицированных лиц перекрёстно реагирует как с первым, так и со вторым типом ВПГ 7 , что серьёзно затрудняет приживаемость вируса, поступившего на уже «занятый» плацдарм.
Небезопасный спутник
У большинства заражённых ВПГ-2 не вызывает никакой симптоматики — лишь 10–20% серопозитивных лиц сообщают о «перенесённом когда-то» генитальном герпесе. Как раз в этом вирус проявляет своё коварство, поскольку бессимптомные носители служат разносчиками инфекции в популяции. При наличии типичных проявлений больные жалуются на болезненные пузырьки в области половых органов, однако возможна и атипичная симптоматика — эрозивно-язвенные поражения, локализация на бёдрах, ягодицах, в перианальной области и др. Эти неприятные проявления способны снижать качество жизни пациентов, иногда значительно. Однако на сугубо симптоматическом аспекте вредоносность генитального герпеса не заканчивается.
Как и всякое заболевание, передаваемое половым путём, генитальный герпес нередко становится виновником психологических и психосексуальных расстройств. И этот аспект инфектологии изучен ещё далеко недостаточно. В частности, многие проведённые в этом направлении исследования, к сожалению, используют ограниченную выборку, слишком разнообразные для сравнивания анкеты и отчётности, отсутствуют контрольные группы, не ведётся учёт уже существующих до инфицирования психопатологических отклонений. Так, хотя было показано, что рецидивы генитального герпеса и стресс часто совпадают по времени, не удаётся установить, что же из них первично — данные ретроспективных и проспективных исследований расходятся.
Тем не менее есть причины утверждать, что у страдающих рецидивами генитального герпеса нередко возникают депрессии; у них снижена уверенность в себе, они испытывают подавленность, гнев и враждебные чувства по отношению к человеку, который, как они полагают, их заразил 11,12,17 .
В исследовании белорусских коллег были использованы анкеты-опросники DIQL (Дерматологический индекс качества жизни) и RGHQoL (Опросник качества жизни пациентов с рецидивирующим генитальным герпесом), и оказалось, что качество жизни пациентов с рецидивирующим генитальным герпесом средней степени тяжести значительно снижено и не превышает 30% нормы 36 .
В числе отрицательных следствий генитального герпеса значится также и влияние на половую потенцию — доказано, что ВПГ-инфицированные мужчины достоверно чаще обращаются к врачу по поводу эректильной дисфункции 18 .
Существуют сведения, что ВПГ, присутствующий в организме и поражающий органы и ткани каких угодно локализаций, затрудняет элиминацию папилломавируса человека. Более того — сочетание «ВПЧ+ВПГ-2» даже в отсутствие симптоматики герпеса, по данным одного из крупных исследований, увеличивало риск CIN в 34 раза, а карциномы шейки матки — в 61 раз в сравнении с контрольной группой здоровых женщин 33 *.
* См. статью О.С. Крыштопиной и соавт. «Сочетанное ви-русоносительство и элиминация ВПЧ» (StatusPraesens. 2013. №5 [6]. С. 38–42).
При беременности и потом
В ряде европейских стран по ВПГ-2 серопозитивны от 10 до 40% беременных. В России этот показатель достигает 31%. У беременных ВПГ-2 опасен не только везикулярными высыпаниями и нарушением психологического равновесия — описаны случаи гораздо более серьёзных осложнений: острого гепатита с тромбоцитопенией и коагулопатией 21 , эндометрита, диссеминированной инфекции 23 . И хотя частота таких осложнений невелика, о потенциальной возможности подобных состояний врачу следует помнить. Любое необъяснимое осложнение во время беременности должно быть рассмотрено в том числе и с точки зрения вероятности герпетической атаки.
Однако наиболее серьёзную опасность ВПГ представляет для плода ввиду несформированности его иммунной системы. Риск передачи инфекции плоду максимален в III триместре; при этом в 80% случаев инфицирование происходит интранатально, в 15% — постнатально и в 5% — антенатально 31 . К счастью, частота неонатального герпеса относительно невелика. В США, где учёт проводят очень скрупулёзно, статистика приводит показатель заболеваемости неонатальным герпесом 3,3 на 100 тыс. новорождённых 28 , для контраста в Малави (Восточная Африка) заболеваемость в 22 раза выше — 72 на 100 тыс. 29 . А вот что касается России, то достоверных и свежих данных по количеству заболевших новорождённых найти не удалось; публикации на эту тему, представленные в интернете, не отличаются высокой достоверностью и весьма противоречивы. По крайней мере, в 1995 году этот показатель держался на уровне 14,1 на 100 тыс. 30 . Получается, мы где-то посередине, но где именно — установить не так-то просто. А между тем осложнения неонатального герпеса разнообразны и часто фатальны (летальность может достигать 80%). Перенесённый неонатальный герпес нередко выливается в инвалидность.
- Невезикулярные поражения гортани и гениталий плода 23 .
- Водянка плода и преждевременные роды 20 .
- Эпиглоттит новорождённого с тяжёлой интоксикацией 22 .
- Тяжёлые поражения кожи и центральной нервной системы, гиперлейкоцитоз 25 .
- Сепсис в первые 5 нед 24 .
- Энцефалит, при подостром течении приводящий к мультикистозной энцефалопатии с минерализацией и дефицитом цереброспинальной жидкости 19 .
- Респираторный дистресс-синдром, апноэ, гепатомегалия, гемофагоцитоз, менингит 26 .
- Острый некроз сетчатки глаза 27 .
С сибирской обстоятельностью
Для того факта, что в России сложно получить эпидемиологические данные, есть довольно простое объяснение. Дело в том, что для такого рода исследований необходимо финансирование, которое во всём мире происходит за счёт государственных средств и фондов научных исследовательских центров, что в России пока случается совсем нечасто. Тем ценнее редкие и качественные российские научные работы. Так, в течение многих лет, с 1994 по 2005 год проходило крупное исследование популяций народов Сибири, включая городские и сельское население — в Новосибирске, Республике Горный Алтай и Республике Тыва.
Эта работа была инициирована в рамках международных исследований: WHO MONICA (Мониторинг заболеваемости и смертности от сердечнососудистых заболеваний и уровней их факторов риска) и HAPIEE (Детерминанты сердечно-сосудистых заболеваний в Восточной Европе: мультицентровое когортное исследование). Вот его хронология.
- 1994 год: случайная выборка взрослого населения Новосибирска в возрасте 25–64 лет — 211 человек.
- 1996–1998 годы: в рамках эпидемиологической программы «Изучение здоровья коренных народностей Сибири» обследованы коренные жители сельских регионов Восточной Сибири — Республики Тыва и Республики Горный Алтай (по два посёлка в каждом регионе). Население этих посёлков состоит из представителей монголоидной расы (буряты). Проведено сплошное обследование жителей этих поселков в возрасте 25–64 лет: 100 человек в Тыве и 87 — в Горном Алтае.
- 1999 год: получены 104 образца сыворотки крови школьников 14–17 лет из двух случайно выбранных средних школ Новосибирска.
- 2003–2005 годы: случайная выборка взрослого населения Новосибирска в возрасте 25–64 лет — 512 человек.
В общей сложности были проанализированы образцы сыворотки крови 1014 жителей; 47,4% составили мужчины и 52,6% — женщины. Протокол исследования одобрен Этическим комитетом НИИ терапии Сибирского отделения РАМН. Все обследованные подписали информированное согласие для участия в исследовании.
Сыворотку крови получали путём центрифугирования, транспортировали пробы при температуре –20 °С, хранили в морозильной камере при от –30 до –70 °С до момента тестирования без промежуточного размораживания. В полученных образцах сывороток крови при помощи иммуноферментного анализа определяли IgG к ВПГ-1 и ВПГ-2 (тест-системы «ВектоВПГ–IgG», «Век-тоВПГ-2–IgG»). Иммуноферментный анализ проводили согласно инструкциям к наборам.
Обсуждаем и сравниваем
Общая распространённость антител к ВПГ-1 у взрослых не различалась между обследованными популяциями и в целом составила 99,4%. Таким образом, инфицированы этим вирусом почти все взрослые жители обследованных регионов. Среди школьников 14–17 лет антитела выявляли гораздо реже — серопозитивными оказались 78,8% подростков (рРаспространённость антител к ВПГ-2 у взрослого населения Новосибирска в целом за 1994–2005 года составила 21,1%, будучи выше у женщин по сравнению с мужчинами (26,3 и 17% соответственно; p13. Не исключено, что достаточно низкая инфицированность сибирских подростков связана с тем, что в этом регионе очень распространён ВПГ-1, в результате чего возникает перекрёстный иммунитет заодно и к ВПГ-2 5 . Как и ожидали исследователи, общая частота выявления антител к ВПГ-2 возрастала пропорционально возрасту (см. инфографику).
Что касается Тывы и Горного Алтая, то распространённость антител к ВПГ-2 у коренного населения в целом составила 20,2%. Однако женщины были инфицированы достоверно чаще мужчин — 23,5 и 7,9% соответственно (p=0,03). В целом Западная и Восточная Сибирь не различались по частоте выявления антител к ВПГ-2, а значит, этот показатель не зависит от этнической принадлежности (европеоиды и монголоиды), а также уровня урбанизации (промышленный мегаполис или посёлок) — распространение инфекции в Сибири универсально. А вот в США данные контрастны: неевропеиоидное население инфицируется ВПГ-2 почти в 3 раза чаще (45,9%), чем европеоидное (17,6%) 14 .
Если сравнивать распространённость ВПГ-2 в Сибири с другими регионами мира, то получается, что показатели наиболее близки к США и Скандинавским странам, и до благополучной Испании нам ещё далеко. С другой стороны, не может не радовать, что лидируем по частоте серопозитивности всё-таки не мы, а Африка.
В разных популяциях Сибири женщины ожидаемо оказались в 1,5–3 раза чаще инфицированы ВПГ-2, чем мужчины. Сходные данные отмечают практически во всех исследованиях мира. Дело в том, что поверхность слизистой оболочки половых органов у женщин значительно обширнее по площади, что повышает вероятность инокуляции вируса. Кроме того, у мужчин чаще возникают рецидивы, при которых клинические проявления менее выражены. А значит, мужчины смело вступают в половые контакты и заражают партнёрш в наиболее контагиозный период. Не исключено также, что молодые женщины чаще имеют контакты с более взрослыми партнёрами, частота инфицирования которых выше, чем у молодых. И, наконец, вероятность передачи вируса от мужчины женщине шестикратно превышает риск заражения мужчины от женщины 7 . При этом женщины в возрасте от 18 до 39 лет составляют группу риска, у них заболеваемость генитальным герпесом достигает 136 на 100 тыс. населения данного пола и возраста 9,10 .
Она растёт
Эпидемиологические исследования — не только показатель интереса интеллектуального сообщества к тому или иному вопросу. Врачу на приёме, через кабинет которого ежедневно проходят примерно 30 женщин, следует чётко представлять, что почти все они, за казуистическим исключением, носительницы ВПГ-1, и каждая пятая рискует обострением ВПГ-2.
Такая настороженность — очевидный путь преодоления гиподиагностики генитального герпеса, а значит, и всех сопутствующих ему проблем.
Вирус герпеса третьего типа varicella zoster (VZV) вызывает два клинически обособленных заболевания - ветряную оспу и опоясывающий герпес (Баринский И.Ф. и др., 1986; Haanpaa M., 2001). Оба заболевания, прежде всего, характеризуются везикулярной сыпью. Первичная инфекция манифестирует в форме ветряной оспы (ветрянки), а реактивация латентного VZV обусловливает появление локализованных высыпаний - опоясывающего лишая (Хахалин Н.Н., 2002). Мысль о связи между ветрянкой оспой и опоясывающим лишаем впервые была высказана в 1888 венским врачом Яношом Бокеем (von Bokay J., 1909).
Эпизод ветряной оспы в детстве способствует формированию специфической клеточной и гуморальной иммунной защиты. Считается, что рецидив инфекции у таких пациентов может развиться только на фоне недостаточности иммунной защиты, вследствие снижения активности специфических натуральных киллеров, Т-киллеров и системы интерферонов (Fleming D.M. et al., 2004). После первичной инфекции излюбленным местом персистенции VZV являются ганглий тройничного нерва и спинномозговые ганглии чувствительных корешков грудного отдела спинного мозга, где VZV находится в латентном состоянии. В течение этого времени вирус не размножается и не проявляет патогенных свойств. По-видимому, время латентного состояния вируса определяется уровнем специфических антител к VZV. Снижение их количества ведет к реактивации вируса, вирусной репликации (размножению), что на клиническом уровне и проявляется в виде опоясывающего лишая (Arvin A., 2005). Данный вывод подтверждается высокой корреляцией между вероятностью возникновения опоясывающего лишая у людей пожилого возраста и возрастным ослаблением активности клеточного звена иммунитета (Gilden et al., 2000)., На это также указывают данные, свидетельствующие о более высокой заболеваемости опоясывающим герпесом среди лиц, инфицированных вирусом иммунодефицита человека (Gilson I.H. et al., 1989), однако точные механизмы, лежащие в основе перехода вируса из латентного состояния в активное неизвестны.
В случае реактивации VZV ганглии чувствительных нервов становятся местами репликации вируса, именно в них обнаруживаются наиболее выраженные дегенеративные повреждения нейронов (Zerboni L. et al., 2005; Reichelt M. et al., 2008). В результате развивается ганглионит, сопровождаемый распространением инфекции вниз по нервным аксонам к коже. Каким образом происходит транспортировка вируса в поврежденных аксонах неизвестно. Инфекция также может распространяться центрально, приводя к воспалению оболочек в области передних и задних рогов спинного мозга (Gray F. et al. 1994). Отдельные патолого-анатомические наблюдения также свидетельствуют о наличии воспалительных изменений и в контралатеральных спинномозговых ганглиях (Miller S. E. et al., 1997), отмечается снижение количества нейронов и наличие воспалительных инфильтратов в ганглиях, периферических нервах, и спинномозговых корешках (Gowrishankar K. et al., 2007). В некоторых случаях отмечается выраженные некротические изменения в спинномозговых ганглиях. Большинство изменений в периферическом нерве протекает по типу Валлериановской дегенерации, имеющей место, как в толстых, так и в тонких волокнах. (Denny-Brown et al., 1944).
Доказано, что повреждение нейрональных структур начинается перед появлением кожной сыпи. При этом VZV по ходу чувствительных нервных волокон проникает в кожу, «ускользая» от факторов врожденного и приобретенного иммунитета, что в конечном итоге обусловливает возникновение односторонней везикулярной кожной сыпи, характерной для опоясывающего лишая.
Острая VZV инфекция клинически характеризуется стадией продрома и стадией везикулярных высыпаний (Arvin A., 2005).
Сыпь обычно локализуется в одном или нескольких смежных дерматомах и сопровождается развитием острой невропатической боли. У 50% больных сыпь встречается на туловище, у 20% - на голове, у 15% - на руках, и у 15% - на ногах (Arani R.B. et al., 2001).
Клинический диагноз опоясывающего лишая в типичных случаях достаточно прост. Однако иногда требуется проведение лабораторной диагностики с целью идентификации вируса. Наиболее быстрым и высокочувствительным методом является полимеразная цепная реакция.
В остром периоде болезни или после него возможно развитие осложнений, захватывающих различные системы организма. Наиболее серьезными считаются неврологические осложнения. В структуре неврологических расстройств ведущее место занимает поражение периферической нервной системы. При данном заболевании воспалительный процесс затрагивает региональные, чувствительные ганглии с развитием ганглиолитов. Наличие у больных корешковых болей, парастезий, сегментарных нарушений чувствительности отмечается практически у каждого больного (Stankus S. et al., 2000; Thyregod H. G. et al., 2007). Болевой синдром имеет выраженную вегетативную окраску в виде жгучих, приступообразных, резких болей, усиливающихся в ночное время. В головном мозге при опоясывающем герпесе могут быть обнаружены явления отека, выраженная диффузная инфильтрация подпаутинного пространства, геморрагии в белом веществе, базальных ганглиях (Sissoko D. et al., 1998). Следует заметить, что осложнения со стороны головного и спинного мозга в настоящее время встречаются редко. В случаях развития VZV-инфекции в области тройничного нерва часто наблюдаются осложнения со стороны глаз - кератит, ирит, ретинит, офтальмит. Ранее, при отсутствии специфической противогерпетической терапии, к частым осложнениям VZV-инфекции относились пневмонии, энцефалиты или гепатиты, иногда приводившие к летальному исходу.
Вместе с тем, из всех перечисленных осложнений VZV инфекции самым распространенным считается постгерпетическая невралгия (Dworkin R.H., Portenoy R.K., 1996).
Различают острую герпетическую невралгию (в течение 30 дней после начала заболевания) и постгерпетическую невралгию (Choo P. et al.,1997). К ПГН относят упорные боли в областях, затронутых герпесной инфекцией после заживления кожи (Dworkin R. et al. 2003). Наиболее хорошо установленными факторами риска для ПГН являются пожилой возраст, большая распространенность высыпаний на коже и выраженная боль перед везикулярной сыпью (Desmond R.A. et al., 2002; Fleming D.M. et al., 2004). Все эти факторы находятся во взаимосвязи, поэтому пациенты 50 лет и старше в большинстве случаев испытывают тяжелую, нестерпимую боль и значительные кожные высыпания, что гораздо чаще приводит к развитию ПГН. У пациентов со всеми этими факторами риск развития ПГН превышает 50-75 % (Gnann J., Whitley R. 2002; Jung B.F., 2004). Постгерпетическая невралгия может развиться в любом возрасте, однако для нее характерна прямая корреляция частоты встречаемости и длительности ПГН с возрастом. Более 50% всех пациентов с ПГН - старше 60 лет, 75% больных с указанной патологией приходится на возрастную группу старше 75 лет (Nurmikko T.J., 2001). Половина всех пациентов с ПГН старше 60 лет испытывает постоянную боль более 6 месяцев, в то время как в возрастной группе 30-50 лет ПГН более 6 месяцевь наблюдается у 10% больных (Whitley R. et al. 1996). В США ежегодно регистрируется 100-200 тыс. новых случаев ПГН (Nurmikko T.J., 2001). Однако, истинная распространенность ПГН не известна, не только потому, что эпидемиологические данные недостаточны, но также из-за отсутствия конценсусса по определению ПГН. Некоторые авторы относят к ПГН боли, возникающие в любой период герпесной инфекции, другие считают, что ПГН - это боль, сохраняющаяся спустя 3 месяца после заживления кожи. В первом случае определения ПГН ее распространенность составляет 8%, во втором - 4,5% (Choo P. et al. 1997). Постоянную боль в течение 1 мес после сыпи испытывают до 15% пациентов и около 4% пациентов от общего количества перенесших опоясывающий лишай отмечают сохранение боли в течение года (Lancaster T. et al. 1995).
Классическое проспективное исследование, проведенное Hope-Simpson (1975), продемонстрировало, что из 321 пациента с опоясывающим лишаем 10 % имеют выраженную боль спустя 3 месяца после острой герпетической инфекции, а 4 % - и через 12 месяцев. Подобные результаты были получены и в других проспективных исследованиях (Helgason S. et al. 1996; 2000; Scott F.T. et al., 2006), в которых также было показано, что наибольший риск пролонгации болевого синдрома после перенесенного опоясывающего лишая имеют пациенты в возрасте около 60 лет.
Постгерпетическая невралгия занимает третье место по частоте встречаемости среди различных типов невропатической боли и уступает только болям в нижней части спины и диабетической невропатии (Montero H.J. et al., 2005; Breivik H. et al, 2006; Torrance N. et al., 2006).
Локализация болевого синдрома практически всегда соответствует зоне кожных высыпаний. Интенсивность болевого синдрома как правило высокая. Кроме глубоких ноющих и стреляющих болей очень характерны поверхностные жгучие боли и наличие стимулозависимых болей - динамической гипералгезии и аллодинии (Baron R., 2004).
При клиническом осмотре в зоне болей выявляются нарушения поверхностной чувствительности. Качество боли в острый период опоясывающего лишая и при ПГН различно. Вместе с тем, несмотря на разный выбор дескрипторов из МакГилловского болевого вопросника, пациенты с опоясывающим лишаем и ПГН для описания своих болевых ощущений выбирают похожие по смыслу слова, например, горячая и жгучая боль или пронзающая и простреливающая боль (Bennett M., 2001).
Схожие проявления наблюдаются и при описании вызванной боли пациентами с опоясывающим лишаем и ПГН. И те, и другие отмечают наличие схожих типов гипералгезии и аллодинии (Haanpaa M. et al., 2000; Berry J.D., Rowbotham M.C., 2004).
У большинства пациентов боль, связанная с ПГН, уменьшается в течение первого года. Однако у части больных она может сохраняться годами и даже в течение всей оставшейся жизни, причиняя немалые страдания (Cunningham A.L., Dworkin R.H., 2000). Затяжной, тяжелый характер заболевания с длительным, выраженным болевым синдромом способствует формированию расстройств психики (Dworkin R.H., et al., 1992). У таких пациентов выявляются тревожно-депрессивные расстройства, когнитивные нарушения - снижение активного внимания, памяти, затруднения осмысления происходящего, отмечается некритичность, нетерпеливость, неряшливость, страх боли, неуверенность в завтрашнем дне, отмечается снижение социальной активности (Haythornthwaite J.A. et al., 2003). ПГН оказывает значительное отрицательное влияние на качество жизни и функциональный статус пациентов особенно пожилого возраста (Lydick E. et al., 1995). У пациентов с ПГН отмечается хроническая усталость, снижение массы тела, физической активности, нарушения сна (Morin C.M., Gibson D., Wade J., 1998).
В основе боли, связанной с ПГН, лежат воспалительные изменения или повреждения ганглиев задних корешков спинного мозга и периферических нервов в пораженных зонах тела. Такие боли относят к невропатическим болям, их выделяют в отдельную самостоятельную группу и определяют как боли, возникающие вследствие первичного повреждения соматосенсорной нервной системы (Treede R.D. et al., 2008).
Патофизиологической основой невропатических болевых синдромов являются нарушения генерации и проведения ноцицептивного сигнала в нервных волокнах, а также механизмов контроля возбудимости ноцицептивных нейронов в структурах спинного и головного мозга (Кукушкин М.Л., Хитров Н.К., 2004; Baron R. 2000).
Лечебная тактика при опоясывающем лишае включает два основных направления: противовирусная терапия и купирование невропатической боли, как в острый период заболевания, так и в стадии постгерпетической невралгии. Результаты нескольких рандомизированных контролируемых испытаний свидетельствуют о том, что раннее начало лечения простого герпеса может предотвратить развитие постгерпетической невралгии или способствовать ее скорейшему разрешению (Исаков В.А. и др., 2004; Helgason S. et al., 1996; Jackson J.L. et al., 1997 ; Volmink J. et al., 1996).
Наиболее широкое применение нашли такие специфические противогерпетические препараты, как ацикловир, фамцикловир и валацикловир, которые, являясь нуклеозидными аналогами, блокируют вирусную репликацию (Романцев М.Г., 1996; Beutner K. et al., 1995; Bruxelle J., 1995). Важно, что противовирусное лечение проявляет наивысшую активность, если назначено в течение 72 ч от начала герпетических высыпаний (Johnson R., 2001; Johnson R., Dworkin R.H., 2003). В ряде исследований доказана высокая эффективность ацикловира в уменьшении тяжести, продолжительности острой герпесной инфекции и профилактике ПГН, особенно при его раннем назначении. Оценка эффективности фамцикловира также продемонстрировала уменьшение времени до разрешения сыпи (Dworkin R.H. et al., 1998). В сравнительном исследовании ацикловира и валацикловира показана эквивалентная эффективность в сокращении продолжительности невропатической ПГН (Beutner K. et al. 1995). В другом клиническом испытании установлена терапевтическая эквивалентность фамцикловира и валацикловира для неосложненного герпеса (Tyring S. et al. 2000). Возможно также сочетанное использование противовирусной терапии и глюкокортикостероидов (Whitley R. et al. 1999). Выявлено, что такая комбинация эффективнее монотерапии противовирусными препаратами, особенно для лечения острой боли и коррекции различных аспектов качества жизни пациентов. Комбинация ацикловир+преднизолон значительно быстрее купирует острую невралгию и возвращает пациента к обычной жизнедеятельности, но существенно не влияет на течение ПГН, то есть она наиболее показана в остром периоде в старших возрастных группах для терапии острого болевого синдрома. Доказано, что хотя преднизолон является иммуносупрессором, его использование не увеличивает частоты развития ПГН и в этом смысле его действие сравнимо с влиянием плацебо, то есть данная комбинация может быть спокойно использована в старших возрастных группах. Для некупируемых тяжелых случаев ПГН некоторые исследователи рекомендуют интратекальное введение метилпреднизолона (Kost R., Straus S., 1996).
В настоящее время в США делается акцент на профилактику герпетической инфекции. С 1995 г. в США проводится всеобщая вакцинация от ветряной оспы, особенно пожилых лиц, и с 1999 г. отмечается резкое снижение заболеваемости (Hambleton S., Gershon A., 2005; Oxman M.N. et al., 2005).
При постгерпетической невралгии препаратами с доказанной эффективностью (класс А - терапия первой линии) являются: пластины с 5% лидокаином, габапентин, прегабалин, трициклические антидепрессанты, трамадол (Attal et al., 2006).
На сегодняшний день эффективность применения пластин с 5% лидокаином (Версатис, Grunenthal Gmbh) убедительно доказана при лечении ПГН. Так, в нескольких рандомизированных клинических исследованиях установлено, что применение пластин с 5% лидокаином статистически достоверно более значимо облегчает проявления болевого синдрома у пациентов с постгерпетической невралгией по сравнению с плацебо (Rowbotham M.C., 1996; Galer B.S., 1999, 2002). На основании полученных данных FDA одобрило применение данного препарата в качестве стартовой терапии у пациентов с постгерпетической невралгией. (Richard L. et al., 2004)
Версатис - это топический анальгетик, который действует непосредственно там, где болит. Он выпускается в виде мягких пластин размером 10х14 см, которые наклеиваются на неповрежденную кожу без признаков воспаления. Медленно высвобождающийся из пластины лидокаин создает более или менее значительную концентрацию лишь в поверхностных слоях кожи, где проходят тонкие волокна, обеспечивающие болевую и температурную чувствительность (Gammaitoni AR, Davis MW. 2002.). Лидокаин лишь в незначительной степени проникает в более глубокие слои кожи, где проходят кровеносные сосуды, поэтому его попадание в системный кровоток сведено к минимуму. У пациентов, использовавших пластины Версатис, не наблюдалось никаких известных системных эффектов лидокаина (влияние на деятельность ЦНС и сердечно-сосудистой системы). Таким образом, важнейшим преимуществом пластин Версатис служит отсутствие системного действия, что гарантирует безопасность лечения. Практически полное отсутствие системного эффекта позволяет назначать Версатис совместно с любыми другими препаратами для лечения нейропатической боли.
Механизм лечебного эффекта препарата Версатис не ограничивается только действием высвобождающегося из них лидокаина. Важное значение имеет также то, что пластина выполняет роль механического барьера, препятствуя раздражению участка кожи с измененной чувствительностью (аллодиния), а также оказывает не него легкое охлаждающее действие (Galer BS, Gammaitoni AR, Oleka N et al., 2004)
Пластины Версатис рекомендуется прикреплять на 12 ч в течение суток, затем следует 12-часовой перерыв. Обезболивающий эффект часто начинается в течение 30 мин после прикрепления пластины, но может проявляться и позже, нарастает в течение 4 ч и затем поддерживается в течение длительного времени, пока пластина прикреплена к коже. Более того, он может сохраняться и после ее удаления.
Для объективной оценки эффективности каждого из препаратов при лечении ПГН используется показатель NNT (number needed to treat - количество больных, которых нужно пролечить, чтобы получить у одного 50% снижение боли). Чем ниже NNT, тем более эффективен препарат при данной патологии. NNT для пластин с 5% лидокаином при лечении пациентов с ПГН составляет 2,0; для амитриптилина - 2,6; габапентина - 4,4; прегабалина - 4,6 (Wu C.L., Raja S.N., 2008); для трамадола - 3,9 (Kalso E., 2006).
Кроме того, в клинической практике очень важен показатель NNH (number needed to harm - число пациентов, которых необходимо пролечить данным препаратом, чтобы получить развитие 1 случая неблагоприятной побочной реакции, приводящей к отмене препарата). Он показывает, насколько безопасен данный препарат при его использовании. Величина NNH для трамадола, рассчитанная по результатам нескольких клинических исследований, составила 9.0, для ТЦА 14.7, для габапентина 26.1. Рассчитать показатель NNH для пластин с 5% лидокаином не представляется возможным в связи благоприятным профилем безопасности препарата, сравнимым с плацебо.
Таким образом, оценка препарата Версатис с позиций доказательной медицины делает его препаратом выбора при лечении постгерпетической невралгии, что подтверждено в соответствующих рекомендациях.
СПИСОК ЛИТЕРАТУРЫ
Читайте также:

