Кишечная метаплазия покровно ямочного эпителия что это такое
Обновлено: 24.04.2024
Рак желудка представляет серьезную медицинскую и социальную проблему как для большинства стран мира, так и для России. Пациенты с хроническим атрофическим гастритом или кишечной метаплазией имеют повышенный риск развития аденокарциномы желудка. В обзоре о
Modern strategy of patient management in pre-cancer stomach diseases: diagnostic approaches and therapeutic possibilities L. B. Lazebnik, E. A. Lyalyukova
Stomach cancer represents a serious medical and social problem, both for most of the countries, and for Russia. Patients with chronic atrophic gastritis or intestinal metaplasia have increased risk of stomach adenocarcinoma development. This review summarizes the available international guidelines of patient management in atrophic gastritis, intestinal metaplasia and stomach dysplasia.
Несмотря на успехи в области диагностики и лечения, рак желудка остается серьезной проблемой в мировом масштабе, занимая пятое место по уровню заболеваемости и третье — в структуре смертности от онкологических заболеваний [1–2]. Самые высокие показатели отмечаются в странах Восточной и Центральной Азии, Латинской Америки, самые низкие — в Северной Америке. В Восточной Азии заболеваемость раком желудка составляет 32,1 на 100 000 у мужчин, 13,2 — у женщин, в Южной Корее — 57,8 и 23,5 на 100 000, в Японии 40,7 и 16,0 на 100 000 для мужчин и женщин соответственно [1–2]. Наименьшая заболеваемость наблюдается в Соединенных Штатах (5,5 на 100 000 у мужчин; 2,8 у женщин) [1]. Россия относится к странам с умеренным риском рака желудка, наряду с Португалией, Сингапуром, Эстонией. В 2018 г. в структуре заболеваемости удельный вес опухолей желудка составил 20,4 на 100 000 населения у мужчин и 8,8 на 100 000 населения у женщин [3]. Улучшение эпидемиологической ситуации по раку желудка наблюдается, как правило, в странах, где разработаны профилактические мероприятия, высокий уровень осведомленности населения и длительное время существуют национальные программы ведения пациентов с предраковыми заболеваниями и скрининга [4].
Целью представленного обзора является обобщение существующих международных рекомендаций по ведению пациентов с атрофическим гастритом, кишечной метаплазией и дисплазией желудка.
В 2012 г. Европейским обществом гастроинтестинальной эндоскопии (ESGE), Европейской группой по изучению Helicobacter pylori и микробиоты (EHMSG), Европейским обществом патологов (ESP) и Португальским обществом гастроинтестинальной эндоскопии (SPED) были разработаны первые международные рекомендации по лечению предраковых состояний и изменений желудка (MAPS). В 2019 г. опубликована обновленная версия рекомендаций под названием MAPS II [4]. Данные рекомендации были представлены на рассмотрение в разных странах.
Рак желудка — злокачественная опухоль, развивающаяся из эпителия слизистой оболочки желудка, которая представлена гетерогенной группой новообразований. Различные формы имеют свои специфические характеристики, знание которых позволит оптимизировать диагностику рака желудка на ранних стадиях. На основе гистологических характеристик рак желудка может быть представлен: кишечным типом (строение опухоли сходно с раком кишки, характерны отчетливые железистые структуры, состоящие из высокодифференцированного цилиндрического эпителия с развитой щеточной каемкой); диффузным типом (опухоль представлена слабо организованными группами или одиночными клетками с большим содержанием муцина (перстневидные клетки), характерен диффузный инфильтративный рост) и смешанным типом (в опухоли присутствуют участки и кишечного, и диффузного типа) [5]. Дифференцированный тип чаще встречается у пожилых мужчин и развивается медленно, тогда как диффузный тип чаще встречается у женщин более молодого возраста и имеет худший прогноз [5].
Обзор представленных рекомендаций не распространяется на наследственный/семейный диффузный рак желудка, для которого разработаны специальные рекомендации [6].
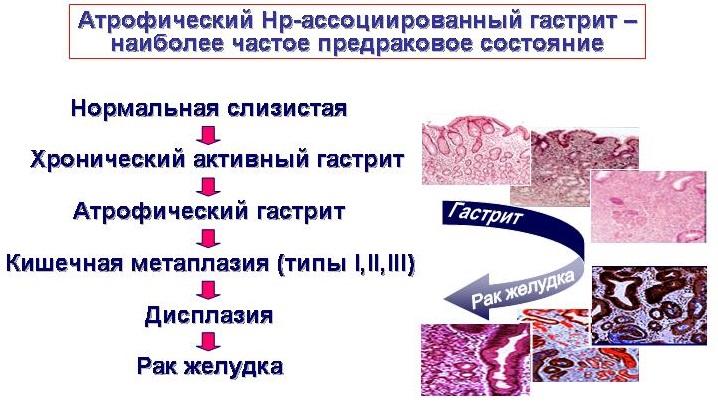
Аденокарцинома желудка кишечного типа представляет собой окончательный исход последовательности «воспаление — атрофия — метаплазия — дисплазия — карцинома», известной как каскад Корреа [7–11].
Рекомендация 1 (MAPS II).
Хроническое воспаление слизистой оболочки желудка на фоне нерационального питания, злоупотребления алкоголем и приема отдельных групп лекарственных медикаментов, со временем может привести к развитию кишечной метаплазии. Чаще всего заболевание диагностируется у людей средней возрастной группы и пожилых пациентов. Эта патология сопровождается характерными клиническими симптомами и негативно отражается на общем состоянии человека.
Что такое метаплазия
В основе этого заболевания лежит планомерная атрофия эпителия слизистой оболочки желудка, с последующим его замещением на эпителий толстого или тонкого кишечника. Изменённая слизистая оболочка начинает выполнять функции того органа, к которому оно принадлежит по факту. Таким образом, желудок теряет свои функции как орган пищеварения со всеми вытекающими последствиями. Метаплазия относится к редким патологиям пищеварительной системы, при этом не является самостоятельным заболеванием, а возникает только при длительном хроническом повреждении слизистой оболочки органа на фоне воспалительного процесса. Это заболевание несет прямую угрозу не только здоровью, но и жизни человека. Несмотря на это, своевременная диагностика и комплексное лечение дают все шансы на полное выздоровление.
Виды метаплазии
В гастроэнтерологии выделяют такие разновидности кишечной метаплазии или атрофии:
- Толстокишечная (незрелая или неполная). Эта разновидность метаплазии наиболее опасна для человека, так как её появление сопровождается риском злокачественного перерождения.
- Тонкокишечная (зрелая или полная). По сравнению с предыдущим вариантом, эта разновидность метаплазии не сопровождается риском перерождения в онкологию.
Кроме перечисленных двух видов, может развиваться и смешанный вариант кишечной метаплазии слизистой, при котором в желудке обнаруживаются клетки эпителия как толстого, так и тонкого кишечника.
По степени распространённости выделяют такие формы метаплазии:
- Выраженная. Более 20% поверхности стенок желудка содержит клетки эпителия кишечника.
- Умеренная. Площадь поражения желудка составляет не более 20%.
- Слабовыраженная. В данном случае, кишечный эпителий покрывает не более 5% площади желудка.
Существует также классификация данного заболевания по характеру распространения. Выделяют такие разновидности метаплазии:
- Диффузная. Местом локализации патологических изменений является антральный и пилорический отделы желудка. По мере прогрессирования болезни, клетки кишечного эпителия могут обнаруживаться в фундальном отделе органа.
- Очаговая. Эта форма заболевания характеризуется локальным изменением клеточного состава оболочки желудка в антральном и пилорическом отделах. Этот процесс развивается на фоне нарушения механизма естественного обновления клеток, а также при длительном вялотекущем воспалительном процессе.
Абсолютная тонкокишечная метаплазия
Эта форма метаплазии характеризуется появлением клеток эпителия тонкого кишечника по всей площади желудка. Характерным признаком абсолютной тонкокишечной метаплазии является появление клеток Панета. По структуре и функциональным особенностям, желудок полностью напоминает тонкий кишечник. Эта форма метаплазии чаще сопровождается хроническим гастритом.
Частичная толстокишечная метаплазия
Для этой формы заболевания не характерно появление клеток Панета, но при этом наблюдается появление эпителиальных клеток, которые выстилают внутреннюю поверхность толстого кишечника. При толстокишечной метаплазии может нарушаться процесс дифференцирования и созревания клеток, что указывает на высокую вероятность образования злокачественной опухоли.
Причины возникновения
Первопричины развития данного состояния до конца не установлены, но существует ряд предрасполагающих факторов, которые могут спровоцировать развитие метаплазии. К таким факторам можно отнести:
- хронический вялотекущий воспалительный процесс в желудке;
- инфицирование желудка бактерией Хеликобактер Пилори; .
Клинические симптомы
Для каждой формы метаплазии характерны свои симптомы, но существует ряд признаков, которые указывают на развитие данного состояния. К таким признакам относят:
- частичная или полная утрата аппетита;
- расстройства кишечника;
- приступы тошноты, эпизоды рвоты;
- боль и дискомфорт в подложенной области;
- повышенная или пониженная кислотность желудочного сока;
- отрыжка с кислым или горьким привкусом.
Диагностика
Наиболее информативным методом диагностики метаплазии является фиброгастродуоденоскопия, с помощью которой удается не только обнаружить патологически измененные очаги на стенках желудка, но и взять образец биоматериала для последующего гистологического анализа. В отдельных случаях применяется методика гастроскопии с использованием контраста (хромогастроскопия). В качестве окрашивающего вещества используется метиленовый синий.
Лечение
Комплексное лечение включает использование безоперационных и хирургических методов. Лечение назначается индивидуально, при этом во внимание берутся такие факторы, как возраст пациента, результаты обследования и наличие сопутствующих заболеваний. Медикаментозное лечение может включать прием таких групп лекарственных медикаментов:
- ингибиторы протонной помпы;
- антибактериальные средства широкого спектра действия;
- обволакивающие средства;
- антациды;
- блокаторы Н2 гистаминовых рецепторов.
При кишечной метаплазии желудка очень важно позаботиться о нормализации микрофлоры, так как при нарушении баланса микроорганизмов в желудке и кишечнике страдает не только иммунитет, но и подрывается здоровье всего ЖКТ. Свою эффективность в восстановлении кишечной и желудочной микрофлоры доказал метапребиотик Стимбифид Плюс, содержащий натуральную питательную среду для полезных микроорганизмов, обитающих в просвете ЖКТ. Стимбифид Плюс не только восстанавливает нормальный баланс бактерий при хроническом гастрите, но и ускоряет процесс восстановления эпителия желудка, препятствуя дальнейшему прогрессированию метаплазии.

Поделитесь информацией с друзьями
Обзор современных концепций кишечной метаплазии желудка и рака желудка.
Кишечная метаплазия желудка является предраковым изменением слизистой оболочки желудка и связана с повышенным риском дисплазии и рака. В патогенезе прогрессирования от предраковых состояний к аденокарциноме желудка кишечного типа, согласно предложенного каскада Correa, считают переход от нормального эпителия желудка через воспаление, атрофию, внутрислизистую карциному, и наконец, к инвазивной карциноме. Множественные факторы риска были связаны с развитием взаимосвязи кишечной метаплазии желудка, включая инфекцию желудка H. pylori, генетических факторов, экологической среды, ревматических болезней, табакокурения, питания, желчного рефлюкса и кишечной микробиоты. Во всем мире в странах с высоким уровнем заболеваемости разработаны руководящие принципы скрининга.
Кишечная метаплазия желудка определяется как замена поверхностного, фовеолярного, и/или железистого эпителия кислотопродуцирующей или антральной слизистой желудка кишечным эпителием. Кишечная метаплазия желудка характеризуется анатомически как ограниченный процесс, если он находится в одной области желудка или как обширный, если вовлечены две области желудка. Гистологически кишечная метаплазия желудка считается либо полной, либо неполной. Полный (I тип) кишечная метаплазия определяется слизистой оболочкой тонкой кишки со зрелыми абсорбирующими клетками, бокаловидными клетками (Гоблета) и щеточной каймой. Неполная (II тип) кишечная метаплазия секретирует сиаломуцины и сходна с толстокишечным эпителием с цилиндрическими “промежуточными” клетками на различных стадиях дифференцировки, неравномерными каплями муцина и отсутствием щеточной каймы.
Самый высокий риск развития рака желудка связан с неполным и/или обширной кишечной метаплазией желудка. Систематический обзор, который включал 10 наблюдательных исследований по всей Европе, Азии и Латинской Америке в диапазоне от 10 месяцев до 19 лет наблюдения, показал, что риск рака желудка составляет в 4-11 раз выше при наличии неполной метаплазии по сравнению с ее отсутствием.
Первым изменением в гистологическом каскаде является либо активное хроническое воспаление неатрофического хронического гастрита, характеризующегося наличием желез, либо мультифокальный атрофический гастрит. Последующие гистологические изменения прогрессируют через появление полной метаплазии, неполной метаплазии, дисплазии низкой и высокой степени с последующей карциномой. В Нидерландах было проведено общенациональное когортное исследование для оценки риска развития рака желудка, связанного с различными предраковыми поражениями желудка. Атрофический гастрит, кишечная метаплазия, умеренно выраженная дисплазия, и высокая дисплазия были связаны с ежегодной заболеваемостью рака желудка в 0,1%, 0,25%, 0,6%, и 6,0%, соответственно. Заболеваемость раком желудка, ассоциированным с кишечной метаплазией желудка, в систематических обзорах колеблется от 0% до 10%, причем переменный диапазон обусловлен различными размерами выборки и периодами наблюдения.
Эндоскопический скрининг и наблюдение
Пациентам с высоким риском рекомендовано пройти эндоскопическое обследование с картированием биопсий по модифицированной Сиднейской системе (MSS) из 5 точек – антрального отдела (большая кривизна, малая кривизна), угол желудка и тело желудка (большая кривизна, малая кривизна). Следует отметить, что биопсии тела особенно ценны после длительного лечения ингибиторами протонной помпы, так как кислотопродуцирующая слизистая оболочка может быть изолировано инфицирована H. pylori. Биопсии с угла желудка также особенно важны, так как они, скорее всего, выявят максимальную атрофию, кишечную метаплазию и предраковую дисплазию. De Vries и его коллеги провели проспективное многоцентровое исследование в 2010 году. Золотым стандартом считалось получение 12 биопсий. На основе MSS (5 биопсий) выявили 90% пациентов с кишечной метаплазией желудка и 50% пациентов с дисплазией, в отличие от 97% и 100%, соответственно, когда было получено не менее 7 биопсий. De Vries и его коллеги пришли к выводу, что по крайней мере 9 биопсий, в том числе из кардии, необходимы для адекватного наблюдения предраковых поражений в популяции с низкой частотой рака желудка, к которым относятся европеоиды и белые американцы не испанского, африканского или восточноазиатского происхождения.
В настоящее время ASGE не рекомендуют общее наблюдение за людьми с кишечной метаплазией желудка, если не присутствуют другие факторы риска рака желудка, например, семейного анамнеза рака желудка и азиатского происхождения. Однако, европейский партнер, ESGE, рекомендует лечение H. pylori, если установлено, что пациент заражен бактериями, с последующим картированием биопсий по выявлению дисплазии каждые 3 года. Если слабая дисплазии (LGD) обнаруживается у пациента с кишечной метаплазией желудка, то ЭГДС с картированием необходима в течение 1 года для оценки эндоскопически видимых поражений. Пациентам с подтвержденной дисплазией высокой степени (HGD) при отсутствии эндоскопически видимого поражения рекомендуется повторное ЭГДC через 6-12 месяцев для наблюдения видимых поражений. Эти пациенты с поражениями должны пройти надлежащее либо хирургическую, либо эндоскопическую резекцию из-за высокой вероятности сосуществования инвазивной аденокарциномы, так как 25% пациентов с дисплазией высокой степени могут спрогрессировать до аденокарциномы в течение 1 года.
David S. Jencks, Jason D. Adam, Marie L. Borum, Joyce M. Koh, Sindu Stephen, David B. Doman. Overview of Current Concepts in Gastric Intestinal Metaplasia and Gastric Cancer. Gastroenterol Hepatol (NY). 2018 Feb; 14(2): 92–101.
Часто приходят на прием пациенты, которым было проведено эндоскопическое исследование желудка и в заключении специалист пишет: «хронический гастрит, кишечная метаплазия». Если о хроническом гастрите наши пациенты наслышаны, то кишечная метаплазия вызывает тревогу и мысли о злокачественном поражении желудка. Так ли это?
Термин «хронический гастрит» обозначает хроническое воспаление желудка, но речь идет не обо всей стенке желудка, а только слизистой оболочке, в которой наряду с воспалительными и атрофическими процессами развивается нарушение обновления клеток слизистой желудка, что является важным признаком гастрита и может определять прогноз хронического гастрита.
О слизистой желудка подробнее
Слизистой желудка свойственно постоянное клеточное обновление. При любых повреждениях слизистой желудка активизируется регенерация, что приводит к восстановлению структуры слизистой. Свидетельством нарушения клеточного обновления при хроническом гастрите служат характерные для него изменения слизистой, нарушение фаз клеточного обновления, которые хорошо известны морфологам и определяются как нарушения морфологической перестройки слизистой оболочки желудка в виде кишечной метаплазии и дисплазии слизистой.
Поэтому при проведении эндоскопического исследования необходимо провести множественные биопсии слизистой желудка, чтобы подтвердить диагноз хронического гастрита, при котором может наблюдаться качественное нарушение регенерации (восстановления) клеток и замещение их несвойственными для желудка или его отделов клетками, т.е. речь идет о замещении желудочного эпителия кишечным. Метаплазия (от греческого «образование, формирование) — стойкое замещение клеток одного типа на клетки другого типа при сохранении видовой принадлежности ткани.
Что представляет собой кишечная метаплазия
Кишечная метаплазия была описана более ста лет назад, и до настоящего времени она изучается, главным образом, из-за возможной связи с раком желудка. Кишечная метаплазия встречается достаточно часто. В пожилом возрасте ее находят и у практически здоровых людей, но особенно часто при атрофическом гастрите почти в 100%. При язвах желудка – в 81%. При язвах 12-перстной кишки – 47%. Рак желудка занимает 4 место в структуре онкологических заболеваний.
Уровень пепсиногенов в крови является маркером хронического атрофического гастрита и риска развития рака желудка. Поэтому проведение определения по анализу крови уровня пепсиногенов и хеликобактерной инфекции улучшает выявление хронического атрофического гастрита и рака желудка.
При подозрении у пациента хронического атрофического гастрита (по результатам гастропанели) показано проведение гастродуоденоскопии с множественной биопсией слизистой желудка. Гистологическое подтверждение кишечной метаплазии является наиболее надежным маркером атрофии слизистой оболочки желудка. Пациенты, у которых диагностирован хронический атрофический гастрит с кишечной метаплазией, находятся в группе риска по развитию рака желудка (аденокарциномы желудка).
Факторами риска кишечной метаплазии могут быть:
- хеликобактерная инфекция,
- нерациональное питание,
- генетические факторы,
- экологическая среда,
- табакокурение,
- дуоденогастральный рефлюкс — желчный рефлюкс в желудок,
- нарушение кишечной микрофлоры.
Кишечная метаплазия — типы
В настоящее время различают два типа метаплазии – полную, напоминающую слизистую тонкой кишки, метаплазия 1 типа и неполную, напоминающую слизистую толстой кишки, метаплазия 2 типа.
Полная кишечная метаплазия

Она встречается наиболее часто при хронических гастритах. Тонкокишечный эпителий, образующий участки метаплазии, вообще мало склонен к малигнизации (раковому перерождению). Широко известным фактором является большая редкость рака тонкой кишки. Поэтому полную кишечную метаплазию не относят к предраковым изменениям слизистой. Если наблюдаются проявления хронического гастрита, то динамическое наблюдение и проведение гастродуодкерскопии проводится через 3-5 лет.
В питании показано употреблять продукты, обладающие обволакивающими свойствами — рисовый отвар, кисель, фрукты в запеченном виде, джемы на пектинах, из трав – семя льна.
Неполная кишечная метаплазия
Напоминает слизистую толстой кишки и выявляется у 11% больных всеми доброкачественными заболеваниями желудка, но при раке желудка она наблюдается в 94% случаев. Неполная кишечная метаплазия показала более высокую специфичность этого признака изменения слизистой желудка к раку, но низкая чувствительность (38%) говорит об ограниченном значении ее как показателя прогноза развития рака кишечного типа. Важным фактором при этом имеет большая площадь замещения нормального желудочного эпителия кишечным.
Известна связь хронического атрофического гастрита, кишечной метаплазии и хеликобактер пилори, при которых ликвидация хеликобактера способна предотвратить развитие и прогрессирование атрофии, а также возможно обратное развитие атрофии слизистой желудка. Наличие же кишечной метаплазии является признаком хеликобактерного гастрита. Пациенты с неполной кишечной метаплазией наблюдаются динамически ежегодно.
Неполная кишечная метаплазия слизистой желудка часто переходит в следующую стадию перестройки слизистой – дисплазию метаплазированного эпителия.
Морфологическая диагностика болезней желудка
Дисплазия метаплазированного эпителия – диагноз морфологический. О ней можно говорить при наличии клеточной атипии и нарушении структуры клеток слизистой оболочки желудка. В зависимости от выраженности этих изменений выделяют 3 степени дисплазии:
- 1 — слабая,
- 2- умеренная,
- 3- выраженная или тяжелая степень.
Понятие дисплазии было предложено для обозначения предраковых изменений, формирования групп повышенного риска для наблюдения и превентивного лечения. Исследования развития дисплазий показали, что у больных с дисплазией 2 степени в 4-8% найдено прогрессирование в дисплазию 3 степени.
Наблюдение больных дисплазией 1 и 2 степени
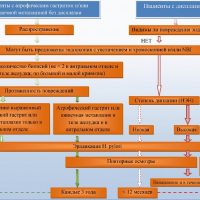
При слабой степени дисплазии, выявленной у людей старше 60 лет на фоне выраженного гастрита, рекомендуется проведение повторных эндоскопий с биопсиями через 12 месяцев и затем каждые 3 года.
При выявлении в биоптатах слизистой желудка признаков тяжелой дисплазии следует провести множественные повторные биопсии через 6-12 месяцев, так как тяжелая дисплазия чаще свидетельствует не о том, что у больного может возникнуть рак, а о том, что он уже есть. И если даже рак еще не обнаружен, то таким больным рекомендуется хирургическое лечение — хирургическая или эндоскопическая резекция из-за высокой вероятности развития аденокарциномы (рака желудка). У 25% дисплазия высокой степени может спрогрессировать до аденокарциномы в течение года.
Иначе просто динамическое наблюдение даже с множеством биопсий при эндоскопии при подтверждении тяжелой дисплазии слизистой желудка может закончиться тем, что будет упущено время для диагностики раннего рака желудка и своевременного лечения и выздоровления.
Лечение больных дисплазией 3 степени
У пациентов, у которых выявлен хронический атрофический гастрит с дисплазией, которая связана со штаммами хеликобактер пилори высокой вирулентности, повышенный риск развития рака желудка. Эрадикация хеликобактер пилори может привести к регрессу атрофических процессов в желудке и снижению риска рака желудка. При дисплазии требуется эрадикация хеликобактер пилори, ритмичное питание, защита слизистой желудка от повреждения ее лекарственными средствами.
Если при обследовании выявлен низкий уровень пепсиногена I и низкое соотношение пепсиноген I/пепсиноген II, это уже серьезная стадия атрофического гастрита/ Рекомендуется гастродуоденоскопия с множественной биопсией, даже в тех случаях, если серологический тест (определение антител в сыворотке крови) на хеликобактер пилори не выявил инфекцию в желудке.
Морфологами в биоптатах слизистой оболочки желудка по новой системе стадирования атрофического гастрита (OLGA) cумммируются показатели атрофии в теле и антральном отделе желудка с определением баллов в каждом биоптате. III и IV стадии выраженности атрофического гастрита по этой системе свидетельствует о высокой реальности развития рака желудка
Кишечная метаплазия – будьте бдительны!
В заключении хочу привести слова проф. Аруина Л.И., опытного и знающего морфолога, который сказал: «хронический гастрит и рак желудка разделяет дистанция огромного размера, а дисплазия и рак желудка живут в одной квартире».
Будьте внимательны к своему здоровью, вовремя проводите обследования, задавайте вопросы доктору, следуйте его рекомендациям. Здоровья вам!

Поделитесь информацией с друзьями
Пищевод Барретта определяется как замещение слизистой пищевода слизистой желудочного типа (цилиндроклеточной метаплазии) с наличием среди нее очагов кишечных клеток (кишечной метаплазии).
Вопрос века
Если развитие цилиндроклеточной метаплазии уже состоялось, можно ли на фоне лечения добиться, чтобы на этом месте образовался нормальный эпителий пищевода? Решению вопроса о том, можно ли вылечить пищевод Барретта было посвящено множество исследований и, к сожалению, на сегодня ни медикаментозное, ни хирургическое лечение обеспечить этого с доказательной достоверностью не могут. В ряде исследований отмечено о появлении даже островков нового эпителия пищевода, но неполное его восстановление. Некоторые авторы сообщали о полной регрессии цилиндроклеточной метаплазии, но только у 2 пациентов из 190 наблюдавшихся.
Можно ли вылечить пищевод Барретта разрушением очагов болезни?
Перспективным и современным методом лечения пищевода Барретта рассматривается в настоящее время различные формы абляции (разрушение очагов пищевода Барретта различными методами). К этим методам прибегают только при прогрессировании пищевода Барретта, т.е. обнаружении на фоне цилиндроклеточной метаплазии, кишечной метаплазии в сочетании с дисплазией.
Также следует отметить, что данные процедуры делаются под контролем зрения человека, не на микроскопическом уровне. Возникает пресловутый «человеческий фактор», когда невозможно точно и повсеместно определить все очаги поражения. Описаны не единичные случаи остаточных микроскопических очагов пищевода Барретта, которые не были разрушены. Поверх этих очагов образовывался новый эпителий пищевода, а под ним из неразрушенных остатков пищевода Барретта продолжал развиваться процесс, который при последующей эндоскопии никак не определялся.
Можно ли вылечить пищевод Барретта изменением мировозрения?
Нужно помнить, что развитие пищевода Барретта – это своеобразный защитный механизм организма от агрессии кислотой и желчью. К этому агрессивному воздействию клетки слизистой пищевода не адаптированы, вот и образуются в этом месте такие клетки (клетки желудка и кишки), которые привычны к кислоте и/или желчи. Поэтому, чтобы вылечить данное состояние, необходимо не только прием лекарственных препаратов для ликвидации уже приобретенных изменений, но и глубоко изменение образа жизни и, если хотите, мировозрения.
Поэтому, отвечая на этот вопрос, сегодня с уверенностью можно сказать: медицине пока это не подвластно. При подозрении и обнаружении пищевода Барретта необходимо проводить пожизненную медикаментозную терапию с оптимальным сочетанием хирургических вмешательств, и при возникновении диспластических процессов в слизистой пищевода Барретт прибегать к из разрушению, т.е абляции.
Читайте также:

