Какой вирус папилломы человека вызывает рак шейки матки
Обновлено: 25.04.2024
Мы привыкли говорить о том, что рак возникает по разным причинам, как сочетание множества факторов. По поводу рака шейки матки (РШМ) можно сказать однозначно: в 90% случаев появление злокачественных новообразований связано с инфицированием вирусом папилломы человека (ВПЧ) и в 70% случаев РШМ вызван онкогенными типами ВПЧ 16 и 18.
Сегодня 4 марта отмечается Международный день борьбы с ВПЧ. Мы обсудили с экспертами ЛАБквест основные вопросы, касающиеся папилломавируса.
ЧТО ТАКОЕ ВПЧ?
ВПЧ - самое распространенное на планете инфекционное заболевание, передающееся половым путем. Известно более 100 видов ВПЧ, 14 из них приводят к появлению злокачественных новообразований.
ТИПЫ ВПЧ
Все штаммы ВПЧ делятся на 3 вида:
- Низкого онкогенного риска (5-8, 11, 12, 14, 15, 17, 19-25, 42-44).Они являются причиной появления кондилом и бородавок шейки матки, слизистой влагалища и эпителия наружных половых органов. Такие папилломы не являются предшественниками злокачественных новообразований и лечатся по запросу пациента (по косметическим соображениям).
- Высокого онкогенного риска (16,18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68). Они могут быть причиной возникновения РШМ, анального рака, рака горла, вульвы и влагалища, полового члена. ВПЧ высокого онкогенного риска обнаруживается у 90% пациенток с РШМ. И лишь в малом проценте случаев возникновение новообразований не связано с ВПЧ.
- Неонкогенные папиломмавирусы (1-4, 7, 10, 28, 41)
ЧТО ТАКОЕ ВПЧ ВЫСОКОГО ОНКОГЕННОГО РИСКА
Большинство низко- и высокоонкогенных типов ВПЧ-инфекции подавляются иммунитетом самостоятельно, однако при сочетании различных канцерогенных факторов, инфекция становится хронической, и может вызывать патологические состояния.
У инфицированных женщин с адекватным иммунным ответом с момента инфицирования до возникновения диспластических изменений шейки матки проходит больше 10 лет. У женщин с ослабленным иммунитетом с момента инфицирования до диагностирования рака проходит около 5 лет.
ПРИ КАКИХ УСЛОВИЯХ ВПЧ ВЫЗЫВАЕТ РАК
Совокупность этих факторов увеличивает риск перерождения клеток, инфицированных ВПЧ в злокачественную опухоль:
- диагностирован ВПЧ высокоонкогенного типа;
- ВИЧ-инфекция или другие нарушения иммунного статуса;
- инфицирование организма одновременно не только высокоонкогенным типом ВПЧ, но и другими возбудителями ЗППП: гонореей, сифилисом, хламидиями и т.д.;
- ранние первые роды или большое число рожденных детей;
- курение.
КАК ПЕРЕДАЕТСЯ ВПЧ
По данным Всемирной организации здравоохранения около 80% сексуально активного населения планеты в течении жизни сталкивается с ВПЧ.
Вирус передается при незащищенном половом контакте, при оральном сексе, либо при тесном контакте кожи и слизистых оболочек.
ВПЧ настолько сильно распространился благодаря тому, что большинство носителей не имеет никаких симптомов и заражает своих партнеров, даже не зная об этом.
КАК ОБНАРУЖИТЬ ВПЧ
Согласно международным рекомендациям, чтобы снизить риск возникновения РШМ :
с 21 года до 30 лет — каждые 3-5 лет сдавать ПАП-тест (PAP-тест, или мазок по Папаниколау). Если есть возможность выбрать, предпочтительнее, чтобы тест делали методом жидкостной цитологии. Такой анализ проще стандартизировать, поэтому он дает более надежный результат, чем «классический» мазок, который исследуют под микроскопом.
с 30 до 65 лет — каждые 3-5 лет нужно делать ПАП-тест и сдавать анализ на ВПЧ. Это должен быть мазок из влагалища, который будут исследовать методом ПЦР на высокоонкогенные типы вируса.
КАК БЕРУТ АНАЛИЗ НА ВПЧ И КАК К НЕМУ ПОДГОТОВИТЬСЯ
У женщин взятие биоматериала не зависит от дня цикла, исключение составляют месячные +- 3 дня до и после. Перед анализом нужно исключить половые контакты за 2-3 дня и не проводить спринцевание. Мужчинам не рекомендуется мочиться за 1.5-2 часа до взятия биоматериала. Мазок берут с помощью урогенитального зонда из влагалища у женщин и из уретры у мужчин.
КАК РАСШИФРОВАТЬ АНАЛИЗ НА ВПЧ И ЧТО ДЕЛАТЬ, ЕСЛИ ВПЧ НАШЛИ
Расшифровать результаты может только врач. Специалисты сервиса Doctor Q помогут перевести результаты с медицинского на русский и маршрутизируют к нужному специалисту.
Обычно по результатам анализов женщины распределяются на 3 группы:
Дальнейшие действия зависят от результатов анализа. Если обнаружатся злокачественные клетки, их потребуется удалить. Конкретный метод удаления опасных клеток должен предложить лечащий врач — онколог.
КАК ЛЕЧИТЬ ВПЧ
На сегодняшний день клинически одобренного протокола лечения ВПЧ не существует, за вирусом в организме человека наблюдают и работают только с измененными клетками эпителия.
Самый лучший способ обезопасить себя на сегодняшний день - вакцинироваться.
Вакцина защищает организм от некоторых онкогенных типов ВПЧ, даже если человек уже был инфицирован.
Стандартные протоколы рекомендуют прививать девочек в возрасте от 9 до 14 лет, однако последние исследования показали, что даже инфицированные женщины могут вакцинироваться до 45 лет включительно.
После вакцинации все равно необходимо регулярно проходить гинекологические обследования раз в год, так как одобренные вакцины не защищают от абсолютно всех высокоонкогенных вирусов.
ЧТО ДЕЛАТЬ МУЖЧИНЕ, ЕСЛИ У ЕГО ПАРТНЕРШИ ВПЧ
Чаще всего мужчины обследуются на ВПЧ после того, как узнают о заражении партнерши.
Возможность возникновения злокачественных новообразований, вызванных ВПЧ у мужчин гораздо ниже, чем у женщин. Мужчины должны занимать выжидательную позицию: наблюдать за образованием папиллом в области рта и гениталий, и при их обнаружении своевременно обращаться к врачу.
Во всем мире рак шейки матки является четвертым по распространенности видом рака среди женщин; по оценкам, в 2020 г. произошло 604 000 новых случаев заболевания. Примерно 90% от произошедших в 2020 г. 342 000 случаев смерти от рака шейки матки имело место в странах с низким и средним уровнем дохода. Вероятность заболевания раком шейки матки у женщин с ВИЧ-инфекцией в шесть раз выше, чем у женщин, не инфицированных ВИЧ, и, согласно оценкам, c ВИЧ связано 5% всех случаев заболевания раком шейки матки (2). Кроме того, во всех регионах мира роль ВИЧ в развитии рака шейки матки выше среди женщин более молодого возраста.
В странах с высоким уровнем дохода имеются программы, в рамках которых осуществляются вакцинация против ВПЧ среди девочек и регулярный скрининг и назначение необходимого лечения среди женщин. Скрининг позволяет выявлять предраковые поражения на стадиях, когда их можно легко лечить.
В странах с низким и средним уровнем дохода такие профилактические меры менее доступны, и рак шейки матки часто выявляется лишь на поздних стадиях, когда развиваются симптомы. Ограниченно доступными могут быть также услуги по лечению раковых поражений (например, хирургическая операция, лучевая терапия и химиотерапия), что приводит к более высокой смертности от рака шейки матки в этих странах.
Высокую глобальную смертность от рака шейки матки (стандартизированный по возрасту показатель: 13,3/100 000 в 2020 г.) можно снизить путем принятия ряда эффективных мер в различных возрастных группах.
ВПЧ и рак шейки матки
Подавляющее большинство (более 95%) случаев рака шейки матки вызваны вирусом папилломы человека (ВПЧ).
ВПЧ является наиболее распространенной вирусной инфекцией половых путей. Им в какой-то момент жизни заражается большинство сексуально активных женщин и мужчин, иногда неоднократно. У более 90% зараженных инфекция впоследствии исчезает.
Рак шейки матки – наиболее распространенное из обусловленных ВПЧ заболеваний. Почти все случаи развития рака шейки матки объясняются заражением ВПЧ.
Хотя в большинстве случаев заражение ВПЧ проходит само собой, а предраковые поражения самопроизвольно излечиваются, все женщины подвержены риску перехода инфекции в хроническую форму и прогрессирования предраковых поражений в инвазивный рак шейки матки.
У женщин с нормальным иммунитетом рак шейки матки может развиваться в течение 15–20 лет. Однако при нарушениях иммунной системы, например у женщин с нелеченой ВИЧ-инфекцией, этот процесс может занять всего
5–10 лет.
Комплексный подход к борьбе с раком шейки матки
В Глобальной стратегии по ускорению элиминации рака шейки матки как проблемы общественного здравоохранения, принятой Всемирной ассамблеей здравоохранения в 2020 г., рекомендуется применять комплексный подход к профилактике рака шейки матки и борьбе с ним. Рекомендуемый комплекс мер включает мероприятия, охватывающие весь жизненный цикл.
Подход к борьбе с раком шейки матки, охватывающий весь жизненный цикл

- Вакцинация против ВПЧ
- Санитарное просвещение и предупреждения в отношении употребления табака
- Половое воспитание с учетом возраста и культуры
- Мужское обрезание
- Скрининг с помощью высокоэффективного теста, эквивалентного или превосходящего тест на ВПЧ
- Немедленное или как можно более быстрое назначение лечения предраковых поражений после получения положительного результата молекулярного теста на ВПЧ
- Хирургическая операция
- Лучевая терапия
- Химиотерапия
- Паллиативная помощь
Профилактика рака шейки матки должна вестись на основе междисциплинарного полхода и включать такие компоненты, как информирование населения, социальная мобилизация, вакцинация, скрининг, лечение и паллиативная помощь.
Вакцинация против ВПЧ
В настоящее время имеются четыре преквалифицированные ВОЗ вакцины, все из которых защищают от ВПЧ типов 16 и 18, которые, как известно, вызывают как минимум 70% раковых заболеваний шейки матки. Девятивалентная вакцина защищает еще от пяти канцерогенных типов ВПЧ, вызывающих еще 20% раковых заболеваний шейки матки. Две из этих вакцин защищают также от ВПЧ типов 6 и 11, приводящих к развитию аногенитальных кондилом.
Результаты клинических испытаний и пост-маркетингового наблюдения свидетельствуют о том, что вакцины против ВПЧ позволяют безопасно и эффективно предупреждать ВПЧ-инфекции, серьезные предраковые поражения и инвазивный рак (3).
Вакцины против ВПЧ наиболее эффективны, если вводятся до заражения ВПЧ. Поэтому в целях профилактики рака шейки матки ВОЗ рекомендует проводить вакцинацию девочек в возрасте от 9 до 14 лет, когда большинство из них еще не начали половую жизнь. В некоторых странах начата вакцинация мальчиков, поскольку она предупреждает развитие связанных с ВПЧ видов рака у мужчин.
Вакцинация против ВПЧ не заменяет скрининг на рак шейки матки. В странах, где предусмотрена вакцинация против ВПЧ, для сокращения заболеваемости и смертности в связи с раком шейки матки необходимо проводить программы общепопуляционного скрининга, позволяющие выявлять и лечить предраковые состояния и рак шейки матки.
Скрининг и лечение предраковых поражений шейки матки
Скрининг
Скрининг на рак шейки матки включает тестирование на ВПЧ-инфекцию для выявления предраковых состояний с последующим назначением соответствующего лечения. Тестирование проводится среди женщин, не имеющих симптомов и чувствующих себя совершенно здоровыми. Если скрининг выявляет ВПЧ-инфекцию или предраковые поражения, их можно легко лечить и тем самым предотвратить развитие рака. Скрининг может также выявить рак на ранней стадии, когда существует высокая вероятность излечения.
В настоящее время в обновленном руководстве ВОЗ странам рекомендуется использовать для цервикального скрининга тесты на ВПЧ, в частности:
- тесты на ДНК ВПЧ, позволяющие выявлять высокоопасные штаммы ВПЧ, вызывающие почти все виды рака шейки матки;
- тесты на мРНК ВПЧ, позволяющие выявлять ВПЧ-инфекции, приводящие к появлению атипичных клеток.
Тесты на ВПЧ, в отличие от визуального обследования, позволяют получить объективный результат. Они зарекомендовали себя простотой использования, возможностью выявления большего числа предраковых и раковых состояний и спасения большего числа жизней. Их применение также более экономически оправдано по сравнению с визуальными методами обследования или цитологией (мазок Папаниколау).
В общей популяции женщин скрининг должен проводиться с использованием валидированного теста на ВПЧ начиная с 30-летнего возраста с интервалом каждые 5–10 лет; среди женщин с ВИЧ-инфекцией его следует проводить начиная с 25-летнего возраста. Кроме того, скрининг среди ВИЧ‑инфицированных женщин должен проводиться чаще, каждые 3–5 лет.
Для проведения цитологии и теста на ВПЧ медицинским персоналом применяются аналогичные процедуры взятия цервикального образца. ВОЗ допускает возможность самостоятельного взятия образцов пациенткой при проведении теста на ДНК (но не мРНК) ВПЧ. Для уверенного выполнения данной процедуры женщинам должна оказываться надлежащая поддержка.
Скрининг должен быть увязан с лечением и ведением пациентов с положительными результатами скрининга. ВИЧ-положительным женщинам в условиях нехватки ресурсов лечение может назначаться без подтверждающей диагностики. При этом лечение ВИЧ-положительных женщин можно начинать только после получения положительного на ВПЧ результата теста (например, визуального обследования с использованием уксусной кислоты).
Лечение предраковых положений
В случае необходимости лечения предраковых поражений и соответствия пациентки критериям лечения рекомендуется проводить удаление пораженных тканей методом криотерапии или термоабляции. Оба метода лечения эффективны и безопасны и могут выполняться в амбулаторных условиях.
Лечение инвазивного рака шейки матки
Женщин с симптомами, позволяющими предполагать рак шейки матки, необходимо направлять в соответствующие медицинские учреждения для дальнейшего обследования, диагностики и лечения.
Симптомы ранней стадии рака шейки матки могут включать:
- нерегулярные кровянистые выделения или небольшие кровотечения в период между менструациями у женщин репродуктивного возраста;
- кровянистые выделения или кровотечения в постклимактерический период;
- кровотечения после полового акта; и
- обильные влагалищные выделения, иногда с неприятным запахом.
По мере развития рака шейки матки могут появляться более серьезные симптомы, включая:
- постоянные боли в области спины, ноги и/или таза;
- потеря веса, усталость, потеря аппетита;
- выделения с неприятным запахом и неприятные ощущения во влагалище; и
- отек ноги или обеих нижних конечностей.
На более поздних стадиях могут возникать другие тяжелые симптомы в зависимости от того, на какие органы распространился рак.
Диагноз рака шейки матки должен ставиться на основе результатов гистопатологического исследования. Определение стадии проводится на основе размера опухоли и распространения болезни в пределах таза и на удаленные органы. План лечения зависит от стадии болезни и включает хирургическую операцию, лучевую терапию и химиотерапию. Паллиативная помощь также является важным элементом ведения онкологических пациентов, позволяющим облегчать чрезмерную боль и страдания.
Деятельность ВОЗ
Всемирная ассамблея здравоохранения приняла глобальную стратегию по ускорению элиминации рака шейки матки как проблемы общественного здравоохранения. Элиминация рака шейки матки была определена как достижение порогового значения, составляющего менее 4 случаев заболевания раком шейки матки на 100 000 женщин в год. В целях достижения этого порогового значения к концу XXI века ВОЗ наметила целевые показатели
«90–70–90», которые должны быть обеспечены к 2030 г. и стабильно поддерживаться впоследствии (WHA73.2) (4):
- 90% девочек к 15 годам должны быть в полной мере вакцинированы против ВПЧ;
- 70% женщин должны пройти скрининг на основе высокоэффективного теста в возрасте 35 лет и затем в возрасте 45 лет; и
- 90% женщин с выявленной болезнью шейки матки должны получать лечение (обеспечить лечение для 90% женщин с предраком; обеспечить ведение 90% женщин с инвазивным раком).
ВОЗ разработала руководство и инструментарий по профилактике рака шейки матки и борьбе с ним путем вакцинации, скрининга и лечения, а также терапии инвазивного рака. ВОЗ сотрудничает со странами и партнерами в разработке и осуществлении всеобъемлющих программ в соответствии с глобальной стратегией.
Библиография
(1) Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2021:71:209–49. doi:10.3322/caac.21660.
(3) Lei et al. (2020) HPV Vaccination and the Risk of Invasive Cervical Cancer.
N Engl J Med 2020;383:1340-8. DOI: 10.1056/NEJMoa1917338
Основные факты
Общие сведения о ВПЧ
Вирусы папилломы человека (ВПЧ) — возбудители самой распространенной вирусной инфекции половых путей. Большинство ведущих половую жизнь женщин и мужчин рано или поздно приобретают эту инфекцию, а некоторые могут заражаться несколько раз в течение жизни.
Большинство женщин и мужчин заражаются ВПЧ вскоре после начала половой жизни. Инфекция ВПЧ относится к заболеваниям, передающимся половым путем, хотя заражение возможно и при половых контактах без проникновения. Известно, что передача вируса происходит и при простом соприкосновении половых органов.
Среди множества типов ВПЧ многие не представляют опасности для здоровья. ВПЧ-инфекции обычно исчезают за несколько месяцев без какого бы то ни было лечения, и примерно в 90% случаев элиминация инфекции из организма достигается в течение 2 лет. В небольшой доле случаев инфекции ВПЧ определенных типов могут принимать хронический характер и со временем приводить к развитию рака шейки матки.
Рак шейки матки вне всяких сомнений является самым распространенным из заболеваний, связанных с ВПЧ. Почти все случаи рака шейки матки вызваны ВПЧ-инфекцией.
Инфекциями ВПЧ некоторых типов также обусловлена определенная доля случаев рака заднего прохода, вульвы, влагалища, полового члена и ротоглотки, — заболеваний, которые можно предотвратить с помощью тех же методов первичной профилактики, что и рак шейки матки.
Некоторые не онкогенные вирусы папилломы человека, особенно ВПЧ 6-го и 11-го типов, могут приводить к образованию остроконечных кондилом и развитию респираторного папилломатоза (заболевания, при котором опухоли образуются в дыхательных путях, ведущих от носа и полости рта в легкие). Хотя эти патологические состояния очень редко приводят к смерти, распространенность заболевания может быть значительной. Остроконечные кондиломы очень широко распространены, отличаются высокой контагиозностью и отрицательно влияют на половую жизнь.
Каким образом инфекция ВПЧ приводит к развитию рака шейки матки
Несмотря на то, что большинство ВПЧ-инфекций исчезают сами по себе, а предраковые поражения в большинстве случаев самопроизвольно излечиваются, все женщины подвержены риску перехода инфекции в хроническую форму и прогрессирования предраковых поражений в инвазивный рак шейки матки.
У женщин с нормальным иммунитетом рак шейки матки может развиваться в течение 15-20 лет. Однако при нарушениях иммунной системы, например у женщин с нелеченой ВИЧ-инфекцией, этот процесс может занять всего 5–10 лет.
Факторы риска хронической ВПЧ-инфекции и рака шейки матки
- степень онкогенности ВПЧ (способности вируса вызывать рак);
- нарушения иммунитета: люди с ослабленным иммунитетом, в частности, лица, живущие с ВИЧ, подвержены более высокому риску хронической ВПЧ-инфекции и ускоренного развития предраковых поражений и рака;
- наличие сопутствующих инфекций, передающихся половым путем, таких как генитальный герпес, хламидиоз и гонорея;
- количество родов в анамнезе и роды в раннем возрасте;
- курение табака.
Бремя рака шейки матки в мире
В развитых странах реализуются программы по вакцинации девочек против ВПЧ и ведется регулярный скрининг женщин на ВПЧ-инфекцию. Скрининг позволяет выявлять предраковые поражения на стадиях, на которых они легко поддаются лечению. В этих странах раннее начало лечения позволяет предотвратить развитие рака шейки матки почти в 80% случаев.
В развивающихся странах из-за ограниченного доступа к профилактике рак шейки матки часто остается не выявленным до поздних стадий заболевания и появления клинических симптомов. Кроме того, в этих странах может быть крайне ограничен доступ к лечению поздних стадий рака (например, доступ к онкохирургии, лучевой и химиотерапии), в связи с чем смертность от рака шейки матки там намного выше.
Проведение эффективных лечебно-профилактических мероприятий могло бы позволить снизить высокий показатель смертности от этого заболевания в мире (стандартизированный по возрасту коэффициент смертности в 2018 г.: 6,9 на 100 000).
Комплексный подход к борьбе с раком шейки матки
ВОЗ рекомендует комплексный подход к профилактике и лечению рака шейки матки. В рекомендуемый набор действий входят мероприятия, относящиеся ко всем этапам жизненного цикла. В эту многопрофильную программу должны входить такие компоненты, как просветительская работа в сообществах, мобилизация социальных ресурсов, вакцинация, скрининг, лечение и паллиативная помощь.
Первичная профилактика
Вторичная профилактика
Третичная профилактика
- Вакцинация против ВПЧ
- Санитарное просвещение и информирование о вреде употребления табака
- Сексуальное просвещение с учетом возраста и культурных традиций
- Пропаганда безопасного секса и раздача презервативов подросткам, живущим половой жизнью
- Мужское обрезание
- Экспресс-тесты на ВПЧ высокого риска в пунктах оказания медицинской помощи
- Немедленное последующее лечение
- Лечение на месте
- Хирургическое лечение
- Лучевая терапия
- Химиотерапия
- Паллиативная помощь
Первичная профилактика начинается с вакцинации девочек в возрасте 9–14 лет до начала половой жизни.
В перечень других рекомендуемых профилактических мероприятий для девочек или мальчиков, в зависимости от ситуации, входят:
- информирование о практиках безопасного секса, в том числе о нежелательности раннего начала половой жизни;
- пропаганда использования презервативов и предоставление их тем, кто уже начал половую жизнь;
- предупреждение о вреде употребления табака, к которому многие приобщаются в подростковом возрасте и которое является серьезным фактором риска развития рака шейки матки и других онкологических заболеваний;
- мужское обрезание.
Начиная с 30 лет все женщины, ведущие активную половую жизнь, должны проходить скрининг на атипичные клетки шейки матки и наличие предраковых поражений.
Если для лечения предраковых поражений шейки матки необходимо иссечение участков с атипичными клетками или измененными тканями, рекомендуется применять метод криотерапии, основанный на разрушении патологических тканей путем их замораживания.
При обнаружении признаков рака шейки матки необходимо начинать лечение, вариантами которого могут быть хирургическое вмешательство, лучевая терапия и химиотерапия.
Вакцинация против ВПЧ
Клинические и пострегистрационные исследования показывают, что вакцины против ВПЧ отличаются высокой безопасностью и высокой эффективностью в предотвращении ВПЧ-инфекций.
Вакцины против ВПЧ дают максимальный эффект, если их вводят до контакта организма с этими вирусами. В связи с этим ВОЗ рекомендует вакцинировать девочек в возрасте от 9 до 14 лет, когда большинство из них еще не начали вести половую жизнь.
Вакцины не лечат ВПЧ-инфекцию и связанные с ВПЧ заболевания, в частности, рак.
В некоторых странах начали вакцинировать и мальчиков, так как вакцинация предотвращает развитие рака половых органов не только у женщин, но и у мужчин, а две из существующих вакцин способны также препятствовать развитию остроконечных кондилом у представителей обоих полов. Рекомендуемая ВОЗ вакцинация девочек в возрасте от 9 до 14 лет представляет собой наиболее эффективное с точки зрения затрат медицинское мероприятие по борьбе с раком шейки матки.
Вакцинация против ВПЧ не отменяет необходимости скрининга на рак шейки матки. В странах, где вакцинация против ВПЧ внедрена в медицинскую практику, может сохраняться необходимость в разработке или усилении программ по скринингу.
Выявление и лечение предраковых поражений
Скрининг на рак шейки матки предусматривает проверку на наличие предраковых и раковых образований у женщин, которые зачастую могут чувствовать себя совершенно здоровыми и у не иметь никаких симптомов заболевания. Если при скрининге обнаруживаются предраковые поражения, их лечение не представляет трудностей и позволяет избежать развития рака. Кроме того, скрининг позволяет обнаруживать рак на ранней стадии, когда высока вероятность полного излечения.
Поскольку предраковые поражения развиваются на протяжении многих лет, скрининг рекомендуется регулярно проходить всем женщинам, начиная с возраста 30 лет (периодичность скрининга зависит от используемого для этого метода). Регулярный скрининг у женщин с ВИЧ-инфекцией, ведущих активную половую жизнь, должен начинаться раньше — с момента, когда они узнают о своем ВИЧ-статусе.
При проведении скрининга необходимо обеспечить возможность последующего лечения и предусмотреть необходимые действия в случае получения положительных результатов теста. Без надлежащей организации таких мероприятий проведение скрининга неэтично.
Существуют три различных типа скрининговых тестов, рекомендуемых ВОЗ в настоящее время:
- тесты на ВПЧ, относящиеся к группе высокого риска;
- визуальная проверка с применением уксусной кислоты;
- традиционный ПАП-тест и метод жидкостной цитологии (ЖЦ).
Для лечения предраковых поражений ВОЗ рекомендует применять методы криотерапии и электрохирургической петлевой эксцизии. При обнаружении более глубоких поражений следует направлять пациенток на дополнительные обследования для принятия обоснованных решений о дальнейших действиях.
Лечение инвазивного рака шейки матки
На ранних стадиях рака шейки матки могут появляться следующие симптомы:
- нерегулярные мажущие кровянистые выделения или слабое кровотечение в период между месячными у женщин детородного возраста;
- мажущие выделения или кровотечение у женщин в постменопаузе;
- кровотечение после полового акта;
- более обильные выделения из влагалища, иногда с неприятным запахом.
По мере прогрессирования рака могут появляться более тяжелые симптомы, в том числе:
- постоянная боль в спине, ногах и (или) в области таза;
- потеря веса, утомляемость, снижение аппетита;
- неприятно пахнущие выделения и дискомфорт во влагалище;
- отек одной или обеих нижних конечностей.
При далеко зашедших формах рака могут развиться и другие тяжелые симптомы, в зависимости от того, на какие органы распространился рак.
Диагноз рака шейки матки должен быть подтвержден результатами гистологического исследования. Стадию заболевания устанавливают на основании размеров опухоли и распространения процесса на область таза и отдаленные органы. Выбор метода лечения зависит от стадии рака, при этом в перечень возможных вариантов входят хирургическая операция, лучевая терапия и химиотерапия. Кроме того, важную роль в ведении пациентов с онкологическими заболеваниями играет паллиативная помощь, позволяющая облегчать боль и страдания, причиняемые болезнью.
Действия ВОЗ
ВОЗ разработала руководство по профилактике рака шейки матки и борьбе с этим заболеванием путем вакцинации, скрининга и лечения инвазивной формы рака. Совместно со странами и партнерами ВОЗ занимается разработкой и осуществлением комплексных программ.
В мае 2018 г. Генеральный директор ВОЗ выступил с призывом к действиям, направленным на ликвидацию рака шейки матки, и предложил странам и партнерам объединить усилия для расширения доступа к мерам профилактики рака шейки матки и увеличения охвата населения. В качестве трех основных мер были названы вакцинация против ВПЧ, скрининг и лечение предраковых поражений, а также ведение пациенток с раком шейки матки.

Разработчик сайтов, журналист, редактор, дизайнер, программист, копирайтер. Стаж работы — 25 лет. Область интересов: новейшие технологии в медицине, медицинский web-контент, профессиональное фото, видео, web-дизайн. Цели: максимально амбициозные.
- Запись опубликована: 12.04.2020
- Reading time: 3 минут чтения
Подозрение, что механизм развития рака шейки матки связан с половым путем передачи, возникло еще в 19-том веке. Специфическая связь между ВПЧ и раком шейки матки была установлена в 1980-х годах, когда в Германии ученые обнаружили ВПЧ в большинстве опухолей шейки матки. Чуть позже было доказано, что папилломавирус провоцирует ещё несколько типов рака.
С того момента прошло уже 40 лет, во многих странах на законодательном уровне приняты профилактические меры. В России также доступны скрининги на ВПЧ и рак. Но тем не менее и сейчас о существовании ВПЧ или его связи с раковыми опухолями знают лишь немногие люди, поэтому пациенты крайне неохотно сдают анализы на ВПЧ. Ещё менее охотно россияне делают прививки.
Частично это связано с недостаточным образованием по этому вопросу и плохим информированием общественности. В итоге очень часто человек узнает о ВПЧ только после того, как получил положительный тест Папаниколау или даже диагноз «рак». Не пожалейте 5 минут, прочтите информацию, представленную ниже. Возможно, это спасет жизнь вам или вашим близким. Это как раз тот случай, когда 5 минут могут стоить целой жизни.
Хронология ВПЧ и рака: 100 лет борьбы
История разработки первых скринингов и вакцин против ВПЧ насчитывает почти 100 лет. И кое-кто в мире уже сделал определенные выводы, поэтому активно внедряет профилактические меры. В числе таких стран – США и Англия.
Рассмотрим исторические факты.
1928 год. Доктор Джордж Папаниколау обнаружил, что раковые клетки шейки матки можно выявить с помощью анализа мазка из влагалища. Это открыло дорогу для создания первого в мире скринингового теста на рак шейки матки, известного сейчас как мазок Папаниколау. С его помощью определяют раковые клетки слизистой шейки и влагалища. Этот тест применяется и сейчас, в т.ч. и в России.
1943 год. Пап-тест представлен в кабинетах гинекологов. Он помогает врачам выявлять и лечить рак шейки матки и предраковые заболевания, прежде чем злокачественная опухоль сможет распространиться на другие органы.
В течение следующих нескольких десятилетий pap-тест помогает предотвратить тысячи смертей в странах с высоким уровнем экономического развития. С момента первоначального введения, мазок Папаниколау привел к снижению уровня заболеваемости раком шейки матки во многих странах, например, в США примерно на 70%.
1983-1985 годы. Немецкие исследователи обнаружили, что большинство предраковых заболеваний шейки матки и рака содержат ВПЧ. В частности, они находят типы ВПЧ 16 или 18. Другие типы ВПЧ, также связанные с раком шейки матки, определены позднее, но 16 и 18 считаются наиболее рискованными. В 1980-х годах была установлена связь ВПЧ с раком анального отверстия, полового члена, влагалища и вульвы.
Анализ на впч
1990 год. Опубликованы первые исследования, подтверждающие связь типов ВПЧ 16 и 18 с раковыми заболеваниями ротоглотки.
1999 год. Широко распространенный, финансируемый Medicare, скрининг на рак шейки матки у женщин старше 65 лет приводит с 1990 года к снижению диагнозов этого рака на 19%. Скрининг позволил лучше выявить предраковые поражения, что привело к более раннему лечению и остановке развития рака.
1999 год. Тест ДНК HPV одобрен FDA (управление по контролю за качеством пищевых продуктов и медикаментов, федеральное агентство, США). Он отличается от мазка Папаниколау тем, что с его помощью можно установить присутствие ДНК ВПЧ высокого риска в ДНК клетки. Используя специальный аппарат, анализ мазка Папаниколау помогает найти аномальные изменения в клетке, которые можно увидеть через микроскоп.
Тест ДНК ВПЧ способен идентифицировать ДНК нескольких типов ВПЧ высокого риска. Использование ДНК-теста ВПЧ позволяет обнаружить инфекции ВПЧ, которые могут вызвать клеточные аномалии, даже до того, как эти отклонения становятся видимыми.
Тест на ВПЧ в настоящее время одобрен для использования для женщин старше 25 лет без необходимости проведения параллельного теста на Папаниколау, а также для женщин любого возраста, у которых получен неоднозначный результат Pap-тестирования.
Используемый отдельно тест на ВПЧ поможет определить необходимость дополнительного исследования или скрининга.
ДНК-тест HPV лучше обнаруживает предраковые заболевания, чем pap-тест, но также может дать ложный результат. В сочетании, тесты на ДНК и Пап – отличный инструмент для выявления предракового риска. В 2014 году FDA одобрило тест ДНК HPV, который используется отдельно для выявления предраковых состояний и определения необходимости дополнительного тестирования.
2006 год. FDA одобряет Гардасил, первую вакцину, защищающую от ВПЧ. Эта первая версия Gardasil предотвращает инфицирование HPV 16 и 18, двумя штаммами высокого онкогенного риска, которые вызывают большинство раковых заболеваний: анального, вагинального, вульварного, ротоглоточного, полового члена и шейки матки.
Препарат одобрен для использования женщинами и мужчинами в возрасте 9–26 лет, однако в настоящее время он рекомендуется только для девочек.
2008 год. В Великобритании одобрена вторая вакцина против ВПЧ 16 и 18 под названием Cervarix. Ее рекомендуют для молодых девушек в возрасте 9-25 лет.
2009 год. В США одобрен Церварикс. Его рекомендуют для женщин в возрасте 10-25 лет. Также в США для предотвращения развития генитальных бородавок одобрен Гардасил. Его разрешают применять в возрасте от 9 до 26 лет.
2010 год. Фонд Анального Рака демонстрирует перед FDA важность и необходимость предотвращения анального рака. FDA для профилактики анального рака одобряет Гардасил.
2011 год. В США Gardasil рекомендуется для прививания абсолютно всех детей – мальчиков и девочек – в возрасте 11-12 лет. Это означает, что он рекомендуется как плановая прививка, наряду с другими вакцинами для подростков.
По мнению врачей, также должны быть вакцинированы до достижения возраста 26 лет мужчины, имеющие половые контакты с лицами своего пола и мужчины с ослабленным иммунитетом.
2012 год. Министерство здравоохранения Великобритании одобряет Гардасил и заменяет Церварикс в национальной программе иммунизации.
2013 год. В США президентская группа по борьбе с раком публикует отчет, призывающий увеличить применение вакцин. Группа ученых отмечает, что полный охват вакцинацией среди девочек-подростков в 2012 году составил лишь 33,4%. Среди мальчиков охват был еще хуже – всего 6,8%. Такие низкие показатели – серьезная угроза прогрессу в борьбе с раком.
Ученые заявляют, что необходимо поддержать вакцинацию как неотложную национальную и глобальную приоритетную задачу в области здравоохранения. Национальная программа борьбы с раком США имеет беспрецедентную возможность внести свой вклад в предотвращение миллионов предотвратимых раковых заболеваний и другие условия у мужчин и женщин во всем мире.
2014 год. Начинается глобальное ANCHOR исследование. Цель исследования: определить наиболее эффективный способ определения и лечения плоскоклеточных внутриэпителиальных поражений (HSIL) у ВИЧ-положительных мужчин и женщин. Это исследование до сих пор активно набирает участников.
Фонд Анального Рака надеется, что однажды анализ анального мазка по Папаниколау станет такой же обычной, привычной диагностикой, как сегодня Pap-тест шейки матки. Исследование ANCHOR – это первый шаг к этому дню и спасению тысяч жизней во всем мире.
Также в 2014 году FDA одобрило использование третьей вакцины, Гардасил 9, для применения у женщин в возрасте 9–26 лет и мужчин в возрасте 9–15 лет. Знак «9» был добавлен, поскольку эта вакцина обеспечивает защиту от девяти различных штаммов ВПЧ: типы 6, 11, 16, 18, 31, 33, 45, 52 и 58. Как и Гардасил, Гардасил 9 защищает от анального, шейного, вульварного и рака влагалища и от генитальных бородавок.
2018 год. Объединенный комитет по вакцинации и иммунизации (JCVI) рекомендовал включение мальчиков в программу вакцинации против ВПЧ в Великобритании с сентября 2019 года.
2019 год. В Великобритании всем 12- и 13-летним школьникам будет предложена вакцинация против ВПЧ в рамках NHS (национальная программа вакцинации).
Выводы. Они будут жить. А мы? Решать нам!
Вакцина от ВПЧ входит в национальные календари прививок в большинстве стран Западной Европы, странах Африки,в Узбекистане, в Австралии, США и других. По состоянию на октябрь 2019 года ввели HPV-вакцину в национальные графики 100 стран.
К сожалению, в нашей стране HPV-вакцина не включена в национальный календарь прививок, поэтому вакцинация проводится только за счет личных средств граждан. Прививки делаются в 59 регионах России (по состоянию на 2018 год).
Делать прививки против ВПЧ или нет – решать вам. Также только вы можете решить, сдавать ли анализы на ВПЧ в профилактических целях или ждать пока о себе дадут знать симптомы опаснейшего заболевания. Мы надеемся, что победит чувство самосохранения и здравый смысл!
Что такое папилломавирусная инфекция (ВПЧ)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Борисовой Элины Вячеславовны, гинеколога со стажем в 35 лет.
Над статьей доктора Борисовой Элины Вячеславовны работали литературный редактор Юлия Липовская , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Папилломавирусная инфекция — это состояние, развивающееся при заражении какой-либо разновидностью вируса папилломы человека (ВПЧ). Возбудители данной группы могут существовать только в человеческом организме, поражая кожу и слизистые оболочки, приводя к появлению папиллом, бородавок, плоских и остроконечных кондилом. [1] [2] [4]
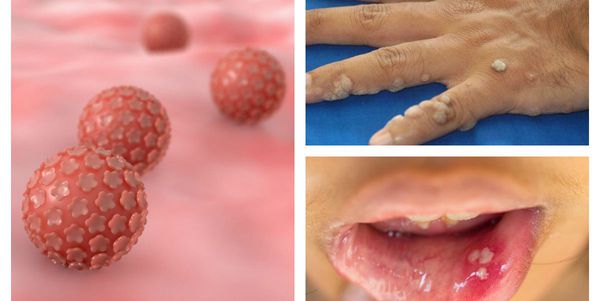
ВПЧ довольно широко распространён в человеческой популяции, особенно среди сексуально активных людей, а это свыше 80% всего населения. До недавнего времени вирусы этой группы считались относительно безобидными, вызывающими лишь косметические дефекты, но последние научные исследования показывают, что проблема гораздо серьёзнее. [9]
На сегодняшний день науке известно несколько сотен штаммов (типов) папилломавирусов . Около 40 из них преимущественно поражают аногенитальную область и передаются половым путём. Особую опасность представляют штаммы высокого онкогенного риска, так как они могут спровоцировать развитие онкологических заболеваний, в том числе рака шейки матки.
Чаще всего заражение происходит в молодом возрасте, как правило, с началом половой жизни, при этом возможно неоднократное инфицирование. Наиболее уязвимой группой в плане вероятности заражения ВПЧ и развития неблагоприятных последствий являются молодые женщины в возрасте 15-30 лет.
Помимо этого ВПЧ может перейти от инфицированной матери к ребёнку, например, при родах. Не исключается и контактно-бытовой способ передачи возбудителя, например, при соприкосновениях и даже при совместном использовании предметов личной гигиены.
К факторам риска, способствующим заражению ВПЧ, развитию хронической папилломавирусной инфекции и её переходу в предраковые состояния с потенциальным перерождением в злокачественную опухоль, относятся:
- иммунодефицит любого происхождения, в том числе вследствие ВИЧ-инфекции, лучевых поражений, применения иммунодепрессантов при трансплантации органов и тканей, лечения цитостатиками и других причин;
- подавленное состояние иммунитета во время беременности;
- раннее начало половой жизни;
- частая смена половых партнёров, незащищённый секс;
- инфицированность высокоонкогенными штаммами ВПЧ;
- заражение одновременно несколькими типами ВПЧ;
- наличие других инфекций, передающихся половым путём, например, герпесвирусной и цитомегаловирусной инфекции, вируса Эпштейна — Барр, гепатитов В и С, гонореи и трихомониаза;
- стресс, истощение, гиповитаминоз, гормональный дисбаланс;
- многократные роды и аборты;
- тяжёлые хронические заболевания, в том числе сахарный диабет;
- вредные привычки (курение, злоупотребление спиртным);
- низкий социальный статус, плохие условия жизни, неудовлетворительная интимная гигиена;
- пренебрежение регулярными профилактическими обследованиями (один из важнейших факторов риска);
- низкий уровень развития медицины в регионе проживания.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы папилломавирусной инфекции
Далеко не всегда человек догадывается о наличии в своём организме папилломавирусной инфекции, оставаясь при этом источником заражения для потенциальных партнёров. [1] [2] Дело в том, что заболевание может долгое время протекать бессимптомно: вирус скрыто существует в организме от нескольких месяцев до нескольких лет, никак себя не проявляя. Кроме того, уже имеющиеся проявления инфекции не всегда доступны для наружного обзора. Например, если папилломы, бородавки и кондиломы на открытых участках тела и поверхности гениталий ещё можно заметить самостоятельно, то патологические изменения, локализующиеся на шейке матки, сможет обнаружить только специалист в ходе осмотра с применением соответствующих инструментов.
И всё же существует несколько симптомов, которые прямо или косвенно могут указывать на наличие папилломавирусной инфекции и её неблагоприятных последствий. [3] К ним относятся:
- появление на коже и/или слизистых оболочках каких-либо разрастаний различных форм (на тонкой ножке или с широким основанием, нитевидной, округлой или плоской конфигурации, в форме цветной капусты или петушиного гребня) и размеров (от образований в несколько миллиметров до разрастаний, занимающих всю промежность);
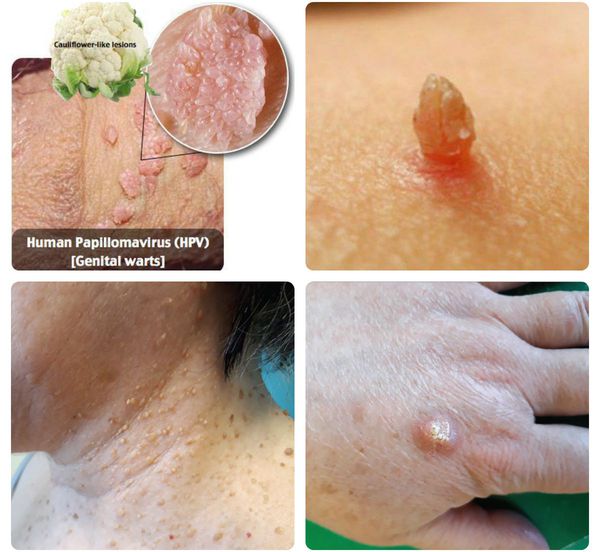
- отёчность и воспалительная инфильтрация папилломатозных разрастаний (остроконечных кондилом), их ранимость и кровоточивость, что приводит к присоединению вторичной инфекции с появлением гнойного отделяемого с неприятным запахом;
- зуд, жжение, мокнутие в области промежности, появление обильных белей, даже при отсутствии видимых патологических образований;
- межменструальные кровянистые выделения, в том числе появляющиеся в результате полового контакта:
- дискомфорт во время полового акта.
Наиболее тревожными признаками заболевания являются:
- постоянные боли в области спины и таза;
- слабость;
- беспричинная потеря веса;
- опухание одной или обеих ног.
Патогенез папилломавирусной инфекции
Заражение папилломавирусной инфекцией происходит при попадании вирусных частиц на кожу или слизистую оболочку. [1] [2] Излюбленная локализация инфекции на теле женщины — промежность, большие и малые половые губы, вульва, влагалище и шейка матки, у мужчин — половой член. Может также произойти поражение слизистой полости рта, пищевода, мочевого пузыря, трахеи, конъюнктивы и других органов и тканей.
Заражению способствуют микротравмы и потёртости. Особенно благоприятные для инфицирования условия создаются при половом акте. В 60–80% случаев достаточно однократного сексуального контакта с больным папилломавирусной инфекцией или бессимптомным носителем ВПЧ. К развитию заболевания может привести попадание в организм буквально единичных вирусных частиц.
При наличии предрасполагающих факторов (микроповреждения, слабого иммунитета и других) возбудитель проникает в эпителиальную ткань до её базального слоя. Там он прикрепляется к оболочке незрелой клетки и внедряется сначала в её цитоплазму, а затем и в ядро, где повреждает генетический аппарат. После этого начинается деление клеток с изменённым геномом, что приводит к появлению в месте внедрения вируса генитальных кондилом (образований, которые постепенно разрастаются), а, например, на шейке матки — к развитию диспластических процессов различной степени тяжести (дисплазия шейки матки).
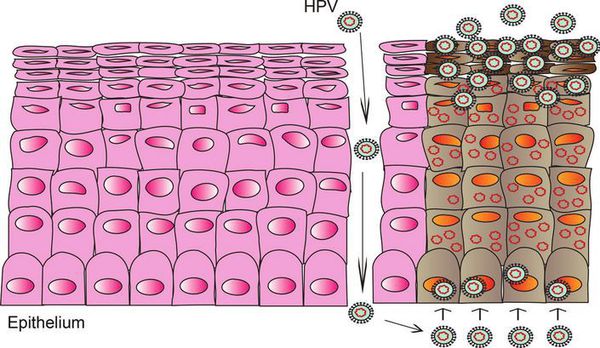
В случае ВПЧ высокого онкогенного риска определённые гены в вирусной ДНК кодируют синтез специфических белков-онкопротеинов (Е6 и Е7), которые подавляют противораковую защиту клеток. Под действием онкопротеинов нарушается стабильность генома клеток, стимулируется их размножение и снижается способность к дифференцировке — всё это со временем может привести к онкопатологии. [12]
Формирование новых полноценных вирусных частиц, способных инфицировать другого человека, происходит уже не в базальном, а в самых поверхностных слоях поражённого эпителия. Возбудитель может содержаться в слущивающихся отмирающих клетках, которые отделаются слизистой оболочкой. Таким образом они переходят к новому хозяину при тесном (сексуальном или бытовом) контакте.
Классификация и стадии развития папилломавирусной инфекции
По способности индуцировать развитие злокачественных новообразований ВПЧ подразделяют на четыре группы: [8]
- неонкогенные штаммы ВПЧ (типы 1-5);
- ВПЧ низкого онкогенного риска (типы 6, 11, 40, 42-44, 54, 61, 70, 72, 81);
- ВПЧ среднего онкогенного риска (типы 26, 31, 33, 35, 51-53, 58, 66);
- ВПЧ высокого онкогенного риска (типы 16, 18, 39, 45, 56, 59, 68, 73, 82).
Клинические формы папилломавирусной инфекции: [5]
- латентная — скрытая форма, не имеющая клинических и морфологических признаков, но обнаруживаемая иммунохимическими и молекулярно-биологическими методами;
- субклиническая — возникает у лиц с нормальным иммунитетом, определяется только специальными диагностическими методами (пробы с растворами-индикаторами, гистологические и цитологические исследования);
- манифестная — появляется у лиц с временным или стойким снижением иммунитета, в случае генитальной папилломавирусной инфекции характеризуется появлением кондилом.
Латентная инфекция может переходить в субклиническую и манифестную форму в случае возникновения предрасполагающих условий (факторов риска), но чаще всего она протекает бессимптомно, не манифестируя.
Клинические проявления папилломавирусной инфекции:
- кожные поражения: подошвенные, плоские и обычные (вульгарные) бородавки, бородавчатая эпидермодисплазия, бородавки Бютчера и небородавчатые поражения кожи;
- поражения слизистых оболочек гениталий: кондиломы, некондиломатозные поражения, карциномы;
- поражения слизистых вне гениталий: папилломатоз гортани, карциномы шеи, языка и другое.
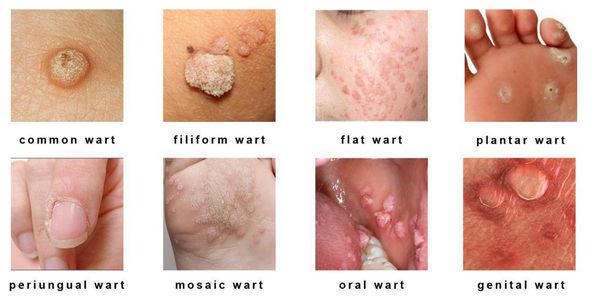
Разновидности поражений:
- экзофитные — видимые разрастания в виде папиллом и бородавок;
- эндофитные — образования, располагающиеся в толще ткани, которые не видны невооружённым глазом.
Осложнения папилломавирусной инфекции
Основными наиболее опасными осложнениями папилломавирусной инфекции являются злокачественные новообразования. Но возможны и другие серьёзные последствия:
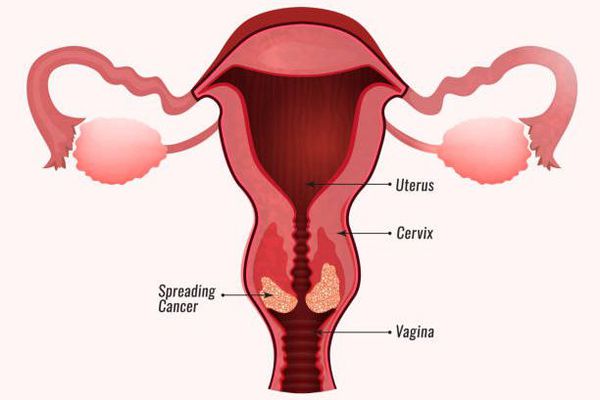
- Злокачественные новообразования заднего прохода, вульвы, полового члена и ротоглотки. Повышение риска их развития также связывают с высокоонкогенными штаммами ВПЧ. [6]
- Остроконечные кондиломы на гениталиях, папилломатоз верхних дыхательных путей (рецидивирующий респираторный папилломатоз, веррукозный ларингит). Причиной возникновения могут стать 6-й и 11-й типы вируса, несмотря на свой низкий онкогенный риск. В случае папилломатоза есть вероятность полной потери голоса, обструкции (перекрытия) гортани с развитием асфиксии. Это довольно редкое заболевание может возникать у детей, рождённых женщинами с папилломавирусной инфекцией. По разным данным, заражение может происходить как во время родов, так и внутриутробно. Как правило, респираторный папилломатоз начинает проявляться в детском и подростковом возрасте, он склонен к неоднократным рецидивам после удаления множественных папиллом, перекрывающих дыхательные пути.
- Гнойно-септические осложнения. Папилломатозные разрастания на слизистых оболочках очень ранимы, легко травмируются, и через участки мокнутия, расчёсов и потёртостей может проникать вторичная инфекция, которая в свою очередь и вызывает нагноение.
Диагностика папилломавирусной инфекции
Основные цели диагностических мероприятий: [3]
- ранняя диагностика папилломавирусной инфекции для динамического наблюдения и лечения;
- своевременное обнаружение и лечение предраковых изменений, что позволяет на 80% предотвратить развитие злокачественных новообразований;
- выявление онкологических новообразований на ранних стадиях, что в большинстве случаев даёт хороший прогноз эффективного излечения;
- решение вопроса о целесообразности вакцинации.
Для выявления папилломавирусной инфекции на сегодняшний день существует целый комплекс диагностических процедур:
- Гинекологический осмотр в зеркалах — позволяет увидеть папилломатозные разрастания (аногенитальные кондиломы) и другие изменения.
- Классический тест Папаниколау (мазки с поверхности шейки матки и стенок влагалища для цитологического исследования) — обнаруживает ранние признаки дисплазии и злокачественного перерождения.
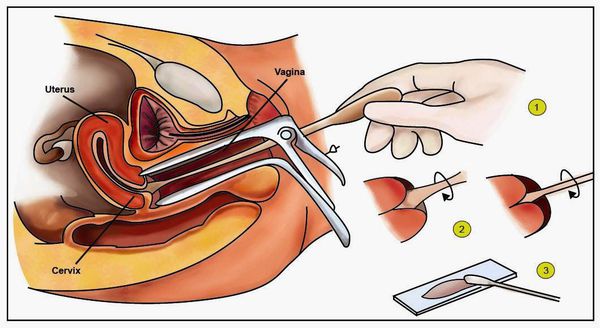
- Пробы с уксусной кислотой и раствором Люголя — выявляют участки поражения слизистой шейки матки.
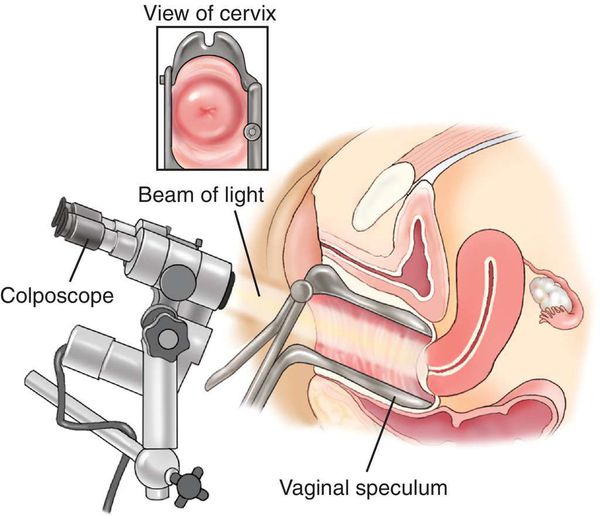
- Кольпоскопия, в том числе с биопсией подозрительных участков и их гистологическим исследованием, — определяет характер имеющегося новообразования.
- Иммунофлюоресцентный анализ (ИФА) обнаруживает в цервикальном соскобе онкопротеины (Е7 и Е6). Этот метод достаточно новый, с его помощью можно различить носительство ВПЧ и первые признаки злокачественного перерождения в клетках, [12] оценить агрессивность данного процесса, сделать предположения относительно прогноза заболевания.
- Полимеразная цепная реакция (ПЦР) находит вирусную ДНК в биологическом материале (соскоб со слизистой), определяет тип ВПЧ, степень его онкогенности, а также количество вирусных частиц, что косвенно позволяет судить о характере течения папилломавирусной инфекции у данного пациента, возможности спонтанного излечения или высокого риска прогрессирования. Обнаружение ВПЧ с помощью этого возможно даже при латентном течении болезни, когда цитологические и гистологические методы не эффективны.
Целесообразно дополнительное обследование пациента на наличие других инфекций, передающихся половым путём, так как папилломавирус в 90% случаев с ними сочетается, и это может осложнять течение заболевания.
Лечение папилломавирусной инфекции
Лечение папилломавирусной инфекции должно быть комплексным и включать следующие составляющие: [3] [5]
- деструкцию (удаление) видимых проявлений (аногенитальных кондилом и др.);
- иммуномодулирующую терапию;
- противовирусную терапию;
- лечение сопутствующих инфекций, передающихся половым путём.
Деструктивные методы делятся на две основные группы:
- химические — с применением трихлоруксусной кислоты, а также таких препаратов, как "Солкодерм", "Колломак", "Ферезол" и др.;
- физические — хирургическое удаление, электрокоагуляция, криодеструкция, радиоволновая и плазменная коагуляция, лазеротерапия.
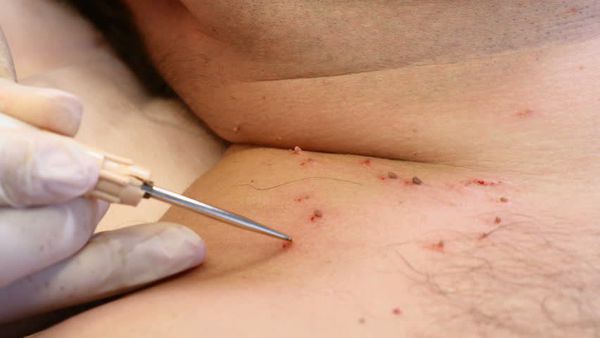
Лечение сопутствующих половых инфекций проводят до начала деструктивной терапии на фоне адекватной иммунокоррекции.
Удаление видимых проявлений папилломавирусной инфекции должно сочетаться с противовирусной терапией — как с общей, так и с применением препаратов местного действия после удаления кондилом.
Следует помнить, что успешно проведённое лечение не исключает развитие рецидивов в дальнейшем, особенно у пациентов с нарушениями иммунитета. Поэтому за ними устанавливается динамическое наблюдение в течение как минимум 1-2 лет.
Прогноз. Профилактика
В 90% случаев здоровая иммунная система человека справляется с папилломавирусной инфекцией самостоятельно за период от полугода до двух лет с момента инфицирования, после чего происходит полное выздоровление с исчезновением вируса из организма. При этом не формируется напряжённого пожизненного иммунитета, то есть человек может заразиться повторно.
В других случаях, при наличии предрасполагающих факторов, заболевание приобретает хроническую форму, склонную к длительному скрытому течению с периодическими рецидивами и возможным развитием тяжёлых осложнений.
От момента попадания вируса в организм до развития предраковых состояний и тем более возникновения рака может пройти достаточно много времени, иногда десятки лет. Поэтому регулярные профилактические обследования, своевременное выявление и лечение предраковых состояний — вполне реальный и эффективный способ избежать самого неблагоприятного варианта развития событий. [13] С этой целью Всемирная организация здравоохранения рекомендует всем женщинам старше 30 лет при первичном скрининге проходить не только “рутинное” цитологическое исследование, но и делать тест на наличие ВПЧ. [10]
Регулярное посещение гинеколога (при отсутствии каких-либо жалоб — раз в год) с проведением теста Папаниколау позволяет своевременно обнаружить начальные признаки дисплазии и предпринять все необходимые меры для предотвращения прогрессирования процесса и его перехода в онкологическое заболевание.
Использование методов барьерной контрацепции хоть и не полностью защищает от инфицирования, но несколько снижает его вероятность.
Главным методом первичной профилактики папилломавирусной инфекции считается вакцинация. [11] Современные вакцины разработаны с целью защиты от наиболее опасных, высокоонкогенных штаммов ВПЧ, ответственных за 70-80% случаев развития рака шейки матки. Стандартный курс, состоящий из трёх прививок, даёт вполне надёжную защиту.
Читайте также:


