Какой слой эпидермиса появляется после 12 лет
Обновлено: 18.04.2024
Для цитирования: Аравийская Е.Р. Возрастные изменения в дерме: новые сведения и пути коррекции с помощью средств для ежедневного ухода. РМЖ. 2008;8:574.
Возрастные изменения кожи и их коррекция являются важной проблемой современной дерматологии и косметологии. Для коррекции возрастных изменений общеприняты наружные средства для ежедневного ухода, различные косметические процедуры (пилинги, маски, массаж и др.), методики аппаратной косметологии, инъекционные методы, пластическая хирургия. При современном развитии науки постоянно появляются и совершенствуются все новые и новые методики борьбы со старением кожи.
Большинство исследователей в сфере возрастных изменений кожи выделяют хронологическое (физиологическое, естественное) старение, менопаузальное старение и фотостарение. Хронологическое и менопаузальное старение некоторые авторы объединяют общим термином – биологическое старение [5,9–11]. Отмечается сочетанность и неравномерность проявлений указанных видов старения у разных людей [5]. К настоящему времени накоплены сведения о комплексе морфологических изменений в коже. Наиболее существенные изменения при любом виде старения кожи касаются изменений в дерме: со стороны клеток, основного вещества и волокнистых структур.
При биологическом старении отмечают уменьшение численности и размеров различных клеточных элементов: фибробластов, гистиоцитов и тучных клеток. Показано также снижение пролиферативной активности основных ключевых клеток дермы – фибробластов. При этом исследователи отмечают их меньшую восприимчивость к факторам роста [13]. Снижается и синтетической активность фибробластов в отношении продукции ими белков коллагена и эластина, а также компонентов аморфного вещества соединительной ткани дермы [7,10,12,13]. Описана также спонтанная контракция фибробластов дермы под влиянием импульсов от сокращающихся поперечнополосатых мышц лица. Было показано, что фибробласты дермы способны на сокращение, аналогичное мышечным клеткам, благодаря наличию в них небольшого, по сравнению с миоцитами, количества тонофиламентов [4]. При этом происходит выделение кальция в эндоплазматическом ретикулюме, под влиянием которого тонофиламенты фибробласта подвергаются сокращению. Сократившийся фиброфласт подтягивает за собой сложную сеть волокнистых структур дермы и эпидермис, исходом чего являются постоянно нарастающие дегенеративно–дистрофические изменения в этих участках кожи. Таким образом, становится понятным, что мимическая морщина формируется из–за своеобразного постоянного «механического стресса» в области дермы. Не случайно некоторые исследователи выделяют особый вид старения – миостарение [10].
При биологическом старении постепенно происходит истончение дермы за счет уменьшения объема основного вещества, коллагеновых и эластических волокон [2,7,15]. Основным возрастным изменением соединительной ткани является уменьшение воды и соотношения «основное вещество – волокна». Уменьшение этого соотношения связано со снижением концентрации гликозоаминогликанов (ГАГ). Отмечено также, что с возрастом изменяются количественные соотношения между отдельным гликанами: гиалуроновой кислотой, хондроитин–6–сульфатом, гепарином и геперан–сульфатом [3,4]. Известно, что первые возрастные изменения ассоциированы со снижением содержания гиалуроновой кислоты. Подчеркивают, что ранние изменения ГАГ возникают на фоне хронического ультрафиолетового воздействия [14,16,18]. Было показано, что связанные с возрастом существенные изменения ГАГ регистрируются после 35–40 лет и достигают своего максимума в период менопаузы. Одновременно отмечают постепенное увеличение количества хондроитинсульфата в сетчатом слое дермы [2,11]. Вместе с тем, было показано снижение его экспрессии в сосочковом слое дермы, особенно в глубине морщин в возрасте после 50 лет [14]. Описанные изменения со стороны основного вещества дермы приводят к уменьшению гидратации, тургора и эластичности кожи, способствуют сухости и образованию морщин [14,17].
Еще в начале прошлого столетия ученые отметили, что начальные признаки возрастных изменений кожи взаимосвязаны с разрушением эластических волокон, а более отсроченные – как эластических, так и коллагеновых [6,7]. К настоящему времени накоплены обширные сведения о состоянии волокнистых структур дермы при старении кожи. Известно, что происходит изменение физико–химических свойств коллагена: снижение содержания растворимых фракций, увеличение числа и прочности интра– и интермолекулярных поперечных связей, снижение эластичности и способности к набуханию, а также продукции тканевых ингибиторов металлопротеиназ [2,4,9,15]. Имеются указания на снижение растворимости молекул коллагена и изменение их механических качеств [13,14]. Описано изменение соотношения различных типов коллагена: увеличение коллагена III типа и снижение коллагена I типа [2,10]. С возрастом исчезает упорядоченность ориентации коллагеновых волокон, характерная для молодой кожи [2,15]. Именно указанные изменения приводят к появлению сначала поверхностных, а затем – более глубоких морщин. Снижение эластичности коллагеновых волокон и способности коллагена к набуханию являются причиной стойкого отпечатывания «подушки» на лице после сна [4]. Меньше сведений накоплено о состоянии эластических волокнистых структур. К настоящему моменту известно, что эластические волокна, отвечающие за эластичность кожи, подразделяются на три разновидности: окситалановые, элауниновые и истинные эластические волокна. Их отличает толщина и глубина расположения [4,8]. Окситалановые эластические волокна являются самыми тонкими и располагаются перпендикулярно поверхности кожи непосредственно под эпидермисом. Их разрушение проявляется клинически формированием поверхностных морщин. Расположенные параллельно поверхности коже глубже в дерме элауниновые и истинные эластические волокна ориентированы вдоль линий Лангера. Именно поэтому в классической хирургии рекомендуют производить операционные разрезы вдоль линий натяжения кожи. Разрушение данного типа волокон приводит к более глубоким морщинам [14,17].
Было показано, что каждый человек после 40 лет теряет до 1% волокон в год. А в период менопаузы этот процент увеличивается до 2 [10]. Повышенное разрушение волокнистых структур обусловлено повышенной активностью эластаз и коллагеназ, или матриксных металлопротеиназ (Matrix Metallo Proteinases, MMP). Эти энзимы продуцируются самими фибробластами [4].
Одновременно при старении выявляют существенные изменения со стороны кровеносных сосудов и придатков кожи [15]. Так, отмечено уменьшение вертикальных капиллярных петель в сосочковом слое дермы, а также венул [2,15]. Уменьшение численности венул связывают со снижением синтеза гепарина тучными клетками дермы, обладающего выраженными ангиогенными свойствами [11]. Количество и функциональная активность эккринных потовых желез снижается. Кроме того, регистрируют снижение продукции кожного сала сальными железами при одновременном их увеличении в размерах [2,15]. Изменения со стороны морфологии и функции желез приводит к сухости кожи, а также к изменению состава гидролипидной мантии, что, в свою очередь, приводит к нарушению барьерных свойств кожи [18].
Специализированный базовый уход за кожей играет существенную роль в профилактике и коррекции возрастных изменений кожи [1,5,10,11,18]. Он включает бережное очищение и адекватное увлажнение. Для ежедневного очищения наиболее приемлемыми считают различные синтетические детергенты, имеющие рН, соответствующий нормальной кислотности кожи, мыла, содержащие большое количество жиров, а также специально предназначенные для этого эмульсии. При уходе за кожей советуют применять современные эмульсионные увлажняющие кремы [1].
В препараты для базового ухода включают различные средства, действующие на те или иные возрастные изменения. Так, для коррекции дегидратации кожи в современные наружные средства вводят биосовместимые хумиктанты: гиалуроновую кислоту, ДНК, гликаны, полисахариды и другие агенты. Учитывая высокий молекулярный вес перечисленных компонентов, с помощью высоких технологий их денатурируют, фрагментируют, помещают внутрь липосом [1,10,11]. С целью восполнения барьерных свойств кожи актуально включение в ежедневные средства керамидов, их предшественников (сфингоидные основания), а также ненасыщенных жирных кислот, принимающих участие в синтезе керамидов. С целью восстановления нормальной текстуры кожи используют вещества с отшелушивающим действием, как правило, различные кислоты или производные ретинола [10,18].
При мимических морщинах широко используют кремы для ежедневного ухода за кожей с эффектом ботулинического токсина. Их действие, в основном, направлено на прекращение выделения кальция в эндоплазматическом ретикулюме фибробласта (с этой целью, как правило, используют антагонисты Ca – ионы Mg) или на замедление выделения энергии, необходимой для образования актомиозинового комплекса (например, аденозин).
При менопаузальном старении используют, помимо адекватного увлажнения и восполнения барьерных свойств кожи, средства, стимулирующие пролиферативную активность базальных кератиноцитов и фибробластов. С такой целью их состав включают фитоэстрогены и другие агенты, которые способны распознаваться ключевыми клетками эпидермиса и дермы как собственные факторы роста [1,10,12].
Одним из современных направлений является включение в состав наружных средств комплекса активных компонентов – антиэластаз и антиметаллопротеиназ, способных препятствовать разрушению волокон дермы под действием соответствующих энзимов. Известно, что витамин А и его производные способны тормозить активность коллагеназ, поэтому средства, содержащие указанные ингредиенты имеют и эту точку приложения [10].
Благодаря детальному изучению описанных механизмов старения кожи, учеными из Лабораторий Виши (Франция) удалось создать гамму средств для коррекции возрастных изменениий – Лифтактив PRO. В состав гаммы входят дневной крем, дневной крем для сухой кожи, ночной крем, крем для контура глаз, уже хорошо известные специалистам. Недавно в аптеках появилось новое средство для коррекции возрастных изменений – Интенсивный Уход Лифтактив PRO[С+]. Все средства гаммы Лифтактив PRO содержат «Фиброцикламид®» – уникальный комплекс активных ингредиентов. В многокомпонентный состав Фиброцикламида® включены вещества, как стимулирующие синтетическую активность фибробластов, так и препятствующие разрушению волокон дермы. Так, например, стимулируют синтетическую активность фибробластов компоненты Аминокин и Цитовитин. Вещество Аминокин является растительным производным, оно получено в лабораториях в процессе ферментации протеина сои – растения, хорошо известного своим противовозрастным действием [9–11]. Цитовитин является биотехнологическим компонентом, выделенным из культуры дрожжей. Доказанным протективным действием в отношении волокнистых структур дермы обладает Фермиксин – растительный компонент, экстракт японского гриба Шиитаке (Lentinus Edodes), обогащенный олигосахаридами и галактуроновой кислотой, обладающие свойствами хумиктантов [1,10]. Особым образом синтезированный псевдопептид ER 2947 имеет свойства антиэластазы. Важно также подчеркнуть, что все средства «Лифтактив PRO» содержат высококачественные увлажняющие компоненты, которые крайне необходимы для зрелой кожи. Это средства могут быть рекомендованы лицам с признаками как хронологического, так и менопаузального старения в качестве ежедневного базового ухода. Его используют два раза в день на очищенную кожу. Новый препарат Интенсивный Уход Лифтактив PRO[С+] имеет легкую текстуру и может назначаться как самостоятельно, так и наноситься под крем Лифтактив PRO.
Таким образом, последние разработки ученых в сфере дерматокосметологии открыли новые возможности в коррекции и профилактике возрастных изменений кожи. Следует еще раз подчеркнуть, что коррекция старения кожи должна быть комплексной и зависит от доминирующего вида старения, сопутствующих заболеваний, возраста и мотиваций пациентов.
Литература
1. Аравийская Е.Р. Коррекция возрастных изменений кожи: современные направления в средствах для ухода за кожей // В: Сборник статей научно–практического общества врачей косметологов Санкт–Петербурга, СПб МАПО, кафедра медицинской косметологии. – 2006. – вып. 7. – с. 32–33
2. Ахтямов С.Н., Бутов Ю.С. Практическая дерматокосметология: Учебное пособие. – М.: Медицина, 2003. – 400 с.
3. Березов Т.Т., Коровин Б.Ф. Биологическая химия: Учебник / Под ред. С.С.Дебова. – М.: Медицина, 1983. – 752 с.
4. Быков В.Л. Частная гистология (краткий обзорный курс). – СПб.: АНТ–М, 1994. – 252 с.
5. Кольгуненко И.И. Основы геронтокосметологии. – М: Из–во «Медицина», 1974.
6. Никольский П.В. Болезни кожи. – М.–Л., 1928.
7. Подвысоцкая И.И. О некоторых региональных и индивидуальных особенностях строения старческой кожи. – Вестн дерматол венерол, 1962. – № 11. – С.15–21.
8. Соколовский Е.В., Аравийская Е.Р., Монахов К.Н. и соавт. Дерматовенерология: Учебник для студентов высших медицинских учебных заведений / Под ред. Е.В.Соколовского. – М.: Издательский центр «Академия», 2005. – 528 с.
9. Фержтек О. и соавт. Косметология. Теория и практика. Издание на русском языке. Изд–во Lekarske a Kosmeticke Centrum s.r.o., 2002. – 378 с.
10. Baran R., Maibach H.I. Textbook of cosmetic Dermatology. Martin Dunitz Ltd, 1998. – P.99–167.
11. Baumann L. Cosmetic dermatology. – New York: McGraw–Hill, 2002.
12. Brincat M., Kabalan S., Studd W.W. et al. A study of the decrease of skin collagen content, skin thikness and bone mass in the postmenopausal women // Gynekol Obstet. – 1987. – Vol.70. – P. 840–845.
13. Campisi J. Molecular mechanisms of intrinsic aging // Ann. Dermatol. Venereol. – 2002. – Vol. 129. – P. 1100.
14. Contet–Audonneau J.L. A histological study of human wrinkle structures. Comparison between sun–exposed areas of the face, with or without wrinkles, and sun–protected areas // Brit J Dermatol. – 1999. – Vol. 140, № 6. – P. 1038–1047.
15. Lever W.F., Shaumburg–Lever I. Histopathology of the skin. 5–th edition – J.B.Lippincot Company, 1975. – 793 p.
16. Rougier A., Schaefer H. Protection of the skin against ultraviolet radiations / John Libbey Eurotext, Paris, 1998. – 211 p.
17. Spencer S.K., Kierland R.K. The aging skin problems and their causes / Geriatrics, 1970. – Vol. 25. – P.81.
18. Wilkinson J.D. The skin as a chemical barrier. In: The Physical Nature of the Skin / Marks R.M., Barton S.P., Edwards C. eds. – MPT Press, 1988. – P. 73–78.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.

Кожа ребенка, как и взрослого человека, состоит из эпидермы, дермы (собственно кожи) и гиподермы (подкожной клетчатки). Однако по своим морфологическим и функциональным особенностям она отличается значительным своеобразием, особенно у детей раннего возраста.
Хороший детский дерматолог Москва — поликлиника «Маркушка».
Эпидермис имеет очень тонкий роговой слой, состоящий из 2-3 рядов слабо связанных между собой и слущивающихся клеток, и активно разрастающийся основной слой. Основная перепонка, разделяющая эпидермис и дерму, у детей раннего возраста недоразвита, рыхла, вследствие чего при патологии эпидермис может отделяться от дермы пластами (десквамативная эритродермия). Для детской кожи особенно характерно хорошее кровенаполнение, связанное с густой сетью широких капилляров, что придает кожным покровам вначале ярко-розовый, затем нежно-розовый цвет.
Дерма состоит из сосочкового и ретикулярного слоев, в которых слабо развиты эластические, соединительнотканные и мышечные элементы.
Сальные, потовые железы у ребенка, волосы на голове новорожденных детей
Сальные железы у ребенка хорошо функционируют уже внутриутробно, образуя творожистую смазку, покрывающую его тело при рождении. У новорожденных и детей 1-го года жизни на коже лица заметны желтовато-белые точки — избыточное скопление секрета в кожных сальных железах. У детей, предрасположенных к экссудативному диатезу, на щеках образуется тонкая, так называемая молочная корка, а на волосистой части головы — гнейс (жирная себорея).
Потовые железы у новорожденных сформированы, но в течение первых 3-4 мес. жизни обнаруживается их некоторая функциональная недостаточность, что связано с несовершенством центра терморегуляции.
Волосы на голове новорожденных детей вполне развиты, но не имеют сердцевины, сменяются несколько раз на 1-м году жизни. Кожа на спине и плечах покрыта пушком, более выраженным у недоношенных. Брови и ресницы выражены слабо, рост их усиливается на 1-м году, а к 3-5 годам жизни они становятся, как у взрослых людей. Ногти обычно хорошо развиты и доходят до кончиков пальцев у доношенных новорожденных.
Подкожная жировая клетчатка у ребенка, детей
Состав подкожной жировой клетчатки у детей разных возрастов различен: у детей раннего возраста в ней содержится большее количество твердых жирных кислот (пальмитиновой и стеариновой) и меньше — жидкой олеиновой кислоты, что и обусловливает более плотный тургор тканей у детей 1 -го года жизни, более высокую точку плавления жира и наклонность к образованию локальных уплотнений и отека кожи и подкожной клетчатки с образованием склеремы и склередемы. Важно отметить, что состав подкожного жирового слоя у грудных детей близок по составу к жирам женского молока, поэтому они всасываются, минуя переваривание, в желудочно-кишечном тракте ребенка. Подкожный жир в различных частях тела ребенка имеет разный состав, чем и обусловлены своеобразие распределения и порядок накопления или исчезновения жирового слоя при похудении. Так, при накоплении жира отложение его происходит прежде всего на лице, потом на конечностях, туловище и затем на животе (здесь преобладают жидкие жирные кислоты). Исчезает подкожная клетчатка в обратном порядке.
Особенностью детей раннего возраста является наличие у них скоплений бурой жировой ткани в задней шейной области, супраилеоцекальной зоне, вокруг почек, в межлопаточном пространстве, вокруг магистральных сосудов. У доношенного новорожденного ее количество составляет около 1—3 % всей массы тела. Она обеспечивает более высокий уровень теплопродукции за счет так называемого несократительного термогенеза (не связанного с мышечным сокращением).
Малым количеством жировой клетчатки объясняется большая смещаемость внутренних органов у детей до 5-летнего возраста, так как только к этому возрасту увеличивается количество жира в грудной, брюшной полостях, в забрюшинном пространстве. Жировые клетки у детей раннего возраста мельче и содержат ядра, с возрастом они увеличиваются в размере, а ядра, наоборот, уменьшаются. Округлость форм тела у девочек обусловлена тем, что более 70 % жировой ткани приходится на подкожный жир, в то время как у мальчиков — лишь около 50 %.
Функции кожи у ребенка, детей: защитная, дыхательная, резорбционная
Функции кожи многообразны, но главная из них — защитная. У детей эта функция выражена слабо, о чем свидетельствуют легкая ранимость кожи, частая инфицируемость из-за недостаточной кератинизации рогового слоя и его тонкости, незрелости местного иммунитета (детский иммунолог — поликлиника «Маркушка») и обильного кровоснабжения. Эти особенности делают детскую кожу легкоранимой и склонной к воспалениям, в частности при плохом уходе (мокрые, грязные пеленки).
Дыхательная функция кожи у детей раннего возраста имеет большее значение, чем у взрослых. Кожа активно участвует в образовании ферментов, витаминов, биологически активных веществ. Тесно связаны между собой выделительная и терморегулирующая функции, которые становятся возможными лишь к 3—4 мес. при созревании нервных центров. До этого возраста плохая регуляция температуры тела связана с большой относительной поверхностью тела, хорошо развитой сетью сосудов, из-за чего новорожденный ребенок, особенно недоношенный, может легко перегреваться или переохлаждаться при недостаточном уходе.
Резорбционная функция кожи у детей раннего возраста повышена (тонкость рогового слоя, богатое кровоснабжение), в связи с чем следует осторожно применять лекарственные средства в мазях, кремах, пастах, так как накопление их может вызвать неблагоприятный эффект. Кожа является органом с многочисленными и разнообразными рецепторами, обеспечивающими осязательную, температурную, поверхностную болевую чувствительность.
Отеки кожи ребенка, детей
При осмотре кожи ребенка, детей обращается внимание на наличие отеков и их распространенность (на лице, веках, конечностях, общий отек или местный, истинный или слизистый).
Причины генерализованных отеков многообразны. К факторам, влияющим на развитие отеков, относятся: повышение гидростатического давления в сосудистом русле, что способствует усиленному пропотеванию жидкости через сосудистую стенку в межклеточное пространство (сердечная недостаточность — консультации детского кардиолога, портальная гипертензия, слипчивый перикардит, тромбофлебит и др.); снижение онкотического давления, обусловленное уменьшением содержания белка в сыворотке крови (нефротический синдром; общие отеки часто возникают при острых и хронических почечных заболеваниях, при сердечной недостаточности).
Развитию общего отека в случае сердечной недостаточности у детей предшествуют отечность нижних конечностей и увеличение печени. По мере развития декомпенсации отеки становятся более распространенными, сочетаются с накоплением жидкости в серозных полостях (плевральной, перикардиальной, брюшной). В отличие от отеков сердечного происхождения отеки при заболеваниях почек сначала возникают на лице, а затем захватывают все новые и новые участки кожи. Особенно массивные отеки наблюдаются при нефротической форме гломерулонефрита. Общие отеки алиментарного происхождения появляются при недостаточности в рационе белковой пищи (преимущественное питание мучной, углеводистой пищей), при общей дистрофии.
Алиментарные отеки могут появляться при тяжелых хронических заболеваниях (циррозе печени), при расстройствах процессов расщепления и всасывания в кишечнике (целиакии, дисахаридазной недостаточности и др.). Безбелковые отеки зависят от гидростатического давления, то есть более выражены в соответствующих частях тела, например, односторонний легочный отек у лежачих больных при вынужденном или предпочтительном положении.
Своеобразный отек кожи и подкожной жировой клетчатки наблюдается при гипотиреозе. Кожа при этом становится сухой и утолщенной, в надключичных ямках в виде «подушечек» располагаются муцинозные (слизистые) отеки. Стероидные отеки возникают при лечении кортикостероидами и АКТГ в высоких дозах, при синдроме Кушинга.
Распространенные отеки наблюдаются при отечной форме гемолитической болезни новорожденных.
Местные отеки, иногда массивные, наблюдаются после укусов насекомых, змей, особенно в тех случаях, когда ребенок имеет аллергическую настроенность (консультация детский аллерголог поликлиника «Маркушка»). Они возникают также вследствие ангионевротических расстройств, типичным проявлением которых является отек Квинке, локализующийся в любом месте: на губах, веках, ушных раковинах, языке, наружных половых органах и т.д. Реже отек Квинке локализуется в области голосовых связок, что приводит к синдрому острого стеноза гортани.
Изолированные отеки в области лица у детей бывают после приступов кашля при коклюше, после интенсивного растирания глаз. Известно, что локальная инфекция в области придаточных пазух носа, зубов, миндалин может вызвать затруднение оттока и застой лимфы в лимфатических узлах угла нижней челюсти и симулировать односторонний или двусторонний отек лица, который исчезает по мере стихания воспалительного процесса.
К редким причинам отека лица относятся начинающийся дерматомиозит, склеродермия и тромбоз кавернозного синуса. Наиболее часто в детской практике встречаются сердечные и почечные отеки.

К 2025 г. прогнозируемая продолжительность жизни в развитых странах достигнет 100 лет. Это приведет к увеличению численности пожилого населения, а значит, и частоты ассоциированных со старением заболеваний, в том числе кожных.
В возрасте 50+ в результате структурных изменений кожи начинает развиваться дисфункция эпидермиса, которая выражается в снижении гидратации рогового слоя, нарушении проницаемости барьера, повышении поверхностного рН. На этом фоне увеличивается риск развития или обостряются различные кожные патологии, в том числе атопический дерматит, контактный дерматит, зуд, ксероз.
В обзоре, выполненном группой специалистов под руководством Питера Элиаса, одного из начальников корнеотерапии, обсуждаются возрастные изменения эпидермиса, их связь с разными заболеваниями и способы профилактики и коррекции. Приводим часть перевода этого обзора.
Функции эпидермиса, меняющиеся с возрастом
На рисунке представлены все основные изменения эпидермиса, наблюдающиеся с возрастом. Остановимся на каждом из них подробнее.

Изменение барьерной функции
Оценка барьерной функции рогового слоя проводится путем измерения трансэпидермальной потери воды (ТЭПВ) — при нарушении барьера данный показатель резко возрастает.
У неповрежденной кожи средние нормальные значения ТЭПВ варьируют в зависимости от пола, участка тела, пигментации кожи. Что касается корреляции ТЭПВ с возрастом, то информации на эту тему не так много, и она в определенной степени противоречива. Так, в ряде работ говорится о том, что средние уровни ТЭПВ на некоторых участках тела у пожилых людей могут быть ниже, чем у молодых [1, 2], что на первый взгляд свидетельствует о более надежном барьере возрастной кожи. Вместе с тем в области декольте наблюдается возрастное увеличение ТЭПВ, что говорит об обратном [3]. На шее, предплечьях и кистях рук уровни ТЭПВ сопоставимы у молодых и пожилых женщин [3]. Также было установлено, что параметр ТЭПВ в среднем выше у пожилых женщин, чем у пожилых мужчин [4].
Несмотря на разбор результатов, ясно одно — уровни ТЭПВ в здоровой неповрежденной коже людей разного возраста хоть и несколько отличаются, но не настолько критично, чтобы говорить о патологическом нарушении барьерной функции при старении кожи. Однако возрастная проблема все же существует — после повреждения рогового слоя восстановление барьерной функции у пожилых людей происходит значительно медленнее по сравнению с более молодыми людьми. Этому есть объяснение, и оно заключается в биохимических и структурных изменениях в эпидермисе, которые проявляются с возрастом.
Напомним, что барьер проницаемости кожи локализован в роговом слое. Он состоит из корнеоцитов, заполненных кератином и окруженных белковым роговым конвертом, и чередующихся липидных и водных пластов, расположенных между корнеоцитами и регулирующих диффузию низкомолекулярных веществ через роговой слой. Функционирование барьера в значительной степени определяется количеством и качеством белковых и липидных компонентов, которые формируются в ходе созревания кератиноцитов и их финального превращения в корнеоциты.
Эпидермальный фактор роста. В эпидермисе стареющей кожи уровень эпидермального фактора роста снижается вместе с замедлением скорости деления базальных кератиноцитов. В то же время увеличивается число апоптозов кератиноцитов. Все эти приводит к истончению как живых слоев эпидермиса, так и рогового слоя [5, 6].
Ионы кальция. С возрастом наблюдается изменение градиента концентрации ионов кальция в эпидермисе — еще одного важного фактора, контролирующего деление и созревание кератиноцитов и формирование рогового слоя. Так, в базальном и шиповатом слоях эпидермиса пожилых людей концентрация кальция более высокая, что тормозит пролиферацию кератиноцитов [7, 8]. В гранулярном слое, напротив, уровень кальция падает, и это ухудшает созревание белков рогового слоя (филаггрин, лорикрин и др.) [9–11], что может привести к формированию дефектных корнеоцитов и изменению барьера проницаемости.
Межклеточные липидные пласты рогового слоя (липидный барьер). Что касается межклеточных липидных пластов, являющихся основой липидного барьера рогового слоя, то в них также выявляются возрастные изменения. Для формирования липидного барьера требуются холестерин, свободные жирные кислоты и церамиды примерно в равном молярном соотношении [12]. Эти липиды синтезируются кератиноцитами, и дефицит любого из них может привести к дефектам в барьерных структурах [13]. Исследования показали, что в «старом» роговом слое наблюдается снижение общего содержания липидов более чем на 30% по сравнению с «молодым» [2], что связано с ослаблением синтетической активности кератиноцитов — как в интактном состоянии, так и после острого повреждения. Аппликация смеси барьерных липидов может улучшить функцию барьера у пожилых людей, и это обстоятельство, в свою очередь, подтверждает наличие возрастной барьерной дисфункции [14].
рН рогового слоя. Одним из этапов формирования липидного барьера является ферментативное превращение предшественников липидов в барьерные липиды, и это превращение осуществляется уже вне кератиноцитов во внеклеточных пространствах рогового слоя [15]. Кроме ферментов, ответственных за липидный барьер, в роговом слое есть ферменты, обеспечивающие своевременное отшелушивание роговых чешуек путем разрушения корнеодесмосом (протеолитические ферменты). Все ферменты рогового слоя, как и любые другие ферменты, очень чувствительны к рН своего микроокружения. В роговом слое существует градиент рН — с кислого значения порядка 5,5 (гидролипидная мантия на поверхности кожи) к слабощелочному около 7,2 (на границе с гранулярным слоем). Таким образом, на разной глубине рогового слоя будет свой уровень рН, контролирующий работу ферментов на данной глубине (см. Вставку 1. — Прим. ред.).

С возрастом наблюдается тенденция к повышению поверхностного рН [16–17], что меняет градиент рН через роговой слой, и это сказывается на активности ферментов — протеолитические ферменты в середине и на поверхности рогового слоя при повышении рН активируются, что ускоряет отшелушивание. Напротив, ферменты, отвечающие за липидный барьер, при повышении рН угнетаются, что приводит к формированию измененного липидного барьера. Все это в совокупности приводит к ослаблению барьера проницаемости рогового слоя (см. Вставки 2 и 3. — Прим. ред.).


Аппликация препаратов с нейтральным рН задерживает восстановление барьера, напротив, подкисление рогового слоя ускоряет восстановление барьера как в молодой, так и в возрастной коже [18–20].
Глюкокортикоиды и кортизол. Биологическое старение сопровождается увеличением секреции глюкокортикоидов и повышением уровня кортизола в коже [5, 21]. Исследования показали, что системное или местное применение глюкокортикоидов тормозит пролиферацию кератиноцитов и ослабляет барьер [22]. В коже под действием 11β-гидроксистероиддегидрогеназы 1 кортизон превращается в активную форму — кортизол [23]. В возрастной коже активность этого фермента выше по сравнению с молодой [24], и это отрицательно сказывается на способности эпидермиса к восстановлению и формированию барьера [25]. Ингибирование 11β-гидроксистероиддегидрогеназы 1 не только корректирует вызванные глюкокортикоидами эпидермальные функциональные нарушения, но и способствует восстановлению структуры барьера [26, 27].
Другие факторы. Есть и другие факторы, связанные со старением изменения кожи, которые могут способствовать изменению функции эпидермиса. Например, по сравнению с молодым эпидермисом в стареющем эпидермисе наблюдается более чем 60% снижение уровня белка-антагониста рецептора ИЛ-1, а дефицит рецептора ИЛ-1α типа 1 задерживает восстановление барьера [28]. Напротив, как повышение экспрессии, так и введение ИЛ-1α укрепляет барьер как в стареющей коже, так и в коже плода [29, 30].
В стареющей коже также наблюдается снижение количества гиалуроновой кислоты. Исследования показали: местное применение гиалуроновой кислоты стимулирует дифференцировку кератиноцитов и выработку липидов, что приводит к усилению функции эпидермального барьера проницаемости как в молодой, так и в пожилой коже [31, 32].
Наконец, с возрастом наблюдается снижение экспрессии эпидермального аквапорина-3 — белка, формирующего водные каналы в мембране кератиноцитов и отвечающего за внутриклеточный водный баланс 34. Выключение гена, кодирующего аквапорин-3, задерживает восстановление барьера проницаемости [35]. Напротив, усиление экспрессии аквапорина-3 улучшает барьерную функцию [36].
Снижение гидратации рогового слоя
Примерно после 40 лет уровень гидратации рогового слоя начинает снижаться. Механизмы, лежащие в основе уменьшения гидратации рогового слоя в стареющей коже, можно объяснить дефицитом веществ, входящих в водорегулирующие и водоудерживающие его структуры.
Во-первых, в роговом слое стареющей кожи снижается количество барьерных липидов [2, 37], в том числе церамидов [38]. Их дефицит можно компенсировать путем перорального или местного применения церамидов, что приводит к повышению гидратации рогового слоя [39, 40].
Во-вторых, снижается уровень филаггрина [11] и его метаболитов, включая транс-урокановую и пироглутаминовую кислоты, входящие в состав натурального увлажняющего фактора (NMF). Аппликации этих веществ, а также и других компонентов NMF, таких как свободные аминокислоты, молочная кислота и мочевина, способствуют повышению гидратации рогового слоя.
В-третьих, в возрастной коже по сравнению с молодой ниже продукция себума в целом и глицерина в частности [16, 41]. Себум вместе с секретом потовых желез формирует гидролипидную мантию, регулирующую испарение воды с поверхности кожи. Если мантия нарушена, испарение усиливается, поэтому в себодефицитной коже наблюдается снижение гидратации рогового слоя, и аппликация препаратов, имитирующих гидролипидную мантию, помогает ее восстановить.
Наконец, в возрастном эпидермисе снижается уровень аквапорина-3 [33–35]. Это ухудшает движение воды в живых слоях эпидермиса и способствует развитию застойных явлений, на фоне которых тормозится деление и созревание кератиноцитов. Аквапориновые каналы могут активироваться в присутствии небольшого количества глицерина (несколько процентов) в окружающей среде [42], высокие концентрации глицерина (свыше 10%), напротив, ингибируют их работу.
Повышение pH поверхности кожи
Значение pH поверхности кожи человека в первые две недели жизни обычно выше, к 5–6-й нед оно снижается до среднего 5,5 [43]. После 55 лет pH поверхности кожи имеет тенденцию к повышению, и у людей старше 70 это повышение становится существенным [16, 18]. Нормальные значения pH поверхности кожи человека зависят от пола и участка тела [44].
Возрастное повышение рН поверхности кожи связано с несколькими факторами. Один из них — уменьшение продукции себума и, соответственно, количества триглицеридов [3, 16], из которых высвобождаются свободные жирные кислоты, подкисляющие гидролипидную мантию и поверхность рогового слоя [45]. В нижних слоях роговой слой подкисляется благодаря высвобождению свободных жирных кислот из фосфолипидов клеточных мембран под действием секреторной фосфолипазы 2 (sPLA2) [46], экспрессия которой заметно снижается с возрастом.
Натрий-водородный обменник 1 (NHE1) — еще один механизм, регулирующий градиент pH в роговом слое: при дефиците NHE1 pH поверхности кожи повышается [47]. В стареющей коже экспрессия NHE1 значительно ниже, чем в молодой коже, что может способствовать повышению поверхностного рН.
И наконец, в стареющей коже наблюдается низкий уровень экспрессии филаггрина [10], который может расщепляться до транс-урокановой кислоты по филаггрин-гистидин-урокановокислотному пути [48]. Урокановая кислота подкисляет роговой слой [49].
Узнать больше о последствиях возрастных изменений эпидермиса, а также подходах к улучшению эпидермальных функций в стареющей коже — что именно нужно делать, чтобы поддержать здоровье кожи, вы можете в полной версии статьи, опубликованной у журнале «Косметика и медицина» №4-2020. Журнал доступен в печатной и электронной версии. Рекомендуем — там еще много очень интересных материалов!
Литература:
© Wang Z., Man M.Q., Tienan L., et al. Aging-associated alterations in epidermal function and their clinical significance. Aging 2020; 12(6): 5551–5565. Перевод и публикация в сокращенном виде — в соответствии с лицензией Creative Commons Attribution License.

Нарушить барьерную функцию кожи можно разными путями. Например, как сейчас, — путем нарушения структуры гидролипидной мантии обработкой органическими растворителями (спирт) или ПАВ, посредством физического разрушения рогового слоя (пилинг, дермабразия, лазерная шлифовка). Есть еще один способ ослабить барьерные свойства кожи — изменить состав поверхностных липидов, что произойдет, например, в результате длительного ограничения приема пищевых жиров или продолжительного применения большого количества косметического масла (любого!).
Сразу же после физического повреждения рогового слоя скорость испарения воды с его поверхности резко возрастает. Затем в течение нескольких часов она постепенно снижается, что говорит о том, что барьерный слой снова восстанавливается. Если проследить всю динамику восстановления барьерной функции кожи, то можно видеть, что сначала восстановление идет довольно быстро. У человека барьерная функция восстанавливается на 60% через 12 ч, но полное восстановление занимает 72 ч. Считается, что быстрое восстановление происходит за счет массового выброса из гранулярных кератиноцитов уже готовых ламеллярных телец. В медленную фазу восстановления барьера происходит усиление синтеза жирных кислот, холестерина и церамидов, а также образование новых ламеллярных гранул.
В ответ на повреждение рогового слоя кератиноциты секретируют ряд сигнальных молекул — цитокинов, факторов роста. Установлено, что сразу после повреждения рогового слоя повышается концентрация ИЛ-1а (интерлейкин 1а), TNFα (фактор некроза опухолей альфа) и некоторых других цитокинов. Точная роль этих молекул в восстановлении эпидермального барьера пока не известна, но сам факт повышения их концентрации важен. Скорее всего, они стимулируют синтез липидов и образование ламеллярных гранул в эпидермисе, но они же могут вызывать появление гиперпигментации, воспаления и эпидермальной гиперплазии. Показано, что даже незначительное, но систематическое повреждение барьерного слоя (например, частое умывание горячей водой с мылом) приводит к возникновению гиперплазии эпидермиса, что говорит о том, что цитокины, вырабатываемые кожей при повреждении рогового слоя, могут инициировать патологические процессы.
Нанесение на кожу различных веществ может помочь или, напротив, затормозить восстановительные процессы.
Полная окклюзия
Если на кожу наложить полиэтиленовую или резиновую пленку, то секреции ламеллярных телец и увеличения синтеза липидов не происходит. Более того, сейчас актуальна проблема с тем, что сама окклюзия — ношение резиновых перчаток, может стать причиной повреждения барьерной функции кожи, ведь повышенная влажность приводит к повышению проницаемости кожи.
По всей видимости, увеличение скорости испарения воды через роговой слой является главным сигналом к восстановительным работам при разрушении барьерных структур. Непроницаемая пленка, которая не позволяет воде испаряться, блокирует ответ клеток эпидермиса на повреждение.
Частичная окклюзия
Если кожу с разрушенным роговым слоем покрыть слоем вазелина, то в первые часы после повреждения наблюдается замедление восстановления. На электронных микрофотографиях в гранулярном слое эпидермиса можно видеть деформированные (словно поеденные молью) ламеллярные тельца. Это говорит о том, что вазелин в какой-то мере проникает в гранулярный слой эпидермиса и нарушает формирование ламеллярных телец. Тем не менее тонкий слой вазелина не препятствует газообмену, как это делает полиэтиленовая пленка. И некоторое количество трансдермальной воды через нее испаряется, а кислород и углекислый газ нормально проходят.
Поэтому в итоге под слоем вазелина восстановление барьера завершается быстрее, чем без него. Временный барьер, который создает вазелин, защищает кожу от сильного обезвоживания и проникновения токсических веществ. Поэтому клетки могут успешнее работать над восстановлением барьера, не отвлекаясь на борьбу с внешним стрессом.
Физиологические липиды
Если вазелин при нанесении на кожу лишь в незначительной степени проникает внутрь, то физиологические липиды (церамиды, нейтральные жиры, жирные кислоты, холестерин) ведут себя совершенно иначе. Используя флуоресцентные метки, удалось показать, что эти молекулы с легкостью преодолевают роговой слой и проникают в живые клетки эпидермиса. Поскольку в клетках кожи есть все необходимые ферменты для переработки экзогенных липидов, липидные молекулы, проникшие извне, быстро разбираются на «запчасти», из которых строятся липиды эпидермиса.
Тем не менее, если обратиться к динамике восстановления кожи, то будет видно, что эффективное восстановление ее барьерной функции наблюдается лишь при использовании смеси трех ключевых липидов кожи — церамидов, холестерина, жирных кислот, взятых в определенном соотношении. В ходе многолетних экспериментов удалось подобрать соотношение физиологических липидов в смеси, оптимальное для скорейшего восстановления барьера — 3:1:1. Обращаем внимание на то, что это молярная пропорция, отражающая соотношение числа липидных молекул в смеси и означающая, что на три молекулы одного вида липидов приходится по одной молекуле двух других видов. Примечательно, что липидную смесь следует адаптировать под конкретное состояние кожи:
- если проблемы с кожей вызваны дефицитом незаменимых жирных кислот (несбалансированное питание, фотоповреждение), то оптимальной рецептурой для восстановления барьерной функции кожи будет:
1 (церамиды) : 1 (холестерин) : 3 (незаменимые жирные кислоты);
- для стареющей кожи необходимо увеличить долю холестерина по сравнению с остальными липидами, так как в стареющем эпидермисе часто наблюдается нарушение метаболизма холестерина, поэтому смесь будет выглядеть следующим образом:
1 (церамиды) : 3 (холестерин) : 1 (незаменимые жирные кислоты);
- при лечении атопического дерматита и некоторых других кожных заболеваний рекомендуется рецептура:
3 (церамиды) : 1 (холестерин) : 1 (жирные кислоты).
С практической точки зрения важно, что свободные жирные кислоты можно заменить триглицеридами или фосфолипидами и все еще получить быстрое восстановление барьера. Можно заменить церамиды сфингомиелином или холестерин эфирами холестерина без какого-либо ущерба для процесса восстановления. Это подтверждает наличие в коже очень активных ферментов, с помощью которых клетки эпидермиса могут использовать экзогенные липиды для синтеза собственных липидов.
Быстрое восстановление барьерной функции наблюдается лишь в том случае, если три ключевых липида (церамиды, холестерин, жирные кислоты) присутствуют в необходимом соотношении. При этом неважно, использована концентрированная или разбавленная липидная смесь, важно, чтобы пропорция ключевых липидов в ней сохранилась.
Натуральные масла
С тех пор как была установлена исключительная роль незаменимых жирных кислот в физиологии кожи, в косметологии большую популярность приобрели натуральные масла. Зачастую их наносят на кожу в чистом виде. С одной стороны, казалось бы, идея хорошая. Натуральные масла не содержат никаких посторонних химических веществ, и многие из них богаты дополнительными активными компонентами, такими как фитостерины, витамин Е, каротиноиды. Однако увлекаться чистыми маслами все-таки не стоит. Напомним, что целостность липидных пластов рогового слоя поддерживается точным соотношением всех липидных компонентов — церамидов, холестерина, свободных жирных кислот. Масла являются по своей природе нейтральными жирами, в основе которых триглицериды. Хотя они могут быть разобраны на составные части с высвобождением свободных жирных кислот, сначала они должны проникнуть через липидные пласты. Если масла слишком много, оно будет разбавлять липидные пласты, временно нарушая их структуру. Обычно структура пластов быстро восстанавливается. Однако слишком обильное и частое применение масел может привести к стойкому нарушению барьерной функции кожи. Все хорошо в меру.
В составе косметических средств натуральные масла обычно содержатся в небольших количествах, поэтому они не так заметно влияют на структуру барьера.
Информацию по составу и свойствам растительных масел, использующихся в косметике и для ухода за кожей, а также нюансы, касающиеся использования физиологических липидов и средств для создания окклюзии вы найдете в наших книгах «НОВАЯ КОСМЕТОЛОГИЯ. Косметические средства: ингредиенты, рецептуры, применение», «Косметическая химия для косметологов и дерматологов» и «НОВАЯ КОСМЕТОЛОГИЯ. Основы современной косметологии. 2-е издание, переработанное и дополненное». Они все доступны в электронном виде, и вы можете познакомиться с ними уже сегодня!
Анатомия и физиология кожи
Кожа – наш самый большой орган, составляющий 15% от общей массы тела. Она выполняет множество функций, прежде всего защищает организм от воздействия внешних факторов физической, химической и биологической природы, от потери воды, участвует в терморегуляции. Последние научные данные подтверждают, что кожа не только обладает собственной иммунной системой, но и сама является периферическим иммунном органом.
Структура кожи
Кожа состоит из 3 слоев: эпидермиса, дермы и подкожной жировой клетчатки (ПЖК) (рис. 1). Эпидермис – самый тонкий из них, представляет собой многослойный ороговевающий эпителий. Дерма – средний слой кожи. Главным образом состоит из фибрилл структурного белка коллагена. ПЖК содержит жировые клетки – адипоциты. Толщина этих слоев может значительно варьировать в зависимости от анатомического места расположения.
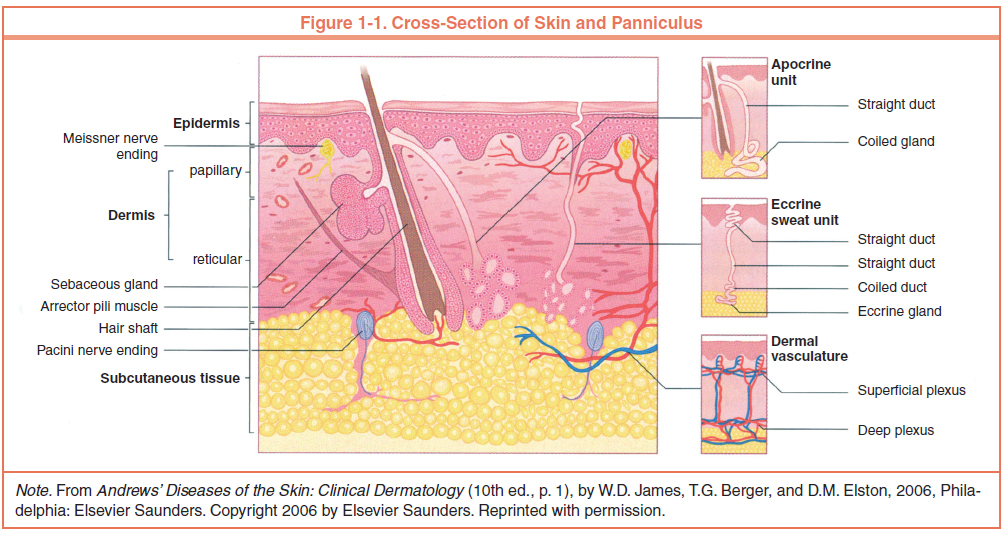
Рис.1. Структура кожи
Эпидермис
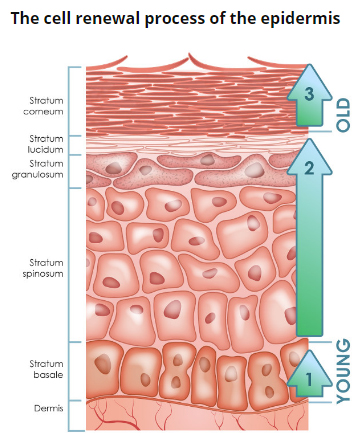
Рис. 2. Эпидермис
Эпидермис – постоянно слущивающийся эпителиальный слой кожи, в котором представлены в основном из 2 типа клеток – кератиноциты и дендритные клетки. В небольшом количестве в эпидермисе присутствуют меланоциты, клетки Лангерганса, клетки Меркеля, внутриэпидермальные Т-лимфоциты. Структурно эпидермис разделяется на 5 слоев: базальный, шиповатый, зернистый, блестящий и роговой , различающиеся положением и степенью дифференцировки кератиноцитов, основной клеточной популяции эпидермиса (рис. 2).
Кератинизация. По мере дифференцировки кератиноцитов и продвижения от базального слоя до рогового происходит их кератинизация (ороговевание) – процесс, начинающийся с фазы синтеза кератина кератиноцитами и заканчивающийся их клеточной деградацией. Кератин служит строительным блоком для промежуточных филаментов. Пучки из этих филаментов, достигая цитоплазматический мембраны, формируют десмосомы, необходимые для образования прочных контактов между соседними клетками. Далее, по мере процесса эпителиальной дифференцировки, клетки эпидермиса вступают в фазу деградации. Ядра и цитоплазматические органеллы разрушаются и исчезают, обмен веществ прекращается, и наступаетапоптозклетки, когда она полностью кератинизируется (превращается в роговую чешуйку).
Базальный слой эпидермиса состоит из одного ряда митотически активных кератиноцитов, которые делятся в среднем каждые 24 часа и дают начало новым клеткам новым клеткам вышележащих эпидермальных слоев. Они активируются только в особых случаях, например при возникновении раны. Далее новая клетка, кератиноцит, выталкивается в шиповатый слой, в котором она проводит до 2 недель, постепенно приближаясь к гранулярному слою. Движение клетки до рогового слоя занимает еще 14 дней. Таким образом, время жизни кератиноцита составляет около 28 дней.
Надо заметить, что не все клетки базального слоя делятся с такой скоростью, как кератиноциты. Эпидермальные стволовые клетки в нормальных условиях образуют долгоживущую популяцию с медленным циклом пролиферации.
Шиповатый слой эпидермиса состоит из 5-10 слоев кератиноцитов, различающихся формой, структурой и внутриклеточным содержимым, что определяется положением клетки. Так, ближе к базальному слою, клетки имеют полиэдрическую форму и круглое ядро, но по мере приближения клеток к гранулярному слою они становятся крупнее, приобретают более плоскую форму, в них появляются ламеллярные гранулы, в избытке содержащие различные гидролитические ферменты. Клетки интенсивно синтезируют кератиновые нити, которые, собираясь в промежуточные филаменты, остаются не связанными со стороны ядра, но участвуют в образовании множественных десмосом со стороны мембраны, формируя связи с соседними клетками. Присутствие большого количества десмосом придает этому слою колючий вид, за что он и получил название «шиповатый».
Зернистый слой эпидермиса составляют еще живые кератиноциты, отличающиеся своей уплощенной формой и большим количеством кератогиалиновых гранул. Последние отвечают за синтез и модификацию белков, участвующих в кератинизации. Гранулярный слой является самым кератогенным слоем эпидермиса. Кроме кератогиалиновых гранул кератиноциты этого слоя содержат в большом количестве лизосомальные гранулы. Их ферменты расщепляют клеточные органеллы в процессе перехода кератиноцита в фазу терминальной дифференцировки и последующего апоптоза. Толщина гранулярного слоя может варьировать, ее величина, пропорциональная толщине вышележащего рогового слоя, максимальна в коже ладоней и подошв стоп.
Блестящий слой эпидермиса (назван так за особый блеск при просмотре препаратов кожи на световом микроскопе) тонкий, состоит из плоских кератиноцитов, в которых полностью разрушены ядра и органеллы. Клетки наполнены элейдином – промежуточной формой кератина. Хорошо развит лишь на некоторых участках тела – на ладонях и подошвах.
Роговой слой эпидермиса представлен корнеоцитами (мертвыми, терминально-дифференцированными кератиноцитами) с высоким содержанием белка. Клетки окружены водонепроницаемым липидным матриксом, компоненты которого содержат соединения, необходимые для отшелушивания рогового слоя (рис. 3). Физические и биохимические свойства клеток в роговом слое различаются в зависимости от положения клетки внутри слоя, направляя процесс отшелушивания наружу. Например, клетки в средних слоях рогового слоя обладают более сильными водосвязывающими свойствами за счет высокой концентрации свободных аминокислот в их цитоплазме.
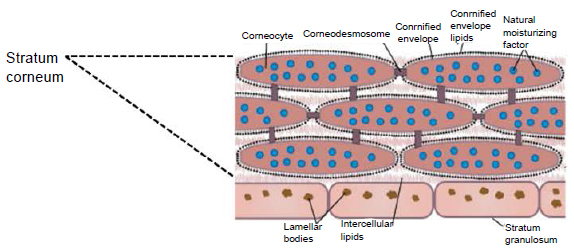
Рис. 3. Схематичное изображение рогового слоя с нижележащим зернистым слоем эпидермиса.
Регуляция пролиферации и дифференцировки кератиноцитов эпидермиса . Являясь непрерывно обновляющейся тканью, эпидермис содержит относительно постоянное число клеток и регулирует все взаимодействия и контакты между ними: адгезию между кератиноцитами, взаимодействие между кератиноцитами и мигрирующими клетками, адгезию с базальной мембраной и подлежащей дермой, процесс терминальной дифференцировки в корнеоциты. Основной механизм регуляции гомеостаза в эпидермисе поддерживается рядом сигнальных молекул – гормонами, факторами роста и цитокинами. Кроме этого, эпидермальный морфогенез и дифференцировка частично регулируются подлежащей дермой, которая играет критическую роль в поддержании постнатальной структуры и функции кожи.
Дерма
Дерма представляет собой сложноорганизованную рыхлую соединительную ткань, состоящую из отдельных волокон, клеток, сети сосудов и нервных окончаний, а также эпидермальных выростов, окружающих волосяные фолликулы и сальные железы. Клеточные элементы дермы представлены фибробластами, макрофагами и тучными клетками. Лимфоциты, лейкоциты и другие клетки способны мигрировать в дерму в ответ на различные стимулы.
Дерма, составляя основной объем кожи, выполняет преимущественно трофическую и опорную функции, обеспечивая коже такие механические свойства, как пластичность, эластичность и прочность, необходимые ей для защиты внутренних органов тела от механических повреждений. Также дерма удерживает воду, участвует в терморегуляции и содержит механорецепторы. И, наконец, ее взаимодействие с эпидермисом поддерживает нормальное функционирование этих слоев кожи.
В дерме нет такого направленного и структурированного процесса клеточной дифференцировки, как в эпидермисе, тем не менее в ней также прослеживается четкая структурная организация элементов в зависимости от глубины их залегания. И клетки, и внеклеточный матрикс дермы также подвергаются постоянному обновлению и ремоделированию.
Внеклеточный матрикс (ВКМ) дермы , или межклеточное вещество, в состав которого входят различные белки (главным образом коллаген, эластин), гликозаминогликаны, самым известным из которых является гиалуроновая кислота, и протеогликаны (фибронектин, ламинин, декорин, версикан, фибриллин). Все эти вещества секретируются фибробластами дермы. ВКМ представляет собой не беспорядочное скопление всех компонентов, а сложноорганизованную сеть, состав и архитектоника которой определяют такие биомеханические свойства кожи, как жесткость, растяжимость и упругость. К белкам ВКМ прикрепляются кератиноциты эпидермиса, которые тесно состыкованы друг с другом. Именно они и формируют плотный защитный слой кожи. Структура ВКМ также способна оказывать регулирующее влияние на погруженные в него клетки. Регуляция может быть как прямой, так и косвенной. В первом случае белки и гликозаминогликаны ВКМ непосредственно взаимодействуют с рецепторами клеток и инициируют в них специфические пути передачи сигнала. Косвенная регуляция осуществляется посредством действия цитокинов и ростовых факторов, удерживаемых в ячейках сети ВКМ и высвобождаемых в определенный момент для взаимодействия с рецепторами клеток. Структурная сеть ВКМ подвергается ремоделированию ферментами из семейства матриксных металлопротеиназ (ММР). В частности, ММР-1 и ММР-13 инициируют деградацию коллагенов I и III типов. Плотность сети ВКМ дермы неравномерна – в папиллярном слое она более рыхлая, в ретикулярном - значительно плотнее как за счет более близкого расположения волокон структурных белков, так и за счет увеличения диаметра этих волокон.
Коллаген – один из главных компонентов ВКМ дермы. Синтезируется фибробластами. Процесс его биосинтеза сложный и многоступенчатый, в результате которого фибробласт секретирует в экстрацеллюлярное пространство проколлаген, состоящий из трех полипептидных α-цепей, свернутых в одну тройную спираль. Затем мономеры проколлагена ферментивным путем собираются в протяженные фибриллярные структуры различного типа. Всего в коже не менее 15 типов коллагена, в дерме больше всего I, III и V типов этого белка: 88, 10 и 2% соответственно. Коллаген IV типа локализуется в зоне базальной мембраны, а коллаген VII типа, секретируемый кератиноцитами, играет роль адаптерного белка для закрепления фибрилл ВКМ на базальной мембране (рис. 4). Волокна структурных коллагенов I, III и V типов служат каркасом, к которому присоединяются другие белки ВКМ, в частности коллагены XII и XIV типов. Считается, что эти минорные коллагены, а также небольшие протеогликаны (декорин, фибромодулин и люмикан) регулируют формирование структурных коллагеновых волокон, их диаметр и плотность образуемой сети. Взаимодействие олигомерных и полимерных комплексов коллагена с другими белками, полисахаридами ВКМ, разнообразными факторами роста и цитокинами приводит к образованию особой сети, обладающей определенной биологической активностью, стабильностью и биофизическими характеристиками, важными для нормального функционирования кожи. В папиллярном слое дермы волокна коллагена располагаются рыхло и более свободно, тогда как ее ретикулярный слой содержит более крупные тяжи коллагеновых волокон.
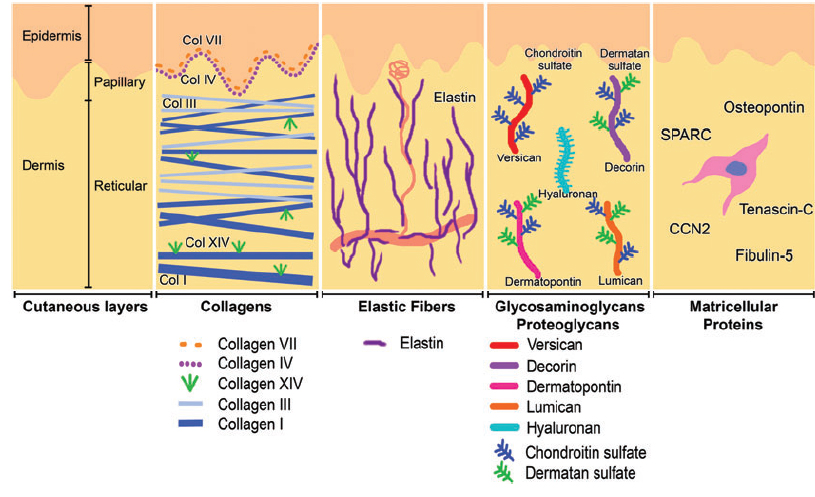
Рис. 4. Схематичное представление слоев кожи и распределения коллагенов разных типов.
Коллаген постоянно обновляется, деградируя под действием протеолитических ферментов коллагеназ и замещаясь вновь синтезированными волокнами. Этот белок составляет 70% сухого веса кожи. Именно коллагеновые волокна «держат удар» при механическом воздействии на нее.
Эластин формирует еще одну сеть волокон в дерме, наделяя кожу такими качествами, как упругость и эластичность. По сравнению с коллагеном эластиновые волокна менее жесткие, они скручиваются вокруг коллагеновых волокон. Именно с эластиновыми волокнами связываются такие белки, как фибулины и фибриллины, с которыми, в свою очередь, связывается латентный TGF-β-связывающий белок (LTBP). Диссоциация этого комплекса приводит к высвобождению и к активации TGF-β, самого мощного из всех факторов роста. Он контролирует экспрессию, отложение и распределение коллагенов и других матриксных белков кожи. Таким образом, интактная сеть из волокон эластина служит депо для TGF-β.
Гиалуроновая кислота (ГК) представляет собой линейный полисахарид, состоящий из повторяющихся димеров D-глюкуроновой кислоты и N-ацетилглюкозамина. Количество димеров в полимере варьирует, что приводит к образованию молекул ГК разного молекулярного веса и длины - 1х10 5 -10 7 Да (2-25 мкм), оказывающих, соответственно, различный биологический эффект.
ГК - высокогидрофильное вещество, влияющее на движение и распределение воды в матриксе дермы. Благодаря этому ее свойству наша кожа в норме и в молодости обладает высоким тургором и сопротивляемостью механическому давлению.
ГК с легкостью образует вторичные водородные связи и внутри одной молекулы, и между соседними молекулами. В первом случае они обеспечивают формирование относительно жестких спиральных структур. Во втором – происходит ассоциация с другими молекулами ГК и неспецифическое взаимодействие с клеточными мембранами, что приводит к образованию сети из полимеров полисахаридов с включенными в нее фибробластами. На длинную молекулу ГК, как на нить, «усаживаются» более короткие молекулы протеогликанов (версикана, люмикана, декорина и др.), формируя агрегаты огромных размеров. Протяженные во всех направлениях, они создают каркас, внося вклад в стабилизацию белковой сети ВКМ и фиксируя фибробласты в определенном окружении матрикса. В совокупности все эти свойства ГК наделяют матрикс определенными химическими характеристиками – вязкостью, плотностью «ячеек» и стабильностью. Однако сеть ВКМ является динамической структурой, зависящей от состояния организма. Например, в условиях воспаления агрегаты ГК с протеогликанами диссоциируют, а образование новых агрегатов между вновь синтезированными молекулами ГК (обновляющимися каждые 3 дня) и протеогликанами блокируется. Это приводит к изменению пространственной структуры матрикса: увеличивается размер его ячеек, меняется распределение всех волокон, структура становится более рыхлой, клетки меняют свою форму и функциональную активность. Все это сказывается на состоянии кожи, приводя к снижению ее тонуса.
Помимо регуляции водного баланса и стабилизации ВКМ, ГК выполняет важную регуляторную роль в поддержании эпидермального и дермального гомеостаза. ГК активно регулирует динамические процессы в эпидермисе, включая пролиферацию и дифференцировку кератиноцитов, окислительный стресс и воспалительный ответ, поддержание эпидермального барьера и заживление раны. В дерме ГК также регулирует активность фибробластов и синтез коллагена. Ремоделируя матрикс, ГК управляет функционированием клеток в матриксе, влияя на их доступность для различных факторов роста и изменяя их функциональную активности. От действия ГК зависит миграция клеток и иммунный ответ в ткани. Таким образом, изменения в распределении, организации, молекулярном весе и метаболизме ГК имеют значимые физиологические последствия.
Фибробласты представляют собой основной тип клеточных элементов дермы. Именно эти клетки отвечают за продукцию ГК, коллагена, эластина, фибронектина и многих других белков межклеточного матрикса, необходимых для формирования соединительной ткани. Фибробласты в различных слоях дермы различаются и морфологически, и функционально. От глубины их залегания в дерме зависит не только количество синтезируемого ими коллагена, но и соотношение типов этого коллагена, например I и III типов, а также синтез коллагеназы: фибробласты более глубоких слоев дермы производят меньшее ее количество. Вообще, фибробласты – очень пластичные клетки, способные менять свои функции и физиологический ответ и даже дифференцироваться в другой тип клеток в зависимости от полученного стимула. В роли последнего могут выступать и сигнальные молекулы, синтезированные соседними клетками, и перестройка окружающего ВКМ.
Подкожно-жировая клетчатка
Подкожно-жировая клетчатка , или гиподерма, - самый нижний слой кожи, располагается под дермой. Состоит из жировых долек, разделенных между собой соединительнотканными септами, содержащими коллаген и пронизанными крупными сосудами. Главными клетками жировых долек являются адипоциты, количество которых варьирует в различных областях тела. В настоящее время ПЖК рассматривают не только как энергетическое депо, но и как эндокринный орган, адипоциты которого участвуют в выработке ряда гормонов (лептина, адипонектина, резистина), цитокинов и медиаторов, оказывающих влияние на метаболизм, чувствительность к инсулину, функциональную активность репродуктивной и иммунной систем.
Читайте также:

