Какие животные клетки способны к сокращению 1 эпидермиса
Обновлено: 02.05.2024
В представленной статье обобщены современные данные о строении и функции эпидермального барьера, рассмотрены вопросы его роли в развитии атопического дерматита.
This article summarizes current data on the structure and function of the epidermal barrier, we also considered its role in development of atopic dermatitis.
С тех пор как наземная жизнь стала угрожать млекопитающим обезвоживанием, все более становятся актуальными исследования структурных, клеточных, биохимических и регуляторных механизмов организма, участвующих в поддержании гомеостаза проницаемости эпидермального барьера [1].
Кожа обеспечивает жизненно важную функцию, защищая позвоночных от повседневных и экстремальных влияний факторов внешней среды, таких как воздействие антигенов, ультрафиолетового света, моющих средств, микроорганизмов, токсинов, наночастиц и иных повреждений [2]. Таким образом, эпидермальный барьер, являясь физическим барьером [3], обеспечивает защиту организма на границе двух сред, ограничивая как потерю воды из организма, так и попадание патогенных микроорганизмов в организм [4].
Важнейшая составная часть эпидермального барьера, от которой зависит проникновение раздражителей и аллергенов, находится в нижней части рогового слоя [5]. Несмотря на минимальные размеры (толщина около 7–35 мкм), он играет определяющую роль в формировании защитного барьера и способствует предотвращению чрезкожного проникновения патогенов. Кроме роли физического барьера, роговой слой участвует в терморегуляции, газообмене, гидратации, обеспечении врожденного иммунитета, а создавая определенную pH поверхности кожи (слегка кислую), обеспечивает дополнительную защиту от болезнетворных микроорганизмов [6].
Во время терминальной дифференцировки кератиноциты зернистого слоя «заменяют» свою клеточную мембрану на нерастворимый белковый слой — роговую оболочку [7]. Она придает прочность корнеоцитам и является «платформой» для прикрепления липидов. Роговая оболочка в основном сформирована структурными белками, такими как лорикрин, инволюкрин, филаггрин (ФЛГ) и малыми пролин-богатыми белками. Особенно важен филаггрин, объединяющий кератиновые волокна клеток, «скручивая» кератиноциты в уплощенные диски с большой площадью поверхности [8].
Вокруг корнеоцитов расположены холестерин, фосфолипиды и церамиды, создавая многослойную мембрану из липидных пластинок [3, 9]. Последние играют важную роль в регуляции водного гомеостаза кожи, помогают сохранять воду в организме, а также предотвращают проникновение патогенных микроорганизмов и аллергенов [10].
На границе между роговым и зернистым слоями происходит секреция ламеллярных телец, содержащих предшественники липидов, а также необходимые ферменты для переработки этих прекурсоров в зрелые составляющие липидной матрицы [11]. Перед секрецией происходит сборка ламеллярных телец в пластинчатом комплексе, посредством дифференцированной их упаковки с различным содержимым [12]. Кроме вышеупомянутых метаболитов липидов, липидные тельца доставляют в межклеточное пространство рогового слоя протеолитически активные ферменты, такие как сериновые протеазы семейства калликреина, а также их ингибиторов, в том числе и лимфоэпителиальный ингибитор сериновых протеаз типа Kazal-5 (LEKTI) [13].
Единство между корнеоцитами рогового слоя зависит прежде всего от корнеодесмосом. Подобно десмосомам, они поддерживают целостность тканей посредством молекул межклеточной адгезии с помощью кальций-зависимых взаимодействий между двумя представителями семейства кадгерина, внеклеточных трансмембранных гликопротеинов — десмоглеина и десмоколлина. Внутри корнеоцитов десмоглеин и десмоколлин соединяют кератиновые филламенты корнеодесмосом посредством «соединительной бляшки», состоящей из плакоглобина, десмоплакина и плакофиллина. Десмоглеин и десмоколлин перемещаются от оболочки корнеоцитов в липидную пластину между корнеоцитами и связывают воедино белки соседних клеток. Кроме того, в процессе кератинизации эпителия экспрессируется специфический белок с молекулярной массой 52 кДа — корнеодесмосин [8, 14]. После секреции в экстрацеллюлярное пространство корнеодесмосин перемещается в область между зернистым и роговым слоями и проникает в десмосому. Появление корнеодесмосина знаменует переход от десмосом к корнеодесмосомам [3, 12].
Во время «нормальной» десквамации рогового слоя самые поверхностные корнеоциты «уходят» с поверхности кожи, замещаясь кератиноцитами, подвергшимися терминальной дифференцировке [14, 15]. Таким образом, существует «тонкий» баланс между базальной клеточной пролиферацией и десквамацией рогового слоя. Это обеспечивает постоянное обновление клеток эпидермиса, а также способствует поддержанию одинаковой толщины эпителия [14, 16]. Caubet и соавт. [15] описали несколько деградационных протеаз, которые разрушают внеклеточные корнеодесмосомальные адгезивные белки, связывающие корнеоциты вместе.
В роговом слое среди протеаз, вовлеченных в процесс десквамации, присутствуют хемотрипсиновые (SCCE) и трипсиновые ферменты (SCTE), которые экспрессируются кератиноцитами зернистого слоя и находятся во внеклеточном пространстве рогового слоя [14]. Данные протеазы гидролизуют корнеодесмосин и десмоколлин [15]. Их активность контролируется семейством специфических ингибиторов, в которое входит LEKTI [17]. При этом скорость десквамации коррелирует с количеством ингибиторов протеаз, поступивших из ламеллярных телец [3].
На барьерную функцию эпидермиса влияют структура, дифференцировка, функциональная активность кератиноцитов, качественный и количественный состав липидов рогового слоя эпидермиса, наличие веществ, относящихся к естественному увлажняющему фактору, а также рН поверхности кожи [18]. При изменении каких-либо из перечисленных показателей барьерная функция эпидермиса нарушается, что приводит к усиленному испарению воды через роговой слой. У человека эпидермальный барьер восстанавливается на 60% через 12 часов, а полное восстановление занимает 72 часа [19]. Полагают, что быстрое восстановление эпидермального барьера происходит за счет массового выброса из клеток готовых ламеллярных телец. В медленную фазу восстановления усиливается синтез жирных кислот, холестерина, церамидов, а также образование новых ламеллярных гранул. Нарушение восстановления кожного барьера приводит к обезвоживанию эпидермиса и развитию выраженной сухости кожи, что и наблюдается при развитии атопического дерматита (АД) [20].
Повреждение эпидермального барьера способствует проникновению через кожу микробов, аллергенов и различных поллютантов (токсины, раздражающие и загрязняющие вещества). Проникновение агентов с антигенными свойствами увеличивает риск сенсибилизации, поскольку взаимодействие аллергенов и аллерген-представляющих клеток кожи инициирует воспаление [14]. Степень дисфункции барьера коррелирует со степенью воспаления и тяжестью АД [11]. Впервые Y. Werner и M. Lindberg (1985 г.) привели доказательства нарушений барьерной функции кожи, измерив трансэпидермальную потерю воды (ТЭПВ) у лиц с АД. Авторам удалось показать, что у больных АД нарушения эпидермального барьера отмечаются не только в очагах активного воспаления, но и на клинически неизмененной коже [10, 21].
Изменения в свойствах эпидермального барьера, которые наблюдаются при АД, включают увеличение ТЭПВ, изменения рН поверхности кожи, повышение ее проницаемости, увеличение бактериальной колонизации, изменение в экспрессии антимикробных пептидов, а также нарушение его целостности. При аномалии эпидермального барьера аллергены, раздражающие и другие вещества могут проникать через кожу, способствуя обострению АД [6].
В настоящее время нарушение функции кожного барьера является одним из ведущих этиопатогенетических факторов АД. По данным разных авторов у 30–66% больных АД протекает без изменения уровня общего IgE в сыворотке крови и специфичных IgE к аллергенам. Полагают, что именно у этих пациентов нарушение функции кожного барьера играет ведущую роль в развитии и прогрессировании заболевания [22].
В последние годы определен ряд генетических мутаций, приводящих к изменениям в роговом слое эпидермиса. Так, у больных АД определяются мутации гена профилаггрина [23], способствующие нарушению синтеза белка ФЛГ — одного из компонентов цитокератинового скелета, обеспечивающего ороговение кератиноцитов. В результате изменения терминальной дифференцировки кератиноцитов развивается их функциональная несостоятельность [24]. Кроме того, снижение экспрессии гена ФЛГ уменьшает уровень «натурального увлажняющего фактора» [25]. Дефицит ФЛГ и/или продуктов его деградации способствует сухости кожи, что коррелирует с клинической картиной нарушения эпидермального барьера при АД [26]. Более того, при уменьшении ФЛГ усиливается «раздражающий» эффект аллергенов на дендритные клетки, понижая при этом порог их чувствительности к воспалению, что демонстрирует важность этого белка в предотвращении пенетрации аллергенов [27].
Кроме того, у больных АД выявлены полиморфные варианты гена SPINK5, приводящие к дизрегуляции синтеза ингибитора сериновой протеазы LEKTI, который в норме блокирует избыточную продукцию SCCE [28]. Активность деградационных протеаз также значимо связана с дефектом кожного барьера при АД [23]. Разбалансировка функционирования этих ферментов ведет к усиленному отшелушиванию клеток и истончению рогового слоя, увеличивая проницаемость эпидермального барьера [14]. Установлено, что у больных АД изменена липидная мантия рогового слоя, предупреждающая ТЭПВ. Отмечается низкий уровень церамидов первого и третьего типов в сочетании с повышением уровня свободного холестерола [29]. Повышение уровня рН на поверхности кожи приводит к снижению синтеза липидов и активизации ферментов (в частности, SCCE), повреждающих корнеодесмосомы. Уменьшение количества веществ, относящихся к «натуральному увлажняющему фактору», также способствует нарушению функционирования эпидермального барьера [30].
Таким образом, у больных АД отмечается комплекс нарушений, приводящих к дисфункции кожного барьера, усилению ТЭПВ и обезвоживанию кожных покровов [14]. Из вышеуказанного следует, что пациенты с АД могут иметь дефект кожного барьера, в основе которого лежат как генетические, так и приобретенные механизмы. Этот дефект способны спровоцировать внешние факторы, такие как царапины, использование моющих средств, микробная колонизация, а также воздействие протеаз различных аллергенов (в частности, протеаз клещей домашней пыли) [10]. Распознание конкретных механизмов, участвующих в патогенезе воспалительных заболеваний кожи, в частности, АД, безусловно, будет способствовать поиску и разработке новых, более эффективных методов воздействия на патологический процесс с минимальным количеством системных эффектов [8].
Литература
- Elias P. M. The skin barrier as an innate immune element // Semin. Immunopathol. 2007. Vol. 29 (1); р. 3–14.
- De Benedetto A., Kubo А., Beck L. A. Skin barrier disruption — a requirement for allergen sensitization? // J. Invest. Dermatol. 2012. Vol. 132 (3); р. 949–63.
- Danby S. G., Cork M. J. New understanding of atopic dermatitis: the role of epidermal barrier dysfunction and subclinical inflammation. // J. Clin. Dermatol. 2010. Vol. 1 (2); р. 33–46.
- Котлуков В. К., Кузьменко Л. Г., Антипова Н. В. Наружные дерматологические средства серии «Бепантен» в практике педиатра // Медицинский совет. 2012. Т. 5; с. 81–85.
- Madison K. С. Barrier function of the skin: «la raison d’etre» of the epidermis // J. Invest. Dermatol. 2003. Vol. 121; р. 231–241.
- Lorena S. T., Morello III A. P., Mack Correa M. C. et al. The infant skin barrier: can we preserve, protect, and enhance the barrier? // Dermatol. Res. Pract. 2012. Doi: 10.1155/2012/198789.
- Candi E., Schmidt R., Melino G. The cornified envelope: a model of cell death in the skin // Nat. Rev. Mol. Cell Biol. 2005. Vol. 6; р. 328–340.
- Michael J. C., Simon G. D., Yiannis V. et al. Epidermal barrier dysfunction in atopic dermatitis // J. Invest. Dermatol. 2009. Vol. 129; р. 1892–908.
- Ревякина В. А. Современные тенденции в комплексной наружной терапии атопического дерматита у детей // Лечащий Врач. 2014. № 6, с. 38.
- De Benedetto А., Agnihothri R., McGirt L. Y. et al. Atopic dermatitis: a disease caused by innate immune defects? // J. Invest. Dermatol. 2009. Vol. 129; р. 14–30.
- Roelandt T., Thys B., Heughebaert C. et al. LEKTI-1 in sickness and in health // Int. J. Cosmetic Sci. 2009. Vol. 31 (4); р. 247–254.
- Ishida-Yamamoto A., Simon M., Kishibe M. et al. Epidermal lamellar granules transport different cargoes as distinct aggregates // J. Invest. Dermatol. 2004. Vol. 122; р. 1137–1144.
- Ishida-Yamamoto A., Deraison C., Bonnart C. et al. LEKTI is localized in lamellar granules, separated from KLK5 and KLK7, and is secreted in the extracellular spaces of the superficial stratum granulosum // J. Invest. Dermatol. 2005. Vol. 124; р. 360–366.
- Cork M. J., Robinson D. A., Vasilopoulos Y. et al. New perspectives on epidermal barrier dysfunction in atopic dermatitis: gene-environment interactions // J. Allergy Clin. Immunol. 2006. Vol. 118; р. 3–21.
- Caubet C., Jonca N., Brattsand M. et al. Degradation of corneodesmosome proteins by two serine proteases of the kallikrein family, SCTE/KLK5/hK5 and SCCE/KLK7/hK7 // J. Invest. Dermatol. 2004. Vol. 122; Р. 1235–1244.
- Goldstein A. M., Abramovits W. Ceramides and the stratum corneum: structure, function, and new methods to promote repair // Int. J. Dermatol. 2003. Vol. 42; р. 256–59.
- Chavanas S., Bodemer C., Rochat A. Mutations in SPINK5, encoding a serine protease inhibitor, cause Netherton syndrome // Nat. Genet. 2000. Vol. 25; р. 141–142.
- Мурашкин Н. Н. Нарушения дермального барьера как фактор хронизации дерматозов в детском возрасте, подходы к терапии: теоретические и практические инновации // Лечащий Врач. 2014. № 6, с. 19.
- Эрнандес Е., Марголина А., Петрухина А. Липидный барьер кожи и косметические средства // Косметика и медицина. 2005. Т. 6; с. 35–38.
- Тамразова О. Б. Синдром сухой кожи // Дерматология. Приложение к журналу Consilium Medicum. 2014. Т. 3; с. 25–31.
- Хлебникова А. Н. Увлажняющие средства в терапии хронических дерматозов // Клиническая дерматология и венерология. 2010. Т. 4; с. 32–39.
- Palmer C. N., Irvine A. D., Terron-Kwiatkowski A. et al. Common loss-of-function variants of the epidermal barrier protein filaggrin are a major predisposing factor for atopic dermatitis // Nat. Genet. 2006. Vol. 38 (4); р. 441–446.
- Молочков А. В., Тамразова О. Б. Ксероз кожи — основной патогенетический фактор развития атопического дерматита // Дерматология. Приложение к журналу Consilium Medicum. 2014. Т. 4; с. 48–54.
- Vasilopoulos Y., Cork M. J., Murphy R. et al. Genetic association between an AACC insertion in the 3’UTR of the stratum corneum chymotryptic enzyme gene and atopic dermatitis // J. Invest. Dermatol. 2004. Vol. 123; р. 62–66.
- Smith F. J., Irvine A. D., Terron-Kwiatkowski A. et al. Loss-of-function mutations in the gene encoding filaggrin cause ichthyosis vulgaris // Nat. Genet. 2006. Vol. 38 (3); р. 337–342.
- Nemoto-Hasebe I., Akiyama M., Nomura T. et al. Clinical severity correlates with impaired barrier in? laggrin-related eczema // J. Invest. Dermatol. 2009. Vol. 129 (3); р. 682–689.
- Fallon P. G., Sasaki T., Sandilands A. et al. A homozygous frameshift mutation in the mouse Flg gene facilitates enhanced percutaneous allergen priming // Nat. Genet. 2009. Vol. 41 (5); р. 602–608.
- Kato A., Fukai K., Oiso N. et al. Association of SPINK5 gene polymorphisms with atopic dermatitis in the Japanese population // Br. J. Dermatol. 2003. Vol. 148; р. 665–669.
- Пампура А. Н., Чусляева А. А. Современные подходы к терапии атопического дерматита у детей // Медицинский вестник Башкортостана. 2014. Т. 9 (1); с. 93–98.
- Eberlein-Konig B., Schafer T., Huss-Marp J. et al. Skin surface pH, stratum corneum hydration, transepidermal water loss and skin roughness related to atopic eczema and skin dryness in a population of primary school children // Acta Dermatol. Venereol. 2000. Vol. 80; р. 188–191.
С. В. Левашева 1 , кандидат медицинских наук
Э. И. Эткина, доктор медицинских наук, профессор
Л. Л. Гурьева, кандидат медицинских наук
Л. И. Бабенкова, кандидат медицинских наук
Л. Я. Данилова
С. Э. Якута
Делящиеся и неделящиеся клетки. Митоз. Дифференцировка и специализация клеток. Этапы жизненного цикла специализированной клетки. Некроз и апоптоз. Регуляция численности клеток в организме.
До сих пор много тайн клетки остаются неразгаданными. Загадочным во многом остается и запрограммированный генетически алгоритм ее жизни, названный жизненным циклом клетки (клеточным циклом). Жизненный цикл клетки (рисунок 1.3.14) начинается с момента ее образования после деления родительской клетки и заканчивается либо новым делением, либо превращением в специализированную клетку.
Рисунок 1.3.14. Жизненный цикл клетки:
1 - интерфаза; 2 - митоз; 3 - дифференцировка; 4 - функционирование специализированной клетки
Большинство клеток продолжает делиться. Им свойственен клеточный цикл, состоящий из периодически повторяющихся стадий: так называемой интерфазы (1) – этапа подготовки к делению и непосредственно процесса деления – митоза (2). К этапам дифференцировки (3) и функционирования специализированной клетки (4) мы вернемся чуть позже.
На стадии подготовки к делению происходит удвоение генетического материала (редупликация ДНК). Масса клетки во время интерфазы увеличивается до тех пор, пока она примерно вдвое не превысит начальную. Отметим, что сам процесс деления намного короче этапа подготовки к нему: митоз занимает примерно 1/10 часть клеточного цикла.
Цикличность (периодическое повторение) стадий интерфазы и митоза можно проиллюстрировать на примере фибробластов – одного из видов клеток соединительной ткани (рисунок 1.3.15). Так, нормальные фибробласты эмбриона человека размножаются приблизительно 50 раз. Каков генетически запрограммированный предел возможных делений клетки – это одна из неразгаданных тайн биологии.
Рисунок 1.3.15. Цикличность стадий интерфазы и митоза:
1 - интерфаза, стадия подготовки к митозу; 2 - митоз (деление клетки)
Хотя все клетки появляются путем деления предшествующей (материнской) клетки (“Всякая клетка от клетки”), не все они продолжают делиться. Клетки, достигшие некоторой стадии развития при дифференцировке, могут терять способность к делению.
Дифференцировка – возникновение различий в процессе развития первоначально одинаковых клеток, приводящее к их специализации. Процесс дифференцировки заключается в последовательном считывании и использовании наследственной информации, что обеспечивает синтез различных белков (в первую очередь ферментов), характерных для данного вида клеток. Другими словами, различия между клетками определяются набором белков, синтезируемых в клетках определенного вида.
При дифференцировке набор хромосом в клетке не меняется, изменяется лишь соотношение активных и неактивных генов, кодирующих различные белки.
Существуют два типа регуляции экспрессии (активации или блокирования) генов:
- Кратковременная адаптивная активация (реже блокирование), зависящая, в частности, от концентрации вещества, включающегося в обмен веществ (исходного вещества или продукта метаболизма). Этот механизм выработался эволюционно как приспособительная реакция и особенно ярко проявляется у животных (например, быстрый синтез пигментов у хамелеона в зависимости от условий).
- Длительное (в течение всей жизни клетки и/или многих генераций клеток!) блокирование или активация гена, возникающее в ходе клеточной дифференцировки. Например, в ДНК любой клетки желудка есть ген, отвечающий за синтез белков, из которых состоит ноготь. Но он необратимо блокирован гистонами и другими белками (этот участок ДНК плотно упакован), что никогда не позволит считывать с него информацию. Поэтому в желудке не растут ногти; а гены, ответственные за синтез гемоглобина, функционируют только у молодых форм эритроцитов, но не действуют в зрелых эритроцитах или других клетках.
На рисунке 1.3.14 цифрами 3 и 4 отмечены этапы дифференцировки и активного функционирования специализированной клетки.
Нервные клетки мозга, однажды возникнув, уже не делятся. В течение жизни число нейронов постепенно уменьшается. Поврежденные ткани мозга неспособны восстанавливаться путем регенерации. Однако изначально число нейронов в мозге настолько велико, что до конца жизни человека они способны поддерживать необходимые связи в нервной системе.
В качестве примера клеток, неспособных к делению, можно рассмотреть эритроциты. Как известно, эритроциты в процессе специализации теряют ядро, следовательно, не имеют в своем составе ДНК. Возникают эритроциты из так называемой стволовой клетки костного мозга. Клеткой-предшественницей (стволовой клеткой) называют клетки кроветворной ткани, которые на протяжении всей жизни человека сохраняют способность делиться и, тем самым, поставлять дочерние клетки, которые в дальнейшем будут специализироваться в одном направлении и замещать погибшие клетки. Срок жизни и активного функционирования эритроцитов невелик (около 4 месяцев), затем они разрушаются, в основном в селезенке.
Этапы жизни специализированной клетки, неспособной к делению (нейрона, эритроцита), условно можно изобразить на оси времени линией, разделенной на несколько отрезков (рисунок 1.3.16). Эти отрезки дают представление о временном соотношении периодов жизни такой клетки: рождения, созревания и активного функционирования, угасания (старения) и естественной гибели.
Рисунок 1.3.16. Этапы жизненного цикла специализированной клетки:
1 - рождение в процессе деления материнской клетки; 2 - созревание и дифференцировка; 3 - активное функционирование; 4 - угасание (старение); 5 - запрограммированная клеточная гибель
Время протекания каждого этапа и продолжительность жизненного цикла для однотипных клеток в нормальных условиях практически одинаковы.
Например, эритроциты живут 90-125 дней, а тромбоциты – всего 4 суток. Это говорит о том, что клетки используют для отсчета времени своей жизни некий механизм, алгоритм, заложенный в них природой. И в каждый момент жизни клетка строго следует законам, продиктованным этим алгоритмом.
На всех этапах клеточного цикла варьируют значения некоторых параметров жизнедеятельности клетки, и, в частности, отмечается различная скорость и интенсивность протекания процессов метаболизма (рисунок 1.3.17). Это обусловлено, в первую очередь, непрерывно меняющейся активностью ферментов, благодаря которым протекают все реакции в клетке. Ферменты могут синтезироваться в клетке “по мере надобности”, активироваться, временно блокироваться или полностью разрушаться (подробнее о ферментах будет сказано в разделе 1.4.3).
Рисунок 1.3.17. Интенсивность метаболизма на различных этапах жизни клетки:
1 - рождение; 2 - созревание и дифференцировка; 3 - активное функционирование; 4 - угасание (старение); 5 - запрограммированная клеточная гибель
Рассмотрим подробнее наиболее характерные процессы, происходящие на каждом из этапов клеточного цикла.
Рождение. Отправным моментом жизни любой клетки (кроме половой, для которой характерен мейоз) считают деление материнской клетки с образованием двух идентичных дочерних – митоз (от греческого mitos – нить). Во время митоза основная задача материнской клетки – поровну передать равноценный в количественном и качественном отношении генетический материал дочерним клеткам.
Митоз часто называют “танцем хромосом”. Каждая следующая фигура в этом танце не случайна, здесь нет ни одного лишнего или бессмысленного “па” – это еще один четкий, выверенный природой алгоритм. В. Дудинцев в романе “Белые одежды” так описывает процесс деления клетки: “Хромосомы шевелились, как клубок серых червей, потом вдруг выстроились в строгий вертикальный порядок. Вдруг удвоились – теперь это были пары. Тут же какая-то сила потащила эти пары врозь, хромосомы подчинились, обмякли, и что-то повлекло их к двум разным полюсам.”
Деление клетки на две идентичные (митоз) характеризуется сменой нескольких морфологически и физиологически различающихся стадий (рисунок 1.3.18). На первой стадии митоза хроматин плотно упаковывается (этот процесс называется суперспирализацией хроматина) с образованием хромосом (1). Каждая хромосома состоит из двух идентичных половинок (хроматид) – будущих дочерних хромосом. Затем при сокращении так называемого веретена деления (2), представляющего собой комплекс микротрубочек и микрофибрилл, дочерние хромосомы расходятся, буквально подтягиваются нитями веретена деления к противоположным полюсам клетки. После окончательного расхождения дочерние хромосомы вновь раскручиваются, превращаясь в длинные и тонкие нити хроматина (3). Веретено деления исчезает, хроматин в дочерних клетках окружается ядерной оболочкой, и между дочерними клетками образуется поперечная перетяжка (4) из клеточных мембран.
Рисунок 1.3.18. Последовательность стадий митоза (схема):
1 - хромосомы; 2 - веретено деления; 3 - хроматин; 4 - поперечная перетяжка
Хромосомы, как мы уже говорили, представляют собой максимально плотно упакованные нити ДНК, с которых на этапе деления невозможно считывание информации. Соответственно, на этапе деления не происходит биосинтеза белка, интенсивность процессов метаболизма минимальна, транспорт веществ в клетку и из нее практически равен нулю. Все процессы в делящейся клетке направлены на выполнение главнейшей задачи – максимально точно, без искажения, передать генетическую информацию дочерним клеткам, – в ущерб второстепенным (на данном этапе!) функциям.
Созревание. В этот период происходит дифференцировка клеток и становление ключевых ферментных систем. Клетка готовится выполнять предназначенные природой функции, постепенно активизируя свой обмен веществ.
Активное функционирование. Интенсивность реакций метаболизма и сопряженного с ним энергетического обмена в это время максимальны.
Процессы в клетке направлены на обеспечение постоянства внутренней среды и выполнение специфических функций: нейрон воспринимает и передает нервный импульс, эритроцит переносит кислород и так далее.
Угасание (старение). Этот процесс запрограммирован генетически и, в первую очередь, проявляется уменьшением выработки и активности ферментов в клетке. При этом замедляются биохимические реакции, тормозится метаболизм и энергетический обмен.
Стареющие клетки, как правило, имеют неудвоенное количество ДНК, но сохраняют жизнеспособность и некоторую метаболическую активность в течение определенного времени.
Естественная гибель клетки (апоптоз). К сожалению, до сих пор процесс естественной гибели клеток до конца не изучен.
Известно, что в клетке из-за блокирования ферментов прекращается синтез белка, а нет белка – нет и жизни. Морфологически апоптоз характеризуется разрушением ядра и цитоплазмы. “Осколки” погибшей клетки поглощаются и перерабатываются специальными клетками иммунной системы – фагоцитами. Но ведь клетки могут погибнуть и под воздействием случайных факторов (механических, химических и любых других). Случайная гибель клеток (а также ткани, органа) в биологии называется некрозом. Важно то, что естественная клеточная гибель (апоптоз) в отличие от некроза не вызывает воспаления в окружающих тканях.
В организме запрограммированная клеточная гибель выполняет функцию, противоположную митозу, и, тем самым, регулирует общее число клеток в организме. Апоптоз играет важную роль в защите организма при вирусных инфекциях. В частности, иммунодефицит при ВИЧ-инфекции определяется нарушениями в контроле апоптоза.
Теперь, когда мы рассмотрели все этапы жизненного цикла клеток, коротко остановимся на процессах регуляции численности клеток в организме. Во время эмбриогенеза (первого этапа внутриутробного развития) число клеток постоянно возрастает, причем в геометрической прогрессии (рисунок 1.3.19).
Рисунок 1.3.19. Увеличение численности клеток на этапе эмбриогенеза
Зигота, образовавшаяся после слияния яйцеклетки и сперматозоида, делится с образованием двух дочерних клеток. Затем, в результате последовательных делений, образуются четыре, восемь, шестнадцать клеток и так далее. Параллельно с увеличением численности на этапе эмбриогенеза происходит дифференцировка клеток – так образуются ткани (смотри раздел 1.5.1).
Во взрослом организме общая численность клеток стабильна, она остается практически неизменной на протяжении многих лет (рисунок 1.3.20).
Рисунок 1.3.20. Поддержание постоянства общей численности клеток во взрослом организме
Это происходит за счет уравновешивания процессов возникновения новых клеток (митоза) и гибели клеток, естественной (апоптоза) или случайной (некроза). При смещении равновесия, например, гибели большого количества клеток в результате травмы или другого негативного воздействия, включаются механизмы регенерации (увеличение интенсивности деления клеток для замещения погибших), о которых уже было сказано. Таким образом, общая численность клеток поддерживается практически на постоянном уровне.
Анатомия и физиология кожи
Кожа – наш самый большой орган, составляющий 15% от общей массы тела. Она выполняет множество функций, прежде всего защищает организм от воздействия внешних факторов физической, химической и биологической природы, от потери воды, участвует в терморегуляции. Последние научные данные подтверждают, что кожа не только обладает собственной иммунной системой, но и сама является периферическим иммунном органом.
Структура кожи
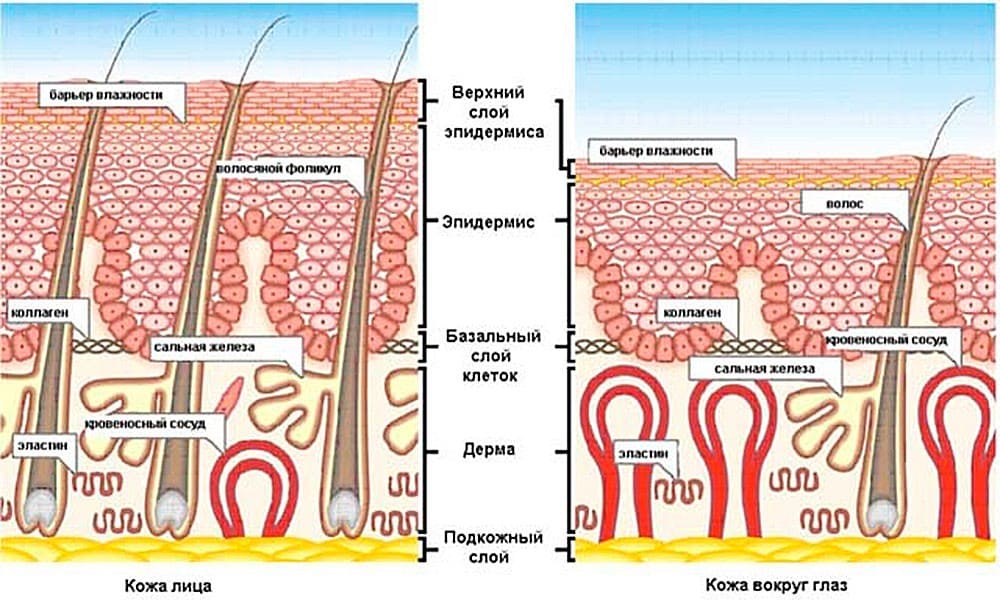
Кожа состоит из 3 слоев: эпидермиса, дермы и подкожной жировой клетчатки (ПЖК) (рис. 1). Эпидермис – самый тонкий из них, представляет собой многослойный ороговевающий эпителий. Дерма – средний слой кожи. Главным образом состоит из фибрилл структурного белка коллагена. ПЖК содержит жировые клетки – адипоциты. Толщина этих слоев может значительно варьировать в зависимости от анатомического места расположения.
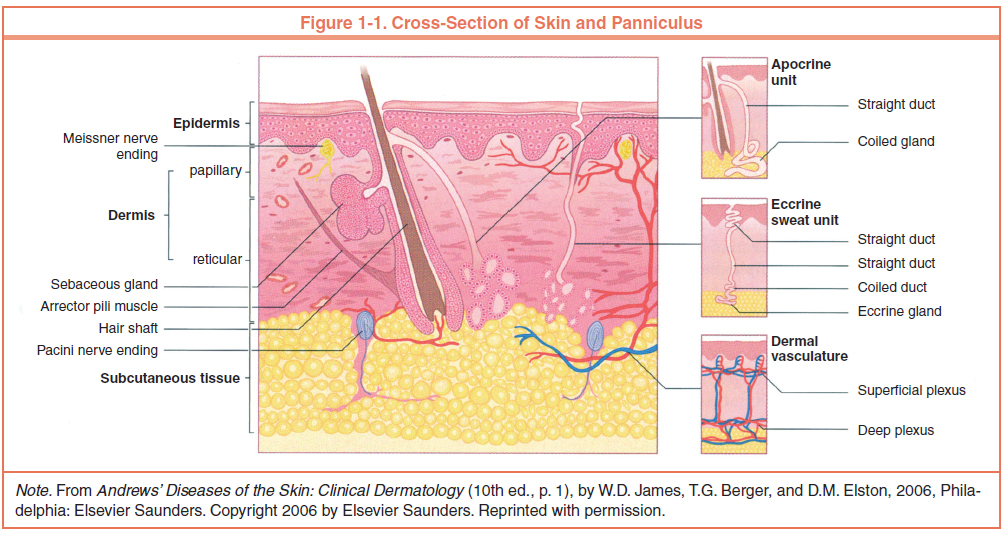
Рис.1. Структура кожи
Эпидермис
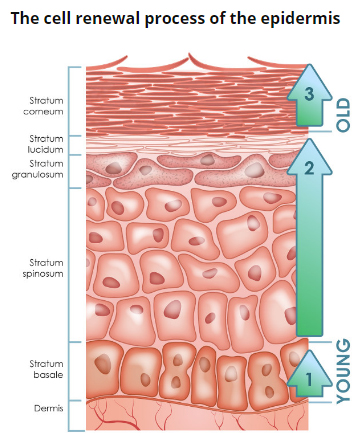
Рис. 2. Эпидермис
Эпидермис – постоянно слущивающийся эпителиальный слой кожи, в котором представлены в основном из 2 типа клеток – кератиноциты и дендритные клетки. В небольшом количестве в эпидермисе присутствуют меланоциты, клетки Лангерганса, клетки Меркеля, внутриэпидермальные Т-лимфоциты. Структурно эпидермис разделяется на 5 слоев: базальный, шиповатый, зернистый, блестящий и роговой , различающиеся положением и степенью дифференцировки кератиноцитов, основной клеточной популяции эпидермиса (рис. 2).
Кератинизация. По мере дифференцировки кератиноцитов и продвижения от базального слоя до рогового происходит их кератинизация (ороговевание) – процесс, начинающийся с фазы синтеза кератина кератиноцитами и заканчивающийся их клеточной деградацией. Кератин служит строительным блоком для промежуточных филаментов. Пучки из этих филаментов, достигая цитоплазматический мембраны, формируют десмосомы, необходимые для образования прочных контактов между соседними клетками. Далее, по мере процесса эпителиальной дифференцировки, клетки эпидермиса вступают в фазу деградации. Ядра и цитоплазматические органеллы разрушаются и исчезают, обмен веществ прекращается, и наступаетапоптозклетки, когда она полностью кератинизируется (превращается в роговую чешуйку).
Базальный слой эпидермиса состоит из одного ряда митотически активных кератиноцитов, которые делятся в среднем каждые 24 часа и дают начало новым клеткам новым клеткам вышележащих эпидермальных слоев. Они активируются только в особых случаях, например при возникновении раны. Далее новая клетка, кератиноцит, выталкивается в шиповатый слой, в котором она проводит до 2 недель, постепенно приближаясь к гранулярному слою. Движение клетки до рогового слоя занимает еще 14 дней. Таким образом, время жизни кератиноцита составляет около 28 дней.
Надо заметить, что не все клетки базального слоя делятся с такой скоростью, как кератиноциты. Эпидермальные стволовые клетки в нормальных условиях образуют долгоживущую популяцию с медленным циклом пролиферации.
Шиповатый слой эпидермиса состоит из 5-10 слоев кератиноцитов, различающихся формой, структурой и внутриклеточным содержимым, что определяется положением клетки. Так, ближе к базальному слою, клетки имеют полиэдрическую форму и круглое ядро, но по мере приближения клеток к гранулярному слою они становятся крупнее, приобретают более плоскую форму, в них появляются ламеллярные гранулы, в избытке содержащие различные гидролитические ферменты. Клетки интенсивно синтезируют кератиновые нити, которые, собираясь в промежуточные филаменты, остаются не связанными со стороны ядра, но участвуют в образовании множественных десмосом со стороны мембраны, формируя связи с соседними клетками. Присутствие большого количества десмосом придает этому слою колючий вид, за что он и получил название «шиповатый».
Зернистый слой эпидермиса составляют еще живые кератиноциты, отличающиеся своей уплощенной формой и большим количеством кератогиалиновых гранул. Последние отвечают за синтез и модификацию белков, участвующих в кератинизации. Гранулярный слой является самым кератогенным слоем эпидермиса. Кроме кератогиалиновых гранул кератиноциты этого слоя содержат в большом количестве лизосомальные гранулы. Их ферменты расщепляют клеточные органеллы в процессе перехода кератиноцита в фазу терминальной дифференцировки и последующего апоптоза. Толщина гранулярного слоя может варьировать, ее величина, пропорциональная толщине вышележащего рогового слоя, максимальна в коже ладоней и подошв стоп.
Блестящий слой эпидермиса (назван так за особый блеск при просмотре препаратов кожи на световом микроскопе) тонкий, состоит из плоских кератиноцитов, в которых полностью разрушены ядра и органеллы. Клетки наполнены элейдином – промежуточной формой кератина. Хорошо развит лишь на некоторых участках тела – на ладонях и подошвах.
Роговой слой эпидермиса представлен корнеоцитами (мертвыми, терминально-дифференцированными кератиноцитами) с высоким содержанием белка. Клетки окружены водонепроницаемым липидным матриксом, компоненты которого содержат соединения, необходимые для отшелушивания рогового слоя (рис. 3). Физические и биохимические свойства клеток в роговом слое различаются в зависимости от положения клетки внутри слоя, направляя процесс отшелушивания наружу. Например, клетки в средних слоях рогового слоя обладают более сильными водосвязывающими свойствами за счет высокой концентрации свободных аминокислот в их цитоплазме.
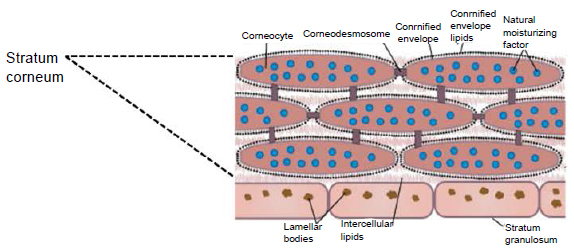
Рис. 3. Схематичное изображение рогового слоя с нижележащим зернистым слоем эпидермиса.
Регуляция пролиферации и дифференцировки кератиноцитов эпидермиса . Являясь непрерывно обновляющейся тканью, эпидермис содержит относительно постоянное число клеток и регулирует все взаимодействия и контакты между ними: адгезию между кератиноцитами, взаимодействие между кератиноцитами и мигрирующими клетками, адгезию с базальной мембраной и подлежащей дермой, процесс терминальной дифференцировки в корнеоциты. Основной механизм регуляции гомеостаза в эпидермисе поддерживается рядом сигнальных молекул – гормонами, факторами роста и цитокинами. Кроме этого, эпидермальный морфогенез и дифференцировка частично регулируются подлежащей дермой, которая играет критическую роль в поддержании постнатальной структуры и функции кожи.
Дерма
Дерма представляет собой сложноорганизованную рыхлую соединительную ткань, состоящую из отдельных волокон, клеток, сети сосудов и нервных окончаний, а также эпидермальных выростов, окружающих волосяные фолликулы и сальные железы. Клеточные элементы дермы представлены фибробластами, макрофагами и тучными клетками. Лимфоциты, лейкоциты и другие клетки способны мигрировать в дерму в ответ на различные стимулы.
Дерма, составляя основной объем кожи, выполняет преимущественно трофическую и опорную функции, обеспечивая коже такие механические свойства, как пластичность, эластичность и прочность, необходимые ей для защиты внутренних органов тела от механических повреждений. Также дерма удерживает воду, участвует в терморегуляции и содержит механорецепторы. И, наконец, ее взаимодействие с эпидермисом поддерживает нормальное функционирование этих слоев кожи.
В дерме нет такого направленного и структурированного процесса клеточной дифференцировки, как в эпидермисе, тем не менее в ней также прослеживается четкая структурная организация элементов в зависимости от глубины их залегания. И клетки, и внеклеточный матрикс дермы также подвергаются постоянному обновлению и ремоделированию.
Внеклеточный матрикс (ВКМ) дермы , или межклеточное вещество, в состав которого входят различные белки (главным образом коллаген, эластин), гликозаминогликаны, самым известным из которых является гиалуроновая кислота, и протеогликаны (фибронектин, ламинин, декорин, версикан, фибриллин). Все эти вещества секретируются фибробластами дермы. ВКМ представляет собой не беспорядочное скопление всех компонентов, а сложноорганизованную сеть, состав и архитектоника которой определяют такие биомеханические свойства кожи, как жесткость, растяжимость и упругость. К белкам ВКМ прикрепляются кератиноциты эпидермиса, которые тесно состыкованы друг с другом. Именно они и формируют плотный защитный слой кожи. Структура ВКМ также способна оказывать регулирующее влияние на погруженные в него клетки. Регуляция может быть как прямой, так и косвенной. В первом случае белки и гликозаминогликаны ВКМ непосредственно взаимодействуют с рецепторами клеток и инициируют в них специфические пути передачи сигнала. Косвенная регуляция осуществляется посредством действия цитокинов и ростовых факторов, удерживаемых в ячейках сети ВКМ и высвобождаемых в определенный момент для взаимодействия с рецепторами клеток. Структурная сеть ВКМ подвергается ремоделированию ферментами из семейства матриксных металлопротеиназ (ММР). В частности, ММР-1 и ММР-13 инициируют деградацию коллагенов I и III типов. Плотность сети ВКМ дермы неравномерна – в папиллярном слое она более рыхлая, в ретикулярном - значительно плотнее как за счет более близкого расположения волокон структурных белков, так и за счет увеличения диаметра этих волокон.
Коллаген – один из главных компонентов ВКМ дермы. Синтезируется фибробластами. Процесс его биосинтеза сложный и многоступенчатый, в результате которого фибробласт секретирует в экстрацеллюлярное пространство проколлаген, состоящий из трех полипептидных α-цепей, свернутых в одну тройную спираль. Затем мономеры проколлагена ферментивным путем собираются в протяженные фибриллярные структуры различного типа. Всего в коже не менее 15 типов коллагена, в дерме больше всего I, III и V типов этого белка: 88, 10 и 2% соответственно. Коллаген IV типа локализуется в зоне базальной мембраны, а коллаген VII типа, секретируемый кератиноцитами, играет роль адаптерного белка для закрепления фибрилл ВКМ на базальной мембране (рис. 4). Волокна структурных коллагенов I, III и V типов служат каркасом, к которому присоединяются другие белки ВКМ, в частности коллагены XII и XIV типов. Считается, что эти минорные коллагены, а также небольшие протеогликаны (декорин, фибромодулин и люмикан) регулируют формирование структурных коллагеновых волокон, их диаметр и плотность образуемой сети. Взаимодействие олигомерных и полимерных комплексов коллагена с другими белками, полисахаридами ВКМ, разнообразными факторами роста и цитокинами приводит к образованию особой сети, обладающей определенной биологической активностью, стабильностью и биофизическими характеристиками, важными для нормального функционирования кожи. В папиллярном слое дермы волокна коллагена располагаются рыхло и более свободно, тогда как ее ретикулярный слой содержит более крупные тяжи коллагеновых волокон.
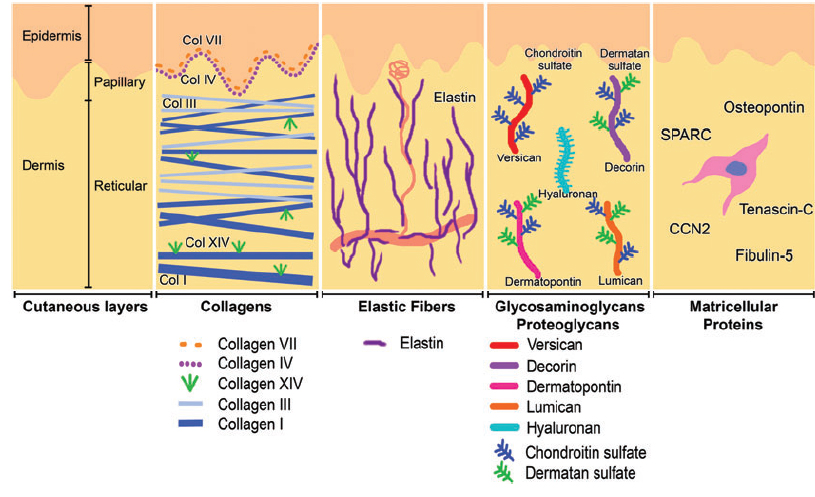
Рис. 4. Схематичное представление слоев кожи и распределения коллагенов разных типов.
Коллаген постоянно обновляется, деградируя под действием протеолитических ферментов коллагеназ и замещаясь вновь синтезированными волокнами. Этот белок составляет 70% сухого веса кожи. Именно коллагеновые волокна «держат удар» при механическом воздействии на нее.
Эластин формирует еще одну сеть волокон в дерме, наделяя кожу такими качествами, как упругость и эластичность. По сравнению с коллагеном эластиновые волокна менее жесткие, они скручиваются вокруг коллагеновых волокон. Именно с эластиновыми волокнами связываются такие белки, как фибулины и фибриллины, с которыми, в свою очередь, связывается латентный TGF-β-связывающий белок (LTBP). Диссоциация этого комплекса приводит к высвобождению и к активации TGF-β, самого мощного из всех факторов роста. Он контролирует экспрессию, отложение и распределение коллагенов и других матриксных белков кожи. Таким образом, интактная сеть из волокон эластина служит депо для TGF-β.
Гиалуроновая кислота (ГК) представляет собой линейный полисахарид, состоящий из повторяющихся димеров D-глюкуроновой кислоты и N-ацетилглюкозамина. Количество димеров в полимере варьирует, что приводит к образованию молекул ГК разного молекулярного веса и длины - 1х10 5 -10 7 Да (2-25 мкм), оказывающих, соответственно, различный биологический эффект.
ГК - высокогидрофильное вещество, влияющее на движение и распределение воды в матриксе дермы. Благодаря этому ее свойству наша кожа в норме и в молодости обладает высоким тургором и сопротивляемостью механическому давлению.
ГК с легкостью образует вторичные водородные связи и внутри одной молекулы, и между соседними молекулами. В первом случае они обеспечивают формирование относительно жестких спиральных структур. Во втором – происходит ассоциация с другими молекулами ГК и неспецифическое взаимодействие с клеточными мембранами, что приводит к образованию сети из полимеров полисахаридов с включенными в нее фибробластами. На длинную молекулу ГК, как на нить, «усаживаются» более короткие молекулы протеогликанов (версикана, люмикана, декорина и др.), формируя агрегаты огромных размеров. Протяженные во всех направлениях, они создают каркас, внося вклад в стабилизацию белковой сети ВКМ и фиксируя фибробласты в определенном окружении матрикса. В совокупности все эти свойства ГК наделяют матрикс определенными химическими характеристиками – вязкостью, плотностью «ячеек» и стабильностью. Однако сеть ВКМ является динамической структурой, зависящей от состояния организма. Например, в условиях воспаления агрегаты ГК с протеогликанами диссоциируют, а образование новых агрегатов между вновь синтезированными молекулами ГК (обновляющимися каждые 3 дня) и протеогликанами блокируется. Это приводит к изменению пространственной структуры матрикса: увеличивается размер его ячеек, меняется распределение всех волокон, структура становится более рыхлой, клетки меняют свою форму и функциональную активность. Все это сказывается на состоянии кожи, приводя к снижению ее тонуса.
Помимо регуляции водного баланса и стабилизации ВКМ, ГК выполняет важную регуляторную роль в поддержании эпидермального и дермального гомеостаза. ГК активно регулирует динамические процессы в эпидермисе, включая пролиферацию и дифференцировку кератиноцитов, окислительный стресс и воспалительный ответ, поддержание эпидермального барьера и заживление раны. В дерме ГК также регулирует активность фибробластов и синтез коллагена. Ремоделируя матрикс, ГК управляет функционированием клеток в матриксе, влияя на их доступность для различных факторов роста и изменяя их функциональную активности. От действия ГК зависит миграция клеток и иммунный ответ в ткани. Таким образом, изменения в распределении, организации, молекулярном весе и метаболизме ГК имеют значимые физиологические последствия.
Фибробласты представляют собой основной тип клеточных элементов дермы. Именно эти клетки отвечают за продукцию ГК, коллагена, эластина, фибронектина и многих других белков межклеточного матрикса, необходимых для формирования соединительной ткани. Фибробласты в различных слоях дермы различаются и морфологически, и функционально. От глубины их залегания в дерме зависит не только количество синтезируемого ими коллагена, но и соотношение типов этого коллагена, например I и III типов, а также синтез коллагеназы: фибробласты более глубоких слоев дермы производят меньшее ее количество. Вообще, фибробласты – очень пластичные клетки, способные менять свои функции и физиологический ответ и даже дифференцироваться в другой тип клеток в зависимости от полученного стимула. В роли последнего могут выступать и сигнальные молекулы, синтезированные соседними клетками, и перестройка окружающего ВКМ.
Подкожно-жировая клетчатка
Подкожно-жировая клетчатка , или гиподерма, - самый нижний слой кожи, располагается под дермой. Состоит из жировых долек, разделенных между собой соединительнотканными септами, содержащими коллаген и пронизанными крупными сосудами. Главными клетками жировых долек являются адипоциты, количество которых варьирует в различных областях тела. В настоящее время ПЖК рассматривают не только как энергетическое депо, но и как эндокринный орган, адипоциты которого участвуют в выработке ряда гормонов (лептина, адипонектина, резистина), цитокинов и медиаторов, оказывающих влияние на метаболизм, чувствительность к инсулину, функциональную активность репродуктивной и иммунной систем.
Эпидермис самый поверхностный слой кожи, который защищает наш организм от опасных факторов окружающей среды, токсинов, инфекции, а также препятствует обезвоживанию.
Эпидермис образован многослойным эпителием.
Строение эпидермиса
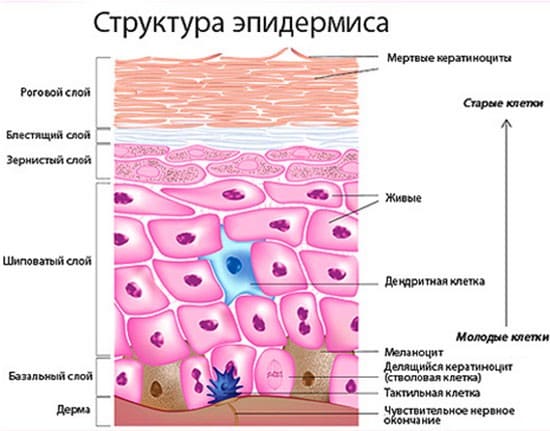
В его составе 5 слоев клеток:
- роговой слой – самый поверхностный, состоит из 5—6 рядов сплющенных, утративших свою форму неживых клеток, которые называются корнеоциты. Этот слой наиболее развит там, где кожа подвергается значительному механическому воздействию. Например, на ладонях и подошвах этих рядов бывает до 10—15.
- блестящий слой – представлен 3 - 4 рядами уплощенных клеток, границы между которыми трудно различить. Он также более выражен на ладонях и стопах;
- зернистый слой состоит из 2-4 рядов плотно прилегающих клеток ромбовидной формы;
- шиповатый слой состоит из 3-6, а иногда 15 слоев клеток многоугольной формы, которые отделены друг от друга узкими пространствами, соединяясь тонкими отростками, имеющими вид шипиков.
- базальный слой является регенераторным. Он представлен 1 рядом клеток кератиноцитов (90% ) и меланоцитов (5%).
Базальный слой эпидермиса
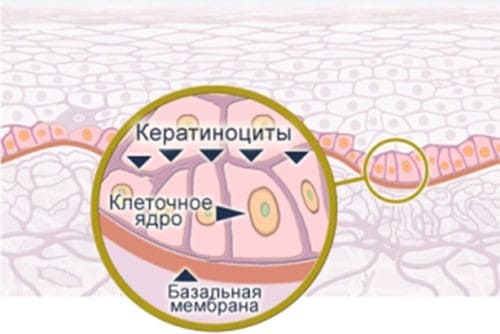
Эпидермис отделен от дермы базальной мембраной, которая представляет собой тонкую пластинку, состоящую из ретикулярных волокон, аморфного вещества и микроэлементов.
Базальная мембрана выполняет несколько важных функций:
- является опорой для клеток эпидермиса - кератиноцитов;
- базальная мембрана прочно связывает эпидермис с подлежащей дермой;
- препятствует росту эпидермиса в дерму;
- через базальную мембрану из сосудов дермы осуществляется питание, снабжение кислородом и выведение продуктов жизнедеятельности клеток эпидермиса.
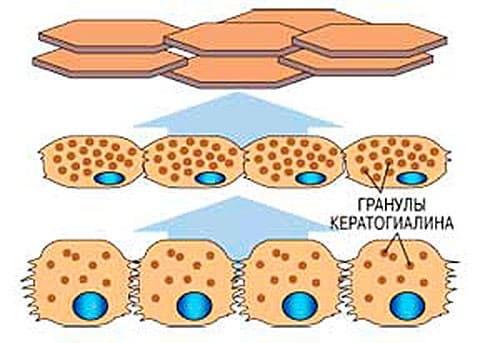
Базальный (самый нижний слой) называется ростковым или зародышевым, так как он дает начало всем клеткам эпидермиса.
Между собой клетки базального слоя соединены межклеточными мостиками (десмосомами), а к базальной мембране крепятся полудесмосомами. Десмосомы по мере созревания клеток уплотняются и становятся практически неразрывными в роговом слое.
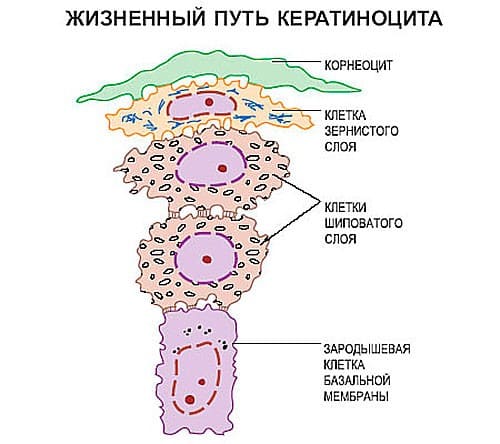
Основная функция базального слоя заключается в регулярном обновлении эпидермиса. Клетки базального слоя (кератиноциты) делятся (1 деление на 400 клеток), давая начало новым, которые, продвигаясь выше к поверхности, созревают, накапливают нерастворимый белок кератогиалин, утрачивают органеллы и все функции, постепенно превращаясь в неживые роговые чешуйки - корнеоциты.
Примерно за 28 - 30 дней «новорожденные» клетки базального слоя достигают поверхностного рогового, а затем они отшелушиваются и сменяются новыми. В детстве процесс обновления клеток эпидермиса идет более активно, а с возрастом замедляется. При травме кожи способность к делению появляется в клетках шиповатого слоя, что обеспечивает быстрое заживление.
Меланоциты - пигментные клетки эпидермиса
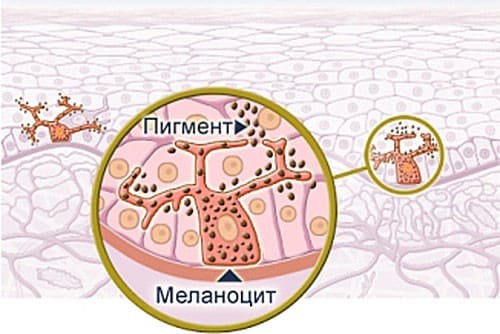
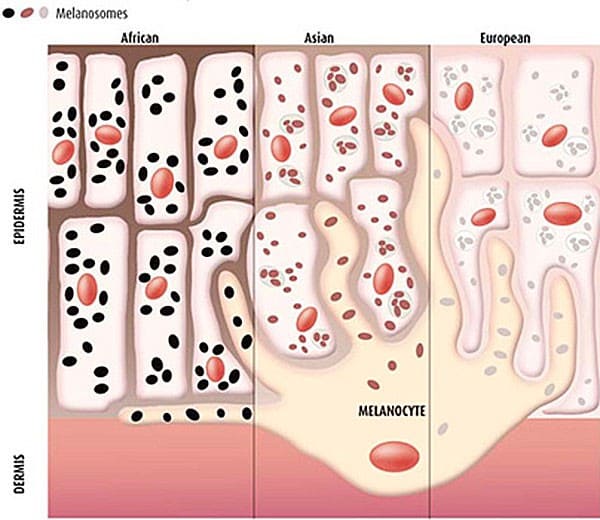
Между клетками базального слоя располагаются пигментные клетки –меланоциты. Эти клетки имеют большое количество отростков, распространяющихся до рогового слоя эпидермиса. Главной функцией меланоцитов является синтез меланина — пигмента, придающего цвет коже, волосам, а так же отвечает за загар, который проявляется под действием ультрафиолетовых лучей. Кроме того, меланин обладает хорошими теплоизоляционными свойствами.
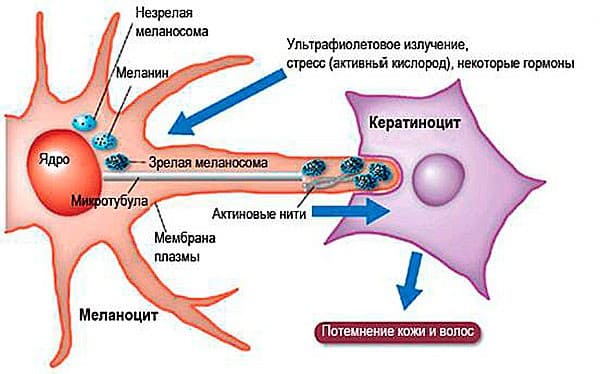
Меланоциты синтезируют, накапливают меланин в виде капелек – меланосом, которые по своим отросткам передают базальным кератиноцитам, образуя защитный экран от ультрафиолетового и радиоактивного излучения. У людей с темной кожей пигмент проникает также в клетки шиповатого и зернистого слоев.
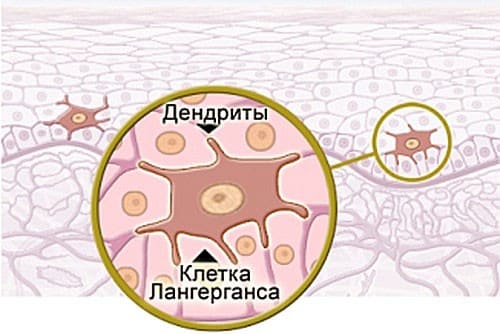
Подобно меланоцитам, иммунные клетки Лангерганса обладают большим количеством отростков. Они обычно располагаются в пределах шиповатого слоя (средней части эпидермиса), хотя случайные клетки также могут встречаться и в самых нижних слоях эпидермиса. Клетки Лангерганса выполняют функцию защиты от инородных тел и микробов.
Плотные соединения между роговыми чешуйками в сочетании с поверхностной сально-жировой пленкой, образованной продуктами жизнедеятельности эпителия, сальных и потовых желез кожи, имеет слабокислую реакцию (4,5-5,5), задерживает испарение воды из эпидермиса и является естественным первым защитным барьером при проникновении инфекционных, химических и физических агентов в организм человека.
Интересные факты об эпидермисе
Самый толстый эпидермис на ладонях и стопах, самый тонкий в области половых органов и век. Толщина рогового слоя зависит от скорости размножения и продвижения кератиноцитов в вертикальном направлении и скорости отторжения роговых чешуек.
Эпидермис обладает полярностью: строение клеток базального и рогового слоя радикально отличается.
Эпидермису присуща высокая способность к регенерации. Восстановление происходит за счет деления кератиноцитов базального, шиповатого слоя, а также за счет стволовых клеток кожи.
В эпидермисе нет сосудов. Питание эпидермиса осуществляется через базальную мембрану за счет дермы.
Деление базальных кератиноцитов происходит в основном по ночам и в утренние часы.
Между клетками эпидермиса практически нет межклеточного, аморфного вещества, а клетки связаны между собой с помощью отростков и прочных десмосом (межклеточных мостиков).
Каждый день с кожи слущивается от 6 до 14 грамм роговых чешуек.
Цвет кожи зависит от степени кровенаполнения сосудов и от количества пигмента – меланина в одной клетке, а не от общего количества меланоцитов, которое примерно постоянно у людей различных рас, хотя доказано, что под действием ультрафиолетовых лучей деление меланоцитов может усиливаться.
Как правило, у светлокожих и светловолосых людей накапливается незначительное количество пигмента в клетках базального слоя, а у смуглых брюнетов содержание пигмента больше. У жителей тропических стран пигмента очень много и он располагается не только в базальном, но и в шиповидном слое. Людей с полным отсутствием меланоцитов называют альбиносами.
От состояния эпидермиса во многом зависит наш внешний вид.
С возрастом клетки эпидермиса становятся мелкими, очень медленно делятся и продвигаются к поверхности, как правило, роговой слой становится толще, так как нарушается слущивание кожи. С другой стороны ослабляются связи (десмосомы) между роговыми чешуйками, поэтому характерно неравномерное шелушение. Вместо полного обновления клетки наслаиваются друг на друга, а мы получаем толстую и ороговевшую кожу.
Читайте также:

