Какие пробиотики лучше при атопическом дерматите
Обновлено: 24.04.2024
Пробиотики - препараты, которые применяют для достижения баланса в составе микрофлоры, имеющейся в ЖКТ. В их составе - культуры или смеси культур живых микроорганизмов.
Пробиотические бактерии были выделены из грудного молока, поэтому место их нахождения – ЖКТ новорожденного. В последние годы исследования показали, что пробиотики очень помогают в лечении и профилактике атопического дерматита.
Большое влияние на развитие атопического дерматита у детей играет состояние микрофлоры кишечника. Пробиотики уменьшают побочный эффект от приема других препаратов, снижают аллергенность организма, улучшают самочувствие. Считается, что при здоровой микрофлоре кишечника проще бороться против потенциальных аллергенов и вирусов.
Пробиотики при атопическом дерматите ребенку рекомендуют добавлять в пищу. К пище, обладающей пробиотическим эффектом относятся натуральные кисломолочные продукты; молочные продукты, в которые добавлены ацидофильные бактерии; квашеные продукты без уксуса и стерилизации, черный хлеб, приготовленный на заквасках.
При запоре у ребенка при атопическом дерматите симптомы болезни усиливаются, а часто и являются основной причиной. При запоре аллергены остаются в неопорожненном кишечнике и являются причиной аллергии. Частота стула у ребенка очень важна и если есть проблемы, то необходимо обязательно обращаться к врачу.
Врачи при запоре и у детей, и у взрослых пациентов при атопическом дерматите назначают лекарственные препараты группы пробиотков.
При регулярном приеме правильно подобранных врачом пробиотических препаратов кал размягчается и лучше продвигается по кишечнику. Средства необходимо принимать в течение нескольких недель. Мгновенного эффекта не будет.
Также прием пробиотиков снижает до минимума распирание и вздутие живота, урчание. Самыми лучшими считаются те, в состав которых входят лактобактерии и бифидобактерии. Для младенцев пробиотики подбираются с учетом работы желудочно-кишечного тракта, питания (грудного или искусственного) и возраста.
Таким образом, лечение запоров пробиотиками при атопическом дерматите в большинстве случаев дает положительные результаты. Однако лечение должно быть комплексным: не забывать о приеме других лекарств и витаминов, прописанных врачом, соблюдать диету, много двигаться и бывать на свежем воздухе.
Самолечение не допускается. Количество и продолжительность приема пробиотических средств врач должен подбирать каждому пациенту индивидуально.
Материал подготовил: Раводин Роман Анатольевич, дерматовенеролог, дерматоонколог, дерматокосметолог. Доктор медицинских наук, доцент
Н.А. Иванова, ФГБВОУ ВПО «Военно-медицинская академия имени С.М. Кирова» Министерства обороны РФ, г. Санкт-Петербург, к. м. н.
Ключевые слова: пробиотики, лечение атопического дерматита, адаптация желудочно-кишечного тракта, Линекс для детей ®
Keywords: probiotics, treatment of atopic dermatitis, adaptation of gastrointestinal tract, Lineks for children ®
В основе развития АтД лежит «вторая ошибка» иммунитета, а именно генетически детерминированная потеря толерантности к экзогенным неинфекционным аллергенам («первая ошибка» иммунитета – врожденные иммунодефициты). С рождения до конца первого месяца жизни ребенок находится в первом критическом периоде становления иммунной системы [1].
В это время начинается постнатальная антигенная селекция и «обучение» иммунной системы для достижения зрелости и формирования толерантности. Манифестация аллергических заболеваний у предрасположенных к атопии детей наступает тогда, когда сумма наследственных факторов (нерегулируемых) и неблагоприятных факторов внешней среды (регулируемых) превышает пороговое значение.
Каждый ребенок после рождения имеет постоянный контакт с пищевыми белками, которые абсорбируются из желудочно-кишечного тракта (ЖКТ) без каких-либо патологических иммунологических и клинических реакций. В норме поступление пищевых белков формирует пищевую толерантность – специфическое подавление иммунного ответа при пероральном поступлении аллергена.
Толерантность поддерживает баланс между нормальным ответом на внешний агент и ги-перергическим ответом, который характерен для детей, предрасположенных к развитию аллергических заболеваний.
Формирование толерантности зависит от:
- возраста ребенка;
- дозы и свойств аллергенов;
- состояния барьерной функции ЖКТ;
- адекватности распознавания аллергена иммунной системой.
Профилактические меры следует начинать в пренатальном периоде, ограничивая (но не исключая) наиболее значимые пищевые аллергены в последнем триместре беременности. Большое значение имеет раннее прикладывание к груди и исключение докорма молочной смесью в родильном доме. При наличии абсолютных показаний к докорму и искусственном вскармливании с рождения следует использовать смеси на основе частичного гидролиза белков коровьего молока.
Большое значение в формировании толерантности имеет анатомическая и функциональная состоятельность эпителиального барьера слизистой оболочки кишечника, что напрямую связано с адекватной работой иммунной системы, ассоциированной со слизистой оболочкой желудочно-кишечного тракта (GALT – gut-associated lymphoid tissue), которая обеспечивает адекватную работу врожденного и приобретенного иммунного ответа.
Поддержание целостности барьера ЖКТ и адекватный иммунный ответ на пищевые аллергены во многом обеспечиваются нормальной микрофлорой кишечника. Значимость микрофлоры кишечника в формировании иммунной системы доказана экспериментально на животных. Врожденное и созданное искусственно отсутствие микробиоты у животных приводит дефектам строения и функции GALT – основным лимфоидным органом, ответственным за формирование оральной толерантности. У стерильных животных отмечено уменьшение количества лимфоидных образований GALT, в которых происходит распознавание аллергенов. Основная мембрана слизистой оболочки ЖКТ более тонкая, чем у животных с нормальной микрофлорой. Лимфатические узлы меньших размеров и с меньшим количеством клеток. Помимо структурных нарушений у стерильных животных отмечено снижение Toll-like-рецепторов, которые ответственны за распознавание и презентацию антигенов и за направление иммунного ответа в сторону развития толерантности. Стерильные животные не способны к развитию оральной толерантности [2].
До рождения кишечник плода стерилен, но начиная с интранатального периода быстро заселяется микроорганизмами. В течение нескольких часов после рождения микроорганизмы появляются в кале. При грудном вскармливании преобладают Bifidobacterium, поскольку комплекс олигосахаридов, которые содержатся в грудном молоке, обеспечивает колонизацию этими микроорганизмами кишечник новорожденного ребенка. При искусственном вскармливании микробиоту новорожденных детей составляет микст микроорганизмов, но коррекция состава адаптированных молочных смесей может эти различия уменьшить. К 2 годам микрофлора ребенка мало отличается от микрофлоры взрослых [3], что указывает на огромную значимость поддержания и, при наличии показаний, коррекцию состава кишечной микрофлоры в раннем детском возрасте. При исследовании микрофлоры кишечника детей из группы риска до манифестации АтД были выявлены количественные, качественные и функциональные различия микрофлоры кишечника по сравнению с детьми без предрасположенности к атопии [4]. Количественные изменения характеризуются снижением числа Bifidobacterium species и количественным преобладанием B. Adolescentis, присутствие которых характерно для взрослых людей. Функциональные нарушения характеризуются снижением адгезии Bifidobacterium species, снижением продукции IL10 и увеличением секреции провоспалительных цитокинов [5]. Данные наблюдения позволяют предположить, что пищевые добавки, которые содержат живые микроорганизмы, могут изменить имеющийся дисбаланс и метаболическую активность микрофлоры кишечника и таким образом повлиять на становление иммунологической реактивности ребенка, угрожаемого по атопии, то есть предотвратить развитие заболевания.
Пробиотики представляют собой препараты, содержащие культуры или смеси культур живых микроорганизмов, которые применяются для достижения сбалансированного равновесного состава микрофлоры, заселяющей, в частности, ЖКТ.
Обнаружение бактерий в грудном молоке существенно повысило интерес к пробиотикам, поскольку и молоко здоровой матери рассматривается как источник пробиотических бактерий, которые способствуют защите ребенка от инфекционных и аллергических заболеваний. Пробиотические бактерии, которые первоначально выделены из человеческого молока, находятся в симбиозе с ребенком с рождения, и они изначально адаптированы для проживания в желудочно-кишечном тракте новорожденного. Их использование физиологично у особо чувствительных категорий – новорожденных детей и у детей первого года жизни. Bifidobacterium animalis subsp. lactis BB-12 является повсеместно признанным пробиотическим штаммом, который широко применяется в клинической практике для симптоматического лечения инфекционных диарей (например, при ротавирусной инфекции), антибиотик-ассоциированной диареи, метеоризма и других пищеварительных расстройств. Кроме того, в последнее десятилетие проведены многочисленные исследования эффективности пробиотиков, в которых содержатся Bifidobacterium и Lactobacillus, в профилактике аллергических заболеваний у детей.
В 2014 году опубликованы результаты мета-анализа исследований, посвященных эффективности первичной профилактике атопиче-ского дерматита у детей с наследственной отя-гощенностью по аллергическим заболеваниям [6]. В метаанализ было включено 16 исследований, соответствующих критериям доказательной медицины.
В 11 исследованиях пробиотики назначались беременным женщинам в последнем триместре беременности и во время вскармливания грудью, в 4 – только в постнатальный период (матери или новорожденному ребенку), в 1 исследовании – только пренатально. В 7 исследованиях использовали монопрепарат, в 9 – комбинации бактерий. Эффективность лечения оценивали по частоте манифестации АтД на первом году жизни у детей основной группы и группы сравнения – дети с отягощенной наследственностью, но не получавшие про-биотики. Более эффективным оказалось назначение пробиотиков в пре- и постнаталь-ном периоде (последние месяцы беременности и ребенку с момента рождения до 1 месяца жизни) по сравнению с назначением только в пренатальном и только в постнатальном периоде.
Профилактическое влияние пробиотиков на иммунную систему детей, предрасположенных к аллергическим заболеваниям, реализуется через их влияние на эпителиальные и дендритные клетки субэпителиального слоя слизистой оболочки ЖКТ, где они активируют образраспознающие Tool-lake-рецепторы, что приводит к формированию пищевой толерантности. Помимо новорожденных детей с отягощенным семейным анамнезом, воздействие многих постнатальных факторов может вызывать нарушение формирования нормальной микрофлоры. К ним можно отнести детей, рожденных путем кесарева сечения, с недоношенностью, поздним прикладыванием к груди, длительным пребыванием в родильном доме, раннем искусственном вскармливании.
АтД является, как правило, самым ранним клиническим проявлением атопии и наиболее часто встречающимся атопическим заболеванием у детей первых лет жизни. Кожные покровы ребенка раннего возраста не случайно становятся «органом-мишенью» аллергической реакции. Это связано с анатомо-гистологическими особенностями, а также с характером иммунного ответа кожи на воздействие антигенов внешней среды у новорожденного и грудного ребенка. Собственно кожа (дерма) и подкожная жировая клетчатка детей первых месяцев жизни представляют собой «средоточие» клеток, участвующих в распознавании, представлении антигенов и в ответе на них. Особенно большое значение имеет наличие в коже и подкожной клетчатке множества тучных клеток. Исследователи отмечают, что с конца ХХ века появилась тенденция к более ранней манифестации заболевания (с первого-второго месяца жизни), частая манифестация заболевания у детей, находящихся на грудном вскармливании, более тяжелое течение с увеличением площади поражения кожи, более частое, чем в предшествующие десятилетия, формирование респираторной аллергии у детей с АтД [7]. Аллергические болезни кожи у детей первых лет жизни составляют 80–85% случаев всей аллергической патологии [8]; у 50% пациентов манифестация АтД происходит на первом году жизни (9); у 60– 65% детей с АтД выявлены дисбиотические нарушения кишечника [10].
АтД гетерогенен по клинико-иммунологическим формам и ответу на терапию. В настоящее время рассматривают иммунную и неиммунную формы заболевания. При IgE-зависимой форме АтД положительный эффект влияния пробиотиков на течение заболевания может быть связан с иммунотропным действием пробиотиков, которое описано ранее, хотя не следует переоценивать влияние пробиотиков на сформировавшийся атопический фенотип ребенка. Тем не менее такие механизмы пробиотиков, как активация синтеза sIgA, стимуляция образования биопленки и др., способствуют повышению барьерной функции ЖКТ, что снижает триггерную роль пищевых аллергенов у детей как с IgE, так и не с IgE-зависимой формой заболевания. Секреция противомикробных пептидов (бактериоци-нов), конкурентное блокирование адгезии патогенных бактерий повышает резистентность ребенка с АтД инфекциям ЖКТ и тем самым также способствует сохранности барьерной функции слизистой оболочки кишечника. Пробиотики не могут быть монотерапией АтД, но вносят существенный вклад в эффективную комплексную терапию этого распространенного заболевания. Кроме того, применение пробиотиков актуально при совместном течении двух столь часто встречающихся патологических состояний, как острые кишечные инфекции (ОКИ) и АтД. Иммунный дисбаланс и нарушения микробиоценоза ЖКТ, возникающие в результате подобного сочетания, могут приводить как к усилению клинических проявлений, так и к низкой эффективности традиционного лечения этих двух патологических состояний. Назначение симбиотического препарата Линекс детям с АтД с первых дней острой кишечной инфекции (курсом не менее 2 недель) заметно ускоряло сроки выздоровления, улучшало прогноз и исход заболевания, а также способствовало снижению риска и длительности обострения фоновой аллергической патологии, доказанно влияя на выраженность микроэкологических нарушений кишечника [11].
В метаанализе, проведенном в 2014 году [12], подтверждена клиническая эффективность пробиотиков и симбиотиков в комплексной терапии АтД у детей и взрослых.
Данные литературы свидетельствуют о высокой эффективности Lactobacilli LGG и Bifidobacteria ВВ-12 [13], при этом подчеркивается, что нет преимуществ в использовании микста бактерий перед монопрепаратами [14]. Линекс для детей отвечает всем требованиям, предъявляемым к пробиотику, который можно с успехом использовать у детей с целью профилактики и комплексного лечения АтД. Это пищевая добавка, которая содержит только Bifidobacterium animalis subsp. lactis ВВ-12 не менее 1,0×10*8 КОЕ/г (что соответствует 1,5×10*8 КОЕ/саше). Линекс для детей не содержит лактозы. Вспомогательный компонент мальтодекстрин нейтрален для пищеварения младенца. Пробиотик Линекс для детей хорошо переносится и может быть рекомендован при любых неблагоприятных состояниях, которые сопряжены с риском нарушения микробиоценоза и иммунологической толерантности кишечника [15].
А.А. Алексеева, к.м.н., врач аллерголог-иммунолог, старший научный сотрудник отделения восстановительного лечения детей с аллергическими болезнями и заболеваниями органов дыхания НИИ ПП и ВЛ.
Научный центр здоровья детей РАМН, Москва
Атопический дерматит (АД) относится к числу распространенных аллергических болезней у детей и приобретает все большее медико-социальное значение. Существенным фактором риска является патология органов желудочно-кишечного тракта, особенно дисбиоз кишечника, который выявляется у 89–94,1% детей, больных атопическим дерматитом. Свидетельством этому служат как взаимосвязь степени выраженности дисбиоза с тяжестью клинических проявлений АД, так и то, что целенаправленное воздействие на микрофлору кишечника приводит к повышению эффективности лечения основного заболевания. В протоколы лечения атопического дерматита у детей наряду с элиминационной диетой, приемом антигистаминных средств, местной терапией в течение многих десятилетий включают энтеросорбенты. Особенно эффективными являются лекарственные средства, содержащие пребиотики и сорбенты. В статье представлен широкий опыт применения пребиотика со свойствами сорбента (препарат Лактофильтрум) в комплексной терапии атопического дерматита у детей.
Ключевые слова: энтеросорбенты, пребиотики, атопический дерматит, дисбиоз кишечника.
Проблема атопического дерматита приобретает в последние годы все большее медико-социальное значение, т.к. распространенность заболевания неуклонно растет. Атопический дерматит относится к числу распространенных аллергических болезней у детей и представляет собой хроническое воспалительное заболевание кожи, сопровождающееся зудом, обусловленное воздействием на сенсибилизированный организм ребенка различных аллергенов [1]. В типичных случаях заболевание начинается в раннем детском возрасте, может продолжаться или рецидивировать в зрелом возрасте и привести к физической и эмоциональной дезадаптации пациента. За последние три десятилетия распространенность заболевания, по данным эпидемиологических исследований, возросла и составляет в развитых странах, по мнению разных авторов, 10– 15% у детей в возрасте до 5 лет и 15–20% у детей школьного возраста [2].
Атопический дерматит — мультифакториальное заболевание, которое в большинстве случаев развивается у лиц с наследственной предрасположенностью и часто сочетается с другими аллергическими болезнями (бронхиальная астма, аллергический ринит, пищевая аллергия, рецидивирующие кожные инфекции), немаловажно и отрицательное влияние неблагоприятных воздействий внешней среды. Существенным фактором риска АД является патология органов желудочно-кишечного тракта, особенно дисбиоз кишечника, который выявляется у 89–94,1% детей, больных атопическим дерматитом [3–5]. Несомненно, кишечная микрофлора в силу большой функциональной нагрузки не может не участвовать в процессах патологических расстройств при АД.
Свидетельством этому служат как взаимосвязь степени выраженности дисбиоза с тяжестью клинических проявлений атопического дерматита, так и то, что целенаправленное воздействие на микрофлору кишечника приводит к повышению эффективности лечения основного заболевания [3, 6, 7]. Кроме того, рост заболеваемости атопическим дерматитом происходит параллельно с широким распространением кишечного дисбиоза в период новорожденности. Это может быть связано с тем, что нарушению микроэкологии кишечника и возникновению аллергических реакций способствуют одни и те же факторы. Среди них значительное место занимает лишение ребенка грудного молока с первых дней жизни, ранний перевод на смешанное и искусственное вскармливание, расширение спектра лекарственных препаратов, широкое внедрение химии в быт, неблагоприятная окружающая среда и т.д. [6].
В состав флоры содержимого толстого кишечника входят анаэробные и аэробные бактерии. Нормальная микрофлора на 95% состоит из анаэробных видов бактерий, главными из которых являются бифидобактерии и лактобактерии. Аэробные бактерии, представленные кишечными палочками, энтерококками и др., составляют сопутствующую микрофлору. К остаточной микрофлоре относят стафилококки, клостридии, протей, грибы. Самые многочисленные и незаменимые представители полезной микрофлоры — это бифидобактерии.
Бифидобактерии стимулируют перистальтику, предупреждая нарушения стула, повышают эффективность факторов иммунитета организма, инактивируют некоторые канцерогены и вырабатывают витамины. Типичными продуктами жизнедеятельности бифидобактерий являются молочная, уксусная, муравьиная и янтарная кислоты, аминокислоты и белки, витамины В1, В2, К, никотиновая, пантотеновая и фолиевая кислоты, пиридоксин, цианокобаламин. Производя молочную и уксусную кислоту, они препятствуют размножению патогенных микроорганизмов. Бифидобактерии стимулируют лимфоидный аппарат человека и участвуют в процессе синтеза иммуноглобулинов. В клеточной стенке данных бактерий содержится большое количество мурамил-дипептида, который активирует образование В- и Т-лимфоцитов и макрофагов. Указанные бактерии являются естественными биосорбентами и способны накапливать значительное число соединений тяжелых металлов, фенолы, формальдегиды и другие токсичные вещества, попадающие в организм хозяина из окружающей среды и влияющие на снижение иммунитета [3, 8]. Еще одна группа полезных микроорганизмов — лактобактерии, без участия которых нельзя представить нормальную жизнедеятельность организма. Лактобациллы заселяют организм новорожденного в раннем постнатальном периоде. Средой обитания лактобацилл являются различные отделы желудочно-кишечного тракта, начиная с полости рта и кончая толстой кишкой. Лактобациллы (Lactobacillus acitophilus) обеспечивают своевременное опорожнение кишечника. Эти бактерии стимулируют образование IgА, которые, особенно в раннем детском возрасте, нейтрализуют пищевые аллергены и уменьшают их всасывание в кишечнике [8–10]. Кроме прямого влияния лактобактерий на сенсибилизацию при атопическом дерматите, в настоящее время доказано опосредованное воздействие дисбиоза кишечника на состав микрофлоры кожи при АД: снижение содержания лактобактерий в кишечнике приводит к повышению уровня Staphylococcus epidermidis на коже, которые являются дополнительным источником аллергизации организма [11, 12].
Под дисбиозом понимают состояние экосистемы, при котором нарушается функционирование ее составных частей и механизмов их взаимодействия (в зарубежной литературе применяется термин «Bacterial overgrowth syndrome» — «синдром избыточного бактериального роста», включающий в себя изменение количественного и видового состава микроорганизмов, характерных для биотопа). Дисбиотические состояния приводят к изменениям в количественном и качественном составе микрофлоры человека, что создает условия для реализации вирулентного действия условно-патогенных микроорганизмов, обычно обнаруживаемых в содержимом кишечника в небольших количествах. Обильно развивается гнилостная или бродильная флора, грибы, преимущественно рода Candida, в кишечнике могут обнаруживаться микроорганизмы, в норме нехарактерные для него. Они не способны выполнять многие физиологические функции, присущие нормальной микрофлоре, как результат — утрачивается способность инактивировать токсические продукты кишечного содержимого, нарушается поглощающая способность кишечника [3, 8]. Это, как правило, приводит к нарушению ферментного статуса пищеварительного тракта, создавая условия для развития патологии полостного, пристеночного и мембранного пищеварения и всасывания. Наблюдается повышенное поступление бактериальных и инфекционных аллергенов в организм ребенка. Значительно повышенная антигенная стимуляция недорасщепленными макромолекулами пищевых веществ и бактериальными аллергенами при слабости иммунного ответа и неспособности организма к элиминации комплексов антиген-антитело приводит к отягощению атопического дерматита [12]. Известно, что кожа имеет физиологическую связь с различными органами и системами организма человека и является своеобразным экраном, отражающим многие патологические процессы. В генезе атопического дерматита важная роль принадлежит пищевой сенсибилизации.
Обязательным условием коррекции дисбиоза кишечника является выявление и устранение причины его возникновения, а также эффективная терапия основного заболевания [13, 14].
В связи с этим принципы лечения атопического дерматита включают воздействие на основные звенья патогенеза аллергического воспаления и устранение аллергена. Оптимальные рекомендации по терапии ребенка с атопическим дерматитом должны включать следующие основные позиции:
1) мероприятия по устранению аллергена (элиминационная диета и изменения аллергенного окружения);
2) сеансы психотерапии;
3) наружную терапию (увлажняющие и смягчающие средства; топические глюкокортикоиды; топические ингибиторы кальциневрина; антисептики и местные антибактериальные препараты при осложненных формах);
4) системное лечение (антигистаминные препараты, стабилизаторы тучных клеток; антибактериальная терапия; энтеросорбенты, при тяжелом течении — системная иммуномодулирующая терапия) [15].
В протоколы лечения атопического дерматита у детей наряду с элиминационной диетой, приемом антигистаминных средств, местной терапией в течение многих десятилетий включают энтеросорбенты.
Сорбенты выводят из организма токсичные вещества и уменьшают метеоризм, как правило, наблюдающийся при дисбиозе. Показано также, что аутомикроорганизмы обеспечивают более быстрое восстановление нормального состояния микрофлоры кишечника, чем вводимые извне [16]. Основой пребиотиков являются препараты, содержащие бифидогенные факторы, стимулирующие рост и развитие полезных бактерий (лактулоза, соевый олигосахарид, ксилобиоза и др.). В практике хорошо зарекомендовали себя препараты, содержащие лактулозу. Идеальным сочетанием являются лекарственные средства, содержащие пребиотики и сорбенты.
В последние годы активно используются препараты на основе гидролизного лигнина — природного полимера растительного происхождения, продукта переработки древесины хвойных и лиственных пород деревьев. К таким препаратам относится пребиотик со свойствами сорбента Лактофильтрум (ОАО «Сти-Мед-Сорб», Россия) — комплексный препарат, содержащий гидролизный лигнин и лактулозу. Действие лигнинов основано на способности сорбировать и прочно удерживать токсины экзогенного и эндогенного происхождения, патогенные микроорганизмы, присутствующие в энтеральной среде. Лигнины обладают более высокой сорбционной емкостью по сравнению с другими сорбентами. Это обусловлено наличием в них не только активной поверхности частиц, но и развитой пористой системы. Лигнины не травмируют слизистую оболочку кишечника и обладают репаративными свойствами по отношению к ней [17, 18]. Лактулоза, входящая в состав Лактофильтрума, является синтетическим дисахаридом. Она не подвергается расщеплению ферментами в тонком кишечнике. Активное вещество лактулозы начинает действовать в толстой кишке, где под влиянием кишечной микрофлоры трансформируется в низкомолекулярные органические кислоты, в основном молочную, уксусную, масляную и пропионовую. Благодаря подкислению кишечного содержимого подавляется рост гнилостной и болезнетворной микрофлоры, увеличивается осмотическое давление в просвете толстой кишки. Важно также, что лактулоза не сорбируется на поверхности лигнина, т.к. ее молекула невелика по размеру и несет на своей поверхности (как и большинство активных групп лигнина) отрицательный заряд [19, 20]. Особенностью комплекса пребиотика (лактулозы) и сорбента (лигнина) является суммарный эффект, направленный на формирование оптимального микробиоценоза кишечника [21]. Кроме того, препарат имеет существенное преимущество перед другими энтеросорбентами — он представлен не в виде порошка или геля, что затрудняет дозирование, а в таблетированной форме, существенно улучшающей его органолептические свойства.
В 2002 г. в отделении аллергологии Научного центра здоровья детей РАМН проводилось исследование, целью которого был анализ эффективности препаратов Фильтрум (препарат растительного происхождения, получаемый из гидролизного лигнина) и Лактофильтрум в комплексной терапии детей с атопическим дерматитом и бронхиальной астмой [22]. Было обследовано 30 детей с атопическим дерматитом в возрасте от 3 до 15 лет (18 девочек и 12 мальчиков). Степень тяжести определялась с помощью шкалы SCORAD. Практически у всех детей (более 70%) имелась сопутствующая патология желудочно-кишечного тракта. Обследованные пациенты были разделены на две группы. Первая группа в составе комплексной терапии получала препарат Фильтрум, вторая — Лактофильтрум. Препараты назначались в течение 2 нед за час-полтора до еды. В результате исследования была отработана оптимальная терапевтическая дозировка препаратов. На фоне проводимого лечения препаратами отмечалась более выраженная положительная динамика со стороны клинических проявлений атопического дерматита. Так, в первой группе, получавшей Фильтрум, купирование гиперемии составило в среднем 3,5 ± 1 день, в контрольной группе 4,7 ± 1,5 дня (p Другое исследование проводилось в 2009 г. на базе Курского государственного медицинского университета, в котором принимали участие 96 детей в возрасте от 3 до 6 лет, страдающих атопическим дерматитом [23]. Пациенты были разделены на 3 группы, в зависимости от применяемой терапии. Детям I группы (n = 30) в качестве традиционной терапии назначали антигистаминные, мембраностабилизирующие и витаминные препараты, а также ингибиторы кальциневрина. Дети II группы (n = 33) дополнительно к указанным препаратам получали Лактофильтрум 0,5 мг 3 раза в день, 10 дней. Детям III группы (n = 33) кроме того назначали препарат Гепон (является иммуномодулятором и оказывает противовирусное действие). У пациентов второй и третьей групп клиническая ремиссия наступала в среднем на 3–6 сут раньше, нежели у пациентов первой группы. Во всех группах на фоне проведенного лечения выявлены признаки нормализации функции желудочно-кишечного тракта. Оценка терапевтической эффективности проводилась на основании динамики клинических проявлений (индекс SCORAD), а также показателей иммунного статуса. В группе детей, получавших Лактофильтрум и Гепон, выявлено статистически достоверное снижение индекса SCORAD. Переносимость Лактофильтрума и Гепона в представленых дозах была хорошей у всех детей. Побочных реакций не выявлено. Следовательно, включение указанных препаратов в комплексное лечение атопического дерматита у детей дошкольного возраста способствует более быстрому наступлению клинической ремиссии, более выраженной динамике симптомов нарушения гастроинтестинальной системы и коррекции иммунологических показателей. Высокая терапевтическая и иммуномодулирующая эффективность, отсутствие осложнений и побочных реакций при их применении позволяют рекомендовать эти препараты в комплексном лечении детей дошкольного возраста, страдающих атопическим дерматитом.
Учитывая, что кишечная микрофлора может участвовать в поддержании патологических расстройств при атопическом дерматите, для коррекции дисбиоза кишечника у детей с АД целесообразно использование средств, содержащих пребиотики и энтеросорбенты (препарат Лактофильтрум).
СПИСОК ЛИТЕРАТУРЫ
1. Bos J.D., Sillevis Smitt J.H. Atopic dermatitis. YEADV. 1996; 7: 101–114. Consensus Conference on Pediatric Atopic Dermatitis. J. Am. Acad. Dermatol. 2003; 49: 1088–1095.
2. Гущина Н.С. Совершенствование лечения и реабилитации детей младшего школьного возраста, больных атопическим дерматитом, в условиях санаторно-лесной школы. Автореф. дисс. канд. мед. наук. Москва. 1996. 30 с.
3. Жадамбаа С-Э., Батбаатар Г., Горшкова Г.В. Основные факторы, влияющие на течение атопического дерматита. IV Annual Meeting of Mongolian Society of allergology and International Educational Exchange Program American Academy of Allergy, Asthma and immunology. Ulaanbaatar. 2006. P. 15–16.
4. Смирнова Г.И. Современные принципы патогенетической терапии атопического дерматита у детей. Вопросы современной педиатрии. 2006; 5 (2): 50–56.
5. Плаксина И.А. Распространенность и клинико-иммунологические особенности течения атопического дерматита, сопровождающегося дисбиозом кишечника. Автореф. дисс. канд. мед. наук. Краснодар. 2007. С. 21.
6. Тучков Д.Ю. Синдром диареи при атопическом дерматите у детей раннего возраста. Автореф. дисс. канд. мед. наук. Оренбург. 2004. С. 20.
7. Ардатская М.Д., Минушкин О.Н. Современные принципы диагностики и фармакологической коррекции. Гастроэнтерология, прилож. к журналу. Consilium Medicum. 2006; 8 (2).
8. Суворова К.Н., Куклин В.Т., Рукавишникова В.М. Детская дерматовенерология. Казань. 1996. 441 с.
9. Cremonini F. et al. Meta-analysis: the effect. Aliment. Pharmacol. Ther. 2002; 16: 1461– 1467.
10. Фокина Р.А. Особенности течения атопического дерматита в условиях Якутии у детей и подростков в сравнительном аспекте. Дальневосточный медицинский журнал. 2007; 18–19.
11. Галлямова Ю.А. Атопический дерматит и дисбактериоз. Лечащий врач. 2010; 10.
12. Куваева И.Б., Ладодо К.С. Микроэкологические и иммунные нарушения у детей. Москва. 1991.
13. Пинегин Б.В., Мальцев В.Н., Коршунов В.М. Дисбиозы кишечника. Москва. 1984.
14. Потемкина A.M. Атопический дерматит у детей, профилактика, лечение, диспансеризация. Казань. 1999. 40 с.
15. Nancy T.W. Probiotics. American J. of Health-System Pharmacy. 2010; 67 (6): 449–458.
16. Бондаренко В.М., Учайкин В.Ф., Мурашова А.О., Абрамов Н.А. Дисбиоз. Современные возможности профилактики и лечения. Москва. 1995.
17. Gibson G.B., Wang X. Bifidogenic properties of different types of fructooligosaccharides. Food Microbiol. 1994; 11: 491–498.
18. Duffy L.C., Zielezny M.A., Riepenhoff-Talty M. et al. Effectiveness of Bifidobacterium bifidum in experimentally induced MRV infection: dietary implications in formulas for newborn. Endocr Regulations. 1993; 27: 223–229.
19. Ballongue J., Crociani J., Grill J.P. In vitro study of the effect of lactulose and lactitol on growth and metabolism of intestinal bacteria. Gut. 1995; 37 (Suppl. 2): A48.
20.Bezkorovainiy A., Miller-Catchpole R. Biochemistry and physiology of bifidobacteria. Boca Raton: CRC Press. 1989. Р. 226.
21. Портнова И.В., Гамалеева А.В., Ревякина В.А. Энтеросорбенты в терапии аллергических заболеваний у детей. Лечащий врач. 2002; 4: 27.
28. Сароян А.С., Силина Л.В. Опыт применения лактофильтрума и гепона при атопическом дерматите у детей дошкольного возраста. Сборник тезисов НАДК. Уфа. 2009.
Д.м.н. Л.С. Круглова
Московский Научно-практический центр дерматовенерологии и косметологии Департамента здравоохранения г. Москвы
Современная медицинская наука дает возможность практикующему врачу рассматривать заболевания не только в узких рамках симптомокомплекса, но и с точки зрения изменения функциональных резервов организма человека в результате нарушения его адаптационных возможностей. Неуклонный рост заболеваемости атопическим дерматитом (АтД), наличие рецидивирующих, хронических форм создают потребность в интеграции лечебно-реабилитационных технологий, направленных на восстановление и сохранение здоровья, нарушенного данной патологией.
По современным представлениям человеческий организм является определенной экологической нишей для множества разнообразных микроорганизмов, которые в норме формируют своего рода различные биотопы, являющиеся достаточно сложными системами, сформировавшимися в процессе эволюции и со временем приобретшие определенную устойчивость применительно к особенностям макроорганизма. Биотопы отличаются не только многокомпонентностью, но и количественным разнообразием входящих в них представителей микрофлоры [1].
Постоянство бактериальной аутомикрофлоры организма человека позволяет рассматривать бактерий, существующих преимущественно в четырех локализациях - на коже и слизистой полости рта, кишечника, половых органов - как своеобразный прокариотический орган. Причем изменения в одном из биотопов могут приводить к нарушениям в других. Формирование микрофлоры биотопов организма, и в первую очередь кожи и кишечника, происходит уже с самого рождения ребенка при прохождении по родовым путям. В дальнейшем на формирование влияет много факторов: состав микрофлоры биотопов матери, вид вскармливания, а затем и характер питания, состояние соматического здоровья ребенка и состояние окружающей среды [2,3].
Из всех биотопов организма наибольшая численность и видовое разнообразие бактерий отмечается в биотопе кишечника: так, на площади в 200 м 2 обитает 10 12 -10 14 бактерий, может встречаться до 450 видов различных микроорганизмов, общая масса которых доходит до 5% массы самого кишечника [4,5]. При этом в разных отделах кишечника количество и состав микроорганизмов биоценоза различен. В тонком кишечнике микробов меньше - это преимущественно лактобациллы, стрептококки и веилонеллы, в толстом кишечнике их больше, причем преобладают кишечные палочки и анаэробные бактерии.
Многочисленные микроорганизмы обеспечивают такие важные функции, как выработка ферментов, участвующих в метаболизме белков, липидов, жиров, нуклеиновых и желчных кислот, формирование механизмов иммунной защиты, поддержание гомеостаза организма, продукция биологически активных веществ и витаминов, детоксикация эндогенных и экзогенных субстратов и многие другие.
Микрофлора кишечника условно подразделяется на защитную, сапрофитную и оппортунистическую (условно-патогенную). Защитная микрофлора наиболее многочисленная (до 95%) и в основном представлена лактобактериями, бифидобактериями и кишечной палочкой с нормальными ферментативными свойствами. Именно они обеспечивают постоянство микрофлоры за счет колониальной резистентности. Так, бифидобактерии, лактобактерии выделяют молочную, уксусную кислоты, другие вещества, обладающие избирательным антимикробным действием. Кислая среда, обусловленная жизнедеятельностью этих микроорганизмов, препятствует проникновению и закреплению на слизистой патологических микробов, не свойственных данному биотопу. Помимо этого, бифидобактерии стимулируют клеточное звено иммунитета и участвуют в синтезе иммуноглобулинов. Данные бактерии являются естественными биосорбентами и способны накапливать значительное количество соединений тяжелых металлов, фенолов, формальдегидов и других токсичных веществ [6,7]. Однако в соответствии с современными воззрениями, скорее всего, недостаточное количество лактобактерии является основным отягчающим фактором при атопическом дерматите.
Именно лактобактерии в значительной степени снижают всасывание аллергенов в кишечнике и стимулируют синтез иммуноглобулинов класса А, которые, особенно в раннем детском возрасте, являются основными антителами против пищевых аллергенов [8,9].
Сапрофитная микрофлора кишечника представлена эпидермальным и сапрофитным стафилококками, энтерококками и другими микроорганизмами, основной функцией которых является утилизация конечных продуктов метаболизма макроорганизма [5].
Оппортунистическая микрофлора может быть представлена различными микроорганизмами (3-гемолитический стрептококк, золотистый стафилококк, спороносные анаэробы, грамотрицательные энтерококки, грибы рода Candida ), которые при определенных условиях вызывают патологический процесс [5].
Таким образом, в кишечном микробиоценозе, как в единой системе, существуют корреляционные связи между различными видами бактерий. Нарушение колонизационной резистентности кишечника, связанное с изменением состава постоянной микрофлоры, способствует колонизации патогенными и условно-патогенными бактериями, нарушению основных функций, что и приводит к формированию дисбиоза [Мельникова, 1997; Билимова, 2000; Белова с соавт., 2004; Cammaro-ta, Ogava, 1998].
Согласно существующему в России медицинскому стандарту оказания специализированной помощи при патологии желудочно-кишечного тракта (ЖКТ) дисбиоз кишечника рассматривается, как своеобразный клинико-лабораторный синдром, который характеризуется изменением качественного и/или количественного состава аутомикрофлоры, с возможной транслокацией микроорганизмов в несвойственные для них биотопы; при этом данные изменения могут сопровождаться клиническими симптомами поражения кишечника. В широком понимании дисбиоз является проявлением общего нарушения в различных микробиотах организма, которое приводит к нарушению функционирования микробиот и сопровождается определенными симптомами, ассоциированными с различными патологическими состояниями [5,10,11].
При развитии дисбиоза защитная микрофлора кишечника перестает выполнять свои функции в достаточной степени, что приводит к формированию патологических состояний либо усугублению течения имеющейся соматической патологии [12,13]. Ассоциированные с дисбиозом заболевания в зависимости от преобладания механизмов, отягчающих течение болезни, условно подразделяются на 4 группы:
- заболевания органов пищеварения,
- гнойно-воспалительные заболевания,
- аллергические заболевания,
- заболевания, связанные с нарушением обмена веществ (метаболизма).
Безусловно, рациональные схемы лечения атопического дерматита должны включать методы детоксикации (в частности, энтеросорбции) и использование препаратов, восстанавливающих и поддерживающих нормальную микрофлору кишечника. Энтеросорбция является неинвазивным методом детоксикации и направлена на выведение из организма различных эндогенных и экзогенных аллергенов, токсинов, патогенных микроорганизмов и продуктов их жизнедеятельности. Известно, что на фоне проведения энтеросорбционных мероприятий происходит повышение функциональной активности клеточного и гуморального иммунитета, ускоряется регресс объективных и субъективных симптомов АтД [17,18].
Существенным является и то, что сорбенты позволяют снизить медикаментозную нагрузку, а в ряде случаев и обходиться без них. Требования к современным энтеросорбентам следующие: высокие сорбционные свойства (емкость); отсутствие токсических свойств и системной фармакокинетики; атравматичность для слизистых оболочек ЖКТ; хорошая эвакуаторная способность; высокая комплаентность [19].
Механизм процесса энтеросорбции зависит от двух факторов - характеристик сорбента и структуры подлежащих сорбции веществ. Сорбенты могут отличаться по ряду признаков: лекарственная форма, физические свойства и химическая структура. Одними из самых эффективных сорбентов являются природные органические на основе пищевых волокон, такие как лигнин, который не усваивается в пищеварительной системе человека и полностью ферментируется кишечными бактериями. Важнейшее свойство лигнина - высокая сорбционная активность.
Вместе с тем большой интерес представляет развитие относительно нового направления в лечении атопического дерматита - включение в комплекс терапевтических мероприятий пребиотиков , выделенных из естественных источников и обладающих определенными регулирующими свойствами в отношении функционирования биотопа кишечника. В отличие от пробиотиков, которые поставляют необходимые бактерии извне, пребиотики выступают в качестве питательной среды для развития собственной нормальной микрофлоры организма, что способствует более быстрому и устойчивому восстановлению нормальной аутомикрофлоры кишечника [20,21]. Как правило, в качестве пребиотиков используют вещества, содержащие бифидогенные факторы, стимулирующие рост и развитие полезных бактерий. Таким веществом, в частности, является лактулоза - синтетический стереоизомер молочного сахара - лактозы.
Таким образом, на сегодняшний день идеальным сочетанием можно считать комбинированные лекарст венные средства, содержащие пребиотик и адсорбент. Таким средством является препарат Лактофильтрум ® , включаюший сорбент и пребиотик. В качестве сорбента препарат содержит растительный компонент - лигнин, который обладает неспецифическим дезинтоксикационным действием. За счет большой площади поверх ности и развитой системы пор обладает высокой сорбционной емкостью и таким образом способен выводить из организма токсины, аллергены и патогенные микро организмы. В качестве пребиотика выступает лактулоза, положительное влияние которой на микрофлору кишечника обусловлено целым рядом фармакологических свойств. Так, продукты бактериального метаболизма лактулозы сдвигают рН среды в толстой кишке в кислую сторону, что при водит к подавлению размножения патогенных микроорганизмов и угнетению процессов гниения. Помимо этого, являясь пищевым субстратом для бактерий, лактулоза стимулирует рост собственных бифидобактерий и лактобактерий в толстом кишечнике, а это, в свою очередь, восстанавливает, нарушенные функции биотопа кишечника.
Активные составляющие препарата не инактивируются в агрессивных средах желудка и двенадцатиперстной кишки, что обеспечивает 100%-ю доставку непосредственно к месту действия.
Лактофильтрум ® производится из компонентов природного происхождения в таблетированной форме и удобен в применении. Препарат зарекомендовал себя как высоко безопасный, который практически не имеет противопоказаний к применению и побочных эффектов [22,23].
В клинических условиях под нашим наблюдением находилось 40 пациентов (средний возраст 18,9±2,3 года, продолжительность заболевания 11,4±2,7лет) с диагностированным по основным критериям атопическим дерматитом в стадии обострения. У большинства пациентов АтД носил распространенный характер - ДИШС (Дерматологический индекс шкалы симптомов) составил 18,2±2,3 балла, что соответствует среднетяжелому течению АтД. В зависимости от проводимого лечения пациенты были разделены на 2 сопоставимые по всем параметрам группы. В основную группу вошли 20 больных, которые получали препарат
Лактофильтрум ® по 2 таблетки 3 раза в сутки на протяжении 21 дня и фармакотерапию, соответствующую стандартам при данной патологии. Пациенты 2 группы (20 человек) получали традиционную медикаментозную терапию.
До лечения у 97,5% пациентов был диагностирован дисбиоз кишечника, причем у 52,5% пациентов он протекал с клиническими симптомами (метеоризм, усиление перистальтики, нарушение стула, дискомфортные субъективные ощущения). После комплексного лечения в основной группе у 95% пациентов отмечалась нормализация содержания лактобактерий, бифидобактрий и Е. coli. Такая же тенденция наблюдалась и в отношении клинических симптомов дисбиоза. В группе сравнения достоверно значимых изменений количественного содержания лактобактерий, бифидобактрий и Е. coli не отмечалось (рис.1).
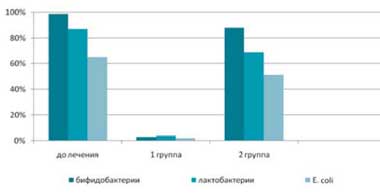
Рис. 1. Число пациентов с нарушением колониальной резистентности
до и после комплексного лечения, включающего применение Лактофильтрума ®
и традиционного медикаментозного лечения
Под влиянием комплексного лечения (1 группа) через 3 недели общие проявления всех объективных симптомов заболевания сохранялись в среднем лишь у 10% больных, в то время как в группе сравнения они были выражены в 54% случаев (рис. 2).
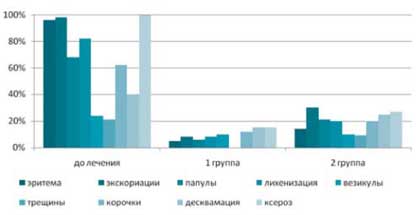
Рис. 2. Динамика регресса клинических симптомов у больных атопическим дерматитом под влиянием различных методов лечения
К концу лечения индекс ДИШС, отражающий тяжесть течения АтД, в основной группе снизился на 84%, в группе сравнения лишь на 53%. Анализ выраженности зуда с использованием опросника Behavioral rating scores (BRS) показал выраженное отрицательное влияние зуда на повседневную деятельность пациентов с АтД. Так, до лечения в 1-й группе значение BRS составило 7,1 ±0,4 баллов, во 2-й группе - 6,8±0,5 баллов. Уже через 1 неделю от начала лечения в 1-й группе отмечался более выраженный регресс субъективной симптоматики: снижение BRS на 55%, во 2-й группе - на 26%. К концу лечения в 1-й группе значение BRS составило 0,4±0,1 балла. В контрольной группе к концу лечения индекс снизился лишь на 58% (рис. 3). Эти данные находились в соответствии с показателями биохимических маркеров зуда (табл. 1).
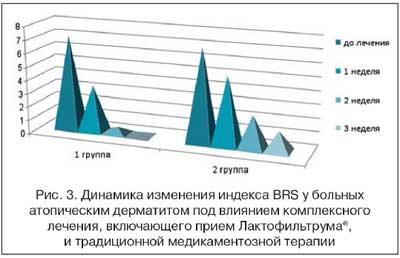
Таблица 1.
Динамика показателей гистамина и серотонина в сыворотке крови у больных АтД под влиянием комплексного лечения, включающего прием Лактофильтрума ® и традиционной медикаментозной терапии
| Изучаемый показатель | Контроль(n=20) | До лечения (n=40) | После лечения | |
|---|---|---|---|---|
| 1 группа (n=20) | 2 группа (n=20) | |||
| Серотонин (мкмоль/л) | 0,6±0,03 | 2,35±0,24Р1** | 0,81±0,32Р2*** | 1,46±0,22РГ**,РЗ* |
| Гистамин (мкмоль/л) | 0,8±0,06 | 2,14±0,62Р1** | 0,87±0,13Р2*** | 1,35±0,25Р1***,Р2** |
| Примечание: Р1 - сравнение с нормой; Р2 - сравнение с показателями до лечения; РЗ - сравнение с основной группой; *- р | ||||
Как видно из приведенных в таблице данных, после комплексной терапии, включающей применение Лактофильтрума ® отмечалось восстановление повышенных в исходном состоянии показателей серотонина и гистамина до нормальных значений - 0,81 ±0,32 и 0,87±0,13 (рВ процессе лечения с улучшением клинической картины заболевания пропорционально улучшались и показатели качества жизни (рис. 4). В результате анализа полученных данных, более выраженная положительная динамика дерматологического индекса качества жизни (ДИКЖ), особенно в первые дни терапии, была отмечена у пациентов 1 группы. Так, в первую неделю параметры ДИКЖ улучшились на 30% в 1 группе и лишь на 8% во 2 группе (рис. 5). К концу курса лечения ДИКЖ улучшился на 87 и 54% соответственно.
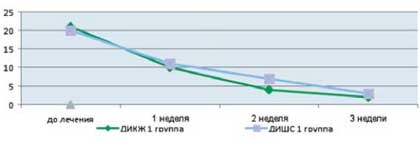
Рис. 4. Динамика изменения показателей, отражающих субъективные и объективные симптомы заболевания
у пациентов с АтД под влиянием комплексного лечения, включающего прием Лактофильтрума ®
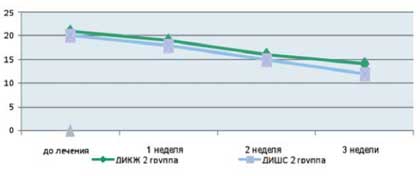
Рис. 5. Динамика изменения показателей, отражающих субъективные и объективные симптомы заболевания
у пациентов с АтД под влиянием традиционной медикаментозной терапии
Таким образом, по оценке самими пациентами эффективности и комфортности проводимого лечения, метод, включающий применение Лактофильтрума ® , является наиболее эффективным.
Выводы
Нарушение колониальной резистентости кишечника, приводящее к повышенной эндотоксинемии, аллергизации и нарушению гомеостаза, может отразиться на состоянии кожи и течении атопического дерматита.
Представители нормальной микрофлоры биоты кишечника выполняют физиологически важную функцию поддержания постоянства внутренней среды организма, принимают участие в формировании иммунобиологической реактивности макроорганизма. Нарушение нормоценозаспособствуетхронизации патологических процессов (в частности, атопического дерматита).
Включение препарата Лактофильтрум ® в комплекс терапии больных АтД приводит к более быстрому и выраженному регрессу кожных высыпаний и субъективных ощущений, нормализации функции биотопа кишечника, что в конечном итоге способствует значитель-номуулучшению качества жизни. Препарат не токсичен, не вызывает побочных эффектов, обладает высокой комплаентностью.
Литература
Цель исследования: совершенствование методов лечения атопического дерматита (АД) у детей на основании изучения эффективности синбиотика Максилак ® Бэби у детей первых лет жизни в составе комплексной терапии.
Материал и методы: обследовано 65 детей с АД в возрасте от 4-х мес. до 2-х лет, разделенных на 2 группы. Основная группа — 35 детей, получающих в составе комплексной терапии синбиотик Максилак ® Бэби по 1 пакетику-саше в сутки в течение 20 дней. Группа сравнения — 30 детей, получающих только традиционную противоаллергическую терапию, которая в сравниваемых группах не различалась. Проводились клинические обследования с оценкой тяжести АД по шкале SCORAD (scoring of atopic dermatitis — шкала атопического дерматита), а также лабораторно-инструментальные и специфические аллергологические исследования.
Результаты исследования: на фоне проводимой терапии у детей основной группы общий терапевтический эффект составил 91,4±5,1%, а в группе сравнения — 80,0±4,3%, р Долгосрочные позитивные эффекты характеризовались продлением ремиссии в 3 раза, а у 62,8% больных основной группы за время наблюдения отмечалась стойкая ремиссия на фоне уменьшения уровня общего IgE в 3 раза и аллерген-
специфических IgE — более чем на 1 класс, а также нормализации кишечной микробиоты.
Заключение: полученные результаты открывают новые возможности применения синбиотика Максилак ® Бэби у детей с АД.
Ключевые слова: атопический дерматит, пищевая аллергия, дети, комплексная терапия, микробиота, синбиотик, Максилак ® Бэби.
Для цитирования: Маланичева Т.Г., Зиатдинова Н.В., Сердинская И.Н. Эффективность синбиотиков у детей с атопическим дерматитом. РМЖ. 2018;9:69-72.
Effectiveness of synbiotics in children with atopic dermatitis
T.G. Malanicheva, N.V. Ziatdinova, I.N. Serdinskaya
Kazan State Medical University
Aim: to improve methods of atopic dermatitis (AD) treatment in children on a basis of Maxilac ® Baby synbiotic effectiveness study in children of the first years of life as part of complex therapy of this pathology.
Patients and Methods: 65 children with AD at the age from 4 months to 2 years, who are divided into two groups, were examined. A main group consists of 35 children receiving Maxilac ® Baby synbiotic as a part of the complex therapy 1 sachet per day for 20 days. A comparison group — 30 children receiving only traditional antiallergic therapy, which in the compared groups did not differ. Clinical examination methods were performed with an assessment of AD severity on a SCORAD scale, as well as laboratory-instrumental and specific allergological methods.
Results: Against the background of ongoing therapy in children of the main group, overall therapeutic effect was 91.4±5.1%, and in the comparison group — 80.0±4.3%, p Conclusion: the obtained results open new possibilities for using Maxilac ® Baby synbiotic in children with AD.
Key words: atopic dermatitis, food allergy, children, complex therapy, microbiota, synbiotic, Maxilac ® Baby.
For citation: Malanicheva T.G., Ziatdinova N.V., Serdinskaya I.N. Effectiveness of synbiotics in children with atopic dermatitis // RMJ. 2018. № 9. P. 69–72.
Статья посвящена эффективности синбиотиков у детей с атопическим дерматитом. Рассмотрены новые возможности применения синбиотика Максилак ® Бэби у детей с атопическим дерматитом
Введение
Атопический дерматит (АД) у детей занимает первое место среди патологий, связанных с пищевой аллергией, а его частота составляет от 15,6 до 35% [1, 2]. АД характеризуется непрерывно рецидивирующим течением, резистентностью к терапии, развитием вторичных осложнений, снижением качества жизни [3, 4]. Эффект от традиционной терапии АД оказывается не всегда достаточно выраженным, часто заболевание имеет волнообразное течение, что придает вопросам выбора рациональной терапии данной формы аллергии особую актуальность. Работы зарубежных и отечественных исследователей последних лет показали, что аллергические проявления являются результатом сложных взаимодействий между генетическими, эпигенетическими, экологическими факторами и микробным воздействием на ранних этапах жизни ребенка [5–7]. Дисбиоз играет ключевую роль в патогенезе АД и предшествует появлению клинических симптомов заболевания, а восстановление кишечной микробиоты служит предупреждению и лечению данной патологии [8, 9] и защите от проявлений атопии [10–13]. В профилактике и лечении АД хорошую эффективность показали синбиотики, представляющие собой комбинацию полезных бактерий (пробиотиков) и субстрата для их размножения (пребиотиков). Так, метаанализ продемонстрировал доказательства полезности применения синбиотиков для лечения АД у детей в возрасте 1 года и старше, особенно в случае использования комбинации пробиотических штаммов [14]. К инновационным синбиотикам последнего поколения относится
Максилак ® Бэби, выпускаемый в форме лиофилизата в гранулах, специально для детей с 4-месячного возраста. Он содержит 9 специально подобранных штаммов полезных бактерий, в т. ч. Lactobacillus rhamnosus GG и Bifidobacterium longum BG-7 в концентрации 1 млрд КОЕ + пребиотический компонент — фруктоолигосахариды. Гранулы Максилак ® Бэби защищены технологией Micro MURE ® (Multi Resistant Encapsulation) двумя оболочками: белковой и из коллоидных полисахаридов. Белковая оболочка позволяет без потери качественного и количественного состава пройти три естественных барьера: кислую среду желудка, соли желчных кислот, пищеварительные ферменты. Оболочка из коллоидных полисахаридов защищает содержимое от воздействия влаги и высоких температур.
Максилак ® Бэби не содержит лактозы и казеина, что особенно важно для детей с АД, имеющих сенсибилизацию к белкам коровьего молока. Исходя из вышеизложенного определена цель исследования: совершенствовать методы лечения АД, изучив эффективность синбиотика Максилак ® Бэби у детей первых лет жизни в составе комплексной терапии.
Материал и методы
Под наблюдением находились 65 детей с АД в возрасте от 4-х мес. до 2-х лет с младенческой формой заболевания. Из них детей до 1 года — 64,6%, от 1 года до 2-х лет — 35,4%, мальчиков — 50,7%, девочек — 49,3%. У всех детей имела место сенсибилизация к пищевым аллергенам. Среднетяжелое течение заболевания отмечалось у 58,4% пациентов, легкое — у 41,6%. Экссудативная форма диагностирована у 63,1% детей, эритематозно-сквамозная — у 27,7%, лихенификация — у 9,2%. Всем пациентам проводилось углубленное клиническое обследование с оценкой тяжести течения по шкале SCORAD (scoring of atopic dermatitis — шкала атопического дерматита) в баллах. При среднетяжелом течении заболевания индекс SCORAD составил 15–40 баллов, при тяжелом — более 40, при легком — до 15 баллов. Назначались лабораторно-инструментальные исследования (общий анализ крови, общий анализ мочи, кал на яйца глистов и простейшие, кал на дисбактериоз, УЗИ органов брюшной полости) и специфические аллергологические: сбор аллергологического анамнеза, определение общего IgE и аллерген-специфических IgE к пищевым аллергенам (Food Panel).
Наблюдаемые пациенты были разделены на 2 группы. В основную группу вошли 35 детей от 4-х мес. до 3-х лет с АД, получающих в составе комплексной терапии (гипоаллергенная диета, наружные противовоспалительные средства, лечебно-косметический уход за кожей и антигистаминные препараты) синбиотик Максилак ® Бэби по 1 пакетику-саше в сутки в течение 20 дней. Группу сравнения составили 30 детей с АД, получающих только комплексную противоаллергическую терапию, которая в сравниваемых группах не различалась. Обе группы были сопоставимы по возрасту, полу, клиническим формам заболевания и тяжести течения.
Клиническую эффективность синбиотика Максилак ® Бэби в комплексном лечении АД у детей оценивали по индивидуальному терапевтическому эффекту (ИТЭ) и общему терапевтическогму эффекту. ИТЭ оценивался по срокам наступления ремиссии и снижению индекса SCORAD в динамике. Высоким ИТЭ считался при наступлении ремиссии через 9–10 дней, снижении индекса SCORAD в 3 раза и более; средним — соответственно через 12–14 дней и в 2,0–2,9 раза. Низким ИТЭ считался при наступлении ремиссии через 15 дней и снижении индекса SCORAD менее чем в 2 раза. Общий терапевтический эффект оценивали по проценту больных, продемонстрировавших положительный ИТЭ. Также учитывали и долгосрочные результаты проводимой терапии, которые оценивали по удлинению периода ремиссии, снижению уровня сенсибилизации и по нормализации показателей со стороны микрофлоры кишечника. Статистическую обработку материала проводили с использованием методов вариационной статистики с помощью пакета программ Statistica 6.0.
Результаты и обсуждение
Заключение
Таким образом, включение в состав комплексной терапии АД у детей синбиотика Максилак ® Бэби показало общую терапевтическую эффективность в 91,4% случаев, что проявилось сокращением периода обострения в 1,5 раза, высоким индивидуальным терапевтическим эффектом в 60% случаев, снижением индекса SCORAD в 5 раз. Долгосрочные позитивные эффекты характеризовались продлением ремиссии со стороны кожного процесса в 3 раза, а у 62,8% больных отмечалась стойкая клиническая ремиссия за время наблюдения. Клиническая эффективность проводимой терапии отмечалась на фоне уменьшения уровня общего IgE в 3 раза и аллергенспецифических IgE более чем на 1 класс, а также нормализации кишечной микробиоты. Полученные результаты открывают большой потенциал синбиотика Максилак ® Бэби в лечении детей с АД.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Читайте также:

