Какие лекарства принимать при красной волчанке
Обновлено: 26.04.2024
Системная красная волчанка (СКВ) – аутоиммунное заболевание, этиология которого остается неизвестной. Кожный синдром при СКВ зачастую имеет первостепенное диагностическое значение – поражение кожи в 20-30% случаев является самым ранним симптомом, а у 60-
Systemic lupus erythematosus: alertness in the practice of a dermatologist / M. M. Tlish, Zh. Yu. Naatyzh1, T. G. Kuznetsova, E. A. Chernenko /State Budgetary educational institution of higher professional education Kuban State Medical University of the Ministry of Healthcare of the Russian Federation, Krasnodar, Russia
Abstract. Systemic lupus erythematosus (SLE) is an autoimmune disease, the etiology of which remains unknown. Skin syndrome in SLE is often of paramount diagnostic value – skin lesion is the earliest symptom in 20-30% of cases, and in 60-70% it manifests itself at various stages of the course of the disease, which leads to the patient's primary referral to a dermatologist. Frequent diagnostic errors are due to the absence of clinical symptoms of systemic lesions in the presence of cutaneous manifestations of lupus erythematosus (LE). In this case, laboratory tests are an integral part of the algorithm for managing patients with LE at the stage of contacting a dermatologist. The most specific laboratory test is the determination of antinuclear antibodies by an indirect immunofluorescence reaction, referred to as antinuclear factor (ANF). An elevated ANF titer is included in the list of diagnostic criteria for SLE, its detection allows one to suggest a diagnosis of SLE and determine a further algorithm for the provision of medical care. The article presents two clinical cases illustrating that against the background of an isolated skin lesion and the absence of visible somatic pathology, abnormalities in immunological tests were identified. This made it possible to suspect the systemic course of the process at an early stage and refer patients to a rheumatologist's consultation, where the diagnosis of SLE was confirmed. For citation: Tlish M. M., Naatyzh Zh. Yu., Kuznetsova T. G., Chernenko E. A. Systemic lupus erythematosus: alertness in the practice of a dermatologist // Lechaschy Vrach. 2020; vol. 23 (11): 23-26. DOI: 110.26295/OS.2020.35.78.005
Согласно современным представлениям, системная красная волчанка (СКВ) – аутоиммунное заболевание неустановленной этиологии, характеризующееся гиперпродукцией органонеспецифических аутоантител с развитием иммуновоспалительного повреждения тканей внутренних органов [1]. Широкий ряд вырабатываемых аутоантител и их прямое или опосредованное воздействие на клеточные мишени обуславливают многообразие клинических проявлений при красной волчанке (КВ) [2]. СКВ может проявляться изолированным или сочетанным поражением систем и органов, включающим поражение кожи и слизистых оболочек (волчаночная бабочка, дискоидная эритема, фотосенсибилизация, алопеция, телеангиэктазии, сетчатое ливедо, язвы в полости рта), сердечно-сосудистой системы (перикардит, миокардит, эндокардит, коронарит), почек (волчаночный нефрит), центральной нервной системы (судороги, психоз), опорно-двигательного аппарата (артралгии, артриты), легких (плеврит, волчаночный пневмонит), гематологическими нарушениями (гемолитическая анемия, лейкопения, тромбоцитопения) и т. д. [3].
Ключевую роль в диагностике СКВ играет обнаружение клинических проявлений заболевания и данные лабораторной диагностики [3]. Кожный синдром при СКВ зачастую имеет первостепенное диагностическое значение – поражение кожи в 20-30% случаев является самым ранним симптомом, а у 60-70% проявляется на различных этапах течения болезни, что приводит к первичному обращению больного именно к дерматологу [4]. Поражения кожи при СКВ полиморфны и представлены различными изменениями – от незначительных телеангиэктазий до буллезных поражений [2]. Выделяют волчаночно-специфичные и волчаночно-неспецифичные поражения кожи, последние встречаются в несколько раз чаще. К волчаночно-специ-фичным относят различные проявления хронической, подострой и острой КВ [5]. Группа неспецифических поражений включает: фотосенсибилизацию, лейкоцитокластический и уртикарный васкулит, телеангиэктазии, сетчатое ливедо, злокачественный атрофический папулез и синдром Рейно [5]. Широкая вариабельность клинических проявлений кожного синдрома обуславливает необходимость проведения тщательного дифференциального диагноза [1].
Важным инструментом ранней диагностики системных заболеваний является обнаружение аутоантител с помощью лабораторных тестов [3]. Наиболее специ-фичными для СКВ являются антинуклеарные антитела (АНА) – это гетерогенная группа аутоантител к компонентам клеточного ядра, среди которых выделяют антитела к двуспиральной дезоксирибонуклеиновой кислоте (ДНК), гистонам, нуклеосомам, экстрагируемым ядерным антигенам, ядрышковым антигенам и другим клеточным структурам [6]. Стандартным методом обнаружения группы АНА является непрямая реакция иммунофлюоресценции (НРИФ) с использованием линии эпителиальных клеток аденокарциномы гортани человека (HЕp-2) [7]. Определение АНА методом НРИФ принято обозначать как антинуклеарный фактор (АНФ), содержание которого оценивается по максимальному выявленному титру в сыворотке крови, с указанием интенсивности и типа флюоресценции [8]. Количественное увеличение титра свыше 1:160 входит в перечень диагностических критериев СКВ согласно рекомендациям Американской коллегии ревматологов (American College of Rheumatology, ACR) и Европейской лиги борьбы с ревматизмом (European League Against Rheumatism, ULAR) и используется для оценки активности процесса, прогноза, так как является предиктором развития СКВ на доклинической стадии [8].
Длительное формирование патогномоничного клинического симптомокомплекса СКВ, отсутствие проведения необходимых лабораторных исследований и междисциплинарного взаимодействия являются причиной частых диагностических ошибок, приводящих к отсутствию своевременной противовоспалительной и иммуносупрессивной терапии у врача-ревматолога. Учитывая вышесказанное, считаем целесообразным привести собственные клинические наблюдения.
Клиническое наблюдение № 1
Больная М., 27 лет, считает себя больной с июля 2019 г., когда после длительного отдыха на побережье появились высыпания на коже лица. Обратилась к дерматологу по месту жительства, где был выставлен диагноз: «Розацеа, папулопустулезный подтип, среднетяжелое течение». Получала курсовое лечение (доксициклин, метронидазол гель). Видимого улучшения пациентка не отмечала, процесс на коже продолжал прогрессировать, в связи с чем обратилась на кафедру дерматовенерологии ФГБОУ ВО КубГМУ Минздрава России.
Данные со стороны других органов и систем: предъявляет жалобы на ноющие боли в мелких суставах кистей и коленных суставах, чувство утренней скованности. Соматически не обследована.
Объективно: кожный патологический процесс носит ограниченный симметричный характер, локализуется на коже крыльев носа, щек, подбородка. Представлен: эритематозные пятна, чешуйки, телеангиэктазии.
На коже лица (в области крыльев носа, щек, подбородка) расположены ярко-розовые эритематозные очаги, с четкими границами, слегка инфильтрированные, правильной округлой формы, диаметром 3-4 см, покрытые небольшим шелушением в центре очагов; в периферической зоне очагов визуализируются телеангиэктазии (рис. 1). Удаление чешуек сопровождается болезненностью (симптом Бенье–Мещерского).
.jpg)
Определена биодоза 20 секунд.
С предположительным диагнозом «Дискоидная красная волчанка?» больная была направлена на гистоморфологическое исследование кожи.
Результаты гистоморфологического исследования кожи из патологического очага на правой щеке: фолликулярный гиперкератоз; эпидермис с тенденцией к атрофии; вакуольная дистрофия клеток базального слоя. Под эпидермисом сосуды расширены. Во всех отделах дермы – густые диффузные и периваскулярные лимфогистиоцитарные инфильтраты с примесью нейтрофилов и плазмоцитов. Вокруг сально-волосяных фолликулов – густой лимфогистиоцитарный инфильтрат с примесью нейтрофилов, тучных клеток и фибробластов, проникающий в наружное эпителиальное влагалище. В дерме – участки мукоидного набухания коллагеновых волокон. Заключение: морфологическая картина может соответствовать красной волчанке.
Данные общеклинических исследований: общий и биохимический анализ крови – показатели в пределах нормы; общий анализ мочи – показатели в пределах нормы.
Настораживающими факторами в плане трансформации кожной формы в системный процесс у пациентки М. явились: дебют заболевания в молодом возрасте, длительная инсоляция в анамнезе, II фототип кожи, биодоза 20 секунд, наличие выраженного суставного синдрома.
Для исключения диагноза СКВ было проведено иммунологическое исследование:
- Антинуклеарный фактор на НЕр-2 клетках: 1:320 титр (норма менее 160); мелкогранулярный тип свечения.
- Антитела к двуспиральной ДНК (a-dsDNA) – 53 МЕ/мл (норма – менее 25 МЕ/мл).
- Анализ крови на антитела к фосфолипидам класса IgG (скрининг) – 10,13 МЕ/мл (референсные значения: до 10 МЕ/мл – не обнаружено).
- Анализ крови на антитела к фосфолипидам класса IgM (скрининг) – 12,68 МЕ/мл (референсные значения: до 10 МЕ/мл – не обнаружено).
С полученными данными больная направлена к ревматологу в Краевую клиническую больницу № 2, где был подтвержден диагноз СКВ. Больная взята на диспансерный учет ревматологом для определения дальнейшей тактики ведения и лечения.
Клиническое наблюдение № 2
Пациентка В., 66 лет, считает себя больной с апреля 2018 г., когда впервые появились высыпания на коже щек и подбородка. При сборе анамнеза установлено, что больная длительное время проживала в северном регионе и после переезда в Краснодарский край начала отмечать появление высыпаний. Самостоятельно использовала бетаметазон и декспантенол. Отмечала временное улучшение, но в весенне-летний период заболевание обострялось. Обратилась к дерматологу по месту жительства, где был выставлен диагноз «стероидпровоцированная розацеа» и назначено лечение (наружные и системные антибактериальные препараты, ангиопротекторы). Видимого улучшения не наблюдала, в связи с чем обратилась на кафедру дерматовенерологии ФГБОУ ВО КубГМУ МЗ РФ.
Объективно: кожный патологический процесс носит распространенный характер, локализован на коже лица, шеи. Представлен: пятна, телеангиэктазии, чешуйки.
На коже лица в области щек, левой околоушной области и шеи расположены отечные эритематозные очаги розовато-красного цвета, диаметром 2–3 см, преимущественно правильно-округлой формы с небольшим шелушением, визуализируются единичные телеангиэктазии. Удаление чешуек сопровождается болезненностью (симптом Бенье–Мещерского) (рис. 2).
.jpg)
С предварительным диагнозом «Дискоидная красная волчанка?» пациентка направлена на гистоморфологическое исследование.
Результаты гистоморфологического исследования кожи из патологического очага: на коже левой щеки – фолликулярный гиперкератоз; участки паракератоза; эпидермис местами атрофичен; вакуольная дистрофия клеток базального слоя эпидермиса; подэпидермальные пузыри. В сосочковом слое – отек, стенки сосудов утолщены. В дерме – густые очаговые и периваскулярные лимфогистиоцитарные инфильтраты с примесью нейтрофилов. Вокруг сально-волосяных фолликулов – густой лимфогистиоцитарный инфильтрат с примесью нейтрофилов, тучных клеток и фибробластов, проникающий в наружное эпителиальное влагалище. В дерме – участки мукоидного набухания коллагеновых волокон. Заключение: морфологическая картина больше соответствует красной волчанке.
Данные общеклинических исследований: в общем и биохимическом анализах крови выявлены следующие отклонения – лейкоциты 3,7 × 10 9 /л; холестерин 8,7 ммоль/л.
Учитывая длительность течения кожного патологического процесса, отсутствие результатов обследования смежных специалистов, для исключения диагноза СКВ было проведено иммунологическое исследование:
- Антинуклеарный фактор на НЕр-2 клетках: 12 560 титр (норма менее 160); крупногранулярный тип свечения.
- Антитела к двуспиральной ДНК (a-dsDNA) – 0,5 МЕ/мл (норма – менее 25 МЕ/мл).
- Анализ крови на антитела к фосфолипидам класса IgG (скрининг) 16,65 МЕ/мл (референсные значения: до 10 МЕ/мл – не обнаружено).
- Анализ крови на антитела к фосфолипидам класса IgM (скрининг) – 14,68 МЕ/мл (референсные значения до 10 МЕ/мл – не обнаружено).
С полученными результатами лабораторных исследований больная была направленна на консультацию к ревматологу в Краевую клиническую больницу № 2, где был установлен диагноз: «СКВ, хроническое течение, 1-й степени активности, с поражением кожи (эритема по типу «бабочки»), иммунологическими нарушениями (антинуклеарный фактор на НЕр-2 клетках, положительный анализ крови на антитела к фосфолипидам IgG, IgM)». Больную госпитализировали в ревматологическое отделение на стационарное лечение.
Таким образом, иммунологические исследования и их комплексный анализ являются неотъемлемой составляющей алгоритма ведения больных с КВ уже на этапе обращения к врачу-дерматологу и способствуют высокому качеству оказания медицинской помощи данному контингенту больных.
Литература/References
- Тлиш М. М., Наатыж Ж. Ю., Сычева Н. Л., Кузнецова Т. Г., Иризелян Г. А., Псавок Ф. А. Системная красная волчанка: междисциплинарный подход к диагностике // Российский журнал кожных и венерических болезней. 2016; 19 (3): 141-147. [Tlish M. M., Naatyzh Zh. Yu., Sycheva N. L., Kuznetsova T. G., Irizelyan G. A., Psavok F. A. Sistemnaya krasnaya volchanka: mezhdistsiplinarnyy podkhod k diagnostike [Systemic lupus erythematosus: an interdisciplinary approach to diagnosis] Rossiyskiy zhurnal kozhnykh i venericheskikh bolezney. 2016; 19 (3): pp. 141-147.]
- Мазуров В. И., ред. Диффузные болезни соединительной ткани: руководство для врачей. СПб: СпецЛит, 2009. 192 с. [Mazurov V. I., red. Diffuznyye bolezni soyedinitel'noy tkani: rukovodstvo dlya vrachey. [Diffuse connective tissue diseases: a guide for physicians.] SPb: SpetsLit, 2009. P. 192.]
- Насонов Е. Л., ред. Клинические рекомендации по ревматологии. 2-е изд., испр. и доп. М.: ГЭОТАРМедиа, 2010. 429 с. [Nasonov Ye. L., red. Klinicheskiye rekomendatsii po revmatologii. [Clinical practice guidelines to rheumatology.] 2-ye izd., ispr. i dop. M.: GEOTARMedia, 2010. P. 429.]
- Романова Н. В., Шилкина Н. П. Клинико-иммуноло-гическая характеристика кожного синдрома у больных красной волчанкой // Российский журнал кожных и венерических болезней. 2005; (4): 45-48. [Romanova N. V., Shilkina N. P. Kliniko-immuno-logicheskaya kharakteristika kozhnogo sindroma u bol'nykh krasnoy volchankoy [Clinical and immunological characteristics of skin syndrome in patients with lupus erythematosus] Rossiyskiy zhurnal kozhnykh i venericheskikh bolezney. 2005; (4): pp. 45-48.]
- Тлиш М. М., Наатыж Ж. Ю., Сычева Н. Л., Кузнецова Т. Г. Системная красная волчанка в практике дерматолога // Клиническая медицина. 2018; 96 (3): 277-281. [Tlish M. M., Naatyzh Zh. Yu., Sycheva N. L., Kuznetsova T. G. Sistemnaya krasnaya volchanka v praktike dermatologa [Systemic lupus erythematosus in the practice of a dermatologist] Klinicheskaya meditsina. 2018; 96 (3): pp. 277-281.]
- Клюквина Н. Г. Клиническое значение лабораторных нарушений при системной красной волчанке // Современная ревматология. 2014; (2): 41-47. [Klyukvina N. G. Klinicheskoye znacheniye laboratornykh narusheniy pri sistemnoy krasnoy volchanke [Clinical significance of laboratory disorders in systemic lupus erythematosus] Sovremennaya revmatologiya. 2014; (2): pp. 41-47.]
- Александрова Е. Н., Новиков А. А., Насонов Е. Л. Рекомендации по лабораторной диагностике ревматических заболеваний Общероссийской общественной организации «Ассоциация ревматологов России» – 2015 // Современная ревматология. 2015; 9 (4): 25-36. [Aleksandrova Ye. N., Novikov A. A., Nasonov Ye. L. Rekomendatsii po laboratornoy diagnostike revmaticheskikh zabolevaniy Obshcherossiyskoy obshchestvennoy organizatsii «Assotsiatsiya revmatologov Rossii» – 2015 [Recommendations for laboratory diagnostics of rheumatic diseases of the All-Russian public organization «Association of rheumatologists of Russia» – 2015] Sovremennaya revmatologiya. 2015; 9 (4): pp. 25-36.]
- Александрова Е. Н., Новиков А. А., Верижникова Ж. Г., Лукина Г. В. Современный взгляд на проблемы исследования антинуклеарных антител при системной красной волчанке (обзор литературы) // Клиническая лабораторная диагностика. 2018; 63 (6): 340-348. [Aleksandrova Ye. N., Novikov A. A., Verizhnikova Zh. G., Lukina G. V. Sovremennyy vzglyad na problemy issledovaniya antinuklearnykh antitel pri sistemnoy krasnoy volchanke (obzor literatury) [Modern view on the problems of studying antinuclear antibodies in systemic lupus erythematosus (literature review)] Klinicheskaya laboratornaya diagnostika. 2018; 63 (6): pp. 340-348.]
М. М. Тлиш, доктор медицинских наук, профессор
Ж. Ю. Наатыж 1 , кандидат медицинских наук
Т. Г. Кузнецова, кандидат медицинских наук
Е. А. Черненко
ФГБОУ ВО КубГМУ Минздрава России, Краснодар, Россия
Системная красная волчанка: настороженность в практике дерматолога/ М. М. Тлиш, Ж. Ю. Наатыж, Т. Г. Кузнецова, Е. А. Черненко
Для цитирования: Тлиш М. М., Наатыж Ж. Ю., Кузнецова Т. Г., Черненко Е. А. Системная красная волчанка: настороженность в практике дерматолога // Лечащий Врач. 2020; т. 23 (11), 23-26. DOI: 110.26295/OS.2020.35.78.005
Теги: аутоиммунное заболевание, кожный синдром, алгоритм лечения
Не существует препаратов, способных вылечить человека от волчанки (системной красной волчанки, СКВ). Однако они помогают контролировать большинство симптомов волчанки, а также предотвращать повреждение внутренних органов.
Для снятия симптомов, как правило, достаточно нестероидных противовоспалительных препаратов (НПВП) и противомалярийных препаратов, поскольку большинство из них вызвано воспалением.
Острая форма волчанки лечится при помощи препаратов, подавляющих иммунную систему, - кортикостероидов и иммунодепрессантов. Их назначение и прием проходят под строгим наблюдением врача, поскольку данные препараты вызывают серьезные побочные эффекты.
Волчанка часто сопровождается кожной сыпью, появление которой можно предотвратить, используя солнцезащитные средства, избегая воздействия солнечных лучей, а также препаратами. Препараты имеют различное действие на каждого человека, некоторые из них вызывают продолжительные побочные эффекты.
Некоторые препараты против волчанки, например, ацетаминофен и преднизон, безопасны для беременных женщин. Однако, далеко не все препараты являются таковыми. В некоторых случаях прием препарата против волчанки необходимо продолжать во время беременности, или принимать препарат только во время обострения симптомов. Женщине, страдающей волчанкой, следует проконсультироваться с врачом перед тем, как беременеть.
Выбор препарата против волчанки
При неострой волчанке, симптомах, которые не вызывают повреждений органов, врач может прописать:
Нестероидные противовоспалительные препараты (НПВП), иногда одновременно с противомалярийными препаратами
При острой волчанке врач может прописать:
Иммунодепрессанты, такие, как азатиофрин, циклофосфамид, циклоспорин, мофетил микофенолата, метотрексат.
Если у пациента обнаруживались сгустки крови в вене или артерии (венозный или артериальный тромбоз) или наблюдался антифосфолипидный синдром, который повышает риск развития кровяных сгустков, врач может прописать пациенту антикоагулянт (противосвертывающее средство).
Медикаментозное лечение волчанки предполагает определение золотой середины между предотвращением повреждения органов, поддержанием состояния здоровья пациента и сведением к минимуму побочных эффектов препаратов.
Лечение волчанки требует постоянного контроля развития симптомов и проявления побочных эффектов. В зависимости от реакции организма пациента на препарат, врач будет изменять дозы препарата, а также может комбинировать разные препараты для достижения наилучшего эффекта.
У людей, страдающих волчанкой, может внезапно наступить ремиссия. В таком случае врач может снизить дозу препаратов или отменить их прием вовсе.
При умеренных симптомах волчанки (системной красной волчанки, СКВ) хирургическое вмешательство не требуется. Хирургическое вмешательство необходимо в случаях серьезного повреждения почек, которое угрожает жизни пациента. В таких случаях вместо продолжительного медикаментозного лечения, которое сопровождается побочными эффектами, врач делает выбор в пользу пересадки почек или диализа.
Если кортикостероиды и иммунодепрессанты не улучшают состояния почек, врач назначает диализ или пересадку почек.
После диализа и пересадки почек, волчанка, как правило, не развивается так активно, как до проведения этих процедур.

Новость
Знаменитый телесериал «Доктор Хаус» запоминается не только циничным и сварливым нравом главного героя — гения медицинской диагностики, — но и аутоиммунным заболеванием системной красной волчанкой, появляющейся там едва ли не в каждой серии и даже ставшей своеобразным рефреном сериала.
Автор
Редакторы
Системная красная волчанка — это мультифакторное заболевание, развивающееся на основе генетического несовершенства иммунной системы и характеризующееся выработкой широкого спектра аутоантител к компонентам клеточного ядра. Молекулярно-генетические основы болезни изучены довольно плохо, в связи с чем специфического лечения до сих пор не создано, а в основе проводимой в клинике патогенетической терапии лежат иммунодепрессанты — глюкокортикостероиды и цитостатики. И вот, после более чем 50 лет попыток разработать специфическое лечение волчанки, произошел сдвиг: Управление по контролю за качеством пищевых продуктов и лекарств США официально утвердило в качестве лекарства от волчанки препарат Бенлиста (Benlysta) на основе моноклональных антител, специфически блокирующих B-лимфоцит-стимулирующий белок (BLyS).
Системная красная волчанка (СКВ) — одно из самых распространённых аутоиммуных заболеваний, в основе которого лежит генетически обусловленное комплексное нарушение иммунорегуляторных механизмов. При заболевании происходит образование широкого спектра аутоантител к различным компонентам ядра клеток и формирование иммунных комплексов. Развивающееся в различных органах и тканях иммунное воспаление приводит к обширным поражениям микроциркуляторного кровяного русла и системной дезорганизации соединительной ткани [1], [2].
Патогенез СКВ
В патогенезе СКВ важное место отводится иммунным механизмам, многие аспекты которых, несмотря на интенсивное изучение, остаются невыясненными. СКВ характеризуется обескураживающей «пестротой» иммунологических феноменов, что связывают с изменением практически всех известных функций иммунокомпетентных клеток (рис. 1).

Рисунок 1. Патогенез СКВ
Волчанка во многом связана с нарушениями на уровне пролиферации различных клонов В-клеток, активируемых многочисленными антигенами, в роли которых могут выступать медицинские препараты, бактериальная или вирусная ДНК и даже фосфолипиды мембраны митохондрий. Взаимодействие антигенов с лейкоцитами связано либо с поглощением антигенов антиген-презентирующими клетками (АПК), либо с взаимодействием антигена с антителом на поверхности В-клетки.
В результате поочередной активации то T-, то B-клеток увеличивается продукция антител (в том числе, аутоантител), наступает гипергаммаглобулинемия, образуются иммунные комплексы, чрезмерно и неконтролируемо дифференцируются Т-хелперы. Разнообразные дефекты иммунорегуляции, свойственные СКВ, связаны также с гиперпродукцией цитокинов Th2-типа (IL-2, IL-6, IL-4, IL-10 IL-12).
Одним из ключевых моментов в нарушении иммунной регуляции при СКВ является затрудненное расщепление (клиренс) иммунных комплексов, — возможно, вследствие их недостаточного фагоцитоза, связанного, в частности, с уменьшением экспрессии CR1-рецепторов комплемента на фагоцитах и с функциональными рецепторными дефектами.
Распространённость СКВ колеблется в пределах 4–250 случаев на 100 000 населения; пик заболеваемости приходится на возраст 15–25 лет при соотношении заболевших женщин к мужчинам 18:1. Наиболее часто заболевание развивается у женщин репродуктивного возраста с увеличением риска обострения во время беременности, в послеродовом периоде, а также после инсоляции и вакцинации.
СКВ часто становится причиной инвалидности. В развитых странах в среднем через 3,5 года после постановки диагноза 40% больных СКВ полностью прекращают работать, — в основном, в связи с нейрокогнитивными дисфункциями и повышенной утомляемостью. К потере трудоспособности чаще всего приводят дискоидная волчанка и волчаночный нефрит.
Клинические проявления СКВ чрезвычайно разнообразны: поражение кожи, суставов, мышц, слизистых оболочек, лёгких, сердца, нервной системы и т.д. У одного пациента можно наблюдать различные, сменяющие друг друга варианты течения и активности заболевания; у большинства больных периоды обострения заболевания чередуются с ремиссией. Более чем у половины больных есть признаки поражения почек, сопровождающиеся ухудшением реологических свойств крови [4].
Поскольку молекулярные и генетические механизмы, лежащие в основе заболевания, до сих пор как следует не изучены, специфического лечения волчанки до недавнего времени не существовало. Базисная терапия основана на приёме противовоспалительных препаратов, действие которых направлено на подавление иммунокомплексного воспаления, как в период обострения, так и во время ремиссии. Основными препаратами для лечения СКВ являются:
- глюкокортикоиды (преднизолон, метилпреднизолон);
- цитостатические препараты (циклофосфамид, азатиоприн, метотрексат, мофетила микофенолат, циклоспорин).
«Я знаю пароль, я вижу ориентир»
В конце 1990-х в биофармацевтической компании Human Genome Sciences (Роквилл, Мэриленд, США) открыли молекулярный путь, «сузив» который, можно в какой-то степени сдержать развитие СКВ. В этом пути участвует белок, получивший название «стимулятор B-лимфоцитов» (или BLyS), — цитокин из семейства фактора некроза опухолей. Было обнаружено, что ингибирование BLyS позволяет несколько сдержать разыгравшуюся иммунную систему и уменьшить число колоний B-лимфоцитов, производящих аутоантитела, атакующие здоровые ткани.
Исследователи, желая специфически блокировать BLyS, сделали ставку на человеческое моноклональное антитело, разработанное совместно с английской биотехнологической фирмой Cambridge Antibody Technology, и названное белимумаб (belimumab). В начале марта 2011 года американское Управление по контролю за качеством пищевых продуктов и лекарственных препаратов (FDA) впервые за 56 лет одобрило препарат, предназначенный для специфического лечения системной красной волчанки. Эти препаратом стал Бенлиста — коммерческое название антитела белимумаба, производством которого уже занимается компания GlaxoSmithKline. До того FDA одобряла для терапии СКВ гидроксихлорохин — лекарство от малярии; было это в 1956 году.
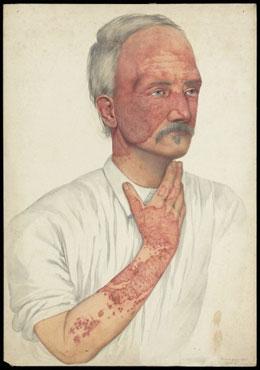
Рисунок 2. Человек, больной системной красной волчанкой (акварель 1902 года кисти Мэйбл Грин). Свое название заболевание получило ещё в средневековье, когда людям казалось, что характерная волчаночная сыпь на переносице напоминает волчьи укусы.
Дорога к этому свершению была долгой, потому что до 2009 года, когда белимумаб успешно прошел первые две фазы клинического тестирования, ещё ни одно лекарство против волчанки не добиралось до фазы III испытаний — рандомизированного мультицентрового исследования с участием большой популяции пациентов. (О процессе разработки лекарств и о клинических испытаниях см. «Драг-дизайн: как в современном мире создаются новые лекарства» [5].) Дело в том, что «строгая» система клинических проверок, основанная на идеологии доказательной медицины, просто не пропускала препараты-«кандидаты», оказывавшиеся на поверку просто неэффективными или опасными для здоровья пациентов.
«Под проекты разработки лекарств против волчанки было просто не получить финансирования, поскольку все знали, что эти разработки как одна проваливаются», — говорит Ричард Фьюри (Richard Furie), ревматолог из Нью-Йорка, руководивший клиническими исследованиями белимумаба. — «Люди открыто говорили: „вы никогда не добьетесь успеха [в клинических исследованиях]“» [6].
Целенаправленная терапия
Когда исследователи из Human Genome Sciences (HGS) открыли цитокин BLyS [7] на основе анализа генетической активности белых клеток крови, полной последовательности генома человека [8] еще не было. «Это было чудное время», — рассказал Дэвид Гилберт (David Hilbert), бывший руководитель исследований этой компании. — «Мы каждый день сидели над лимфоцитами и получали последовательности все новых и новых генов, про которые совершенно не было понятно, что они такое» [6].
В процессе исследования BLyS сотрудники HGS обнаружили, что количество этого цитокина сильно увеличивается при воспалении, а особенно — у больных волчанкой. Это была очень важная зацепка, хотя и было понятно с самого начала, что дорога предстоит нелёгкая, учитывая количество уже провалившихся клинических испытаний препаратов. Ситуация особенно осложнялась тем, что клинические проявления СКВ крайне разнообразны — от лёгкого дискомфорта у одних до тяжкого бремени на всю жизнь у других, — что и побудило, наверное, авторов «Доктора Хауса» включить волчанку в сериал в таком утрированном контексте.
Кстати, цитокину BLyS даже есть памятник, причем в процессе его синтеза на рибосоме: дочь основателя компании HGS, увлекающаяся молекулярной скульптурой [9], «позаимствовала» у отца белок для ваяния. Скульптура установлена в американском НИИ Колд Спринг Харбор.
Действие лекарств, селективно на молекулярном уровне «выключающих» некоторые ветви иммунитета, должно быть очень точным. Например, в 2008 закончились неудачей клинические испытания атацицепта (atacicept), ингибирующего не только BLyS, но и ещё один родственный белок. Тестирование на больных тяжелой формой волчанки — волчаночным нефритом — пришлось срочно прекратить из-за аномально высокого числа побочных инфекций у принимавших лекарство. Аналогичная ситуация была с антителом окрелизумабом (ocrelizumab), блокировавшим работу B-лимфоцитов по другому механизму.
Следующие на очереди
Белимумаб — только первое лекарство из находящихся на очереди в процессе тестирования у различных фармацевтических фирм (таких как Anthera, Eli Lilly и других). Часть разрабатываемых лекарств действуют также на BLyS, другие — ингибируют работу T-лимфоцитов, «атакуя» белок под «научным» названием B7-родственный белок, ещё один препарат ингибирует медиатор воспаления интерферон-γ. Самому же белимумабу пророчат светлое будущее — с точки зрения фармацевтических гигантов, это обозначает миллиардные продажи, выводящие препарат в заветный список «блокбастеров». Между прочим, это совершенно не обозначает полного излечения от болезни миллионам пациентов — эффективность препарата не такая уж и высокая (согласно официальной информации, помогает он одному пациенту из 11), тем более что тестирование проводили не на тяжелой форме заболевания [10]. Кроме того, белимумаб оказался неэффективен в лечении чернокожих пациентов. Впрочем, это все равно лучше, чем неспецифически «глушить» иммунитет пациентов. Жаль только, что большинству российских больных придется по старинке использовать преднизолон, хоть менее эффективный, но зато намного более дешевый, чем инновационный препарат «с пылу-жару».
Системная красная волчанка (СКВ) — это аутоиммунное мультисистемное заболевание, которое может поражать такие жизненно важные органы, как почки и головной мозг. Хотя в последние десятилетия выживаемость больных СКВ значительно улучшилась в результате использования кортикостероидов и иммуносупрессантов, современное лечение сопровождается значительными побочными эффектами. И сама болезнь, и побочные эффекты лечения приводят к кумуляции органных повреждений, что снижает и качество, и продолжительность жизни пациентов. Международная экспертная группа сформулировала рекомендации для достижения хороших результатов лечения СКВ с учетом клинического течения, накопления необратимых органных изменений и функционального статуса. Рабочая группа установила четыре всеобъемлющих принципа ведения больных СКВ, подчеркивая важность вклада пациента в процесс принятия решений, мультидисциплинарного подхода, регулярного мониторинга и корректировки терапии с целью повышения продолжительности жизни, предотвращения повреждения внутренних органов, оптимизации качества жизни путем снижения активности СКВ, минимизации проявлений сопутствующей патологии и токсичности лекарственных препаратов.
Ключевые слова: системная красная волчанка, лечение, ремиссия, активность, качество жизни.
Для цитирования: Мок Т.М. «Лечение до достижения цели» при системной красной волчанке. Вызовы современности. РМЖ. 2018;4(I):6-9.
Challenges in treating-to-target in systemic lupus erythematosus
Mok T.M.
City University of Hong Kong
North District Hospital, New Territories, Hong Kong
Systemic lupus erythematosus (SLE) is an autoimmune multi-systemic disease that can affect such vital organs as the kidneys and the brain. Although the survival rate of SLE patients has dramatically improved over the past few decades as a result of the use of corticosteroids and immunosuppressants, the current treatment is associated with significant adverse effects. Both the disease itself and the side effects from treatment are associated with cumulative organ damage, which reduces both the quality and expectancy of patients’ life. The international expert group on treat-to-target in SLE has formulated recommendations with the goals to yield superior outcomes in terms of clinical course, long-term damage and functional status. The working group established four overarching principles for managing SLE patients, emphasizing the importance of contribution of the patient in the decision making, the multidisciplinary approach, the regular monitoring and adjustment of therapy with the goals towards ensuring long-term survival, preventing organ damage, optimising health-related quality of life by controlling disease activity, minimising comorbidities and drug toxicity.
Key words: systemic lupus erythematosus, treatment, remission, activity, quality of life.
For citation: Mok T.M. Challenges in treating-to-target in systemic lupus erythematosus // RMJ. 2018. № 4(I). P. 6–9.
Статья посвящена возможностям концепции «Лечение до достижения цели» при системной красной волчанке. Представлены рекомендации международной экспертной группы по лечению системной красной волчанки.
Введение
Системная красная волчанка (СКВ) — это системное аутоиммунное заболевание, распространенное среди азиатов несколько больше, чем в европейской популяции. СКВ затрагивает преимущественно женщин в репродуктивном возрасте и связана со значительной заболеваемостью и смертностью [1]. Это мультисистемное воспалительное заболевание, которое может поражать такие жизненно важные органы, как почки и головной мозг. Хотя в последние десятилетия выживаемость больных СКВ значительно улучшилась в результате использования кортикостероидов и иммуносупрессантов, современное лечение сопровождается значительными побочными эффектами. И сама болезнь, и побочные эффекты лечения приводят к кумуляции органных повреждений, что снижает качество и продолжительность жизни пациентов. Пациенты с СКВ также имеют повышенный стандартизированный коэффициент смертности, прежде всего за счет сердечно-сосудистой патологии и инфекционных осложнений [2].
Проблема ведения больных СКВ далека от разрешения
Несмотря на то, что СКВ по большей части имеет волнообразное течение клинической картины, у значительной доли пациентов (46–52%) имеет место постоянно высокая активность болезни [3]. Около четверти пациентов (24,5%) демонстрируют рефрактерное к проводимой терапии течение СКВ [4]. Рефрактерное течение СКВ, несмотря на современный арсенал терапии, часто проявляется симптомами изъязвления кожи (дискоидной волчанки), волчаночного нефрита и нейропсихиатрической симптоматикой. Пациенты с активным волчаночным нефритом, которые не отвечают на индукционную терапию, имеют худший долговременный прогноз по сравнению с теми, у кого имеется полностью или частично ранний положительный эффект лечения. В целом поражение внутренних органов при СКВ обусловливает неблагоприятный прогноз болезни и более высокую летальность [5].
В настоящее время единственным утвержденным биологическим препаратом для лечения активной СКВ является белимумаб. Он показан при легкой и умеренной степени активности заболевания. В связи с этим возникает насущная потребность в разработке стратегий для лучшего ведения больных СКВ и создания терапевтических подходов с более высокой клинической эффективностью и меньшим количеством побочных эффектов.
Подход «лечение до достижения цели» дает многообещающие клинические результаты
Лечение хронических заболеваний, включая сахарный диабет, артериальную гипертензию и гиперлипидемию, позволяет использовать «лечение до достижения цели» (treat-to-target, Т2Т) при ведении пациентов с данной патологией. Имеются обширные свидетельства, показывающие хорошие клинические результаты в борьбе с болезнями, при которых четко определены цели лечения. В последние годы борьба с ревматическими болезнями также эволюционировала от подхода, основанного на симптомах, к подходу, предполагающему воздействие на цель [6]. Лучше всего стратегия Т2Т работает при ревматоидном артрите (РА), где существуют хорошо зарекомендовавшие себя методы для измерения активности болезни, эффективные методы терапии, в т. ч. комбинации противоревматических препаратов, модифицирующих болезнь (DMARDs), и биологических агентов, а также реалистичная и вполне достижимая терапевтическая цель. Помимо хорошо определенной цели лечения (отсутствие активности заболевания — ремиссия, а если ремиссия не может быть достигнута, то состояние низкой клинической активности) при РА разработаны совершенные методы мониторинга пациентов с целевым титрованием лекарственных препаратов. Все это способствует контролю над симптомами и активностью болезни, замедлению рентгенологической прогрессии эрозивных изменений суставов, улучшению их функционального состояния и качества жизни пациентов [7].
Трудности, стоящие на пути внедрения стратегии Т2Т при СКВ
Критерии Европейской антиревматической лиги (EULAR) для стратегии Т2Т при СКВ
Международная целевая группа сформулировала рекомендации с целями достижения превосходных результатов лечения СКВ с учетом клинического течения, накопления необратимых изменений и функционального статуса. Рабочая группа установила 4 всеобъемлющих принципа ведения больных СКВ, подчеркивая важность:
вклада пациента в процесс принятия решений;
мультидисциплинарного подхода;
регулярного мониторинга и корректировки терапии;
повышения продолжительности жизни, предотвращения повреждения внутренних органов, оптимизации качества жизни путем снижения активности СКВ, минимизации проявлений сопутствующей патологии и токсичности лекарственных препаратов.
Ниже представлен упрощенный вариант этих рекомендаций:
Ремиссия или как можно более низкая активность болезни, если ремиссия не может быть достигнута, являются терапевтическими мишенями, измеряемыми с помощью надежного индекса активности СКВ.
Предотвращение обострений.
Лечение больных СКВ с признаками серологической активности без явной клинической активности не рекомендуется.
Предотвращение накопления необратимых изменений в органах.
Решение проблемы факторов, влияющих на здоровье и связанных с качеством жизни больного: усталость, боль, депрессия.
Раннее распознавание и лечение волчаночного нефрита.
Как минимум 3-летняя поддерживающая иммуносупрессивная терапия волчаночного нефрита после успешного ответа на начальный курс терапии.
Использование, насколько возможно, низких доз кортикостероидов и, при возможности, их полная отмена.
Профилактика и лечение проявлений антифосфолипидного синдрома.
Применение противомалярийных препаратов у всех больных СКВ, если нет противопоказаний.
Контроль сопутствующей патологии.
Заключение
При СКВ необходимо мобилизовать усилия врачей для разработки стратегии Т2Т в целях оптимизации лечения этого заболевания. С разработкой удобных в клинической практике методик для измерения степени органоспецифических поражений, при конкретизации реалистичных и достижимых терапевтических целей, с выработкой критериев эффективности лечения поражения органов, с созданием системы строгого мониторинга пациентов с серологической активностью и созданием новых, высокоэффективных биологических агентов можно предположить, что цели профилактики обострений и органных повреждений при СКВ, а в конечном итоге — улучшение качества жизни и снижение смертности могут быть достигнуты.
Оригинал статьи: Mok T.M. Challenges in treating-to-target in systemic lupus erythematosus // Hong Kong Medical Diary. 2017. Vol. 22(10). P. 15–19. Перевод и публикация согласованы с редакцией издания. This reprint was authorized by The Federation of Medical Societies of Hong Kong. The Hong Kong Medical Diary May Issue 2017.
Статью перевел к.м.н. М.В. Головизнин
1. Mok M.Y., Li W.L. Do Asian patients have worse lupus? // Lupus. 2010. Vol. 19(12). P. 1384–1390.
2. Bernatsky S., Boivin J.F., Joseph L. et al. Mortality in systemic lupus erythematosus // Arthritis Rheum. 2006. Vol. 54(8). P. 2550–2257.
3. Conti F., Ceccarelli F., Perricone C. et al. Flare, persistently active disease, and serologically active clinically quiescent disease in systemic lupus erythematosus: a 2-year follow-up study // PLoS One. 2012. Vol. 7. P. e45934.
4. Pego-Reigosa J.M., Rua-Figueroa I., Lopez-Longo F.J. et al. Analysis of disease activity and response to treatment in a large Spanish cohort of patients with systemic lupus erythematosus // Lupus. 2015. Vol. 24. P. 720–729.
5. Bruce I.N., O’Keeffe A.G., Farewell V. et al. Factors associated with damage accrual in patients with systemic lupus erythematosus: results from the Systemic Lupus International Collaborating Clinics (SLICC) Inception Cohort // Ann Rheum Dis. 2015. Vol. 74. P. 1706–1713.
6. Atar D., Birkeland K.I., Uhlig T. ‘Treat to target’: moving targets from hypertension, hyperlipidaemia and diabetes to rheumatoid arthritis // Ann Rheum Dis. 2010. Vol. 69. P. 629–630.
7. Smolen J.S., Breedveld F.C., Burmester G.R. et al.Treating rheumatoid arthritis to target: 2014 update of the recommendations of an international task force // Ann Rheum Dis. 2016. Vol. 75. P. 3–15.
8. Gibson K.L., Gipson D.S., Massengill S.A. et al. Predictors of relapse and end stage kidney disease in proliferative lupus nephritis: focus on children, adolescents, and young adults // Clin J Am Soc Nephrol. 2009. Vol. 4. P. 1962–1967.
9. Urowitz M.B., Feletar M., Bruce I.N. et al. Prolonged remission in systemic lupus erythematosus // J Rheumatol. 2005. Vol. 32. P. 1467–1472.
10. Medina-Quinones C.V., Ramos-Merino L., Ruiz-Sada P., Isenberg D. Analysis of Complete Remission in Systemic Lupus Erythematosus Patients Over a 32-Year Period // Arthritis Care Res. 2016. Vol. 68. P. 981–987.
11. Carlavilla A., Gutierrez E., Ortuño T. et al. Relapse of lupus nephritis more than 10 years after complete remission // Nephrol Dial Transplant. 2005. Vol. 20. P. 1994–1998.
12. Golder V., Kandane-Rathnayake R., Hoi A.Y. et al. Association of the lupus low disease activity state (LLDAS) with health-related quality of life in a multinational prospective study // Arthritis Res Ther. 2017. Vol. 19. P. 62.
13. Mikdashi J., Nived O. Measuring disease activity in adults with systemic lupus erythematosus: the challenges of administrative burden and responsiveness to patient concerns in clinical research // Arthritis Res Ther. 2015. Vol. 17. P. 183.
14. Romero-Diaz J., Isenberg D., Ramsey-Goldman R. Measures of adult systemic lupus erythematosus: updated version of British Isles Lupus Assessment Group (BILAG 2004), European Consensus Lupus Activity Measurements (ECLAM), Systemic Lupus Activity Measure, Revised (SLAM-R), Systemic Lupus Activity Questionnaire for Population Studies (SLAQ), Systemic Lupus Erythematosus Disease Activity Index 2000 (SLEDAI-2K), and Systemic Lupus International Collaborating Clinics/American College of Rheumatology Damage Index (SDI) // Arthritis Care Res. 2011. Vol. 63 Suppl. 11. P. S37–S46.
15. Isenberg D.A., Gordon C., Group BGBILA. From BILAG to BLIPS — disease activity assessment in lupus past, present and future // Lupus. 2000. Vol. 9. P. 651–654.
16. Steiman A.J., Gladman D.D., Ibanez D., Urowitz M.B. Prolonged serologically active clinically quiescent systemic lupus erythematosus: frequency and outcome // J Rheumatol. 2010. Vol. 37. P. 1822–1827.
17. Steiman A.J., Gladman D.D., Ibañez D., Urowitz M.B. Outcomes in patients with systemic lupus erythematosus with and without a prolonged serologically active clinically quiescent period // Arthritis Care Res. 2012. Vol. 64. P. 511–518.
18. Tseng C.E., Buyon J.P., Kim M. et al. The effect of moderate-dose corticosteroids in preventing severe flares in patients with serologically active, but clinically stable, systemic lupus erythematosus: findings of a prospective, randomized, double-blind, placebo-controlled trial // Arthritis Rheum. 2006. Vol. 54. P. 3623–3632.
19. Mok M.Y., Chan E.Y., Fong D.Y. et al. Antiphospholipid antibody profiles and their clinical associations in Chinese patients with systemic lupus erythematosus // J Rheumatol. 2005. Vol. 32. P. 622–628.
20. Mikdashi J., Handwerger B. Predictors of neuropsychiatric damage in systemic lupus erythematosus: data from the Maryland lupus cohort // Rheumatology. 2004. Vol. 43. P. 1555–1560.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
За последние два десятилетия благодаря рациональному использованию кортикостероидных гормонов (КГ) и цитотоксических иммунодепрессантов (ЦИ) удалось значительно улучшить жизненный прогноз больных системной красной волчанкой (СКВ). Проведение пульс-терапи
За последние два десятилетия благодаря рациональному использованию кортикостероидных гормонов (КГ) и цитотоксических иммунодепрессантов (ЦИ) удалось значительно улучшить жизненный прогноз больных системной красной волчанкой (СКВ). Проведение пульс-терапии метилпреднизолоном (МП) и циклофосфаном (ЦФ) у больных с волчаночным нефритом, поражением центральной нервной системы (ЦНС) и цитопеническим кризом способствует ускорению сроков достижения клинического улучшения. Патофизиологическим обоснованием для применения ударных доз метилпреднизолона является его способность активно влиять на систему иммунитета и подавлять воспалительные реакции. Один из важнейших эффектов ударных доз КГ — подавление активности нейтрофилов и моноцитов и способность вызывать транзиторную перераспределительную лимфопению. Угнетающее воздействие мегадоз кортикостероидов на функцию В-лимфоцитов приводит к стойкому снижению продукции иммуноглобулинов, а следовательно, и аутоантител, а также к уменьшению образования патологических иммунных комплексов. Из других важных компонентов механизма действия ударных доз КГ заслуживают внимания воздействие на систему цитокинов-интерлейкинов-1,6, фактора некроза опухоли, металлопротеиназ и липокортина, ингибиция экспрессии и функциональной активности Fc и СЗ рецепторов мононуклеарных фагоцитов.
Однако далеко не во всех случаях классическая ПТ позволяет быстро и надежно решать сложнейшие вопросы лечения в критических ситуациях и прогностически неблагоприятных вариантах течения СКВ. В настоящее время достаточно четко выявляется особая группа риска. В эту группу в первую очередь включаются пациенты с развитием СКВ в подростковом возрасте, быстропрогрессирующим волчаночным нефритом с диффузным поражением клубочкового аппарата и «полулуниями», стойкой артериальной гипертензией и азотемией, быстрым развитием нефротического синдрома в молодом возрасте, церебропатией с судорожным синдромом и комой, поперечным миелитом, геморрагическим пневмонитом, тромбоцитопенией, генерализованным поражением кожи и слизистых оболочек с развитием некрозов, сопровождающихся криоглобулинемией, гипокомплементемией и высоким уровнем антиядерных антител. Огромное значение в оценке жизненного прогноза у этой группы пациентов имеет своевременное назначение патогенетической терапии.
Консервативная терапия с использованием подавляющих доз преднизолона и цитостатиков, назначаемых внутрь, у некоторых больных улучшает клиническую картину, но почти не влияет на жизненный прогноз, особенно в случаях прогрессирующего волчаночного нефрита, церебрального криза и геморрагического пневмонита. Однократное трехдневное применение ПТ МП может за сравнительно короткое время уменьшить клиническую и лабораторную активность при нефротическом синдроме. Однако 5-летняя выживаемость пациентов, как правило, не превышает 60%. Другими словами, ударные дозы МП прекрасно зарекомендовали себя в качестве фактически ургентной терапии, с успехом применяющейся в ситуациях, непосредственно угрожающих жизни пациента, при нарастании симптоматики и в случаях неэффективности или невозможности использования консервативной схемы лечения.
Практически при всех прогрессирующих хронических заболеваниях, в том числе и аутоиммунных, жизненный и социальный прогноз в огромной степени зависит от системного, программного подхода к терапии.
Различные схемы и программы интенсивной терапии у больных СКВ стали появляться уже с середины 80-х годов и сводились к назначению ПТ в ежемесячном режиме в течение полугода. Несколько позже появилась схема программного назначения ПТ в комбинации с циклофосфаном: 1 г циклофосфана может быть добавлен к стандартной пульс-терапии обычно на 2-3-й день лечения или дополнительно к метипреду при ежемесячном режиме. Показанием для комбинированного использования циклофосфана и метипреда является манифестная высокоактивная СКВ с выраженными иммунологическими нарушениями. Программное применение пульс-терапии ЦФ у больных быстро прогрессирующим люпус-нефритом впервые в стране предложила группа исследователей во главе с профессором И. Е. Тареевой. Согласно этой методике, ЦФ вводится внутривенно из расчета 1 г на 1 м 2 поверхности тела 1-2 раза в месяц в течение года. По сравнению с пероральным назначением ЦФ эта программа позволяет добиться хороших и стабильных результатов более чем у 70% больных с прогрессирующим нефритом. Особенно важным представляется то, что внутривенное введение мегадоз ЦФ оказывает значительно меньшее токсическое воздействие на эпителий мочевого пузыря и костный мозг, практически не вызывая геморрагических циститов и агранулоцитоза.
Другое направление интенсивной терапии ревматических заболеваний — экстракорпоральные методы лечения: плазмаферез (ПФ) и практически все сорбционные технологии, гемо- и плазмосорбция. В современном исполнении ПФ осуществляется с помощью центрифужной или мебранной технологии с удалением 40-60 мл плазмы на 1 кг веса больного. Для замещения потери белка используется альбумин или свежезамороженная плазма. Стандартные курсы ПФ состоят из 3-6 процедур, проводимых последовательно или с короткими интервалами, с суммарной эксфузией плазмы до 15 л.
Интерес к ПФ у ревматологов возник на рубеже 60-80-х годов после фундаментальных исследований, посвященных иммунокомплексной природе СКВ, изучению механизмов иммунокомплексного поражения органов и тканей и патогенетической роли антител к нативной ДНК. Представлялось вполне рациональным уменьшить степень тканевых повреждений за счет удаления из циркуляции иммунных комплексов (ЦИК), антител к ДНК (а-ДНК), криоглобулинов и цитокинов.
Первые попытки применения терапевтического ПФ у больных СКВ продемонстрировали возможности этого метода в первую очередь в ситуациях, когда кортикостероидная и иммуносупрессивная терапия оказывается неэффективной, при наличии высокого уровня ЦИК, а-ДНК, криоглобулинемии, цитопениях. Выявлена прямая зависимость между адекватным удалением из циркуляции патологических белковых структур и клиническим эффектом, изучены механизмы деблокирования РЭС и повышения естественного клиренса.
Эффективность плазмафереза (от нескольких процедур до многократно повторяемых серий при неблагоприятном течении СКВ) хорошо известна и доказана в ходе многочисленных, в основном зарубежных, исследований 80-90-х годов. Пока не получено убедительных данных об эффективности ПФ у больных люпус-нефритом. Результаты проведенных в США и Канаде открытых и контролируемых испытаний весьма противоречивы.
Изолированное применение ПФ при СКВ в большинстве случаев существенно ограничено развитием так называемого синдрома рикошета, возникающего непосредственно после удаления достаточно большого объема плазмы. Резкое повышение уровня аутоантител в ближайшие дни после процедуры — «рикошет» — связывается со стимуляцией лимфоцитов, продуцирующих аутоантитела по принципу обратной связи. Обычно лабораторный «рикошет» сопровождается обострением клинической картины, что в целом производит впечатление терапевтической неудачи. Логичными представляются два выхода из этой ситуации. Первый — сокращение времени между процедурами и проведение длительных серий ПФ в течение нескольких месяцев или даже лет. Второй, по-видимому, более рациональный и эффективный способ достижения стойкого клинического эффекта при назначении ПФ у больных СКВ — комбинирование экстракорпоральных методов и пульс-терапии МП и ЦФ в синхронном режиме.
Идея синхронной ИТ материализовалась уже в 80-х годах и является практически неотъемлемой частью лечения некоторых системных васкулитов, синдрома Гудпасчера, Вегенера, Хаммана-Ричи, криоглобулинемической пурпуры и поражения центральной и периферической нервной системы при болезни Шегрена. Первые успешные попытки применения синхронной ИТ у больных СКВ были предприняты в 1984 году в Японии, России и Германии: за рубежом — плазмаферез в комбинации с ЦФ, в России — ПФ в комбинации с пульс-терапией МП и ЦФ.
В Институте ревматологии начиная с середины 80-х изучалась эффективность синхронного применения ПФ и пульс-терапии МП и ЦФ у 56 больных СКВ с неблагоприятным жизненным прогнозом. Методика проведения синхронной интенсивной терапии (СИТ) заключалась в следующем: в течение первого месяца больным проводились три процедуры ПФ с удалением не менее 1500 мл плазмы за сеанс, интервалы между процедурами составляли 5-6 дней. После каждой процедуры назначался внутривенно 1 г метипреда, а после второй процедуры к МП добавлялся 1 г ЦФ. Далее в течение года через каждые 3 месяца проводилась одна процедура ПФ с последующим введением 1 г МП и 1 г ЦФ. Основу группы составляли молодые женщины, в подавляющем большинстве с небольшим сроком заболевания, с развернутой клиникой СКВ. Почти у каждого пациента наблюдался прогрессирующий волчаночный нефрит, более чем у половины — нефротический синдром, церебропатия, у трети больных на фоне криоглобулинемии наблюдался распространенный генерализованный васкулит кожи и слизистых оболочек. Высокая клиническая активность сопровождалась значительным повышением уровня антител к ДНК, ЦИК и гипокомплементемией.
Особо следует подчеркнуть, что у половины больных этой группы стандартная терапия, включавшая в себя массивные дозы кортикостероидов и иммунодепрессантов, была неэффективной, а почти трети пациентов адекватная терапия вообще не проводилась.
Многолетнее наблюдение за этой группой больных по окончании 12-месячной СИТ позволило сделать заключение о ее высокой эффективности. Среди этих пациентов 5-летняя выживаемость составила 81%. Наиболее показательными оказались результаты применения СИТ в группе из 12 подростков, у которых течение волчанки, как правило, приобретает фатальный характер. За весь период наблюдения состояние, близкое к клинико-лабораторной ремиссии, было отмечено у 8 из 12 больных, у 2 пациентов эпизодически наблюдались кратковременные обострения СКВ. Ежедневная доза преднизолона составляла от 2,5 до 15 мг, у одной пациентки кортикостероиды были полностью отменены. Большинству больных удалось вернуться к нормальной жизни, учебе, посильной работе, некоторые пациентки вышли замуж и имеют здоровых детей.
Таким образом, программа синхронной интенсивной многомесячной терапии оказывает значительное влияние на клинико-лабораторные проявления и существенно улучшает жизненный и социальный прогноз у больных СКВ с прогностически неблагоприятным вариантом течения. Синхронное назначение ПФ и внутривенное введение ударных доз МП и ЦФ могут использоваться по жизненным показаниям в случаях так называемого волчаночного криза — при тромбоцитопенической пурпуре, церебральной коме, развитии тромбозов, инфарктов и инсультов у больных с антифосфолипидным синдромом и геморрагическим пневмонитом. В этих ситуациях проведение СИТ обычно ограничивается 3-4 последовательными процедурами — вплоть до купирования ургентной ситуации. В случаях с заведомо неблагоприятным долгосрочным жизненным прогнозом — прогрессирующий гломерулонефрит или поражение ЦНС, язвенно-некротический васкулит, острое начало болезни у подростка — требуется проведение длительных программ СИТ.
Нам представляется, что возможности программной СИТ далеко не исчерпаны. Перспективным может оказаться добавление в схему внутривенного иммуноглобулина, моноклональных антител и интерферонов, применение которых способно блокировать образование аутоантител и патологических ЦИК. Весьма актуальным остается индивидуальный подбор программы с более частым (ежемесячным, еженедельным) назначением плазмафереза и ПТ. Особенно важным аспектом, обеспечивающим возможность проведения более длительных и полноценных курсов экстракорпоральных процедур, является внедрение новых технологий обработки плазмы, таких, как каскадная фильтрация и иммуносорбция, применение которых позволяет сводить к минимуму потерю альбумина и селективно удалять из циркуляции патологические аутоантитела и иммунные комплексы.
Читайте также:

