Какие лекарства нельзя при волчанке
Обновлено: 18.04.2024
За последние два десятилетия благодаря рациональному использованию кортикостероидных гормонов (КГ) и цитотоксических иммунодепрессантов (ЦИ) удалось значительно улучшить жизненный прогноз больных системной красной волчанкой (СКВ). Проведение пульс-терапи
За последние два десятилетия благодаря рациональному использованию кортикостероидных гормонов (КГ) и цитотоксических иммунодепрессантов (ЦИ) удалось значительно улучшить жизненный прогноз больных системной красной волчанкой (СКВ). Проведение пульс-терапии метилпреднизолоном (МП) и циклофосфаном (ЦФ) у больных с волчаночным нефритом, поражением центральной нервной системы (ЦНС) и цитопеническим кризом способствует ускорению сроков достижения клинического улучшения. Патофизиологическим обоснованием для применения ударных доз метилпреднизолона является его способность активно влиять на систему иммунитета и подавлять воспалительные реакции. Один из важнейших эффектов ударных доз КГ — подавление активности нейтрофилов и моноцитов и способность вызывать транзиторную перераспределительную лимфопению. Угнетающее воздействие мегадоз кортикостероидов на функцию В-лимфоцитов приводит к стойкому снижению продукции иммуноглобулинов, а следовательно, и аутоантител, а также к уменьшению образования патологических иммунных комплексов. Из других важных компонентов механизма действия ударных доз КГ заслуживают внимания воздействие на систему цитокинов-интерлейкинов-1,6, фактора некроза опухоли, металлопротеиназ и липокортина, ингибиция экспрессии и функциональной активности Fc и СЗ рецепторов мононуклеарных фагоцитов.
Однако далеко не во всех случаях классическая ПТ позволяет быстро и надежно решать сложнейшие вопросы лечения в критических ситуациях и прогностически неблагоприятных вариантах течения СКВ. В настоящее время достаточно четко выявляется особая группа риска. В эту группу в первую очередь включаются пациенты с развитием СКВ в подростковом возрасте, быстропрогрессирующим волчаночным нефритом с диффузным поражением клубочкового аппарата и «полулуниями», стойкой артериальной гипертензией и азотемией, быстрым развитием нефротического синдрома в молодом возрасте, церебропатией с судорожным синдромом и комой, поперечным миелитом, геморрагическим пневмонитом, тромбоцитопенией, генерализованным поражением кожи и слизистых оболочек с развитием некрозов, сопровождающихся криоглобулинемией, гипокомплементемией и высоким уровнем антиядерных антител. Огромное значение в оценке жизненного прогноза у этой группы пациентов имеет своевременное назначение патогенетической терапии.
Консервативная терапия с использованием подавляющих доз преднизолона и цитостатиков, назначаемых внутрь, у некоторых больных улучшает клиническую картину, но почти не влияет на жизненный прогноз, особенно в случаях прогрессирующего волчаночного нефрита, церебрального криза и геморрагического пневмонита. Однократное трехдневное применение ПТ МП может за сравнительно короткое время уменьшить клиническую и лабораторную активность при нефротическом синдроме. Однако 5-летняя выживаемость пациентов, как правило, не превышает 60%. Другими словами, ударные дозы МП прекрасно зарекомендовали себя в качестве фактически ургентной терапии, с успехом применяющейся в ситуациях, непосредственно угрожающих жизни пациента, при нарастании симптоматики и в случаях неэффективности или невозможности использования консервативной схемы лечения.
Практически при всех прогрессирующих хронических заболеваниях, в том числе и аутоиммунных, жизненный и социальный прогноз в огромной степени зависит от системного, программного подхода к терапии.
Различные схемы и программы интенсивной терапии у больных СКВ стали появляться уже с середины 80-х годов и сводились к назначению ПТ в ежемесячном режиме в течение полугода. Несколько позже появилась схема программного назначения ПТ в комбинации с циклофосфаном: 1 г циклофосфана может быть добавлен к стандартной пульс-терапии обычно на 2-3-й день лечения или дополнительно к метипреду при ежемесячном режиме. Показанием для комбинированного использования циклофосфана и метипреда является манифестная высокоактивная СКВ с выраженными иммунологическими нарушениями. Программное применение пульс-терапии ЦФ у больных быстро прогрессирующим люпус-нефритом впервые в стране предложила группа исследователей во главе с профессором И. Е. Тареевой. Согласно этой методике, ЦФ вводится внутривенно из расчета 1 г на 1 м 2 поверхности тела 1-2 раза в месяц в течение года. По сравнению с пероральным назначением ЦФ эта программа позволяет добиться хороших и стабильных результатов более чем у 70% больных с прогрессирующим нефритом. Особенно важным представляется то, что внутривенное введение мегадоз ЦФ оказывает значительно меньшее токсическое воздействие на эпителий мочевого пузыря и костный мозг, практически не вызывая геморрагических циститов и агранулоцитоза.
Другое направление интенсивной терапии ревматических заболеваний — экстракорпоральные методы лечения: плазмаферез (ПФ) и практически все сорбционные технологии, гемо- и плазмосорбция. В современном исполнении ПФ осуществляется с помощью центрифужной или мебранной технологии с удалением 40-60 мл плазмы на 1 кг веса больного. Для замещения потери белка используется альбумин или свежезамороженная плазма. Стандартные курсы ПФ состоят из 3-6 процедур, проводимых последовательно или с короткими интервалами, с суммарной эксфузией плазмы до 15 л.
Интерес к ПФ у ревматологов возник на рубеже 60-80-х годов после фундаментальных исследований, посвященных иммунокомплексной природе СКВ, изучению механизмов иммунокомплексного поражения органов и тканей и патогенетической роли антител к нативной ДНК. Представлялось вполне рациональным уменьшить степень тканевых повреждений за счет удаления из циркуляции иммунных комплексов (ЦИК), антител к ДНК (а-ДНК), криоглобулинов и цитокинов.
Первые попытки применения терапевтического ПФ у больных СКВ продемонстрировали возможности этого метода в первую очередь в ситуациях, когда кортикостероидная и иммуносупрессивная терапия оказывается неэффективной, при наличии высокого уровня ЦИК, а-ДНК, криоглобулинемии, цитопениях. Выявлена прямая зависимость между адекватным удалением из циркуляции патологических белковых структур и клиническим эффектом, изучены механизмы деблокирования РЭС и повышения естественного клиренса.
Эффективность плазмафереза (от нескольких процедур до многократно повторяемых серий при неблагоприятном течении СКВ) хорошо известна и доказана в ходе многочисленных, в основном зарубежных, исследований 80-90-х годов. Пока не получено убедительных данных об эффективности ПФ у больных люпус-нефритом. Результаты проведенных в США и Канаде открытых и контролируемых испытаний весьма противоречивы.
Изолированное применение ПФ при СКВ в большинстве случаев существенно ограничено развитием так называемого синдрома рикошета, возникающего непосредственно после удаления достаточно большого объема плазмы. Резкое повышение уровня аутоантител в ближайшие дни после процедуры — «рикошет» — связывается со стимуляцией лимфоцитов, продуцирующих аутоантитела по принципу обратной связи. Обычно лабораторный «рикошет» сопровождается обострением клинической картины, что в целом производит впечатление терапевтической неудачи. Логичными представляются два выхода из этой ситуации. Первый — сокращение времени между процедурами и проведение длительных серий ПФ в течение нескольких месяцев или даже лет. Второй, по-видимому, более рациональный и эффективный способ достижения стойкого клинического эффекта при назначении ПФ у больных СКВ — комбинирование экстракорпоральных методов и пульс-терапии МП и ЦФ в синхронном режиме.
Идея синхронной ИТ материализовалась уже в 80-х годах и является практически неотъемлемой частью лечения некоторых системных васкулитов, синдрома Гудпасчера, Вегенера, Хаммана-Ричи, криоглобулинемической пурпуры и поражения центральной и периферической нервной системы при болезни Шегрена. Первые успешные попытки применения синхронной ИТ у больных СКВ были предприняты в 1984 году в Японии, России и Германии: за рубежом — плазмаферез в комбинации с ЦФ, в России — ПФ в комбинации с пульс-терапией МП и ЦФ.
В Институте ревматологии начиная с середины 80-х изучалась эффективность синхронного применения ПФ и пульс-терапии МП и ЦФ у 56 больных СКВ с неблагоприятным жизненным прогнозом. Методика проведения синхронной интенсивной терапии (СИТ) заключалась в следующем: в течение первого месяца больным проводились три процедуры ПФ с удалением не менее 1500 мл плазмы за сеанс, интервалы между процедурами составляли 5-6 дней. После каждой процедуры назначался внутривенно 1 г метипреда, а после второй процедуры к МП добавлялся 1 г ЦФ. Далее в течение года через каждые 3 месяца проводилась одна процедура ПФ с последующим введением 1 г МП и 1 г ЦФ. Основу группы составляли молодые женщины, в подавляющем большинстве с небольшим сроком заболевания, с развернутой клиникой СКВ. Почти у каждого пациента наблюдался прогрессирующий волчаночный нефрит, более чем у половины — нефротический синдром, церебропатия, у трети больных на фоне криоглобулинемии наблюдался распространенный генерализованный васкулит кожи и слизистых оболочек. Высокая клиническая активность сопровождалась значительным повышением уровня антител к ДНК, ЦИК и гипокомплементемией.
Особо следует подчеркнуть, что у половины больных этой группы стандартная терапия, включавшая в себя массивные дозы кортикостероидов и иммунодепрессантов, была неэффективной, а почти трети пациентов адекватная терапия вообще не проводилась.
Многолетнее наблюдение за этой группой больных по окончании 12-месячной СИТ позволило сделать заключение о ее высокой эффективности. Среди этих пациентов 5-летняя выживаемость составила 81%. Наиболее показательными оказались результаты применения СИТ в группе из 12 подростков, у которых течение волчанки, как правило, приобретает фатальный характер. За весь период наблюдения состояние, близкое к клинико-лабораторной ремиссии, было отмечено у 8 из 12 больных, у 2 пациентов эпизодически наблюдались кратковременные обострения СКВ. Ежедневная доза преднизолона составляла от 2,5 до 15 мг, у одной пациентки кортикостероиды были полностью отменены. Большинству больных удалось вернуться к нормальной жизни, учебе, посильной работе, некоторые пациентки вышли замуж и имеют здоровых детей.
Таким образом, программа синхронной интенсивной многомесячной терапии оказывает значительное влияние на клинико-лабораторные проявления и существенно улучшает жизненный и социальный прогноз у больных СКВ с прогностически неблагоприятным вариантом течения. Синхронное назначение ПФ и внутривенное введение ударных доз МП и ЦФ могут использоваться по жизненным показаниям в случаях так называемого волчаночного криза — при тромбоцитопенической пурпуре, церебральной коме, развитии тромбозов, инфарктов и инсультов у больных с антифосфолипидным синдромом и геморрагическим пневмонитом. В этих ситуациях проведение СИТ обычно ограничивается 3-4 последовательными процедурами — вплоть до купирования ургентной ситуации. В случаях с заведомо неблагоприятным долгосрочным жизненным прогнозом — прогрессирующий гломерулонефрит или поражение ЦНС, язвенно-некротический васкулит, острое начало болезни у подростка — требуется проведение длительных программ СИТ.
Нам представляется, что возможности программной СИТ далеко не исчерпаны. Перспективным может оказаться добавление в схему внутривенного иммуноглобулина, моноклональных антител и интерферонов, применение которых способно блокировать образование аутоантител и патологических ЦИК. Весьма актуальным остается индивидуальный подбор программы с более частым (ежемесячным, еженедельным) назначением плазмафереза и ПТ. Особенно важным аспектом, обеспечивающим возможность проведения более длительных и полноценных курсов экстракорпоральных процедур, является внедрение новых технологий обработки плазмы, таких, как каскадная фильтрация и иммуносорбция, применение которых позволяет сводить к минимуму потерю альбумина и селективно удалять из циркуляции патологические аутоантитела и иммунные комплексы.

В журнале Rheumatology 06 октября 2017 г. опубликовано руководство по лечению системной красной волчанки у взрослых, подготовленное Британским обществом ревматологии.
Клинические и серологические признаки о вероятном диагнозе системной красной волчанки (СКВ):
1) СКВ является мультисистемным аутоиммунным заболеванием. Диагноз требует наличия комбинации клинических признаков и наличия как минимум одной связанной иммунологической патологии. При подозрении на СКВ необходимо проведение тестов крови, включая тесты на серологические маркеры.
2) Антинуклеарные антитела (ANA) присутствуют у около 95% пациентов с СКВ. Если тест негативен, то имеется низкая вероятность наличия СКВ у пациента. Положительный тест ANA имеется у около 5% взрослых и изолированно имеет низкую прогностическую ценность при отсутствии клинических признаков аутоиммунной ревматической болезни.
3) Наличие антител к двухцепочечной ДНК (анти-dsDNA), низкий уровень комплемента или анти-Sm (Smith) – антитела являются высокопрогностичным признаком диагноза СКВ у пациентов с соответствующими клиническими признаками. Анти Ro/La – антитела, и анти RNP – антитела являются менее специфичными маркерами СКВ, так как они обнаруживаются при других аутоиммунных ревматических болезнях и при СКВ.
4) Необходимо проведение теста на синдром антифосфолипидных антител у всех пациентов с СКВ изначально, особенно с отклонениями беременности в анамнезе, либо с артериальными/венозными тромботическими событиями. Подтверждающими тестами на антифосфолипидный синдром являются положительный волчаночный антикоагулянт, антитела к кардиолипину (IgG и IgM) и/или анти-бета-2 гликопротеин-1 (IgG и IgM) при проведении тестов 2 раза с как минимум 12 недель между тестированием.
Обследование пациентов с СКВ:
1) Клинические проявления у пациентов с СКВ зависят от активности болезни, поражений, токсичности препаратов или наличия сопутствующих заболеваний. По активности болезни, очень важно убедиться является ли это из-за активного воспаления или тромбоза, что и будет обусловливать стратегию лечения.
2) Клиническая оценка пациентов с СКВ должна включать тщательный анамнез и обзор систем, полный клинический осмотр и мониторинг основных показателей состояния организма, общий анализ мочи, лабораторные тесты, оценка состояния здоровья и качества жизни, и измерение активности болезни и степени повреждений с применением стандартных инструментов оценки СКВ. При наличии показаний необходимо проводить методы визуализации, биопсию почек и других тканей.
3) Активность болезни категоризуется на легкую, умеренную и тяжелую с периодами обострений. Легкой активностью болезни является клиническая стабильность без жизне-угрожающего вовлечения органов, с основным проявлением в виде артрита, кожно-слизистых поражений и легкого плеврита. У пациентов с умеренной активностью болезни имеются более серьезные проявления. При тяжелой активности болезни имеются жизне-угрожающие или орган-угрожающие проявления.
1) Пациенты с СКВ должны проходить мониторинг на регулярной основе на проявления болезни, токсичность препаратов и сопутствующие заболевания.
2) Пациенты с активной болезнью должны проходить контрольные осмотры как минимум каждые 1 - 3 месяца с измерением АД, общего анализа мочи, функции почек, анти-dsDNA антитела, уровень комплемента, С-реактивный белок, развернутый общий анализ крови, и печеночные тесты. Пациенты со стабильной болезнью с низкой активностью или в ремиссии могут проходить мониторинг менее часто, например каждые 6 - 12 месяцев.
3) Наличие синдрома антифосфолипидных антител связано с тромботическими событиями, повреждениями и неблагоприятными исходами при беременности. При отрицательном предыдущем тестировании, необходимо повторное тестирование до беременности или операции, либо при наличии новых тяжелых проявлений или сосудистых событий.
4) Анти-Ro/La антитела связаны с неонатальной СКВ (включая врожденной блокадой сердца) и должны быть проверены до беременности.
5) Пациенты с СКВ имеют повышенный риск сопутствующих болезней, таких как атеросклеротическая болезнь, остеопороз, аваскулярный некроз, злокачественных новообразований и инфекций. Необходимо проводить исходную и ежегодную оценку модифицируемых факторов риска, включая гипертонию, дислипидемию, диабет, высокий индекс массы тела и курение.
6) Иммуносупрессивная терапия может приводить к токсическим проявлениям. Необходимо проводить тщательный мониторинг препаратов путем лабораторных тестов и клинической оценки согласно руководствам по мониторингу препаратов.
Лечение легкой СКВ:
1) Лечение легкой орган-не-угрожающей СКВ включают болезнь-модифицирующие препараты гидроксихлорохин и метотрексат, и короткие курсы НПВС для контроля симптомов. Данные препараты позволяют избегать либо снижать дозу кортикостероидов.
2) Для поддерживающей терапии может понадобиться применение преднизолона в низкой дозе ≤ 7,5 мг/день . Возможно применение средств местного применения при кожных проявлениях и внутрисуставных инъекций при артритах.
3) Солнцезащитный крем с высоким SPF UV-A и UV-B является важным в лечении и профилактике вызываемых ультра-фиолетовым излучением поражений кожи. Необходимо информировать пациентов об избегании солнца и ношении соответствующей защитной одежды.
Лечение умеренной СКВ:
1) При лечении умеренной СКВ применяют более высокие дозы преднизолона (до 0,5 мг/кг/день), либо в/м иди в/в дозы метилпреднизолона. Для контроля активной болезни часто необходимы иммуносупрессивные препараты, позволяющие избежать стероиды. Данные препараты также снижают риск повреждений в длительном периоде.
2) Метотрексат, азатиоприн, микофенолата мофетил, циклоспорин и другие ингибиторы кальциневрина должны быть рассмотрены в случаях артрита, кожных поражений, серозитов, васкулите или цитопениях, если гидроксихлорохин оказался недостаточным.
3) В рефрактерных случаях можно рассмотреть возможность применения белимумаба или ритуксимаба.
Лечение тяжелой СКВ:
1) Пациенты с тяжелой СКВ, включая с поражением почек и нейро-психиатрическими проявлениями, нуждаются в тщательном обследовании для исключения других причин, включая инфекции. Лечение зависит от этиологии (воспалительной и/или тромботической) и необходимо соответствующее лечение с применением иммуносупрессии и/или антикоагуляции соответственно.
2) Иммуносупрессивные режимы при тяжелой активной СКВ включают в/в метилпреднизолон или пер-оральный преднизолон в высоких дозах (до 1 мг/кг/день) для приведения к ремиссии, либо изолированно, или как чаще бывает, в составе протокола лечения с другим иммуносупрессивным препаратом.
3) Микофенолата мофетил или циклофосфамид применяются при большинстве случаев волчаночного нефрита и при рефрактерных тяжелых случаях болезни без поражения почек.
4) Можно рассмотреть возможность применения биолоджиков белимумаба или ритуксимаба на индивидуальной основе, когда у пациентов неэффективны или непереносимы другие иммуносупрессивные препараты.
5) Внутривенные иммуноглобулины и плазмаферез могут быть рассмотрены для пациентов с рефрактерной цитопенией, тромботической тромбоцитопенической пурпурой, быстро ухудшающемся остром галлюциногенном состоянии и катастрофической формой антифосфолипидного синдрома.
По препаратам смотрите таблицу 1.
Подробнее смотрите в прикрепленном файле.
Посмотреть другие обзоры
Автор обзора
Автор обзоров мировой медицинской периодики на портале MedElement - врач общей практики, хирург Талант Иманалиевич Кадыров.
Закончил Киргизский Государственный медицинский институт (красный диплом), в совершенстве владеет английским языком. Имеет опыт работы хирургом в Чуйской областной больнице; в настоящий момент ведет частную практику.
Регулярное повышение квалификации: курсы Advanced Cardiac Life Support, International Trauma Life Support, Family Practice Review and Update Course (Англия, США, Канада).
Чтобы исследовать состояние у пациентов с СКВ, которые принимали или недавно прекратили принимать противомалярийные препараты, исследователи выявили 1573 потенциальных участника из долгосрочного наблюдательного когортного исследования в университетской клинике.
Из этой многочисленной группы было выделено 88 клинических случаев - пациентов, которые достигли клинической ремиссии в течение как минимум года и прекратили прием противомалярийной терапии.
Первая контрольная группа была представлена пациентами, которые достигли ремиссии и продолжали принимать лекарства. Также был произведен второй контроль, в результате чего общее количество участников исследования составило 173.
Все пациенты наблюдались не менее 2 лет.
Обострение СКВ было определено как любое увеличение показателей по шкале SLEDAI-2K, при значительном обострении – превышение нормы на 4 или более баллов.
Средний возраст исследуемых составил 44 года, средний возраст в контрольной группе - 46 лет.
Представителями обеих групп были преимущественно белокожие женщины.
Причины отмены препаратов включали собственную инициативу, ремиссию, а также токсическое повреждение сетчатки, кожи, слизистых оболочек и органов сердечно-сосудистой системы.
20 участников экспериментальной группы сообщили о неблагоприятных побочных эффектах противомалярийных препаратов, связанных с их высоким профилем токсичности.
Врачи также сравнили результаты 26 пожилых пациентов с волчанкой, которые принимали гидроксихлорохин в течение как минимум 5 лет до момента прекращения приема препарата, с 32 пациентами контрольной группы, которые продолжали принимать гидроксихлорохин на момент исследования.
Обострение СКВ произошло в 61,4% случаев по сравнению с 45,1% в контрольной группе (P = 0,002), причем наиболее распространенными вариантами обострений были обострения со стороны кожи и скелетно-мышечной системы.
После многомерного анализа риск обострения более чем в два раза возрастал у тех, кто прекратил лечение (отношение шансов, 2,26; 95% доверительный интервал, 1,24–4,11; P = 0,008).
Более чем в половине случаев (n = 46) противомалярийные препараты возобновляли после отмены, что в основном было связано с обострением заболевания.
Из группы пациентов, возобновивших лечение в связи с обострением СКВ: у 88% вновь был достигнут контроль над заболеванием \ произошло улучшение состояния, у оставшихся 12% случились новые обострения.
Из 88 пациентов 51 пациент резко прекратили прием терапии тогда, как 37 пациентов отмену препаратов производили постепенно.
У пациентов, придерживающихся постепенной отмены, было меньше обострений (45,9%) по сравнению с пациентами, прекратившими лечение внезапно (72,6%).
После многофакторного анализа риск обострения более чем в три раза увеличился для группы внезапной отмены лекарств (OR 3,42; 95% ДИ 1,26-9,26; P = 0,016).
Пациенты, снизившие дозу противомалярийных препаратов, позднее возобновили полноценную терапию по сравнению с группой резкой отмены лекарств (37,8% против 62,7%; P = 0,02).
Только у 5 пожилых пациентов из каждой группы - 19,2% в группе отмены и 15,6% в группе пролонгирования терапии произошел эпизод обострения СКВ (OR 1,28; 95% ДИ 0,31-5,30; P = 0,73). Большинство обострений были кожными и скелетно-мышечными по своей природе; ни в одной из групп не было развития серьезных патологических состояний.
Медленное снижение дозы или продолжение приема противомалярийных препаратов может помочь предотвратить обострение болезни у пациентов с СКВ, достигших клинической ремиссии в течение как минимум года.
У пожилых пациентов с СКВ, которые постепенно прекращают прием гидроксихлорохина, также отсутствует повышенный риск обострения болезни.
Цель: Описать схемы терапии АГ при СКВ, определить факторы, ассоциированные с неконтролируемой АГ.
Дизайн: Кросс-секционное исследование.
Методы: Для участия в исследовании по электронной базе клиник McGill Lupus отбирались пациенты, посетившие врача в период с января 2018 по май 2019 и принимавшие гипотензивные препараты. Из исследования исключались пациенты, получавшие гипотензивную терапию по поводу других патологий (например болезнь Рейно). Частота неконтролируемой АГ определялась согласно рекомендациям Канадского и Американского института кардиологии/Американской ассоциации кардиологов. Расчет методом многомерной логистической регрессии (с поправкой на возраст, пол и расу/этническую принадлежность) проводился в том случае, если неконтролируемая АГ сочеталась с высоким индексом массы тела (ИМТ), высокой длительность СКВ, высокой активностью заболевания, наличием повреждения почек, комбинацией из нескольких гипотензивных препаратов, терапией преднизолоном и нестероидными противовоспалительными препаратами (НПВС).
Результаты: Из 442 пациентов с СКВ, 108 получали гипотензивные препараты и 38 принимали комбинированную терапию. Наиболее часто встречались антагонисты рецепторов ангиотензина II, далее следовали блокаторы кальциевых каналов, диуретики, ингибиторы ангиотензин-превращающего фермента и бета блокаторы. Среди 108 пациентов 39.8% (n=43) имели артериальное давление (АД) >140/90 мм.рт.ст., 66.7% (n=72) - АД >130/80 мм.рт.ст. Мультивариантный анализ показал, что неконтролируемая АГ чаще встречается у европеоидов (ОШ 2.72, 95% ДИ, от 1.12 до 6.78) и лиц с высоким ИМТ (ОШ 1.08, 95% ДИ, от 1.00 до 1.19). У пациентов с повреждением почек АГ контролировалась лучше (ОШ 0.39, 95% ДИ. от 0.16 до 0.97). Обнаружить связь с другими переменными не удалось.
Выводы: Неконтролируемая АГ чаще встречается у европеоидов и пациентов с ожирением. Наличие отрицательной связи с повреждением почек обнадеживает, так как контролируемое АД является ключевым фактором защиты почек.

Новость
Знаменитый телесериал «Доктор Хаус» запоминается не только циничным и сварливым нравом главного героя — гения медицинской диагностики, — но и аутоиммунным заболеванием системной красной волчанкой, появляющейся там едва ли не в каждой серии и даже ставшей своеобразным рефреном сериала.
Автор
Редакторы
Системная красная волчанка — это мультифакторное заболевание, развивающееся на основе генетического несовершенства иммунной системы и характеризующееся выработкой широкого спектра аутоантител к компонентам клеточного ядра. Молекулярно-генетические основы болезни изучены довольно плохо, в связи с чем специфического лечения до сих пор не создано, а в основе проводимой в клинике патогенетической терапии лежат иммунодепрессанты — глюкокортикостероиды и цитостатики. И вот, после более чем 50 лет попыток разработать специфическое лечение волчанки, произошел сдвиг: Управление по контролю за качеством пищевых продуктов и лекарств США официально утвердило в качестве лекарства от волчанки препарат Бенлиста (Benlysta) на основе моноклональных антител, специфически блокирующих B-лимфоцит-стимулирующий белок (BLyS).
Системная красная волчанка (СКВ) — одно из самых распространённых аутоиммуных заболеваний, в основе которого лежит генетически обусловленное комплексное нарушение иммунорегуляторных механизмов. При заболевании происходит образование широкого спектра аутоантител к различным компонентам ядра клеток и формирование иммунных комплексов. Развивающееся в различных органах и тканях иммунное воспаление приводит к обширным поражениям микроциркуляторного кровяного русла и системной дезорганизации соединительной ткани [1], [2].
Патогенез СКВ
В патогенезе СКВ важное место отводится иммунным механизмам, многие аспекты которых, несмотря на интенсивное изучение, остаются невыясненными. СКВ характеризуется обескураживающей «пестротой» иммунологических феноменов, что связывают с изменением практически всех известных функций иммунокомпетентных клеток (рис. 1).

Рисунок 1. Патогенез СКВ
Волчанка во многом связана с нарушениями на уровне пролиферации различных клонов В-клеток, активируемых многочисленными антигенами, в роли которых могут выступать медицинские препараты, бактериальная или вирусная ДНК и даже фосфолипиды мембраны митохондрий. Взаимодействие антигенов с лейкоцитами связано либо с поглощением антигенов антиген-презентирующими клетками (АПК), либо с взаимодействием антигена с антителом на поверхности В-клетки.
В результате поочередной активации то T-, то B-клеток увеличивается продукция антител (в том числе, аутоантител), наступает гипергаммаглобулинемия, образуются иммунные комплексы, чрезмерно и неконтролируемо дифференцируются Т-хелперы. Разнообразные дефекты иммунорегуляции, свойственные СКВ, связаны также с гиперпродукцией цитокинов Th2-типа (IL-2, IL-6, IL-4, IL-10 IL-12).
Одним из ключевых моментов в нарушении иммунной регуляции при СКВ является затрудненное расщепление (клиренс) иммунных комплексов, — возможно, вследствие их недостаточного фагоцитоза, связанного, в частности, с уменьшением экспрессии CR1-рецепторов комплемента на фагоцитах и с функциональными рецепторными дефектами.
Распространённость СКВ колеблется в пределах 4–250 случаев на 100 000 населения; пик заболеваемости приходится на возраст 15–25 лет при соотношении заболевших женщин к мужчинам 18:1. Наиболее часто заболевание развивается у женщин репродуктивного возраста с увеличением риска обострения во время беременности, в послеродовом периоде, а также после инсоляции и вакцинации.
СКВ часто становится причиной инвалидности. В развитых странах в среднем через 3,5 года после постановки диагноза 40% больных СКВ полностью прекращают работать, — в основном, в связи с нейрокогнитивными дисфункциями и повышенной утомляемостью. К потере трудоспособности чаще всего приводят дискоидная волчанка и волчаночный нефрит.
Клинические проявления СКВ чрезвычайно разнообразны: поражение кожи, суставов, мышц, слизистых оболочек, лёгких, сердца, нервной системы и т.д. У одного пациента можно наблюдать различные, сменяющие друг друга варианты течения и активности заболевания; у большинства больных периоды обострения заболевания чередуются с ремиссией. Более чем у половины больных есть признаки поражения почек, сопровождающиеся ухудшением реологических свойств крови [4].
Поскольку молекулярные и генетические механизмы, лежащие в основе заболевания, до сих пор как следует не изучены, специфического лечения волчанки до недавнего времени не существовало. Базисная терапия основана на приёме противовоспалительных препаратов, действие которых направлено на подавление иммунокомплексного воспаления, как в период обострения, так и во время ремиссии. Основными препаратами для лечения СКВ являются:
- глюкокортикоиды (преднизолон, метилпреднизолон);
- цитостатические препараты (циклофосфамид, азатиоприн, метотрексат, мофетила микофенолат, циклоспорин).
«Я знаю пароль, я вижу ориентир»
В конце 1990-х в биофармацевтической компании Human Genome Sciences (Роквилл, Мэриленд, США) открыли молекулярный путь, «сузив» который, можно в какой-то степени сдержать развитие СКВ. В этом пути участвует белок, получивший название «стимулятор B-лимфоцитов» (или BLyS), — цитокин из семейства фактора некроза опухолей. Было обнаружено, что ингибирование BLyS позволяет несколько сдержать разыгравшуюся иммунную систему и уменьшить число колоний B-лимфоцитов, производящих аутоантитела, атакующие здоровые ткани.
Исследователи, желая специфически блокировать BLyS, сделали ставку на человеческое моноклональное антитело, разработанное совместно с английской биотехнологической фирмой Cambridge Antibody Technology, и названное белимумаб (belimumab). В начале марта 2011 года американское Управление по контролю за качеством пищевых продуктов и лекарственных препаратов (FDA) впервые за 56 лет одобрило препарат, предназначенный для специфического лечения системной красной волчанки. Эти препаратом стал Бенлиста — коммерческое название антитела белимумаба, производством которого уже занимается компания GlaxoSmithKline. До того FDA одобряла для терапии СКВ гидроксихлорохин — лекарство от малярии; было это в 1956 году.
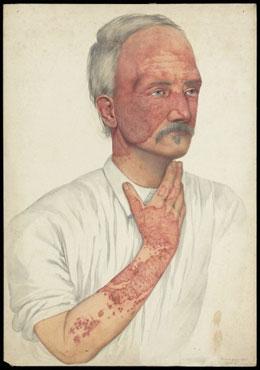
Рисунок 2. Человек, больной системной красной волчанкой (акварель 1902 года кисти Мэйбл Грин). Свое название заболевание получило ещё в средневековье, когда людям казалось, что характерная волчаночная сыпь на переносице напоминает волчьи укусы.
Дорога к этому свершению была долгой, потому что до 2009 года, когда белимумаб успешно прошел первые две фазы клинического тестирования, ещё ни одно лекарство против волчанки не добиралось до фазы III испытаний — рандомизированного мультицентрового исследования с участием большой популяции пациентов. (О процессе разработки лекарств и о клинических испытаниях см. «Драг-дизайн: как в современном мире создаются новые лекарства» [5].) Дело в том, что «строгая» система клинических проверок, основанная на идеологии доказательной медицины, просто не пропускала препараты-«кандидаты», оказывавшиеся на поверку просто неэффективными или опасными для здоровья пациентов.
«Под проекты разработки лекарств против волчанки было просто не получить финансирования, поскольку все знали, что эти разработки как одна проваливаются», — говорит Ричард Фьюри (Richard Furie), ревматолог из Нью-Йорка, руководивший клиническими исследованиями белимумаба. — «Люди открыто говорили: „вы никогда не добьетесь успеха [в клинических исследованиях]“» [6].
Целенаправленная терапия
Когда исследователи из Human Genome Sciences (HGS) открыли цитокин BLyS [7] на основе анализа генетической активности белых клеток крови, полной последовательности генома человека [8] еще не было. «Это было чудное время», — рассказал Дэвид Гилберт (David Hilbert), бывший руководитель исследований этой компании. — «Мы каждый день сидели над лимфоцитами и получали последовательности все новых и новых генов, про которые совершенно не было понятно, что они такое» [6].
В процессе исследования BLyS сотрудники HGS обнаружили, что количество этого цитокина сильно увеличивается при воспалении, а особенно — у больных волчанкой. Это была очень важная зацепка, хотя и было понятно с самого начала, что дорога предстоит нелёгкая, учитывая количество уже провалившихся клинических испытаний препаратов. Ситуация особенно осложнялась тем, что клинические проявления СКВ крайне разнообразны — от лёгкого дискомфорта у одних до тяжкого бремени на всю жизнь у других, — что и побудило, наверное, авторов «Доктора Хауса» включить волчанку в сериал в таком утрированном контексте.
Кстати, цитокину BLyS даже есть памятник, причем в процессе его синтеза на рибосоме: дочь основателя компании HGS, увлекающаяся молекулярной скульптурой [9], «позаимствовала» у отца белок для ваяния. Скульптура установлена в американском НИИ Колд Спринг Харбор.
Действие лекарств, селективно на молекулярном уровне «выключающих» некоторые ветви иммунитета, должно быть очень точным. Например, в 2008 закончились неудачей клинические испытания атацицепта (atacicept), ингибирующего не только BLyS, но и ещё один родственный белок. Тестирование на больных тяжелой формой волчанки — волчаночным нефритом — пришлось срочно прекратить из-за аномально высокого числа побочных инфекций у принимавших лекарство. Аналогичная ситуация была с антителом окрелизумабом (ocrelizumab), блокировавшим работу B-лимфоцитов по другому механизму.
Следующие на очереди
Белимумаб — только первое лекарство из находящихся на очереди в процессе тестирования у различных фармацевтических фирм (таких как Anthera, Eli Lilly и других). Часть разрабатываемых лекарств действуют также на BLyS, другие — ингибируют работу T-лимфоцитов, «атакуя» белок под «научным» названием B7-родственный белок, ещё один препарат ингибирует медиатор воспаления интерферон-γ. Самому же белимумабу пророчат светлое будущее — с точки зрения фармацевтических гигантов, это обозначает миллиардные продажи, выводящие препарат в заветный список «блокбастеров». Между прочим, это совершенно не обозначает полного излечения от болезни миллионам пациентов — эффективность препарата не такая уж и высокая (согласно официальной информации, помогает он одному пациенту из 11), тем более что тестирование проводили не на тяжелой форме заболевания [10]. Кроме того, белимумаб оказался неэффективен в лечении чернокожих пациентов. Впрочем, это все равно лучше, чем неспецифически «глушить» иммунитет пациентов. Жаль только, что большинству российских больных придется по старинке использовать преднизолон, хоть менее эффективный, но зато намного более дешевый, чем инновационный препарат «с пылу-жару».
Читайте также:

