Какие клетки кожи синтезируют коллаген
Обновлено: 25.04.2024
Настимулировать коллагена и эластина - вот она самозабвенная мечта косметолога и пациента. Девиз нашей научной недели - найти то, что скрыто. Зачем косметологу нужны аминокислоты для стимуляции синтеза коллагена. Ответы ищите в статье
Что такое коллаген
Кожа, как известно, состоит из нескольких слоев: эпидермиса, дермы и подкожно-жировой клетчатки.
АЗТ- и PRP-терапия направлены главным образом на дерму, которая отвечает за толщину и эластичность кожи, в дерме происходит огромное количество параллельных процессов синтеза и распада. Лучше пытаться влиять на эту деятельность , хорошо представляя себе патогенетические механизмы, протекающие в коже.
Основной компонент дермы – это коллаген, органическое соединение из группы фибриллярных белков. Сосочковый слой дермы образован более мелкими пучками волокон коллагена, в нем преобладает большое количество клеток (фибробласты, фиброциты, тучные клетки, Т-лимфоциты), в то время как сетчатый слой характеризуется более крупными пучками, формирующими характерную сеть, обеспечивающую прочность кожи, отсюда и название слоя – сетчатый.
- Основной белок дермы
- Волокна переплетены в правозакрученную спираль, состоящую из трех полипептидных цепей
- Производится фибробластами и расщепляется коллагеназой
- Обеспечивает упругость и эластичность кожи
Синтез коллагена
Фибробласты – основные клетки дермы, которые производят как коллаген, так и другие белки и некоторые энзимы. В разные периоды жизни человека дерма претерпевает изменения. Так, в юном возрасте она характеризуется высокой активностью фибробластов и состоит из небольших ярко-красных пучков коллагеновых волокон. С возрастом активность фибробластов снижается, уменьшается их количество, пучки коллагеновых волокон утолщаются и приобретают бледно-розовую окраску.
Молекула коллагена состоит из трех полипептидных цепей, скрученных в виде правой тройной спирали и состоящих из аминокислотных остатков (как правило, это остатки глицина, пролина и лизина). Трёхспиральная структура коллагена придает молекуле прочность.
На одном из концов молекула «сшита» поперечными связями из остатков лизина, что придает волокнам высокую степень упругости.

Особую роль в регуляции синтеза коллагена играют гормоны. Глюкокортикоиды тормозят синтез коллагена, что проявляется уменьшением толщины дермы, а также атрофией кожи в местах продолжительного введения этих гормонов (Zöller et al.).
На синтез коллагена влияют также половые гормоны, рецепторы к которым обнаружены в фибробластах. Синтез коллагена зависит от содержания эстрогенов, что подтверждает тот факт, что у женщин в менопаузе снижается содержание коллагена в дерме (Calleja-Agius et al.).
Основные типы коллагена в дерме
Существует 19 типов коллагена, в разных тканях преобладают разные его типы, что в свою очередь определяется той ролью, которую коллаген играет в конкретном органе или ткани.
В дерме, в основном, содержится коллаген I (сетчатый слой) и III (сосочковый слой) типов. Тип I составляет от 80 до 85 % матрикса дермы и отвечает за эластичность. Коллаген типа I является главным «союзником» старения. Как было установлено Nelson et al., в результате фотостарения содержание коллагена в коже снижается. Тип III второй по важности, составляет от 10 до 15 % матрикса. Волокна отличаются меньшим диаметром в сравнении с волокнами коллагена типа I и формируют более мелкие пучки, обеспечивая коже гибкость.
Тип IV является структурной составляющей базальной мембраны.
Тип V диффузно распространен в дерме и составляет от 4 до 5 % матрикса.
Тип VII участвует в образовании заякоренных фибриллов.
Тип XVII локализуется в гемидесмосомах, которые связывают клетки эпителия с лежащей под ними базальной мембраной.
В молодой коже преобладают волокна коллагена типов I (80 %) и III (15 %), что составляет 6:1. С возрастом происходит уменьшение содержания коллагена типа I, что ведет к утолщению и нарушению связей между волокнами.
Интересно, что кожа, длительное время подвергавшаяся ультрафиолетовому излучению, демонстрирует изменения в коллагене типа VII, что может быть связано с хрупкостью кожи у возрастных пациентов. Некоторые исследования также показали, что образование морщин может быть связано с ослаблением связи между дермой и эпидермисом, которая осуществляется посредством так называемых заякоренных фибриллов коллагена типа VII (Craven et al.).
Коллаген и старение
Старение характеризуется такими изменениями кожи, как появление морщин и потеря упругости. Это связано с уменьшением количества волокон коллагена в дерме. Поскольку коллаген является важнейшей «опорой» кожи, неудивительно, что если уровень его снижается, то кожа начинает «проседать», терять эластичность, а взамен приобретать морщины. Установлено, что каждый год происходит снижение уровня коллагена в тканях на 2 % (Fenske et al.).
Важную роль играет и гликация, процесс, в ходе которого лишняя молекула сахара (глюкоза) присоединяется к белковой молекуле (в частности, к молекуле коллагена), как бы склеивая ее. «Склеенные» волокна коллагена теряют способность к сокращению, что затрудняет их способность к регенерации и снижает упругость.

Как мы можем контролировать процессы синтеза и распада коллагена?
В настоящее время эстетическая медицина может предложить современные и эффективные методики созданию пула веществ для наиболее эффективного и контролируемого синтеза коллагена. В первую очередь это аминокислотно-заместительная терапия (АЗТ) и PRP-терапия (плазмотерапия).
Аминокислотно-заместительная терапия
АЗТ представляет собой инъекционное введение аминокислот (глицин, L-пролин, L-лизин моногидрохлорид, L-лейцин), которые ответственны за выработку коллагена.
Недавнее исследование Avantaggiato et al. показало, что совместное инъекционное введение ацетилцистеина и аминокислот привело к улучшению внешнего вида кожи, замедлило ее старение и обезвоживание.
На российском рынке хорошо зарекомендовал себя препарат JALUPRO® (Италия).
Практические аспекты использования AЗТ мы выяснили у Дианы Юдиной, доктора-косметолога, которая давно и очень успешно использует аминокислотно-заместительную терапию в своих комплексных программах.
Сертифицированный тренер и руководитель направления "Мезотерапия и Пилинги" компании «Валлекс М» (Москва), тренер Эстетической Академии Galderma, сертифицированный тренер компании Ipsen (Москва), член экспертной группы Skin Tech & Aesthetic Dermal (Испания).
• Основная функция коллагена состоит в обеспечении структурной опоры тканей
• Коллагены представляют собой семейство, состоящее более чем из 20 различных белков внеклеточного матрикса. Эти белки — наиболее распространенные в царстве животных
• Все коллагены организованы в тройные спирализованные «коллагеновые субъединицы», обладающие суперспиральной структурой и состоящие из трех отдельных полипептидов
• Коллагеновые субъединицы выходят из клеток и затем, во внеклеточном пространстве, собираются в более крупные фибриллы и волокна
• Мутации в коллагеновых генах вызывают множество патологических состояний, начиная от появления морщин до развития хрупкости костей и таких тяжелых заболеваний, как образование кожных волдырей
Семейство коллагенов включает более 20 белков, которые относятся к наиболее распространенным белкам клеток животных. У многоклеточных организмов коллагены существуют по крайней мере 500 млн лет. Почти все клетки животных синтезируют и секретируют по меньшей мере одну из форм коллагена.
Коллагены обеспечивают тканям структурную поддержку и существуют во множественных формах, организованных в различные структуры. Все белки семейства коллагенов характеризуются одним общим свойством: они собраны в тонкие (примерно 1,5 нм диаметром) тройные спиральные суперспирализованные структуры, состоящие из трех субъединиц коллагеновых белков, которые удерживаются вместе ковалентными и нековалентными связями.
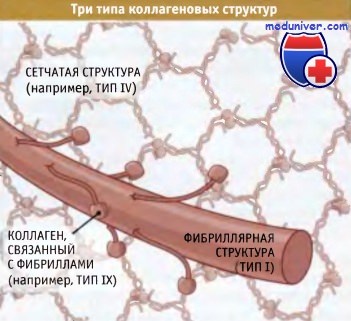
Коллагеновые субъединицы собираются в тройные спиральные структуры, которые организуются в фибриллы или в сеть,
где они связаны между собой другими белками внеклеточного матрикса, включая коллагены, связанные с фибриллами.
Суперспирализованные структуры бывают трех типов — фибриллярные, слоистые и связанные с фибринами:
• В фибриллярных коллагенах суперспирализованные спирали организованы в фибриллы или «канаты», которые обеспечивают прочность структуры вдоль единственнной оси (такая структура напоминает прочный стальной трос, образованный проволочными пучками). Когда эти фибриллы собраны в параллельно расположенные пучки, как в сухожилиях, они обеспечивают невероятную прочность структуры, которая способна противостоять усилиям, развиваемым мышцами, закрепленными на костях.
• Слоистые коллагены представляют собой сеть, состоящую из суперспирализованных спиральных структур. Они в меньшей степени устойчивы к мышечным усилиям, но гораздо лучше противостоят растяжению в нескольких направлениях. Сеть таких структур, например, характерна для кожи.
• Третий тип коллагена, известный как «фибриллярные связки», образует суперспирализованные спиральные структуры, связывающие коллагеновые фибриллы вместе.
Независимо от организации, коллагены образуют основную каркасную структуру внеклеточного матрикса. Такие входящие во внеклеточный матрикс белки, как фибронектин и витронектин, связываются с коллагенами и вплетены в структуры, образованные коллагеновым каркасом. Один из представителей семейства коллагенов представляет собой трансмембранный белок, который участвует в формировании межклеточных контактов.
Существует примерно 20 различных типов коллагена, большая часть которых может быть сгруппирована в четыре класса. Каждая из тройных спиралеобразных структур обозначается римской цифрой (I, II, III и т. д.). Каждая коллагеновая субъединица имеет обозначение как субъединица а, а ее типу присвоен номер (а1, а2, а3 и т. д.), после которого римской цифрой обозначен тип, в котором она находится. Например, основной фибриллярный коллаген хвоста (и других тканей) крыс относится к типу I и состоит из двух копий субъединиц а1(1) и одной копии субъединицы а2 (I).
На рисунке ниже представлена структура коллагеновых волокон. Три полипептидные субъединицы параллельно обернуты вокруг друг друга и образуют суперспирализованную спиральную структуру длиной 300 нм. Для коллагенов характерна повторяющаяся последовательность аминокислот, содержащая элемент глицин-X-Y, где X и Y могут представлять собой любую аминокислоту, но обычно это пролин и гидроксипролин соответственно.
Такая последовательность способствует плотной упаковке трех субъединиц и облегчает образование суперспиральной структуры. Субъединицы длиной 300 нм скрепляются вместе посредством ковалентных связей, которые образуются между N-концевым участком одной субъединицы и С-концевым участком примыкающей к ней. Суперспирализованные спиральные структуры располагаются параллельно, образуя между собой небольшие зазоры (64-67 нм). Эти зазоры обеспечивают характерный вид (исчерченность) фибрилл, видимый в электронном микроскопе.

Коллагеновые белки подразделяются на четыре основные группы, которые отличаются по молекулярной формуле,
характеру полимерных форм и по распределению в тканях. Некоторые группы включают коллагены нескольких типов.
Полностью собранные коллагеновые структуры (фибриллярные или сетчатые) по размерам оказываются гораздо больше, чем сами клетки; некоторые фибриллы могут достигать нескольких миллиметров длины. Таким образом, субъединицы коллагена синтезируются и секретируются в виде суперспирализованных спиральных структур, и окончательные этапы их сборки происходят вне клетки. Как показано на рисунке ниже, синтез коллагена и дальнейший его процессинг происходят на протяжении всего секреторного пути. При синтезе коллагеновые белки направляются в гранулярный эндоплазматический ретикулум (ЭПР) при участии частиц, распознающих сигнал и связанного с ними белкового аппарата.
Коллагеновые субъединицы синтезируются в виде крайне длинных полипептидов, которые называются проколлагены и содержат пропептиды, представляющие собой «хвосты», расположенные на амино- и карбоксильном концах.
После того как проколлагены попали в просвет ЭР, по мере транспорта из ЭР через аппарат Гольджи и в секреторные везикулы, они претерпевают серию модификаций. В процессе транспорта проколлагена через ЭР и аппарат Гольджи, к боковым цепям пролина и лизина, находящимся в средней части молекул проколлагена, добавляются гидроксильные группы (-ОН). При этом образуются гидроксипролин и гидроксилизин.
Эти модификации обеспечивают правильное образование водородных связей, которые скрепляют вместе три субъединицы в суперспирализованной спиральной структуре. Между амино- и карбоксиконцевыми частями пропептидов образуются дисульфидные связи, которые затем обеспечивают правильное расположение трех проколлагеновых субъединиц с образованием тройной спиральной суперспирализованной структуры. Затем спираль образуется спонтанно, в направлении от С-конца к N-концу.
Пропептиды препятствуют взаимодействию суперспирализованных спиралей друг с другом, тем самым предотвращая полимеризацию коллагена в клетке. Когда произошла секреция тройных спиралей проколлагена, ферменты, которые называются протеазы проколлагена, отщепляют пропептиды. Остающийся белок, известный под названием тропоколлагена, почти весь организован в тройную спираль и представляет собой основную структурную единицу коллагеновой фибриллы.
Фибриллы собираются просто: боковые цепи лизина в тропоколлагене модифицируются при действии фермента лизилоксидазы, образуя аллизины. Эти модифицированные лизины образуют ковалентные сшивки, которые обеспечивают полимеризацию тропоколлагенов. Лизилоксидаза представляет собой внеклеточный фермент, и эта стадия сборки фибрилл происходит только после выхода проколлагена из клетки. После сборки фибриллы могут объединяться, образуя большие пучки или волокна, характерные для фибриллярного коллагена.
Принимая во внимание всю важность коллагена в обеспечении структурной поддержки тканей, можно представить, какие тяжелые последствия для организма будет иметь нарушение процесса сборки фибрилл. Мутации в генах, кодирующих синтез коллагенов или ферментов, модифицирующих проколлаген, вызывают развитие множества генетических заболеваний, затрагивающих практически все ткани. Например, коллаген типа I представляет собой основной структурный белок костной ткани. Мутации в коллагеновых генах этого типа служат причиной незавершения остеогенеза, т. н. развития «болезни хрупких костей».
Мутации в коллагеновом гене типа IV приводят к нарушению сборки базальной ламины в большинстве эпителиальных тканей и к развитию такого кожного заболевания, как буллезный эпидермоз.
Клетки связываются с коллагеном посредством специфических рецепторов, называемых интегринами. Эти рецепторы обеспечивают возможность обратимого связывания клеток с коллагенами по мере их движения по внеклеточному матриксу. Интегриновые рецепторы также активируют пути передачи сигналов, так что связывание с коллагенами (и с другими белками внеклеточного матрикса) изменяет активность в клетке биохимических процессов и, таким образом, способствует контролю над ростом и дифференцировкой клеток.
Схематическое строение тройной спиральной структуры коллагена (наверху),
организация витой структуры в фибрилле (в середине) и фибрилл в коллагеновом волокне (внизу).
Наличие 67-нм зазора между соседними спиральными структурами обусловливает видимую в электронном микроскопе исчерченность фибрилл, составляющих волокно. Посттрансляционная модификация и сборка субъединиц проколлагена в тройные спиральные структуры происходит при внутриклеточном перемещении по секреторному пути.
Однако сборка фибрилл происходит во внеклеточном пространстве после секреции тройных спиралей, обладающих витой структурой.
Для упрощения в тройных структурах не показаны гидроксильные группы и сахарные остатки. Лизилоксидаза катализирует ковалентное связывание двух боковых цепей лизина с образованием аллизинов (альдегидных производных лизина),
которые затем образуют между собой альдольную связь.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
• Основная функция эластина состоит в обеспечении эластических свойств тканей
• Мономеры эластина (известные как тропоэластиновые субъединицы) организованы в волокна, настолько прочные и устойчивые, что функционируют в течение всей жизни организмов
• Прочность этих волокон обусловлена образованием ковалентных сшивок между боковыми цепями лизина, находящегося в соседних мономерах эластина
• Эластичность волокон связана с наличием гидрофобных областей, которые при приложении силы растягиваются, а при снятии нагрузки спонтанно сокращаются
• Сборка волокон тропоэластина происходит во внеклеточном пространстве и находится под контролем трехступенчатого процесса
• Мутации в гене эластина являются причиной развития разнообразных патологических состояний, начиная от образования морщин на коже и заканчивая ранней детской смертностью
Как следует из названия, эластин представляет собой белок внеклеточного матрикса, главным образом, обеспечивающий эластические свойства тканей. Благодаря эластину, ткань может растягиваться и возвращаться к исходному размеру, дополнительно не расходуя энергию. Эластина особенного много в таких тканях, как кровеносные сосуды, кожа и легкие, где эластичность является критическим фактором, обеспечивающим правильное функционирование органа.
Например, эластичность кровеносных сосудов играет важную роль в поддержании надлежащего уровня кровяного давления, а эластичность легких с каждым вдохом обеспечивает их заполнение воздухом и последующее опорожнение.
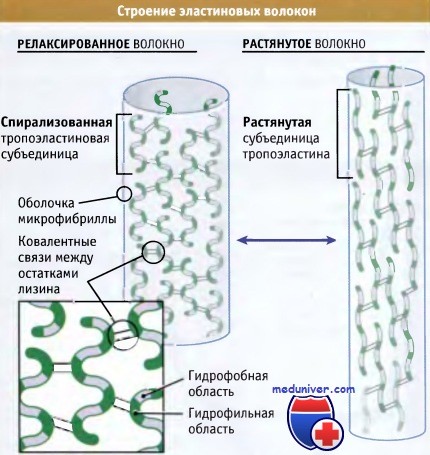
Схематическое строение релаксированных и растянутых эластиновых волокон.
Отметьте выраженные различия в структуре эластиновых субъединиц в каждом случае.
Детали строения субъединиц пока неизвестны.
Эластин синтезируется и секретируется фибробластами, представляющими собой один из наиболее распространенных типов клеток у животных, а также клетками гладкой мускулатуры. Эти клетки также секретируют коллагены, которые противостоят растяжению. В результате внеклеточный матрикс каждого органа характеризуется комбинацией свойств эластичности и прочности. Изменяя соотношение эластина и коллагена во внеклеточном матриксе, клетки могут регулировать эластические свойства органов.
Как следует из рисунка ниже, эластин организован в волокна, которые состоят из основной области эластиновых белков, окруженной оболочкой микрофибриллярных белков диаметром 10-12 нм. Основным компонентом этой оболочки является гликопротеин, связанный с микрофибриллами, который ассоциирован с мономером эластина и способствует его включению в более крупные эластиновые волокна. Эти волокна настолько прочны и стабильны, что функционируют на протяжении всей жизни организмов (т. е. не деградируя и не замещаясь). Присутствующий в этих волокнах эластин является наименее растворимым белком позвоночных.
Каким образом, эластин, обладая высокой прочностью и стабильностью, тем не менее, проявляет высокую эластичность? Ответ лежит в особенностях его структуры. Ген эластина содержит 36 экзонов, которые кодируют две совершенно разных последовательности аминокислот: некоторые из них проявляют гидрофильные свойства и содержат много остатков лизина, в то время, как другие обогащены гидрофобными аминокислотами, особенно глицином, пролином, аланином и валином.
Гидрофобные последовательности вкраплены среди гидрофильных областей, что обусловливает существование большого по размеру белка, обладающего двумя различными свойствами. Прочность эластиновых волокон, в основном определяется ковалентными связями, возникающими между боковыми цепями лизина в примыкающих друг к другу белках, подобно тому как это имеет место в коллагене. Наоборот, гидрофобные области обеспечивают эластичность за счет сворачивания молекулы в спираль в нерастянутом состоянии, и ее растяжения при приложении силы. При снятии напряжения эти области снова спонтанно сворачиваются. Даже после многолетних исследований биологи не пришли к заключению о точной конформации эластиновых белков в волокнах.
Сборка таких нерастворимых белков ставит перед клеткой особые проблемы. Если эти белки, до момента их секреции из клетки, спонтанно агрегируют, они могут повлиять на секрецию других белков, «закупоривая» секреторные пути, а также вызывать разрыв органелл или плазматической мембраны. Клетки синтезируют и секретируют эластиновые белки в виде мономеров, однако собирают волокна только во внеклеточном пространстве, после того как белки вышли из клетки, не нарушив ее внутреннюю среду.
Как иллюстрирует рисунок ниже, образование эластина включает три основных этапа:
• Вскоре после образования эластиновых мономеров (известных под названием тропоэластина) они связываются в ЭПР с белком-шапероном мол. массы 67 кДа. В течение всего процесса секреции этот шаперон остается связанным с тропоэластином и предотвращает агрегацию эластина в клетке.
• После завершения секреции комплекс с помощью шаперона удерживается на поверхности клетки до тех пор, пока он не вступит в контакт с оболочкой эластинового волокна. После этого вновь секрети-рованный тропоэластин встраивается в эластиновое волокно с участием сахарных компонентов его оболочки, которые замещают шапероны.
• Большая часть боковых цепей лизина, присутствующего в мономере тропоэластина, дезаминируется при действии фермента лизилоксидазы. При этом образуются аллизины, которые ковалентно связываются с аллизинами или немодифицированными лизинами, присутствующими в других эластиновых белках волокна. Название зрелый эластин используют для обозначения эластиновых белков, которые были модифицированы лизилоксидазой и образовали полимер.
Таким образом, трехэтапный метод обеспечивает полную сборку эластина только в тех местах клетки, где это является необходимым.
Как можно ожидать, изменения, наступающие в процессе сборки или функционировании эластина и эластиновых волокон, могут иметь серьезные последствия для клетки. Дряблость кожи, заболевание, которое выражается в утрате эластиновых волокон в коже и соединительной ткани, по тяжести проявления может варьировать от незначительного разрушения волокон и возникновения морщин до практически полной утраты волокон. У больных, в клетках которых мало эластиновых волокон или они вообще отсутствуют, не поддерживается целостность тканей, и они умирают в раннем детстве.
У больных с синдромом Вильямса образуются укороченные формы эластина, в которых отсутствуют некоторые домены связывания, и нарушен процесс организации в волокна. У этих больных развивается сильное сужение крупных артерий, по-видимому, обусловленное аномальным ростом вокруг артерий клеток гладкой мускулатуры. Это служит компенсаторной реакцией в ответ на утрату эластиновых волокон, обычно присутствующих в стенке артерий.
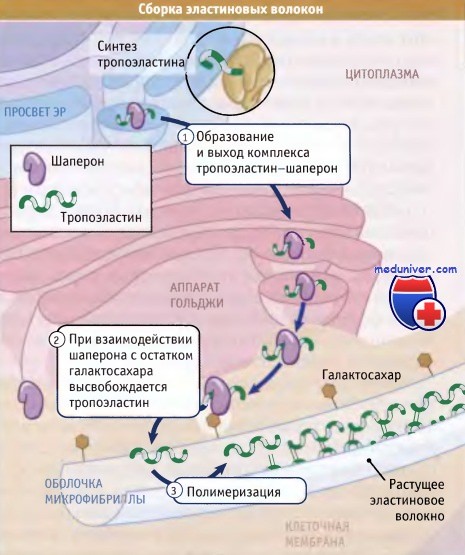
Во время транспорта к клеточной поверхности эластиновые мономеры (тропоэластины) связаны с шаперонами.
Связывание шаперонов с оболочкой микроволокна приводит к высвобождению мономеров эластина.
Полимеризация катализируется поперечными сшивками тропоэластинов, которые образуются при действии лизилоксидазы.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Гистология дермы. Коллагеновые, эластические, ретикулярные волокна дермы
В дерме три типа волокон — коллагеновые, эластические и ретикулярные.
Коллагеновые волокна. Коллаген составляет более 98% соединительной ткани дермы и выглядит как пучки волокон, связанных друг с другом основным межуточным веществом. Наиболее грубые волокна и пучки расположены ближе к подкожной жировой клетчатке, наиболее нежные — в верхней части дермы.
В сосочковом и подсосочковом слоях дермы коллагеновые пучки располагаются без всякого порядка и взаимно не пересекаются. В нижних частях дермы пучки расположены параллельно поверхности кожи и пересекаются. Коллагеновые пучки сами по себе обладают слабой способностью к растяжению, однако их волнообразное расположение усиливает эту способность.
Между коллагеновыми пучками разбросано небольшое количество клеток — фибробластов, имеющих бледное ядро овальной или веретенообразной формы, заключенное в отчетливую ядерную мембрану.
Эластические волокна. Коллагеновые пучки тесно переплетаются с сетью эластических волокон, располагающихся в пространствах между первыми. Эластические волокна прямые или слегка волнистые. Они толще и их намного больше в нижней части дермы, где их расположение напоминает расположение коллагеновых волокон — главным образом параллельно поверхности кожи. Длина волокон достигает 200 u.
В сосочках эластические волокна направляются кверху и расщепляются на отдельные волоконца, способствующие тесной связи между эпидермисом и дермой. Эластические волокна не окрашиваются такими обычными красками как гематоксилинэозин и флоксин-метиленовая синь. Чтобы их выявить, необходимо применять избирательные окраски, например по методу Верхофа (Verhoeff). Эластические волокна ригидны, но эластичны; ригидность предохраняет кожу от чрезмерной растяжимости.
Когда кожа чрезмерно растянута, например при беременности, эластические волокна могут разрываться и дегенерировать.
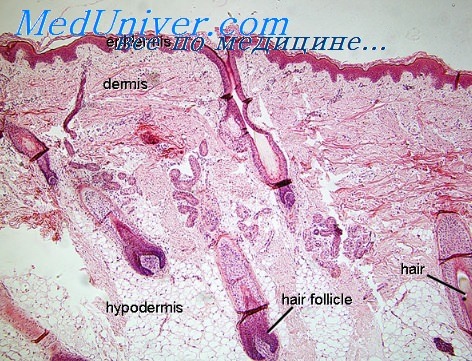
Ретикулярные волокна. Ретикулярные, или решетчатые, волокна («Gitterfasern») образуют третью систему волокон в коже. Они не видны при применении обычных красок, но окрашиваются серебром (краской Фута). В настоящее время считают, что ретикулярная ткань кожи представляет собой незрелый коллаген («преколлаген») или коллаген, находящийся в состоянии отдельных волоконец; коллаген же является компактной ретикулярной тканью [Маллори и Паркер (Mallorу, Parker)].
На препаратах, содержащих ретикулярные волокна (при окраске по Футу), легко заметить, что в участках, где эти волокна расположены наиболее густо, они имеют тенденцию собираться в агрегаты коллагеновых пучков. Мнение об идентичности коллагена и ретикулярной ткани основывается и на их одинаковой окрашиваемости. Исключение составляет различная окрашиваемость серебром. Разница в аргирофильных свойствах зависит от того, что ретикулярные волокна — более нежные структуры, чем коллагеновые волокна, и потому легче проницаемы для коллоидального серебра [Нажеотт и Гийон (Nageotte, Guyon)].
Ретикулярные волокна образуются, по-видимому, в результате желатинизации внеклеточного вещества, секретируемого мезодермальными клетками [Фут и Дэй (Day)]. Способностью к формированию ретикулярных волокон обладают различные типы мезодермальных клеток — ретикулоциты, гистиоциты, лимфоциты, сосудистые эндотелиальные клетки, клетки гладких и поперечнополосатых мышц, жировые клетки [Деблин (Dublin)].
Нормальная кожа содержит лишь небольшое количество ретикулярных волокон, так как вся ретикулярная ткань находится в зрелом виде, т. е. в виде коллагена. Небольшое число ретикулярных волокон обнаруживается обычно вокруг потовых желез и вокруг кровеносных сосудов. Кроме того, ретикулярные волокна находятся непосредственно под базальным слоем эпидермиса. На поперечных срезах волоса эти ретикулярные волокна расположены по типу щетки, а на горизонтальных срезах — в виде волокнистой сети (Одлэнд).
Вследствие того, что протоплазматические отростки базальных клеток проникают в эту сеть, осуществляется тесная связь между эпидермисом и дермой.
В противоположность этому при патологических состояниях кожи, сопровождающихся образованием молодых мезодермальных клеток, кожа содержит многочисленные ретикулярные волокна. Особенно многочисленны ретикулярные волокна при гранулемах, таких как туберкулез, саркоид и сифилис, а также при мезодермальных опухолях — гистиоцитоме, саркомах, лимфомах. Если, однако, мезодермальные клетки чрезвычайно незрелы (как, например, при лимфоме развивающейся из недифференцированных лимфоидных клеток— «stem cells»), они могут не обладать способностью образовывать ретикулярную ткань. Если же мезодермальные клетки очень зрелые (как, например, при некоторых фибромах), вся вновь образуемая ретикулярная ткань превращается в коллаген.
- Вернуться в оглавление раздела "Дерматология"
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Об антивозрастной пользе коллагена знают многие. Но на этом его возможности не заканчиваются.
Этот белок защищает от сердечно-сосудистых заболеваний, помогает быстрее нарастить мышечную массу, укрепляет кости, повышает эластичность связок. И это далеко не полный список.
Когда еще он может быть полезен и способен ли навредить? Давайте разберемся.
Подтяжка лица мезонитями LUXEFACE - Подтянутая кожа и красивые черты лица без дорогостоящих пластических операций.
Нитевая подтяжка подбородка - Подтяжка подбородка по технологии LUXEFACE – идите по жизни с высоко поднятой головой.
Польза коллагена
Коллаген является одним из самых незаменимых структурных белков межклеточного матрикса. Вот некоторые его функции:
Улучшает здоровье кожи. Коллаген - это настоящий каркас для поддержания молодости кожи, так как обеспечивает её прочность и эластичность. Благодаря ему кожа остается гладкой, подтянутой и увлажненной. Также белок способствует естественному самовосстановлению тканей при повреждениях. Например, ускоряет заживление ран, ожогов, царапин.
Повышает эластичность связок. А, кроме того, укрепляет кости и делает суставы более подвижными, а также снижает риск развития остеопороза.
Ускоряет рост мышц. Исследования, проведённые в Германии, показали, что коллаген способствует выработке мышечных белков и повышает эффективность тренировок. К слову, мышечная ткань на 10% состоит из коллагена.
Защищает хрящевую ткань от разрушения.
Снижает риск развития сердечно-сосудистых заболеваний. Белок формирует стенки артерий, и при его дефиците они становятся хрупкими, разрушаясь в дальнейшем. Японские учёные провели эксперимент: на протяжении полугода давали испытуемым 16 граммов коллагена. После окончания опыта было зафиксировано снижение жесткости артериальной стенки.
Повышает прочность костей и предотвращает их ломкость.
Помогает сохранять целостность внутренних органов.
Этот список полезных свойств коллагена базируется на научно доказанных фактах. По наблюдениям врачей, он также позволяет нормализовать работу кишечника, контролировать вес, снижает проявления акне, влияет на улучшение настроения и уменьшение тревоги.
Причины снижения коллагенового белка

Главной причиной снижения коллагена является старение. Начиная с 25 лет, его уровень медленно, но верно начинает падать. Однако ускорить этот процесс могут и другие факторы.
К разрушителям фибриллярного белка относятся:
частые стрессовые ситуации;
злоупотребление продуктов с высоким уровнем сахара;
токсическое действие табака;
загрязненная окружающая среда;
аутоиммунные расстройства (при их наличии вырабатываются антитела, повреждающие коллагеновое вещество).
Признаки недостатка коллагена
Образованию коллагена способствуют такие вещества, как фолиевая кислота, витамин В6, цинк, медь, кремний, сера, пиридоксин, жирорастворимые витамины. При их снижении, а также при увеличении уровня аминокислоты гомоцистеин, выработка белка нарушается, что и приводит к дисфункции органов и систем. Признак недостатка коллагена можно выявить по:
снижению упругости и эластичности кожи, появлению морщин;
ухудшению здоровья зубов, кариесу, их выпадению;
снижение остроты зрения;
появлению болей в суставах;
проблемами с межпозвоночными дисками;
плохому росту ногтей и ухудшению их состояния;
более яркому проявлению сколиоза.
Как повысить уровень коллагена

Существует несколько способов восполнить его дефицит.
Применение косметических средств с коллагеновым компонентом в составе.
Минус этого метода заключается в том, что молекулы коллагена слишком велики, чтобы проникнуть в дерму. К тому же, кремы с качественным коллагеном - дорогое удовольствие. При покупке средства обратите внимание на состав. Хорошо, если в нём присутствуют активные пептиды, например, матриксил, аргирелин. Они помогают средству лучше и глубже проникнуть в дерму, а также более эффективно взаимодействовать с фибробластами.
Пищевые добавки.
Представлены в качестве спортивного питания и фармакологических средств. Лидирующие позиции занимают морской коллаген и пептиды коллагена. Для лучшего синтеза желательно параллельно принимать витамин С. Однако стоит учитывать, что в готовом виде этот белок очень трудно усваивается из пищеварительного тракта, поэтому на кожу добавки практически не оказывают никакого влияния.
Включение в ежедневный рацион продуктов с высоким содержанием этого белка.
Им богаты говядина, телятина (в особенности - костный бульон), курица, индейка, мясо кролика. А также креветки, сельдь, тунец, яйца.
Косметологические процедуры.
Они нацелены на повышение выработки белка в организме и пополнение его искусственным, но быстрым и самым эффективным способом.
Противопоказания
Любые добавки и, тем более, косметические процедуры важно проводить исключительно после консультации с грамотным специалистом. Если начать злоупотреблять этим веществом, то могут возникнуть:
плохое самочувствие, вздутие, изжога;
Коллаген не относится к опасным веществам, однако дополнительная забота о своем здоровье никогда не будет лишней.
Косметологические процедуры

Коллаген синтезируется специальными клетками - фибробластами. После 25 лет волокна становятся очень более ломкими, жесткими, а их разрушение начинает преобладать над синтезом. В коже начинает накапливаться поврежденный коллаген, она становится менее упругой, увлажненной и эластичной. Поэтому морщин становится все больше, а кожа теряет былую упругость и эластичность.
Как говорилось ранее, коллаген имеет крупные молекулы, поэтому наружные средства с трудом могут помочь ему проникнуть внутрь. Поэтому самым эффективным способом “добора” коллагена будут косметологические процедуры.
Сразу после инъекций в коже начинается активная выработка нового коллагена и восстановление поврежденного. Уколы обновляют кожу, корректируют морщины и растяжки. Косметологи рекомендуют прибегать к процедуре в возрасте от 35 до 60 лет. Для поддержания омолаживающего эффекта требуются регулярные сеансы примерно 1 раз в полгода.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для Вашего здоровья!
Коллаген: польза и вред
Об антивозрастной пользе коллагена знают многие. Но на этом его возможности не заканчиваются. Этот белок защищает от сердечно-сосудистых заболеваний, помогает быстрее нарастить мышечную массу, укрепляет кости, повышает эластичность связок. И это далеко не полный список. Когда еще он может быть полезен и способен ли навредить? Давайте разберемся. Услуги Expert Clinics Подтяжка лица мезонитями Подтяжка лица мезонитями LUXEFACE - Подтянутая кожа и красивые черты лица без дорогостоящих пластических операций. Подтяжка лица мезонитями Нитевая подтяжка подбородка Нитевая подтяжка подбородка - Подтяжка подбородка по технологии LUXEFACE – идите по жизни с высоко поднятой головой. Нитевая подтяжка подбородка Нитевая подтяжка шеи Нитевая подтяжка шеи - Уникальная методика LUXEFACE позволит вернуть молодость и красоту вашей шее. Нитевая подтяжка шеи Перезвоните мне Польза коллагена Коллаген является одним из самых незаменимых структурных белков межклеточного матрикса. Вот некоторые его функции: Улучшает здоровье кожи. Коллаген - это настоящий каркас для поддержания молодости кожи, так как обеспечивает её прочность и эластичность. Благодаря ему кожа остается гладкой, подтянутой и увлажненной. Также белок способствует естественному самовосстановлению тканей при повреждениях. Например, ускоряет заживление ран, ожогов, царапин. Повышает эластичность связок. А, кроме того, укрепляет кости и делает суставы более подвижными, а также снижает риск развития остеопороза. Ускоряет рост мышц. Исследования, проведённые в Германии, показали, что коллаген способствует выработке мышечных белков и повышает эффективность тренировок. К слову, мышечная ткань на 10% состоит из коллагена. Защищает хрящевую ткань от разрушения. Снижает риск развития сердечно-сосудистых заболеваний. Белок формирует стенки артерий, и при его дефиците они становятся хрупкими, разрушаясь в дальнейшем. Японские учёные провели эксперимент: на протяжении полугода давали испытуемым 16 граммов коллагена. После окончания опыта было зафиксировано снижение жесткости артериальной стенки. Повышает прочность костей и предотвращает их ломкость. Помогает сохранять целостность внутренних органов. Этот список полезных свойств коллагена базируется на научно доказанных фактах. По наблюдениям врачей, он также позволяет нормализовать работу кишечника, контролировать вес, снижает проявления акне, влияет на улучшение настроения и уменьшение тревоги. Причины снижения коллагенового белка Главной причиной снижения коллагена является старение. Начиная с 25 лет, его уровень медленно, но верно начинает падать. Однако ускорить этот процесс могут и другие факторы. К разрушителям фибриллярного белка относятся: частые стрессовые ситуации; гормональный сбой; злоупотребление продуктов с высоким уровнем сахара; недосып; токсическое действие табака; резкое похудение; загрязненная окружающая среда; аутоиммунные расстройства (при их наличии вырабатываются антитела, повреждающие коллагеновое вещество). Записаться на консультацию Признаки недостатка коллагена Образованию коллагена способствуют такие вещества, как фолиевая кислота, витамин В6, цинк, медь, кремний, сера, пиридоксин, жирорастворимые витамины. При их снижении, а также при увеличении уровня аминокислоты гомоцистеин, выработка белка нарушается, что и приводит к дисфункции органов и систем. Признак недостатка коллагена можно выявить по: снижению упругости и эластичности кожи, появлению морщин; ухудшению здоровья зубов, кариесу, их выпадению; мышечной слабости; снижение остроты зрения; появлению болей в суставах; проблемами с межпозвоночными дисками; плохому росту ногтей и ухудшению их состояния; более яркому проявлению сколиоза. Как повысить уровень коллагена Существует несколько способов восполнить его дефицит. Применение косметических средств с коллагеновым компонентом в составе. Минус этого метода заключается в том, что молекулы коллагена слишком велики, чтобы проникнуть в дерму. К тому же, кремы с качественным коллагеном - дорогое удовольствие. При покупке средства обратите внимание на состав. Хорошо, если в нём присутствуют активные пептиды, например, матриксил, аргирелин. Они помогают средству лучше и глубже проникнуть в дерму, а также более эффективно взаимодействовать с фибробластами. Пищевые добавки. Представлены в качестве спортивного питания и фармакологических средств. Лидирующие позиции занимают морской коллаген и пептиды коллагена. Для лучшего синтеза желательно параллельно принимать витамин С. Однако стоит учитывать, что в готовом виде этот белок очень трудно усваивается из пищеварительного тракта, поэтому на кожу добавки практически не оказывают никакого влияния. Включение в ежедневный рацион продуктов с высоким содержанием этого белка. Им богаты говядина, телятина (в особенности - костный бульон), курица, индейка, мясо кролика. А также креветки, сельдь, тунец, яйца. Косметологические процедуры. Они нацелены на повышение выработки белка в организме и пополнение его искусственным, но быстрым и самым эффективным способом. Противопоказания Любые добавки и, тем более, косметические процедуры важно проводить исключительно после консультации с грамотным специалистом. Если начать злоупотреблять этим веществом, то могут возникнуть: аллергическая реакция; плохое самочувствие, вздутие, изжога; отравление. Коллаген не относится к опасным веществам, однако дополнительная забота о своем здоровье никогда не будет лишней. Косметологические процедуры Коллаген синтезируется специальными клетками - фибробластами. После 25 лет волокна становятся очень более ломкими, жесткими, а их разрушение начинает преобладать над синтезом. В коже начинает накапливаться поврежденный коллаген, она становится менее упругой, увлажненной и эластичной. Поэтому морщин становится все больше, а кожа теряет былую упругость и эластичность. Как говорилось ранее, коллаген имеет крупные молекулы, поэтому наружные средства с трудом могут помочь ему проникнуть внутрь. Поэтому самым эффективным способом “добора” коллагена будут косметологические процедуры. Сразу после инъекций в коже начинается активная выработка нового коллагена и восстановление поврежденного. Уколы обновляют кожу, корректируют морщины и растяжки. Косметологи рекомендуют прибегать к процедуре в возрасте от 35 до 60 лет. Для поддержания омолаживающего эффекта требуются регулярные сеансы примерно 1 раз в полгода. Записаться
Читайте также:

