Какие клетки кожи обладают митотической активностью
Обновлено: 24.04.2024
Митотический режим опухолевых клеток. Митозы раковых клеток.
В морфологической характеристике опухолевых клеток большую роль играют исследования митотического режима. Исчерпывающие сведения о митотическом режиме в нормальных клетках можно найти в фундаментальных работах И. А. Алова, а о митотическом режиме в опухолевых клетках—в работах И. А. Алова и И. А. Казанцевой.
Накопленные факты позволили определить следующие основные направления возможного использования исследования митотического режима в опухолях: 1) ранняя диагностика рака; 2) дифференциальная диагностика доброкачественных и злокачественных опухолей сходного гистогенеза; 3) разработка методов прогнозирования малигнизации предопухолевых процессов, 4) дифференциальная диагностика опухолей разного гистогенеза и уточнение гистогенетнческой принадлежности новообразования (первичного н метастатического), 5) оценка степени терапевтического повреждения опухоли.
Суммируя материалы, полученные И. А. Казанцевой, можно следующим образом охарактеризовать особенности митотического режима при гиперпластических и диспластических процессах и в опухолевых клетках.
Для многих нормальных эпителиальных тканей характерны умеренная митотическая активность, которая, однако, значительно выше в быстро обновляющихся тканях; примерно одинаковое количество клеток в стадии профазы и метафазы с преобладанием иногда первой; невысокая частота патологических митозов.
При фоновых процессах (умеренная дисплазня эпителия гортани и шейки матки, эпидермизация псевдоэрозий шейки матки, простая железисто-кистозная гиперплазия эндометрия и др. ) отмечают некоторое увеличение митотической активности, небольшое преобладание клеток в стадии метафазы, повышение количества патологических митозов, среди которых около 90% составляют колхициноподобные метафазы и отставание хромосом в метафазе.
При гиперпластических и диспластических процессах, которые могут рассматриваться как предраковые (тяжелая дисплазня шейки эпителия матки, атипическая гиперплазия эпителия гортани и др ), а также при некоторых доброкачественных опухолях может наблюдаться дальнейшее нарастание нарушений митотического режима, связанных с преобладанием метафаз, учащением числа патологических митозов и их разнообразие с появлением разновидностей, ведущих к анеуплоидин, расширение зоны, где встречаются делящиеся клетки.
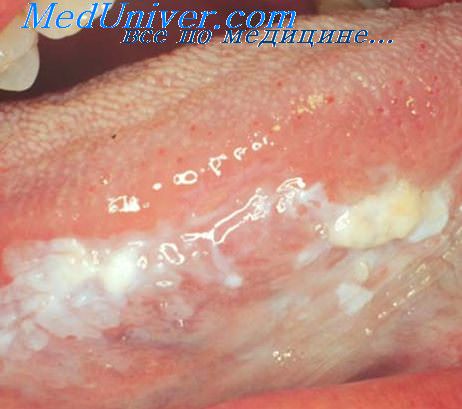
Для клеток злокачественных опухолей характерно преобладание метафаз над другими стадиями митоза, резкое возрастание частоты патологических митозов, различная степень повышения митотической активности, нередко незначительная. Существуют опухоли, в которых митотическая активность ниже, чем в нормальных тканях. Мнение, что во всех опухолях клетки делятся чаше, чем в норме, неверно.
Нет, по-видимому, и прямой связи между митотической активностью и быстротой роста опухоли.
Обнаружение соответствующих нарушений митотического режима может быть дополнительным ранним диагностическим признаком наступившей малигнизации или иметь прогностическое значение при оценке предопухолевых процессов чем резче выражены нарушения митотического режима, тем неблагоприятнее прогноз.
Не исключено, что, возможно, имеют место некоторые различия в характере нарушения митотического режима в опухолях разного гистогенеза.
На основании изучения митотического режима может быть получена полезная информация для оценки степени повреждения опухолевых клеток при лучевом или лекарственном лечении новообразований. Например, снижение митотического индекса и нарастание так называемых комковатых митозов, являющихся разновидностью К-митозов и ведущих клетку к гибели, может служить одним из критериев терапевтического эффекта.
Исследование закономерностей митотического режима в новообразованиях имеет решающее значение для понимания механизмов, определяющих книети ку популяции опухолевых клеток, которая по многим параметрам оказывается весьма гетерогенной. Если рассматривать популяцию опухолевых клеток с точки зрения их деления, то следует отметить, что вышедшие из митотического цикла опухолевые клетки могут или вступить на путь диффереицировки, или вновь вступить в митоз и продолжать пролиферировать, или остаться в покоящемся состоянии. Таким образом, в популяции имеется 3 группы клеток, нахо дящихся во взаимосвязи друг с другом недифференцированные покоящиеся клетки, недифференцированные пролиферирующие клетки и дифференцирующиеся, но уже не пролифернрующие клетки.
Покоящиеся опухолевые клетки, как было показано О. И. Епифановой и соавт., сохраняют жизнеспособность и пролиферативный потенциал, они резистентны к химиотерапевтическим препаратам (цитостатикам, алкилирующим соединениям, антибиотикам), митотическим ингибиторам Сохраняя способность при каких-то условиях вновь вступать в митоз, эти клетки являются источником рецидивов, что делает их изучение крайне важным. Хотя существуют сведения о том, что в покоящихся опухолевых клетках ниже проницаемость плазматической мембраны, более резко конденсирован хроматин, возможно, в ДНК имеются участки, более прочно связанные с белком, повы шено обновление молекул, однако их практическая идентификация в опухоли пока еще невозможна, так как мы не знаем их особенностей нх обмена, ни их морфологических, гистохимических или ультраструктурных особенностей, ко торые позволили бы отличить их от других недифференцированных опухолевых клеток.
В связи с тем что недифференцированные пролиферирующие опухолевые клетки чувствительны к лучевому и химнотерапевтическому лечению, делают попытки перевести покоящиеся клетки в группу пролиферирующих путем гормональных воздействий или иных мероприятий.
Катаплазия на светооптическом уровне касается не только морфологии опухолевых клеток (их фенотипа), но еще в большей степени их морфогенетических потенций, что выражается в нарушении обычной тканевой и органной структуры новообразований. Органная и тканевая катаплазия, являющаяся, так же как инвазивный рост и метастазирование, наиболее характерным морфологическим признаком опухолевого роста, наряду с клеточной катаплазией составляют ту сумму признаков, которые позволяют на светооптическом уровне идентифицировать опухоль во всем многообразии ее строения.
Классические гистологические методы поэтому были и остаются основой морфологической диагностики новообразований человека, однако использование только их не дает возможности решать встающие перед онкологией новые задачи. Расширить методические возможности морфологической верификации новообразований можно с помощью таких современных способов исследования, как электронная микроскопия, гистохимия, иммуногистохимия. Анализ ультраструктурных, гистохимических, иммуногистохимических и биологических особенностей опухолевых клеток главным образом в плане диагностики и установления гистогенеза новообразований человека дан в последующих трех разделах.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Кожа состоит из трех слоев: эпидермиса, дермы (собственно кожи) и гиподермы (подкожной клетчатки).
Эпидермис – самый верхний, наружный слой кожи - состоит из клеток многослойного плоского ороговевающего эпителия, которые по мере дифференцировки продвигаются от базальной мембраны по направлению к поверхности кожи. Эпидермис, в свою очередь, состоит из 5 слоев: базального, шиповатого, зернистого, блестящего и рогового.
Основа эпидермиса – самый нижний, внутренний базальный слой (stratum basale, germinativum), состоит из 1 ряда мелких клеток цилиндрической формы - базальных кератиноцитов. Непосредственно над базальным слоем кератиноциты увеличиваются в размере и формируют шиповатый слой (stratum spinosum), состоящий из 3—6 (до 15) рядов шиповатых кератиноцитов, постепенно уплощающихся к поверхности кожи. Из-за высокой митотической активности (частого деления клеток) базальный и шиповатый слои называют ростковым слоем Мальпиги, за счет него происходят формирование и регенерация эпидермиса.
Зернистый слой (stratum granulosum) состоит из 2—3 рядов клеток, имеющих вблизи шиповатого слоя цилиндрическую или кубическую форму, а ближе к поверхности кожи – ромбовидную.
Блестящий слой (stratum lucidum) выражен в участках наиболее развитого эпидермиса, т. е. на ладонях и подошвах, где состоит из 3—4 рядов вытянутых по форме слабо контурированных клеток.
Роговой слой (stratum corneum) образован полностью ороговевшими безъядерными клетками – корнеоцитами (роговыми пластинками), которые содержат нерастворимый белок - кератин. Наиболее развит роговой слой там, где кожа подвергается наибольшему механическому воздействию (ладони, подошвы).
Кроме вышеперечисленных клеток в эпидермисе также обнаруживаются меланоциты (клетки, вырабатывающие основной пигмент кожи), а также клетки иммунной системы кожи: клетки Лангерганса (эпидермальные макрофаги) и клетки Гринстейна (тканевые макрофаги).
Эпидермис отделен от дермы базальной мембраной, которая является эластической опорой, прочно связывающей эпителий с дермой и препятствующей прорастанию клеток эпидермиса в дерму.

Дерма – соединительнотканная часть кожи – является опорой для придатков кожи (волос, ногтей, потовых и сальных желез), сосудов и нервов. Она состоит из двух слоев: сосочкового и сетчатого.
Тонкий верхний сосочковый слой (stratum papillare) состоит из бесструктурного вещества и тонких соединительнотканных (коллагеновых, эластических и ретикулярных) волокон и образует сосочки, залегающие между эпителиальными гребнями шиповатых клеток. Более толстый сетчатый слой (stratum reticulare) распространяется от основания сосочкового слоя до подкожной жировой клетчатки; основу его составляют пучки толстых коллагеновых волокон, расположенные параллельно поверхности кожи. В дерме располагается поверхностная сосудистая сеть, и две сети лимфатических сосудов - поверхностная и глубокая. В дерме же сосредоточена основная часть нервного аппарата кожи: два нервных сплетения - глубокое и поверхностное и множественные кожные рецепторы (свободные и инкапсулированные: колбы Краузе,тельца Фатера—Пачини, тельца Мейснера, диски Меркеля). В некоторых участках сосочкового слоя дермы располагаются мышечные волокна, связанные с волосяными луковицами - мышцы, поднимающие волос.
Гиподерма – подкожная жировая клетчатка - состоит из сети коллагеновых, эластических и ретикулярных волокон, между которыми располагаются дольки жировой ткани – скопления крупных жировых клеток-липоцитов. Толщина гиподермы варьирует от 2 мм (на черепе) до 10 см и более (на ягодицах). Гиподерма толще на дорсальных и разгибательных, тоньше на вентральных и сгибательных поверхностях конечностей. Местами (на веках, под ногтевыми пластинками, на крайней плоти, малых половых губах и мошонке) она отсутствует. В подкожной жировой клетчатке залегают крупные сосуды и нервные стволы.
Придатки кожи
К придаткам кожи относят волосы, ногти, сальные и потовые железы.
Волосы. В каждом волосе (pilus) различают две части: стержень и корень. Стержень – часть волоса, выступающая над поверхностью кожи. Корень волоса заложен в дерме и иногда доходит до подкожной жировой клетчатки. Корень волоса погружен в дермальное влагалище (соединительнотканную сумку) и формирует вместе с ним волосяной фолликул. Волосяной фолликул имеет цилиндрическую форму и открывается на поверхности кожи своеобразным расширением – воронкой, в которую погружается стержень волоса. На границе верхней и средней трети фолликула в него открывается выводной проток сальной железы. Самая глубокая расширенная часть корня волоса называется волосяной луковицей; нижняя часть луковицы – матрикс – состоит из клеток, отличающихся очень высокой митотической активностью и обеспечивающих рост волоса.
Анатомия и физиология кожи
Кожа – наш самый большой орган, составляющий 15% от общей массы тела. Она выполняет множество функций, прежде всего защищает организм от воздействия внешних факторов физической, химической и биологической природы, от потери воды, участвует в терморегуляции. Последние научные данные подтверждают, что кожа не только обладает собственной иммунной системой, но и сама является периферическим иммунном органом.
Структура кожи
Кожа состоит из 3 слоев: эпидермиса, дермы и подкожной жировой клетчатки (ПЖК) (рис. 1). Эпидермис – самый тонкий из них, представляет собой многослойный ороговевающий эпителий. Дерма – средний слой кожи. Главным образом состоит из фибрилл структурного белка коллагена. ПЖК содержит жировые клетки – адипоциты. Толщина этих слоев может значительно варьировать в зависимости от анатомического места расположения.
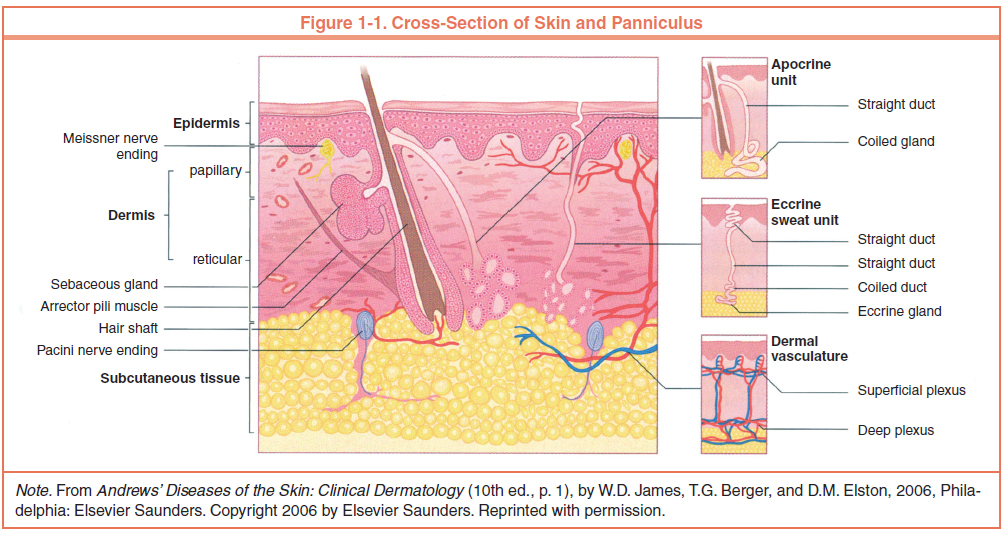
Рис.1. Структура кожи
Эпидермис
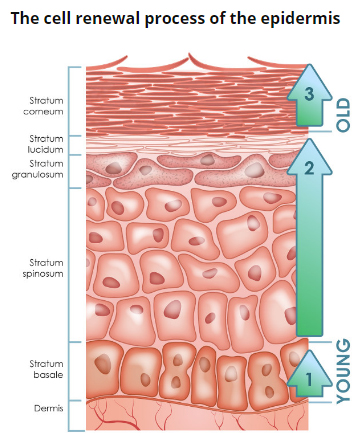
Рис. 2. Эпидермис
Эпидермис – постоянно слущивающийся эпителиальный слой кожи, в котором представлены в основном из 2 типа клеток – кератиноциты и дендритные клетки. В небольшом количестве в эпидермисе присутствуют меланоциты, клетки Лангерганса, клетки Меркеля, внутриэпидермальные Т-лимфоциты. Структурно эпидермис разделяется на 5 слоев: базальный, шиповатый, зернистый, блестящий и роговой , различающиеся положением и степенью дифференцировки кератиноцитов, основной клеточной популяции эпидермиса (рис. 2).
Кератинизация. По мере дифференцировки кератиноцитов и продвижения от базального слоя до рогового происходит их кератинизация (ороговевание) – процесс, начинающийся с фазы синтеза кератина кератиноцитами и заканчивающийся их клеточной деградацией. Кератин служит строительным блоком для промежуточных филаментов. Пучки из этих филаментов, достигая цитоплазматический мембраны, формируют десмосомы, необходимые для образования прочных контактов между соседними клетками. Далее, по мере процесса эпителиальной дифференцировки, клетки эпидермиса вступают в фазу деградации. Ядра и цитоплазматические органеллы разрушаются и исчезают, обмен веществ прекращается, и наступаетапоптозклетки, когда она полностью кератинизируется (превращается в роговую чешуйку).
Базальный слой эпидермиса состоит из одного ряда митотически активных кератиноцитов, которые делятся в среднем каждые 24 часа и дают начало новым клеткам новым клеткам вышележащих эпидермальных слоев. Они активируются только в особых случаях, например при возникновении раны. Далее новая клетка, кератиноцит, выталкивается в шиповатый слой, в котором она проводит до 2 недель, постепенно приближаясь к гранулярному слою. Движение клетки до рогового слоя занимает еще 14 дней. Таким образом, время жизни кератиноцита составляет около 28 дней.
Надо заметить, что не все клетки базального слоя делятся с такой скоростью, как кератиноциты. Эпидермальные стволовые клетки в нормальных условиях образуют долгоживущую популяцию с медленным циклом пролиферации.
Шиповатый слой эпидермиса состоит из 5-10 слоев кератиноцитов, различающихся формой, структурой и внутриклеточным содержимым, что определяется положением клетки. Так, ближе к базальному слою, клетки имеют полиэдрическую форму и круглое ядро, но по мере приближения клеток к гранулярному слою они становятся крупнее, приобретают более плоскую форму, в них появляются ламеллярные гранулы, в избытке содержащие различные гидролитические ферменты. Клетки интенсивно синтезируют кератиновые нити, которые, собираясь в промежуточные филаменты, остаются не связанными со стороны ядра, но участвуют в образовании множественных десмосом со стороны мембраны, формируя связи с соседними клетками. Присутствие большого количества десмосом придает этому слою колючий вид, за что он и получил название «шиповатый».
Зернистый слой эпидермиса составляют еще живые кератиноциты, отличающиеся своей уплощенной формой и большим количеством кератогиалиновых гранул. Последние отвечают за синтез и модификацию белков, участвующих в кератинизации. Гранулярный слой является самым кератогенным слоем эпидермиса. Кроме кератогиалиновых гранул кератиноциты этого слоя содержат в большом количестве лизосомальные гранулы. Их ферменты расщепляют клеточные органеллы в процессе перехода кератиноцита в фазу терминальной дифференцировки и последующего апоптоза. Толщина гранулярного слоя может варьировать, ее величина, пропорциональная толщине вышележащего рогового слоя, максимальна в коже ладоней и подошв стоп.
Блестящий слой эпидермиса (назван так за особый блеск при просмотре препаратов кожи на световом микроскопе) тонкий, состоит из плоских кератиноцитов, в которых полностью разрушены ядра и органеллы. Клетки наполнены элейдином – промежуточной формой кератина. Хорошо развит лишь на некоторых участках тела – на ладонях и подошвах.
Роговой слой эпидермиса представлен корнеоцитами (мертвыми, терминально-дифференцированными кератиноцитами) с высоким содержанием белка. Клетки окружены водонепроницаемым липидным матриксом, компоненты которого содержат соединения, необходимые для отшелушивания рогового слоя (рис. 3). Физические и биохимические свойства клеток в роговом слое различаются в зависимости от положения клетки внутри слоя, направляя процесс отшелушивания наружу. Например, клетки в средних слоях рогового слоя обладают более сильными водосвязывающими свойствами за счет высокой концентрации свободных аминокислот в их цитоплазме.
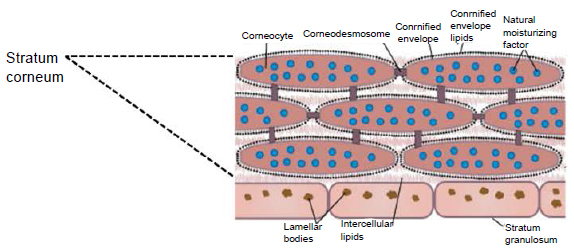
Рис. 3. Схематичное изображение рогового слоя с нижележащим зернистым слоем эпидермиса.
Регуляция пролиферации и дифференцировки кератиноцитов эпидермиса . Являясь непрерывно обновляющейся тканью, эпидермис содержит относительно постоянное число клеток и регулирует все взаимодействия и контакты между ними: адгезию между кератиноцитами, взаимодействие между кератиноцитами и мигрирующими клетками, адгезию с базальной мембраной и подлежащей дермой, процесс терминальной дифференцировки в корнеоциты. Основной механизм регуляции гомеостаза в эпидермисе поддерживается рядом сигнальных молекул – гормонами, факторами роста и цитокинами. Кроме этого, эпидермальный морфогенез и дифференцировка частично регулируются подлежащей дермой, которая играет критическую роль в поддержании постнатальной структуры и функции кожи.
Дерма
Дерма представляет собой сложноорганизованную рыхлую соединительную ткань, состоящую из отдельных волокон, клеток, сети сосудов и нервных окончаний, а также эпидермальных выростов, окружающих волосяные фолликулы и сальные железы. Клеточные элементы дермы представлены фибробластами, макрофагами и тучными клетками. Лимфоциты, лейкоциты и другие клетки способны мигрировать в дерму в ответ на различные стимулы.
Дерма, составляя основной объем кожи, выполняет преимущественно трофическую и опорную функции, обеспечивая коже такие механические свойства, как пластичность, эластичность и прочность, необходимые ей для защиты внутренних органов тела от механических повреждений. Также дерма удерживает воду, участвует в терморегуляции и содержит механорецепторы. И, наконец, ее взаимодействие с эпидермисом поддерживает нормальное функционирование этих слоев кожи.
В дерме нет такого направленного и структурированного процесса клеточной дифференцировки, как в эпидермисе, тем не менее в ней также прослеживается четкая структурная организация элементов в зависимости от глубины их залегания. И клетки, и внеклеточный матрикс дермы также подвергаются постоянному обновлению и ремоделированию.
Внеклеточный матрикс (ВКМ) дермы , или межклеточное вещество, в состав которого входят различные белки (главным образом коллаген, эластин), гликозаминогликаны, самым известным из которых является гиалуроновая кислота, и протеогликаны (фибронектин, ламинин, декорин, версикан, фибриллин). Все эти вещества секретируются фибробластами дермы. ВКМ представляет собой не беспорядочное скопление всех компонентов, а сложноорганизованную сеть, состав и архитектоника которой определяют такие биомеханические свойства кожи, как жесткость, растяжимость и упругость. К белкам ВКМ прикрепляются кератиноциты эпидермиса, которые тесно состыкованы друг с другом. Именно они и формируют плотный защитный слой кожи. Структура ВКМ также способна оказывать регулирующее влияние на погруженные в него клетки. Регуляция может быть как прямой, так и косвенной. В первом случае белки и гликозаминогликаны ВКМ непосредственно взаимодействуют с рецепторами клеток и инициируют в них специфические пути передачи сигнала. Косвенная регуляция осуществляется посредством действия цитокинов и ростовых факторов, удерживаемых в ячейках сети ВКМ и высвобождаемых в определенный момент для взаимодействия с рецепторами клеток. Структурная сеть ВКМ подвергается ремоделированию ферментами из семейства матриксных металлопротеиназ (ММР). В частности, ММР-1 и ММР-13 инициируют деградацию коллагенов I и III типов. Плотность сети ВКМ дермы неравномерна – в папиллярном слое она более рыхлая, в ретикулярном - значительно плотнее как за счет более близкого расположения волокон структурных белков, так и за счет увеличения диаметра этих волокон.
Коллаген – один из главных компонентов ВКМ дермы. Синтезируется фибробластами. Процесс его биосинтеза сложный и многоступенчатый, в результате которого фибробласт секретирует в экстрацеллюлярное пространство проколлаген, состоящий из трех полипептидных α-цепей, свернутых в одну тройную спираль. Затем мономеры проколлагена ферментивным путем собираются в протяженные фибриллярные структуры различного типа. Всего в коже не менее 15 типов коллагена, в дерме больше всего I, III и V типов этого белка: 88, 10 и 2% соответственно. Коллаген IV типа локализуется в зоне базальной мембраны, а коллаген VII типа, секретируемый кератиноцитами, играет роль адаптерного белка для закрепления фибрилл ВКМ на базальной мембране (рис. 4). Волокна структурных коллагенов I, III и V типов служат каркасом, к которому присоединяются другие белки ВКМ, в частности коллагены XII и XIV типов. Считается, что эти минорные коллагены, а также небольшие протеогликаны (декорин, фибромодулин и люмикан) регулируют формирование структурных коллагеновых волокон, их диаметр и плотность образуемой сети. Взаимодействие олигомерных и полимерных комплексов коллагена с другими белками, полисахаридами ВКМ, разнообразными факторами роста и цитокинами приводит к образованию особой сети, обладающей определенной биологической активностью, стабильностью и биофизическими характеристиками, важными для нормального функционирования кожи. В папиллярном слое дермы волокна коллагена располагаются рыхло и более свободно, тогда как ее ретикулярный слой содержит более крупные тяжи коллагеновых волокон.
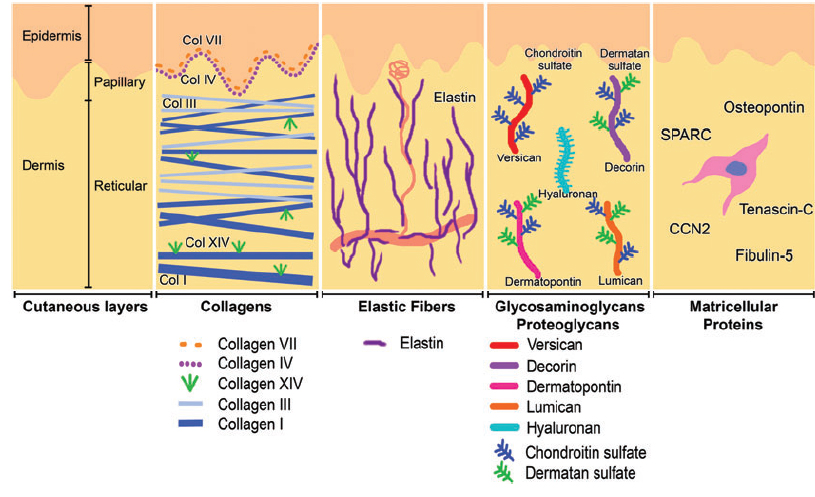
Рис. 4. Схематичное представление слоев кожи и распределения коллагенов разных типов.
Коллаген постоянно обновляется, деградируя под действием протеолитических ферментов коллагеназ и замещаясь вновь синтезированными волокнами. Этот белок составляет 70% сухого веса кожи. Именно коллагеновые волокна «держат удар» при механическом воздействии на нее.
Эластин формирует еще одну сеть волокон в дерме, наделяя кожу такими качествами, как упругость и эластичность. По сравнению с коллагеном эластиновые волокна менее жесткие, они скручиваются вокруг коллагеновых волокон. Именно с эластиновыми волокнами связываются такие белки, как фибулины и фибриллины, с которыми, в свою очередь, связывается латентный TGF-β-связывающий белок (LTBP). Диссоциация этого комплекса приводит к высвобождению и к активации TGF-β, самого мощного из всех факторов роста. Он контролирует экспрессию, отложение и распределение коллагенов и других матриксных белков кожи. Таким образом, интактная сеть из волокон эластина служит депо для TGF-β.
Гиалуроновая кислота (ГК) представляет собой линейный полисахарид, состоящий из повторяющихся димеров D-глюкуроновой кислоты и N-ацетилглюкозамина. Количество димеров в полимере варьирует, что приводит к образованию молекул ГК разного молекулярного веса и длины - 1х10 5 -10 7 Да (2-25 мкм), оказывающих, соответственно, различный биологический эффект.
ГК - высокогидрофильное вещество, влияющее на движение и распределение воды в матриксе дермы. Благодаря этому ее свойству наша кожа в норме и в молодости обладает высоким тургором и сопротивляемостью механическому давлению.
ГК с легкостью образует вторичные водородные связи и внутри одной молекулы, и между соседними молекулами. В первом случае они обеспечивают формирование относительно жестких спиральных структур. Во втором – происходит ассоциация с другими молекулами ГК и неспецифическое взаимодействие с клеточными мембранами, что приводит к образованию сети из полимеров полисахаридов с включенными в нее фибробластами. На длинную молекулу ГК, как на нить, «усаживаются» более короткие молекулы протеогликанов (версикана, люмикана, декорина и др.), формируя агрегаты огромных размеров. Протяженные во всех направлениях, они создают каркас, внося вклад в стабилизацию белковой сети ВКМ и фиксируя фибробласты в определенном окружении матрикса. В совокупности все эти свойства ГК наделяют матрикс определенными химическими характеристиками – вязкостью, плотностью «ячеек» и стабильностью. Однако сеть ВКМ является динамической структурой, зависящей от состояния организма. Например, в условиях воспаления агрегаты ГК с протеогликанами диссоциируют, а образование новых агрегатов между вновь синтезированными молекулами ГК (обновляющимися каждые 3 дня) и протеогликанами блокируется. Это приводит к изменению пространственной структуры матрикса: увеличивается размер его ячеек, меняется распределение всех волокон, структура становится более рыхлой, клетки меняют свою форму и функциональную активность. Все это сказывается на состоянии кожи, приводя к снижению ее тонуса.
Помимо регуляции водного баланса и стабилизации ВКМ, ГК выполняет важную регуляторную роль в поддержании эпидермального и дермального гомеостаза. ГК активно регулирует динамические процессы в эпидермисе, включая пролиферацию и дифференцировку кератиноцитов, окислительный стресс и воспалительный ответ, поддержание эпидермального барьера и заживление раны. В дерме ГК также регулирует активность фибробластов и синтез коллагена. Ремоделируя матрикс, ГК управляет функционированием клеток в матриксе, влияя на их доступность для различных факторов роста и изменяя их функциональную активности. От действия ГК зависит миграция клеток и иммунный ответ в ткани. Таким образом, изменения в распределении, организации, молекулярном весе и метаболизме ГК имеют значимые физиологические последствия.
Фибробласты представляют собой основной тип клеточных элементов дермы. Именно эти клетки отвечают за продукцию ГК, коллагена, эластина, фибронектина и многих других белков межклеточного матрикса, необходимых для формирования соединительной ткани. Фибробласты в различных слоях дермы различаются и морфологически, и функционально. От глубины их залегания в дерме зависит не только количество синтезируемого ими коллагена, но и соотношение типов этого коллагена, например I и III типов, а также синтез коллагеназы: фибробласты более глубоких слоев дермы производят меньшее ее количество. Вообще, фибробласты – очень пластичные клетки, способные менять свои функции и физиологический ответ и даже дифференцироваться в другой тип клеток в зависимости от полученного стимула. В роли последнего могут выступать и сигнальные молекулы, синтезированные соседними клетками, и перестройка окружающего ВКМ.
Подкожно-жировая клетчатка
Подкожно-жировая клетчатка , или гиподерма, - самый нижний слой кожи, располагается под дермой. Состоит из жировых долек, разделенных между собой соединительнотканными септами, содержащими коллаген и пронизанными крупными сосудами. Главными клетками жировых долек являются адипоциты, количество которых варьирует в различных областях тела. В настоящее время ПЖК рассматривают не только как энергетическое депо, но и как эндокринный орган, адипоциты которого участвуют в выработке ряда гормонов (лептина, адипонектина, резистина), цитокинов и медиаторов, оказывающих влияние на метаболизм, чувствительность к инсулину, функциональную активность репродуктивной и иммунной систем.
Факторы определяющие степень злокачественности меланомы.
Количество митозов в дермальном компоненте опухоли, особенно их число на 1 мм2 площади, является важным прогностическим фактором для меланомы. Митотическая активность выше, чем 6 митозов на 1 ммг, измеренная в компоненте вертикальной стадии роста опухоли, является фактором высокой степени риска. Можно использовать прогностический индекс (pi) для меланомы, который вычисляется путем умножения числа митозов, приходящихся на 1 мм2 площади опухоли, на показатель толщины опухоли в миллиметрах. Это более точный показатель прогноза для пациента, чем любая из этих двух переменных в отдельности.
Изъязвление меланомы
Изъязвление эпидермиса над дермальной частью опухоли — важная прогностическая переменная. Фактически в нескольких исследованиях она была представлена как независимый фактор прогноза. Но не все исследователи согласны с этим выводом. Изъязвление появляется в опухолях с достаточной глубиной инвазии для появления метастазов, но в проведенных исследованиях этот факт не учитывался. Однако в тех случаях, когда изучались опухоли, согласованные по толщине, сокращение периода выживания у пациентов с изъязвленными опухолями снизилось с 80 до 55%, при этом прогностическое значение имели изъязвления диаметром более 3 мм.
Лимфоидная инфильтрация меланомы
В меланомах ответная реакция организма на неопластический процесс представлена, в основном, лимфоцитами. Опухоли с выраженным лимфоцитарной инфильтрацией имеют лучший прогноз. W.H. С1аrk с соавт. ввели термин TTLs («лимфоциты, инфильтрирующие опухоль»), чтобы учеств наличие лимфоцитов, фактически проникающих между клетками опухоли, что особенно важно для вертикальной стадии роста опухоли. В своих исследованиях они не относили к TILs лимфоциты, инфильтрирующие строму опухоли, и лимфоциты, связанные с радиальной стадией роста меланомы. Посредством многофакторного анализа эти ученые установили, что TILs является вторым наиболее важным прогностическим фактором для стадии I и II, а опухоль с оживленным TILs-ответом имеет более благоприятный исход. Отсутствие иммунного ответа в опухолях толщиной 3,65 мм и более служит отрицательным прогностическим фактором в отношении выживания больных и положительным в отношении вероятности развития костных и висцеральных метастазов.
Регрессия меланомы
Один из уникальных аспектов меланомы — способность опухоли к спонтанной регрессии. Регрессия может быть частичной или полной.
Сложившиеся противоречия вокруг понятия «спонтанной регрессии» в меланоме как прогностического фактора являются результатом использования различных определений самой «регрессии». Регрессия может проис-ходитв как в радиальной, так и в вертикальной стадии роста. Однако именно регрессия при радиальной стадии роста исторически была изучена как потенциальный прогностический признак меланомы. Эта регрессия была определена как отсутствие элементов опухоли в эпидермисе. Участок регрессии характеризовался фиброзом сосочкового слоя дермы, повышенной васкуляризацией и смешанной инфильтрацией лимфоцитами и меланофагами. Регрессия описывалась как «ак-ивная», когда присутствовали TILs, и как «прошлая», когда все клетки опухоли исчезали. Полное исчезновение клеток опухоли можно определить и как «истинную» регрессию. Несколько групп исследователей наблюдали неблагоприятные результаты у пациентов с частичной регрессией опухоли, в то время как другие не отмечали подобных результатов. W.H. Clark и соавт. предположили, что регрессия при радиальной стадии роста опухоли является важным независимым фактором прогноза выживания, но только у пациентов с наличием компонента вертикальной стадии роста. Невозможно предсказать прогноз у пациентов, если опухоль полностью регрессировала, или у пациентов, имевших только радиальную стадию роста опухоли, потому что статистически последние имеют выживание в 100% случаев, независимо от присутствия регрессии или любого другого прогностического фактора.

Гистологический подтип меланомы
Исторически сложилось, что подтип меланомы (злокачественное лентиго, поверхностно распространяющаяся или узловая меланома и т.д.) рассматривается как важный прогностический фактор, однако он не является независимым фактором прогноза. Так, неблагоприятный прогноз при узловой меланоме связан с толщиной опухоли, а не с гистологическим подтипом. Узловая меланома — по определению, опухоль в вертикальной стадии роста, в среднем ее толщина больше, чем при других гистологических подтипах, которые классифицируются на основании присутствия компонента радиальной стадии роста. Меланома типа злокачественного лентиго — единственная форма, имеющая лучший прогноз, чем другие подтипы.
Неточный состав компонента вертикальной стадии роста меланомы
Все меланомы имеют области, содержащие эпителиоидные и веретенообразные клетки, хотя в большинстве случаев отдельный клеточный тип преобладает. Меланомы, состоящие из веретенообразных клеток, имеют лучший прогноз, но при анализе клеточный состав редко рассматривается как независимый фактор прогноза. Плоидностъ
Проточная цитометрия для определения плоидности клеток применялась и при изучении меланом. В результате установлено, что анеуплоидность постоянно коррелирует с толщиной, уровнем инвазии и изъязвлением и является независимым фактором риска развития рецидива для опухолей толщиной более 1,5 мм и менее 3,0 мм. Анеуплоидность клеток также связана и с короткой ремиссией. Komino с соавт. выявили, что анеуплоидность может обнаруживаться в маленьких меланомах (и менее 6 мм) и уже на этой стадии связана с высоким риском рецидивирования и метастазирования.
Маркеры пролиферации меланомы
Митотическая активность в меланомах связана с рецидивами и выживанием. Иммуногистохимическое выявление высокого показателя пролиферации Ki-67 (MIBl) в меланомах коррелирует с толшиной опухоли. Толшина опухоли и максимальная числовая плотность Ki-67-положительных ядер является независимым фактором прогноза, более существенным по своему значению, чем толщина опухоли или число митозов по отдельности. Рецепторы эстрогена
Поскольку существуют явные различия в анатомическом местоположении и биологическом поведении меланом у мужчин и женщин, была исследована роль эстрогена и его рецепторов в меланомах. Меланомы имеют способность закрепления гормона стероида, однако не все исследования до настоящего времени сумели подтвердить наличие белка эстроген-рецептора в меланомах, даже в течение беременности. Тем не менее Walker с соавт. выявили наличие белка рецептора в 37-50% меланом как у мужчин, гак и у женщин и определили его как фактор прогноза, наряду с толшиной опухоли и уровнем инвазии. Присутствие и роль эстроген-рецепторов в меланомах требуют дальнейшего изучения.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Содержание темы
1. Кроме кожи, человек име е т следующие её производные. -
| Ж е л е з ы : | Придатки кожи : |
| п отовые , м олочные (по происхождению это видоизменённые потовые железы) , с альные. | в олосы , н огти . |
2. а) Молочные железы будут рассмотрены вместе с женской половой системой.
б) Остальные перечисленные структуры и сама кожа - содержание этой темы.
27.1.1. Исходные сведения
27.1.1.1. Компоненты кожи
2 . Поэтому вам уже известно, что в коже имеются два основных компонента:
многослойный плоский ороговевающий эпителий, называемый эпидермисом , и
соединительнотканная основа, или дерма.
5. Роговой слой (5)
4. Блестящий слой (4)
3. Зернистый слой (3)
2. Шиповатый слой (2)
1. Базальный слой (1)
1. Сосочковый слой (6) – рыхлая неоформленная соединительная ткань.
2. Сетчатый слой (7) - плотная неоформленная соединительная ткань.
4 . Под дермой обычно располагается подкожная жировая клетчатка , или гиподерма.
27.1.1.2. Типы кожи
I. Основные различия
По толщине эпидермиса различают два типа кожи. –
II. Препарат тонкой кожи
а) Препарат, приведённый выше (в п. 27.1.1.1), относился к "толстой" коже.
базальный (1),
шиповатый (2),
зернистый (3) и
очень тонкий роговой (4).
27.1.2. Эпидермис: клеточный состав
27.1.2.1. Типы клеток
кератиноциты (I),
меланоциты (II),
внутриэпителиальные макрофаги (клетки Лангерганса) (III.А) и
Т-лимфоциты (III.Б),осязательные клетки Меркеля (IV).
2. Из них только кератиноциты располагаются во всех слоях эпидермиса - базальном (1), шиповатом (2), зернистом (3), блестящем (4) и роговом (5).
27.1.2.2. Кератиноциты
Кератиноциты - основной тип клеток ( 85 %) эпидермиса.
I. Обновление состава
б) В процессе дифференцировки происходит образование роговых чешуек (5) : последние
лишены в сех органелл,
но заполнены кератиновыми филаментами.
3. а) П ри этом постоянно происходит
не только слущивание роговых чешуек,
но и вступление в дифференцировку новых стволовых клеток .
б) Поэтому состав кератиноцитов всё время обновляется .
II. Функции кератиноцитов
привлекают в эпидермис Т-лимфоциты и
вызывают их антигеннезависимую пролиферацию .
27.1.2.3. Меланоциты
б) Они располагаются в базальном слое эпидермиса (составляя не менее 10% клеток этого слоя).
б) Они с одержат меланосомы - мембранные органеллы, где синтезируется (из аминокислоты тирозина) и накапливается в виде плотных гранул пигмент меланин .
не количество меланоцитов в эпидермисе,
а количество и размер меланосом в клетках.
б) Некоторое количество меланосом может из меланоцитов эпидермиса переходить в состав других клеток (не способных к синтезу меланина) -
кератиноцитов и макрофагов эпидермиса ,
а также меланоцитов дермы .
в) Меланин, поглощая УФ-лучи , защищает подлежащие ткани.
27.1.2.4. Внутриэпителиальные макрофаги
(клетки Лангерганса)
Напомним, что данные клетки находятся также в эпителии воздухоносных путей (пп. 26.2.1.2 и 26.2.3.2).
б) Располагаются в базальном и шиповатом слоях эпидермиса.
в) Подобно меланоцитам,
не образуют десмосомных контактов и
б) Видимо, существуют эпидермальные пролиферативные единицы:
каждая из них содержит
определённое число кератиноцитов разной степени зрелости и
организующий их в единое целое макрофаг .
представляют корпускулярные антигены привлечённым сюда Т-лимфоцитам,
а также выделяют лизоцим и интерферон.
27.1.2.5. Осязательные клетки Меркеля
( а) Ещё один вид этих рецепторов нам уже знаком - осязательные тельца Мейснера в сосочковом слое дермы; п. 13.2.3.1.
в базальном слое эпидермиса (их много в кончиках пальцев) и
Схема - клетка Меркеля.
б) С этими клетками контактируют окончания дендритов (1) чувствительных нейронов.
б) Последние выделяются после раздражения клеток и влияют на
регенерацию эпителия и
тонус кровеносных сосудов.
27.1.3. Процесс кератинизации
27.1.3.1. Введение
I. Кератиноциты на препарате
2. Именно благодаря этой дифференцировке и образуются те пять слоёв, которые выделяют в эпидермисе:
базальный (1),
шиповатый (2),
зернистый (3),
блестящий (4) и
роговой (5).

II. Кератиноциты на схеме
2. Обозначения на схеме таковы:
I - баз альн ый ,
II - шиповат ый ,
III - зернистый,
IV - рогово й ;
б) вне- и межклеточные структуры -
1 - базальная мембрана,
2 - полудесмосомы,
3 - десмосомы;
в) специфические внутриклеточные структуры:
4 - кератиновые тонофибриллы,
5 - лизосомы и кератиносомы,
6 - "кератогиалиновые" гранулы,
7 - кератин в роговых чешуйках ;г) обычная внутриклеточная структура:
8 - ядра клеток.
27.1.3.2. Базальные клетки
стволовые клетки, находящиеся в G о -периоде,
переходные клетки, которые 2-4 раза делятся,
переходные клетки, утратившие способность к делению и вступившие в созревание.
б ) Цитоплазма - базофильная из-за наличия в ней рибосом.
б) Кератин образует промежуточные филаменты, или тонофибриллы.
в) Но последних пока мало ; они объединены в пучки и вплетаются в
полудесмосомы (2) - контакты с базальной мембраной (1) и
десмосомы (контакты с соседними клетками).
27.1.3.3. Шиповатые клетки
I. Основные сведения
от 3-4 ("тонкая" кожа)
до 10 и более ("толстая" кожа).
2. а) У них - короткие отростки ("шипики"),
между которыми образуются десмосомы (3) .
б) А. В них начинается синтез липидов (церамидов, холестеринсульфата) .
II. Дополнение: две микрофотографии
1. а) Межклеточное пространство практически отсутствует (что характерно для всех видов эпителиальных тканей; п. 7.1.2.2).
б) А клетки, действительно, образуют друг с другом множество
2. а) От этих контактов в цитоплазму отходят
3. Ядра клеток - крупные, округлой или овальной формы.
4. В цитоплазме видны многочисленные электроноплотные гранулы:
некоторые из них идентифицированы как митохондрии (2) ;
другие, видимо, представляют собой кератиносомы .
так что на снимке - лишь граничные участки двух кератиноцитов.
2. а) Достаточно хорошо видна структура десмосомных контактов (3) между этими клетками.
б) Она вполне соответствует классическому описанию (п. 2.2.3.1):
- в области десмосомы плазмолеммы утолщены с внутренней стороны (за счёт белков десмоплакинов),
поперечные фибриллоподобные структуры
и срединная перегородка .
3. а) Некоторые тонофибриллы вновь расположены параллельно поверхности ядра (1).
б) В цитоплазме видны также митохондрии (5) и рибосомы (6) .
27.1.3.4. Зернистые клетки
б) Они содержат белок филагрин;
причём, последние уже начинают поступать в межклеточное пространство в виде ламеллярных (мембраноподобных) структур.
ещё сохраняющимися десмосомами и
уже выделившимися в межклеточное вещество липидами.
27.1.3.5. Клетки блестящего слоя
б) При этом они лишаются ядер и почти всех прочих органелл (митохондрий, аппарата Гольджи, рибосом и др.) - под действием ферментов лизосом.
с поверхности - толстая оболочка (плазмолемма и под ней - мощный слой кератолинина ),
б) В коже ладоней и подошв толщина межклеточных "прослоек", видимо, особенно велика ; поэтому
границы клеток становятся неразличимыми
и весь слой воспринимается как блестящая полоса.
27.1.3.6. Роговые чешуйки (зрелые корнеоциты)
б) Это позволяет им более тесно прилегать друг к другу и укладываться в виде столбиков:
по 3-4 (в "тонкой" коже) или
15-20 (в "толстой" коже) рядов.
в составе кератолинина и
в кератиновых тонофиламентах (7) .
(В частности, кератин становится нерастворимым).
имею т толстую (роговую) оболочку из кератолинина и
содержа т роговое вещество из т .н. мягкого кератина.
б) Внутри их также часто находятся пузырьки воздуха.
б) Поэтому адгезия (связь) между роговыми чешуйками ослабевает и происходит их слущивание (десквамация ).
27.1.3.7. Резюме
На основании приведённых сведений можно составить следующую таблицу.
в) Кератиносомы - синтезируют липиды и выделяют их вне клеток.
б) Продольно расположенные пучки тонофибрилл в матриксе из филагрина.
б) Уплотнённые (за счёт поперечных связей) пучки тонофибрилл - мягкий кератин (без филагрина).
27.1.3.8. Базальная мембрана эпидермиса
В базальной мембране эпидермиса - 2 слоя.
27.1.4.1. Препарат
27.1.4.2. Характеристика слоёв дермы
Краткая характеристика двух слоёв дермы приводится в таблице.
одни связаны с волосом и поднимают его;
27.1.5. Кровоснабжение и иннервация кожи
27.1.5.1. Кровоснабжение
27.1.5.2. Иннервация кожи
гладкие миоциты в сосудах,
внесосудистые гладкие миоциты,
потовые железы.
2. а) Кроме того, в коже - много чувствительных нервных окончаний.
б) Их виды и локализация показаны на схеме.
II. Осязательные тельца Мейснера на препарате: специальная окраска
2. Мы видим обычные компоненты кожи:
эпидермис (1) и
сосочковый слой дермы (2).
конечные ветвления дендрита ,
окружающие их видоизменённые глиальные клетки (которые, возможно, принимают участие в рецепции),
тонкую (в данных тельцах) соединительнотканную капсулу.
III. Осязательные тельца Мейснера на препарате: обычная окраска
1. А этот снимок показывает, что осязательное тельце (3) можно обнаружить (хотя с б о льшим трудом) и при обычной окраске.
Читайте также:

