Какие клетки эпидермиса развиваются из моноцитов крови
Обновлено: 28.04.2024
Фагоцитирующие клетки. Фагоциты. Полиморфно-ядерные лейкоциты ( гранулоциты ). Нейтрофилы. Феномен краевого стояния. Нейтрофилия. Эозинофилия.
Фагоциты выполняют не только защитные (поглощают и разрушают чужеродные агенты), но и дренажные функции (удаляют погибшие и деградировавшие структуры организма). Фагоциты представлены клетками миелопоэтического ряда (полиморфно-ядерные лейкоциты) и макрофагально-моноцитарной системы (моноциты, тканевые макрофаги). Основные свойства фагоцитирующих клеток представлены в табл. 10-5.
Полиморфно-ядерные лейкоциты имеют дольчатое ядро и множество мелких цитоплаз-матических гранул (поэтому их также называют гранулоциты). По окрашиванию гранул выделяют три типа клеток: нейтрофилы, эозинофилы и базофилы.
Таблица 10-5. Характеристики фагоцитирующих клеток
| Клетки | Источник | Формы участия в защитных реакциях |
| Нейтрофилы | Костный мозг; после дифференцировки выходят в кровоток | Адгезия к эндотелию и выход за пределы кровотока; хемотаксис; поглощение; дегрануляция; секреция О 2 -зависимых и О 2 -независимых микробицидных факторов |
| Эозинофилы | Тот же | Секреция О2-зависимых и 02-независимых микробицидных факторов, направленных против паразитов (простейшие и гельминты) |
| Моноциты | Костный мозг; после дифференцировки промоноциты выходят в кровоток | Адгезия к эндотелию и выход за пределы кровотока; хемотаксис; поглощение; дегрануляция; секреция О2-зависимых и О2-независимых микробицидных факторов (включая цитокины) |
| Макрофаги (клетки фон Купффера, альвеолярные макрофаги, гистиоциты, перитонеальные макрофаги, клетки мик-роглии, макрофаги селезёнки и др.) | Моноциты периферической крови | Адгезия к эндотелию и выход за пределы кровотока; хемотаксис; поглощение; дегрануля-ция; секреция О2-зависимых и О2-независимых микробицидных факторов; синтез компонентов комплемента, активатора ппазминогена и других протеаз; секреция медиаторов и компонентов клеточных мембран, включая продукты I и II классов МНС; участие в иммунных реакциях |
Нейтрофилы. Феномен краевого стояния. Нейтрофилия. Эозинофилия
Нейтрофилы — основные эффекторные клетки острого воспаления; у взрослых лиц они составляют самую многочисленную популяцию лейкоцитов. Основная часть нейтрофилов циркулирует в крови в течение 6-7 ч. Затем они скапливаются в капиллярах, где формируют краевой пул, прикрепляясь к эндотелию (по периметру кровотока); в таком состоянии нейтрофилы находятся в готовности немедленно покинуть кровеносное русло (феномен краевого стояния). Нейтрофилия (увеличение их количества в периферической крови) часто указывает на наличие воспалительной реакции.
Потенциал эозинофилов направлен не столько на фагоцитирование бактерий, сколько на нейтрализацию паразитов, особенно гельминтов (например, нематод). Поэтому, эозинофилия — признак, указывающий на возможную глистную инвазию. Кроме того, эозинофилы участвуют в разрушении гистамина, выделяя гистаминазу. Именно поэтому эозинофилию также наблюдают при аллергических заболеваниях. Определённая роль в подобной специализации эозинофилов принадлежит специфическим гранулам, содержащим пероксидазы и катионные белки (например, основный белок, катионные белки эозинофилов), активные именно в отношении паразитов. В активации эозинофилов важную роль играют IgE, образующиеся в ответ на сенсибилизацию организма аллергенами (в том числе микробными).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
1 ГБОУ ВПО «Саратовский государственный медицинский университет им. В.И. Разумовского Минздрава России»

1. Аллергология и иммунология, клинические рекомендации для педиатров / Под ред. А.А. Баранова и Р.М. Хаитова. – М.: М-Студио. – 248 с.
2. Гематология / Рукавицын О.А., Павлов А.Д., Морщакова Е.Ф. и др. Под ред. О.А. Рукавицына. – Изд–во СПб.: ООО «Д.П.», 2007. – 912 с.
3. Гематологический атлас. С. Луговская, М.Е. Почтар. 3-е издание. – Москва – Тверь. ООО «Изд-во Триада», 2011. – 368 с.
4. Драпник Г.Н. Клиническая иммунология и аллергология. – М. ООО «Медицинское информационное агентство», – 2003. – 604 с.
5. Зайчик А.Ш. Механизмы развития болезней и синдромов // А.Ш. Зайчик, Л.П. Чурилов. – СПб.: ЭЛБИ, 2002. – Т. 3. – 507 с.
6. Нормальная физиология: учебник [Н.А. Агаджанян, Н.А. Барабаш, А.Ф. Белов и др.] / Под ред. проф. В.М. Смирнова. – 3-е изд. – М.: Издательский центр «Академия», 2010. – 480 с.
8. Типовые реакции иммунной системы на действие антигенов–аллергенов / Под общей ред. проф. Чесноковой Н.П. – Изд–во Саратов. мед. ун-та. Саратов, 2014. – 154 с.
9. Физиология человека / В.Ф. Киричук, О.Н. Антипова, Н.Е. Бабиченко, В.М. Головченко, Е.В. Понукалина, И.В. Смышляева, Л.К. Токаева / Под ред В.Ф. Киричука. – 2-е изд. – Изд-во Саратовского медицинского университета. – 2009. – 343 с.
12. Abbas A.K. Diseases of immunity / Robbins and Cotran pathologic basis of disease. – 7th ed. / Editet by V. Kumar, A.K. Abbas, N. Fausto. – Philadelphia, Pennsylvania. Elserier, 2005. – P. 193–267.
Антигенперерабатывающие и антигенпрезентирующие клетки
Мононуклеарная система фагоцитов включает в себя промоноциты костного мозга и их предшественников, моноциты крови и тканевые макрофаги.
Дифференцировка моноцитов из монобластов происходит в костном мозге в течение 5 дней, после чего они сразу выходят в кровоток, не формируя, в отличие от гранулоцитов, костномозговой резерв. Небольшая часть моноцитов трансформируется в макрофаги костного мозга.
В крови человека имеются маргинальный пул моноцитов, примыкающий к сосудистой стенке, и циркулирующий пул.
Непринимающий участие в циркуляции маргинальный пул в 3,5 раза больше, чем пул циркулирующих моноцитов.
В периферической крови моноциты составляют от 1 до 10 % всех лейкоцитов, что соответствует абсолютному количеству, равному 80–600 клеткам в 1 мм3 у взрослых. Моноциты циркулируют в крови от 1,5 до 4,5 суток, а затем покидают ее и эмигрируют в ткани.
Тканевой пул моноцитов в 25 раз превышает внутрисосудистый пул. В тканях происходит трансформация моноцитов в тканевые макрофаги. Сроки жизни тканевых макрофагов составляют 60 дней и более. Наибольшее количество макрофагов содержится в печени (56,4 %) , в легких (14,9 %) , селезенке (15 %) , перитонеальной полости (7,6 %). Тканевым макрофагам отводится ведущая роль в переработке антигена, образовании высокоиммуногенных фракций антигена, индукции иммунного ответа.
Антигенперерабатывающие клетки, или профессиональные фагоциты (А–клетки), включают в себя фиксированные макрофаги печени, костного мозга, селезенки, лимфатических узлов, центральной нервной системы, а также остеокласты, альвеолярные и перитонеальные макрофаги, макрофаги плевральной и перикардиальной областей, эпителиоидные и гигантские многоядерные клетки очагов воспаления.
Основными функциями антигенперерабатывающих клеток являются фагоцитоз и уничтожение различных объектов, к числу которых относятся микроорганизмы, иммунные комплексы, опухолевые клетки, вирусинфицированные клетки, а также поврежденные, дегенерирующие в процессе апоптоза клетки.
Фагоцитоз, обеспечиваемый антигенперерабатывающими клетками, осуществляется в виде классических стадий: приближения фагоцита к фагоцитируемому объекту, аттракции, поглощения объекта фагоцитом, умерщвления (киллинга) жизнеспособных объектов, переваривания нежизнеспособных объектов.
Процессы киллинга во всех антигенперерабатывающих клетках обеспечиваются при участии кислородзависимых и кислороднезависимых бактерицидных систем. Кислородзависимые системы обеспечиваются миелопероксидазой, продуктами дыхательного взрыва, возникающего при активации фагоцитов: Н2О2, супероксидным анион-радикалом, гидроксильным радикалом, синглетным кислородом, галогенами.
Кислороднезависимые системы включают лизоцим, лактоферрин, щелочную фосфатазу, катионные белки, кислую среду фагосом.
При утрате жизнеспособности патогенных агентов антигенперерабатывающие клетки обеспечивают их переваривание за счет выделения в фагосому содержимого лизосом. В процессе слияния фагосомы и лизосомы формируется фаголизосома, где проявляют разрушающее действие различные гидролитические ферменты: протеазы, амилазы, липазы, фосфолипазы, эластазы, коллагеназы, ДНК-азы, РНК-азы, глюкозидазы и др.
Общими свойствами профессиональных фагоцитов, или антигенперерабатывающих и представляющих клеток, являются секреция биологически активных соединений на фоне антигенной стимуляции, а также представление антигенов лимфоцитам.
К профессиональным антигенпредставляющим клеткам, помимо моноцитов и А–клеток, относят клетки Лангерганса, дентритные клетки – ДК, интердигитирующие клетки тимуса, фолликулярные дендритные клетки зародышевых центров лимфатических узлов, которые несут конституциональные антигены MHC.
Касаясь локализации антигенпредставляющих клеток, следует отметить, что клетки Лангерганса локализованы в супрабазальном слое эпидермиса, составляя до 2 % всех эпидермальных клеток, а также в эпителии слизистой полости рта, пищевода, легких, влагалища, шейки матки, конъюнктивы. В небольшом количестве клетки Лангерганса выявляются в тимусе, лимфатических узлах, селезенке.
Клетки Лангерганса являются основными клетками, регулирующими интенсивность иммунного ответа в коже. Они относятся к линии дендритных клеток в связи с их способностью образовывать длинные цитоплазматические отростки, посредством которых происходит контакт с другими клетками.
Другой разновидностью антигенпредставляющих клеток являются фолликулярные дендритные клетки, локализующиеся в зародышевых центрах и первичных лимфоидных фолликулах лимфоузлов, а также селезенке.
Интердигитирующие клетки, а также клетки Лангерганса располагаются в паракортикальных зонах лимфоузлов и соответствующих Т-зависимых зонах селезенки, миндалин, мозговом веществе тимуса. В небольшом количестве они содержатся практически во всех органах и тканях.
ДК вторичных лимфоидных органов представлены несколькими субпопуляциями, отличающимися по степени экспрессии СД18. Различают незрелые ДК, а также зрелые ДК: ДК1 и ДК2, несущие различные хемокины и обеспечивающие, соответственно, дифференцировку Th0 в Th1 и Th2. Костномозговые ДК способны вызвать как Th1, так и Th2.ответы.
К числу непрофессиональных антигенпредставляющих клеток могут быть отнесены также В-лимфоциты, эндотелий сосудов, а также полиморфноядерные лейкоциты, кератиноциты, эозинофилы, тучные клетки, которые несут только индуцированные молекулы MHC.
Самыми эффективными антигенпредставляющими клетками являются дендритные клетки, способные представить антиген в первичном иммунном ответе. Источником происхождения дендритных клеток являются стволовая кроветворная клетка и, возможно, общий для Т- и В-лимфоцитов предшественник. Дендритные клетки обеспечивают индукцию иммунного ответа на экзогенные и эндогенные антигены.
Дендритные клетки первыми связывают антигенные вещества, проникая через барьер кожи, возможно, и слизистых; прочно фиксируют антиген на своей поверхности; обеспечивают неглубокий эндоцитоз и частичное ферментативное расщепление антигена.
Сконцентрировав антиген на клеточной мембране, дендритные клетки поступают в циркуляцию, затем распространяются в лимфатические узлы для представления и распознавания антигена лимфоцитами.
За короткий промежуток времени эмиграции дендритных клеток в лимфоидные органы на их мембране в высокой концентрации экспрессируются молекулы МНС-II или МНС-I.
Профессиональный фагоцит- макрофаг способен эффективно присоединять комплекс антиген-антитело за счет наличия специализированных рецепторов к Fс-фрагменту иммуноглобулинов. Фрагменты расщепления антигена из поглощенного комплекса макрофаг экспонирует на клеточной мембране в комплексе с молекулами МНС –IМНС-II, т.е. как и классические дендритные антигенпредставляющие клетки.
Следует отметить, что Т-лимфоциты способны лишь к «двойному» распознаванию пептидных антигенов только при условии их укомплектованности на поверхности клеточной мембраны антигенпредставляющих клеток с собственными молекулами клеточной мембраны, называемыми молекулами главного комплекса гистосовместимости (МНС I или II класса). За это открытие ученые P. Doherty и R. Zinkernagel, 1996 г., были удостоены Нобелевской премии по физиологии и медицине.
В-лимфоциты в роли антигенпредставляющих клеток способны уловить иммуноглобулиновым рецептором мембраны низкие дозы растворимых антигенов, особенно при повторной антигенной стимуляции.
Эндотелиальные клетки могут выполнять антигенпредставляющую функцию в зоне инфекционного воспаления, т.е. в месте проникновения антигена-аллергена.
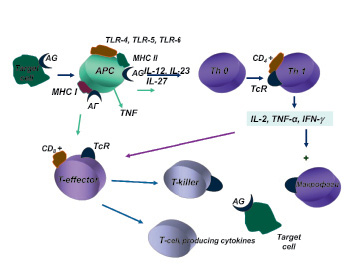
Схема участия моноцитарно-макрофагальной системы крови и тканей в механизмах индукции иммунного ответа на корпускулярные антигены-аллергены
Основными антигенпредставляющими клетками являются дендритные клетки Лангерганса, фолликулярные дендритные клетки зародышевых центров лимфатических узлов, интердигитирующие клетки тимуса.
Касаясь значимости клеток мононуклеарной фагоцитирующей системы в развитии межклеточного взаимодействия на фоне антигенной стимуляции, необходимо отметить не только их фагоцитарную и антигенпредставляющую функции, но и способность к продукции комплекса биологически активных соединений – монокинов.
Монокины – гетерогенная группа соединений с различной биологической активностью. К числу монокинов относятся следующие группы веществ:
Медиаторы воспаления и иммуномодуляции (интерлейкин 1, фактор некроза опухоли, интерферон, лизоцим, фактор активации нейтрофилов, компоненты системы комплемента С1, С2, С3, С5, а также интерлейкины – 3, 6, 8, 10, 12, 15).
Факторы свертывающей системы крови, активаторы и ингибиторы фибринолиза (активатор плазминогена, ингибиторы плазминогена и плазмина, V, VII, IX, Х плазменные факторы свертываемости крови).
Факторы роста, в частности, различные колониестимулирующие факторы, активизирующие гемопоэз в костном мозге, фактор роста фибробластов.
Моноциты и тканевые макрофаги являются ведущими клетками иммунного ответа организма, обеспечивая переработку антигенов и их презентацию (особенно при вторичном иммунном ответе) Т-хелперам. Подобная презентация необходима для запуска иммунного ответа на многие Т-зависимые антигены.
Связь между Т-хелперами и макрофагами обеспечивается при участии адгезивных молекул, синтез которых, в свою очередь, зависит от интенсивности продукции макрофагами ИЛ-I,ИЛ-6,ФНО (рисунок).
Резюмируя вышеизложенное, следует заключить, что моноциты периферической крови, трансформируясь в тканевые макрофаги по мере эмиграции за пределы сосудистого русла, обеспечивают многогранные функции, включающие не только фагоцитоз и элиминацию клеток, несущих генетически чужеродную информацию, но и индукцию иммунного ответа со стороны Т- и В-систем лимфоцитов, а также развитие синдрома системного воспалительного ответа за счет активации синтеза цитокинов с полимодальным локальным и системным действием.
Мононуклеары: моноциты и макрофаги
Мононуклеарным фагоцитам (моноцитам и макрофагам) принадлежит важнейшая роль в иммунных реакциях, защите организма от инфекций, а также восстановлении и перестройке тканей. Не бывает человека, у которого отсутствовала бы эта линия клеток, поскольку макрофаги, по-видимому, необходимы для удаления примитивных тканей по мере их замещения новыми в процессе эмбрионального развития.
Моноциты и различные формы тканевых макрофагов составляют систему мононуклеарных фагоцитов. Это именно система, так как все мононуклеары имеют общее происхождение, сходное строение и одинаковые функции (фагоцитоз).
Основная локализация макрофагов в тканях:
• Печень (купферовские клетки).
• Легкие (интерстициальные и альвеолярные макрофаги).
• Соединительная ткань.
• Серозные полости (плевральные и перитонеальные макрофаги).
• Кости (остеокласты).
• Головной мозг (реактивные клетки микроглии).
• Селезенка, лимфатические узлы, костный мозг.
• Стенка кишечника.
• Грудное молоко.
• Плацента.
• Гранулемы (многоядерные гигантские клетки).
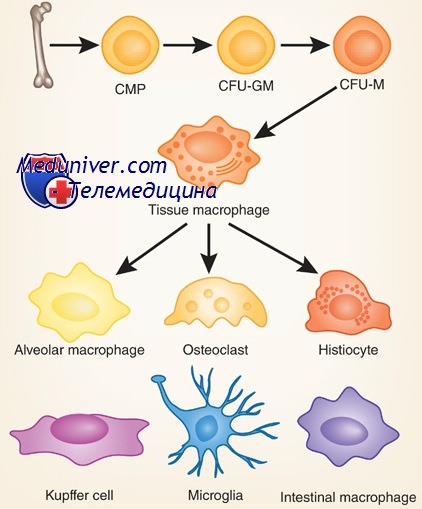
Моноциты — циркулирующие в крови предшественники тканевых макрофагов — развиваются в костном мозге быстрее и остаются в крови дольше нейтрофилов. Первый предшественник моноцита, монобласт, превращается в промоноцит, несколько более крупную клетку с цитоплазматическими гранулами и вдавленным ядром, состоящую из небольших глыбок хроматина, и, наконец, — в полностью развитый моноцит.
Зрелый моноцит по своим размерам больше нейтрофила, и его цитоплазма заполнена гранулами, содержащими гидролитические ферменты. Превращение монобласта в зрелый моноцит крови занимает около 6 сут. Моноциты сохраняют некоторую способность к делению и после попадания в ткани подвергаются дальнейшей дифференцировке; в тканях они могут оставаться в течение нескольких недель и месяцев.
В отсутствие воспаления моноциты, по-видимому, случайным образом попадают в ткани. Оказавшись там, они трансформируются в тканевые макрофаги, морфологические, а иногда и функциональные свойства которых зависят от конкретной ткани. Органоспецифические факторы влияют на дифференцировку моноцитов и определяют их метаболические и структурные особенности. В печени они превращаются в купферовские клетки, которые соединяют синусоиды, разделяющие соседние пластинки гепатоцитов.
В легких они представлены крупными эллипсоидными альвеолярными макрофагами, в костях — остеокластами. Все макрофаги обладают по крайней мере тремя основными функциями — антигенпредставляющей, фагоцитарной и иммуномодулирующей, связанной с секрецией многих цитокинов. В очагах воспаления моноциты и макрофаги могут сливаться друг с другом, образуя многоядерные гигантские клетки — последняя стадия развития мононуклеарных фагоцитов. Под действием некоторых цитокинов моноциты крови дифференцируются в дендритные клетки, которые особенно эффективно представляют антигены лимфоцитам.
Кожа является крупнейшим специализированным органом человека, площадь которого составляет 2 м 2 , а масса — почти 3 кг. Она выполняет ряд важнейших функций. В частности, кожа — это барьерный орган и, что особенно важно отметить, подобно тимусу, она является местом, где созревают некоторые типы иммунных клеток и протекают иммунологические реакции. В принципе, в кожном барьере представлены все типы клеток, способные осуществлять широкий спектриммунных реакций. Это дает основание считать кожу органом иммунной системы.
В начале 80х гг. XX века была сформулирована концепция лимфоидной ткани кожи — skin-associated lymphoid tissue (SALT), которая продолжает развиваться и в наши дни. В соответствии с современными взглядами наряду с лимфоцитами к иммунной системе кожи следует отнести нейтрофилы, тучные клетки и эозинофилы, клетки Лангерганса и кератиноциты [3, 4, 20].
Лимфоциты
Для лимфоидных клеток характерна рециркуляция — постоянный обмен между кровью, лимфой и органами, содержащими лимфоидную ткань. Другой особенностью данной клеточной популяции является хоминг — заселение определенных участков лимфоидных органов и тканей. Поэтому внутридермальные лимфоциты отличаются от циркулирующих в периферической крови. Для изучения популяционного состава лимфоцитов кожи были использованы методы иммуногистохимии и «кожного окна» (определение процентного содержания клеток на отпечатке с небольшого участка кожи после удаления поверхностного слоя эпидермиса). Это позволило установить, что в норме лимфоидные клетки кожи являются преимущественно Т-лимфоцитами: CD5+ — 19%, CD3+ — 48%, CD25+ — 26%, CD4+ — 33%, CD22+ — 18% [7, 14]. Все они имеют достаточно специфичный общий маркер — кожный лимфоцитарный антиген (CLA), который считается рецептором, контролирующим сродство Т-клеток к коже. CLA — это адгезивная молекула на мембране, которая обеспечивает связывание Т-лимфоцита с эндотелием посткапиллярных венул кожи и переход его в дерму. CLA-позитивные T-клетки составляют 10—15% циркулирующих клеток крови. Популяция CLA-позитивных Т-клеток представлена несколькими субпопуляциями, различающимися по рецепторному статусу и функциональной активности [10, 11, 12]. Для всех CLA-позитивных Т-клеток характерна экспрессия кожного Т-клеточного хемоаттрактанта (CTACK), который «привлекает» в кожу Т-лимфоциты из циркуляции, прежде всего при различных воспалительных процессах. Совокупность накопленных сегодня клинико-экспериментальных данных показывает, что CTACK играет важную роль в иммунном ответе кожи. Наиболее значима его патогенетическая роль как провоспалительного фактора при таких заболеваниях, как атопический и контактный дерматиты [13].

Кроме того, большинство Т-лимфоцитов нормальной кожи здорового человека имеют рецепторы к другим хемокинам — биологически активным веществам, контролирующим миграцию клеток, в частности лимфоцитов. Это способствует их активному участию в различных иммунологических реакциях, как физиологических, так и патологических [1, 6, 21].
Т-клетки кожи способны дифференцироваться в цитотоксические клетки или клетки памяти (CD45RO). Клетки памяти экспрессируют также кожный лимфоцитарный антиген (CLA), образуются в лимфатических узлах, дренирующих кожу, и возвращаются в кожу при воспалении. В норме они участвуют в формировании иммунитета в коже, а при патологии принимают участие в патогенезе кожной Т-клеточной лимфомы, отторжения трансплантата, атопического дерматита и т. д. [2, 5, 10, 17]. Около трети лимфоцитов кожи являются Т-хелперами (СD4+). В последние годы показано, что данная субпопуляция клеток представлена двумя разновидностями —Th1 и Th2, которые различаются прежде всего по спектру продуцируемых цитокинов. В норме между этими клетками существует определенный баланс; при заболеваниях кожи соотношение Th1/Th2 меняется. Например,при воспалительных процессах повышается активность Th1-лимфоцитов [1, 8, 12, 15]. Таким образом, лимфоциты кожи представляют собой гетерогенную клеточную популяцию, в которой присутствуют клетки рециркулирующего пула и специфические кожные лимфоциты. Для последних характерен своеобразный набор клеточных рецепторов, обусловливающих их тропность к коже, а также определенный набор продуцируемых цитокинов, позволяющий им участвовать в различных клеточных реакциях, которые обеспечивают репарацию кожи.
Нейтрофилы
Нейтрофилы содержатся в нормальной коже в незначительном количестве, а при острых воспалительных процессах их число существенно возрастает. Кроме того, нейтрофильные гранулоциты участвуют в регуляции репаративных процессов путем взаимодействия с другими клетками (макрофагами, кератиноцитами). Одним из механизмов этого взаимодействия является продукция нейтрофилокинов, стимулирующих секрецию фибробластами и лимфоцитами факторов роста, которые в свою очередь индуцируют пролиферативную активность клеток регенерирующей ткани [3, 18].
Тучные клетки и эозинофилы
Тучные клетки (ТК) и эозинофилы кожи участвуют в различных патологических процессах, прежде всего — в аллергических. При внедрении аллергена в кожу он взаимодействует с эозинофилами и ТК, несущими на своей поверхности IgE-антитела. В результате этого взаимодействия происходит активация и дегрануляция клеток с последующим высвобождением различных медиаторов (субстанции Р, интерлейкинов 1 и 6, хемокинов). Они способствуют миграции в очаг патологического процесса других иммунокомпетентных клеток и поддерживают активность воспалительной реакции. Количество и функциональная активность этих клеток по-разному меняются при различных кожных заболеваниях. Кроме того, ТК и эозинофилы играют определенную роль в реализации патогенных эффектов стресса на кожу [2, 6, 9].
Клетки Лангерганса

Клетки Лангерганса (КЛ) относятся к специализированным клеткам эпидермиса и составляют 2-3% от общего числа его клеток. Они представляют собой одну из форм дендритных клеток, имеющих моноцитарно-макрофагальное происхождение и выполняющих в организме важнейшие иммунные функции, прежде всего — как антигенпрезентирующие клетки. Дендритные клетки являются ключевым звеном, связывающим приобретенный и врожденный иммунитет [16].
При воспалении и других процессах, связанных с антигенной стимуляцией, КЛ приобретают двигательную активность, покидают эпидермис с током тканевой жидкости и, перемещаясь по лимфе, претерпевают определенные морфологические трансформации, в результате чего становятся так называемыми «вуалевыми» клетками. Достигая лимфатических узлов, они активно взаимо действуют с другими иммунокомпетентными клетками и осуществляют презентацию им антигенов. КЛ способны взаимодейство вать с различными типами Т-клеток, модулируя таким образом различные типы иммунных реакций (воспаление, аутоиммунитет). Кроме того, КЛ непосредственно участвуют в уничтожении бактерий в коже.
Кератиноциты
Кератиноциты также следует отнести к иммунной системе кожи. Они продуцируют широкий спектр регуляторных молекул (ростовых факторов, цитокинов), чем обусловлено их участие в иммунной защите кожи [2, 8, 16, 21]. Нарушение взаимодействия молекул адгезии на поверхности кератиноцитов с рецепторами лимфоцитов является важным механизмом патогенеза ряда заболеваний, например псориаза [5, 7, 17, 19].
Меланоциты
В последние годы эти пигмент-продуцирующие клетки кожи стали относить и к иммунокомпетентным, поскольку они, как и кератиноциты, способны продуцировать ряд цитокинов (интерлейкины 1, 3 и 6, фактор некроза опухолей, трансформирующий фактор роста и другие), которые выступают в роли медиаторов иммунного ответа в дерме [2].
Цитокины — биорегуляторы иммунных реакций
Последние десятилетия характеризовались бурным накоплением данных о новом классе иммунорегуляторных молекул — цитокинов. Они включают в себя огромное количество различных веществ, в том числе интерлейкинов, которые выполняют коммуникативную функцию между иммуноцитами и оказывают различные регуляторные влияния как в рамках иммунной системы, так и в других органах и тканях. В настоящее время в коже обнаружено большинство известных интерлейкинов: их функции связаны с кожей, а нарушение продукции лежит в основе патогенеза ряда кожных заболеваний, в частности псориаза и атопического дерматита [2, 6, 7].
Иммунная система кожи при инфекционном и неинфекционном поражении
Иммунная система кожи участвует в реализации и врожденного, и приобретенного иммунитета. Наиболее значимо ее роль проявляется при нарушении целостности барьера и проникновении в дерму микро организмов. При этом SALT реагирует как единая функциональная система. В анти-генпрезентирующих клетках происходят процессинг и презентация антигена, в ходе которых КЛ превращаются в дендритные клетки и перемещаются по дерме в лимфатические узлы. В результате они приобретают способность взаимодействовать с Т-хелперами, которые затем активируют В-клетки и частично дифференцируются в эффекторные лимфоциты и клетки памяти. Т-клетки памяти, несущие CLA, способны из кровотока мигрировать в эпидермис; именно они и преобладают в коже. В результате увеличения числа Т-клеток, контактирующих с наиболее «актуальными» антигенами, вносится поправка в антигенраспознающий репертуар Т- лимфоцитов. Этим определяется активность иммунного ответа.
При неинфекционном поражении кожи, например при травме, иммунная система активно участвует в заживлении кожной раны. Заживление кожной раны — это динамичный интерактивный процесс с участием медиаторов, клеток крови, межклеточного матрикса и мезенхимальных клеток, который состоит из трех фаз: воспаление, образование грануляционной ткани и тканевое ремоделирование. Воспаление является реакцией организма в целом и кожи в частности на травму. Ведущая роль в его развитии принадлежит клеткам крови — нейтрофилам. Они не только участвуют в гемостазе, но и выделяют биологически активные вещества.

В результате происходит активация моноцитов-макрофагов, которые служат связующим звеном между воспалением и регенерацией. Активация этих клеток приводит к индукции пролиферации эпидермиса. Необходимо отметить, что реэпителизация начинается уже через несколько часов поле нанесения травмы. Первоначально она идет за счет сокращения внутриклеточных тонофиламентов, что повышает миграционную способность эпидермальных клеток. Примерно через четверо суток в ране определяется новообразованная строма (грануляционная ткань). Под влиянием различных цитокинов, продуцируемых иммунокомпетентными клетками, в ней происходят дифференцировка фибробластов, синтез коллагена, новообразование сосудов. Активное участие в этих процессах принимают цитокины, и в том числе — ростовые факторы (эпидермальный, трансформирующий, тромбоцитарный, эндотелиальный и другие). Метаболизм коллагена, появление в грануляционной ткани миофибробластов, пролиферация кератиноцитов и целый ряд других клеточных событий, завершающих «созревание» грануляционной ткани, приводят к формированию кожного рубца, что свидетельствует о восстановлении целостности ткани и завершении репаративного процесса [19, 21].
Таким образом, в коже представлены все типы иммунного ответа — врожденный и приобретенный (адоптивный), клеточный и гуморальный. Благодаря этому возможны и неспецифическая защитная функция (иммуноглобулины, лизоцим, лактоферрин, дефенсины, фагоцитоз), и первичное распознавание антигена с последующей его презентацией и пролиферацией антиген-специфических Т-клеток. В результате в дерме осуществляются как цитотоксические реакции, так и антителообразование. Необходимо подчеркнуть, что особенностью кожи как иммунного органа является относительное преобладание врожденного иммунитета над приобретенным, а в системе врожденного иммунитета кожи в свою очередь превалируют клеточные факторы. Анализ многочисленных научных данных позволяет полагать, что иммунные реакции имеют отношение к большинству физиологических и патологических процессов, происходящих в коже.

Нарушения функции SALT
На обширном экспериментальном и клиническом материале показано, что нарушения функций SALT — реактивности Т-клеток, продукции цитокинов, экспрессии хемокинов на клетках, межклеточных взаимодействий и других иммунологических реакций — приводят к развитию ряда заболеваний, любое из которых сопровождается изменением внешнего вида кожи. Это могут быть воспалительные заболевания кожи (фурункулы, акне), атопический дерматит, псориаз, Т-клеточная кожная лимфома [5, 16, 17]. Известно, что возрастные изменения кожи также связаны с изменением ее иммунологических функций. В стареющей коже наблюдаются мононуклеарная инфильтрация, снижение числа клеток Лангерганса и изменение продукции иммунокомпетентными клетками цитокинов, влияющих на пролиферацию и дифференцировку клеток кожи.
Разнообразие клеток, входящих в иммунную систему кожи, а также многообразие их функций объясняют тот факт, что на уровне кожи возможно проявление всех типов иммунопатологических синдромов (иммунодефицитный, аутоиммунный, аллергический, лимфопролиферативный). Иммунодефицитный синдром проявляется, например, фурункулезом и другими гнойно-воспалительными процессами. При дефектах фагоцитоза кожа становится чувствительной ко многим бактериальным и грибковым инфекциям, но иммунный ответ нарушается на любой антиген, поскольку страдает антигенная презентация.
Аллергический (гиперергический) синдром встречается достаточно часто и имеет место при контактном и атопическом дерматитах. Явления гиперергии характерны и для псориаза. Аутоиммунный синдром также имеет кожные проявления (склеродермия, системная красная волчанка). Примером лимфопролиферативного синдрома служит Т-клеточная лимфома кожи (грибовидный микоз).
Диагностика всех этих состояний основана на клинических признаках. Например, для иммунодефицитного заболевания это будут такие критерии, как рецидивирующее течение инфекционного поражения кожи, его затяжное течение несмотря на проведение адекватной фармакотерапии, тенденция к генерализации инфекционно-воспалительного процесса в коже, резистентность к антимикробной терапии, преобладание в очаге поражения некротических изменений над воспалительными, несоответствие локальных и системных проявлений кожной инфекции. Специфических тестов, характеризующих состояние иммунитета кожи, в практической медицине не существует. Дерматолог может ориентироваться на стандартные иммунологические показатели крови. В научных же исследованиях используют морфологическую (гистологическую) оценку иммунокомпетентных структур кожи, метод «кожного окна» и некоторые другие.
Как улучшить иммунитет кожи?
Патология иммунной системы приводит к развитию иммунозависимой патологии. Поэтому потребность в стимуляции иммунитета кожи при его угнетении патогенетически обоснована. Для этих целей могут быть рекомендованы такие препараты, как Полиоксидоний и Ликопид. Некоторые иммуномодуляторы (например, Рибоксин) могут использоваться как для системного, так и для местного применения, в том числе в мезотерапевтических методиках. При этом интрадермальные иньекции оказывают влияние преимущественно на иммунную систему кожи, а системное применение приводит к активации лимфопоэза в тимусе и лимфатических узлах. Другими словами, выбор способа введения препарата (местное или системное) должен базироваться на характере иммунных нарушений — как в коже, так и в организме в целом.

Умеренным иммунотропным действием обладают и неспецифические адаптогены (витаминно-микроэлементные комплексы, настойка аралии и т. п.). Мы обнаружили иммуноактивные свойства у органического кремния, который широко используется в мезотерапевтической практике. В лечении заболеваний, вызванных повышенной реактивностью иммунной системы (псориаз, лимфомы), используют иммунодепрессанты (циклоспорин). Последним достижением иммунофармакологии является использование в качестве ингибиторов иммунной системы моноклональных (высокоспецифичных) антител.
Улучшая иммунный статус кожи, следует помнить о том, что иммунная система кожи, морфологически представленная SALT, с одной стороны, является достаточно автономным отделом иммунной системы организма, с другой — имеет с ней тесные морфофункциональные и регуляторные взаимоотношения. Нарушения нормальных иммунных реакций в коже приводят к развитию многих дерматологических заболеваний и подавляющего большинства эстетических проблем, в том числе к преждевременному старению кожи. Неудивительно, что кожа является мишенью для иммунотерапевтических вмешательств, в частности иммуномезотерапии. Более подробно этот вопрос мы планируем рассмотреть в следующих публикациях.
Тромбоцитопоэз. Моноцитопоэз. Лимфоцитопоэз и иммуноцитопоэз.
Мультипотентные клетки (КОЕ-ГЭММ) миелопоэза под влиянием факторов микроокружения и тромбопоэтина дифференцируются в родоначальные клетки мегакариоцитарного ряда (КОЕ-Мег). Далее этот ряд включает следующие формы: мегакариобласт, промегакариоцит, мегакариоцит, тромбоциты.
Мегакариобласт — крупная полиплоидная клетка. По мере увеличения степени плоидности до 32-64 п она приобретает гигантские размеры. Наиболее дифференцированная клетка этого ряда — мегакариоцит — имеет базофильную цитоплазму с многочисленными азурофильными гранулами. Происходит значительное увеличение размеров ядра вследствие его полиплоидизации и сегментации. Мегакариоциты находятся в миелоидной ткани красного костного мозга. От поверхности цитоплазмы этих клеток по каналам агранулярной эндоплазматической сети отшнуровываются небольшие фрагменты, превращающиеся в кровяные пластинки. Последние попадают в кровяное русло. Основное проявление дифференцировки клеток при тромбоцитопоэзе сводится к увеличению размеров мегакариобластов, полиплоидизации, появлению в цитоплазме азурофильной зернистости, отшнуровыванию фрагментов цитоплазмы путем образования впячиваний плазмолеммы, отделению от мегакариоцитов кровяных пластинок, попадающих в кровь.
Моноцитопоэз. Моноцитопоэз — образование моноцитов — происходит в красном костном мозге из стволовых клеток через стадии КОЕ-ГЭММ, далее — КОЕ-ГМо, затем КОЕ-Мо, монобласта, промоноцита и моноцита. Конечной стадией дифференцировки клеток моноцитарного ряда является не моноцит, а макрофаг (мононуклеарный фагоцит), который находится вне сосудистого русла. Дифференцировка клеток при моноцитопоэзе характеризуется: увеличением размеров клетки, приобретением ядра бобовидной формы, снижением базофилии цитоплазмы, превращением моноцита в макрофаг.
Лимфоцитопоэз и иммуноцитопоэз. Лимфоидная ткань у человека имеется в составе лимфатических узлов, селезенки, миндалин, аппендикса и в других лимфоидных образованиях по ходу пищеварительного тракта. В лимфоидной ткани происходит лимфопоэз. Исходными клетками лимфопоэза являются стволовые клетки красного костного мозга. Через стадию мультипотентных клеток (КОЕ-Л) они дифференцируются в родоначальные про-Т- и про-В-лимфобласты и далее в Т- и В-лимфобласты, Т- и В-пролимфоциты и Т- и В-лимфоциты.
В лимфоцитопоэзе в тимусе возникают субпопуляции Т-клеток с различными рецепторами (так называемая антигеннезависимая пролиферация и дифференцировка). Т-лимфоциты участвуют в формировании клеточного иммунитета. Другой ряд дифференцировки в лимфопоэзе приводит к образованию из В-лимфоцитов через стадии плазмобласта и проплазмоцита — плазматических клеток (плазмоцитов). Эти клетки вырабатывают антитела, обеспечивая гуморальный иммунитет. Подробнее образование иммунокомпетентных клеток и их участие в развитии воспаления рассматриваются ниже.
Из лимфобластов образуются большие, средние и малые лимфоциты. Этот ряд дифференцировки сопровождается уменьшением размеров клеток, уплотнением ядер, снижением митотической активности. Малые лимфоциты способны к "бласттрансформации" — своеобразной дедифференцировке с последующей повторной их дифференцировкой. Явление бласттрансформации открыто А.А. Максимовым (1902).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

