Какие иммуномодуляторы при фурункулезе
Обновлено: 17.04.2024
В статье представлены результаты обследования пациентов с фурункулами челюстно – лицевой области. Выявлено, что в 40,9% случаев, заболевание протекает на фоне угнетения клеточного и гуморального звеньев иммунной системы. Количество CD3 + – клеток снижено на 26,3 %, CD4 + – на 25 %, CD8 + – на 25,4%. Показатели Ig G снижены на 22%, Ig M соответствовали контролю. Применение иммуномодулятора «Деринат» в комплексном лечении фурункулов лица способствует нормализации показателей клеточного и гуморального иммунитета, а также сокращает срок очищения раны от гнойно – некротических масс и ее эпителизации.
Ключевые слова: фурункул, фурункулез, иммунодепрессия, иммуномодулятор «Деринат».
Klimova I.S.
Candidate of Medical Sciences, Chita state medical Academy
IMMUNOMODULATOR DERINAT IN THE TREATMENT OF FURUNCLES THE MAXILLOFACIAL AREA
Abstract
The article presents the results of examination of patients with the furuncles of the maxillofacial area. It is revealed that in 40.9% of cases, the disease occurs against the backdrop of oppression of the cellular and humoral immune system. The number of CD3+ cells decreased by 26.3 %, CD4+ 25 %, and CD8+ – 25.4%. Indicators Ig G reduced by 22%, Ig M corresponded to control. Application of immunomodulator Derinat in complex treatment of furuncles person contributes to the normalization of the indices of cellular and humoral immunity and reduces time of the cleansing of wounds from a purulent – necrotic masses and epithelization.
Keywords: furuncle, furunculosis, immunosuppression, immunomodulator Derinat.
По данным различных авторов [3,5,6] число госпитализированных больных с фурункулом в структуре гнойно-воспалительных заболеваний челюстно – лицевой области составляет около 30%. Преимущественно страдают лица в возрасте 14-30 лет [1,3,4,5,6,7].
В челюстно–лицевой области воспалительный процесс при фурункуле в большинстве случаев протекает по гиперергическому типу. При этом заболевание приобретает агрессивное течение, что может привести к развитию флегмоны, тромбофлебита, сепсиса и иных осложнений.
В последние годы в практике все чаще диагностируются длительные, вялотекущие формы заболевания, с тенденцией к хронизации процесса. В таких случаях фурункул протекает на фоне нарушения нормального функционирования и взаимодействия различных звеньев иммунной системы, эндокринных расстройств, заболеваний желудочно – кишечного тракта, аутоиммунной патологии [1,2,6,7] .
В связи с этим, целью нашего исследования стало изучение состояния иммунной системы у пациентов с фурункулом челюстно – лицевой области, коррекция выявленных нарушений с помощью иммуномодулятора «Деринат».
Материалы и методы. Под нашим наблюдением находились 110 пациентов с одиночным фурункулом и хроническим фурункулезом челюстно – лицевой области в возрасте от 14 до 65 лет. Группу клинического контроля составили 50 практически здоровых лиц в возрасте 18 – 57 лет (20 мужчин и 30 женщин).
Всем пациентам выполнялся стандартный клинико – лабораторный минимум обследования в соответствии с нормативами Министерства здравоохранения РФ, который был дополнен иммунологическим исследованием.
Статистическую обработку осуществляли с использованием компьютерных программ Microsoft Excel, Statistica 6.0. Soft Inc. (USA) и Biostat, с применением t – критерия Стьюдента, коэффициента корреляции, дисперсионного анализа.
Результаты исследования. Большинство пациентов составили лица в возрасте 14–18 и 19–35 лет (30 % и 54,5 % соответственно). С увеличением возраста частота развития данной воспалительной патологии значительно снижается. В 69,1 % случаев нами был диагностирован одиночный фурункул, в 30,9 % – хронический рецидивирующий фурункулез.
Результаты иммунологического исследования показали, что в 40,9% случаев заболевание протекает на фоне депрессии иммунной системы. Среди них 22% составили лица в возрасте 14 – 18 лет, 57,8% – 19 – 35 лет, пациенты остальных возрастов составили 20%.
Уровень CD3 + – лимфоцитов в группе пациентов без признаков иммуносупрессии находился в пределах контрольных значений (67,64 ± 3,35 % и 65,93 ± 4,09 %; Р ≤ 0,05). CD4 + был выше на 26,8 % (33,5 ± 2,95 % и 37,8 ± 1,45 %; Р ≤ 0,05), CD8 + – соответствовал уровню контроля (35,6 ± 1,41 % и 35,14 ± 1,04 %). Содержание Ig G соответствовало уровню контрольных значений (41,55 ± 1,0 % и 40,37 ± 1,01 %; Р ≤ 0,05), Ig A превышал показатели нормы на 16,4 % (22,69 ± 0,89 % и 26,42 ± 1,18 %; Р ≤ 0,05), а Ig M – снижен на 9 % (36,14 ± 1,0 % и 32,96 ± 0,91 %). После купирования воспалительного процесса показатели постепенно снижались до уровня контрольных значений.
У пациентов с фурункулом челюстно – лицевой области, протекающим на фоне иммунодепрессии количество CD3 + – клеток было снижено на 26,3 % (67,64 ± 3,35 % и 49,83 ± 2,3 %; Р ≤ 0,001), CD4 + – на 25 % (33,5 ± 2,95 % и 25,12 ± 0,83 %; Р ≤ 0,001), CD8 + – на 25,4% (35,6 ± 1,41 % и 26,57 ± 2,03 %; Р ≤ 0,001). Показатели Ig G были снижены на 22% (41,55 ± 1,0 % и 32,38 ± 1,01 %; Р ≤ 0,05), Ig A превышал показатели нормы на 12,4 % (22,69 ± 0,89 % и 25,51 ± 0,83 %; Р ≤ 0,001), Ig M соответствовал контролю (36,14 ± 1,0 % и 36,21 ± 1,0 %). (рис.1).
Рис. 1 – Показатели клеточного и гуморального иммунитета у пациентов с фурункулом ЧЛО
После включения в комплекс лечения пациентов с фурункулом, протекающим на фоне иммунодепрессии инъекций 1,5 % раствора иммуномодулятора «Деринат» показатели CD3 + – повысились на 21% (60,4 ± 2,28 %; Р ≤ 0,001), CD4 + – на 32 % (33,15 ± 1,68 %; Р ≤ 0,01), CD8+ – на 20% (31,85 ± 1,68 %; Р ≤ 0,01). Уровень Ig G увеличился на 17 % (37,92 ± 0,89 %; Р ≤ 0,05), Ig A – на 9,4 % (27,9 ± 0,88 %) (рис. 2).
Рис.2 – Показатели клеточного и гуморального иммунитета пациентов с фурункулом ЧЛО,
протекающим на фоне иммунодепрессии
При местном использовании 0,25 % раствора иммуномодулятора «Деринат» в виде повязок на рану нами отмечено сроков очищения раны и ускорение процесса ее эпителизации (табл. 1.).
Таблица 1 – Динамика раневого процесса при различных способах лечения (сут) (М ± м)
| Критерий | Повязки с 0,25 % иммуномодулятором «Деринат» | Традиционное лечение |
| Срок очищения раны | 3,5±0,11; Р≤0,01 | 4,22±0,19 |
| Срок эпителизации | 4,5±0,11; Р≤0,01 | 5,58±0,24 |
| Срок нетрудоспособности | 5,05±0,21; Р≤0,02 | 6,42±0,5 |
Таким образом, депрессия иммунной системы обуславливает длительное течение заболевания, с переходом в хроническую форму. Включение в комплексное лечение иммуномодулятора «Деринат» в виде 1,5 % раствора для инъекций способствует нормализации показателей клеточного и гуморального иммунитета. При местном использовании 0,25 % раствора иммуномодулятор «Деринат» ускоряет сроки очищения раны от некротических масс и ее эпителизацию, тем самым сокращая сроки временной нетрудоспосбности.
В настоящее время существует тенденция к росту хронических бактериальных и вирусных заболеваний, для которых характерны непрерывно рецидивирующее течение и малая эффективность антибактериальной и симптоматической терапии. Одним из таких заболеваний яв
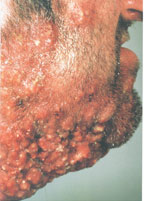
В настоящее время существует тенденция к росту хронических бактериальных и вирусных заболеваний, для которых характерны непрерывно рецидивирующее течение и малая эффективность антибактериальной и симптоматической терапии. Одним из таких заболеваний является хронический рецидивирующий фурункулез (ХРФ). Фурункул развивается в результате острого гнойно-некротического воспаления волосяного фолликула и окружающих его тканей. Как правило, фурункул является осложнением остеофолликулита стафилококковой этиологии. Фурункулы могут возникать как одиночно, так и множественно (так называемый фурункулез).
В случае рецидивирования фурункулеза диагностируется хронический рецидивирующий фурункулез. Как правило, он характеризуется частыми рецидивами, длительными, вялотекущими обострениями, толерантными к проводимой антибактериальной терапии. В зависимости от количества фурункулов, распространенности и выраженности воспалительного процесса ХРФ классифицируется по степени тяжести (Л. Н. Савицкая, 1987).
Тяжелая степень: диссеминированные, множественные, непрерывно рецидивирующие небольшие очаги со слабой местной воспалительной реакцией, не пальпируемыми или слегка определяющимися регионарными лимфатическими узлами. Тяжелое течение фурункулеза сопровождается симптомами общей интоксикации: слабостью, головной болью, снижением работоспособности, повышением температуры тела, потливостью.
Средняя степень тяжести — одиночные или множественные фурункулы больших размеров, протекающие с бурной воспалительной реакцией, с рецидивами от 1 до 3 раз в год. Иногда сопровождается увеличением регионарных лимфатических узлов, лимфангоитом, кратковременным повышением температуры тела и незначительными признаками интоксикации.
Легкая степень тяжести — одиночные фурункулы, сопровождающиеся умеренной воспалительной реакцией, с рецидивами от 1 до 2 раз в год, хорошо пальпируемыми регионарными лимфатическими узлами, без явлений интоксикации.
Чаще всего пациенты, страдающие фурункулезом, получают лечение у хирургов, в лучшем случае на амбулаторном этапе им проводится исследование крови на сахар, аутогемотерапия, некоторым назначают и иммуномодулирующие препараты без предварительно проведенного обследования, и в большинстве случаев они не получают положительного результата от проведенной терапии. Цель нашей статьи — поделиться опытом ведения больных с ХРФ.
Основным этиологическим фактором ХРФ считается золотистый стафилококк, который встречается, по разным данным, в 60–97% случаев. Реже ХРФ вызывается другими микроорганизмами — эпидермальным стафилококком (ранее считавшимся апатогенным), стрептококками групп А и В и другими видами бактерий. Описана вспышка заболеваемости фурункулезом нижних конечностей у 110 пациентов, являвшихся пациентами одного и того же педикюрного салона. Возбудителем данной вспышки являлся Mycobacterium fortuitium, причем этот микроорганизм был выявлен в ванночках для ног, используемых в салоне. В большинстве случаев ХРФ из гнойных очагов высеваются антибиотикорезистентные штаммы золотистого стафилококка. По данным Н. М. Калининой, St. aureus в 89,5% случаев резистентен к пенициллину и ампициллину, в 18,7% — резистентен к эритромицину и в 93% случаев чувствителен к клоксациллину, цефалексину и котримоксазолу. В последние годы отмечается достаточно широкое распространение метициллин-резистентных штаммов этого микроорганизма (до 25% пациентов). По данным зарубежной литературы, наличие на коже или на слизистой оболочке носа патогенного штамма St. aureus считается важным фактором развития заболевания.
ХРФ имеет сложный и до сих пор недостаточно изученный патогенез. Установлено, что дебют и дальнейшее рецидивирование заболевания обусловлены целым рядом эндо- и экзогенных факторов, среди которых наиболее значимыми считаются нарушение барьерной функции кожных покровов, патология ЖКТ, эндокринной и мочевыделительной систем, наличие очагов хронической инфекции различной локализации. По данным проведенных нами исследований, очаги хронической инфекции различной локализации выявляются у 75–99,7% пациентов, страдающих ХРФ. Наиболее часто встречаются очаги хронической инфекции ЛОР-органов (хронический тонзиллит, хронический гайморит, хронический фарингит), дисбактериоз кишечника с увеличением содержания кокковых форм. У больных хроническим фурункулезом патология ЖКТ (хронический гастродуоденит, эрозивный бульбит, хронический холецистит) определяется в 48–91,7% случаев. У 39,7% пациентов диагностируется патология эндокринной системы, представленная нарушениями обмена углеводов, гормонпродуцирующей функции щитовидной и половых желез. У 39,2% больных с упорно текущим фурункулезом имеется латентная сенсибилизация, у 4,2% — клинические проявления сенсибилизации к аллергенам домашней пыли, пыльцы деревьев и злаковых трав, у 11,1% — повышенная концентрация сывороточного IgE.
Таким образом, для большинства больных ХРФ характерны непрерывно рецидивирующее течение заболевания (41,3%) при тяжелой и средней тяжести течения фурункулеза (88%) и длительные обострения (от 14 до 21 дня — 39,3%). У 99,7% пациентов выявлены хронические очаги инфекции различной локализации. В 39,2% случаев определялась латентная сенсибилизация к различным аллергенам. Основным возбудителем является St. aureus.
В возникновении и развитии хронического фурункулеза, наряду с особенностями возбудителя, его патогенными, вирулентными и инвазивными свойствами, наличием сопутствующей патологии, большая роль отводится нарушениям нормального функционирования и взаимодействия различных звеньев иммунной системы. Иммунная система, призванная обеспечить биологическую индивидуальность организма и, как следствие, выполняющая защитную функцию при контакте с инфекционными, генетически чужеродными агентами, в силу разных причин может давать сбой, что ведет к нарушению защиты организма от микробов и проявляется в повышенной инфекционной заболеваемости.
Иммунная защита от бактерий-патогенов включает два взаимосвязанных компонента — врожденный (носящий преимущественно неспецифический характер) и адаптивный (характеризующийся высокой специфичностью к чужеродным антигенам) иммунитет. Возбудитель ХРФ при попадании в кожу вызывает «каскад» защитных реакций.
У 26–35% больных, страдающих хроническим фурункулезом, снижается количество В-лимфоцитов. При оценке компонентов гуморального иммунитета у больных фурункулезом выявляются различные дисиммуноглобулинемии. Наиболее часто встречаются снижение уровней IgG и IgM. Отмечено снижение аффинности иммуноглобулинов у больных ХРФ, причем выявлена корреляция между частотой встречаемости этого дефекта, стадией и тяжестью заболевания. Тяжесть нарушений лабораторных показателей коррелирует с тяжестью клинических проявлений фурункулеза.
Из вышесказанного следует, что изменения показателей иммунного статуса у больных ХРФ носят разноплановый характер: у 42,9% отмечено изменение субпопуляционного состава лимфоцитов, у 71,1% — фагоцитарного и у 59,5% — гуморального звена иммунной системы. В зависимости от выраженности изменений в показателях иммунного статуса больных ХРФ можно разделить на три группы: легкой тяжести, средней и тяжелого течения, что коррелирует с клиническим течением заболевания. При легком течении фурункулеза у большинства больных (70%) показатели иммунного статуса находятся в пределах нормы. При средней и тяжелой степени преимущественно выявляются изменения фагоцитарного и гуморального звеньев иммунной системы.
Диагностика и лечение ХРФ
Исходя из вышеуказанных патогенетических особенностей ХРФ алгоритм диагностики должен включать в себя выявление очагов хронической инфекции, диагностику сопутствующих заболеваний, оценку лабораторных параметров состояния иммунной системы (рис.).
В нашем институте был разработан план обследования больных ХРФ.
- Обязательное лабораторное исследование:
- клинический анализ крови;
- общий анализ мочи;
- биохимический анализ крови (общий белок, белковые фракции, общий билирубин, мочевина, креатинин, трансаминазы - АСТ, АЛТ);
- RW, ВИЧ;
- анализ крови на наличие гепатита В и С;
- посев содержимого фурункула на флору и чувствительность к антибиотикам;
- гликемический профиль;
- иммунологическое обследование (фагоцитарный индекс, спонтанная и индуцированная хемилюминесценция (ХЛ), индекс стимуляции (ИС) люминолзависимой хемилюминесценции ЛЗХЛ), бактерицидность нейтрофилов, иммуноглобулины A, M, G, аффинность иммуноглобулинов);
- бактериологическое исследование фекалий;
- анализ кала на яйца глистов;
- посев из зева на флору и грибы.
- Дополнительное лабораторное исследование:
- определение уровня гормонов щитовидной железы (Т3,Т4, ТТГ, АТ к ТГ);
- определение уровня половых гормонов (эстрадиол, пролактин, прогестерон);
- посев крови на стерильность трехкратно;
- посев мочи (по показаниям);
- посев желчи (по показаниям);
- определение базальной секреции;
- иммунологическое обследование (субпопуляции Т-лимфоцитов, В-лимфоциты);
- общий IgE.
- Инструментальные методы обследования:
- гастроскопия с определением базальной секреции;
- УЗИ органов брюшной полости;
- УЗИ щитовидной железы (по показаниям);
- УЗИ женских половых органов (по показаниям);
- дуоденальное зондирование;
- функции внешнего дыхания;
- ЭКГ;
- рентгенография органов грудной клетки;
- рентгенография придаточных пазух носа.
- Консультации специалистов: отоларинголога, гинеколога, эндокринолога, хирурга, уролога.
Тактика лечения больных ХРФ определяется стадией заболевания, сопутствующей патологией и иммунологическими нарушениями. В стадии обострения ХРФ требуется проведение местной терапии в виде обработки фурункулов антисептическими растворами, антибактериальными мазями, гипертоническим раствором; в случае локализации фурункулов в области головы и шеи или наличия множественных фурункулов — проведение антибактериальной терапии с учетом чувствительности возбудителя. В любой стадии заболевания необходима коррекция выявленной патологии (санация очагов хронической инфекции, лечение патологии ЖКТ, эндокринной патологии и т. д.). При выявлении у больных ХРФ латентной сенсибилизации или при наличии клинических проявлений аллергии необходимо в период поллинации добавлять к лечению антигистаминные препараты, назначать гипоаллергенную диету, проводить хирургическое вмешательство с премедикацией гормональными и антигистаминными препаратами.
В последнее время в комплексной терапии больных ХРФ все чаще используют препараты, оказывающие корригирующее действие на иммунную систему.
Разработаны показания к назначению иммуномодуляторов в зависимости от доминирующего типа нарушений иммунного статуса и степени заболевания. Так, в стадии обострения ХРФ рекомендовано применение следующих иммуномодуляторов.
- При наличии изменений фагоцитарного звена иммунитета целесообразно назначение полиоксидония по 6-12 мг внутримышечно в течение 6-12 дней.
- При снижении аффинности иммуноглобулинов - галавит 100 мг № 15 внутримышечно.
- При снижении уровня В-лимфоцитов, нарушении соотношения CD4/CD8 в сторону уменьшения показано применение миелопида по 3 мг в течение 5 дней внутримышечно.
- При снижении уровня IgG на фоне тяжелого обострения ХРФ при клинической неэффективности применения галавита используются препараты иммуноглобулина для внутривенного введения (октагам, габриглобин, интраглобин).
В период ремиссии возможно назначение следующих иммуномодуляторов.
- Полиоксидоний 6-12 мг внутримышечно в течение 6-12 дней - при наличии изменений фагоцитарного звена иммунитета.
- Ликопид 10 мг в течение 10 дней перорально - при наличии дефектов образования активных форм кислорода.
- Галавит 100 мг № 15 внутримышечно - при снижении аффинности иммуноглобулинов.
Применение ликопида целесообразно также при вялотекущем, непрерывно рецидивирующем фурункулезе. При упорном рецидивировании ХРФ на фоне изменений гуморального звена иммунитета показано назначение препаратов иммуноглобулина для внутривенного введения (октагам, габриглобин, интраглобин). В некоторых случаях целесообразно комбинированное применение иммуномодулирующих препаратов (например, при обострении фурункулеза возможно назначение полиоксидония, в дальнейшем, при выявлении дефекта аффинности иммуноглобулинов, добавляется галавит и т. д.).
Несмотря на значительные успехи, достигнутые в области клинической иммунологии, эффективное лечение ХРФ остается достаточно сложной задачей. В связи с этим требуется дальнейшее изучение патогенетических особенностей этого заболевания, а также разработка новых подходов к терапии ХРФ.
Неоген является синтетическим трипептидом, состоящим из L-аминокислотных остатков изолецитина, глютамина и триптофана. Неоген применялся в составе комплексной терапии, проводимой больным хроническим фурункулезом. Внутримышечные инъекции препарата неогена проводились по 1 мл 0,01% раствора 1 раз в сутки ежедневно, курс — 10 инъекций. Применение неогена в комплексной терапии больных хроническим фурункулезом на стадии ремиссии заболевания вызывает достоверную нормализацию изначально измененных иммунологических показателей (относительного и абсолютного количества лимфоцитов, относительного количества CD3 + , CD8 + , CD19 + , CD16 + -лимфоцитов, поглотительной способности моноцитов по отношению к St. aureus) и увеличение показателей спонтанной ХЛ и аффинности анти-ОАД-антител, количества HLA-DR+-лимфоцитов, а следовательно, позволяет продлить период ремиссии заболевания по сравнению с группой контроля.
Таким образом, из вышеизложенного следует, что ХРФ протекает под воздействием сложного комплекса этиологических и патогенетических факторов и его нельзя рассматривать только как местное воспаление. Больным с ХРФ необходимо проводить всестороннее обследование с целью выявления возможных очагов хронической инфекции, которые являются источником септицемии и при нарушении элиминации микробов в крови в результате снижения иммунологической реактивности организма приводят к возникновению фурункулов. Так как назначение иммунокорригирующих препаратов может вызвать обострение основного заболевания, мы считаем, что лечение больных необходимо начинать с санации выявленных очагов инфекции.
Вопрос о назначении иммунокорригирующих препаратов должен решаться индивидуально, с учетом стадии заболевания, наличия сопутствующей патологии и типа иммунологического дефекта. При выявлении у больного сенсибилизации к различным аллергенам лечение фурункулеза необходимо проводить на фоне противоаллергенной терапии.
Н. Х. Сетдикова, доктор медицинских наук
К. С. Манько
Т. В. Латышева, доктор медицинских наук, профессор

Фурункулез — кожное заболевание, характеризующееся развитием гнойно-некротического процесса, поражающего волосяной фолликул и околофолликулярную соединительную ткань. Характеризуется образованием конусовидной пустулы с формированием некротического стержня и зоной воспаления, отека, болезненности при пальпации кожи вокруг очага. На месте отделившегося некротического стержня формируется язва.
Основной причиной развития фурункулёза является стафилококковая инфекция, которая провоцирует развитие гнойно-воспалительного процесса. Провоцирующим факторами являются: травмы кожи, хронические инфекции в организме, сахарный диабет, снижение иммунитета.
Актуальность. В настоящее время существует тенденция к росту хронических бактериальных заболеваний, для которых характерны непрерывно рецидивирующее течение и малая эффективность антибактериальной терапии, к таковым относится хронический рецидивирующий фурункулез (ХРФ). Для ХРФ характерно непрерывно рецидивирующее течение заболевания (41,3 %) при тяжелой и средней тяжести течения фурункулеза (88 %) и длительные обострения (от 14 до 21 дня — 39,3 %).
Цель работы — изучить действие иммуномодулирующих препаратов на течение фурункулеза и перспективы лечения.
Задачи:
– Изучение механизмов действия препаратов;
– Влияние препаратов на длительность ремиссии;
– Изучить возможности их дальнейшего применения на практике.
Помимо антибиотиков в лечении фурункулеза активно применяются иммуномодулирующие препараты.
Одним из основных является азоксимера бромид (полиоксидоний). Основой механизма иммуномодулирующего действия является прямое воздействие на фагоцитирующие клетки и естественные киллеры, а также стимуляция антителообразования. Препарат восстанавливает иммунные реакции при иммунодефицитных состояниях.
Применение азоксимера бромида снизило количество рецидивов и увеличило длительность ремиссии. Также нормализировалось клиническое состояние, наблюдался регресс старых фурункулов.
Также к иммуномодуляторам относятся аминодигидрофталазиндион натрия (галавит), Глюкозаминилмурамилдипептид (ликопид) и L-изолейцил-L-глутамил-L-триптофана натриевая соль (стемокин), дезоксирибонуклеинат натрия (деринат), экстракт костного мозга телят (миелопид).
Аминодигидрофталазиндион натрия (галавит) нормализует фагоцитарную активность моноцитов/макрофагов, бактерицидную активность нейтрофилов и цитотоксическую активность NK-клеток. При этом, восстанавливая пониженную активность клеток врожденного и адаптивного иммунитета, препарат повышает резистентность организма к инфекционным заболеваниям бактериальной, вирусной и грибковой этиологии, способствует более быстрой элиминации возбудителя из организма, сокращает частоту, выраженность и длительность инфекций.
На фоне приема аминодигидрофталазиндиона натрия отмечалось улучшение клинической картины заболевания, выражавшееся в нормализации температуры тела, исчезновении признаков интоксикации, более быстрой регрессии старых фурункулов по сравнению с контрольной группой, где больные получали только базисную и антибактериальную терапию. Ни у одного из пациентов не зафиксировано местных и общих побочных эффектов, а также аллергических реакций при применении аминодигидрофталазиндиона натрия Также происходило увеличение длительности ремиссии.
Глюкозаминилмурамилдипептид (ликопид) — препарат стимулирующий функциональную (бактерицидную, цитотоксическую) активность фагоцитов, усиливающий презентацию ими антигенов, пролиферацию Т- и В-лимфоцитов, повышает синтез специфических антител, способствует нормализации баланса Thl/Th2-лимфоцитов в сторону преобладания Thl.
При использовании глюкозаминилмурамилдипептида у пациентов наблюдалось процентное увеличение Т-лимфоцитов а также к нормализации функции фаго- цитирующих клеток периферической крови. Таким образом в комплексном применении данного препарата возможно добиться длительной ремиссии.
L-изолейцил-L-глутамил-L-триптофана натриевая соль (стемокин) –синтетический трипептид, состоящий из L-аминокислотных остатков изолецитина, глютамина и триптофана. В основе механизма действия L-изолейцил-L-глутамил-L-триптофаной натриевой соли лежит прямое воздействие препарата на процесс пролиферации и дифференцировки ранних клеток-предшественников гемопоэза, регуляторное воздействие на реакции клеточного и гуморального иммунитета и неспецифическую резистентность организма. Препарат влияет на процессы дифференцировки лимфоидных клеток, индуцируя экспрессию дифференцировочных антигенов на лейкоцитах. На фоне лечения, в течение 7–10 дней, отмечалась достоверная нормализация измененных иммунологических показателей (относительного и абсолютного количества лимфоцитов, CD3+, CD8+, CD19+, CD16+ лимфоцитов, поглотительной способности моноцитов по отношению к St. aureus) и увеличение показателей спонтанной хемилюминесценции и аффинности к общей антигенной детерминанте антител, количества HLA-DR+ лимфоцитов.
Дезоксирибонуклеинат натрия (деринат). Препарат оказывает модулирующее влияние на клеточное и гуморальное звенья иммунной системы и неспецифическую резистентность организма, что приводит к оптимизации воспалительной реакции и специфического иммунного ответа на бактериальные, вирусные и грибковые антигены. Иммуномодулирующий эффект Дезоксирибонуклеината натрия обусловлен его способностью стимулировать В-лимфоциты, активизировать Т-хелперы и клетки моноцитарно-макрофагальной системы. Препарат ускоряет энергетический метаболизм внутри клетки, синтез РНК и ДНК. Активация клеточного иммунитета Дезоксирибонуклеинатом натрия повышает способность естественных киллеров воздействовать на клетки, пораженные вирусами, хламидиями, золотистым стафилококком, кишечной палочкой, хеликобактером и др. Дезоксирибонуклеинат натрия стимулирует репаративные и регенераторные процессы, также нормализует состояние организма при дистрофиях сосудистого происхождения, оказывает слабо выраженное антикоагулянтное действие.
Экстракт костного мозга телят (миелопид). При иммунных нарушениях, которые возникают и при фурункулезе, миелопид восстанавливает показатели В- и Т-систем иммунитета, стимулирует продукцию антител и функциональную активность иммунокомпетентных клеток и способствует восстановлению ряда других показателей гуморального звена иммунитета. Миелопид повышает функциональную активность лейкоцитов периферической крови. При наличии дисбаланса клеток CD8/CD4 в организме миелопид восстанавливает нормальное соотношение этих субпопуляций Т-лимфоцитов, что приводит к коррекции уровня антителообразования. В продуктивной фазе иммунного ответа миелопид индуцирует 2–3-кратное увеличение продукции иммуноглобулинов, усиливает фагоцитоз макрофагами и нейтрофилами, коррегирует некоторые врожденные и приобретенные дефициты Т- и В-системы иммунитета. Доказана способность миелопида коррегировать дифференцировку кроветворных клеток-предшественников у мышей с экспериментальным Т-иммунодефицитом. При изучении действия миелопида на иммунный гомеостаз показано, что данный иммуностимулятор активирует преимущественно гуморальные иммунные реакции. В последние годы выделены и структурно охарактеризованы 6 типов миелопидов (МП-1, МП-2 и др.), каждый из которых действует на определенные показатели неспецифической резистентности организма и системы иммунитета.
Вывод. Несмотря на значительные успехи, достигнутые в области клинической иммунологии, эффективное лечение хронического фурункулеза остается достаточно сложной задачей. Необходим комплексный подход в лечении ХРФ. Иммуномодуляторы, являясь, частью терапии, обеспечивают повышение общей иммунной резистентности организма, тем самым поддерживая ремиссию и положительно влияя на эффективность лечения.
- Лусс Л. В. Полиоксидоний — современный препарат для эффективной иммунотропной терапии заболеваний, протекающих с дисфункциями иммунной системы.Эффективная фармакотерапия, 2015г.
- Хаитов Р. М., Пинегин Б. В. Иммуномодуляторы: механизм действия и клиническое применение. Иммунология, 2003г.
- Чурикова В. Ю., Оганесова И. Б. АКТУАЛЬНЫЕ МЕТОДЫ ЛЕЧЕНИЯ ФУРУНКУЛОВ ЛИЦА // Международный студенческий научный вестник. — 2016г.
- Сетдикова Н. Х., Латышева Т. В. Комплексные механизмы развития хронического рецидивирующего фурункулеза и пути их коррекции // Иммунология — 2000г.
- Камашева Г. Р. Иммуномодулирующая терапия при хроническом фурункулезе // Вестник современной клинической медицины — 2010г.
- Сорокина Е. В. Иммунотерапия в комплексном лечении пиодермий // Мед. иммунол. 2006г.
Основные термины (генерируются автоматически): натрий, неспецифическая резистентность организма, препарат, HLA-DR, антибактериальная терапия, длительность ремиссии, клетка, костный мозг телят, натриевая соль, периферическая кровь.

Аннотация: При хроническом фурункулёзе назначение Ликопид® значительно повышает уровень lgA, фагоцитарную активность нейтрофилов и содержание РОК. При остром фурункулезе оправдано применение миелопида в комбинации с антистафилококковым иммуноглобулином, что повышает число РОК и фагоцитарную активность нейтрофилов. Использование иммуностимуляторов разнонаправленного действия обосновано при различных формах фурункулеза: при хроническом процессе – Ликопид®, при остром – миелопид. Наличие параллелизма клинического и иммунологического эффектов может быть использовано для профилактики рецидивов фурункулеза.
Ключевые слова: фурункулёз, фагоцитарная активность нейтрофилов, рецидив, иммуностимулятор
Фурункулез относится к группе гнойничковых заболеваний и характеризуется множественным высыпанием фурункулов [1]. Возбудителем фурункулеза является стафилококк, который открыл Луи Пастер еще в 1880 г. Патогенез этого заболевания долгое время оставался неизученным. В элиминации внеклеточных паразитов, к которым относится стафилококк, главная роль принадлежит нейтрофилам, иммуноглобулинам и комплементу, причем гибель микроба происходит в нейтрофилах, которые фагоцитируют стафилококк, а комплемент и иммуноглобулины (опсонины) усиливают данный процесс [3]. С учетом этого в настоящее время наряду с базисной терапией фурункулеза широко используют иммунотропные препараты, к которым относятся препараты костномозгового происхождения, такие, как миелопид. а также выделенные из микробов, в частности новый препарат Ликопид®.
Задача настоящей работы состояла в сравнительной оценке клинико-иммунологической эффективности терапии больных острым и хроническим рецидивирующим фурункулезом новыми иммунотропными препаратами ликопидом, миелопидом и антистафилококковым иммуноглобулином. Выбор препаратов определялся их разнонаправленным действием на иммунологические показатели. Ликопид® (глюкозаминилмурамилдипептид - ГМДП) представляет собой синтетический вариант основного повторяющегося фрагмента стенки практически всех известных бактерий. Иммунотропный эффект препарата реализуется через действие на клетки моноцитарно-макрофагальной системы. Миелопид представляет собой смесь миелопептидов (МП), экстрагируемых из костного мозга, у 6 из которых установлена аминокислотная последовательность и изучены основные биологические эффекты. МП действуют на определенные субпопуляции Т-лимфоцитов (МП-1), стимулирует Т-хелперы, МП-2 влияют на экспрессию антигенов CD3 и CD4 на поверхности лимфоцитов [2]. Препарат оказывает быстрое иммунотропное действие за счет инъекционной формы. Антистафилококковый иммуноглобулин оказывает прямое этиотропное действие и вызывает антитоксический эффект.
Методика исследований
Обследовано 80 больных (56 мужчин и 24 женщины): 50 пациентов с острым фурункулезом и 30 пациентов с хроническим рецидивирующим фурункулезом.
Возраст больных составил от 15 до 50 лет; давность заболевания - от 1 года до 5 лет. У 68 больных фурункулы возникали перманентно, у 12 - не реже 1 раза в 2 - 3 мес. Лечение проводили амбулаторно с использованием миелопида, ликопида и антистафилококкового иммуноглобулина. Применяли две схемы лечения.
Схема №1. Миелопид применяли пс 6 мг ежедневно внутримышечно в течение 5 дней. Через 10 дней после окончания курса лечения миелопидом назначали антистафилококковый иммуноглобулин по 3 мл через день внутримышечно курсом 5 инъекций. После очередного 10-дневного перерыва повторяли первый курс миелопида.
Схема №2. Ликопид® назначали по 1 мг 3 раза в день сублингвально за I ч до еды в течение 10 дней. После окончания курса лечения ликопидом (без перерыва) назначали антистафилококковый иммуноглобулин по 3 мл через день внутримышечно курсом 5 инъекций. После 10-дневного перерыва назначали второй курс ликопида по I мл I раз в день сублингвально в течение 10 дней.
Критериями в выборе схемы лечения являлись
1) степень тяжести фурункулеза;
2) выраженность местной воспалительной реакции;
3) течение (острое или хроническое) и давность заболевания.
Иммунологический контроль осуществляли до и после лечения. Он включал в себя определение количества Т-лимфоцитов методом розеткообразования (РОК), уровня сывороточных иммуноглобулинов (в реакции Манчини), фагоцитарной активности нейтрофилов (в тесте с латексом).
Результаты и обсуждение
По схеме No 1 пролеченных больных с тяжелым течением фурункулеза, выраженной местной воспалительной реакцией, давностью заболевания от нескольких недель до 3 лет, частыми рецидивами. Лечение назначали в период обострения. У 50 (91%) больных за период лечения удалось избавиться от фурункулов, нормализовать самочувствие. У 5 (9%) больных после первого курса миелопида отмечались повышение температуры тела до фебрильных цифр, появление новых фурункулов. Этим пациентам дополнительно проводили антибактериальную терапию.
По схеме No 2 пролечено 25 больных с хроническим рецидивирующим фурункулезом, отсутствием выраженной воспалительной реакцией, редкими рецидивами, с давностью заболевания более 3 лет. Лечение назначали в период обострения. Положительный эффект отмечен у 24 (96%) больных. У 1 больной хроническим фурункулезом на фоне сахарного диабета, хотя полного выздоровления и не было достигнуто, в течение болезни наблюдалась положительная динамика (редкие рецидивы с легким и кратковременным течением).
Результаты лечения при использовании обеих схем считали положительными у тех больных, у которых рецидивы заболевания по окончании терапии отсутствовали в течение 6 мес. Рецидивы, возникавшие в течение первого месяца, не учитывали, так как у части больных мы наблюдали стойкое выздоровление лишь через некоторое время после лечения. Побочных эффектов при лечении иммунотропными препаратами не отмечалось.
Анализ динамики иммунологических показателей у больных фурункулезом (см. таблицу), леченных по схеме №1, выявил увеличение содержания РОК и повышение фагоцитарной активности нейтрофилов, у леченных по схеме №2 - повышение фагоцитарной активности нейтрофилов, увеличение численности РОК и концентрации 1дА.
Таким образом, в наших исследованиях установлено, что развитие клинического эффекта при использовании иммунотропных препаратов сопровождается нормализацией лабораторных показателей.
Выводы
1. При хроническом фурункулезе назначение ликопида значительно повышает уровень IgA, фагоцитарную активность нейтрофилов и содержание РОК.
2. При остром фурункулезе оправдано применение миелопида в комбинации с антистафилококховым иммуноглобулином, что повышает число РОК и фагоцитарную активность нейтрофилов.
3. Использование иммуностимуляторов разнонаправленного действия обосновано при различных формах фурункулеза: при хроническом процессе - ликопид, при остром - миелопид.
4. Наличие параллелизма клинического и иммунологического эффектов может быть использовано для профилактики рецидивов фурункулеза.
Таблица. Динамика иммунологических показателей в процессе лечения больных фурункулезом (М ± т).
Для цитирования: Чадаев А.П., Нурписов А.М., Пичугин А.В., Атауллаханов Р.И. Иммуномодуляторы «Иммуномакс» и «Гепон» в комплексном лечении больных острой гнойной хирургической инфекцией. РМЖ. 2004;24:1427.

Литература
1. Атауллаханов Р.И., Холмс Р.Д., Катлинский А.В., Дерябин П.Г., На-
ровлянский А.Н., Мезенцева М.В., Ершов Ф.И. Иммуномодулятор «Гепон» подавляет репликацию вируса гепатита С в культуре клеток человека in vitro. – Антибиотики и химиотерапия, 2002, том 47, №8, 9–11.
2. Атауллаханов Р.И., Холмс Р.Д., Катлинский А.В., Пичугин А.В., Па-
пуашвили М.Н., Шишкова Н.М. Лечение иммуномодулятором «Гепон» повышает эффективность иммунного контроля оппортунистических инфекций у больных ВИЧ–инфекцией. – Аллергия, астма и клиническая иммунология,2002, №10, 3–11.
3. Бардычев М.С. Лечение местных лучевых повреждений. – Лечащий врач, 2003, №5, 78–79.
4. Бардычев М.С., Терехов О.В., Белая Н.С. Терапевтическая эффектив-
ность гепона в лечении лучевых циститов. – Лечащий врач, 2003, №10,
с.61.
5. Баринский И.Ф., Алимбарова Л.М., Лазаренко А.А., Атауллаханов
Р.И. Противовирусная активность пептидного иммуномодулятора «Гепон» при экспериментальных инфекциях, вызванных вирусами простого герпеса типов 1 и 2. – Вопросы вирусологии, 2003, №5, 30–33.
6. Горбарец И.П., Воронкова Н.В., Лопатина Т.В., Ивановская В.Н.,
Брагинский Д.М., Блохина Н.П., Малышев Н.А. Сочетанное применение
препарата «Гепон» и рекомбинантного интерферона–альфа у больных хроническим гепатитом С повышает эффективность противовирусного лечения и уменьшает побочные эффекты терапии. – Гепатология, 2003, №4, 1–7.
7. Грибенча С.В., Холмс Р.Д., Атауллаханов Р.И., Баринский И.Ф. Про-
тивовирусная активность пептидного иммуномодулятора «Гепон» в экспериментах на модели уличного вируса бешенства. – Вопросы вирусологии, 2003, №4, 40–44.
8. Дудченко М.А., Лысенко Б.Ф., Челишвили А.Л., Катлинский А.В., Ата-
уллаханов Р.Р. Комплексное лечение трофических язв. – Лечащий врач,
2002, №10, 72–75.
9. Исаенко Т.П., Бибичева Т.В., Силина Л.В. Гепон в комплексной те-
рапии урогенитальной мико–уреаплазменной инфекции у женщин. – Вест-
ник последипломного медицинского образования, 2003, №1, 52–53.
10. Катлинский А.В., Атауллаханов Р.И., Холмс Р.Д., Наровлянский
А.Н., Мезенцева М.В., Щербенко В.Э., Ершов Ф.И. «Гепон» и его стру-
ктурные гомологи оказывают противовирусное действие в культуре кле-
ток человека, инфицированных вирусом энцефаломиокардита. – Аллергия, астма и клиническая иммунология, 2002, №9, 23–25.
11. Кладова О.В., Ф.С.Харламова, А.А.Щербакова, Т.П.Легкова,
Л.И.Фельдфикс, А.А.Знаменская, Г.С.Овчинникова, В.Ф.Учайкин. Первый
опыт интраназального применения гепона у детей с респираторными ин-
фекциями. – Педиатрия, 2002, №2, 86–88.
12. Холмс Р.Д., Атауллаханов Р.И., Катлинский А.В., Папуашвили М.Н.,
Пичугин А.В. Активация образования антител к антигенам ВИЧ при ле-
чении больных ВИЧ–инфекцией иммуномодулятором «Гепон». – Аллергия, астма и клиническая иммунология, 2002, №10, 12–16.
13. Шаков И.М. Наружное лечение рецидивирующего генитального герпе-
са препаратом «Гепон». – Вестник последипломного медицинского обра-
зования, 2003, №1, 51–52.
14. Чередниченко Т.В., Учайкин В.Ф., Чаплыгина Г.В., Курбанова Г.М.
Новое эффективное лечение вирусных гепатитов. – Лечащий врач, 2003,
№1, 82–83.
15. Новокшонов А.А., Учайкин В.Ф., Соколова Н.В., Курбанова Г.М., Га-
леева Е.В., Портных О.Ю. Роль иммуномодулятора гепон в комплексной
терапии острых кишечных инфекций у детей. – Лечащий врач, 2003, №6,
76–77.
16. Парфенов А.И., Ручкина И.Н. Активатор местного иммунитета Гепон
в комплексной терапии дисбиотических нарушений кишечника. – Экспери-
ментальная и клиническая гастроэнтерология, 2003, №3, 66–69.
17. Полякова Т.С., Артемьев М.Е. Применение гепона для лечения
ЛОР–патологий. – Московский медицинский журнал, май 2003, 16–17.
18. Полякова Т.С., Магомедов М.М., Артемьев М.А., Суриков Е.В., Паль-
чун В.Т. Новый подход к лечению хронических заболеваний глотки. –
Лечащий врач, 2002, №4.
19. Баткаев Э.А., Рюмин Д.В., ШаковИ.М. Иммуномодулятор «Гепон» в лечении герпетической и кандидозно–трихомонадной инфекций урогенитального тракта. – Русский медицинский журнал, 2003, том 11, №17, 962–963.
20. Тищенко А.Л. Новый подход к лечению рецидивирующего урогенитального кандидоза. – Гинекология, 2001, том 3, №6, 210–212.
21. Уварова Е.В. Кандидный вульвовагинит в практике детского гине-
колога. – Русский медицинский журнал, 2002, №18.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Читайте также: