Какие белки образуют тонофиламенты эпителиальных клеток
Обновлено: 22.04.2024
Промежуточные филаменты названы так потому, что их диаметр составляет около 10 нм, что является промежуточной величиной между диаметром микрофиламентов (6 нм) и микротрубочек (25 нм). В отличие от микрофиламентов и микротрубочек они являются не молекулярными полимерами, а поликонденсатами фибриллярных мономеров. Промежуточные филаменты обнаружены во всех клетках животных, но особенно много их в покровном эпителии, нервной и мышечных тканях.
В центральной части молекулы белков промежуточных филаментов содержится одинаковая аминокислотная последовательность из 130 остатков, формирующая a-спираль. Тем не менее, эти белки обладают выраженной тканевой специфичностью, которая определяется концевыми участками их молекул. Сборка филаментов происходит путем упорядоченной конденсации a-спиральных структур.
Белки промежуточных филаментов принадлежат к одной из четырех различных групп – кератинам, белкам мезенхимных клеток, белкам нейрофибрилл и ламинам.
Кератины представляют собой семейство фибриллярных белков с молекулярной массой 40–70 кД, специфичных для эпителиальных клеток. Отдельные белки, которых в семействе около тридцати, лишь незначительно отличаются по аминокислотной последовательности, но их комплексы могут формировать различные супрамолекулярные структуры, которые придают эпителиальным клеткам различные физико-химические свойства. В частности, именно кератины обеспечивают механические свойства волос, ногтей, перьев и других производных эпидермиса у позвоночных животных.
Белки промежуточных филаментов клеток мезенхимального происхождения представлены виментином клеток соединительной ткани, эндотелия сосудов и крови, десмином (скелетином) мышечных тканей и глиальным кислым фибриллярным белкомастроцитов и других клеток нейроглии. Эти белки имеют молекулярную массу 53-58 кД и формируют в клетках опорные структуры. В частности, десмин входит в состав Z-пластинок, к которым прикреплены актиновые нити в сократительных органоидах мышечных волокон – миофибриллах.
К белкам нейрофиламентов относятся три полипептида с молекулярной массой 68, 145 и 220 кД. Они вместе с микротрубочками входят в состав характерных для нервных клеток структур – нейрофибрилл, которые участвуют в формировании системы внутриклеточного транспорта в теле нейрона и его отростках.
Промежуточные филаменты цитоплазмы локализуются в основном вокруг клеточного ядра, а также образуют пучки, идущие от ядра на периферию клетки. Распределение промежуточных филаментов в клетке в значительной степени совпадает с распределением микротрубочек, что отражает их совместное участие во внутриклеточных транспортных системах.
В отличие цитоплазматических белков, образующих фибриллы, локализованные в клеточном ядре ламины A, B и C (молекулярная масса 60-70 кД) собраны в прямоугольные решетки. Сформированный ими остов, или ядерный матрикс, контактирует с внутренней мембраной нуклеолеммы, обеспечивая поддержание размеров и формы клеточного ядра. Ядерный матрикс из ламинов служит также опорной структурой для хромосом. При митозе или мейозе ламины фосфорилируются киназами клеточного деления, что приводит к их деполимеризации и распаду нуклеолеммы на отдельные рассеянные по цитоплазме пузырьки. В конце деления активируются фосфатазы, обеспечивающие полимеризацию ламинов и восстановление ядерного матрикса и нуклеолеммы.
• Промежуточные филаменты представляют собой основные компоненты ядерного и цитоплазматического цитоскелета
• Промежуточные филаменты необходимы для поддержания правильной структуры тканей и их функционирования
• По диаметру промежуточные филаменты находятся между актиновыми филаментами и микротрубочками и образуют прочные сети
• Промежуточные филаменты представляют собой полимеры, состоящие из белковых субъединиц
• Белки, из которых состоят промежуточные филаменты, гетерогенны и кодируются семейством больших и сложно устроенных генов
• У человека более 50 болезней обусловлены возникновением мутаций в белках промежуточных филаментов
Микротрубочки, актиновые филаменты (микрофиламенты) и промежуточные филаменты представляют собой три основные системы белковых филаментов, составляющих цитоскелет. Промежуточные филаменты образуют в цитоплазме и ядре сеть и присутствуют во всех клетках метазоа (животных).
В отличие от микротрубочек и актиновых филаментов, которые необходимы даже для выживания изолированных клеток in vitro, основная функция промежуточных филаментов проявляется на уровне тканевой организации, где они необходимы для надлежащего функционирования тканей и органов. Некоторые типы промежуточных филаментов участвуют в скреплении клеток друг с другом, что необходимо для формирования тканей.
Белки промежуточных филаментов кодируются несколькими большими семействами генов. Эти белки образуют сложную систему филаментов, на долю которых в клетке в нормальных физиологических условиях приходится до 80% общего клеточного белка. Внутриклеточное распределение промежуточных филаментов отличается от характерного для актиновых филаментов и микротрубочек.
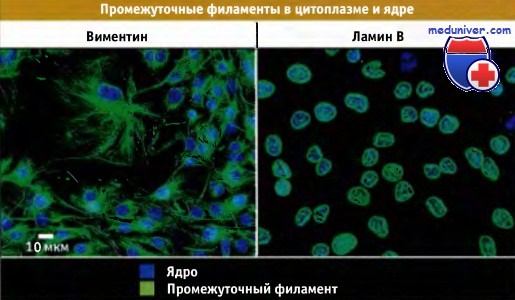
Распределение различных типов промежуточных филаментов в культивируемых фибробластах.
Иммунофлуоресцентное окрашивание на виментин и ламин В. Виментин находится в цитоплазме, а ламины в ядре.
Гистологи обнаружили их (в виде нейрофибрилл нейронов и тонофиламентов клеток эпидермиса) задолго до того, как в 1960-х гг. при электронно-микроскопическом исследовании мышечной ткани были описаны индивидуальные филаменты. В клетках мышц «промежуточные» филаменты занимали по диаметру среднее положение между «толстыми филаментами» миозина-II и «тонкими филаментами» актина. Их средний диаметр составляет около 10 нм, т. е. они толще, чем актиновые филаменты (около 8 нм), и тоньше микротрубочек (около 25 нм). Все три системы филаментов представлены рисунке ниже.
Белки промежуточных филаментов характеризуются общей молекулярной структурой и полимеризуются в филаменты, обладающие высокой механической прочностью. В электронном микроскопе они выглядят одинаково. У высших позвоночных семейство соответствующих белков организовано наиболее сложно, и этот вопрос будет рассмотрен в настоящей главе.
Похожие промежуточные филаменты также обнаружены у беспозвоночных, однако у них количество генов, кодирующих соответствующие белки, значительно меньше, чем у позвоночных. Также промежуточные филаменты беспозвоночных менее гетерогенны и обладают меньшей тканевой специфичностью, чем у млекопитающих. В геноме человека находится порядка 70 генов, кодирующих белки промежуточных филаментов. Принимая во внимание альтернативный сплайсинг для пары из них, общее количество этих белков приближается к 75.
Они представлены гораздо большим числом вариантов и более гетерогенны, чем актиновые или тубулиновые белки. Для всех белков промежуточных филаментов характерна тканеспецифическая экспрессия. Также их экспрессия изменяется в процессе дифференцировки.
Большинство сведений, касающихся экспрессии и биохимических свойств промежуточных филаментов, были получены до того, как были установлены их функции и связь с некоторыми заболеваниями. Сейчас показано, что мутации в генах белков промежуточных филаментов связаны с многими генетическими заболеваниями, которые характеризуются различными фенотипическими проявлениями. Они включают по меньшей мере 50 отдельных болезней, от фликтены до прогерии.
Почти все типы генов белков промежуточных филаментов связаны с той или иной формой проявления хрупкости тканей. Это позволяет предполагать, что для функционирования ткани in vivo необходима надлежащая механическая прочность и что в значительной степени она прямо или опосредованно связана с промежуточными филаментами. Принимая во внимание, что экспрессия генов белков промежуточных филаментов носит тканеспецифический характер, весьма возможно, что все эти белки придают клеткам тканей мельчайшие оттенки различия. Клеткам тканей необходимы различные свойства, такие как прочность, пластичность, быстрота сборки и разборки структур, обеспечивающих прочность.
Может быть, в этом кроется причина того, что в ходе эволюции возникло столь много генов, кодирующих белки промежуточных филаментов.

Основные компоненты цитоскелета в электронном микроскопе.
На ультратонком срезе клетки эпителия почки видны актиновые микрофиламенты, промежуточные филаменты К8/К18 и микротрубочки.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
• Некоторые белки промежуточных филаментов, относящиеся к типу III и IV, ко-экспрессируются в разных тканях
• Многие белки типа III и IV образуют друг с другом сополимеры
• Совместная экспрессия множественных типов белков промежуточных филаментов может маскировать эффект мутаций в белке, принадлежащим к одному из типов
• Десмин представляет собой необходимый белок мышц
• Виментин часто экспрессируется в одиночных клетках
• Мутации в генах белков типа III или IV обычно связаны с мышечными или неврологическими расстройствами, носящими дегенеративный характер
В таблице ниже перечислены гомологичные некератиновые белки промежуточных филаментов, которые относятся к группам III—IV. В данной статье мы рассмотрим белки промежуточных филаментов, относящихся к типам III и IV. Эти типы различаются по принципу гомологии по определенным последовательностям. К белкам III типа относятся десмин, виментин, фибриллярный кислый белок глиального происхождения (GFAP, фибриллы которого представлены на рисунке ниже) и периферии.
Эти белки дифференциально экспрессируются в клетках соединительной ткани, мышц, в нейронах и некоторых других дифференцированных клетках. Их экспрессия индивидуально регулируется для каждого белка и тесно связана со специфическими процессами дифференцировки. Некоторые из этих белков одинаково экспрессируются в разных тканях, а другие могут образовывать друг с другом сополимеры. Однако они никогда не образуют таких комплексов с кератинами (тип I/II) или с ламинами (тип V).
Так же как и для других белков промежуточных филаментов, мы пока точно не знаем, каким образом вариации в аминокислотной последовательности этих белков связаны с их специфическими функциями в клетках различных типов, хотя мутации в них хорошо коррелируют с различными нарушениями в функционировании соответствующей ткани.
Десмин представляет собой белок, необходимый для функционирования клеток мышц всех типов (поперечнополосатых, сердечной и гладких); подобно кератину эпителиальных клеток, десмин обеспечивает упругость ткани при физических воздействиях. Десминовые филаменты проходят между точками скрепления сократительных структур (например, саркомер поперечнополосатых мышц). Эти места в клетках мышц являются сайтами приложения значительных механических усилий. Поэтому десмин можно рассматривать как белок, обеспечивающий устойчивость мышечных клеток к механическому воздействию.
Такая точка зрения возникла после того, как оказалось, что ткани, в клетках которых десмин отсутствует или находится в мутантной форме, теряют способность противостоять механическим воздействиям. Десмин образует комплексы с другими белками типа III; в некоторых клетках он сополимеризуется также с белками типа IV.
В отличие от десмина, который экспрессируется в тканях состоящих из плотных агрегатов клеток, таких как мышечная и эпителиальная, экспрессия виментина типична для клеток, которые функционируют изолированно, или в виде рыхло-связанных клеточных ассоциатов или слоев. В процессе развития виментин экспрессируется после кератинов и остается во многих мезенхимальных и соединительнотканных клетках взрослого организма, от фибробластов до кроветворных клеток и клеток эндотелия сосудов, а также некоторых видов эпителия.
Астроциты и глиальные клетки представляют собой клетки центральной нервной системы, отличные от нейронов. Они необходимы для роста, дифференцировки и регенерации последних. Все астроглиальные клетки экспрессируют GFAP, который обычно экспрессируется вместе с виментином или белком нестином, относящимся к группе IV. Такая совместная экспрессия защищает клетки от последствий мутаций или утраты одного из генов. Эксперименты по двойному нокауту генов, проведенные на животных, показали, что эти промежуточные филаменты типа III необходимы для нормального функционирования астроцитов в центральной нервной системе.
Эти клетки необходимы для заживления ран и развития устойчивости к осмотическому шоку. Для нормального функционирования астроцитам необходимо сформировать отростки, которые при отсутствии промежуточных филаментов несут различные дефекты.
Периферии, главным образом, экспрессируется в клетках периферической нервной системы. При формировании аксонами отростков они вначале синтезируют периферии и виментин; затем этот синтез сменяется экспрессией триплета белков нейрофиламентов (NF-L, NF-M, и NF-H). Впрочем, после повреждения нервной ткани экспрессия периферина быстро возобновляется. По-видимому, для нормального выполнения белком своих функций важен его уровень. Так, в экспериментах на животных показано, что слишком высокое содержание периферина приводит к летальным последствиям, а его отсутствие — к утрате некоторых небольших сенсорных аксонов.
Филаменты астроцитов спинного мозга, состоящие из глиального фибриллярного кислого белка (GFAP).
В настоящее время гомологичный тип IV включает триплет белков нейрофиламентов низкой, средней и высокой молекулярной массы (NF-L, NF-M и NF-H), а также а-интернексин, нестин, синкоилин и синемин. В тканях большинство белков типа IV присутствуют в гетерополимерной форме, и гораздо более эффективно образуют сополимеры с белками типа III или другими белками, относящимися к типу IV. В зрелых нейронах, белки триплета нейрофиламентов почти всегда экспрессируются вместе, в то время как синкоилин и два продукта альтернативного сплайсинга синемина (а и b) преимущественно экспрессируются в клетках мышц и сополимеризуются с белками группы III.
Согласно иммуногистохимическим данным, синкоилин и синемин, так же как и десмин, локализованы в мышечных клетках, в точках приложения нагрузки. Возможно, что эти белки промежуточных филаментов тоже обеспечивают устойчивость клеток к нагрузкам.
Необычайная длина аксональных выростов в нейронах (у нейронов седалищного нерва человека она может достигать 1 м) свидетельствует о важности поддержания соответствующего уровня экспрессии белков нейрофиламентов, необходимых для укрепления цитоплазмы. В процессе развития экспрессия нейрофиламентов происходит по сложной программе, которая включает одновременный синтез многих белков. Соответствующие профили накладываются и смещаются относительно друг друга. Таким образом, нейроны постоянно экспрессируют промежуточные филаменты. Первым экспрессируются нестин и виметин. (Подобно GFAP астроглии, при раневых повреждениях нейрональный нестин может экспрессироваться повторно.)
По мере удлинения выростов, доминирующим становится синтез а-интернексина, который сменяется NF-L, и наконец, происходит экспрессия крупных белков нейрофиламентов. В стабилизации сформировавшихся аксонов и нейритов важную роль играет триплет белков нейрофиламентов.
У нескольких белков, относящихся к группе IV, имеются длинные хвостовые домены, которые участвуют в организации каркасных структур цитоплазмы. В хвостовом домене NF-H присутствует ряд повторов, представляющих собой последовательность Lys-Ser-Pro, которая является сайтом фосфорилирования. Когда происходит фосфорилирование этих повторов, хвостовой домен приобретает высокий положительный заряд и ориентируется под прямым углом к оси филамента. Это способствует растяжению цитоплазмы аксона. У мышей число аксонов и их диаметр коррелирует с уровнем экспрессии белков нейрофиламентов.
Большему диаметру аксона соответствует более быстрая проводимость нервного импульса, что является особенно важным фактором в эволюции крупных по размеру тел позвоночных.
Мутации в генах белков группы III связаны с развитием многочисленных патологических состояний, механизм которых в некоторых случаях удалось выяснить в экспериментах на животных. У человека мутации в генах GFAP связаны со смертельным нейродегенеративным заболеванием, болезнью Александера. В экспериментах на животных показано, что в отсутствие GFAP наблюдается аномальная реакция астроглии на повреждения, и астроциты не образуют цитоплазматических выростов. В десмине обнаружено много патологических мутаций, которые происходят в разных участках белковой структуры.
У человека мутации в гене десмина связаны с дефектами сердечно-сосудистой системы, в особенности с развитием сердечной недостаточности на почве дилатационной кардиомиопатии, а также с некоторыми формами мышечной дистрофии. У мышей при отсутствии десмина стенки важнейших кровеносных сосудов становятся слишком мягкими и не могут поддерживать надлежащий уровень кровяного давления. Это вызывает растяжение уже ослабленного сердца, что приводит к дилатационной кардиомиопатии. При многих десминовых миопатиях в мышечных клетках обнаруживаются агрегаты этого белка, напоминающие кератиновые агрегаты, видимые в кератиноцитах больных с тяжелой формой EBS.
С мутациями в виментине не связано ни одно из известных заболеваний, что, по-видимому, отражает его способность экспрессироваться вместе с другими белками филаментов.
Почти все мутации в белках нейрофиламентов, относящихся к типу IV, локализованы в головном или хвостовом домене. Они связаны с такими нейродегенеративными заболеваниями, как амиотрофный латеральный склероз, Charcot-Marie-Tooth типа 1 и 2Е и болезнь Паркинсона. Большая длина цитоплазмы нейрона делает ее уязвимой к воздействиям различного рода, а не только к связанным с ее повышенной хрупкостью. Белки нейрофиламентов образуются в клетке и затем с помощью белковых моторов микротрубочек транспортируются по аксонам.
Сплетения нейрофибрилл служат общим показателем нейродегенеративного процесса. Они представляют собой внутриклеточные скопления нейрофиламентов, однако неизвестно, являются ли они причиной возникновения патологии. Эти сплетения могут возникать вследствие воздействий других факторов, влияющих на транспорт в аксонах, например такого, как нарушение функционирования микротрубочек По сравнению с кератинами, при развитии заболеваний, мутации в белках нейрофиламентов гораздо труднее поддаются причинно-следственному анализу.
«Кератинопатии» обычно проявляются при рождении или вскоре после него, в то время как большинство нейродегенеративных заболеваний развиваются поздно, что затрудняет проведение генетических исследований.
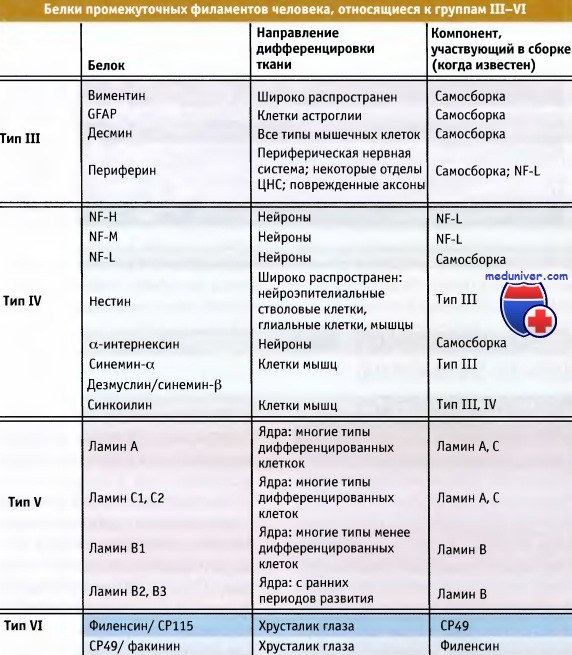
Белки промежуточных филаментов человека, объединенные в типы III—IV по принципу гомологии.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
• Все белки промежуточных филаментов обладают одинаковым строением и имеют общий элемент, представляющий собой центральный стержнеобразный а-спирализованный домен
• Семейство белков промежуточных филаментов подразделяется на шесть групп, представители каждой из которых содержат гомологичную последовательность аминокислот
• Различные типы промежуточных филаментов характеризуются разным типом экспрессии в тканях
• Антитела к индивидуальным белкам промежуточных филаментов представляют собой ценные инструменты для исследования дифференцировки клеток и различных патологических процессов
На основании структуры ДНК и степени гомологии аминокислотных последовательностей семейство белков промежуточных филаментов подразделяется на шесть групп. Существование этих групп может говорить о тканеспецифической экспрессии белков. Почти все белки промежуточных филаментов обладают сходным строением, и их молекулы построены по общему принципу. Все они собираются в филаментарные структуры, диаметр которых по данным электронной микроскопии составляет порядка 10 нм.
Их молекулы имеют удлиненную форму и содержат длинный стержнеобразный а-спиральный домен, ограниченный не организованными в спираль головными и хвостовыми доменами. Стержнеобразный домен имеет четыре а-спиральных сегмента (1А, 1B, 2А и 2В), которые разделены «линкерными» участками (L1, L12 и L2). На основании первичной структуры считают, что эти линкеры не образуют спиральную конфигурацию. Длина стержнеобразного домена промежуточных филаментов у всех клеток.млекопитающих примерно одинакова (около 350 аминокислот). Молекулярная масса большинства белков промежуточных филаментов находится между 40 и 70 кДа.
На границах стержнеобразного домена промежуточных филаментов находятся консервативные последовательности аминокислот. Последние 12 остатков аминокислот стержнеобразного домена представляют собой спирализованный терминальный мотив, обычно имеющий структуру Glu-Ile-Ala-Thr-Tyr-Arg-(X)-Leu-Leu-Glu-Gly-Glu (где X — любая аминокислота). Эта последовательность является сигнальной и присутствует во всех белках промежуточных филаментов. Самое начало спирализованной последовательности, расположенной на N-конце стержнеобразного домена, более вариабельно по своей структуре.
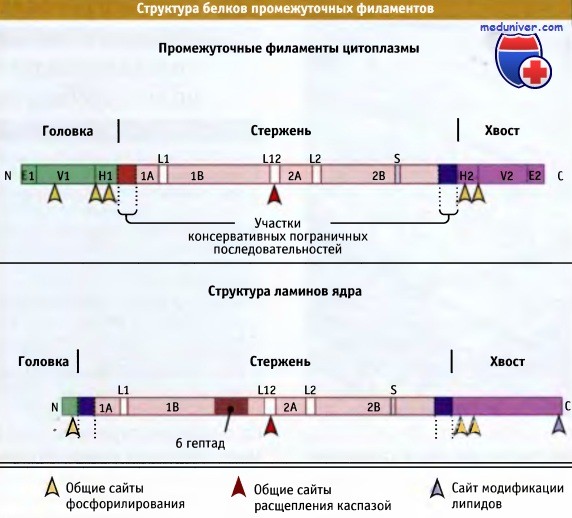
Общая структура белков промежуточных филаментов человека, построенная по данным секвенирования.
Все белки промежуточных филаментов имеют центральный стержневой домен и боковые головной и хвостовой домены.
Этот тип общей структуры лучше всего соответствует белкам типов II, III, и VI.
У белков типа I отсутствуют области Н1/Н2, а у белков типа V нет доменов E/V.
Для белков ламины позвоночных и филаментов беспозвоночных показано наличие дополнительных аминокислот, удлинняющих стержневой домен.
Стрелками отмечено положение сайтов фосфорилирования (в молекулах некоторых белков промежуточных филаментов присутствуют дополнительные сайты фосфорилирования),
сайты атаки каспаз и общие сайты модификации ламинарных липидов.
Консервативность структуры этих двух спирализованных пограничных последовательностей позволяет предполагать, что они имеют особое функциональное значение, и существует много экспериментальных данных в пользу того, что они могут являться местами связи при взаимодействии белковых субъединиц в процессе сборки филаментов. Мутации в этих доменах характеризуются разрушительным действием и вызывают развитие тяжелых патологий. К числу двух других характерных особенностей последовательности стержнеобразного домена относится нерегулярность цепи 2В, получившей название «запинание» (S на рисунке ниже), и вставки кластеров аминокислот, несущих положительный и отрицательный заряд. Эти кластеры расположены вдоль поверхности а-спирали, повторяясь через каждые 9,5 остатков. Они участвуют в латеральных взаимодействиях доменов стержнеобразной структуры при сборке филаментов.
По сравнению со стержнеобразными доменами, структура N-концевого головного и С-концевого хвостового доменов гораздо более вариабельна. Это относится и к длине, и к первичной структуре. Обычно в каждом из концевых доменов различают три различных субдомена: крайний, концевой домен (Е1 или Е2), вариабельная область, содержащая повторы, богатые глицином и серином (VI в головной части и V2 в хвостовой), и гипервариабельная область (Н1 или Н2). У многих белков промежуточных филаментов концевые домены содержат сайты фосфорилирования, участвующие в сборке и разборке самих филаментов.
Третичная структура головных и хвостовых доменов известна не полностью, однако их конфигурация, вероятно, меняется по мере сборки молекулы белка. Головной домен необходим для сборки филаментов, однако роль хвостового домена представляется менее ясной, поскольку некоторые белки промежуточных филаментов его не содержат.
Шесть групп семейства промежуточных филаментов обозначаются как I-VI группы гомологичных последовательностей. Такое разделение основано на сходстве ДНК, аминокислотной последовательности и структуре гена. Первыми белками промежуточных филаментов, для которых была установлена первичная структура, были кератины волос («тип I») и шерсти («тип II»). Белки I и II типа перечислены на рисунках ниже.
Степень гомологии между генами белков одной и той же группы составляет около 60%, однако в некоторых случаях она может быть свыше 95%. Между генами разных групп гомология снижается до 20%. Степень гомологии между стержнеобразными доменами обыкновенно выше для белков, относящихся к одной и той же группе. Особенно это проявляется для последовательностей, расположенных на границе спирализованных участков. Головные и хвостовые домены обнаруживают большую вариабельность, и часто отмечается большее сходство между белками филаментов, с одинаковым характером экспрессии, чем между белками, принадлежащими к одной и той же гомологичной группе. Строение концевых доменов также может быть совершенно различно: кератины типа I имеют короткие домены Н1 и Н2, или вовсе не имеют их. В то же время белки типа IV не обладают субдоменами E1/V1 и E2/V2.
Перечисленные гомологичные группы белков хорошо совпадают с четко выраженным тканеспецифическихм характером экспрессии белков промежуточных филаментов и с их эволюционной историей. Белки, относящиеся к группе I и группе II, представляют собой кератины, которые экспрессируются в эпителии и на долю которых приходится 54 из 70 генов белков промежуточных филаментов человека. Белки III группы включают четыре родственных белка, каждый из которых специфичен для определенного типа клеток.
В IV группе находится семь белков нейрофиламентов, а в V широко распространенные белки ядерной ламины, гены которых с эволюционной точки зрения относятся к самой древней группе генов белков промежуточных филаментов. К VI группе относятся два различных белка филаментов глазного хрусталика, которые не могут быть отнесены к другим группам.
Между отдельными белками каждой группы проявляется тканевая специфичность. Также некоторые белки промежуточных филаментов экспрессируются при воспалительных и раневых процессах. По-видимому, промежуточные филаменты представляют на сегодняшний день наиболее надежные маркеры дифференцировки клеток и тканей. Для оценки степени дифференцировки, которая необходима для исследований по биологии клетки и различных патологических состояний, широко используются антитела к белкам промежуточных филаментов. Исследование тканеспецифической экспрессии белков промежуточных филаментов позволяет проследить их участие в процессах развития и дифференцировки. Обычно характер экспрессии сохраняется даже в случае метастазирующих опухолей.
Процесс аномальной дифференцировки, который часто может быть обнаружен по характеру экспрессии белков промежуточных филаментов, служит ранним показателем протекания в организме серьезных патоологических процессов. Характерной особенностью белков промежуточных филаментов является их тканевая специфичность, которая в большей степени, чем все другие их свойства, способствовала исследованиям этих основных структурных белков. Эти исследования проводились до момента установления их связи с развитием различных заболеваний.
По степени гомологии гены белков промежуточных филаментов можно разделить на шесть групп.
Гены, относящиеся к группам I и II, составляют большинство генов белков промежуточных филаментов (показано в процентах). Белки промежуточных филаментов человека, относящиеся к гомологичной группе типа I (кератины типа I).
Белки сгруппированы в простые кератины (клетки простого эпителия), барьерные кератины (характерные для многослойного чешуйчатого эпителия и эпителия сложной структуры)
и в два типа структурных кератинов, связанных с эпидермальными элементами Белки промежуточных филаментов человека, относящиеся к гомологичной группе типа II (кератины типа II).
Белки сгруппированы в простые кератины (клетки простого эпителия),
барьерные кератины (характерные для многослойного ороговевающего эпителия и эпителия сложной структуры)
и в два типа структурных кератинов, связанных с эпидермальным элементами.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Промежуточные филаменты состоят из большой группы родственных белков, которую делят на четыре типа. Первый тип – кератины, кислые и нейтральные, встречающиеся в эпителиальных клетках; они образуют гетерополимеры из этих двух подтипов. Кератины, кроме того, имеют некоторую гетерогенность, зависящую от тканевого источника. Так, в эпителиях встречается до 20 форм кератинов, 10 форм других кератинов найдено в волосах и ногтях. Молекулярный вес кератинов колеблется от 40 до 70 тыс.
Второй тип белков ПФ включает в себя три вида белков, имеющих сходный молекулярный вес (45-53 тыс.). Это – виментин, характерный для клеток мезенхимного происхождения, входящий в состав цитоскелета клеток соединительной ткани, эндотелия, клеток крови. Десмин – характерен для мышечных клеток, как гладких, так и исчерченных. Глиальный фибриллярный белок входит в состав ПФ некоторых клеток нервной глии – в астроциты и некоторые Шванновские клетки. Периферин – входит в состав периферических и центральных нейронов.
Третий тип – белки нейрофиламентов (мол. вес от 60 до 130 тыс.) встречается в аксонах нервных клеток.
И наконец, четвертый тип – белки ядерной ламины. Хотя эти последние имеют ядерную локализацию, они сходны по строению и свойствам со всеми белками промежуточных филаментов.
Как уже говорилось, промежуточные филаменты, построены из фибриллярных белков наподобие каната. При этом некоторые белки могут образовывать сополимеры, например виментин с десмином, или виментин с глиальными белками.
Все белки промежуточных филаментов обладают сходной аминокислотной последовательностью из 130 остатков в центральной части фибриллярной молекулы, которая обладает a-спиральным строением. Концевые же участки молекул имеют разные последовательности аминокислот, разную длину, и не имеют a-спирального строения. Наличие протяженных a-спиральных участков позволяет двум молекулам образовывать двойную спираль, подобно тому, что приводит к образованию палочковидного димера, длиной около 48 нм. Два димера, объединяясь бок о бок, образуют короткий протофиламент, тетрамер, толщиной около 3 нм. Такие протофиламенты могут объединяться в более толстые и длинные фибриллы и в конечном итоге в промежуточный полный филамент, состоящий из 8 продольных протофиламентов (рис. 242).
Белки ядерной ламины образуют рыхлую прямоугольную решетку. Такие слои ламины быстро разрушаются во время митоза при фосфорилировании ламинов.
Цитоплазматические промежуточные филаменты относятся к самым стабильным и долгоживущим элементам цитоскелета.
Особенности строения и химическая устойчивость промежуточных филаментов определяет их физическую устойчивость. Они служат как бы истинно опорной системой в клетках подвергающихся значительным физическим нагрузкам. В клетках кожного эпидермиса промежуточные филаменты образуют пучки (тонофиламенты), связанные с десмосомами, и создают жесткую внутриклеточную сеть (рис. 243). Так, в нервных аксонах, простирающихся на многие десятки сантиметров, ПФ или нейрофиламенты создают жесткую основу, обеспечивающую гибкость и целостность тонких цитоплазматических отростков нервных клеток. В поперечно исчерченных мышечных клеток десминовые филаменты входят в состав z-дисков и связывают их друг с другом как в составе саркомера, так и в соседних миофибриллах, а также с плазматической мембраной.
Читайте также:

