Какие анализы сдать при фурункулезе у взрослых
Обновлено: 22.04.2024
Антибактериальные препараты из группы фторхинолонов занимают одно из ведущих мест в лечении различных бактериальных инфекций, в том числе в амбулаторных условиях. Однако столь популярные в настоящее время ципрофлоксацин, офлоксацин, ломефлоксацин
Антибактериальные препараты из группы фторхинолонов занимают одно из ведущих мест в лечении различных бактериальных инфекций, в том числе в амбулаторных условиях. Однако столь популярные в настоящее время ципрофлоксацин, офлоксацин, ломефлоксацин, пефлоксацин обладают высокой активностью в отношении грамотрицательных возбудителей, умеренной активностью против атипичных возбудителей и малоактивны в отношении пневмококков и стрептококков, что значительно ограничивает их применение, особенно при респираторных инфекциях.
В последнее десятилетие в клиническую практику стали входить новые препараты из этой группы — т. наз. новые фторхинолоны, которые сохраняют высокую активность против грамотрицательных возбудителей, свойственную их предшественникам, и при этом значительно более активны против грамположительных и атипичных микроорганизмов. Одним из таких препаратов является левофлоксацин (таваник). По химической структуре он представляет собой левовращающий изомер офлоксацина. Широкий спектр антибактериальной активности, высокая безопасность, удобные фармакокинетические свойства обусловливают возможность его широкого применения при различных инфекциях.
Механизм действия
Левофлоксацин обладает быстрым бактерицидным действием, поскольку проникает внутрь микробной клетки и подавляет, так же как и фторхинолоны первого поколения, ДНК-гиразу (топоизомеразу II) бактерий, что нарушает процесс образования бактериальной ДНК. Ферменты клеток человека не чувствительны к фторхинолонам, и последние не оказывают токсического действия на клетки макроорганизма. В отличие от препаратов прежнего поколения новые фторхинолоны ингибируют не только ДНК-гиразу, но и второй фермент, ответственный за синтез ДНК, — топоизомеразу IV, выделенную у некоторых микроорганизмов, прежде всего грамположительных. Считается, что именно воздействием на этот фермент объясняется высокая антипневмококковая и антистафилококковая активность новых фторхинолонов.
Левофлоксацин обладает клинически значимым дозозависимым постантибиотическим эффектом, достоверно более длительным по сравнению с ципрофлоксацином, а также длительным (2-3 часа) субингибирующим действием.
Под действием левофлоксацина отмечено повышение функции полиморфноядерных лимфоцитов у здоровых добровольцев и ВИЧ-инфицированных пациентов. Показано его иммуномодулирующее воздействие на тонзиллярные лимфоциты у больных хроническим тонзиллитом. Полученные данные позволяют говорить не только об антибактериальной активности, но и о синергическом противовоспалительном и антиаллергическом действии левофлоксацина.
Спектр антимикробной активности
Левофлоксацин характеризуется широким антимикробным спектром, включающим грамположительные и грамотрицательные микроорганизмы, в том числе внутриклеточные возбудители (табл. 1).
При сравнении эффективности различных антибактериальных препаратов в отношении возбудителей респираторных инфекций было выявлено, что левофлоксацин в отношении противомикробной активности превосходит остальные препараты. К нему оказались чувствительны все штаммы пневмококка, в том числе пенициллинрезистентные, при сравнительно более низкой чувствительности пневмококков к препаратам сравнения: офлоксацин — 92%, ципрофлоксацин — 82%, кларитромицин — 96%, азитромицин — 94%, амоксициллин/клавуланат — 96%, цефуроксим — 80%. К левофлоксацину оказались также чувствительны все штаммы моракселлы катаралис, гемофильной палочки и метициллин чувствительного золотистого стафилококка, 95% штаммов клебсиеллы пневмонии.
Резистентность
Возможность широкого клинического использования левофлоксацина и других новых фторхинолонов заставляет задуматься об опасности развития резистентности к ним. Хромосомные мутации являются основным механизмом, обеспечивающим устойчивость микробов к фторхинолонам. При этом происходит постепенное накопление мутаций в одном или двух генах и ступенчатое снижение чувствительности. Развитие клинически значимой резистентности пневмококков к левофлоксацину наблюдается после трех мутаций, а следовательно, представляется маловероятным. Это подтверждается и экспериментальными данными: левофлоксацин вызывал спонтанные мутации в 100 раз реже, чем ципрофлоксацин, независимо от чувствительности тестируемых штаммов пневмококка к пенициллину и макролидам. Широкое использование препарата в последние годы в США и Японии не привело к росту резистентности к нему. По данным K. Yamaguchi et al., 1999, чувствительность бактерий к левофлоксацину за пять лет, т. е. с момента начала его широкого применения, не изменилась и превышает 90% как для грамотрицательных, так и для грамположительных возбудителей.
Больший риск развития антибиотикорезистентности связан не с пневмококками, а с грамотрицательными бактериями. В то же время, по некоторым данным, применение левофлоксацина в отделениях интенсивной терапии не сопровождается значимым ростом резистентности грамотрицательной кишечной флоры.
Фармакокинетика
Левофлоксацин хорошо всасывается в желудочно-кишечном тракте. Его биодоступность составляет 99% и более. Так как левофлоксацин почти не подвергается метаболизму в печени, это способствует быстрому достижению максимальной его концентрации в крови (значительно более высокой, чем у ципрофлоксацина). Так, при назначении добровольцам стандартной дозы фторхинолона значения его максимальной концентрации в крови при приеме левофлоксацина составляли 2,48 мкг/мл/70 кг, ципрофлоксацина — 1,2 мкг/мл/70 кг.
После приема разовой дозы левофлоксацина (500 мг) его максимальная концентрация в крови, равная 5,1 ± 0,8 мкг/мл, достигается через 1,3-1,6 часа, при этом бактерицидная активность крови против пневмококков сохраняется до 6,3 часа независимо от их чувствительности к пенициллинам и цефалоспоринам. Более длительное время, до 24 часов, сохраняется бактерицидное действие крови на грамотрицательные бактерии семейства Enterobacteriacae.
Период полувыведения левофлоксацина составляет 6-7,3 часа. Около 87% принятой дозы препарата выделяется с мочой в неизмененном виде в течение последующих 48 часов.
Левофлоксацин быстро проникает в ткани, при этом уровни тканевых концентраций препарата выше, чем в крови. Особенно высокие концентрации устанавливаются в тканях и жидкостях респираторного тракта: альвеолярных макрофагах, слизистой бронхов, бронхиальном секрете. Левофлоксацин также достигает высоких концентраций внутри клеток.
Длительный период полувыведения, достижение высоких тканевых и внутриклеточных концентраций, а также наличие постантибиотического действия — все это позволяет назначать левофлоксацин один раз в сутки.
Лекарственные взаимодействия
Биодоступность левофлоксацина снижается при одновременном приеме с антацидами, сукральфатом, препаратами, содержащими соли железа. Интервал между приемом этих лекарственных средств и левофлоксацина должен составлять не менее 2 часов. Других клинически значимых взаимодействий левофлоксацина выявлено не было.
Клиническая эффективность
Существует много публикаций, посвященных результатам клинических исследований эффективности применения левофлоксацина. Ниже представлены наиболее значимых из них.
В многоцентровом рандомизированном исследовании, включившем 590 пациентов, сравнивалась эффективность и безопасность двух режимов лечения: левофлоксацина в/в и/или перорально в дозе 500 мг в сутки и цефтриаксона в/в 2,0 г в сутки; и/или цефуроксима перорально 500 мг два раза в сутки в комбинации с эритромицином или доксициклином у больных с внебольничной пневмонией. Длительность терапии 7–14 дней. Клиническая эффективность составила 96% в группе левофлоксацина и 90% в группе, получавшей цефалоспорины. Эрадикация возбудителей была достигнута соответственно у 98 и 85% больных. Частота нежелательных действий в группе левофлоксацина составляла 5,8%, а в группе сравнения 8,5%.
В другом большом рандомизированном исследовании сравнивалась эффективность лечения больных с тяжелой пневмонией левофлоксацином 1000 мг в сутки и цефтриаксоном — 4 г в сутки. Первые дни левофлоксацин назначили в/в, затем перорально. Результаты лечения в обеих группах оказались сопоставимы, но в группе цефтриаксона наблюдалась достоверно более частая смена антибиотика в первые дни лечения — из-за недостаточного клинического эффекта.
Сопоставимые результаты были получены и при сравнении групп пациентов, получавших лечение левофлоксацином и коамоксиклавом.
Эффективность монотерапии левофлоксацином изучалась у более чем 1000 пациентов с внебольничной пневмонией. Клиническая и бактериологическая эффективность составляли здесь 94 и 96% соответственно.
Фармакоэкономические исследования показали, что общие затраты на лечение пациентов левофлоксацином и комбинацией цефалоспорина и макролида сопоставимы или даже несколько ниже в группе левофлоксацина.
У пациентов с обострением хронического бронхита сравнивалась эффективность лечения левофлоксацином в дозе 500 мг в сутки перорально и цефуроксимом аксетила внутрь 500 мг два раза в сутки. При этом клиническая и бактериологическая эффективность не различалась в зависимости от групп и составляла 77–97%.
Таким образом, в настоящее время можно считать доказанной высокую эффективность левофлоксацина при респираторных инфекциях нижних дыхательных путей. Результаты проведенных исследований позволили включить левофлоксацин как препарат первого ряда или альтернативный в схему лечения пациентов с внебольничной пневмонией и обострениями хронического бронхита (табл. 2).
Среди возбудителей урологических инфекций наблюдается рост резистентности к широко используемым антибактериальным препаратам. Так, за период с 1992 по 1996 год отмечено увеличение устойчивости E. Coli и S. saprophyticus к котримоксазолу — на 8–16% и к ампициллину — на 20%. Устойчивость к ципрофлоксацину, нитрофуранам и гентамицину возрасла за этот же период на 2%. Применение левофлоксацина у пациентов с осложненными мочевыми инфекциями в дозе 250 мг в сутки оказалось эффективным у 86,7% пациентов.
Выше приводились фармакокинетические показатели высокого содержания левофлоксацина в тканях. Это наряду с антимикробным спектром препарата послужило основанием для его использования с целью профилактики инфекционных осложнений при эндоскопических методах лечения и диагностики, например при ретроградной холангиопанкреатографии и для периоперационной профилактики в ортопедии.
Применение левофлоксацина в этих ситуациях представляется перспективным и требует дальнейшего изучения.
Безопасность
Левофлоксацин считается одним из самых безопасных антибактериальных препаратов. Однако при его назначении существует ряд ограничений.
У пациентов с нарушением функции печени корригировать дозу препарата не нужно, но нарушение функции почек при снижении клиренса креатинина (менее 50 мл/мин) требует уменьшения дозы препарата. Дополнительный прием левофлоксацина после проведения гемодиализа или амбулаторного перитониального диализа не требуется.
Левофлоксацин не применяется у беременных и кормящих женщин, у детей и подростков. Препарат противопоказан пациентам, у которых в анамнезе имеются нежелательные реакции на лечение фторхинолонами.
У больных пожилого и старческого возраста при приеме левофлоксацина не выявлено повышенного риска развития нежелательных побочных реакций и не требуется коррекции доз.
Контролируемые клинические исследования показали, что побочные реакции при применении левофлоксацина возникают редко и большей частью не являются серьезными. Существует зависимость между дозой препарата и частотой развития НД: при суточной дозе 250 мг их частота не превышает 4,0–4,3%, при дозе 500 мг/ сут. — 5,3–26,9%, при дозе 1000 мг/сут. — 22–28,8%. Наиболее часто наблюдались симптомы желудочно-кишечной диспепсии — тошнота и диарея (1,1–2,8%). При внутривенном введении возможно покраснение места инъекции, иногда наблюдается развитие флебитов (1%).
Дозирование
Левофлоксацин выпускается в двух формах: для внутривенного введения и приема внутрь. Применяется по 250-500 мг один раз в сутки, при тяжелых инфекциях возможно назначение по 500 мг два раза в сутки. При внебольничной пневмонии длительность лечения составляет 10-14 дней, при обострении хронического бронхита — 5-7 дней.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Фурункулёз: причины появления, симптомы, диагностика и способы лечения.
Определение
Фурункулез (фурункул) – острое гнойно-некротическое воспаление волосяного фолликула, сальной железы и окружающей ткани. Заболевание проявляется воспалительными элементами, которые со временем вскрываются, из них выделяется гной.
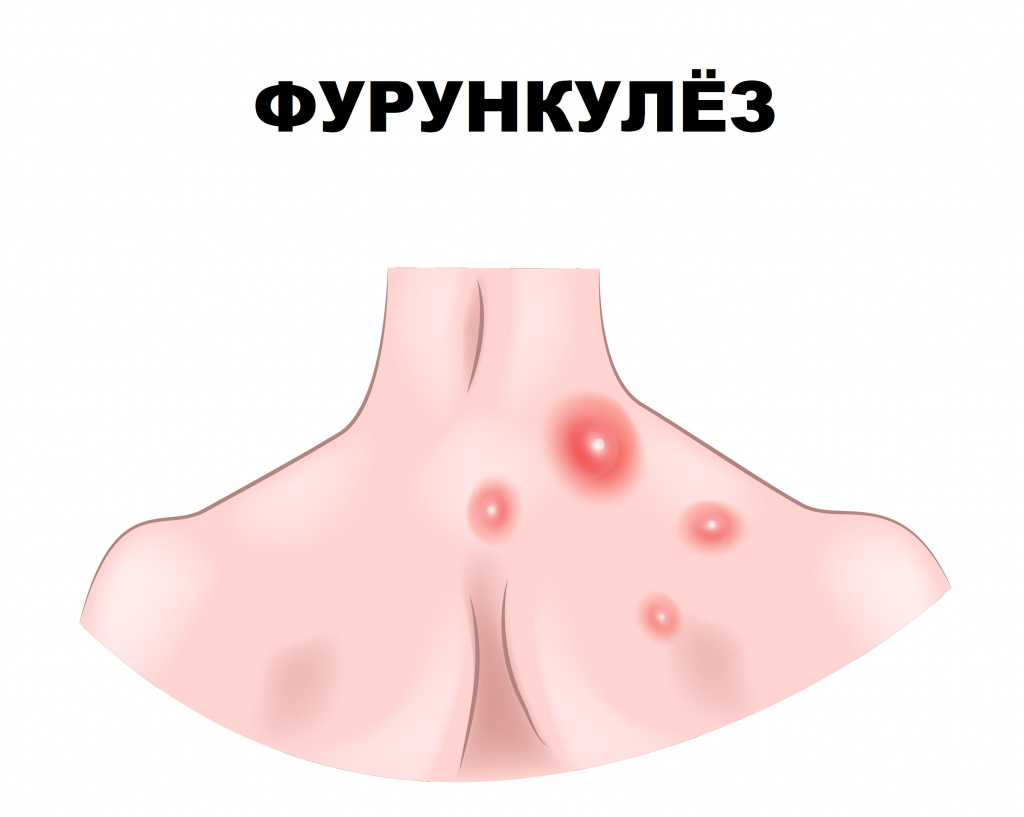
Причины появления фурункулов
Фурункулез характеризуется формированием множественных фурункулов на ограниченных участках кожи, хотя заболевание может иметь и распространенный характер. Рецидивы отмечаются на протяжении нескольких недель и даже лет.
Как правило, фурункулез возникает у людей с ослабленным иммунитетом, при гипо- и авитаминозе, несоблюдении гигиены кожи. Возбудителями фурункулов, как правило, являются стафилококки и стрептококки (S. aureus, S. haemolyticus, S. еpidermidis, β-гемолитический стрептококк). Заболевание могут вызывать и другие микроорганизмы (вульгарный протей, пневмококки, синегнойная палочка), которые в большинстве случаев выявляются в ассоциации со стафилококками и стрептококками.
Фурункулез нередко встречается у подростков и молодых людей с выраженной сенсибилизацией (повышенной чувствительностью) к возбудителям заболевания.
Описан ряд факторов, способствующих манифестации фурункулов: нарушение целостности эпидермиса (микротравмы, мацерация кожи), гипергидроз (повышенное потоотделение), смещение рН кожи в щелочную сторону, действие высоких и низких температур, ожоги, язвы. К эндогенным факторам риска развития фурункулеза относят нарушение углеводного обмена (сахарный диабет), недостаточное поступление в организм белков, хронические интоксикации, наличие очагов стафилококковой инфекции в различных органах и тканях, туберкулез, анемия, ангина, грипп, желудочно-кишечные расстройства.
Фурункул может локализоваться на любом участке кожи, за исключением ладоней и подошв, где отсутствуют волосяные фолликулы.
Наиболее опасной считается локализация фурункула на лице – в области носа и верхней губы. Здесь воспалительный процесс имеет тенденцию быстро переходить на клетчатку, где расположено разветвление передней лицевой вены. Распространение инфекции может привести к тромбозу синусов твердой мозговой оболочки головного мозга и гнойному менингиту. Летальность при этом осложнении достигает 80-100%.
Классификация фурункулеза
Острый фурункулез характеризуется формированием сразу нескольких фурункулов.
Хронический фурункулез – более длительный процесс (от нескольких недель до нескольких месяцев), когда после исчезновения одного фурункула появляются новые воспалительные элементы.
Симптомы фурункулеза
Фурункул проходит три стадии развития.
Первая стадия инфильтрации характеризуется образованием болезненного воспалительного узла диаметром 1-4 см. Кожа над фурункулом приобретает багрово-красный цвет. В местах с хорошо развитой подкожной жировой клетчаткой (ягодицы, бедра, лицо) фурункулы могут достигать еще больших размеров.
Во время второй, гнойно-некротической стадии происходит нагноение и формирование некротического стержня. Над поверхностью кожи выступает конусообразный узел, который размягчается в центре с образованием гнойника. Больных беспокоит жжение и пульсирующая боль. Значительную болезненность пациенты отмечают при локализации фурункулов на волосистой части головы, тыльной поверхности пальцев, передней поверхности голени, в наружном слуховом проходе. После вскрытия гнойника и отделения гноя с примесью крови постепенно отторгается и гнойно-некротический стержень.
Во время третьей стадии на месте фурункула образуется рубец. В зависимости от глубины воспалительного процесса рубцы могут быть или едва заметными, или выраженными.

Эволюция одного фурункула происходит в течение 7-10 дней, но когда одни фурункулы развиваются вслед за другими, болезнь затягивается на долгое время.
При фурункулезе возможно повышение температуры тела до 37,2-39°С, слабость, потеря аппетита.
Диагностика фурункулеза
Диагноз устанавливается на основании жалоб и осмотра пациента. У всех больных фурункулезом уточняются следующие вопросы:
- наличие сопутствующих заболеваний;
- принимаемые в настоящее время лекарственные препараты;
- находится ли пациент на диете.
-
клинический анализ крови: общий анализ, лейкоформула, СОЭ (с микроскопией мазка крови при наличии патологических сдвигов);
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Ячмень и халязион: причины появления, симптомы, диагностика и способы лечения.
Ячмень, гордеолум - это острое гнойное воспаление, возникающее в результате попадания инфекции в сальные или потовые железы, расположенные по краям века (наружный ячмень), или в мейбомиевые железы, которые находятся в толще века (внутренний ячмень).
Часто ячмень путают с халязионом, поскольку внешне они действительно похожи. Однако это два совершенно разных заболевания, и объединяет их только локализация – кожа век. Халязион – это неинфекционное хроническое воспаление хряща вокруг мейбомиевой железы.
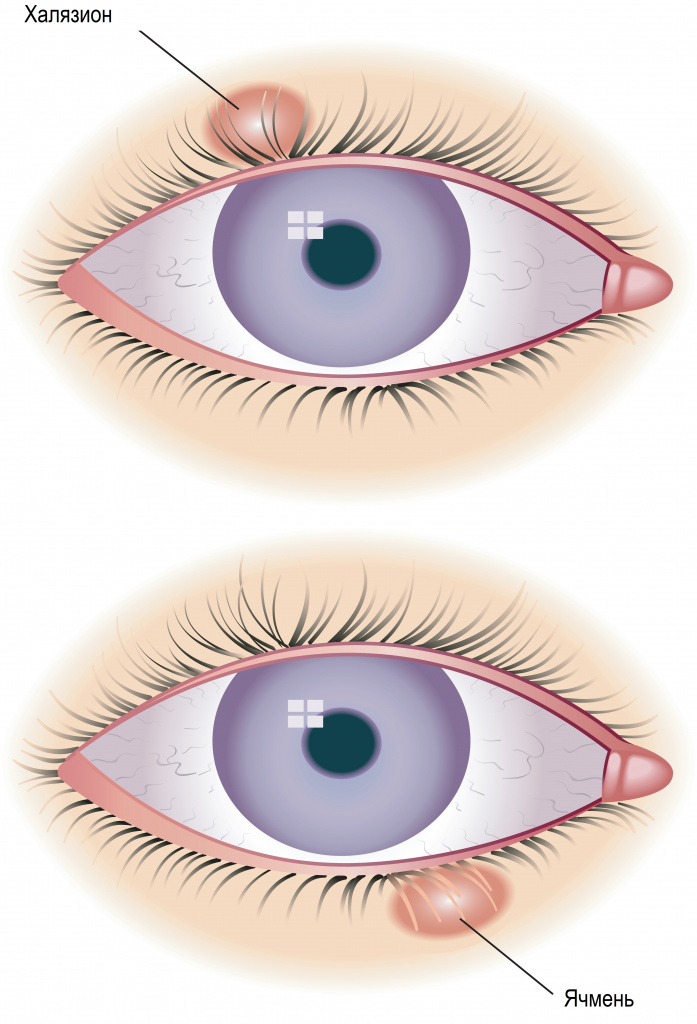
Причины появления ячменя и халязиона
Непосредственной причиной развития гордеолума является бактериальная инфекция. В 90% случаев его возбудителем служит золотистый стафилококк. Попадание микроорганизмов внутрь железы века приводит к закупорке выводного протока и скоплению гнойного секрета. Развитию инфекционного процесса способствуют нарушения правил гигиены при использовании контактных линз, привычка тереть глаза руками, расчесывание век, использование грязного полотенца, а также применение некачественной косметики и обсемененных приспособлений для нанесения макияжа.
Нередко ячмень развивается у пациентов с сахарным диабетом, различными иммунодефицитными состояниями, при гиповитаминозах, хронических заболеваниях желудочно-кишечного тракта.
Отмечается предрасположенность к формированию ячменя у людей с жирной кожей, угревой сыпью, фурункулезом.
Халязион не связан с инфекционным воспалением и возникает в результате закупорки выводного протока мейбомиевой железы; что приводит к ее растяжению с последующим прорывом секрета в окружающие ткани хряща. В результате в толще века формируется плотно-эластичный безболезненный узелок (гранулема) размером до горошины. Кожа над узелком подвижна, не изменена.
Классификация ячменя, халязиона
Ячмень и халязион могут быть как единичными, так и множественными.
В зависимости от локализации ячмень классифицируют как наружный и внутренний.
Наружный ячмень располагается на ресничном крае века с внешней стороны, связан с гнойным воспалением сальных или потовых желез.
Внутренний ячмень, или мейбомит, формируется на внутренней стороне века в результате гнойного воспаления мейбомиевых желез и встречается значительно реже, чем наружный.
В зависимости от глубины поражения различают поверхностный халязион (воспаление присутствует только в мейбомиевой железе) и глубокий (воспаление развивается в хряще века). Клинические проявления при этом никак не различаются.
Симптомы ячменя и халязиона
Ячмень. В самом начале заболевания при зажмуривании у пациента появляется ощущение дискомфорта у свободного края века. По мере развития воспалительного процесса возникают боль, покраснение и отек участка века. Интенсивность боли обычно соответствует степени выраженности отека. Через 1-3 дня в центре очага формируется гнойничок, который через 2-3 дня прорывается наружу. После самопроизвольного вскрытия и при адекватной терапии воспалительные явления (покраснение, отечность, болезненность) постепенно стихают, наступает излечение.
Внутренний ячмень можно увидеть только при вывороте века. Отмечаются локальный отек и воспаление конъюнктивы (слизистой оболочки) века.
Халязион представляет собой безболезненное локальное подкожное образование в форме шарика. При неосложненном течении кожа над ним обычно не изменена.
Диагностика ячменя и халязиона
Диагноз устанавливается на основании жалоб и данных осмотра пациента.
В случае ячменя при осмотре выявляют локальную гиперемию (покраснение) и отек края века в области волосяного фолликула ресницы. При пальпации века пациент жалуется на боль.
При неосложненном халязионе болезненность и покраснение века, как правило, не обнаруживаются.
В начале заболевания клинические проявления внутреннего ячменя и халязиона могут быть схожи. От ячменя халязион отличается лишь большей плотностью, отсутствием признаков острого воспаления, а кожа над ним легко смещается.
Установить правильный диагноз и назначить адекватное лечение может только врач.
Лабораторная и инструментальная диагностика в большинстве случаев не требуется.
К каким врачам обращаться
Лечением пациентов с воспалительными заболеваниями век занимаются офтальмологи.
Лечение ячменя и халязиона
Во избежание осложнений категорически не рекомендуется выдавливать или прокалывать ячмень. Поскольку причина гордеолума – бактериальная инфекция, основа лечения – антибактериальные средства. Используют глазные капли и мази, содержащие антибиотик. Как и при любом другом лечении антибиотиком, крайне важным является соблюдение кратности использования и продолжительности курса, согласно рекомендациям врача.
Несоблюдение схемы назначения антибиотиков может привести к формированию антибиотикорезистентности (устойчивости бактерии к данному антибиотику), неэффективности терапии и необходимости повторного курса уже другого лекарственного препарата.
Лечение халязиона включает применение противовоспалительных средств – глюкокортикостероидов в форме мазей для обработки век или введение раствора в толщу халязиона. Врачом могут быть рекомендованы теплые компрессы, массаж век. При крупных размерах халязиона, а также при неэффективности медикаментозной терапии применяют хирургическое лечение – удаление халязиона, в том числе лазерным методом.
Осложнения ячменя, халязиона
Осложнения, которые могут развиться из-за выдавливания ячменя – распространение инфекции на окружающие ткани: конъюнктивит, флегмона глазницы, менингит и даже сепсис. Кроме того, описаны случаи воспалительных изменений в сосудах с развитием их закупорки (тромбоз вен в области глаза).
Халязион может осложниться бактериальным воспалением, а халязион крупных размеров - вызвать нарушение зрения.
Профилактика ячменя, халязиона
Основа профилактики формирования ячменя и халязиона - соблюдение правил личной гигиены: необходимо пользоваться только личной косметикой и личным полотенцем, правильно хранить контактные линзы, не прикасаться грязными руками к глазам.
Для предупреждения рецидивов халязиона может быть рекомендован массаж век для улучшения оттока секрета мейбомиевых желез, очищение век с помощью специальных косметических средств.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Абсцесс: причины появления, симптомы, диагностика и способы лечения.
Определение
Абсцесс - это ограниченное скопление гноя, окруженное оболочкой (пиогенной капсулой).
Причины появления абсцессов
Абсцессы могут быть асептическими и септическими. Асептические абсцессы развиваются после подкожного введения некоторых раздражающих химических веществ (скипидара, керосина, хлоралгидрата, хлористого кальция), которые вызывают некроз тканей. При этом некротизированные ткани растворяются лейкоцитами с образованием гноя, не содержащего микробов. Септические абсцессы чаще всего формируются в результате внедрения в ткани микроорганизмов (стафилококков, стрептококков, кишечной палочки, синегнойной палочки и т.д.), вызывающих гнойное воспаление.
Инфекционные агенты (бактерии, грибы) могут проникать в организм экзогенно через поврежденный эпителий кожи или слизистые оболочки (входные ворота) или эндогенно (из очага инфекции в самом организме).
Открытые повреждения кожи, инородные тела, медицинские манипуляции (инъекции, блокады, пункции), гематомы, серомы, а также гнойно-воспалительные процессы в организме (сепсис, гнойный лимфаденит, гнойный лимфангит, гнойный тромбофлебит, фурункул, карбункул и др.) могут приводить к развитию абсцесса.
На месте внедрения инфекции и воспаления ткани отмирают, и формируется гнойная полость, вокруг которой на границе со здоровой тканью начинает образовываться пиогенная капсула. Эта капсула служит своеобразным биологическим барьером, препятствующим распространению инфекции по организму. Чем дольше существует абсцесс, тем толще становится пиогенная капсула.
По распространенности самым частым считается абсцесс кожи, подкожной жировой клетчатки и мышечной ткани, хотя возникнуть он может в любом органе и ткани.
При прогрессировании гнойного процесса повышается риск разрыва пиогенной капсулы, в результате чего инфекционный процесс распространяется за ее пределы.
Классификация абсцессов
По причине возникновения:
а) стафилококковые;
б) стрептококковые;
в) пневмококковые;
г) колибациллярные;
д) гонококковые;
е) анаэробные неспорообразующие;
ж) клостридиальные анаэробные;
з) смешанные;
и) грибковые и др.
По происхождению и путям проникновения инфекции:
- метастатические (гематогенные) абсцессы, возникающие из отдаленных гнойных очагов;
- контактные абсцессы, происходящие из близлежащих очагов воспаления;
- травматические абсцессы, являющиеся следствием открытых и проникающих повреждений;
- криптогенные абсцессы, происхождение которых и пути проникновения инфекции установить не представляется возможным.
- поверхностные (поражение кожи и подкожной клетчатки);
- глубокие (в органах и тканях):
- острые абсцессы;
- хронические абсцессы.
Симптомы абсцессов
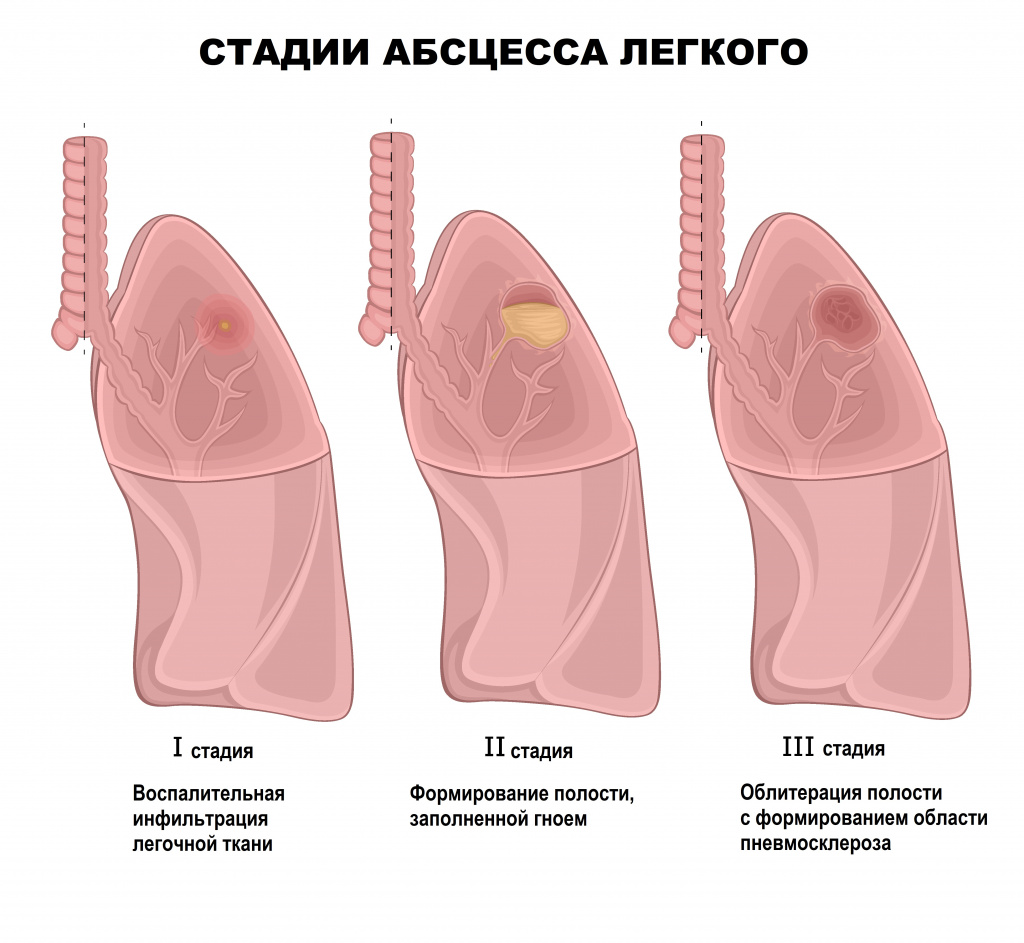
В начальной стадии формирования поверхностного абсцесса определяется отграниченная болезненная припухлость, горячая на ощупь. Через 3-4 дня в центре появляется размягчение, кожа в центре инфильтрата становится более тонкой и темной, а границы абсцесса - более четкими. На 4-7 сутки абсцесс вскрывается и из него выходит гнойное содержимое. При этом болезненность воспаленного участка уменьшается.
Глубокие абсцессы могут формироваться на фоне пневмонии. Чаще всего абсцесс бывает одиночным и локализуется в одном сегменте легкого, реже наблюдаются большие абсцессы, которые захватывают сразу несколько сегментов. В начале заболевания больных беспокоит кашель, боль в грудной клетке, общая слабость, озноб, отсутствие аппетита, жажда. Температура может достигать высоких значений. После прорыва абсцесса в просвет бронха пациенты отмечают отхождение мокроты «полным ртом», симптомы интоксикации уменьшаются. При раннем прорыве и хорошем полном опорожнении гнойная полость может быстро уменьшиться и зажить рубцом. При плохом или недостаточном опорожнении воспаление не затихает, и возникают повторяющиеся обострения.
Абсцесс печени чаще всего возникает в результате распространения инфекции по сосудистому руслу из воспалительных очагов других органов или тканей брюшной полости (аппендицит, холангит, язвенный колит). Абсцессы могут быть одиночными или множественными. Для заболевания характерна высокая температура, озноб, боль и тяжесть в области печени, увеличение ее размеров.
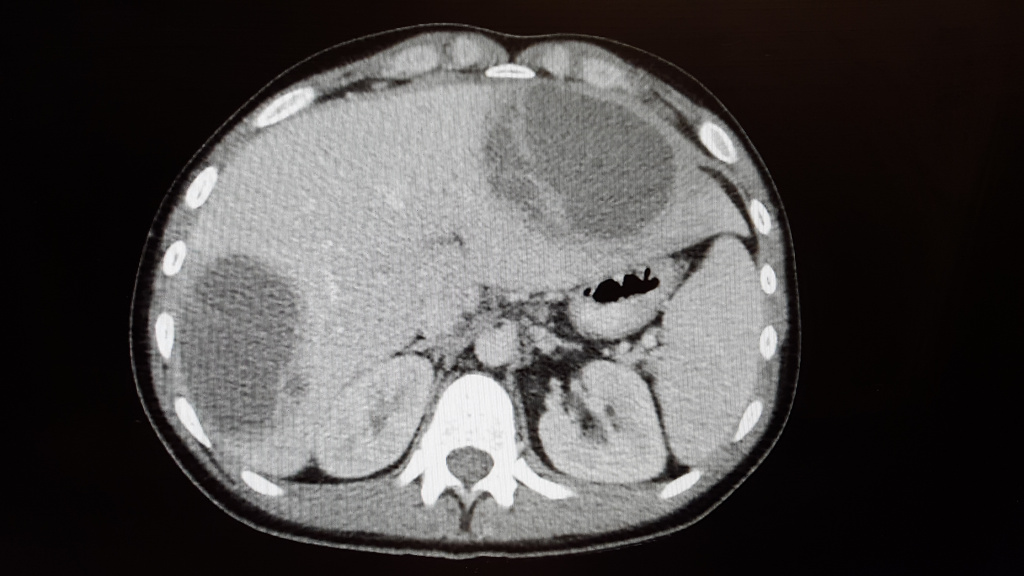
Абсцесс в печени
Абсцесс головного мозга может сформироваться в результате проникновения инфекции из среднего или внутреннего уха, придаточных пазух носа, из гнойных очагов мягких тканей головы. Абсцессы могут быть одиночными или множественными. Заболевание начинается с интоксикации, симптомов повышения внутричерепного давления (головной боли, тошноты и рвоты, сонливости, недомогания, нарушения памяти, расстройства внимания, нарушения зрения). Затем присоединяются общемозговые (головокружение, психомоторное возбуждение, галлюцинации) и очаговые симптомы (неврологические симптомы, свойственные местному поражению определенных структур центральной или периферической нервной системы).
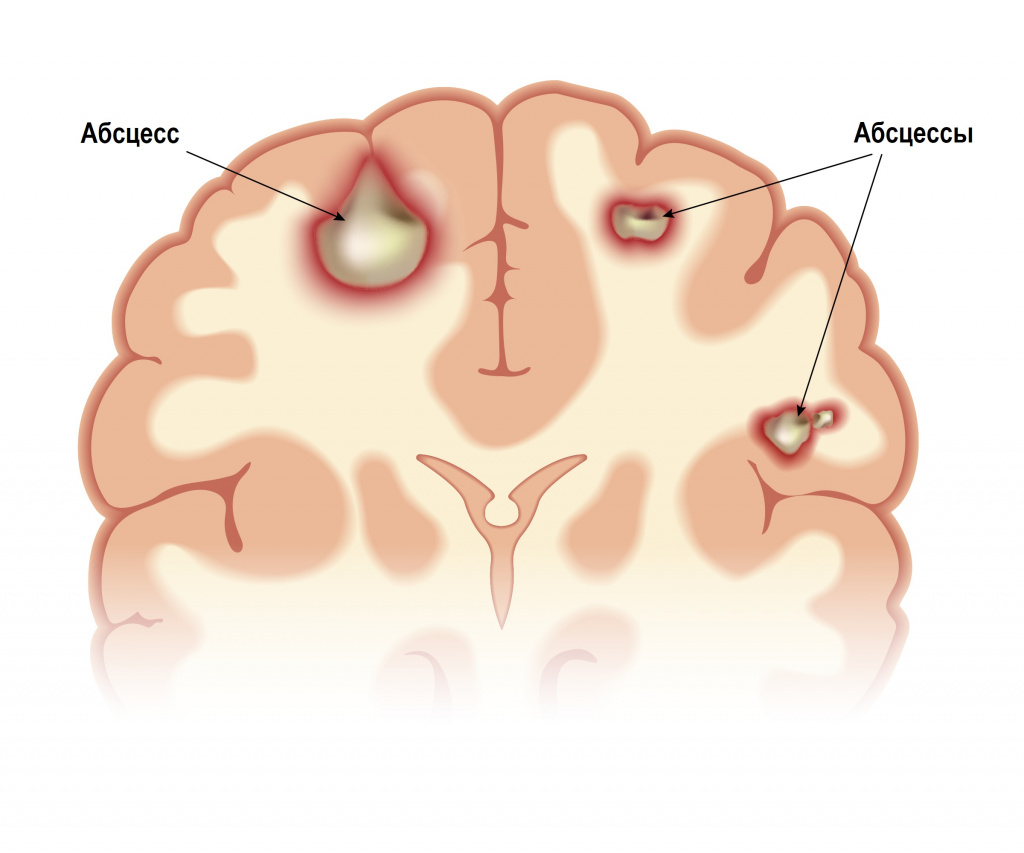
Внутримозговой абсцесс
Абсцессы брюшной полости встречаются в 30-35% у больных гнойным перитонитом. Обычно они располагаются в отлогих областях живота: подпеченочном, поддиафрагмальном пространстве, в подвздошных ямках и т.п. Клинике формирования абсцесса соответствует ухудшение состояния после небольшого светлого промежутка на фоне воспалительного заболевания брюшной полости (аппендицита, холецистита), наблюдается усиление интоксикации и боль в животе.
Внутрикостный абсцесс Броди – это отграниченный некроз губчатого вещества кости с преследующим расплавлением и образованием полости. Локализуется обычно в проксимальном отделе большеберцовой кости. Заболевание начинается с чувствительности к надавливанию. Нередко очаги ничем не проявляются, и боль носит эпизодический характер. Повышение температуры, озноб и другие симптомы интоксикации, как правило, отсутствуют, процесс может длиться годами.
Диагностика абсцессов
Диагностика поверхностного абсцесса не представляет трудностей. Диагноз устанавливается по совокупности жалоб и осмотра. Диагностика глубоких абсцессов может быть основана на результатах дополнительных лабораторных и инструментальных методов исследования.
-
Клинический анализ крови: общий анализ, лейкоформула, СОЭ (с микроскопией мазка крови при наличии патологических сдвигов) покажет присутствие в организме воспалительного процесса.
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
В настоящее время существует тенденция к росту хронических бактериальных и вирусных заболеваний, для которых характерны непрерывно рецидивирующее течение и малая эффективность антибактериальной и симптоматической терапии. Одним из таких заболеваний яв
В настоящее время существует тенденция к росту хронических бактериальных и вирусных заболеваний, для которых характерны непрерывно рецидивирующее течение и малая эффективность антибактериальной и симптоматической терапии. Одним из таких заболеваний является хронический рецидивирующий фурункулез (ХРФ). Фурункул развивается в результате острого гнойно-некротического воспаления волосяного фолликула и окружающих его тканей. Как правило, фурункул является осложнением остеофолликулита стафилококковой этиологии. Фурункулы могут возникать как одиночно, так и множественно (так называемый фурункулез).
В случае рецидивирования фурункулеза диагностируется хронический рецидивирующий фурункулез. Как правило, он характеризуется частыми рецидивами, длительными, вялотекущими обострениями, толерантными к проводимой антибактериальной терапии. В зависимости от количества фурункулов, распространенности и выраженности воспалительного процесса ХРФ классифицируется по степени тяжести (Л. Н. Савицкая, 1987).
Тяжелая степень: диссеминированные, множественные, непрерывно рецидивирующие небольшие очаги со слабой местной воспалительной реакцией, не пальпируемыми или слегка определяющимися регионарными лимфатическими узлами. Тяжелое течение фурункулеза сопровождается симптомами общей интоксикации: слабостью, головной болью, снижением работоспособности, повышением температуры тела, потливостью.
Средняя степень тяжести — одиночные или множественные фурункулы больших размеров, протекающие с бурной воспалительной реакцией, с рецидивами от 1 до 3 раз в год. Иногда сопровождается увеличением регионарных лимфатических узлов, лимфангоитом, кратковременным повышением температуры тела и незначительными признаками интоксикации.
Легкая степень тяжести — одиночные фурункулы, сопровождающиеся умеренной воспалительной реакцией, с рецидивами от 1 до 2 раз в год, хорошо пальпируемыми регионарными лимфатическими узлами, без явлений интоксикации.
Чаще всего пациенты, страдающие фурункулезом, получают лечение у хирургов, в лучшем случае на амбулаторном этапе им проводится исследование крови на сахар, аутогемотерапия, некоторым назначают и иммуномодулирующие препараты без предварительно проведенного обследования, и в большинстве случаев они не получают положительного результата от проведенной терапии. Цель нашей статьи — поделиться опытом ведения больных с ХРФ.
Основным этиологическим фактором ХРФ считается золотистый стафилококк, который встречается, по разным данным, в 60–97% случаев. Реже ХРФ вызывается другими микроорганизмами — эпидермальным стафилококком (ранее считавшимся апатогенным), стрептококками групп А и В и другими видами бактерий. Описана вспышка заболеваемости фурункулезом нижних конечностей у 110 пациентов, являвшихся пациентами одного и того же педикюрного салона. Возбудителем данной вспышки являлся Mycobacterium fortuitium, причем этот микроорганизм был выявлен в ванночках для ног, используемых в салоне. В большинстве случаев ХРФ из гнойных очагов высеваются антибиотикорезистентные штаммы золотистого стафилококка. По данным Н. М. Калининой, St. aureus в 89,5% случаев резистентен к пенициллину и ампициллину, в 18,7% — резистентен к эритромицину и в 93% случаев чувствителен к клоксациллину, цефалексину и котримоксазолу. В последние годы отмечается достаточно широкое распространение метициллин-резистентных штаммов этого микроорганизма (до 25% пациентов). По данным зарубежной литературы, наличие на коже или на слизистой оболочке носа патогенного штамма St. aureus считается важным фактором развития заболевания.
ХРФ имеет сложный и до сих пор недостаточно изученный патогенез. Установлено, что дебют и дальнейшее рецидивирование заболевания обусловлены целым рядом эндо- и экзогенных факторов, среди которых наиболее значимыми считаются нарушение барьерной функции кожных покровов, патология ЖКТ, эндокринной и мочевыделительной систем, наличие очагов хронической инфекции различной локализации. По данным проведенных нами исследований, очаги хронической инфекции различной локализации выявляются у 75–99,7% пациентов, страдающих ХРФ. Наиболее часто встречаются очаги хронической инфекции ЛОР-органов (хронический тонзиллит, хронический гайморит, хронический фарингит), дисбактериоз кишечника с увеличением содержания кокковых форм. У больных хроническим фурункулезом патология ЖКТ (хронический гастродуоденит, эрозивный бульбит, хронический холецистит) определяется в 48–91,7% случаев. У 39,7% пациентов диагностируется патология эндокринной системы, представленная нарушениями обмена углеводов, гормонпродуцирующей функции щитовидной и половых желез. У 39,2% больных с упорно текущим фурункулезом имеется латентная сенсибилизация, у 4,2% — клинические проявления сенсибилизации к аллергенам домашней пыли, пыльцы деревьев и злаковых трав, у 11,1% — повышенная концентрация сывороточного IgE.
Таким образом, для большинства больных ХРФ характерны непрерывно рецидивирующее течение заболевания (41,3%) при тяжелой и средней тяжести течения фурункулеза (88%) и длительные обострения (от 14 до 21 дня — 39,3%). У 99,7% пациентов выявлены хронические очаги инфекции различной локализации. В 39,2% случаев определялась латентная сенсибилизация к различным аллергенам. Основным возбудителем является St. aureus.
В возникновении и развитии хронического фурункулеза, наряду с особенностями возбудителя, его патогенными, вирулентными и инвазивными свойствами, наличием сопутствующей патологии, большая роль отводится нарушениям нормального функционирования и взаимодействия различных звеньев иммунной системы. Иммунная система, призванная обеспечить биологическую индивидуальность организма и, как следствие, выполняющая защитную функцию при контакте с инфекционными, генетически чужеродными агентами, в силу разных причин может давать сбой, что ведет к нарушению защиты организма от микробов и проявляется в повышенной инфекционной заболеваемости.
Иммунная защита от бактерий-патогенов включает два взаимосвязанных компонента — врожденный (носящий преимущественно неспецифический характер) и адаптивный (характеризующийся высокой специфичностью к чужеродным антигенам) иммунитет. Возбудитель ХРФ при попадании в кожу вызывает «каскад» защитных реакций.
У 26–35% больных, страдающих хроническим фурункулезом, снижается количество В-лимфоцитов. При оценке компонентов гуморального иммунитета у больных фурункулезом выявляются различные дисиммуноглобулинемии. Наиболее часто встречаются снижение уровней IgG и IgM. Отмечено снижение аффинности иммуноглобулинов у больных ХРФ, причем выявлена корреляция между частотой встречаемости этого дефекта, стадией и тяжестью заболевания. Тяжесть нарушений лабораторных показателей коррелирует с тяжестью клинических проявлений фурункулеза.
Из вышесказанного следует, что изменения показателей иммунного статуса у больных ХРФ носят разноплановый характер: у 42,9% отмечено изменение субпопуляционного состава лимфоцитов, у 71,1% — фагоцитарного и у 59,5% — гуморального звена иммунной системы. В зависимости от выраженности изменений в показателях иммунного статуса больных ХРФ можно разделить на три группы: легкой тяжести, средней и тяжелого течения, что коррелирует с клиническим течением заболевания. При легком течении фурункулеза у большинства больных (70%) показатели иммунного статуса находятся в пределах нормы. При средней и тяжелой степени преимущественно выявляются изменения фагоцитарного и гуморального звеньев иммунной системы.
Диагностика и лечение ХРФ
Исходя из вышеуказанных патогенетических особенностей ХРФ алгоритм диагностики должен включать в себя выявление очагов хронической инфекции, диагностику сопутствующих заболеваний, оценку лабораторных параметров состояния иммунной системы (рис.).
В нашем институте был разработан план обследования больных ХРФ.
- Обязательное лабораторное исследование:
- клинический анализ крови;
- общий анализ мочи;
- биохимический анализ крови (общий белок, белковые фракции, общий билирубин, мочевина, креатинин, трансаминазы - АСТ, АЛТ);
- RW, ВИЧ;
- анализ крови на наличие гепатита В и С;
- посев содержимого фурункула на флору и чувствительность к антибиотикам;
- гликемический профиль;
- иммунологическое обследование (фагоцитарный индекс, спонтанная и индуцированная хемилюминесценция (ХЛ), индекс стимуляции (ИС) люминолзависимой хемилюминесценции ЛЗХЛ), бактерицидность нейтрофилов, иммуноглобулины A, M, G, аффинность иммуноглобулинов);
- бактериологическое исследование фекалий;
- анализ кала на яйца глистов;
- посев из зева на флору и грибы.
- Дополнительное лабораторное исследование:
- определение уровня гормонов щитовидной железы (Т3,Т4, ТТГ, АТ к ТГ);
- определение уровня половых гормонов (эстрадиол, пролактин, прогестерон);
- посев крови на стерильность трехкратно;
- посев мочи (по показаниям);
- посев желчи (по показаниям);
- определение базальной секреции;
- иммунологическое обследование (субпопуляции Т-лимфоцитов, В-лимфоциты);
- общий IgE.
- Инструментальные методы обследования:
- гастроскопия с определением базальной секреции;
- УЗИ органов брюшной полости;
- УЗИ щитовидной железы (по показаниям);
- УЗИ женских половых органов (по показаниям);
- дуоденальное зондирование;
- функции внешнего дыхания;
- ЭКГ;
- рентгенография органов грудной клетки;
- рентгенография придаточных пазух носа.
- Консультации специалистов: отоларинголога, гинеколога, эндокринолога, хирурга, уролога.
Тактика лечения больных ХРФ определяется стадией заболевания, сопутствующей патологией и иммунологическими нарушениями. В стадии обострения ХРФ требуется проведение местной терапии в виде обработки фурункулов антисептическими растворами, антибактериальными мазями, гипертоническим раствором; в случае локализации фурункулов в области головы и шеи или наличия множественных фурункулов — проведение антибактериальной терапии с учетом чувствительности возбудителя. В любой стадии заболевания необходима коррекция выявленной патологии (санация очагов хронической инфекции, лечение патологии ЖКТ, эндокринной патологии и т. д.). При выявлении у больных ХРФ латентной сенсибилизации или при наличии клинических проявлений аллергии необходимо в период поллинации добавлять к лечению антигистаминные препараты, назначать гипоаллергенную диету, проводить хирургическое вмешательство с премедикацией гормональными и антигистаминными препаратами.
В последнее время в комплексной терапии больных ХРФ все чаще используют препараты, оказывающие корригирующее действие на иммунную систему.
Разработаны показания к назначению иммуномодуляторов в зависимости от доминирующего типа нарушений иммунного статуса и степени заболевания. Так, в стадии обострения ХРФ рекомендовано применение следующих иммуномодуляторов.
- При наличии изменений фагоцитарного звена иммунитета целесообразно назначение полиоксидония по 6-12 мг внутримышечно в течение 6-12 дней.
- При снижении аффинности иммуноглобулинов - галавит 100 мг № 15 внутримышечно.
- При снижении уровня В-лимфоцитов, нарушении соотношения CD4/CD8 в сторону уменьшения показано применение миелопида по 3 мг в течение 5 дней внутримышечно.
- При снижении уровня IgG на фоне тяжелого обострения ХРФ при клинической неэффективности применения галавита используются препараты иммуноглобулина для внутривенного введения (октагам, габриглобин, интраглобин).
В период ремиссии возможно назначение следующих иммуномодуляторов.
- Полиоксидоний 6-12 мг внутримышечно в течение 6-12 дней - при наличии изменений фагоцитарного звена иммунитета.
- Ликопид 10 мг в течение 10 дней перорально - при наличии дефектов образования активных форм кислорода.
- Галавит 100 мг № 15 внутримышечно - при снижении аффинности иммуноглобулинов.
Применение ликопида целесообразно также при вялотекущем, непрерывно рецидивирующем фурункулезе. При упорном рецидивировании ХРФ на фоне изменений гуморального звена иммунитета показано назначение препаратов иммуноглобулина для внутривенного введения (октагам, габриглобин, интраглобин). В некоторых случаях целесообразно комбинированное применение иммуномодулирующих препаратов (например, при обострении фурункулеза возможно назначение полиоксидония, в дальнейшем, при выявлении дефекта аффинности иммуноглобулинов, добавляется галавит и т. д.).
Несмотря на значительные успехи, достигнутые в области клинической иммунологии, эффективное лечение ХРФ остается достаточно сложной задачей. В связи с этим требуется дальнейшее изучение патогенетических особенностей этого заболевания, а также разработка новых подходов к терапии ХРФ.
Неоген является синтетическим трипептидом, состоящим из L-аминокислотных остатков изолецитина, глютамина и триптофана. Неоген применялся в составе комплексной терапии, проводимой больным хроническим фурункулезом. Внутримышечные инъекции препарата неогена проводились по 1 мл 0,01% раствора 1 раз в сутки ежедневно, курс — 10 инъекций. Применение неогена в комплексной терапии больных хроническим фурункулезом на стадии ремиссии заболевания вызывает достоверную нормализацию изначально измененных иммунологических показателей (относительного и абсолютного количества лимфоцитов, относительного количества CD3 + , CD8 + , CD19 + , CD16 + -лимфоцитов, поглотительной способности моноцитов по отношению к St. aureus) и увеличение показателей спонтанной ХЛ и аффинности анти-ОАД-антител, количества HLA-DR+-лимфоцитов, а следовательно, позволяет продлить период ремиссии заболевания по сравнению с группой контроля.
Таким образом, из вышеизложенного следует, что ХРФ протекает под воздействием сложного комплекса этиологических и патогенетических факторов и его нельзя рассматривать только как местное воспаление. Больным с ХРФ необходимо проводить всестороннее обследование с целью выявления возможных очагов хронической инфекции, которые являются источником септицемии и при нарушении элиминации микробов в крови в результате снижения иммунологической реактивности организма приводят к возникновению фурункулов. Так как назначение иммунокорригирующих препаратов может вызвать обострение основного заболевания, мы считаем, что лечение больных необходимо начинать с санации выявленных очагов инфекции.
Вопрос о назначении иммунокорригирующих препаратов должен решаться индивидуально, с учетом стадии заболевания, наличия сопутствующей патологии и типа иммунологического дефекта. При выявлении у больного сенсибилизации к различным аллергенам лечение фурункулеза необходимо проводить на фоне противоаллергенной терапии.
Н. Х. Сетдикова, доктор медицинских наук
К. С. Манько
Т. В. Латышева, доктор медицинских наук, профессор
Читайте также:

