Какие адренорецепторы в сосудах кожи
Обновлено: 19.04.2024
Строение автономной нервной системы, управляющей нашими органами независимо от сознания, ее функции. Участие в приспособительных реакциях организма. Механизм передачи нервного импульса (строение синапса). Ацетилхолин и норадреналин – основные посредники этой системы и их эффекты.
Почему мы не можем по своему желанию остановить собственное сердце или прекратить процесс переваривания пищи в желудке, почему внезапный испуг заставляет сильнее биться сердце? Существует отдельная часть нервной системы человека, которая управляет многими непроизвольными функциями нашего организма. Она называется вегетативной нервной системой. Это автономная нервная система, активность которой не контролируется нашим сознанием. Под контролем этой системы находится активность различных желез, сокращение гладких мышц, работа почек, сокращение сердца и многие другие функции.
Вегетативная нервная система поддерживает на заданном природой уровне кровяное давление, потоотделение, температуру тела, обменные процессы, деятельность внутренних органов, кровеносных и лимфатических сосудов. Вместе с эндокринной системой, о которой мы будем рассказывать в следующей главе, она регулирует постоянство состава крови, лимфы, тканевой жидкости (внутренней среды) в организме, управляет обменом веществ и осуществляет взаимодействие отдельных органов в системах органов (дыхания, кровообращения, пищеварения, выделения и размножения).
Строение вегетативной нервной системы.
Функции их, как правило, противоположны (рисунок 1.5.17). Как видно из рисунка 1.5.17, если нервы симпатического отдела стимулируют какую-то реакцию, то нервы парасимпатического ее подавляют. Эти процессы разнонаправленного воздействия друг на друга в конечном итоге взаимно уравновешивают друг друга, в результате функция поддерживается на соответствующем уровне. Именно на возбуждение или торможение одного из таких противоположных по своей направленности влияний часто направлено действие лекарств.
Возбуждение симпатических нервов вызывает расширение сосудов головного мозга, кожи, периферических сосудов; расширение зрачка; снижение выделительной функции слюнных желез и усиление – потовых; расширение бронхов; ускорение и усиление сердечных сокращений; сокращение мышц, поднимающих волосы; ослабление моторики желудка и кишечника; усиление секреции гормонов надпочечников; расслабление мочевого пузыря; оказывает возбуждающее действие на половые органы, вызывает сокращение матки. По парасимпатическим нервным волокнам отдаются “приказы”, обратные по своей направленности: например, сосудам и зрачку – сузиться, мускулатуре мочевого пузыря – сократиться и так далее.
Вегетативная нервная система очень чувствительна к эмоциональному воздействию. Печаль, гнев, тревога, страх, апатия, половое возбуждение – эти состояния вызывают изменения функций органов, находящихся под контролем вегетативной нервной системы. Например, внезапный испуг заставляет сильнее биться сердце, дыхание становится более частым и глубоким, в кровь из печени выбрасывается глюкоза, прекращается выделение пищеварительного сока, появляется сухость во рту. Организм готовится к быстрой реакции на опасность и, если требуется, к самозащите. Так при длительном и сильном эмоциональном напряжении и возбуждении развиваются тяжелые заболевания, такие как: гипертензия, коронарная болезнь сердца, язвенная болезнь желудка и многие другие.
Представьте себе прогулку по холмистой местности. Пока дорога проходит по ее равнинной части, вы идете не спеша, дыхание ровное, и сердце бьется спокойно. При этом каждая клетка организма всегда помнит генетически запрограммированный оптимальный режим своего функционирования и далее стремится поддерживать его как эталонный. Мы уже упоминали в разделе 1.4.1, что свойство живого организма осуществлять деятельность, направленную на поддержание постоянства внутренней среды, называется гомеостазом.
Затем дорога пошла в гору и, как только это произошло, ваше тело стало выполнять дополнительную работу по преодолению силы земного притяжения. На выполнение этой работы всем участвующим в ней клеткам организма потребовалась дополнительная энергия, поступающая за счет увеличения скорости сгорания энергоемких веществ, которые клетка получает из крови.
В момент, когда клетка стала сжигать этих веществ больше, чем приносит кровь при данной скорости кровотока, она сообщает вегетативной нервной системе о нарушении своего постоянного состава и отклонении от эталонного энергетического состояния. Центральные отделы вегетативной нервной системы при этом формируют управляющее воздействие, приводящее к комплексу изменений для восстановления энергетического голодания: учащению дыхания и сокращений сердца, ускорению распада белков, жиров и углеводов и так далее (рисунок 1.5.18).
Рисунок 1.5.18. Функциональная модель описания вегетативной нервной системы
В результате, за счет увеличения количества поступающего в организм кислорода и скорости кровотока участвующая в работе клетка переходит на новый режим, при котором она отдает больше энергии в условиях повышения физической активности, но и потребляет ее больше ровно настолько, насколько необходимо для поддержания энергетического баланса, обеспечивающего клетке комфортное состояние. Таким образом, можно сделать вывод:
Поддержание постоянства внутренней среды клетки (гомеостаз) осуществляется за счет отрицательной обратной связи вегетативной нервной системы.
И, хотя она действует автономно, то есть выключение сознания не приводит к прекращению ее работы (вы продолжаете дышать, и сердце бьется ровно), она реагирует на малейшие изменения в работе центральной нервной системы. Ее можно назвать “мудрой напарницей” центральной нервной системы. Оказывается, что умственная и эмоциональная деятельность – это тоже работа, осуществляемая за счет потребления дополнительной энергии клетками головного мозга и других органов. При этом работают другие клетки, но с ними происходят процессы, аналогичные описанным ранее.
Для тех, кто хочет детальнее изучить работу вегетативной нервной системы, мы даем ее описание более подробно.
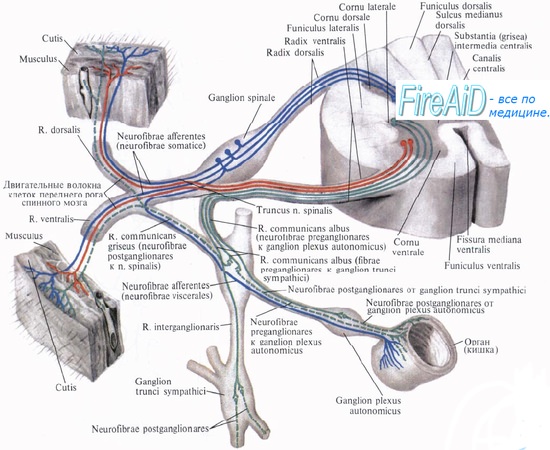
Как мы уже говорили выше, вегетативная нервная система представлена в центральных отделах симпатическими и парасимпатическими ядрами, расположенными в головном и спинном мозге, а на периферии – нервными волокнами и узлами (ганглиями).
Нервные волокна, составляющие ветки и веточки этой системы, расходятся по всему телу, сопровождаемые сетью кровеносных сосудов. Общая длина их составляет около 150 000 км.
В нашем теле все внутренние ткани и органы, “подчиненные” вегетативной нервной системе, снабжены нервами (иннервированы), которые, как датчики, собирают информацию о состоянии организма и передают ее в соответствующие центры, а от них доносят до периферии корректирующие воздействия.
Так же как и центральная нервная система, вегетативная система имеет чувствительные (афферентные) окончания (входы), обеспечивающие возникновение ощущений, и исполнительные (двигательные, или эфферентные) окончания, которые передают из центра модифицирующие воздействия к исполнительному органу. Физиологически этот процесс выражается в чередовании процессов возбуждения и торможения, в ходе которых происходит передача нервных импульсов, возникающих в клетках нервной системы (нейронах).
Переход нервного импульса с одного нейрона на другой или с нейронов на клетки исполнительных (эффекторных) органов осуществляется в местах контакта клеточных мембран, называемых синапсами (рисунок 1.5.19). Передача информации осуществляется специальными химическими веществами-посредниками (медиаторами), выделяемыми из нервных окончаний в синаптическую щель. В нервной системе эти вещества называют нейромедиаторами.
В состоянии покоя эти медиаторы, вырабатываемые в нервных окончаниях, находятся в особых пузырьках. Попробуем коротко рассмотреть работу этих медиаторов на рисунке 1.5.20. Условно (так как он занимает считанные доли секунды) весь процесс передачи информации можно разбить на четыре этапа. Как только по пресинаптическому окончанию поступает импульс, на внутренней стороне клеточной мембраны за счет входа ионов натрия происходит образование положительного заряда, и пузырьки с медиатором начинают приближаться к пресинаптической мембране (этап I на рисунке 1.5.20). На втором этапе осуществляется выход медиатора в синаптическую щель из пузырьков в месте их контакта с пресинаптической мембраной. После выделения из нервных окончаний (этап II) нейромедиатор проникает через синаптическую щель путем диффузии и связывается со своими рецепторами постсинаптической мембраны клетки исполнительного органа или другой нервной клетки (этап III). Активация рецепторов запускает в клетке биохимические процессы, приводящие к изменению ее функционального состояния в соответствии с тем, какой сигнал был получен от афферентных звеньев. На уровне органов это проявляется сокращением или расслаблением гладких мышц (сужением или расширением сосудов, учащением или замедлением и усилением или ослаблением сокращений сердца), выделением секрета и так далее. И, наконец, на IV этапе происходит возвращение синапса в состояние покоя либо за счет разрушения медиатора ферментами в синаптической щели, либо благодаря транспорту его обратно в пресинаптическое окончание. Сигналом к прекращению выделения медиатора служит возбуждение им рецепторов пресинаптической мембраны.
Рисунок 1.5.20. Функционирование синапса:
I - поступление нервного импульса; II - выделение медиатора в синаптическую щель; III - взаимодействие с рецепторами постсинаптической мембраны; IV - "судьба" медиатора в Синаптической щели - возвращение синапса в состояние покоя
1- обратный захват медиатора; 2 - разрушение медиатора ферментом; 3- возбуждение пресинаптических рецепторов
Как мы уже говорили, в вегетативной нервной системе передача информации осуществляется, главным образом, с помощью нейромедиаторов – ацетилхолина и норадреналина. Поэтому пути передачи и синапсы называют холинергическими (медиатор – ацетилхолин) или адренергическими (медиатор – норадреналин). Аналогично этому рецепторы, с которыми связывается ацетилхолин, называют холинорецепторами, а рецепторы норадреналина – адренорецепторами (смотри схему на рисунке 1.5.21). На адренорецепторы влияет также гормон, выделяемый надпочечниками, – адреналин.
Рисунок 1.5.21. Общая схема передачи информации по звеньям вегетативной нервной системы
Холино- и адренорецепторы неоднородны и различаются чувствительностью к некоторым химическим веществам. Так, среди холинорецепторов выделяют мускаринчувствительные (м-холинорецепторы) и никотинчувствительные (н-холинорецепторы) – по названиям естественных алкалоидов, которые оказывают избирательное действие на соответствующие холинорецепторы. Мускариновые холинорецепторы, в свою очередь, могут быть м1-, м2- и м3-типа в зависимости от того, в каких органах или тканях они преобладают.
Адренорецепторы, исходя из различной чувствительности их к химическим соединениям, подразделяют на альфа- и бета-адренорецепторы, которые тоже в зависимости от локализации имеют несколько разновидностей.
Сеть нервных волокон пронизывает все человеческое тело, таким образом, холино- и адренорецепторы расположены по всему телу. Нервный импульс, распространяющийся по всей нервной сети или ее пучку, воспринимается как сигнал к действию теми клетками, которые имеют соответствующие рецепторы. И, хотя холинорецепторы локализуются в большей степени в мышцах внутренних органов (желудочно-кишечного тракта, мочеполовой системы, глаз, сердца, бронхиол и других органов), а адренорецепторы – в сердце, сосудах, бронхах, печени, почках и в жировых клетках, обнаружить их можно практически в каждом органе. Воздействия, при реализации которых они служат посредниками, очень разнообразны.
Препараты, влияющие на различные типы рецепторов, будут представлены в главе 3.2.
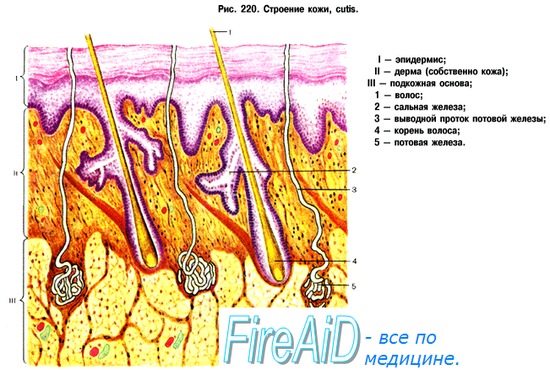
Кровоснабжение кожи. Интенсивность кровотока в сосудах кожи. Миогенная, гуморальная регуляция кровотока в коже.
Кожа в большей степени, чем другие органы, подвержена прямому действию высоких и низких температур, ультрафиолетовых лучей, механических факторов и т. д. Кровоток по ее сосудам значительно превышает собственные нутритивные потребности. Это объясняется тем, что выполнение важнейшей функции кожи человека — участие в терморегуляции — определяется не активностью метаболических процессов в ней, а теплопереносящей функцией кровотока.
В покое при нейтральной температуре внешней среды кожа получает от 5 до 10 % сердечного выброса. Суммарный кожный кровоток взрослого человека при этом составляет 200—500 мл/мин. В различных частях поверхности тела кожный кровоток значительно отличается. Например, в коже спины он составляет 9,5 мл/100 г/мин, на передней поверхности тела 15,5 мл/100 г/мин. Наиболее интенсивный кровоток отмечается в коже пальцев рук и ног, где находится большое количество артериовенозных анастомозов.
Диапазон возможного возрастания кровотока в коже велик: отношение объемной скорости кровотока в покое к максимальной его величине составляет 1:8. Максимальной величины кожный кровоток у человека достигает при тепловом стрессе. В условиях высокой внешней температуры он может возрастать с 200—500 мл/мин до 2,5—3 л/мин, а при продолжительном нагревании организма человека (температура кожи 42 °С) увеличивается до 8 л/мин, составляя 50—70 % сердечного выброса.
Нервная регуляция кровоснабжения кожи обеспечивается широко представленной иннервацией ее сосудов (особенно артериовенозных анастомозов) симпатическими адренергическими сосудосуживающими волокнами. Повышение их активности обусловливает сужение кожных сосудов, а торможение — приводит к вазодилатации.
Главным фактором в регуляции кожного кровотока является температура тела, снижение которой приводит к рефлекторному сужению как артериальных, так и венозных сосудов кожи, что способствует перемещению крови в глубокие вены и сохранению тепла. При общем охлаждении снижается кровоток как через артериовенозные анастомозы, так и через капилляры кожи. Эта реакция опосредована через гипоталамус, а эффектор-ными ее путями являются адренергические нервные волокна. При общем воздействии на организм высоких температур происходит увеличение кожного кровотока за счет, главным образом, раскрытия артериовенозных анастомозов, кровоток через которые увеличивается в 3—3,5 раза. Раскрытие анастомозов является следствием угнетения сосудосуживающей им-пульсации к кожным сосудам по симпатическим адренергическим волокнам, обусловливающим стимуляцию В-адренорецепторов. Медиаторами активной кожной вазодилатации являются гистамин и допамин.
Гуморальная регуляция. В коже имеется большое количество тучных клеток — источника вазоактивных веществ. Дегрануляция тучных клеток и выделение вазоактивных веществ (гистамина, серотонина и др.) происходит при непосредственном воздействии на кожу ультрафиолетового облучения, механических и других факторов. В сосудах кожи имеются Н,-и Н2-гистаминовые рецепторы, опосредующие вазодилататорное действие эндогенного и экзогенного гистамина. Расширение сосудов кожи вызывает субстанция Р, оказывая при этом как прямое влияние на гладкую мышцу сосудов, так и опосредованное — через гистамин, выделяющийся из тучных клеток. В коже происходит биосинтез простагландинов. Внутрикожное введение простагландинов Е2 и Н2 вызывает расширение кожных сосудов, а простагландина F2a — сужение их.
Температура самой крови является фактором, играющим важную роль в локально действующих механизмах контроля сосудистых функций в коже. При локальном нагревании кожи имеет место увеличение капиллярного кровотока без существенных изменений кровотока через артериовенозные анастомозы. В механизме вазодилатации при локальном нагревании кожи большую роль играет освобождение вазоактивных веществ (АТФ, субстанция Р, гистамин) и накопление метаболитов. Однако большее значение в развитии гиперемии в этом случае имеет прямое действие тепла на гладко-мышечные элементы кожных сосудов. При повышении температуры крови снижается миогенный тонус и уменьшаются реакции гладких мышц сосудов кожи на симпатическую импульсацию и вазоконстрикторные вещества, в частности на норадреналин. Снижение адренореактивности гладких мышц кожных сосудов под влиянием гипертермии связано с уменьшением чувствительности их альфа-адренорецепторов.
При локальном действии на кожу низких температур имеют место вазоконстрикции и снижение кожного кровотока, что обусловлено как повышением сосудистого тонуса, так и увеличением вязкости крови.
Типы адренорецепторов и их эффекты
Биологические эффекты адреналина и норадреналина реализуются через девять разных адренорецепторов (α1A,B,D, α2A,B,C, β1, β2, β3). В настоящее время клиническое значение имеет лишь классификация на α1-, α2-, β1- и β2-рецепторы. Агонисты адренорецепторов используются по различным показаниям.
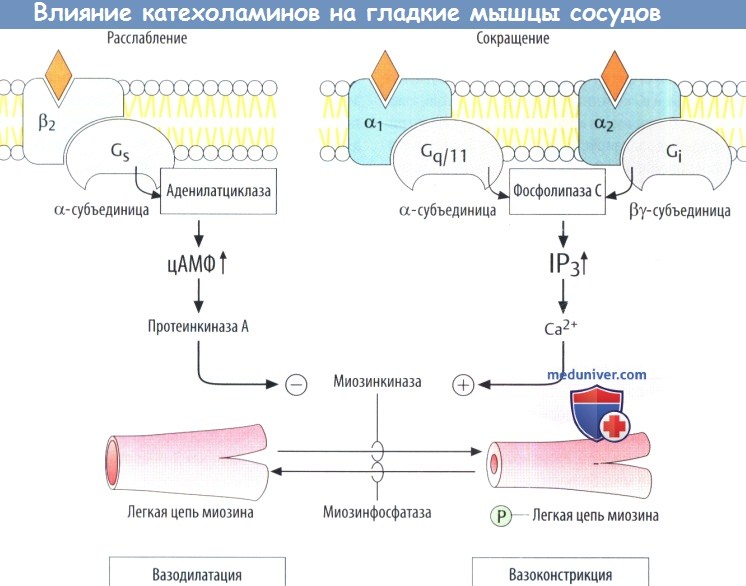
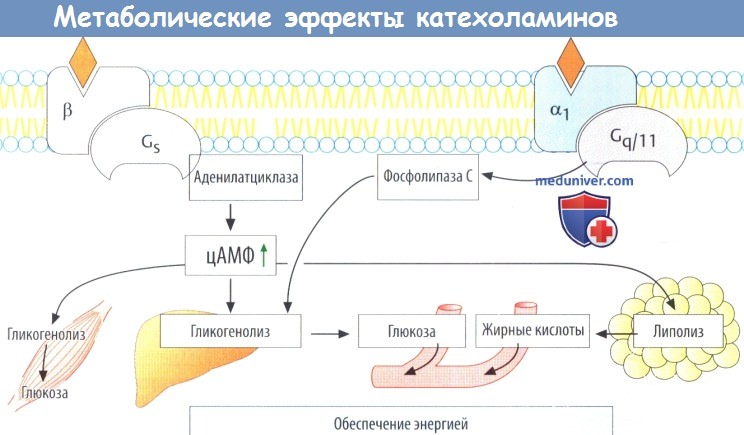
а) Влияние на гладкие мышцы. Противоположное влияние негладкие мышцы при активации α- и β-адренорецепторов обусловлено разницей в передаче сигнала. Стимуляция α1-рецепторов приводит к активации фосфолипазы С через белки Gq/11, с последующей продукцией внутриклеточного посредника инозитолтрифосфата (IP3) и повышением внутриклеточного высвобождения ионов Са 2+ .
Совместно с белком кальмодулином Са 2+ активирует киназу легкой цепи миозина, что приводит к повышению тонуса гладких мышц за счет фосфорилирования сократительного белка миозина (вазоконстрикция). α2-адренорецепторы также могут вызывать сокращение гладкомышечных клеток путем активации фосфолипазы С через βγ-субъединицы белков Gi.
цАМФ ингибирует активацию киназы легкой цепи миозина. С помощью стимулирующих белков G (Gs) β2-рецепторы вызывают повышение продукции цАМФ (вазодилатация).
Дальнейшее ингибирование киназы легкой цепи миозина приводит к расслаблению гладкомышечных клеток.
б) Вазоконстрикция и вазодилатация. Вазоконстрикция при местном введении α-симпатомиметиков может использоваться при инфильтрационной анестезии или для снятия заложенности носа (нафазолин, тетрагидрозолин, ксилометазолин).
Системное введение адреналина важно для повышения АД при купировании анафилактического шока и остановки сердца. Антагонисты α1-адренорецепторов используются при лечении гипертензии и доброкачественной гиперплазии простаты.
в) Бронходилатация. Бронходилатация в результате стимуляции β2-адренорецепторов занимает основное место в лечении бронхиальной астмы и хронической обструктивной болезни легких. С этой целью β2-агонисты обычно вводятся инфляционно; предпочтительными являются препараты с низкой пероральной биодоступностью и низким риском системных нежелательных реакций (фенотерол, сальбутамол, тербуталин).
г) Токолитическое действие. Расслабляющее действие на миометрий агонистов β2-адренорецепторов, например фенотерола, можно использовать для профилактики преждевременных родов. β2-вазодилатация у матери с неизбежным падением системного АД вызывает рефлекторную тахикардию, которая также частично связана с β1-стимулирующим действием этих препаратов. Более длительная стимуляция β2-рецепторов токолитическими средствами приводит к снижению их эффективности, при этом возникает необходимость в повышении дозы (десенситизация рецепторов).
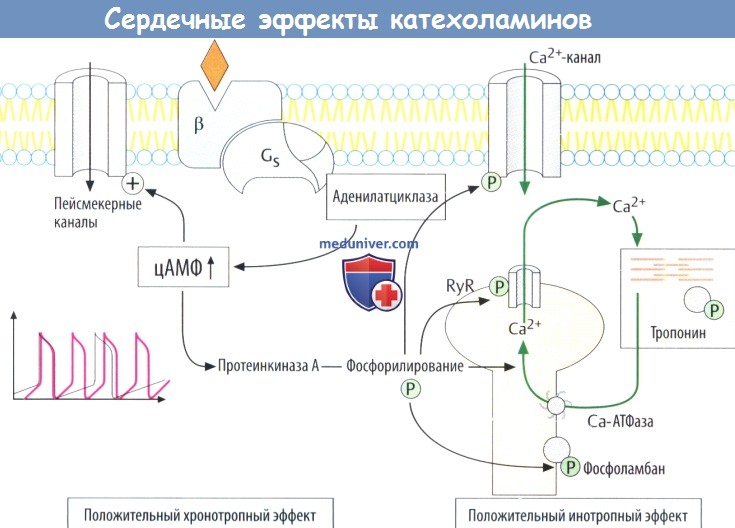
д) Стимуляция сердечной деятельности. При стимуляции β-рецепторов и, следовательно, образования цАМФ катехоламины усиливают все сердечные функции, в т. ч. ударный объем (положительный инотропный эффект), скорость сокращения кардиомиоцитов, частоту импульсов, генерируемых синоатриальным узлом (положительный хронотропный эффект), скорость проведения (дромотропный эффект) и возбудимость (батмотропный эффект).
В волокнах пейсмекеров активируются цАМФ-зависимые каналы (пейсмекерные каналы), что приводит к ускорению диастолической деполяризации и более быстрому достижению порога возбуждения для потенциала действия. цАМФ активирует про-теинкиназу А, которая фосфорилирует различные белки-переносчики Са 2+ .
С помощью такого механизма ускоряется сокращение кардиомиоцитов за счет вхождения большего количества Са 2+ в клетку из внеклеточного пространства через Са 2+ -каналы L-типа и усиливается высвобождение Са 2+ из саркоплазматического ретикулума (через рецепторы рианодина, RyR). Ускоренное расслабление кардиомиоцитов происходит в результате фосфорилирования тропонина и фосфоламбана (уменьшение ингибирующего эффекта Са 2+ -АТФазы).
При острой сердечной недостаточности или остановке сердца β-симпатомиметики используются в качестве средства неотложной помощи с коротким периодом действия. Они не показаны при хронической сердечной недостаточности.
е) Метаболические эффекты. β1-рецепторы через цАМФ и α1-рецепторы через сигнальные метаболические пути Gq/11 ускоряют превращение гликогена в глюкозу (гликогенолиз) (А) как в печени, так и в скелетных мышцах. Из печени глюкоза высвобождается в кровь. В жировой ткани триглицериды гидролизируются до жирных кислот [липолиз, опосредованный β2- и β3-рецепторами), которые затем попадают в кровь.
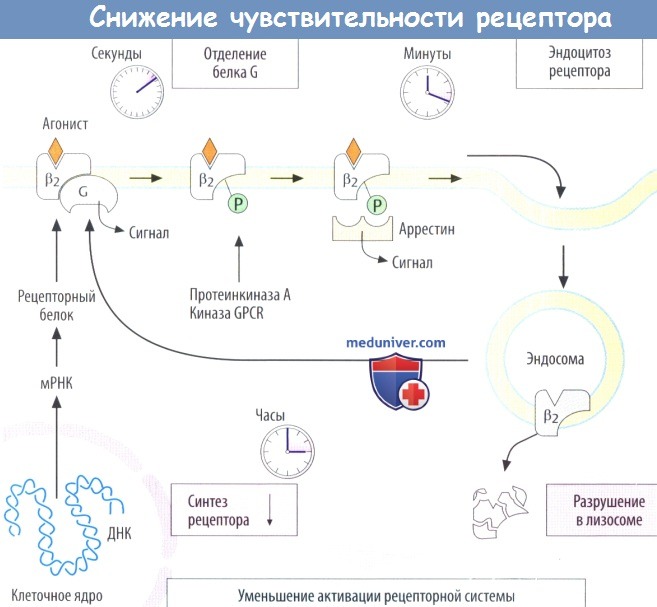
ж) Снижение чувствительности рецепторов. Длительная стимуляция агонистом активирует клеточные процессы, приводящие к уменьшению сигнала от рецепторов (десенситизация). Через несколько секунд после активации рецептора стимулируются киназы(протеинкиназа А, киназы парного рецептора белка G, GPCR). Они фосфорилируют внутриклеточные участки рецепторов, что приводит к разделению рецептора и белка G.
Фосфорилированные рецепторы распознаются адаптерным белком аррестином, который, в свою очередь, активирует внутриклеточные сигнальные метаболические пути и инициирует эндоцитоз рецепторов в течение нескольких минут. Рецепторы на клеточной поверхности удаляются путем эндоцитоза и захватываются эндосомами. Отсюда рецепторы транспортируются далее на лизосомы до разрушения или возвращаются в плазматическую мембрану (рециркуляция), где они готовы для передачи следующего сигнала.
Длительная активация рецепторов (часы) также уменьшает синтез новых рецепторных белков за счет влияния на транскрипцию, стабильность РНК и трансляцию. В целом эти процессы защищают клетку от избыточной стимуляции, но они также уменьшают действие препаратов-агонистов. При длительном или повторном введении агониста достигнутые эффекты уменьшаются (тахифилаксия). При введении β2-симпатомиметиков в виде инфузии для предупреждения преждевременных родов токолитическое действие устойчиво снижается.
Против этого процесса обычно повышают дозы лекарственного средства только в течение короткого времени, до тех пор пока нарастающая тахикардия из-за активации сердечных β-рецепторов не ограничит дальнейшее повышение дозы.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Адреналин. Норадреналин. APUD-система. Катехоламины. Контринсулярный гормон. Адреномедуллин. Гормоны мозгового вещества надпочечников и их эффекты в организме.
Мозговое вещество надпочечников содержит хромаффинные клетки, названные так из-за избирательной окраски хромом.
По происхождению и функции они являются постганглионарными нейронами симпатической нервной системы, однако, в отличие от типичных нейронов, клетки надпочечников:
1) синтезируют больше адреналина, а не норадреналина (отношение у человека между ними 6:1);
2) накапливая секрет в гранулах, после поступления нервного стимула они немедленно выбрасывают гормоны в кровь. Регуляция секреции гормонов мозгового вещества надпочечников осуществляется благодаря наличию гипоталамо-симпатоадреналовой оси, при этом симпатические нервы стимулируют хромаффинные клетки через холинорецепторы, выделяя медиатор ацетилхолин.
Хромаффинные клетки являются частью общей системы нейроэндокринных клеток организма, или APUD-системы (Amine and amine Precursors Uptake and Decarboxylation), т. е. системы поглощения и декарбокси-лирования аминов и их предшественников.
К этой системе относятся нейросекреторные клетки гипоталамуса, клетки желудочно-кишечного тракта (энтериноциты), продуцирующие кишечные гормоны, клетки островков Лангерганса поджелудочной железы и К-клетки щитовидной железы.
Гормоны мозгового вещества — катехоламины — образуются из аминокислоты тирозина поэтапно: тирозин—ДОФА—дофамин-норадреналин— адреналин. Хотя надпочечник и секретирует значительно больше адреналина, тем не менее в состоянии покоя в крови содержится в четыре раза больше норадреналина, так как он поступает в кровь и из симпатических окончаний.
Секреция катехоламинов в кровь хромаффинными клетками осуществляется с обязательным участием Са2+, кальмодулина и особого белка синексина, обеспечивающего агрегацию отдельных гранул и их связь с фосфолипидами мембраны клетки.
Катехоламины называют гормонами срочного приспособления к действию сверхпороговых раздражителей среды.
Физиологические эффекты катехоламинов обусловлены различиями в адренорецепторах (альфа и бета) клеточных мембран, при этом адреналин обладает большим сродством к бета-адренорецепторам, а норадреналин — к альфа.
Чувствительность адренорецепторов к адреналину увеличивают гормоны щитовидной железы и глюкокортикоиды. Основные функциональные эффекты адреналина проявляются в виде:
1) учащения и усиления сердечных сокращений,
2) сужения сосудов кожи и органов брюшной полости,
3) повышения теплообразования в тканях,
4) ослабления сокращений желудка и кишечника,
5) расслабления бронхиальной мускулатуры,
6) стимуляции секреции ренина почкой,
7) уменьшения образования мочи,
8) повышения возбудимости нервной системы, скорости рефлекторных процессов и эффективности приспособительных реакций.

Адреналин вызывает мощные метаболические эффекты в виде усиленного расщепления гликогена в печени и мышцах из-за активации фосфорилазы, а также подавление синтеза гликогена, угнетение потребления глюкозы тканями, что в целом ведет к гипергликемии.
Адреналин вызывает активацию распада жира, мобилизацию в кровь жирных кислот и их окисление. Все эти эффекты противоположны действию инсулина, поэтому адреналин называют контринсулярным гормоном. Адреналин усиливает окислительные процессы в тканях и повышает потребление ими кислорода.
Таким образом, как кортикостероиды, так и катехоламины обеспечивают активацию приспособительных защитных реакций организма и их энергоснабжение, повышая устойчивость организма к неблагоприятным влияниям среды.
В мозговом веществе надпочечников, кроме катехоламинов, образуется и пептидный гормон адреномедуллин. Кроме мозгового вещества надпочечников и плазмы крови он выявлен в тканях легких, почек и сердца, а также эндотелиальных клетках сосудов. Этот пептид состоит у человека из 52 аминокислот. Основное действие гормона заключается в мощном сосудорасширяющем эффекте, в связи с чем его называют гипотензивным пептидом.
Второй физиологический эффект гормона заключается в подавлении продукции альдостерона клетками клубочковой зоны коры надпочечников. При этом пептид подавляет не только базальный, фоновый уровень образования гормона, но и его секрецию, стимулированную высоким уровнем калия в плазме крови или действием ангиотензина-II.
Впервые теория ß-адренергической рецепции появилась в середине XX века. Так, в 1948 г. R.P. Ahlquist описал два функционально различных типа адренорецепторов. Исходя из качественных и количественных различий в действии основных катехоламинов на органы и ткани (адреналин, норадреналин) он предложил подразделять рецепторы на α и ß-адренорецепторы.
Катехоламины стимулируют одновременно α и ß-адренорецепторы. Адреналин является классическим прямым α, ß-адреномиметиком. Норадреналин действует как медиатор на α, ß-адренорецепторы и как лекарство – на α-адренорецепторы. Обычно стимуляция α-рецепторов вызывает эффекты возбуждения, а стимуляция ß-рецепторов сопровождается эффектами ингибирования и торможения. Хотя из этого правила имеются исключения. В миокарде превалируют ß-рецепторы, которые являются стимулирующими по механизму действия.
В желудочно-кишечном тракте (ЖКТ) расположены как α, так и ß-рецепторы, которые, напротив, являются ингибирующими. α-рецепторы сосредоточены преимущественно в кровеносных сосудах кожи, слизистых оболочек мозга и сосудах брюшной полости (почек, кишечника, сфинктерах ЖКТ, трабекулах селезенки). Сосуды в данных органах относятся к разряду емкостных. При возбуждении α-рецепторов происходит активизация физиологических процессов: сокращение гладких мышц сосудов, матки, уретры, дилататора зрачка и т.д.
В связи с их действием на сосуды повышается уровень артериального давления (АД). Стимулируя симпатическую иннервацию радиальной мышцы радужки глаза, адреналин расширяет зрачок (мидриаз). Сокращение капсулы селезенки сопровождается выбросом в кровь большого количества эритроцитов. Это носит защитный характер при реакциях напряжения вследствие гипоксии и кровопотери. ß-адренорецепторы широко представлены во всех тканях и системах организма: сердце, легких, почках, кровеносных сосудах, эндокринных железах, в нервной системе, форменных элементах крови. Возбуждение ß-рецепторов характеризуется дилатацией периферических сосудов, расслаблением гладкой мускулатуры бронхов, увеличением силы и частоты сердечных сокращений (ЧСС), сопровождается повышением автоматизма и проводимости в АВ-узле.
В свою очередь ß-рецепторы подразделяются на две группы: ß1-рецепторы (локализованы в сердце) и ß2-рецепторы (локализованы в бронхах, сосудах скелетных мышц, легочных, мозговых и коронарных сосудах, матке). Стимуляция ß1-рецепторов сопровождается увеличением частоты и силы сердечных сокращений, улучшением проводимости и повышением автоматизма; усилением гликогенолиза, липолиза.
Стимуляция ß2-рецепторов вызывает снижение функции органа: расслабление скелетных мышц, гладких мышц бронхов и кровеносных сосудов. Это означает, что ß2-адренорецепторы являются классическими «тормозными».
Такое расположение рецепторов выработано эволюционно. Подобная целесообразность обусловлена тем, что при возникновении опасности было необходимо моментально убегать. А для этого нужно резко повысить работу сердца, расширить бронхи, увеличить просвет сосудов головного мозга.
Читайте также:

