Как вводить инсулин подкожно или внутримышечно
Обновлено: 22.04.2024
Инсулин был впервые использован у больных сахарным диабетом в 1920-е годы, но первые коммерческие препараты содержали различные примеси и соответствующие потенциальные осложнения.
В 1930 был разработан протамин-цинк-инсулин, что привело к задержке всасывания и более длительному действию, тем самым уменьшая количество доз инсулина, необходимых для заместительной инсулинотерапии.
В 1946 году был произведен нейтральный протамин Хагедорна (НПХ) — главный базальный инсулин на протяжении 20-го века.
В начале 1980-х годов появились новые длительно действующие аналоги инсулина, Гларгин и Детемир, которые характеризовались:
- меньшей вариабельностью гликемии в течение дня,
- большую продолжительность действия,
- введение — 1 раз в сутки.
Поиск идеального режима инсулинотерапии все еще продолжается, стремясь обеспечить оптимальный гликемический контроль с минимальным количеством побочных явлений и улучшением состояния пациента.

Фармакокинетические и фармакодинамические профили инсулинотерапии
- Разработка новых инсулинов направлена на уменьшение эпизодов гипогликемии у пациентов и улучшение фармакокинетического(ФК)/фармакодинамического(ФД) профиля.
- Непостоянство ФК профиля среди инсулинов напрямую влияет на ФД эффекты, увеличивая вероятность эпизодов гипогликемии из-за труднопредсказуемых инсулиновых пиков.
Для того, чтобы свести к минимуму эпизоды гипогликемии или гипергликемии, были разработаны аналоги инсулина с разными ФК/ФД профилями, включая базальный и ультра-длинный базальный инсулины.
Требования для идеального базального инсулина:
- стабильный ФД профиль,
- низкий риск гипогликемии,
- длительность действия 24 ч,
- низкая индивидуальная вариабельность действия.
Сравнение между временем действия профилей разных инсулинов.

- Инсулин-НПХ характеризуется:
- замедленным всасыванием,
- пиком через 4,5 ч после приёма,
- длительностью действия менее 24 ч, так что обычно он вводится как минимум дважды в день,
- высокой индивидуальной вариабельностью.
- После подкожного введения Гларгин остаётся в подкожной клетчатке.
- Инсулин Гларгин имеет одну аминокислоту, замещенную в А цепи, и две в B цепи: это приводит
- к изменению изоэлектрической точки белка,
- снижению его растворимости при физиологическом рН.
- Похожий с Гларгином ФК/ФД профиль:
- ровный ФК/ФД профиль,
- 24 ч длительность действия,
- низкая вариабельность,
- однако, Гларгин немного более эффективен и имеет чуть более стабильный гликемический контроль.
И Гларгин, и Детемир не могут полностью имитировать физиологическую базальную секрецию инсулина.
- При приёме внутрь в больших дозах у обоих возникает пик ФК/ФД профиля;
- низких доз может не хватать для покрытия 24-х часового периода;
- также ещё имеется индивидуальная вариабельность действия.
Чтобы попытаться преодолеть эту проблему, были разработаны ультра-длинные инсулины, такие как Деглудек, LY2605541 и Гларгин 300ед.
- У инсулина Деглудек модифицирована В-цепь. Как и другие инсулины Деглюдек формирует гексамеры и дигексамеры при введении подкожно.
- Происходит медленная диффузия молекул цинка, присутствующих в гексамере и мономер инсулина всасывается.
- По сравнению с инсулинами Гларгин и Детемир, Деглудек обладает ровным ФК/ФД профилем, что уменьшает число эпизодов гипогликемии.
- Инсулин Деглудек имеет период полувыведения более 25 часов, (временя действия >42 ч),
- наиболее изученным в клинических исследованиях способ применения — 1 доза один раз в день.
- Инсулин LY2605541 (или Пегилированный Лизпро) в структуре молекулы имеет полиэтиленгликолевую (ПЭГ) полимерную цепь.
- Пэгилирование замедляет подкожную абсорбцию LY2605541 и снижает его выведение почками, способствуя созданию
- безпикового ФК/ФД профиля,
- увеличению времени полураспада LY2605541.
- потере веса,
- накоплению в печени липидов как при 1, так и при 2 типе СД.
- Механизмы накопления липидов в печени неизвестны, но это привело к прекращению использования этого инсулина.
- Механизм абсорбции такой же, как у инсулина Гларгин.
- При подкожном введении Гларгин 300ед депонируется на меньшей площади, создавая пролонгированное высвобождение, что приводит к более ровному ФК/ФД профилю, чем у гларгина 100ед.
- Действие Гларгин 300ед является более равномерным и контроль глюкозы сохраняется на протяжении 36 ч, что приводит к снижению частоты гипогликемических эпизодов (в целом, и ночных в частности) у пациентов, принимающих только инсулин или получающих инсулин в сочетании с пероральными сахароснижающими препаратами.
- Гларгин 300ед также демонстрирует снижение вариабельности и тенденцию к снижению веса по сравнению с Гларгином 100ед.
Концентрация инсулина гларгин 300ед в сравнении с 100ед на протяжении времени.
![3]()
Инсулинотерапия должна имитировать физиологическую секрецию инсулина,
- таким образом более долгий период полувыведения инсулина не всегда лучший выбор.
В качестве примера:
- Инсулин Ультраленте «ВО-С» имеет среднюю продолжительность действия 20 ч, что превосходит 14 ч инсулина НПХ.
- Но этот инсулин характеризуется:
- более высокой вариабельностью,
- высокой частотой эпизодов гипогликемии,
- худшим контролем глюкозы по сравнению с НПХ.
Ультра-длинные инсулины характеризуются:
- высокой эффективностью,
- безопасностью,
- меньшей фармакодинамической вариабельностью,
- продолжительностью действия более 24 ч.
Среди этих инсулинов как Гларгин 300, так и Деглудек могут быть использованы в качестве базальной и базально-болюсной терапии при 1 и 2 типах СД.
Клинические исследования, оценивающие составы инсулинов ультра-длительного действия
Инсулин Деглудек при СД 1-го типа
В последующем исследовании (BEGIN: Flex T1) проверялась эффективность и безопасность применения инсулина Деглудек один раз в день в зависимости от времени его введения.
- Это было открытое клиническое исследование сравнения
- введения инсулина Деглудек (100 ед/мл) в определенное время (с не менее 8 ч и не более 40 ч интервалом между введениями)
- введения инсулина Деглудек (100 ед/мл; 3 мл) или Гларгин (100 ед/мл; 3 мл) в одно и то же время однократно каждый день.
Инсулин Деглудек при СД 2 типа
BEGIN — исследование лечения базально-болюсным инсулином СД 2 типа было рандомизированным, фаза 3а, открытым, выполненным на 123 площадках в 12 странах.
- В исследование были включены взрослые пациенты с СД 2 типа, которые проходили любой курс инсулинотерапии в течение не менее 3 месяцев с приёмом или без пероральных сахароснижающих препаратов и концентрации гликированного гемоглобинат7.0–10.0 %.
- В исследование вошло 1006 пациентов, рандомизированных 3:1 для введения один раз в день инсулина Деглудек (100 ед/мл; 3 мл) или Гларгин (100 ед/мл; 3 мл) в комбинации с инсулином Аспарт во время приема пищи, с или без назначенного метформина, пиоглитазона или их обоих.
- Главной задачей было подтвердить преимущество Деглудека над Гларгином в плане снижения уровня гликированного гемоглобина.
- Через 1 год уровень гликированного гемоглобина снизился на 1.1 % в группе Деглудек и на 1,2 % в группе Гларгин (разница деглудек-гларгин: 0.08 %; 95 % ДИ -0.05 – 0.21), что доказало отсутствие его преимущества по снижению гликированного гемоглобина.
- Количество случаев гипогликемии были ниже у получавших Деглудек (11.2 против 13.6 эпизода/пациента-год; расчетный коэффициент 0.82; 95 % ДИ 0.69–0.99), в том числе и случаев ночной гипогликемии (1.4 против 1.8 эпизода/пациента-год; расчетный коэффициент 0.75; 95 % ДИ 0.58–0.99).
- Случаи тяжелой гипогликемии были крайне редкими в обеих группах.
- Частота побочных эффектов была одинакова в обеих группах.
- 26-недельное продолжение исследования показало, что Деглудек ведет к сходным улучшениям гликемического контроля по сравнению с Гларгином с меньшим количеством гипогликемических эпизодов (на 24 % меньше в целом и на 31 % меньше ночных эпизодов).
Ещё в одном большом однолетнем исследовании 3 фазы (BEGIN Once Long) было рандомизировано 1030 пациентов с СД 2 типа
- ранее не получавших инсулин,
- с недостаточной компенсацией пероральными сахароснижающими средствами (уровень гликированного гемоглобина 7-10 %),
- часть из которых подучали инсулин Деглудек (3:1), а другие Гларгин один раз в день,
- оба инсулина в сочетании с метформином.
- Инсулин Деглудек показал:
- сходные показатели гликемического контроля,
- сниженным риском развития ночной гипогликемии,
- сниженный риск развития тяжелых побочных эффектов.
Гибкий график введения инсулина Деглудек также был изучен у пациентов с СД 2 типа. Исследование BEGIN Flex:
Инсулин гларгин 300 единиц/мл при СД 1-го типа
Исследование EDITION 4 фаза 3А, результаты которого были опубликованы в 2015 г., было рандомизированным и открытым.
- В исследовании были рандомизированы 549 пациентов (1:1:1:1) для приёма один раз в день:
- инсулина Гларгин 300ед утром,
- инсулина Гларгин 300ед вечером,
- инсулина Гларгин 100ед утром,
- инсулина Гларгин 100ед вечером.
- уровень HbA1C изменился от исходного уровня, снижением 0.40 и 0.44 % соответственно (0.04; ДИ 95 % -0.10 до 0,19 %).
Инсулин гларгин 300 единиц/мл при СД 2 типа
- Исследование EDITION 1 было 6-месячным, многоцентровым (проведено в 13 странах), открытым, в которое включались:
- взрослые пациенты с СД 2 типа,
- получавшие базис-болюсную инсулинотерапию (≥42 единиц/день базального инсулина) не менее одного года (57.4 % с использованием метформина; использование других пероральных сахароснижающих препаратов не разрешшалось)
- уровнем гликированного гемоглобина 7.0–10.0 %.
- инсулина Гларгин 300ед один раз в день,
- инсулина Гларгин 100ед один раз в день.
- Пациенты, получавшие Гларгин 300ед достигли лучших результатов по снижению рисков гипогликемий на 21 % (относительный риск 0,79; 95% ДИ 0.67–0.93).
Исследование 3 фазы EDITION 2 было рандомизированным,с дизайном, похожими на EDITION 1:
- это было 6-месячное, открытое исследование,
- проведенное в 213 центрах в 13 странах,
- анализирующее взрослых пациентов с СД 2 типа,
- которые получали терапию базальным инсулином (≥42 единиц/день базального инсулина) не менее 1 года,
- имели уровень гликированного гемоглобина 7.0–10.0 %.
- не получали инсулин короткого действия перед едой,
- не могли получать других таблетированных сахароснижающих препаратов, за исключением сульфонилмочевины и глинидов (в 94 % пероральная терапия была метформином).
- инъекций инсулина Гларгин 300ед один раз в день,
- инъекций инсулина Гларгин 100ед один раз в день.
- Результаты были статистически сопоставимы в обеих группах (среднее изменение -0.57 % у тех, кто вводил 300ед Гларгина и -0.56 % у тех, кто вводил 100ед Гларгина).
- Ниже у пациентов, получавших Гларгин 300ед (21.6 %), чем Гларгин 100ед (27.9 %), со снижением риска на 23 % (относительный риск 0.77; 95 % ДИ 0.61–0.99).
- частота случаев/участник-год, подтверждающие хронические или тяжелые ночные гипогликемии, были на 37% ниже при использовании инсулина Гларгин 300ед (1.74 против 2.77; ОР = 0.63; ДИ 95 % 0.42–0.96).
EDITION 3 – ещё одно многоцентровое рандомизированное исследование оценки инсулина Гларгин 300ед, но оценивающее инсулинотерапию у взрослых пациентов с СД 2 типа на пероральных сахароснижающих препаратах.
- Участники (N = 878) были рандомизированы для инъекций
- инсулина Гларгин 300ед один раз в день
- инсулина Гларгин 100ед один раз в день в течение 6 месяцев после прекращения приёма препаратов сульфонилмочевины и глинидов.
- Снижение HbA1C в обеих группах было одинаковым (среднее изменение -1.42 % у тех, кто вводил 300ед Гларгина, и -1.46 % у тех, кто вводил 100 ед Гларгина; средняя разница 0.04 %; ДИ 95 % -0,09% до 0.17 %).
- Результаты были статистически похожи у пациентов, получавших Гларгин 300ед (16 %) или Гларгин 100ед (17 %).
Гибкие интервалы введения инсулина Гларгин 300ед также были исследованы у пациентов СД 2 типа.
- Пациенты, участвующие в EDITION 1 (N = 109) и EDITION 2 (N = 89), использовавшие гларгин 300ед, были рандомизированы на 6 месяце:
- одна группа продолжила фиксированный режим введения,
- другая перешла на гибкий график инъекций, допускающий интервалы между инъекциями 24 ± 3 ч по крайней мере 2 дня в неделю.
Барьеры для осуществления инсулинотерапии и неудовлетворенные потребности: упор на гипогликемию
Остаётся несколько барьеров для внедрения инсулина и оптимального его использования в клинической практике, как на уровне больного, так и на уровне врача. Наиболее распространенные причины для отказа от начала инсулинотерапии у больных СД 2-го типа это:
- страх гипогликемии,
- увеличение веса,
- дискомфорт, связанный с необходимостью регулярного анализа крови,
- боль от инъекций,
- мнение, что инсулинотерапия является сложным и трудоемким процессом.
На приверженность инсулинотерапии, однако, большее влияние оказывают такие факторы, как структура медицинского страхования и занятость.
Страх гипогликемии воздействует не только на решение о начале инсулинотерапии, но он может также поставить под угрозу адекватность гликемического контроля.
Сообщалось, что большинство врачей лечило бы пациентов в более агрессивной манере без адекватного контроля уровня глюкозы, если бы не опасения по поводу гипогликемии.
Бремя гипогликемии у пациентов с СД, получающих инсулинотерапию
Гипогликемия — существенный побочный эффект терапии СД, так как она
Обсервационные исследования показывают, что
- гипогликемия встречается у 42.89 случаев/пациента-год при СД 1 типа,
- 16.36 случаев/пациента-год у получающих инсулинотерапию пациентов с СД 2 типа.
Частота тяжелой гипогликемии составляет примерно
- 1.15 случаев/пациента-год и может достигать 3.2 случаев/пациента-год при СД 1-го типа;
- 0.7 случаев/пациента-год у получающих инсулинотерапию пациентов с СД 2 типа.
Ночные гипогликемии, которые происходят во время сна, особенно опасны, так как пациенты вряд ли распознают симптомы или проснутся во время такого эпизода.
- В рамках исследования DCCT было сообщено о 43 и 55 % всех гипогликемических и тяжелых гипогликемических случаях, соответственно, которые произошли во время сна.
- Большой интернет-опрос, проведенный в США среди 7.239 участников с СД 2-го типа (28.7 % на инсулинотерапии), показал, что гипогликемия
- препятствовала социальной активности,
- вызывала больше прогулов работы,
- снижение общей производительности труда,
- негативно сказывалась на общем качестве жизни.
- с потерями, составляющими от U$ 15.26 до U$ 93.47
- с уменьшением рабочего времени от 8.3 до 15,9 ч в месяц.
- 2108 респондентов (32.8 % с 1 типом СД и 67,2 % со 2 типом; 74.2 % получающих инсулин) сообщили, что частота гипогликемических эпизодов существенно повлияла на сон и функциональное состояние на следующий день, 60.7 % сообщили о развитии от умеренных до тяжелых последствий.
- Продольное исследование, включавшее 16,667 пожилых пациентов с СД 2 типа (средний возраст 65 лет; 35 %, получающих инсулин), через 27 лет показало повышенный риск развития деменции среди пациентов с гипогликемическими эпизодами, с ростом риска в зависимости от увеличения числа эпизодов гипогликемии.
Частота гипогликемических эпизодов может приводить к тому, что пациенты начинают избегать приёма лекарств, со значительным сокращением или даже отменой дозы инсулина после случая гипогликемии, что негативно отражается на гликемическом контроле.
Главными причинами высокой смертности и ранней инвалидизации при сахарном диабете становятся поздние микро- и макрососудистые осложнения. Такие синдромы, как диабетическая ретинопатия — поражение сетчатки глаз и диабетическая нефропатия — поражение клубочков почек, являются специфическими для больных сахарным диабетом. Диабетическая ретинопатия, как правило, — доминирующая причина слепоты (особенно в молодом возрасте). Распространенность слепоты среди больных сахарным диабетом в 10 раз выше, чем в популяции в целом. Диабетическая нефропатия занимает первое место среди причин высокой смертности от хронической почечной недостаточности. Смертность от болезней сердца и инсульта у больных сахарным диабетом наблюдается в два-три раза, а гангрена конечностей в 20 раз чаще, чем среди населения в целом.
За последние десятилетия удалось добиться существенного прогресса в терапии сахарного диабета 1 типа. На смену инсулинам животного происхождения пришли генно-инженерные препараты человеческого инсулина. Синтезированы аналоги инсулина ультракороткого действия: хумалог («Эли Лилли») и аспарт («Ново Нордиск»), скорость абсорбции которых значительно выше, чем у человеческих инсулинов короткого действия, что позволяет использовать их непосредственно перед едой и даже во время и после еды. Применение аналогов инсулина ультракороткого действия, вследствие меньшей длительности их эффективности, также снижает вероятность развития гипогликемии. Синтезированы и аналоги инсулина продленного действия: лантус («Авентис»), детемир («Ново Нордиск»). Их преимуществом перед человеческими пролонгированными инсулинами является отсутствие пиков действия, в связи с чем также уменьшается риск развития гипогликемии, что очень важно для пациентов с ночными гипогликемиями. В ходе терапии сахарного диабета 1 типа необходим ежедневный контроль гликемии самим пациентом, с помощью глюкометра или визуальных тест-полосок.
Целью лечения диабета стало поддержание уровня гликемии в пределах нормогликемии. В 1993 г. были опубликованы результаты проведенного в США многоцентрового исследования Diabetes Control and Complications Trial (DCCT), показавшие, что поддержание стойкой компенсации углеводного обмена приводит к предотвращению и существенному замедлению развития поздних осложнений (риск развития диабетической ретинопатии снижается на 76%, диабетической нейропатии — на 60% и альбуминурии — на 54%). Использование интенсифицированной инсулинотерапии путем многократных инъекций в течение суток (введение инсулина средней продолжительности действия или длительного действия один-два раза в день и введение инсулина короткого действия перед каждым приемом пищи из расчета инсулина на хлебные единицы) позволяет намного быстрее и эффективнее достичь компенсации углеводного обмена, нежели ранее использовавшаяся традиционная схема (фиксированное по дозам и времени введение инсулина, диета с фиксированным количеством углеводов). Интенсифицированная инсулинотерапия является имитацией нормальной секреции инсулина поджелудочной железой. Наиболее современный и удобный метод интенсивной инсулинотерапии — это лечение с помощью инсулинового дозатора (инсулиновой «помпы»), т. е. непрерывное подкожное введение инсулина.
Коммерческое производство дозаторов начато в 80-х гг., но широкое распространение они получили с середины 90-х гг. прошлого века. Количество пациентов, переведенных на инсулинотерапию посредством инсулинового дозатора, постоянно растет. Так, в США в 1990 г. дозаторы использовали 6600 пациентов, в 1993 г., когда были опубликованы результаты DCCT, — 15 тыс., в 1998 г. — 60 тыс., 2001 г. — 162 тыс. На сегодняшний день более 200 тыс. пациентов в США и более 300 тыс. пациентов во всем мире применяют дозаторы. В настоящее время существуют несколько фирм, производящих инсулиновые дозаторы: Medtronic, Deltec, Animas, Disetronic, Dana. На российском рынке представлены дозаторы фирмы Medtronic, модель 508.
Дозатор представляет собой альтернативный способ доставки инсулина. Инсулин вводится не с помощью инъекций шприцом или шприц-ручкой, а подается в организм посредством катетера, установленного подкожно и соединенного с резервуаром и блоком памяти, содержащим информацию о количестве инсулина, который необходимо ввести. Размер дозатора небольшой, примерно как сигаретная пачка. При терапии с помощью «помпы» используется только один вид инсулина — ультракороткого действия (хумалог, новоРапид) или короткого действия (хумулин Р, актрапид НМ, инсуман рапид). У дозатора есть два режима введения: непрерывная подача инсулина в микродозах (базальная скорость) и определяемая и программируемая пациентом болюсная скорость. Первый режим имитирует фоновую секрецию инсулина. Этот режим заменяет инсулин средней продолжительности или длительного действия (хумулин НПХ, протафан НМ, лантус и т. д.). Второй — болюсный — вводится пациентом во время еды или при высоком уровне гликемии, т. е. заменяет инсулин короткого действия при обычной инсулинотерапии. Сахар в крови дозатор не измеряет и необходимую дозу инсулина не рассчитывает. Количество инсулина программируется самим пациентом. Препарат поступает в организм через катетер, который устанавливается в подкожную клетчатку. Замена катетера осуществляется пациентом через каждые два-три дня.
Преимущества использования инсулинового дозатора перед инсулинотерапией посредством многократных инъекций
- Использование исключительно инсулина короткого действия и поступление его в микродозах предотвращают депонирование инсулина в подкожной клетчатке, что обеспечивает лучшее всасывание препарата, а также снижает риск гипогликемии в результате его «выброса» из искусственно созданного «депо».
- Дозатор программирует различные базальные скорости введения в зависимости от времени суток, что важно для пациентов с феноменом «утренней зари». Также имеется возможность наложения временной базальной скорости, например уменьшения скорости на время физической нагрузки, что позволяет во много раз снизить риск гипогликемии.
- Введение малых доз инсулина — шаг введения 0,05-0,1 единицы инсулина (в зависимости от дозатора) очень удобен, когда речь идет о маленьких детях с низкой потребностью в инсулине.
- Непрерывное базальное введение инсулина и возможность введения болюсной дозы нажатием комбинации кнопок на дозаторе позволяют пациенту вести более свободный образ жизни, не зависеть от времени проведения инъекций инсулина, основных приемов пищи, перекусов, т. е. во много раз повышает качество жизни.
Первые публикации, посвященные использованию инсулиновых дозаторов в клинической практике, появились в конце 1970-х гг. Исследования продемонстрировали реальную возможность добиться строгого контроля показателей углеводного обмена. С того времени значительно изменились размеры дозаторов, использовать их стало проще и безопаснее. В современных моделях есть «память» (можно воспроизвести дозы и время введения инсулина за последние три месяца), функция установки различной базальной скорости введения в зависимости от времени суток, имеется также возможность введения болюсной дозы с различной скоростью. Кроме того, изменились и стали более безопасны современные системы введения (резервуар и катетер). Подкожная часть катетера — канюля — мягкая, подвижная часть устанавливается с помощью специальных инжекторов. Появился пульт дистанционного управления дозатором.
Непрерывное подкожное введение инсулина широко использовалось в ходе DCCT. Из общего числа участников 42% использовали дозаторы в течение последнего года исследования (1992 г.). У них наряду с улучшением качества жизни было отмечено более выраженное снижение гликированного гемоглобина HbA1c по сравнению с пациентами, у которых практиковались многократные инъекции инсулина (разница составляла 0,2-0,4%). По опубликованным в 2001 г. данным исследования, проведенного Dr. Bruce W. Bode соавт., у 413 взрослых пациентов с сахарным диабетом 1 типа, использовавших инсулиновый дозатор, среднее значение гликированного гемоглобина HbA1c снизилось с 8,3 до 7,5% (при N — 6,1%) за три года. У подростков, находившихся на инсулинотерапии посредством инсулинового дозатора в течение 3,5±3,9 лет, было отмечено значительное снижение гликированного гемоглобина HbA1c с 9,6 до 8,3%. Улучшение контроля углеводного обмена у пациентов с сахарным диабетом 1 типа доказано в ходе множества исследований. Терапия посредством инсулинового дозатора у пациентов с сахарным диабетом 2 типа менее распространена. Та же группа ученых проводила исследования у 11 пациентов с СД 2 типа, у которых не удавалось достичь удовлетворительных показателей углеводного обмена при использовании многократных подкожных инъекций инсулина. Через шесть месяцев после начала терапии посредством дозатора показатели HbA1c снизились с 9,2 до 7,5%, а через 18 месяцев от начала терапии — до 7,2%.
Известно, что улучшение контроля углеводного обмена ведет к увеличению частоты развития гипогликемий. Но при использовании инсулиновых дозаторов частота гипогликемий значительно снижается по сравнению с терапией многократными инъекциями инсулина. Это объясняется несколькими причинами: возможностью изменять базальную скорость введения препарата в зависимости от времени, а также устанавливать временную базальную скорость (например, уменьшение базальной скорости на время незапланированной физической нагрузки); возможностью остановить доставку инсулина. И наконец основная причина — это отсутствие подкожного депонирования инсулина.
У инсулинотерапии посредством дозатора много преимуществ, она позволяет добиться более полной компенсации заболевания и во много раз улучшить качество жизни. Но рекомендовать данную терапию следует только хорошо обученным и дисциплинированным пациентам, так как она требует более частого контроля уровня гликемии (на начальном этапе, при подборе базальных скоростей, шесть—десять раз в сутки) и ежедневной работы врача с пациентом. Использование исключительно инсулина короткого действия в дозаторе приводит к быстрому подъему уровня гликемии при остановке поступления инсулина в организм (при неправильной установке катетера, случайном выдергивании катетера, если закончился инсулин в резервуаре дозатора и по другим причинам), что может повлечь за собой развитие кетоза. Современные дозаторы имеют хорошую систему сигнализации и при любой неполадке в работе информируют о ней пациента с помощью звукового сигнала или вибрации. Больной всегда должен иметь под рукой сменную систему (резервуар и катетер), инсулин, а также инсулиновый шприц или шприц-ручку. Назначение данной терапии требует от врача особого внимания при обучении больного, скрупулезного совместного изучения всех возможностей дозатора, а также отработки схем поведения пациента в случае возникновения тех или иных проблем.
Все компании-производители, представленные на мировом рынке, уделяют большое внимание обучению пациентов, что позволяет повысить эффективность терапии, добиться более полной компенсации углеводного обмена и одновременно повысить качество жизни больных.
Несмотря на значительные достижения за последние 10–15 лет в области диабетологии, сахарный диабет (СД) вообще и особенно СД 1 типа все еще остается неизлечимым заболеванием, и для сохранения жизни и трудоспособности больной должен постоянно получать инсулинотерапию, которая является не патогенетической, а заместительной терапией. Поэтому инсулинотерапия остается пожизненной, что естественно создает определенные трудности как для больного, так и для врача, в связи с необходимостью поддержания состояния углеводного обмена близкого к тому, которое имеется у здорового человека.
Несмотря на сложные механизмы патогенеза сосудистых осложнений диабета, которые являются причиной ранней инвалидизации и высокой летальности при сахарном диабете, установлено, что основной их причиной является гипергликемия. Справедливости ради следует отметить, что на развитие сосудистых осложнений диабета непосредственно влияет не собственно высокое содержание глюкозы в крови, а гипергликемия, опосредованно участвующая в сложном многоступенчатом процессе патогенеза сосудистых осложнений диабета. В связи с этим поиск новых препаратов и схем лечения СД направлен на восстановление нарушенного углеводного обмена и возможность его сохранения в течение длительного времени.
Проспективное исследование DCCT (Контроль сахарного диабета и его взаимосвязь с поздними осложнениями, 1993) показало, что как частота сосудистых осложнений диабета, так и время их манифестации четко коррелирует со степенью компенсации СД. Благодаря устойчивой компенсации диабета, т. е. поддержанию нормальной (или близкой к нормальной) концентрации глюкозы в крови в течение длительного времени, удается отсрочить появление поздних осложнений СД.
Понимание значимости гипергликемии в механизмах развития сосудистых осложнений находит отражение и в изменении критериев компенсации углеводного обмена при СД. Эти критерии через определенные промежутки времени изменяются в сторону приближения показателей углеводного обмена у больных СД к значениям гликемии, наблюдаемым у практически здоровых лиц.
Исходя из этого основной задачей лечения сахарного диабета является достижение компенсации. Современные критерии компенсации СД 1 типа, предложенные Европейской группой по политике СД 1 типа в 1998 г., представлены в таблице 1.
Лечение СД носит комплексный характер и включает в себя несколько компонентов: диету; дозированную физическую нагрузку; обучение больного, контроль и самоконтроль состояния углеводного обмена; применение сахароснижающих лекарственных средств; профилактику и лечение поздних осложнений СД.
Несмотря на то, что цель настоящей публикации заключается в ознакомлении практикующего врача с современными тенденциями в проведении инсулиновой терапии, тем не менее необходимо остановиться на основных моментах лечения сахарного диабета, без выполнения которых трудно добиться основной задачи лечения — снижения частоты сосудистых осложнений и стабилизации состояния больного, а также провести профилактику их развития.
Общие требования к диете:
- физиологическая (полноценная) по составу продуктов;
- изокалорийная - при диабете 1 типа;
- 4-5-кратный прием пищи в течение суток;
- исключение легкоусваиваемых углеводов;
- достаточное содержание клетчатки (волокон);
- 40-50% от общего количества жиров, содержащихся в продуктах, должно быть растительного происхождения.
Соотношение основных ингредиентов в суточном рационе больного не отличается от такового для здорового человека, т. е. около 60% от суточной калорийности пищи покрывается за счет углеводов, 24% — за счет жиров и 16% — за счет белков.
Многократный (4–5-кратный) прием пищи в течение суток позволяет более адекватно моделировать взаимоотношения между уровнем инсулина и содержанием глюкозы в крови, приближаясь к тем показателям, которые имеют место у здорового человека.
Физические нагрузки и лечебная физкультура являются обязательным компонентом терапии больных СД. Объем физической нагрузки должен быть определен с учетом возраста больного, состояния сердечно-сосудистой системы и компенсации углеводного обмена. Любая физическая нагрузка сопровождается снижением уровня глюкозы в крови, а интенсивность его снижения определяется двумя факторами: повышением скорости поглощения глюкозы из крови работающей мышцей и ускорением всасывания инсулина из места его введения благодаря усилению кровообращения при повышенной физической активности. Эти два фактора могут способствовать развитию гипогликемической комы, поэтому в день занятия физкультурой инъекцию инсулина необходимо сделать в область живота, а непосредственно перед физической нагрузкой принять дополнительно небольшое количество углеводов. Обычно рекомендуется 20 г углеводов до занятий физкультурой и через каждые 60 мин, если занятия продолжаются.
В случае, если занятия физкультурой требуют больших физических затрат или продолжительны по времени, то углеводы принимают по 40 г каждый час, а доза инсулина в этот период должна быть снижена.
Ежедневные физические нагрузки должны быть неотъемлемой и составной частью комплексной терапии СД. Они положительно влияют на течение диабета и способствуют поддержанию его стойкой компенсации при заметном снижении потребности в инсулине. Регулярные тренировки способствуют нормализации липидного обмена, улучшают микроциркуляцию, активируют фибринолиз, нормализуют повышенную секрецию катехоламинов в ответ на стрессовую ситуацию, что в итоге предотвращает развитие сосудистых осложнений (ангиопатии). У больных СД, регулярно занимающихся физкультурой, отмечены стабилизация, а у ряда пациентов регресс сосудистых осложнений сахарного диабета.
Многолетние исследования показывают, что обучение больного и выполнение им всех рекомендаций, которые он получил в период обучения в школе больного СД, способствуют снижению уровня гликированного гемоглобина в крови на 0,9–1,5%.
В процессе обучения больной должен получить четкое представление об ежедневном режиме и проведении различных манипуляций, необходимых для поддержания стабильного течения СД (выполнение рекомендаций по диете, умение проводить определение содержания глюкозы в крови и моче, рассчитать количество хлебных единиц в продуктах питания, принимаемых в конкретное время дня, и рассчитать при этом необходимую дозу инсулина и т. п.). Кроме этого, ему необходимо научиться поддерживать нормальный образ жизни (отказ от курения, сокращение до минимума приема алкоголя, соблюдение времени сна, отдыха и рабочей активности и т. д.).
Инсулинотерапия назначается всем больным СД 1 типа, которые составляют до 7–10% популяции больных диабетом, а также части больных СД 2 типа (так называемый инсулинопотребный подтип). На долю этой категории приходится 25–35% пациентов с СД 2 типа.
В соответствии с рекомендациями ВОЗ и Международной диабетической федерации и требованиями Фармакологического комитета Минздрава РФ рекомендуется использование для лечения детей, подростков и беременных женщин, страдающих СД, генно-инженерного (рекомбинантного или биосинтетического) инсулина человека, для терапии взрослых больных СД 1 типа — инсулина человека, а также для инсулинопотребных больных диабетом 2 типа — инсулина человека (у этой категории больных допускается использование монокомпонентного свиного инсулина). Следует отметить, что, несомненно, препаратом выбора при лечении больных с инсулинозависимым СД является генно-инженерный (биосинтетический или рекомбинантный) инсулин человека и все лекарственные формы, полученные на его основе. По данным Международной федерации диабета на конец 2004 г., более чем в 65% странах мира для лечения больных сахарным диабетом применяются только генно-инженерные инсулины человека. Ниже приведен рейтинг препаратов инсулина.
- Инсулины человека монокомпонентные, произведенные по ДНК-рекомбинантной технологии (генно-инженерные); РРМ < 10:
- актрапид НМ, протафан НМ, монотард НМ (Ново Нордиск);
- хумулин Р, хумулин Н (Эли Лилли);
- инсуман рапид, инсуман базал (Санофи-Авентис);
- биосулин Р и биосулин Н (Фармстандарт);
- инсуран Р и инсуран НПХ (институт биоорганической химии им. М. М. Шемякина и Ю. А. Овчинникова).
- Аналоги инсулина ультракороткого действия:
- новорапид (инсулин аспарт, Ново Нордиск);
- хумалог (инсулин лизпро, Эли Лилли);
- апидра (инсулин глюлизин, Санофи-Авентис).
- Аналоги инсулина длительного действия:
- детемир (Ново Нордиск);
- лантус (Авентис).
Характеристика перечисленных препаратов инсулина представлена в таблице 2.
Исследования, проведенные с помощью биостатора, показали, что у здорового человека секреция инсулина имеет дискретный характер на протяжении суток. Такая дискретная секреция инсулина в ответ на повышение гликемии крови осуществляется на фоне базального высвобождения инсулина из поджелудочной железы со скоростью 1–2 ЕД в час в течение суток. Современные режимы и схемы инсулинотерапии разработаны на основе этих данных.
Можно выделить следующие режимы инсулинотерапии.
- Традиционный (инсулин короткого действия перед завтраком и ужином; инсулин средней продолжительности перед завтраком и ужином): его применение в настоящее время не рекомендуется, и эта схема терапии применяется редко.
- Интенсивная инсулинотерапия, или режим многократных инъекций:
- инсулин короткого действия (актрапид НМ, биосулин Р, хумулин регуляр, инсуман-нормаль, инсуран Р и др.) - перед завтраком, обедом, ужином; а перед сном - препарат средней продолжительности действия (биосулин Н, протафан НМ, хумулин Н, инсуман базал, инсуран НПХ и др.);
- инсулин короткого действия (актрапид НМ, биосулин Р, хумулин регуляр, инсуман-нормаль, инсуран Р и др.) - перед завтраком, обедом, ужином; инсулин средней продолжительности (биосулин Н, протафан НМ, хумулин Н, инсуман базал, инсуран НПХ и др.) - перед завтраком и ужином;
- инсулин короткого действия (актрапид НМ, биосулин Р, хумулин регуляр, инсуман-нормаль, инсуран Р и др.) - перед завтраком, обедом и ужином; инсулин средней продолжительности (биосулин Н, протафан НМ, хумулин Н, инсуман базал, инсуран НПХ и др.) - перед завтраком, обедом, ужином и на ночь.
Аналоги инсулина человека или инсулины ультракороткого действия: новорапид, хумалог и апидра отличаются от препаратов инсулина короткого действия более быстрым наступлением эффекта (через 10–20 мин после введения), кроме того у них короче общая продолжительность периода воздействия (3–5 ч) по сравнению с инсулином короткого действия.
Длительность действия у аналогов инсулина или препаратов инсулина ультракороткого действия (новорапид, хумалог и апидра) короче, чем у препаратов инсулина человека короткого действия, а максимальный эффект их действия совпадает с постпрандиальной гипергликемией. Известно, что естественный инсулин как в b-клетках островка поджелудочной железы, так и в растворе инсулина короткого действия присутствует в виде гексамеров. При парентеральном введении препаратов инсулина происходит вначале диссоциация гексамеров до димеров и мономеров, в виде которых инсулин всасывается в межклеточную жидкость и кровь, достигая клеток мишеней, где он и оказывает свое биологическое действие. Быстродействующие аналоги инсулина человека или препараты ультракороткого действия имеют сниженную способность к образованию димеров и гексамеров, т. е. большая часть молекул аналогов инсулина начинает всасываться в виде мономеров из подкожной клетчатки сразу после инъекции, при этом они создают в течение короткого времени концентрации, достаточные для оказания биологического действия.
Как правило, препараты инсулина короткого действия (их называют также растворимыми) вводят подкожно, но в случае необходимости внутримышечно или внутривенно. Время начала и пика действия растворимого инсулина (короткого действия) зависит от способа его введения. Так, пик действия инсулина при внутривенном введении наступает через 1 мин, при интраперитонеальном — через 15 мин, при внутримышечном — через 60 мин, при подкожном — через 90 мин, а при интраназальном — через 10 мин. При подкожном применении инсулина индивидуальный коэффициент вариации начала и максимального действия составляет от 25 до 35%, а по некоторым данным — даже до 50%. Это различие связано со скоростью абсорбции инсулина из места его инъекции, которая зависит от многочисленных факторов (времени суток и состояния микроциркуляции, введенной дозы, количества подкожно-жировой клетчатки и т. д.).
До последнего времени в нашей стране применялись генно-инженерные препараты инсулина в основном трех фирм-производителей: Ново Нордиск, Эли Лилли и Санофи-Авентис. К настоящему времени проведены клинические исследования по оценке эффективности и безопасности рекомбинантных генно-инженерных препаратов инсулина человека фирмы Фармстандарт-Уфавита, производимых из субстанции генно-инженерного происхождения (Диосинт, Франция) — биосулин Р (короткого действия) и биосулин Н (средней продолжительности действия).
Результаты анализов показали, что содержание в сыворотке крови уровня печеночных ферментов, липидов, электролитов, остаточного азота, мочевины, креатинина оставалось в период применения указанных инсулинов в пределах нормальных показателей. Ни у одного больного не отмечалось аллергических реакций и других побочных явлений.
К препаратам инсулина средней продолжительности действия относятся: биосулин Н (Фармстандарт), протафан НМ (Ново Нордиск), хумулин Н или НПХ (Эли Лилли), инсуман базал (Санофи-Авентис), инсуран НПХ (Институт биоорганической химии им М. М. Шемякина и Ю. А. Овчинникова). Начало действия этих препаратов — через 1,5 ч после введения; максимум действия — через 4–12 ч и длительность действия — 18–24 ч. Следует иметь в виду, что у препаратов указанной группы имеются незначительные вариации (± 1–1,5 ч) как максимальной эффективности, так и общей продолжительности действия. Имея уровень рН, близкий к рН тканей организма, большинство препаратов инсулина пролонгированного действия почти не разрушаются в месте введения, сохраняя практически 100%-ную активность.
Гипогликемический эффект инсулинов продленного действия гораздо дольше, чем препаратов инсулина короткого действия, благодаря медленному поступлению из места инъекции в межклеточную жидкость и центральное кровообращение. Замедление скорости всасывания инсулина в препаратах, содержащих суспензию цинк-инсулина, обусловлено наличием кристаллов цинка различной величины.
В качестве пролонгатора всасывания инсулина из места введения препаратов типа НПХ (биосулин Н, протафан, хумулин и др.) используется белок протамин, получаемый из молок лососевых рыб. В отличие от препаратов типа лента препараты НПХ содержат инсулин и протамин в равном (изофанном) количестве.
Более предсказуемое действие НПХ-инсулина, а также возможность смешивания с инсулином короткого действия привели к тому, что в настоящее время в мире подавляющее количество пациентов использует НПХ-инсулин, доля цинк-инсулина составляет, по некоторым данным, менее 2–3% от всех используемых инсулинов. В России ситуация коренным образом отличается: 20–30% наших пациентов применяют именно цинк-инсулин. Исходя из вышесказанного, целесообразным представляется постепенный перевод пациентов с цинк-инсулина на НПХ-инсулин.
Инсулины НПХ можно смешивать в одном шприце в любых соотношениях с препаратами короткого действия без изменения фармакокинетики составляющих их частей.
Что же касается цинк-инсулинов, смешивать их в одном шприце с препаратами короткого действия нельзя.
В случае смешения этих препаратов, инсулин короткого действия будет взаимодействовать в шприце с кристаллами цинк-инсулина, переходя в аморфную или кристаллическую форму, теряя при этом все биологические свойства инсулина короткого действия.
В связи с наличием на отечественном рынке препаратов инсулина различных производителей одновременно использовать препараты короткого действия и средней продолжительности можно только в том случае, если они выпускаются одной и той же фирмой. Это связано с тем, что разные компании используют в препаратах инсулина в качестве консервантов и других обязательных компонентов различные добавки, которые могут интерферировать друг с другом и оказывать нежелательное воздействие на организм.
В настоящее время в России, как и в других странах мира, используются препараты инсулина человека в концентрациях 100 ЕД/мл. Отечественные производители шприцев для введения инсулина в указанных концентрациях освоили выпуск шприцев для введения препаратов инсулина в концентрации 100 ЕД/мл.
Разработаны двухпиковые, смешанные или препараты инсулина комбинированного действия. Такие препараты представляют собой различную комбинацию инсулина короткого действия и инсулина средней продолжительности действия (НПХ или инсулина изофан, протафан или базал).
Фирма Ново Нордиск производит препараты инсулина человека в виде готовых смесей в картриджах (пенфилл): микстард 10 НМ, микстард 20 НМ, микстард 30 НМ, микстард 40 НМ и микстард 50 НМ, которые содержат 10, 20, 30, 40 и 50% инсулина короткого действия и 90, 80, 70, 60 и 50% соответственно инсулина протафан.
Фирма Санофи-Авентис производит инсулины комб 15 (инсуман рапид —15% и инсуман базал — 85%), инсуман комб 25 (инсуман рапид — 25% и инсуман базал — 75%) и инсуман комб 50 (инсуман рапид — 50% и инсуман базал — 50%).
На основе аналогов инсулина или инсулинов ультракороткого действия были разработаны и применяются в клинической практике препараты бифазного или комбинированного действия: новомикс 30 (30% — инсулина новорапид или аспарт и 70% — протаминированного инсулина новорапид или аспарт) производства Ново Нордиск и лизпро микс 25 (25% — инсулина хумалог и 75% — протамин хумалога) производства Эли Лилли.
Таким образом, современная медицина располагает большим набором отечественных и импортных препаратов инсулина человека и его аналогов, с помощью которых возможно поддержание компенсации углеводного обмена на протяжении длительного периода. Это позволяет повысить качество жизни больных СД, отсрочить появление и скорость прогрессирования сосудистых осложнений, а следовательно, снизить частоту инвалидизации и уменьшить летальность данной категории пациентов. Это, в свою очередь, несомненно, позволит в какой-то степени сократить экономические потери, которые несет сегодня государство.
М. И. Балаболкин, доктор медицинских наук, профессор
Е. М. Клебанова, кандидат медицинских наук
ММА им. И. М. Сеченова, МоскваВрач может назначить Вам одну или две инъекции продленного инсулина в сутки (утром и вечером).
Сколько инъекций (1 или 2) будет назначено, зависит от времени действия конкретного препарата инсулина (действует он сутки или меньше) и от инсулина, который вводится на еду.
Часто днем фон обеспечивается за счет «хвостов» пищевого инсулина, а длинный инсулин вводится только на ночь.
При схеме, при которой дневной фон поддерживается за счет пищевого инсулина, следует помнить, что если Вы будете пропускать прием пищи и не вводить короткий инсулин, то Вам днем не хватит фонового инсулина.
Потребность в базальном инсулине может меняться в течение суток. Но в целом, правильно подобранная доза базального инсулина в обычном режиме (без острых заболеваний и пр.) меняется редко. Не надо без причины каждый день изменять дозу базального инсулина. Регулировать колебания глюкозы крови в результате приема пищи надо коротким инсулином.
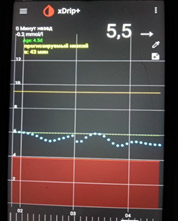
Доза базального инсулина адекватна, если глюкоза крови в пределах целевого уровня утром натощак, ночью и в период пропусков пищи.
Базальный ночной инсулин должен «держать» тот уровень глюкозы, который был перед сном. Т.е. если доза базального инсулина подобрана правильно, то с каким сахаром Вы легли спать, с таким и должны встать.
Какие существуют требования к базальным инсулинам?
Основное требование – отсутствие пика действия. Инсулин должен действовать максимально ровно. Иначе на пике действия возможны гипогликемии. Все генно-инженерные базальные инсулины (протамин, хумулин Н, базал, генсулин Н, протафан и др.) являются пиковыми (имеют пик действия) и это их существенный недостаток. Профиль действия этих инсулинов такой: начало — через 1-2 часа с момента подкожного введения; «пик» — 5-8 часов; общая продолжительность действия — 16-18 часов (изначально была заявлена 24 часа).
Аналоги сверхдлительного действия (лантус, гларгин, левемир, туджео, тресиба) являются беспиковыми инсулинами (инсулины «плоского» действия) и это их огромное преимущество.
Как правильно подобрать фоновый инсулин?
При диабете 2 типа часто инсулинотерапия начинается с инъекции инсулина на ночь («подколка»). При диабете 1 типа базальный инсулин также часто вводится 1 раз вечером.
Оценивать дозу вечернего базального инсулина необходимо по уровню глюкозы крови ночью и утром.
Ночью и утром уровень глюкозы крови находится в пределах целевого уровня, значит, доза инсулина подобрана правильно.
Часто на практике увеличение дозы ночного базального инсулина осуществляется по уровню глюкозы натощак. Если глюкоза крови утром выше целевых значений, просто увеличивается доза ночного инсулина. Это не совсем верный подход. Необходимо сначала разобраться, почему утром высокий уровень глюкозы.
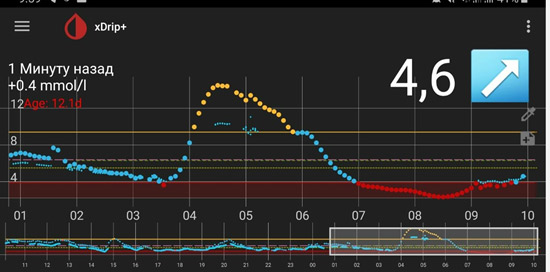
Утренняя гипергликемия – одна из самых сложных проблем в лечении сахарного диабета.
Причиной высокого уровня гликемии утром могут быть:
- Высокий уровень гликемии перед сном.
- «Поздний ужин»: («медленная» еда вечером, которая «вылазит» ночью и «висит» всю ночь).
- Недостаток инсулина.
- Недостаточная продолжительность действия инсулина.
- Ночные гипогликемии.
- Феномен «утренней зари».
- «Ранний ужин» при СД 2.
- Рост уровня глюкозы после пробуждения («стресс пробуждения», феномен «ноги на пол»).
В этом перечне не перечислены такие технические причины, как неисправность шприц-ручки, загиб канюли, испорченный инсулин, введение в места липодистрофий и др.
Чтобы проверить дозу базального ночного инсулина, надо правильно поужинать. Ужин должен быть не позднее, чем за 4 часа до сна. Также ужин должен быть необильным и «легким». При проверке базы на ужин нельзя есть макароны, гречку, перловку, сложные продукты (пельмени, блины, плов и пр.), творог и продукты из него (сырники, запеканка и др.), жирные продукты. Можно: пшенную кашу, геркулес, отварную картошку, отварные и свежие овощи, отварное мясо, отварная рыба, хлеб. Смысл раннего ужина: если поужинать поздно и соответственно поздно ввести короткий инсулин, то действие короткого инсулина наслоится на действие базального инсулина и нельзя будет правильно оценить дозу базального инсулина. Смысл «легкого» ужина: продукты должны усвоиться организмом до того, как человек ляжет спать, т.е. еда должна быть «быстрой». Если поужинать «медленной» едой, она «вылезет» ночью и всю ночь будет повышать уровень глюкозы крови.
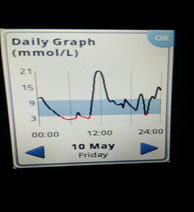
Следующий момент – замеры глюкозы. Если нет мониторинга, замеры надо делать как минимум 5 раз: перед сном; в 00.00; в 03.00; в 06.00 и перед завтраком. Для этого заводится будильник (или спящему пациенту измеряет другой человек). Еще лучше измерять каждые 2 часа. Желательно (многие считают, что обязательно) такую проверку проводить не одну ночь, а три ночи, что исключить случайные колебания. Если четко вырисовывается проблемный участок, на нем надо провести замеры каждый час.
Какие возможны варианты
1) Глюкоза ночью и утром в пределах целевого уровня – оптимальная доза базального инсулина.
![dbi 1]()
2) Линейный рост - нехватка базального инсулина (мало инсулина).
![dbi 2]()
На мониторинге мы видим, что глюкоза крови с 01.00 непрерывно растет, значит надо увеличивать дозу базального инсулина. Но, если на ужин ели «тяжелую» пищу (пельмени, макароны, много мяса и др.), то это может «вылезать» еда!
3) Рост глюкозы крови начинается ближе к утру и растет постепенно - недостаточная продолжительность действия инсулина (инсулин «не тянет» до утра).
![dbi 3]()
Что можно сделать в таком случае:
а) сместить время инъекции на более позднее время;
б) попробовать увеличить дозу инсулина – если нет тенденции к низкому уровню глюкозы;
в) вводить инсулин в более «медленное» место (ногу);
г) заменить инсулин на аналог.
4) Низкий уровень глюкозы ночью, а утром высокий. Такая ситуация говорит об избытке базального инсулина.
![dbi 4]()
Если доза базального инсулина избыточна, то ночью может быть низкий уровень глюкозы крови, на что организм реагирует выбросом гликогена из печени и уровень глюкозы крови растет (так называемый «откат»). Гипогликемия чаще возникает на пике действия инсулина длительного действия (если вводится «пиковый» инсулин). Гипогликемию человек может и не почувствовать. Может быть просто приступ потливости (человек просыпается весь мокрый), человеку могут сниться кошмары, а также могут возникнуть другие неспецифические симптомы. Гипогликемия может длиться несколько минут и ее можно не «поймать» при измерении глюкозы (иногда даже на мониторинге). Вместо гипогликемии фиксируются высокий уровень глюкозы и увеличивается доза инсулина. Но вместо снижения глюкозы крови получаем еще больший рост. Такая ситуация часто встречается при введении «пиковых» инсулинов. Это синдром Сомоджи - синдром передозировки инсулина.
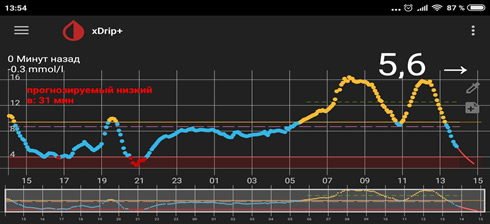
5) Резкий рост глюкозы под утро - «утренняя заря».
![dbi 5]()
В такой ситуации мы видим, что ночью глюкоза находится в целевом диапазоне, но с 4-5 утра начинается резкий рост. Борьба с «зарей» непроста. Если человек на помпе, на это время выставляется большая доза введения инсулина. Если нет, «зарю» надо «скалывать» коротким инсулином. И часто «скалывать» надо на предупреждение (т.е. путем мониторинга или частых замеров четко определяется, в какое время начинается заря, и короткий инсулин вводится до этого времени, т.к. когда «заря» развернулась, «сколоть» ее непросто).
6) Рост уровня глюкозы после пробуждения («стресс пробуждения», феномен «ноги на пол»).
![dbi 6]()
Ситуация похожа с «утренней зарей», но возникает после того как человек проснулся. Т.е. человек проснулся с нормальным уровнем глюкозы крови, получает базальный инсулин суточного действия, не завтракает и не вводит инсулин короткого действия. Казалось бы, глюкоза крови не должна расти (еды нет, базальный инсулин есть). Однако нередко, чем дольше не ест человек, тем больше растет глюкоза и плохо «скалывается» коротким инсулином. Это печень начинает Вас «кормить», раз не хотите есть сами. В такой ситуации надо ввести привычку завтракать вскоре после пробуждения.
В целом, ситуации с утренней зарей, передозировкой или нехваткой инсулина бывает очень сложно дифференцировать.
Проверка базального инсулина в течение дня осуществляется пропуском пищи. Чтобы оценить базу с утра до обеда, утром не вводится короткий инсулин, до обеда ничего не есть, измерять глюкозу каждый час. Чтобы оценить участок с обеда до ужина, между завтраком и ужином должно пройти не менее 4 часов, в обед не вводится короткий инсулин, пропускается обед, измеряется глюкоза каждый час. Аналогично – участок от ужина до сна. На протяжении всего проверяемого периода не должно быть перекусов, введения дополнительных доз инсулина.
Способ проверки базы пропуском еды не подходит, если дневной фон обеспечивается за счет «хвостов» короткого инсулина (т.е. инсулин длительного действия с продолжительностью действия менее 12 часов вводится 1 раз в сутки на ночь). Проверка базы должна в отсутствие физической активности, острых заболеваний, стрессов. Нельзя проверять базу после перенесенной гипогликемии.
Читайте также: