Как проходит химиотерапия при раке кожи
Обновлено: 18.04.2024
Лекарственная противоопухолевая терапия, в том числе и химиотерапия, – один из основных методов лечения рака. При химиотерапии в человеческий организм вводятся различные токсические вещества, которые губительно воздействуют на клетки злокачественных опухолей. Важно при этом, чтобы яды и токсины оказывали наименьшее отрицательное воздействие на весь организм больного.
Схемы химиотерапевтического лечения регламентируются международными методиками и правилами, и рассчитываются индивидуально. Врач-химиотерапевт подбирает пациенту лечение, руководствуясь различными критериями, среди которых:
- морфологическая форма рака
- распространённость процесса
- возраст пациента
- наличие сопутствующих заболеваний и так далее.
Процедура представляет собой внутривенное введение химиопрепаратов или приём таблеток и капсул. Чаще всего терапия назначается несколькими циклами и должна повторяться через определённый промежуток времени – это связано с клеточным циклом.

Виды химиотерапии
- монохимиотерапия — лечение одним препаратом;
- полихимиотерапия — лечение несколькими препаратами одновременно.
Сложные комбинации из нескольких химиопрепаратов на сегодняшний день используются чаще, так как они более эффективные.

Химиотерапия нередко применяется как часть комбинированного лечения рака:
- неоадъюватная — проводится до радикального лечения;
- адъювантная — назначается после хирургической операции.
Дозы и режимы применения противоопухолевых препаратов
Противоопухолевые лекарственные препараты и их дозировка подбираются строго индивидуально.
У каждого препарата имеются свои характеристики и особенности. При проведении химиотерапии важными являются следующие параметры:
- доза препарата
- режим и методика его введения
- интервал между введениями
- осложнения на фоне его применения.


Дозу препарата рассчитывают исходя из схемы химиотерапии, роста, веса, возраста, состояния больного, а в некоторых случаях, на основании лабораторных показателей пациента.
Режимы
Если необходимо повысить интенсивность химиотерапии, то увеличивают дозу препарата, это так называемая высокодозная терапия, либо сокращают интервал между курсами ХТ, то есть вводят уплотненные режимы.
Также существуют метрономные режимы применения цитостатических препаратов, когда вводятся малые дозы препаратов, но постоянно в течение длительного времени.
После каждого курса химитерапевтического лечения обязательно делается определенный перерыв для восстановления организма. Как правило, повторные курсы ХТ проводят через каждые три-четыре недели, это период, в течение которого восстанавливаются показатели лейкоцитов, тромбоцитов и пр.
При использовании некоторых химиопрепаратов, к примеру, нитрозопроизводных, этот интервал увеличивается до 6 недель.
Продолжительность лечения и количество курсов химиотерапии зависит от вида опухоли, от особенностей течения болезни от того, как организм реагирует на лечение. Иногда возникает необходимость прекратить или изменить лечение, и это решение принимает лечащий врач.
Способы применения химиопрепаратов
- Системная химиотерапия
Препараты вводятся внутрь (через рот), подкожно, внутривенно, внутримышечно, ректально.
Системная химиотерапия подразумевает воздействие на весь организм. - Регионарная химиотерапия
Подразумевается воздействие цитостатического препарата в повышенных концентрациях на опухолевую массу с ограничением его поступления в другие органы путем введения в сосуды, питающие новообразование (например, при меланоме). - Локальная химиотерапия
Препараты в виде мазей или растворов наносят на поверхностные опухолевые очаги (кожные язвы), вводят в серозные полости (асцит, плеврит), спинномозговой канал (интратекально) при поражении мозговых оболочек и внутрипузырно – при новообразованиях мочевого пузыря.
Правила введения противоопухолевых препаратов
Наиболее широко используется внутривенное введение противоопухолевых средств. При этом врач обязательно учитывает индивидуальные особенности вен пациентов.
- введение противоопухолевых препаратов должно выполняться только в отделениях, специализирующихся в цитотоксической химиотерапии;
- медицинские сестры для выполнению работ с цитостатиками должны пройти специальную подготовку;
- необходимо соблюдать последовательность и скорость введения препаратов, учитывать химические свойства препаратов при использовании оборудования для их введения;
- соблюдать правила и сроки хранения препаратов, как в аптечной упаковке, так и после их приготовления;
- нельзя смешивать препараты «в одном флаконе», если в инструкции по применению данных препаратов нет для этого особых указаний.
- приготовление инъекционных растворов должно выполняться в стерильном боксе;
- иглы, шприцы, флаконы, ампулы и остатки неиспользованных препаратов должны уничтожаться;
- для инфузии химиотерапевтических препаратов, обладающих кожно-нарывным действием, не должны использоваться иглы типа «бабочка»; предпочтительнее использование периферических катетеров типа «браунюля»;
- для препаратов кожно-нарывного действия с длительным периодом инфузии (12 часов и более) предпочтительнее использовать центральный венозный доступ — установка порт-системы.


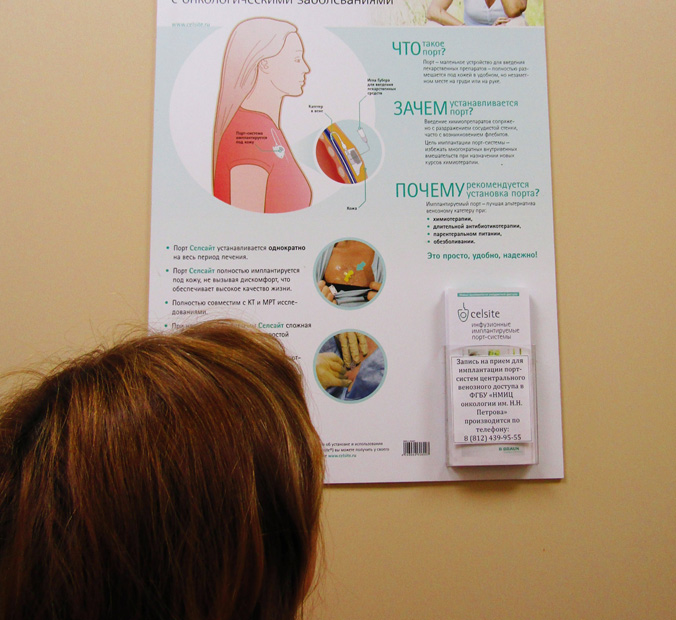
Имплантируемые порт-системы
Имплантируемая порт-система — это катетер, установленный в сосуд или полость и соединенный с ним резервуар-камера. Система «порт — катетер» широко используется в медицине уже более чем 30 лет.
Порт-системы помогают проходить лечение более эффективно, безопасно и качественно. Особенно актуальна их установка в качестве устройства сосудистого доступа пациентам, которым назначено длительное лечение, при осложнениях на фоне химиотерапии, которые привели к затруднению венозного доступа.
При этом терапию пациент может получать как в условиях стационара, так и амбулаторно.
Инфузия лекарственных препаратов производится с помощью специальных игл типа Губера, которые, пунктируя силиконовую мембрану порта, позволяют вводить инфузионный раствор в резервуар, не повреждая силиконовую мембрану. Далее препарат попадает через катетер в кровоток или полость, в зависимости от вида порт-системы и места расположения катетера.
Порт- система полностью скрыта под кожей. Поэтому она подходит для длительного использования, не обременяет пациента и не мешает проведению гигиенических процедур. Необходимо помнить, что при отсутствии использования порт-систему необходимо промывать как минимум 1 раз в 2 месяца.
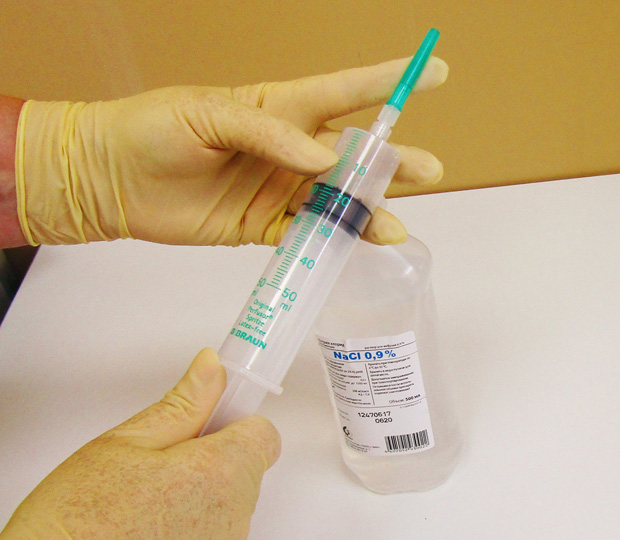
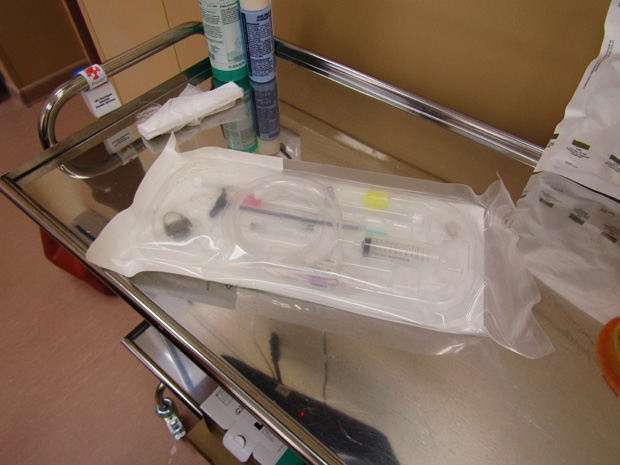
Подготовка к химиотерапии
Химиотерапия – это лечение ядами, поэтому врач перед проведением терапии требует выполнить большой список анализов и обследований для мониторинга функционирования различных органов и выбора схемы лечения. Желательно еще до начала химиотерапии пройти курс лечения всех хронических очагов инфекции: кариеса, хронического гастрита и прочих.
Чтобы не было проблем с поиском вен и установкой катетера за день до химиотерапии желательно выпить 1,5-2 литра жидкости.
Для тренировки вен рекомендуется периодически сжимать кистевой эспандер по 10 мин 3 раза в день или до усталости. При этом рука должна быть свешена ниже уровня сердца.
В день проведения ХТ нужно держать руки в тепле, возможно применение теплых обертываний на места инъекций. Можно периодически обрабатывать руки теплыми полотенцами.
Во время прохождения химиотерапии
В день химиотерапии, с утра необходимо позавтракать.
Далее необходимо соблюдать несколько несложных правил:
Об осложнениях после химиотерапии читайте здесь.
Возможно ли повысить эффективность химиотерапии?
Поиск основных направлений повышения эффективности терапии опухолей осуществляется в разных направлениях:
- разработка препаратов нового типа, в частности таргетной терапии, избирательно действующих на опухолевые клетки;
- разработка комбинированного применения двух и более препаратов — полихимиотерапии;
- совершенствование химиотерапии как этапа комбинированного лечения опухолей;
- применение иных лекарств для уменьшения побочного действия химиотерапии;
- доработка методик применения препаратов — дозирования, режима.

Авторская публикация:
ЯНЧИЙ МАРИНА НИКОЛАЕВНА
врач-онколог отделения краткосрочной химиотерапии
НМИЦ онкологии им Н.Н. Петрова Минздрава России
Автор - Светлана Николаевна Уварова, главный врач клиники De Vita, онколог-химиотерапевт, врач высшей категории.
Паллиативная химиотерапия проводится онкологическим пациентам в том случае, когда радикальное излечение невозможно, но реально достичь временной ремиссии, стабилизации или приостановить дальнейшее прогрессирование заболевания. Как правило, это поздние стадии рака с наличием отдаленных метастазов.
Цель паллиативной химиотерапии не только улучшение качества жизни пациента с онкологическим диагнозом, но и ее продление. Она позволяет контролировать симптомы, предотвращать осложнения и увеличивает выживаемость пациентов с диссеминированными опухолями на месяцы и годы. Благодаря уменьшению размеров или приостановления роста опухоли уменьшаются клинические проявления онкологического заболевания.
- Увеличение продолжительности жизни пациента;
- Улучшение качества жизни;
- Уменьшение потребности в анальгетических препаратах.
Задачи паллиативной химиотерапии:
- Остановка роста опухоли путем уменьшения в объеме опухоли, пораженных лимфатических узлов, метастазов в костях и других органах;
- Уменьшение интоксикации организма больного;
- Купирование болевого синдрома;
- Устранение или предупреждение развития патологических симптомов, таких как одышка, кровохарканье, учащенное сердцебиение, онкологическая лихорадка;
- Сдерживание плеврита и асцита (накопление жидкости в плевральных и брюшной полостях).

Круглова Марина Сергеевна
Онколог-химиотерапевт, врач высшей категории, врач паллиативной медицины
При каких видах рака проводится паллиативная химиотерапия?
Паллиативная химиотерапия проводится при многочисленных нозологиях, в том числе при метастатическом раке молочной железы, раке яичников, раке легкого, раке желудка, колоректальном раке. Эффективность паллиативной химиотерапии подтверждена многочисленными клиническими испытаниями, включая рандомизированные исследования.
- однолетняя выживаемость после паллиативной химиотерапии - 30% больных,
- при симптоматическом лечении – только 10%.
Выбор режима паллиативной химиотерапии рака желудка будет зависеть от предыдущего лечения от общего состояния пациента. Как правило, это полихимиотерапия, включающая 2-3-4 цитостатика. Также при метастатическом раке желудка можно провести генетическое тестирование для выявления маркеров опухоли (HER2neu, PD-L1, MSI), чтобы назначить иммунотерапию или присоединить таргетную терапию.
Паллиативная химиотерапия является главным методом лечения пациентов с метастатическим раком толстой кишки. Существует много активных химиопрепаратов, которые можно использовать в различных комбинациях. Паллиативная химиотерапия проводится непрерывно. Первая линия назначается до прогрессирования заболевания, то есть до тех пор, пока опухоль кишечника реагирует на лечение, дальше подбирается следующая линия терапии.
При метастатическом раке толстой кишки так же можно провести молекулярно-генетическое тестирование, по результатам которого возможно присоединить таргетные или иммунопрепараты.
Это позволяет увеличить выживаемость и снизить токсичность от лечения. Например, добавление препарата Цетуксимаб (Эрбитукс) в качестве первой линии терапии обеспечивает медиану общей выживаемости в 33,1 месяца, что является беспрецедентным результатом. Без противоопухолевого лечения такие больные живут в среднем 5-6 месяцев.
В арсенале паллиативного лечения метастатического рака молочной железы сегодня есть и паллиативная химиотерапия, и таргетные препараты, и бисфосфонаты.
Метастатический рак молочной железы хорошо поддается лечению, и во многих случаях паллиативная химиотерапия позволяет достичь длительной ремиссии.
Совсем недавно появился новый таргетный препарат Пертузумаб, который показывает высокую эффективность при метастатическом поражении головного мозга при раке молочной железы с гиперэкспрессией HER2neu. Пертузумаб в комбинации с трастузумабом и доцетакселом позволяет достичь медианы общей выживаемости в 34,4 месяца, что является беспрецедентным результатом.
Результаты клинических исследований различных режимов паллиативной химиотерапии также свидетельствуют о значительном увеличении общей продолжительности жизни, которая в среднем составляет около 4-4,5 лет. В то время как применение только симптоматической терапии у данной категории больных увеличивает продолжительность жизни лишь на 3-5 месяцев.
При раке яичников прогрессирование происходит преимущественно за счет распространения метастазов по брюшине и отличается малосимптомным течением на ранних стадиях. В связи с этим около 70% больных на момент постановки диагноза имеют III или IV стадию, требующую выполнения циторедуктивной операции и проведения паллиативной химиотерапии.
Более 50% больных с распространенным раком яичников достигают полной клинической ремиссии после современного комбинированного лечения. Однако у большинства из них в течение первых трех лет развивается рецидив. Пятилетняя выживаемость больных с распространенным раком яичников, получающих комбинированное лечение, составляет 10%.
Паллиативная химиотерапия при раке предстательной железы
- Доцетаксел + андрогенная депривация;
- Андрогенная депривация + Абиратерон (+Преднизолон);
При прогрессировании заболевания на данных режимах появилась возможность выбора последующих линий паллиативной химиотерапии – Кабазитаксел, Митоксантрон, Энзалутамид или радионуклидная терапия препаратом радий-223 (Ксофиго).
Развивается персонализированная терапия, и, если у пациента обнаружены мутации BRCA-1,2, возможно назначение PARP-ингибиторов – например, препарата Олапариб.
Непрерывное проведение адекватного противоопухолевого лечения позволяет продлить жизнь пациентам с распространенным раком предстательной железы на 3-5 и более лет.
В нашу онкологическую клинику обращаются пациенты на всех стадиях заболевания, в том числе и поздних. Мы убеждены, что паллиативное лечение не ограничивается только назначением схемы химиотерапии, оно гораздо шире и сочетает в себе общение с пациентом и его родственниками, уход, сочетание профессиональных и таких личных качеств, как забота и неравнодушие.
Наш опыт показывает, что усердие, терпение, желание и стремление помогать, тщательный анализ возможностей лечения, использование современной сопроводительной терапии дают впечатляющие результаты. Организм пациента отвечает, откликается на приложенные усилия, что значительно увеличивает продолжительность и качество жизни.
Химиотерапия после операции проводится с целью снижения риска рецидива болезни, поскольку злокачественные опухоли отличаются от доброкачественных способностью к метастазированию.
Химиотерапия при раке после операции назначается не во всех случаях. Она не требуется на первых стадиях заболевания некоторых солидных опухолей, когда хирургического метода достаточно. Но даже в этом случае врачи смотрят на группы риска по рецидиву заболевания и коллегиально принимают решение о назначении химиотерапии или тактики активного наблюдения за пациентом.
В последние десятилетия хирургическая техника выполнения операций настолько усовершенствовалась, что после удалении опухоли пациент считается клинически излеченным - ни одним из существующих способов обследования и визуально глазом в операционном поле опухолевый процесс не определяется.
Однако, если опухоли имеют доказанное агрессивное течение и высокий показатель Ki-67 (индекс пролиферативной активности, позволяющий верифицировать степень гистологической и биологической злокачественности с максимальной объективностью), то они требуют обязательного назначения курса химиотерапии после операции и как можно скорее.
Спасибо за обращение в наш онкологический центр.
Мы свяжемся с Вами в ближайшее время.
Сроки проведения химиотерапии после операции
- Время начала химиотерапии после операции определяется степенью заживления тканей. Чем быстрее проходит процесс заживления, тем быстрее можно и нужно назначать адъювантное лечение.
- Важно помнить, что промедление в этом вопросе ведет к риску раннего рецидива заболевания, ухудшает отдаленные результаты лечения и прогноз на жизнь.
- Например, при раке молочной железы химиотерапию следует начинать в течение 3-4 недель после операции.
- Исключение составляют пациенты с операциями на желудочно-кишечном тракте и поджелудочной железе, когда удаленная часть кишечной трубки или постоперационный панкреатит не позволяют назначить химиотерапию в кратчайшие сроки. Для этих пациентов оговаривается промежуток не позднее 6 недель, иначе все усилия, приложенные к выполнению объемной операции с целью максимального удаления опухоли, будут напрасны.
Профилактическая химиотерапия после операции
Послеоперационную химиотерапию называют профилактической, она назначается после радикального хирургического удаления опухоли или радикальной лучевой терапии.
Цель ее проведения - уменьшить риск рецидива заболевания в ближайшем и отдаленном будущем, воздействовать на те опухолевые клетки, которые невозможно определить обычными методами исследования (микрометастазы). Клинически доказана важность адъювантной химиотерапии при определенных опухолях, например, при раке толстой кишки и раке молочной железы.
Сколько циклов необходимо?
Назначение и количество циклов профилактической химиотерапии зависит от многих факторов. Это – вид рака, тип опухоли, стадия заболевания, а также дополнительные прогностические маркеров, определяющие степень злокачественности опухоли и прогнозирующие течение болезни.
Например, профилактическая химиотерапия при раке ободочной кишки после радикальной операции проводится в течение 6 месяцев.
Уварова Светлана Николаевна
Главный врач, онколог-химиотерапевт, врач высшей категории, врач паллиативной медицины
Тверезовская Ирина Александровна
Онколог-химиотерапевт, врач высшей категории, врач паллиативной медицины
Буйнякова Анна Игоревна
Онколог-химиотерапевт, к.м.н., врач высшей категории, врач паллиативной медицины
Тверезовский Сергей Александрович
Хирург-онколог, онкодерматолог, маммолог, к.м.н, врач высшей категории
Круглова Марина Сергеевна
Онколог-химиотерапевт, врач высшей категории, врач паллиативной медицины
Ивченко Борис Викторович
Врач паллиативной медицины, нутрициолог, терапевт
Химиотерапия перед операцией
- Начиная со 2-й стадии при определенных гистологических типах рака молочной железы.
- Когда технически невозможно выполнить операцию из-за большого размера опухоли, наличия асцита или гидроторакса.
Химиотерапия перед операцией при раке молочной железы
1. Данная тактика применяется для уменьшения объема опухоли и последующего проведения органосберегающей операции и/или радикальной лучевой терапии.
Это влияет на лучшую переносимость хирургического лечения и скорейшую реабилитацию. Неоадьювантная химиотерапия непосредственно влияет на прогноз заболевания при HER-положительном, а также трижды-негативном подтипах рака молочной железы, значительно улучшая прогноз и приближая 10-летнюю выживаемость к 100%.
2. Еще одно преимущество неоадьювантной химиотерапии заключается в том, что она позволяет увидеть чувствительность опухоли к химиотерапии.
После химиотерапии проводится операция, по время которой удаленный материал отправляют на гистологическое исследование. И случаи, когда в удаленных тканях не определяется ни одной живой клетки, а ложе опухоли полностью замещается на рубцовую ткань, называются полным патоморфозом. Это значительно улучшает прогноз на жизнь и свидетельствует о том, что удалось полностью излечить пациента.

Химиотерапия с паллиативной целью
Если пациент страдает от выраженного асцита - жидкости в брюшной полости и может только сидеть в кровати, или в ситуации, когда пациент страдает от одышки, вызванной гидротораксом, - в этом случае назначается паллиативная химиотерапия для облегчения тягостных симптомов, уменьшения выработки жидкости в плевральной и брюшной полостях.
В этом случае при хорошей чувствительности опухоли химиотерапия может значительно улучшить состояние пациента, вызвать стабилизацию онкологического процесса или частичный регресс заболевания.
При достижении полного исчезновения признаков асцита и гидроторакса обсуждается вопрос о паллиативной операции. Но данный вид лечения - это индивидуальное решение консилиума в каждой конкретной ситуации.
Как проходит первая химиотерапия — один из самых частых вопросов пациентов и их близких. Химиотерапия (ХТ) пугает не меньше самого злокачественного процесса и добавляет негатива восприятию своего заболевания. Боятся осложнений, но главное — в неизвестности непосредственной реакции и отдалённого результата — вдруг мучения окажутся напрасными.
Как проходит химиотерапия?
Химиотерапия предполагает использование цитостатиков, но на практике так называют любое противоопухолевое лекарственное лечение, в том числе использование таргетных и иммуно-онкологических препаратов. Что логично, поскольку они объединяются в схемы с цитостатиками, дополняют курсы химиотерапии и приходят на смену цитостатическим средствам при неэффективности.

Выбор схемы и входящих в неё лекарств обусловлен локализацией злокачественного процесса, так по-разному лечат рак молочной железы и карциному желудка. Лекарства подбираются по морфологической структуре опухоли, то есть плоскоклеточный рак и аденокарцинома легкого неодинаково чувствительны к лекарственным препаратам.
Способы проведения курса химиотерапии многообразны:
- внутривенные инфузии — обычно их называют «укол в вену», когда препарат шприцем вводится в вену в небольшом разведении;
- внутриартериальные инфузии от внутривенных отличаются не только сосудом, но и большей технической сложностью введения в артерию с высоким давлением, как правило, таким способом в определенную анатомическую область доставляются очень высокие дозы химиопрепарата;
- внутривенные капельные вливания предполагают введение препарата в кровеносное русло в хорошем разведении и с небольшой скоростью, один из современных вариантов — многочасовое и даже многосуточное впрыскивание лекарственного средства специальной помпой — инфузоматом;
- внутриполостная химиотерапия — впрыскивание цитостатика внутрь плевральной и брюшной полости, в том числе длительное орошение полости во время операции на фоне гипертермии;
- внутрипузырные инстилляции — вариант внутриполостной ХТ, когда лекарство вводится в мочевой пузырь;
- подкожное и внутримышечное введения применяются очень редко из-за местного раздражающего действия, присущего большинству цитостатиков;
- локальная аппликация — цитостатик в виде мази;
- пероральная химиотерапия — идеальный способ лечения, когда принимаются таблетки или капсулы, к сожалению, основная масса химиопрепаратов выпускается в порошках для растворения или готовыми растворами.
Подготовка к химиотерапии
Обязательное условие для начала любой химиотерапии у любого больного — морфологическая верификация злокачественного процесса, то есть полученный при биопсии или во время операции кусочек опухоли изучен под микроскопом, заболевание классифицировано и доказано, что это точно злокачественный процесс. В сомнительных случаях, когда нет 100% уверенности, что это рак, саркома, меланома, лейкоз и так далее, химиотерапию проводить нельзя.
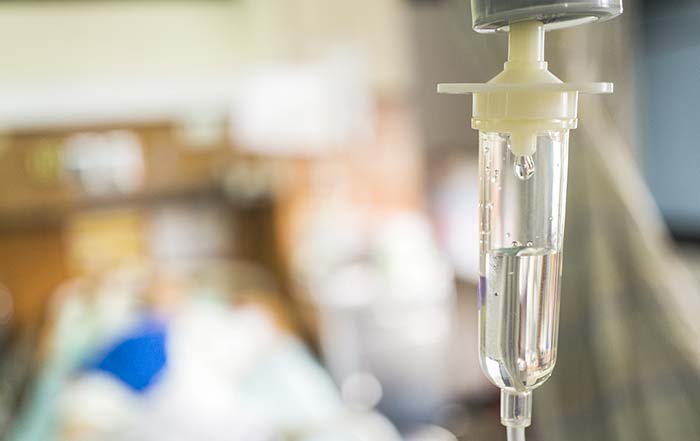
К первому курсу химиотерапии пациент подходит полностью обследованным, если планируется предоперационная или неоадъювантная ХТ, или уже получившим на первом этапе радикальное лечение в виде операции, по необходимости дополняемой профилактической или адъювантной ХТ.
Обследованным пациент будет считаться, когда:
- определены все зоны локализации опухолевого процесса и размеры узлов;
- выяснено состояние сердечно-сосудистой и дыхательной систем, ЦНС и ЖКТ — есть понимание объективного состояния организма, объем функций и ограничений со стороны других органов позволяет провести терапию определенной комбинации и длительности;
- в биохимическом и клиническом анализах крови, анализе мочи все показатели в норме, то есть нет доказательств недостаточности функциональных возможностей и скрыто протекающих патологических состояний;
- при некоторых злокачественных процессах необходима информация о концентрации опухолевых маркёров, что в дальнейшем позволит оценить эффективность терапии.
Поскольку многие цитостатики негативно влияют на кроветворение, анализ крови на лейкоциты и тромбоциты должен быть «первой свежести» — не позже недели.
Режим и время приема препаратов
Каждое лекарственное средство имеет собственный профиль фармакологического действия, требует определенного способа введения в кровь больного и оптимальную дозу на введение.
Разовая дозировка рассчитывается на килограмм веса больного или на кожную поверхность. Для набора достаточной цикловой дозы какое-то лекарство необходимо принимать несколько недель каждый день, что-то требуется вводить раз в неделю, а что-то можно ввести один раз на целых три недели.
Продолжительность введения химиопрепарата обусловлена непосредственными токсическими реакциями или лучшим результатом воздействия на злокачественные клетки. Например, трёхчасовая капельница с производным платины «смягчает» повреждение почек, а часовое введение гемцитабина показало максимальную эффективность в сравнении с инъекцией шприцем.

Длительность курса химиотерапии
Курс ХТ состоит их нескольких циклов, где цикл предполагает введение определенной комбинации препаратов — схемы в определенной дозе и с определенными интервалами, если необходим набор суммарной дозы. Так циклом считается 14-дневный пероральный прием капецитабина, пять введений раз в неделю винорельбина или введение за один день сразу двух препаратов — паклитаксела и доксорубицина.
Несколько таких циклов составляют курс или одну линию химиотерапии. Оптимальная длительность курса с числом циклов определяется в клинических исследованиях, где учитывается не только процент наилучших результатов, но и накопление токсичности — кумулятивный эффект.
Количество курсов химиотерапии и побочные эффекты
Курсы проводятся пока можно надеяться на уменьшение злокачественной опухоли. Как уменьшение опухоли, стабилизация ракового процесса тоже свидетельствует о пользе лечения и говорит об уничтожении популяции чувствительных к цитостатикам клеток. Прогрессирование процесса на фоне лечения свидетельство неэффективности ХТ и необходимости смены комбинации лекарств.
Стандартная комбинация, предлагаемая для первого применения, самая результативная при данной структуре рака и не самая агрессивная. Второй рекомендуется менее эффективная схема лечения, третьей — ещё менее полезная. Для большинства злокачественных процессов разработано три линии лечения, то есть с той или иной пользой можно провести три курса ХТ из нескольких циклов, дальнейшая терапия малоперспективна и точно обещает побочные эффекты, но не позитивный результат.
Когда на первых циклах при нескольких линиях химиотерапии опухоль уменьшалась, а потом возобновляла рост, клетки можно считать чувствительными и есть основания для использования четвёртой-пятой линий.
Ограничить непрерывную смену линий могут побочные эффекты и истощение ресурсов организма по восстановлению химиотерапевтических повреждений. Так с каждым циклом ХТ всё дольше восстанавливается кроветворение, всё выраженнее повреждение почек и периферических нервов, всё труднее печени бороться с интоксикацией.
Только всех пугающая тошнота и рвота сегодня вполне предотвратимый побочный эффект, с которым успешно справляются специалисты нашей клиники, потому что применяют не только сильные противорвотные, но и целую программу подготовки и сопровождения химиотерапии.
Можно ли прерывать курс?
Прерывать курс нежелательно, для лучшего результата необходимо соблюдать разовые и суммарную дозы и интервалы между введениями. Тем не менее, приходится прекращать лечение при опасных для жизни осложнениях, в том числе снижении ниже критического уровня лейкоцитов и тромбоцитов, развитии стоматита и проявляющегося поносами лекарственного колита.
Перерыв между курсами химиотерапии
Перерыв между курсами зависит от достигнутого результата — ремиссии заболевания. Частичная ремиссия — когда клетки опухоли находятся в спящем режиме, полная — полностью уничтожены все проявления болезни. Свободный от проявлений злокачественной опухоли интервал может занять месяцы и годы, период ремиссии очень индивидуален и предсказать его длительность невозможно.
1-й курс химиотерапии
Первый курс обязательно завершится, и совершенно точно, что пройдет он не так, как предполагал пациент. Химиопрепараты убивают не только раковые клетки, но и нормальные, поэтому невозможно предугадать переносимость, гораздо важнее достигнутый в результате лечения результат. Переносимость следующего цикла будет отличаться от предыдущего, потому что на спектре и частоте осложнений сказывается состояние здоровья и настроение, погода и качество препаратов, время года и состояние пищеварения, и ещё много чего.
Клинические исследования выявили оптимальный курс для начала лечения, но это не означает, что у конкретного пациента первая химиотерапия будет самой эффективной, вполне возможно, что второй или даже третий курс дадут лучшие результаты.
Чувствительность злокачественных клеток к лекарствам очень индивидуальна, предсказать её помогает анализ, который выполняют в «Евроонко». Известна вероятность развития осложнений, но какими они будут и будут ли вообще, сказать невозможно. Тем не менее, в «Евроонко» для каждого пациента рассчитывается индивидуальная программа сопровождения химиотерапии, помогающая перенести лечение с наименьшими потерями для здоровья при максимально возможном результате.
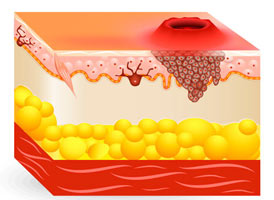
Рак кожи — это группа опухолей с локализацией на коже, в которую входят базальноклеточный, плоскоклеточный и метатипический виды. Среди всех злокачественных заболеваний кожи чаще встречаются базалиома и меланома.
Виды рака кожи
Выделяют следующие основные разновидности злокачественных опухолей кожи:
- базальноклеточный рак;
- плоскоклеточный рак;
- метатипический рак;
- рак из клеток Меркеля;
- меланома – не относится к раку, так как происходит не из эпителия, а из пигментных клеток-меланоцитов.
Базалиома![]()
Базальноклеточный рак кожи отличается довольно редким метастазированием и с первого взгляда кажется не таким опасным заболеванием, но это далеко не так. Без грамотной терапии она может привести к тяжелому поражению кожного покрова. При самом худшем прогнозе последствием базалиомы является разрушение подлежащих хрящевой и костной тканей. [1,2]
Плоскоклеточный рак кожи
Плоскоклеточный рак кожи — наиболее злокачественная эпителиальная опухоль. На долю плоскоклеточного рака кожи приходится около 20% от всех злокачественных новообразований кожи.
Почти в каждом случае плоскоклеточный рак развивается на фоне измененной кожи (предраковые заболевания кожи, псориаз, трофические язвы, рубцы и тп). Чаще развивается после 50 лет (за исключением случаев заболевания у лиц в состоянии иммуносупрессии, тут развитие может наблюдаться гораздо раньше). В развитии плоскоклеточного рака кожи важную роль играет избыточная инсоляция — чем больше общая сумма пребывания на солнце в течение всей жизни, тем выше вероятность развития рака кожи. Другими факторами внешней среды являются ионизирующее излучение, ВПЧ-16 и 18 типа, химические канцерогены. [3,4]
Рак из клеток Меркеля
Рак из клеток Меркеля – очень редкая разновидность злокачественных опухолей кожи, которые отличаются высокой агрессивностью и быстрым ростом. Они развиваются из клеток, продуцирующих гормоны, то есть относятся к нейроэндокринным опухолям. Обычно рак из клеток Меркеля локализуется в области головы и шеи.
Злокачественное новообразование выглядит как узелок куполообразной формы с гладкой поверхностью красного, розового или синюшного цвета. Размеры опухоли обычно менее 2 см. 6
Метатипический рак кожи
Метатипический рак кожи — злокачественное эпителиальное новообразование, которое занимает промежуточное положение между базальноклеточным и плоскоклеточным раком кожи. Метатипический рак кожи отличается большей агрессивностью, чем базалиома, но меньшей чем плоскоклеточный рак. [8]
Причины рака кожи
Можно выделить несколько главных причин возникновения рака кожи:
- Длительное воздействие ультрафиолетового излучения на незащищенную кожу. Это может быть интенсивный загар или частое посещение солярия. Под действием УФ-лучей происходит повреждение ДНК клеток. При этом возникают мутации, которые активируют онкогены и «выключают» гены, подавляющие опухоли. Например, при плоскоклеточном раке зачастую подавлена активность гена-супрессора TP53, который вызывает гибель клеток с поврежденной ДНК. При базальноклеточном раке нередко имеется мутация в гене PTCH1, который контролирует размножение клеток.
- Воздействие ионизирующего излучения. Это может быть работа, связанная с рентгенологическим излучением, с открытыми источниками излучения. Также повышает риск развития рака кожи наличие лучевой терапии в анамнезе.
- Иммунодефицитные состояния, как врожденные, так и приобретенные (ВИЧ, трансплантация органов, необходимость приема цитостатической терапии и др).
- Хроническая травматизация кожи, например, натирание обувью или одеждой.
- Контакт с химическими канцерогенами — сажа, угольная пыль, парафин, деготь, бытовая химия и др.
- Инфицирование вирусом папилломы человека высокого онкогенного риска.
- Наличие предраковых кожных заболеваний — лейкоплакия, кожный рог, пигментная ксеродерма и др. [9]
В чем причина возникновения базалиомы?
Чаще всего базалиому провоцирует длительное ультрафиолетовое излучение, поэтому чаще всего она возникает на открытых участках кожи. [10] Кроме того, развитию базалиомы способствуют химические канцерогены, ионизирующее излучение, иммуносупрессия, воздействие ретровирусов, а также генетическая предрасположенность.
Базалиома встречается и у мужчин и у женщин примерно в равном соотношении. Ей особенно подвержены люди старше 50 лет. В группу риска автоматически попадает большинство пациентов-блондинов со светлой кожей и голубыми глазами. Согласно многочисленным исследованиям базалиома чаще встречается в южных регионах у светлокожих и голубоглазых жителей.
Стадии рака кожи
Выделяют пять основных стадий немеланомного рака кожи:
- Стадия 0 — «рак на месте». На этой начальной стадии рак кожи головы, лица, шеи и других областей тела находится в пределах верхнего слоя кожи — эпидермиса.
- Стадия I — опухоль диаметром не более 2 см, имеет один признак высокого риска.
- Стадия II — опухоль диаметром более 2 см или имеющая 2 признака высокого риска.
- Стадия III — раковые клетки распространились в челюсть, глазницу, кости черепа, в лимфатический узел (при этом его диаметр не превышает 3 см).
- Стадия IV — раковые клетки распространились в кости черепа, позвоночник, ребра, лимфатические узлы, либо обнаружены отдаленные метастазы. [1,3]
Симптомы рака кожи
Как проявляется и как быстро развивается рак кожи будет зависеть от гистологического вида опухоли.
Чаще всего встречается базальноклеточный рак. Он развивается крайне медленно и очень редко дает метастазы, поэтому его еще называют полузлокачественной опухолью. Он может быть представлен узловато-язвенной, поверхностной и морфеаподобной формой.
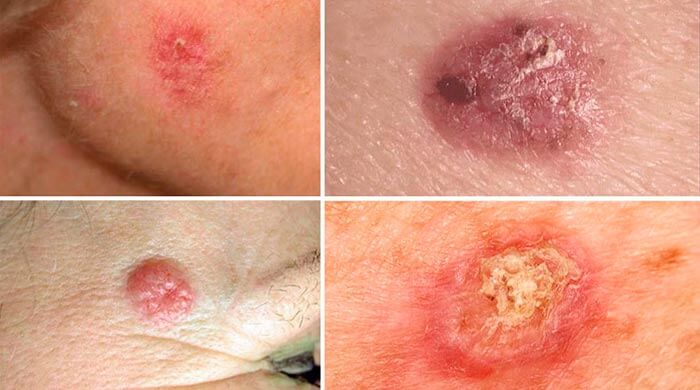
Начальная стадия базальноклеточного рака выглядит как узел, возвышающийся над поверхностью кожи. Со временем на его поверхности образуется язвочка, покрытая корками. Если ее удалить, обнаруживается дно язвы, покрытое бугорками красно-коричневого цвета.
Поверхностная форма базалиомы сначала имеет вид пятна или бляшки, которая может напоминать псориаз. Затем по ее краям начинают образовываться мелкие восковидные узелки. [1,2]
Базальноклеточный рак кожи, внешний вид
Плоскоклеточный рак кожи обычно развивается на фоне предраковых состояний, таких как актинический кератоз (состояние, вызванное воздействием ультрафиолетовых лучей), ожоги, хронические инфекции, папилломавирусная инфекция. В редких случаях опухоль возникает de novo, без предшествующего поражения кожи. Первыми признаками плоскоклеточного рака кожи является папула или уплотнение, покрытое коркой. Оно очень быстро начинает изъязвляться и увеличиваться в размерах. В первую очередь на коже возникает красная бляшка с чешуйками желто-белого цвета. Постепенно она увеличивается в размерах и превращается в темно-красный узел, в его центральной части появляется изъязвление, корка из погибших тканей. Если опухоль возникает de novo, то, как правило, она сразу представляет собой темно-красный узел, покрытый коркой. Если удалить эту корку, то под ней остается язва с неприятным запахом. Плоскоклеточный рак бывает двух видов:
- Экзофитный — опухоль выглядит как большой узел или грибовидное образование, располагающееся на широком основании. Она покрыта корками и легко начинает кровоточить при механическом воздействии.
- Инфильтрирующий — опухоль имеет вид язвы, с кратерообразными краями. Язва быстро разрастается и прорастает в ткани. [3,4]
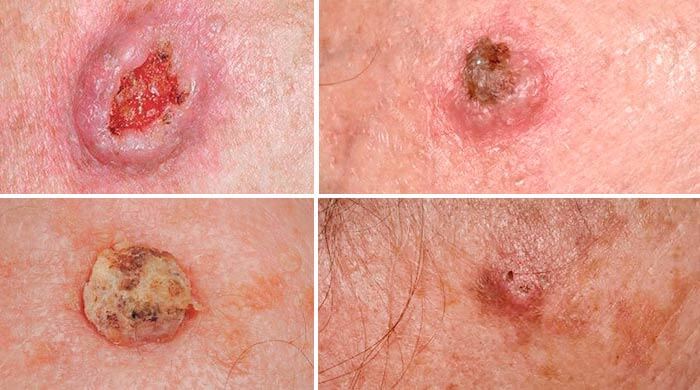
Базальноклеточный рак кожи, внешний вид
Рак из клеток Меркеля чаще всего (в 66% случаев) представляет собой единичную опухоль, но со временем рядом с ней могут появляться дополнительные очаги – сателлитные. Этот тип рака кожи характеризуется быстрым распространением. Иногда первичное новообразование имеет очень малые размеры и не вызывает симптомов, а первым признаком, из-за которого пациент обращается к врачу, становится увеличение пораженных регионарных лимфатических узлов. [5,6]
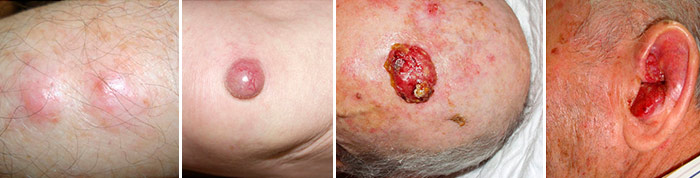
Рак из клеток Меркеля, внешний вид
Неочевидные признаки рака кожи, о которых стоит помнить
В понимании большинства людей словосочетание «рак кожи» ассоциируется с меланомой, хотя, как мы отметили выше, меланома не относится к раковым опухолям. Но эта опухоль наиболее узнаваема: на теле появляется новая родинка (или изменения происходят с уже существующей), которая начинает быстро расти, выглядит очень «неправильно». Однако, многие злокачественные опухоли кожи выглядят не так, и из-за менее ярких проявлений их сложно распознать. Поэтому важно обращать внимание на любые образования:
- Розовые пятна. Они всегда являются проявлением какого-либо патологического процесса в коже и иногда могут представлять собой злокачественную опухоль.
- Новообразования в виде «жемчужин». Чаще всего они возникают в области лица. В некоторых случаях так проявляется базальноклеточный рак.
- Рубцы. Они должны насторожить в случае, если появились в тех местах, где до этого не было травм кожи.
- Шелушение и зуд. Очаги розового цвета, которые шелушатся и зудят, могут быть проявлением актинического кератоза. Это состояние относится к предраковым – оно зачастую предшествует развитию плоскоклеточного рака.
- Темные пятна. Очаги гиперпигментации могут появляться как на коже, так и под ногтями. Если вы заметили у себя такое пятно – его нужно показать врачу-дерматологу, оно может оказаться злокачественной опухолью.
- «Следы от укусов». В некоторых случаях очаги при раке кожи могут напоминать следы от укусов клопов и других насекомых.
- Язвочки. Они должны стать поводом для беспокойства и визита к врачу, как и любые повреждения кожи, которые не заживают в течение длительного времени.
- Бородавки. Чаще всего они доброкачественные и не представляют опасности. Но некоторые со временем превращаются в злокачественные новообразования.
Диагностика рака кожи
Во время первичного приема врач-дерматоонколог расспрашивает пациента о жалобах, о том, когда появилось новообразование кожи, как его внешний вид менялся со временем.
Затем проводится внешний осмотр кожи. Врач использует специальный прибор — дерматоскоп — чтобы осмотреть кожу под увеличением, это помогает выявить изменения, незаметные для невооруженного глаза. В «Евроонко» применяется еще более совершенное оборудование — ФотоФайндер. С помощью него можно составить «карту родинок», обнаружить рак кожи, родинки, подвергшиеся злокачественной трансформации, и другие патологические изменения, отследить их в динамике.
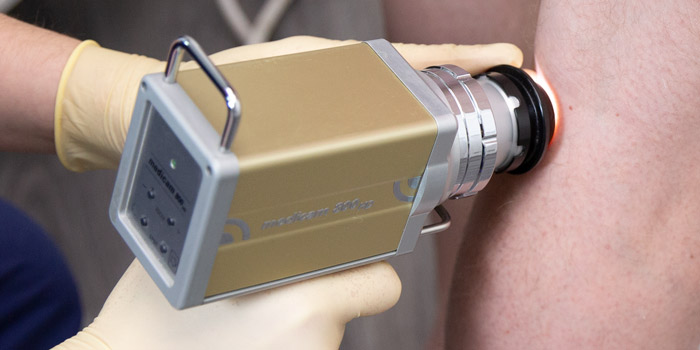
Если по результатам осмотра есть подозрение на рак, проводят биопсию. Врач назначает операцию, во время которой полностью иссекает новообразование и отправляет его в лабораторию для цитологического, гистологического исследования.
Если есть подозрение на то, что могут быть поражены лимфатические узлы, их тоже исследуют. Может быть проведена биопсия сторожевого лимфоузла. Во время этой процедуры врач удаляет ближайший к опухоли лимфатический узел и отправляет его в лабораторию. Если в нем обнаружены раковые клетки, это говорит о том, что они, вероятно, успели распространиться и в другие регионарные лимфоузлы.
Для поиска отдаленных метастазов применят компьютерную томографию, МРТ, ПЭТ-сканирование. 1

Диагностика плоскоклеточного рака кожи
Диагноз плоскоклеточного рака кожи устанавливается на основании клинических и лабораторных данных с обязательным проведением морфологического исследования (цитологического и гистологического). Гистологическая диагностика имеет свои сложности на ранних этапах развития плоскоклеточного рака и в случае недифференцированного варианта. Приходится проводить дифференциальную диагностику с различными заболеваниями. Но гистологическое исследование имеет решающее значение при постановке диагноза «плоскоклеточный рак кожи». [3,4,11]
Лечение рака кожи
Лечение злокачественных опухолей кожи должно быть начато как можно скорее, так как в запущенных случаях заболевание сложнее поддается терапии.
Лечение базальноклеточного рака
Выбор метода лечения базально-клеточного рака зависит от клинической формы, размера и локализации опухоли, возраста пациента, а также сопутствующих заболеваний. К современным способам лечения базалиомы относят:
- лучевую терапию;
- фотодинамическую терапию;
- криовоздействие;
- лазерную терапию;
- терапию радиоволнами;
- медикаментозное лечение.
Все они направлены на деструкцию патологического очага. Однако наиболее радикальным методом лечения базальноклеточного рака кожи остается хирургическое иссечение. [1,2]
Лечение плоскоклеточного рака кожи
Выбор метода лечения зависит от стадии заболевания (наличия/отсутствия метастазов), локализации, степени распространенности первичного процесса, возраста пациента и его общего состояния (наличия/отсутствия сопутствующих заболеваний). Как правило, для плоскоклеточного рака кожи используют следующие методы лечения:
Хирургический — основан на иссечении первичной опухоли в пределах здоровых тканей, отступив на 1 см от края опухоли с последующей пластикой или без нее. При метастазах в регионарные лимфатические узлы проводится операция по удалению пораженного коллектора (лимфодиссекция соответствующего лимфатического коллектора).
Лучевая терапия — наиболее часто используется при лечении пациентов пожилого возраста, а также при большой распространенности первичного очага (особенно в области волосистой части головы или лица), когда невозможно выполнить адекватное хирургическое лечение с пластикой дефекта. Возможно сочетать криотерапию с лучевой терапией. Обычно на первом этапе пациенту проводят «замораживание» с помощью жидкого азота (криотерапия), затем пациент направляется на процедуру лучевой терапии.
Лекарственное лечение — как правило, для плоскоклеточного рака кожи используется в случаях, крупных неоперабельных опухолей, метастатических опухолей, когда другие методы лечения не возможны. В качестве препаратов выбора могут быть: препараты платины (цисплатин, карбоплатин), таксаны (паклитаксел, доцетаксел), блеомицин, метотрексат, фторурацил.
Профилактика плоскоклеточного рака кожи заключается в своевременном выявлении и лечении предраковых заболеваний кожи. [3,4]
Профилактика рака кожи
Защититься на 100% от рака кожи невозможно. Но существуют меры, которые помогут существенно снизить риски:
- Если вам приходится бывать на улице в солнечную погоду, старайтесь находиться в тени.
- Надевайте одежду с длинными рукавами и штанинами.
- Используйте солнцезащитные кремы.
- Выходя на улицу, надевайте шляпу, желательно с широкими полями для защиты кожи лица.
- Носите солнцезащитные очки.
- Откажитесь от курения и других вредных привычек.
- Не посещайте солярии.
- Регулярно проводите самоосмотр кожи — самостоятельно с помощью зеркала, или попросите кого-то из близких осмотреть ваше тело. Заметив любые подозрительные изменения, лучше сразу обратиться к врачу. [10]
| Подробнее о дерматологических исследованиях в «Евроонко» | |
| Консультация дерматолога-онколога | от 5 100 руб |
| Исследование кожи на немецком аппарате FotoFinder | 17 500 руб |
| Диагностика меланомы | от 5 100 руб |
Можно ли предотвратить развитие базалиомы?
Лучший способ снизить риск возникновения базальноклеточного рака — избегать воздействия солнечных лучей, строго соблюдать меры безопасности при работе с веществами, в состав которых входят канцерогены. Людям, находящимся в группе риска, необходимо обязательно проводить регулярные самоосмотры: длительно существующие покраснения на коже и незаживающие ранки могут стать тревожным знаком. В связи с чем при появлении подобных очагов необходимо обратиться к онкологу.
Читайте также: