Как принимать пижму при фурункулах
Обновлено: 24.04.2024
Рассмотрены подходы к комплексной терапии инфекции мочевых путей с применением современных комбинированных фитопрепаратов, которые позволяют повышать эффективность антибактериальной терапии за счет преодоления резистентности возбудителя к антибиотикам, со
The article considers approaches to complex therapy of urinary tract infections, using modern combined phyto-preparations, which allow to enhance efficiency of antibacterial therapy due to overcoming the agent’s resistance to antibiotics, and reduce the course of antibiotic therapy.
Инфекция мочевых путей (ИМП; синонимы: инфекция мочевой системы, инфекция мочевыводящих путей) — собирательный термин, обозначающий инфекционно-воспалительный процесс в мочевыделительной системе без указания его локализации и характера течения. По локализации выделяют инфекцию нижних мочевых путей (цистит, уретрит) и верхних мочевых путей (пиелонефрит, абсцесс и карбункул почки, апостематозный пиелонефрит).
По характеру течения ИМП делятся на неосложненную и осложненную. Неосложненная ИМП развивается, как правило, у людей без обструктивных уропатий и структурных изменений в почках и мочевыводящих путях, в отсутствие фоновых заболеваний. Осложненные инфекции возникают у больных с обструктивными уропатиями, мочекаменной болезнью, поликистозом почек, доброкачественной гиперплазией предстательной железы (ДГПЖ), на фоне катетеризации мочевого пузыря и/или при инструментальных (инвазивных) методах исследования, а также у больных с сопутствующими заболеваниями, такими как сахарный диабет, подагра, другими метаболическими нарушениями.
По возникновению выделяют внебольничные (возникающие в амбулаторных условиях) и нозокомиальные (развивающиеся после 48 ч пребывания пациента в стационаре) ИМП. Не менее 40% всех нозокомиальных инфекций обусловлены ИМП, вызванной в большинстве случаев катетеризацией мочевого пузыря [1–3].
В зависимости от выраженности клинических проявлений ИМП часто подразделяют на афебрильную (преимущественно инфекция нижних мочевых путей), фебрильную (преимущественно инфекция верхних мочевых путей) и бессимптомную бактериурию (ББ). ББ — бактериологический диагноз, который устанавливается при исследовании мочи, собранной с максимальным соблюдением стерильности и доставленной в лабораторию в предельно короткие сроки. По определению Американского общества инфекционных болезней (Infectious Diseases Society of America, IDSA), ББ — это изолированная бактериурия в образце мочи, полученном в условиях, исключающих контаминацию, и при отсутствии симптомов мочевой инфекции [4]. Диагноз ББ может быть установлен:
- если в двух последовательных анализах мочи у женщин без клинических признаков ИМП выделен один и тот же штамм микроорганизмов в количестве ≥ 10 5 КОЕ/мл;
- если в анализе мочи у мужчин без симптомов ИМП однократно выделен бактериальный штамм в количестве ≥ 10 5 КОЕ/мл;
- если в анализе мочи, полученном при катетеризации, как у мужчин, так и женщин, выделен бактериальный штамм в количестве ≥ 10 2 КОЕ/мл.
В структуре инфекционной заболеваемости ИМП занимает второе место, уступая лишь респираторным инфекциям. Среди взрослой популяции женщины в 30–50 раз чаще, чем мужчины, страдают от ИМП, а в течение жизни до 60% женщин сталкиваются с эпизодом ИМП. У каждой четвертой пациентки этой возрастной группы в течение года ИМП рецидивирует [5]. В пожилом и старческом возрасте частота ИМП у женщин и мужчин постепенно сравнивается, что обусловлено развивающейся практически в 100% ДГПЖ, нарушающей уродинамику. В целом ИМП, включая пиелонефрит, регистрируется существенно чаще у женщин, чем у мужчин. Распространенность ИМП в детской популяции составляет 20–22 случая на 1000 детей и в возрасте старше одного года жизни у девочек встречается в десятки раз чаще, чем у мальчиков.
В структуре внутрибольничных инфекций доля ИМП может достигать 40%.
Этиология
Основными возбудителями ИМП являются грамотрицательные бактерии из семейства Enterobacteriacеae, а из них преимущественно Escherichia coli (E. сoli). При неосложненных ИМП на долю E. сoli и других представителей семейства Enterobacteriacеae приходится до 90–95% всех случаев, тогда как при осложненных ИМП доля кишечной палочки в этиологической структуре снижается до 30–50% и значительно чаще встречаются Proteus spp., Pseudomonas spp., Klebsiella spp., грибы (преимущественно Candida albicans). Особенностью осложненных ИМП является большая доля микробных ассоциаций в этиологической структуре (табл. 1).
Лечение ИМП
Основой терапии ИМП является антибиотикотерапия. Как и при других бактериальных инфекциях, чувствительность возбудителей к антибиотикам имеет решающее значение при выборе препарата для эмпирической терапии ИМП. Лучше всего поддается лечению неосложненная ИМП.
Одними из наиболее часто используемых препаратов для лечения ИМП являются фторхинолоны (левофлоксацин, норфлоксацин, офлоксацин, пефлоксацин и др.), которые во многих международных руководствах указываются как препараты выбора в терапии ИМП. Однако в настоящее время отмечается быстрый рост резистентности уропатогенной E. coli к препаратам этой группы. Считается, что при уровне резистентности в популяции более 10% на применение препаратов вводятся ограничения. В России уровень устойчивости уропатогенной E. coli к фторхинолонам, по данным различных исследований, колеблется от 4,3% до 12,9%, составляя в среднем около 7–8% [1, 2, 6, 7].
Для лечения ИМП у беременных женщин и детей, а также у других категорий пациентов при непереносимости фторхинолонов препаратами выбора являются амоксициллин/клавуланат, цефалоспорины II–III поколений, фосфомицина трометамол, нитрофурантоин [8]. Преимуществом применения амоксициллина/клавуланата является не только его высокая активность в отношении E. coli (уровень резистентности ниже, чем к фторхинолонам), но и отсутствие тератогенного воздействия, что делает возможным его применение в I триместре беременности [9, 10].
Доказана эффективность и безопасность применения цефалоспоринов III поколения у детей и беременных женщин при лечении неосложненной и осложненной ИМП [7]. Отличительной чертой цефалоспоринов III поколения является высокая активность в отношении микроорганизмов семейства Enterobacteriaceae, устойчивость к действию бета-лактамаз, длительный период полувыведения [11].
Использование налидиксовой кислоты и нитрофурантоинов имеет определенные недостатки в связи с необходимостью применения этих препаратов 3–4 раза в сутки, а также слабой активностью нитрофурантоина в отношении Proteus spp., а налидиксовой кислоты — в отношении S. saprophyticus [12].
Длительность антибактериальной терапии зависит от особенностей ИМП. Как правило, при отсутствии факторов риска антибактериальная терапия назначается на 3–5 дней при острой инфекции нижних мочевых путей, на 10–14 дней — при инфекции верхних мочевых путей. При острой осложненной ИМП или при наличии факторов риска применяются те же антимикробные препараты, что и при неосложненной ИМП, однако длительность терапии увеличивается до 7–14 или более дней [13].
Особенностью лечения ИМП в детском возрасте является более длительная, по сравнению со взрослыми, антибактериальная терапия с обязательным курсом противорецидивного лечения.
Важной проблемой в лечении как осложненной, так и неосложненной ИМП является антибиотикорезистентность. Так, отмечается высокая частота устойчивости внебольничных штаммов E. coli к ампициллину (неосложненные инфекции — 37%, осложненные — 46%) и ко-тримоксазолу (неосложненные инфекции — 21%, осложненные — 30%), поэтому указанные препараты не рекомендуется использовать в качестве препаратов выбора для лечения ИМП [8]. Кроме того, колонизировавшие уроэпителий микроорганизмы способны производить полимерные субстанции, создавая биопленку, внутрь которой затруднено поступление антибиотиков и факторов защиты слизистой. Это позволяет им «ускользать» от иммунного ответа и во многом обуславливает резистентность к антибактериальным препаратам [14, 15].
Поэтому, несмотря на успехи в создании новых антибактериальных препаратов, лечение ИМП, особенно осложненной и рецидивирующей, остается актуальной задачей, часто требующей в своем решении назначения комбинации препаратов или их последовательной смены, длительных противорецидивных курсов. Это неизбежно приводит к повышению частоты развития нежелательных лекарственных реакций терапии, а также формирует порочный круг, т. к. частое и длительное применение антибиотиков приводит к росту популяции резистентной к ним микрофлоры.
В последние десятилетия возрождается значительный интерес к фитотерапии как компоненту комплексной терапии ИМП. Лечебные свойства растений были хорошо известны врачам древности, народная медицина практически всех народов и стран использует их для лечения различных заболеваний. Действие фитопрепаратов в рамках современных исследований представляется нам в новом свете, прежде всего, с точки зрения преодоления антибиотикорезистентности и способности разрушать микробную биопленку на слизистой оболочке мочевых путей.
В комплексной терапии ИМП применяются фитопрепараты, обладающие противовоспалительным, мочегонным, а также кровоостанавливающим действием, что важно при развитии гематурии.
Растительные препараты можно применять в качестве отдельных настоев или травяных сборов. Компоненты различных растений входят также в состав фабричных лекарственных препаратов.
Наиболее широко применяемые при ИМП лекарственные растения представлены в табл. 2, а также описаны ниже [16, 17].
Золотарник (живительная трава, сердечник) — широко применяется в народной медицине различных стран. В Германии настой золотарника рекомендуют, прежде всего, при хронических воспалительных заболеваниях почек и мочевых путей, кристаллурии и мочекаменной болезни, как мочегонное средство. Препараты травы золотарника обладают гипоазотемическим действием. Трава золотарника содержит флавоноиды, сапонины, органические кислоты и эфирное масло, способствующие разрушению мембран бактериальной клетки, каротин, аскорбиновую и никотиновую кислоты.
Толокнянка (медвежьи ушки) — содержит арбутин, расщепляющийся в организме на гидрохинон (антисептик, оказывающий в мочевыводящих путях антибактериальное действие) и глюкозу. Применяется в виде отваров (30 г на 500 мл) по 2 столовые ложки 5–6 раз в день. Толокнянка проявляет действие в щелочной среде, поэтому прием отвара надо сочетать с приемом внутрь щелочных минеральных вод («Боржоми»), содовых растворов. Для подщелачивания мочи употребляют яблоки, груши, малину.
Хвощ полевой — обладает противовоспалительным, мочегонным и кровоостанавливающим действием. Применяется при ИМП, кристаллуриях и мочекаменной болезни. Благодаря большому содержанию соединений кремния отвары, настои и экстракты хвоща полевого обладают выраженным заживляющим и сосудоукрепляющим действием, способствуют растворению кристаллов солей в моче, ускоряют выведение свинца из организма.
Листья брусники — обладают антимикробным и мочегонным действием. Последнее связано с наличием в листьях брусники гидрохинона. Применяется в виде отвара (2 столовые ложки на 1,5 стакана воды). Назначается по 2 столовые ложки 5–6 раз в день. Также, как и толокнянка, лучше действует в щелочной среде.
Горец птичий (спорыш) — содержит гликозид авикулярин, дубильные вещества, эфирное масло, каротин, аскорбиновую кислоту. Используется как мочегонное, кровоостанавливающее и вяжущее средство. Обладает спазмолитическим действием на мочевые пути. Широко применяется в народной медицине и входит в состав различных сборов.
Петрушка огородная — богата флавоноидами и эфирными маслами. Оказывает непосредственное действие на почечные канальцы, благодаря чему достигается диуретический эффект. Обладает спазмолитическим действием на гладкую мускулатуру мочевых путей и сосудов.
Любисток лекарственный (приворотное зелье) — с медицинской целью используются в основном корни растения. Содержит эфирные масла, органические кислоты, кумарин, дубильные вещества. Обладает выраженным мочегонным и антибактериальным действием. Используется при воспалениях мочевых путей, нарушениях желудочно-кишечного тракта. Как правило, входит в состав комбинированных препаратов и сборов.
Пырей ползучий — содержит эфирные масла, сапонины, инулин, аскорбиновую кислоту, каротин. Обладает диуретическим эффектом благодаря инулину, эфирное масло обеспечивает антисептическое и противовоспалительное действие.
Клюквенный сок, морс (содержит натрия бензоат) — обладает антисептическим действием (увеличивается синтез в печени из бензоата гиппуровой кислоты, которая, выделяясь с мочой, вызывает бактериостатический эффект). Принимают по 2–4 стакана в день.
Сосна лесная — эфирное (скипидарное) масло сосны обладает выраженным бактерицидным, противовоспалительным и мочегонным действием.
При хронических и рецидивирующих инфекциях мочевых путей применяются различные сборы лекарственных трав. Они назначаются, как правило, на долгий период, с чередованием преимущественно бактерицидных и мочегонных сборов. Однако самостоятельное лечение лекарственными растениями таит в себе некоторые опасности. Компоненты многих лекарственных растений в больших дозировках могут быть потенциально ядовиты, оказывать патологическое воздействие на функционирование отдельных органов. Поэтому с точки зрения безопасности в комплексном лечении ИМП предпочтение отдается лекарственным препаратам фабричного производства, правильная дозировка которых обеспечивает высокую эффективность при соблюдении полной безопасности.
Одним из наиболее широко применяемых фитопрепаратов для лечения ИМП является Фитолизин. Фитолизин содержит экстракт смеси растений (золотарника, хвоща полевого, пырея, горца птичьего, листьев березы, любистока, пырея, петрушки, масла шалфея, мяты, сосны и апельсина, семена пажитника), благодаря чему оказывает мочегонное, противовоспалительное, спазмолитическое действие, уменьшает кристаллообразование, способствует растворению кристаллов и конкрементов и выведению их с мочой.
Препарат имеет форму пасты для приготовления суспензии, что обеспечивает легкость его дозировки и применения. Взрослым назначают внутрь по 1 чайной ложке пасты, растворенной в 1/2 стакана теплой сладкой воды, 3–4 раза в день после еды. Фитолизин может применяться в комплексном лечении ИМП вместе с антибиотиками или после их применения на этапе противорецидивной терапии. Препарат широко применяется в качестве профилактического средства при хронических воспалениях мочевых путей. Курс терапии Фитолизином составляет 2–6 недель и при необходимости может быть продлен.
Эффективность лекарственных растений в терапии ИМП доказана многовековым опытом народов мира. Современные комбинированные фитопрепараты, такие как Фитолизин, занимают важное место в комплексной терапии ИМП и позволяют повышать эффективность антибактериальной терапии за счет преодоления резистентности возбудителя к антибиотикам, сокращают курсы антибиотикотерапии, снижают частоту нежелательных лекарственных реакций их применения.
Литература
- Gales A. C., Jones R. N., Gordon K. A. et al. Activity and spectrum of 22 antimicrobial agents tested against urinary tract infection pathogens in hospitalized patients in Latin America: report from the second year of the SENTRY antimicrobial surveillance program (1998) // J Antimicrob Chemother. 2000; 45: 295–303.
- Mazzuli T. Resistance trends in urinary tract pathogens and impact on management // J Urol. 2002; 168: 1720–1722.
- Ruden H., Gastmeier P., Dascher F. D., Schumacher M. Nosocomial and community-acquired infections in Germany. Summary of the results of the First National Prevalence Study (NIDEP) // Infection. 1997; 25: 199–202.
- Nicolle L. E., Bradley S., Colgan R. et al. Infectious Diseases Society of America guidelines for the diagnosis and treatment of asymptomatic bacteriuria in adults // Clin Infect Dis. 2005; 40: 643–654.
- Lindsay E. N. Managing recurrent urinary tract infections in women // Women’s Health. 2005; Jul, 1: 39–50.
- Гриднев О. В. Клинико-фармакологические аспекты рациональной антибиотикотерапии инфекций мочевыводящих путей (клинико-экономическое многоцентровое исследование). М., 2006. С. 124.
- Рафальский В. В., Довгань Е. В., Остроумова М. В. и соавт. Цефиксим: клиническая фармакология и место в терапии инфекций мочевыводящих путей и гонококковой инфекции у женщин // Акушерство и гинекология. 2008, № 6, с. 70–74.
- Практическое руководство по антимикробной химиотерапии. Под ред. Л. С. Страчунского, Ю. Б. Белоусова, С. Н. Козлова М.: Боргес, 2002; с. 384.
- Sweet R. L. Bacteriuria and pyelonephritis during pregnancy // Semin. Perinatol. 1977. № 1. Р. 25–40.
- Пасечников С. П., Венцковская И. Б., Никитин О. Д, Загородняя А. С. Современные подходы к лечению инфекций мочевых путей у беременных // Медицинские аспекты здоровья женщины. 2012, № 2 (53), с. 13–18.
- Forti I. N. Medicina (B. Aires). 1994. P. 439–458.
- Моисеев С. В. Практические рекомендации по антибактериальной терапии и профилактике инфекций мочевыводящих путей с позиций доказательной медицины // Инфекции и антимикробная терапия. 2003, т. 5, № 3.
- Maringhini S., Corrado C., Leone F., Pavone G. Controversies in the antimicrobial treatment of urinary tract infections // J Chemother. 2006, May; 18 Spec no 3: 16–20.
- Бондаренко В. М. Роль условно-патогенных бактерий при хронических воспалительных процессах различной локализации. Тверь: Триада, 2011.
- Эрман М. В. Фитотерапия в лечении инфекции мочевой системы у детей // Эффективная фармакотерапия. 2014, № 2 (16), с. 18–22.
- Окороков А. Н. Лечение болезней внутренних органов: Практическое руководство. Том 2. Минск, 1997, 360 с.
- Лавренова Г. В., Лавренов В. К., Онипко В. Д. От всех болезней (лекарственные растения полей и лесов). Справочник. Донецк: МП «Отечество», 1994, 523 с.
А. В. Малкоч 1 , кандидат медицинских наук
Н. Н. Филатова, кандидат медицинских наук
Цельные цветочные корзинки, отдельные трубчатые цветки, цветоложа и кусочки цветоносов, проходящие сквозь сито с номинальным размером отверстия 5600 мкм. Цвет зеленовато-желтый. Запах своеобразный.
Состав
Пижмы цветки, 100,0 г.
Фармакотерапевтическая группа
Фармакологические свойства
Средство растительного происхождения, применение которого основано исключительно на опыте традиционного использования. Настой цветков пижмы оказывает противоглистное, противовоспалительное, желчегонное, антимикробное действие.
Показания к применению
Внутрь: применяется в качестве антигельминтного средства при аскаридозе и энтеробиозе.
Способ применения и дозы
5 г (1 столовая ложка) измельченных цветков помещают в эмалированную посуду, заливают 200 мл (1 стакан) кипяченой воды комнатной температуры, нагревают в кипящей воде (водяной бане) при частом помешивании 15 минут, охлаждают при комнатной температуре 45 минут, процеживают, оставшееся сырье отжимают. Объем полученного настоя доводят кипяченой водой до 200 мл.
Взрослые принимают внутрь в теплом виде по 1/3–1/2 стакана настоя за 30 минут до еды 2–3 раза в день в течение 3-х дней, затем принимают слабительное. При необходимости прием настоя цветков пижмы можно повторить через 7–14 дней. Перед употреблением настой рекомендуется взбалтывать.
Длительность курса лечения определяется врачом с учетом особенностей заболевания, достигнутого эффекта и переносимости лекарственного средства.
Побочное действие
В случае возникновения побочных реакций, в том числе не указанных в данной инструкции, следует прекратить применение настоя и обратиться к врачу.
Противопоказания
Гиперчувствительность к пижме, а также к растениям семейства астровых (сложноцветных), таким как ромашка, арника, амброзия, тысячелистник, полынь, астра, хризантема. Беременность, период лактации, детский возраст до 18 лет. Желчнокаменная болезнь, обтурационная желтуха.
Взаимодействие с другими лекарственными средствами
Меры предосторожности
Лекарственное средство противопоказано для применения во время беременности, периода лактации, у детей до 18 лет. Перед началом лечения обязательно проконсультируйтесь с врачом. Лечение проводят только под наблюдением врача. Если во время приема настоя происходит ухудшение состояния, необходимо обратиться к врачу.
Передозировка
В связи с содержанием туйона прием настоя цветков пижмы в дозах, превышающих рекомендованные, может привести к отравлению. Симптомы отравления включают покраснение лица, расширение зрачков, стойкий мидриаз, рвоту, боли в животе, гастоэнтерит, сердечную аритмию, маточные кровотечения, тонико-клонические судороги, нарушения функции печени и почек.
В случае появления симптомов передозировки необходимо прекратить прием лекарственного средства и обратиться к врачу.
Применение в период беременности и кормления грудью
Лекарственное средство противопоказано для применения во время беременности, периода лактации.
Влияние на способность к управлению автотранспортом и работе с механизмами
Исследования по оценке влияния на способность управлять автомобилем и работать с механизмами не проводились.
Условия хранения
Хранить в защищенном от влаги и света месте при температуре от 15 до 25 °C. Хранить в недоступном для детей месте.
Приготовленный настой – в прохладном месте (при температуре от 8 до 15 °C) не более 2 суток.
Условия отпуска из аптек
Срок годности
Не применять по истечении срока годности, указанного на упаковке!
Упаковка
В пакеты бумажные по 100,0 г. По 1 пакету бумажному вместе с листком-вкладышем помещают в пачки из картона.
Производитель
ЗАО «БелАсептика», Республика Беларусь, Минский район, деревня Цнянка, военный городок 137 «А», административное здание ЗАО «БелАсептика», комната 7. Тел. (017) 500 33 11, тел./факс (017) 500 33 46.
Пижмы цветки содержат эфирное масло, основными компонентами которого являются бициклические монотерпеновые кетоны α- и β-туйон, флавоноиды, кумарины, фенолкарбоновые кислоты, полиины, горькие и дубильные вещества.
Состав
Пижмы цветки, измельченное сырье.
Фармакотерапевтическая группа
Показания к применению
Внутрь: традиционно применяется в качестве антигельминтного средства при аскаридозе и энтеробиозе.
Противопоказания
Гиперчувствительность к пижме, а также к растениям семейства астровых (сложноцветных), таким как ромашка, арника, амброзия, тысячелистник, полынь, астра, хризантема. Беременность, период лактации, детский возраст до 18 лет. Желчнокаменная болезнь, обтурационная желтуха.
Способ применения и дозировка
5 г (1 столовая ложка) измельченных цветков помещают в эмалированную посуду, заливают 200 мл (1 стакан) кипяченой воды комнатной температуры и нагревают в кипящей воде (водяной бане) 15 мин, охлаждают при комнатной температуре 45 мин, процеживают, оставшееся сырье отжимают. Объем полученного настоя доводят кипяченой водой до 200 мл.
Взрослые принимают внутрь в теплом виде по 1/2-1/3 стакана настоя за 30 мин до еды 2-3 раза в день в течение трех дней, затем принимают слабительное. При необходимости прием настоя цветков пижмы можно повторить через 7-14 дней.
Перед употреблением настой рекомендуется взбалтывать.
Длительность лечения и необходимость в проведении повторного курса лечения определяются врачом индивидуально с учетом особенностей заболевания, терапевтического эффекта и переносимости лекарственного средства.
Побочное действие
Аллергические реакции. В случае возникновения побочных реакций, в том числе не указанных в данной инструкции, следует прекратить применение лекарственного средства и обратиться к врачу.
Взаимодействие с другими лекарственными средствами
Передозировка
В связи с содержанием туйона прием настоя цветков пижмы в дозах, превышающих рекомендованные, может привести к отравлению. Симптомы отравления включают покраснение лица, расширение зрачков, стойкий мидриаз, рвоту, боли в животе, гастроэнтерит, сердечную аритмию, маточные кровотечения, тонико-клонические судороги, нарушения функции печени и почек. В случае появления симптомов передозировки необходимо прекратить прием лекарственного средства и обратиться к врачу. Лечение симптоматическое.
Меры предосторожности
Лекарственное средство противопоказано для применения во время беременности, периода лактации, у детей до 18 лет. Перед началом лечения обязательно проконсультируйтесь с врачом. Лечение проводят только под наблюдением врача. Если во время приема настоя происходит ухудшение состояния, необходимо обратиться к врачу.
Влияние на способность управления автомобилем и работу с движущимися механизмами
Исследования не проводились.
Особенности применения
Принимают в теплом виде за 30 мин до еды.
Условия хранения
Хранить в защищенном от влаги и света месте при температуре от 15 °C до 25 °C. Хранить в недоступном для детей месте. Приготовленный настой - при температуре от 8 °C до 15 °C не более 2 суток.
Срок годности
3 года. Не использовать по истечении срока годности, указанного на упаковке.
В настоящее время существует тенденция к росту хронических бактериальных и вирусных заболеваний, для которых характерны непрерывно рецидивирующее течение и малая эффективность антибактериальной и симптоматической терапии. Одним из таких заболеваний яв
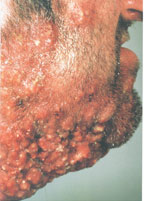
В настоящее время существует тенденция к росту хронических бактериальных и вирусных заболеваний, для которых характерны непрерывно рецидивирующее течение и малая эффективность антибактериальной и симптоматической терапии. Одним из таких заболеваний является хронический рецидивирующий фурункулез (ХРФ). Фурункул развивается в результате острого гнойно-некротического воспаления волосяного фолликула и окружающих его тканей. Как правило, фурункул является осложнением остеофолликулита стафилококковой этиологии. Фурункулы могут возникать как одиночно, так и множественно (так называемый фурункулез).
В случае рецидивирования фурункулеза диагностируется хронический рецидивирующий фурункулез. Как правило, он характеризуется частыми рецидивами, длительными, вялотекущими обострениями, толерантными к проводимой антибактериальной терапии. В зависимости от количества фурункулов, распространенности и выраженности воспалительного процесса ХРФ классифицируется по степени тяжести (Л. Н. Савицкая, 1987).
Тяжелая степень: диссеминированные, множественные, непрерывно рецидивирующие небольшие очаги со слабой местной воспалительной реакцией, не пальпируемыми или слегка определяющимися регионарными лимфатическими узлами. Тяжелое течение фурункулеза сопровождается симптомами общей интоксикации: слабостью, головной болью, снижением работоспособности, повышением температуры тела, потливостью.
Средняя степень тяжести — одиночные или множественные фурункулы больших размеров, протекающие с бурной воспалительной реакцией, с рецидивами от 1 до 3 раз в год. Иногда сопровождается увеличением регионарных лимфатических узлов, лимфангоитом, кратковременным повышением температуры тела и незначительными признаками интоксикации.
Легкая степень тяжести — одиночные фурункулы, сопровождающиеся умеренной воспалительной реакцией, с рецидивами от 1 до 2 раз в год, хорошо пальпируемыми регионарными лимфатическими узлами, без явлений интоксикации.
Чаще всего пациенты, страдающие фурункулезом, получают лечение у хирургов, в лучшем случае на амбулаторном этапе им проводится исследование крови на сахар, аутогемотерапия, некоторым назначают и иммуномодулирующие препараты без предварительно проведенного обследования, и в большинстве случаев они не получают положительного результата от проведенной терапии. Цель нашей статьи — поделиться опытом ведения больных с ХРФ.
Основным этиологическим фактором ХРФ считается золотистый стафилококк, который встречается, по разным данным, в 60–97% случаев. Реже ХРФ вызывается другими микроорганизмами — эпидермальным стафилококком (ранее считавшимся апатогенным), стрептококками групп А и В и другими видами бактерий. Описана вспышка заболеваемости фурункулезом нижних конечностей у 110 пациентов, являвшихся пациентами одного и того же педикюрного салона. Возбудителем данной вспышки являлся Mycobacterium fortuitium, причем этот микроорганизм был выявлен в ванночках для ног, используемых в салоне. В большинстве случаев ХРФ из гнойных очагов высеваются антибиотикорезистентные штаммы золотистого стафилококка. По данным Н. М. Калининой, St. aureus в 89,5% случаев резистентен к пенициллину и ампициллину, в 18,7% — резистентен к эритромицину и в 93% случаев чувствителен к клоксациллину, цефалексину и котримоксазолу. В последние годы отмечается достаточно широкое распространение метициллин-резистентных штаммов этого микроорганизма (до 25% пациентов). По данным зарубежной литературы, наличие на коже или на слизистой оболочке носа патогенного штамма St. aureus считается важным фактором развития заболевания.
ХРФ имеет сложный и до сих пор недостаточно изученный патогенез. Установлено, что дебют и дальнейшее рецидивирование заболевания обусловлены целым рядом эндо- и экзогенных факторов, среди которых наиболее значимыми считаются нарушение барьерной функции кожных покровов, патология ЖКТ, эндокринной и мочевыделительной систем, наличие очагов хронической инфекции различной локализации. По данным проведенных нами исследований, очаги хронической инфекции различной локализации выявляются у 75–99,7% пациентов, страдающих ХРФ. Наиболее часто встречаются очаги хронической инфекции ЛОР-органов (хронический тонзиллит, хронический гайморит, хронический фарингит), дисбактериоз кишечника с увеличением содержания кокковых форм. У больных хроническим фурункулезом патология ЖКТ (хронический гастродуоденит, эрозивный бульбит, хронический холецистит) определяется в 48–91,7% случаев. У 39,7% пациентов диагностируется патология эндокринной системы, представленная нарушениями обмена углеводов, гормонпродуцирующей функции щитовидной и половых желез. У 39,2% больных с упорно текущим фурункулезом имеется латентная сенсибилизация, у 4,2% — клинические проявления сенсибилизации к аллергенам домашней пыли, пыльцы деревьев и злаковых трав, у 11,1% — повышенная концентрация сывороточного IgE.
Таким образом, для большинства больных ХРФ характерны непрерывно рецидивирующее течение заболевания (41,3%) при тяжелой и средней тяжести течения фурункулеза (88%) и длительные обострения (от 14 до 21 дня — 39,3%). У 99,7% пациентов выявлены хронические очаги инфекции различной локализации. В 39,2% случаев определялась латентная сенсибилизация к различным аллергенам. Основным возбудителем является St. aureus.
В возникновении и развитии хронического фурункулеза, наряду с особенностями возбудителя, его патогенными, вирулентными и инвазивными свойствами, наличием сопутствующей патологии, большая роль отводится нарушениям нормального функционирования и взаимодействия различных звеньев иммунной системы. Иммунная система, призванная обеспечить биологическую индивидуальность организма и, как следствие, выполняющая защитную функцию при контакте с инфекционными, генетически чужеродными агентами, в силу разных причин может давать сбой, что ведет к нарушению защиты организма от микробов и проявляется в повышенной инфекционной заболеваемости.
Иммунная защита от бактерий-патогенов включает два взаимосвязанных компонента — врожденный (носящий преимущественно неспецифический характер) и адаптивный (характеризующийся высокой специфичностью к чужеродным антигенам) иммунитет. Возбудитель ХРФ при попадании в кожу вызывает «каскад» защитных реакций.
У 26–35% больных, страдающих хроническим фурункулезом, снижается количество В-лимфоцитов. При оценке компонентов гуморального иммунитета у больных фурункулезом выявляются различные дисиммуноглобулинемии. Наиболее часто встречаются снижение уровней IgG и IgM. Отмечено снижение аффинности иммуноглобулинов у больных ХРФ, причем выявлена корреляция между частотой встречаемости этого дефекта, стадией и тяжестью заболевания. Тяжесть нарушений лабораторных показателей коррелирует с тяжестью клинических проявлений фурункулеза.
Из вышесказанного следует, что изменения показателей иммунного статуса у больных ХРФ носят разноплановый характер: у 42,9% отмечено изменение субпопуляционного состава лимфоцитов, у 71,1% — фагоцитарного и у 59,5% — гуморального звена иммунной системы. В зависимости от выраженности изменений в показателях иммунного статуса больных ХРФ можно разделить на три группы: легкой тяжести, средней и тяжелого течения, что коррелирует с клиническим течением заболевания. При легком течении фурункулеза у большинства больных (70%) показатели иммунного статуса находятся в пределах нормы. При средней и тяжелой степени преимущественно выявляются изменения фагоцитарного и гуморального звеньев иммунной системы.
Диагностика и лечение ХРФ
Исходя из вышеуказанных патогенетических особенностей ХРФ алгоритм диагностики должен включать в себя выявление очагов хронической инфекции, диагностику сопутствующих заболеваний, оценку лабораторных параметров состояния иммунной системы (рис.).
В нашем институте был разработан план обследования больных ХРФ.
- Обязательное лабораторное исследование:
- клинический анализ крови;
- общий анализ мочи;
- биохимический анализ крови (общий белок, белковые фракции, общий билирубин, мочевина, креатинин, трансаминазы - АСТ, АЛТ);
- RW, ВИЧ;
- анализ крови на наличие гепатита В и С;
- посев содержимого фурункула на флору и чувствительность к антибиотикам;
- гликемический профиль;
- иммунологическое обследование (фагоцитарный индекс, спонтанная и индуцированная хемилюминесценция (ХЛ), индекс стимуляции (ИС) люминолзависимой хемилюминесценции ЛЗХЛ), бактерицидность нейтрофилов, иммуноглобулины A, M, G, аффинность иммуноглобулинов);
- бактериологическое исследование фекалий;
- анализ кала на яйца глистов;
- посев из зева на флору и грибы.
- Дополнительное лабораторное исследование:
- определение уровня гормонов щитовидной железы (Т3,Т4, ТТГ, АТ к ТГ);
- определение уровня половых гормонов (эстрадиол, пролактин, прогестерон);
- посев крови на стерильность трехкратно;
- посев мочи (по показаниям);
- посев желчи (по показаниям);
- определение базальной секреции;
- иммунологическое обследование (субпопуляции Т-лимфоцитов, В-лимфоциты);
- общий IgE.
- Инструментальные методы обследования:
- гастроскопия с определением базальной секреции;
- УЗИ органов брюшной полости;
- УЗИ щитовидной железы (по показаниям);
- УЗИ женских половых органов (по показаниям);
- дуоденальное зондирование;
- функции внешнего дыхания;
- ЭКГ;
- рентгенография органов грудной клетки;
- рентгенография придаточных пазух носа.
- Консультации специалистов: отоларинголога, гинеколога, эндокринолога, хирурга, уролога.
Тактика лечения больных ХРФ определяется стадией заболевания, сопутствующей патологией и иммунологическими нарушениями. В стадии обострения ХРФ требуется проведение местной терапии в виде обработки фурункулов антисептическими растворами, антибактериальными мазями, гипертоническим раствором; в случае локализации фурункулов в области головы и шеи или наличия множественных фурункулов — проведение антибактериальной терапии с учетом чувствительности возбудителя. В любой стадии заболевания необходима коррекция выявленной патологии (санация очагов хронической инфекции, лечение патологии ЖКТ, эндокринной патологии и т. д.). При выявлении у больных ХРФ латентной сенсибилизации или при наличии клинических проявлений аллергии необходимо в период поллинации добавлять к лечению антигистаминные препараты, назначать гипоаллергенную диету, проводить хирургическое вмешательство с премедикацией гормональными и антигистаминными препаратами.
В последнее время в комплексной терапии больных ХРФ все чаще используют препараты, оказывающие корригирующее действие на иммунную систему.
Разработаны показания к назначению иммуномодуляторов в зависимости от доминирующего типа нарушений иммунного статуса и степени заболевания. Так, в стадии обострения ХРФ рекомендовано применение следующих иммуномодуляторов.
- При наличии изменений фагоцитарного звена иммунитета целесообразно назначение полиоксидония по 6-12 мг внутримышечно в течение 6-12 дней.
- При снижении аффинности иммуноглобулинов - галавит 100 мг № 15 внутримышечно.
- При снижении уровня В-лимфоцитов, нарушении соотношения CD4/CD8 в сторону уменьшения показано применение миелопида по 3 мг в течение 5 дней внутримышечно.
- При снижении уровня IgG на фоне тяжелого обострения ХРФ при клинической неэффективности применения галавита используются препараты иммуноглобулина для внутривенного введения (октагам, габриглобин, интраглобин).
В период ремиссии возможно назначение следующих иммуномодуляторов.
- Полиоксидоний 6-12 мг внутримышечно в течение 6-12 дней - при наличии изменений фагоцитарного звена иммунитета.
- Ликопид 10 мг в течение 10 дней перорально - при наличии дефектов образования активных форм кислорода.
- Галавит 100 мг № 15 внутримышечно - при снижении аффинности иммуноглобулинов.
Применение ликопида целесообразно также при вялотекущем, непрерывно рецидивирующем фурункулезе. При упорном рецидивировании ХРФ на фоне изменений гуморального звена иммунитета показано назначение препаратов иммуноглобулина для внутривенного введения (октагам, габриглобин, интраглобин). В некоторых случаях целесообразно комбинированное применение иммуномодулирующих препаратов (например, при обострении фурункулеза возможно назначение полиоксидония, в дальнейшем, при выявлении дефекта аффинности иммуноглобулинов, добавляется галавит и т. д.).
Несмотря на значительные успехи, достигнутые в области клинической иммунологии, эффективное лечение ХРФ остается достаточно сложной задачей. В связи с этим требуется дальнейшее изучение патогенетических особенностей этого заболевания, а также разработка новых подходов к терапии ХРФ.
Неоген является синтетическим трипептидом, состоящим из L-аминокислотных остатков изолецитина, глютамина и триптофана. Неоген применялся в составе комплексной терапии, проводимой больным хроническим фурункулезом. Внутримышечные инъекции препарата неогена проводились по 1 мл 0,01% раствора 1 раз в сутки ежедневно, курс — 10 инъекций. Применение неогена в комплексной терапии больных хроническим фурункулезом на стадии ремиссии заболевания вызывает достоверную нормализацию изначально измененных иммунологических показателей (относительного и абсолютного количества лимфоцитов, относительного количества CD3 + , CD8 + , CD19 + , CD16 + -лимфоцитов, поглотительной способности моноцитов по отношению к St. aureus) и увеличение показателей спонтанной ХЛ и аффинности анти-ОАД-антител, количества HLA-DR+-лимфоцитов, а следовательно, позволяет продлить период ремиссии заболевания по сравнению с группой контроля.
Таким образом, из вышеизложенного следует, что ХРФ протекает под воздействием сложного комплекса этиологических и патогенетических факторов и его нельзя рассматривать только как местное воспаление. Больным с ХРФ необходимо проводить всестороннее обследование с целью выявления возможных очагов хронической инфекции, которые являются источником септицемии и при нарушении элиминации микробов в крови в результате снижения иммунологической реактивности организма приводят к возникновению фурункулов. Так как назначение иммунокорригирующих препаратов может вызвать обострение основного заболевания, мы считаем, что лечение больных необходимо начинать с санации выявленных очагов инфекции.
Вопрос о назначении иммунокорригирующих препаратов должен решаться индивидуально, с учетом стадии заболевания, наличия сопутствующей патологии и типа иммунологического дефекта. При выявлении у больного сенсибилизации к различным аллергенам лечение фурункулеза необходимо проводить на фоне противоаллергенной терапии.
Н. Х. Сетдикова, доктор медицинских наук
К. С. Манько
Т. В. Латышева, доктор медицинских наук, профессор
Хронический панкреатит — длительно протекающее воспалительное заболевание поджелудочной железы, проявляющееся необратимыми морфологическими изменениями, которые вызывают боль и/или стойкое снижение функции поджелудочной железы. При хроническом панкреатит
Хронический панкреатит — длительно протекающее воспалительное заболевание поджелудочной железы, проявляющееся необратимыми морфологическими изменениями, которые вызывают боль и/или стойкое снижение функции поджелудочной железы. При хроническом панкреатите морфологические изменения поджелудочной железы сохраняются после прекращения воздействия этиологического агента. В настоящее время распространенность хронического панкреатита, по данным аутопсий, составляет от 0,01 до 5,4%, в среднем — 0,3-0,4%, при этом за последние 40 лет заболеваемость выросла примерно в два раза, что связывают с тем, что население стало употреблять больше алкогольных напитков, а также с воздействием вредных факторов окружающей среды (см. диаграмму 1).
В патогенезе хронического панкреатита важную роль играют несколько факторов. Одним из основных является обструкция главного панкреатического протока при конкрементах, воспалительном стенозе или опухолях. При алкогольном панкреатите повреждение поджелудочной железы связано с повышением содержания белка
в панкреатическом секрете, что приводит к возникновению белковых пробок и обструкции мелких протоков железы. Другим фактором, влияющим на патогенез алкогольного панкреатита, является изменение тонуса сфинктера Одди: его спазм вызывает внутрипротоковую гипертензию, а релаксация способствует рефлюксу дуоденального содержимого и внутрипротоковой активации панкреатических ферментов.
Разрушение экзокринной части поджелудочной железы вызывает прогрессирующее снижение секреции бикарбонатов и ферментов, однако клинические проявления нарушения переваривания пищи развиваются лишь при деструкции более 90% паренхимы органа. В первую очередь возникают проявления недостаточности липазы в виде нарушения всасывания жиров, жирорастворимых витаминов: A, D, E и K, что нечасто проявляется поражением костей, расстройствами свертывания крови. У 10–30% больных хроническим панкреатитом развивается сахарный диабет, обычно на поздних стадиях заболевания, нарушение толерантности в глюкозе наблюдается гораздо чаще. Для таких больных характерно развитие гипогликемических реакций на инсулин, недостаточное питание или злоупотребление алкоголем. Кетоацидоз развивается редко, что связано с одновременным снижением продукции инсулина и глюкагона.
Приступ хронического панкреатита проявляется иррадиирующими в спину болями в верхней половине живота, развивающимися после приема пищи, которые могут продолжаться в течение многих часов или нескольких дней. Нередко наблюдается тошнота, рвота, у 30–52% пациентов — снижение веса, у 16–33% — желтуха. Преходящая желтуха возникает вследствие отека железы при обострениях хронического панкреатита, постоянная — связана с обструкцией общего желчного протока вследствие фиброза головки поджелудочной железы. При разрывах протоков поджелудочной железы, на месте предыдущего некроза ткани происходит скопление секрета, что приводит к формированию псевдокист. Кисты могут быть бессимптомными или вызывать боли в верхней половине живота. При длительном течении заболевания, при уменьшении объема функционирующей паренхимы до 10% от нормы появляются признаки мальабсорбции (полифекалия, жирный стул, похудание).
В течении хронического панкреатита можно выделить несколько стадий (Lankisch P.G., Moessner Y.), умение различать которые важно для правильного подбора терапии. Так, на первой стадии заболевания клиническая симптоматика отсутствует: в этот период характерные для ХП изменения данных КТ или ЭРХПГ выявляются лишь при случайном обследовании.
На второй стадии возникают начальные проявления, характеризующиеся частыми эпизодами обострения ХП (которые могут быть ошибочно расценены как острый панкреатит). Заболевание видоизменяется от повторных приступов боли в животе до постоянных умеренных болей и похудания. С течением времени рецидивы становятся менее тяжелыми, но симптоматика сохраняется в периоды между приступами. На этой стадии может существенно ухудшаться качество жизни. Вторая стадия обычно продолжается на протяжении четырех—семи лет. Иногда заболевание быстро прогрессирует, развивается атрофия ПЖ, и нарушается функция органа.
У больных на третьей стадии постоянно присутствует симптоматика ХП, прежде всего — абдоминальная боль. Пациенты могут стать зависимыми от анальгетиков, значительно сокращают объем принимаемой пищи из-за опасения усиления боли. Появляются признаки экзокринной и эндокринной панкреатической недостаточности.
Особенность панкреатита на четвертой стадии — это атрофия ПЖ, развитие экзокринной и эндокринной недостаточности, что проявляется стеатореей, похуданием и сахарным диабетом. Снижается интенсивность боли, прекращаются острые приступы заболевания, могут развиваться тяжелые системные осложнения ХП и аденокарцинома поджелудочной железы.
Терапия панкреатита проводится по нескольким направлениям: отказ от употребления алкоголя; соблюдение диеты с низким содержанием жира (до 50–75 г/сут) и частым приемом небольших количеств пищи; купирование боли; ферментная заместительная терапия, борьба с витаминной недостаточностью; лечение эндокринных нарушений.
Лечение приступа хронического панкреатита, а также острого панкреатита проводиться по аналогичной схеме. Обязательные компоненты терапии: внутривенное введение растворов электролитов и коллоидов, голодная диета (полное голодание до двух дней) и анальгезия (например, меперидин). Рекомендуется введение свежезамороженной плазмы или альбумина. Диуретики не показаны большинству больных: олигурия разрешается при исчезновении гиповолемии и нормализации перфузии почек. Для облегчения рвоты, купирования пареза желудочно-кишечного тракта и уменьшения стимуляции поджелудочной железы может быть использована аспирация содержимого желудка через назогастральный зонд. Коагулопатия, возникающая при панкреатите, обычно требует назначения гепарина, свежей плазмы. В последние годы при остром панкреатите показана эффективность антагониста тромбоцит-активирующего фактора лексипафанта (60–100 мг/сут), однако его действие при хроническом панкреатите еще нуждается в уточнении.
Применение ингибиторов протеолитических ферментов (например, апротинина, габексата) является спорным. Исследования показывают, что при остром панкреатите не наблюдается дефицита ингибиторов протеаз, кроме того, проведенные клинические исследования не выявили преимуществ этих препаратов по сравнению с плацебо. Однако существуют данные, что габексат, низкомолекулярный ингибитор трипсина, эффективно используется для профилактики развития острого панкреатита, связанного с ЭРХПГ.
Ингибиторы секреции поджелудочной железы: глюкагон, соматостатин, кальцитонин, ингибиторы карбоангидразы, вазопрессин, изопреналин, также было предложено применять для лечения острого панкреатита, однако их эффективность к настоящему времени не получила достаточного подтверждения. Препараты пищеварительных ферментов можно использовать для лечения как в разгар заболевания с целью подавления панкреатической секреции, так и в период выздоровления, когда пациент снова получает возможность принимать пищу орально.
При билиарном обструктивном панкреатите должна быть проведена своевременная эндоскопическая декомпрессия желчных путей. Выполняется папиллосфинктеротомия, дилатация или стентирование панкреатического протока. Хирургическое лечение обструктивного панкреатита, безусловно, является основным методом, в то же время целесообразность проведения вмешательства в первые сутки после развития тяжелого приступа должна быть признана спорной. После стихания остроты воспаления целесообразно проведение холецистэктомии.
Схему длительной терапии при хроническом панкреатите можно разделить на две основные части, в соответствии с ведущими клиническими синдромами (см. диаграмму 2).
Купирование хронического болевого синдрома у больных панкреатитом — крайне сложная задача. В первую очередь необходимо быть уверенным в отсутствии у больного осложнений, которые могут быть скорректированы хирургическим путем (таких, как псевдокисты, внутрипротоковая обструкция или компрессия соседних органов). Некоторое значение для снижения выраженности боли имеет питание — требуется проведение терапии витаминами, препаратами кальция при развитии мальдигестии. Принципиальное значение имеет прекращение приема алкоголя, что достоверно повышает выживаемость больных с тяжелым панкреатитом. Показаны анальгетики: парацетамол или нестероидные противовоспалительные препараты, трамадол. Современные исследования выявили, что при хроническом панкреатите эффективны лишь высокие дозы анальгетических препаратов: так, трамадол необходимо назначать по 800 мг/сут и выше, что в два раза превышает максимальную дозу. В западных странах гастроэнтерологи нередко используют наркотические препараты, что создает проблему развития зависимости у 10—30% больных. Большое значение имеет одновременное назначение вспомогательных препаратов, таких, как антидепрессанты, которые могут оказывать прямое противоболевое действие, способствуют купированию сопутствующей депрессии, а также потенцируют действие анальгетиков. Спазмолитики и холиноблокаторы нормализуют отток желчи и панкреатического сока (что снижает интрапанкреатическое давление) и являются необходимым компонентом терапии.
Часто ненаркотические анальгетики оказываются неэффективны, и встает вопрос о назначении опиатов, вплоть до морфина. Больному предписывается диета с ограничением жира и белка, прием антацидов (для уменьшения стимуляции поджелудочной железы).
Боль могут облегчить большие дозы панкреатических ферментов. Попадание ферментов поджелудочной железы (прежде всего — трипсина) в двенадцатиперстную кишку по механизму отрицательной обратной связи вызывает снижение панкреатической секреции, снижение внутрипротокового давления и уменьшает боль. Традиционно для этой цели использовались порошок или таблетированные препараты панкреатина.
Если болевой синдром резистентен к терапии, при расширении главного протока более 8 мм, у 70–80% пациентов облегчение может принести латеральная панкреатоеюностомия. В случаях, когда панкреатический проток не расширен, показано проведение дистальной панкреатэктомии (при преимущественном поражении хвоста железы) или операция Уиппла (Whipple) (при поражении в основном головки железы). Альтернативой операции является чрезкожная денервация солнечного сплетения введением алкоголя, однако эффект этой процедуры сохраняется лишь в течение нескольких месяцев. Весьма перспективно эндоскопическое лечение под контролем эндоскопического УЗИ (дренирование псевдокист, невролиз солнечного сплетения).
Показаниями для заместительной терапии экзокринной панкреатической недостаточности являются исключительно клинические показатели: похудание, стеаторея, метеоризм. Классическая рекомендация, предусматривающая определение содержания жира в кале перед назначением лечения, в настоящее время потеряла свое значение из-за трудоемкости и низкой чувствительности данного метода. Для купирования внешнесекреторной панкреатической недостаточности используют различные препараты экстрактов поджелудочной железы (см. таблицу 1).
При выборе препарата для заместительной терапии следует учитывать следующие показатели:
- высокое содержание липазы в препарате — дозировка должна быть достаточно удобной для приема до 30 тыс. ед. липазы на один прием пищи;
- наличие оболочки, защищающей ферменты от переваривания желудочным соком;
- маленький размер гранул или микротаблеток, наполняющих капсулы (одновременно с пищей эвакуация препарата из желудка происходит лишь в том случае, если размер его частиц не превышает 2 мм);
- быстрое освобождение ферментов в верхних отделах тонкой кишки.
Способность препарата активироваться только в щелочной среде — очень важное свойство, которое резко повышает эффективность ферментов; так, при использовании препарата, имеющего энтеросолюбильную оболочку, всасывание жиров повышается в среднем на 20% по сравнению с такой же дозой обычного средства. Однако при хроническом панкреатите происходит значительное снижение продукции бикарбонатов, что приводит к нарушению щелочной среды в двенадцатиперстной кишке. Это создает несколько проблем. Первая касается нарушения активации частиц ферментного препарата, покрытых энтеросолюбильной оболочкой. Вторая проблема заключается в том, что в кислой среде происходит преципитация желчных солей и нарушение эмульгации жира, что делает его малодоступным для расщепления липазой. Поэтому эффективность ферментной терапии (см. рисунок 1) может быть повышена благодаря одновременному назначению антацидов за 30 мин до и через 1 ч после еды или антисекреторных препаратов (Н2-блокаторы, омепразол), но необходимо помнить, что антациды, содержащие кальций или магний, ослабляют действие ферментных препаратов. Возможно использование препаратов, содержащих протеолитические ферменты растительного происхождения, которые сохраняют активность в гораздо более кислой среде, чем животные.
Значительное снижение качества жизни больного панкреатитом связано с такой проблемой, о которой обычно забывают, как стойкое вздутие живота. Нередко вздутие не купируется даже при приведении заместительной терапии высокими дозами ферментов. В этом случае к проводимой терапии необходимо добавить адсорбенты (симетикон, диметикон) или использовать комбинированные ферментные препараты, содержащие адсорбирующие вещества.
Разовая доза ферментов, которая рекомендуется для лечения внешнесекреторной панкреатической недостаточности, должна содержать не менее 20–40 тыс. ед. липазы. Обычно пациенту назначают две—четыре капсулы препарата (по 20—25 тыс. ед. липазы) при основных приемах пищи и по одной-две капсуле (по 8—10 тыс. ед. липазы) или таблетки панкреатина при употреблении небольшого количества пищи. При клинически выраженной панкреатической недостаточности обычно не удается полностью устранить стеаторею даже с помощью высоких доз препаратов, поэтому критериями адекватности подобранной дозы пищеварительных ферментов являются: прибавка веса, нормализация стула (менее трех раз в день), снижение вздутия живота.
Причины неэффективности заместительной терапии могут быть связаны как с неточной диагностикой заболевания, так и с неадекватным назначением терапии больному (см. рисунок 2).
- Неадекватная доза препарата (нередко для снижения стоимости курса лечения назначают более низкую дозу препарата).
- Несоблюдение больным схемы терапии, снижение кратности приема.
- Прием в неправильное время: до или после еды.
- Стеаторея внепанкреатического происхождения (такие, как целиакия, лямблиоз и др.).
- Нарушения моторики кишечника, в частности, у больных сахарным диабетом или после ваготомии.
- Неверный выбор схемы лечения:
- назначение обычных ферментов (не имеющих кислотозащитной оболочки) без ингибиторов желудочной секреции;
- использование препаратов, которые из-за больших размеров гранул поступают в двенадцатиперстную кишку неодновременно с пищей.
Побочные эффекты ферментной терапии (см. рисунок 3) обычно не носят тяжелого характера, наиболее известный опасный побочный эффект — развитие фиброзирующей колопатии — возникает при длительном приеме очень высоких доз ферментов в виде микротаблеток: более 50 тыс. ед. липолитической активности на 1 кг веса тела в сутки.
- Болезненные ощущения в ротовой полости.
- Раздражение кожи в перианальной области.
- Дискомфорт в животе.
- Гиперурикемия.
- Аллергические реакции на свиной белок (в том числе у родственников больных c экзокринной панкреатической недостаточностью и медицинского персонала).
- Нарушение всасывания фолиевой кислоты (образование комплексов).
- Фиброз терминальной части подвздошной кишки и правых отделов ободочной кишки.
Таким образом, терапия хронического панкреатита должна проводиться дифференцированно, в зависимости от ведущего клинического синдрома и стадии заболевания. Заболевание, которое удается обнаружить на первой стадии, как правило, не требует медикаментозной коррекции, в этом случае обычно достаточно изменения образа жизни и диетотерапии. Лечение ХП на второй стадии включает назначение таблетированного панкреатина, антисекреторных препаратов и спазмолитиков. Третья стадия обычно требует использования всего арсенала средств, которые имеются у врача для купирования панкреатической боли: микрогранулы панкреатина, антисекреторные препараты, октреотид, спазмолитики, мощные анальгетики, психотропные препараты. На последней, четвертой, стадии лечение основывается, прежде всего, на использовании микрогранул панкреатина в высокой дозе с целью проведения заместительной терапии.
По вопросам литературы обращайтесь в редакцию
А. В. Охлобыстин, кандидат медицинских наук
Э. Р. Буклис, кандидат медицинских наук
ММА им. И. М. Сеченова, МоскваЧитайте также:

