Как повысить иммунитет после опоясывающего лишая
Обновлено: 19.04.2024
Одной из нозологических форм, которую вирусы простого герпеса (ВПГ) вызывают у человека, является генитальный герпес. В настоящее время эта форма ВПГ-инфекции считается наиболее распространенной среди всех инфекций, передающихся половым путем.
Одной из нозологических форм, которую вирусы простого герпеса (ВПГ) вызывают у человека, является генитальный герпес. В настоящее время эта форма ВПГ-инфекции считается наиболее распространенной среди всех инфекций, передающихся половым путем. Генитальный герпес вызывают два серотипа вируса простого герпеса: ВПГ-1 и ВПГ-2; причем наиболее часто — ВПГ-2. Согласно данным сероэпидемиологических исследований, инфицирование ВПГ-1 выявляется у 20—40%, а ВПГ-2 — у 50—70% больных генитальным герпесом [2]. Заболевание передается преимущественно при сексуальных контактах от больного генитальным герпесом. Нередко генитальным герпесом заражаются от лиц, не имеющих симптомов заболевания на момент полового контакта или не знающих о том, что они инфицированы [5]. Эта особенность ВПГ, связанная с бессимптомным вирусоносительством, является сложной задачей, от решения которой зависит не только трудоспособность и здоровье, но и личная судьба миллионов потенциальных больных. Имеются сведения о том, что от 60 до 80% новорожденных, у которых развивается неонатальный герпес, рождаются от матерей с бессимптомным носительством [6].
ВПГ-инфекция также может быть причиной нарушения репродуктивной функции, невынашивания беременности, преждевременных родов и патологии плода. Возможно участие ВПГ в развитии онкологических заболеваний гениталий, иммунодефицитных состояний, что позволяет считать герпесвирусные инфекции важной медико-социальной проблемой практического здравоохранения [2].
Лечение хронических, часто рецидивирующих форм ВПГ-инфекции, до настоящего времени представляет определенные трудности, которые объясняются особенностями взаимодействия вируса с макроорганизмом. Жизнедеятельность вирусов герпеса основывается на следующих биологических особенностях:
- все вирусы герпеса являются внутриклеточными паразитами;
- герпесвирусы пожизненно персистируют в аксоноганглиальных структурах центральной и периферической нервной системы;
- в течение жизни человек многократно реинфицируется новыми штаммами вирусов герпеса, при этом возможно одновременное сосуществование нескольких видов и штаммов вирусов [12];
- при нарушении динамического равновесия между иммунным гомеостазом и вирусами последние переходят в активную форму [9].
Согласно данным проведенных исследований только 20% инфицированных ВПГ имеют диагностированный генитальный герпес, 60% — нераспознанный симптоматический генитальный герпес (атипичную форму) и 20% — бессимптомный герпес. В настоящее время только 27% пациентов с диагнозом генитальный герпес получают противовирусную терапию, из них треть — местное лечение [2]. По данным некоторых авторов, около 95% пациентов с клиническими проявлениями генитального герпеса вообще никак не лечатся [11].
Все разнообразие методов терапии и профилактики герпесвирусных инфекций в конечном счете сводится к трем главным подходам:
- химиотерапия;
- иммунотерапия;
- комбинация этих двух методов.
Каждый врач в своей практической работе так или иначе сталкивается с необходимостью решения этой сложной задачи, требующей тонкого индивидуального подхода к каждому пациенту, страдающему ВПГ.
Теоретически идеальным вариантом химиотерапии был и остается механизм прямой инактивации вирусной ДНК, но из-за неизбежного общего токсического, цитопатического и канцерогенного эффекта этот способ для клинического использования оказался неприемлемым [8]. Поэтому был разработан менее опасный способ инактивации вирусной ДНК — подавление активности вирусных ферментов, обеспечивающих жизнедеятельность ДНК. Наиболее безопасным вариантом оказалось создание синтетических аналогов нуклеозидов герпесвирусной ДНК, которые избирательно фосфорилируются не клеткой, а вирусспецифическим ферментом — тимидинкиназой. В процессе копирования вирусной ДНК эти псевдонуклеазиды встраиваются в дочерние вирусные ДНК, что приводит к генетическому дефекту или нежизнеспособности вирусной ДНК [1]. Первый лечебный синтетический нуклеозид — ацикловир (ациклический аналог гуанозина) — стал «золотым стандартом» противогерпетической химиотерапии. Ацикловир, будучи включен в какой-либо участок новой ДНК, никогда не заменяется естественным гуанином [13]. В последнее время синтезированы и широко используются новые противовирусные препараты этой группы — валтрекс и фамвир.
Различают два способа применения противовирусных химиопрепаратов: эпизодическое назначение (при обострениях герпесвирусной инфекции по мере необходимости) и супрессивная или превентивная терапия. В первом случае препарат назначается коротким курсом (5—10 дней), во втором — ежедневный прием препарата в течение нескольких месяцев, а то и лет призван помочь не столько купировать рецидив, сколько предотвратить развитие рецидивов как таковых.
Однако за последние 10 лет увеличилось число исследований, в ходе которых было показано, что изоляты вируса простого герпеса, полученные от пациенток с продолжающимися рецидивами генитального герпеса на фоне длительной супрессивной терапии (более 4 месяцев), обладают резистентностью по отношению к ацикловиру [10].
К тому же ни ацикловир, ни другие противовирусные агенты — фамцикловир, валацикловир — не предотвращают перехода вируса в латентное состояние, возникновения рецидивов после их отмены либо передачи инфекции, а также, к сожалению, не влияют на естественное течение этой инфекции, то есть не гарантируют полного излечения. Поэтому на протяжении последних двух десятилетий ученые изыскивают методы непосредственного воздействия на иммунную систему больных генитальным герпесом с целью стимуляции специфических и неспецифических ее факторов, тем самым способствуя блокаде репродукции вируса [1].
Главной мишенью применения иммуномодулирующих препаратов служат вторичные иммунодефициты, которые проявляются частыми, рецидивирующими, трудно поддающимися лечению инфекционно-воспалительными процессами разной локализации [7]. Именно к таким процессам, требующим иммунокоррекции, и относится хроническая рецидивирующая герпесвирусная инфекция (ХРГВИ), в частности ее генитальная форма. Иммуномодуляторы назначают в комплексной терапии одновременно с противовирусными средствами.
Полиоксидоний — отечественный иммуномодулятор с широким спектром фармакологического действия, не имеющий аналогов в мире [3]. Опыт применения полиоксидония начиная с 1996 года показал его высокую клиническую эффективность в комплексном лечении многих вторичных иммунодефицитных состояний, проявляющихся хроническими, рецидивирующими, вялотекущими инфекционно-воспалительными процессами различной локализации, в том числе в ходе терапии вирусных инфекций [4].
У нас также имеется определенный позитивный опыт применения полиоксидония у пациентов, резистентных к ацикловиру [9].
Мы проводили исследование открытым методом у 50 пациентов с ХРГВИ. В исследование включались пациенты (возрастной интервал от 18 до 65 лет) мужского и женского пола с достоверным диагнозом ХРГВИ. К исследованию не допускались пациенты с гиперчувствительностью к полиоксидонию и беременные женщины. Все пациенты, включенные в исследование, находились в периоде продрома или обострения не более 48 часов от момента появления высыпаний. Обязательным условием для женщин детородного возраста было соблюдение полноценной контрацепции.
На предварительном этапе были сформированы две равнозначные группы пациентов по 25 человек. Пациенты, вошедшие в изучаемые группы, отбирались методом произвольной выборки. Все пациенты предъявляли жалобы на пузырьковые или эрозивные высыпания в области гениталий, зуд, жжение. До лечения всем пациентам проводилась ПЦР-диагностика ВПГ-2 (мазок) — положительный результат получен в 98,3 %.
Возрастной состав пациентов, страдающих генитальной формой герпесвирусной инфекции, в обеих группах был приблизительно одинаковым (43,6 года в первой группе и 38,9 — во второй), в то время как в первой группе средний возраст женщин и мужчин был несколько выше по сравнению со второй группой.
Дозировка и схемы введения. Всем пациентам производилась в/м инъекция препарата утром, под контролем врача. 1-я схема: терапия проводилась в течение 45 дней: пациенты получали по 6 мг полиоксидония в день в/м в течение 5 дней и по 6 мг в/м через день в течение 10 дней. Поддерживающая терапия — по 6 мг в/м 2 раза в неделю в течение месяца. 2-я схема: 6 мг полиоксидония в/м через день в течение 10 дней (всего 5 инъекций на курс).
Обследование проводилось до приема препарата и на 12—14-й день от начала приема препарата, а также на 3—6-й день после окончания приема препарата. Обследование включало общее клиническое, иммунологическое исследования крови, исследование мочи (общее), объективное исследование. Накануне приема препарата собирался подробный анамнез пациента. В состав исследуемых включались совершеннолетние пациенты мужского и женского пола с достоверным диагнозом ХРГВИ.
Объем сопутствующей терапии: все пациенты получали стандартную сопутствующую терапию (ацикловир по 0,2 г 5 раз в день в течение 5 дней и антиоксиданты).
Критериями оценки эффективности являлись следующие параметры: первичные критерии — время достижения полного выздоровления (полная реэпитализация); вторичные критерии — длительность ремиссии и частота рецидивов в ближайшем и отдаленном периоде после терапии полиоксидонием. С целью оценки местных симптомов проводился наружный осмотр места поражения. Оценивалось состояние кожных покровов и слизистых: наличие пузырьков, язвочек, корочек, гиперемии; выяснялись жалобы пациента (зуд, жжение, общее состояние, температура, миалгия).
На фоне лечения полиоксидонием по первой схеме длительность течения рецидива и период реэпителизации сократились в среднем с 6,44 до 3,5 дня, в то время как на фоне стандартной терапии (ацикловир и антиоксиданты) те же показатели изменились с 6,44 до 5,16 дня соответственно. После курса терапии в ближайшем и отдаленном периоде длительность рецидива и быстрота наступления реэпителизации в среднем составляла 4 дня. В процессе лечения препаратом свежие высыпания ни у одного пациента не появились. 76% (19 человек) отметили уменьшение тяжести течения рецидива; остальные — 24% (6 человек) — не отметили разницы по сравнению с периодом до получения препарата. На фоне лечения полиоксидонием по второй схеме длительность течения рецидива и период реэпителизации сократились в среднем с 6,72 до 4,24 дня вместо 6,72 — 5,04 дня соответственно. После лечения полиоксидонием в ближайшем и отдаленном периоде длительность рецидива и быстрота наступления реэпителизации в среднем также составляли 4 дня. 64 % (16 человек) отметили уменьшение тяжести течения рецидива; остальные — 36% (9 человек) — не отметили никаких изменений по сравнению с периодом до получения препарата.
Частота рецидивов у пациентов, получавших полиоксидоний по первой схеме в течение 6 месяцев после лечения, уменьшилась в среднем с 6,5 до 3 раз по сравнению с показателями ближайших шести месяцев перед получением препарата. Длительность ремиссии возросла в среднем с 27 до 75 дней. Максимальная длительность ремиссии увеличилась в среднем с 45 до 180 дней (у отдельных пациентов максимальная ремиссия достигала 190–220 дней, что связано с неравномерностью возникновения рецидивов в исследуемом временном интервале). У 84% пациентов (21 человек) отмечалось ослабление клиники течения рецидива; у 16% (4 человека) после лечения клиника не изменилась. Ухудшения течения заболевания отмечено не было. Частота рецидивов у пациентов, получавших полиоксидоний по второй схеме, в течение 6 месяцев после лечения уменьшилась в среднем с 6 до 3,6 раза по сравнению с показателями ближайших шести месяцев перед получением препарата. Длительность ремиссии возросла в среднем с 33 до 62 дней. Показатель максимальной длительности ремиссии в обеих группах вырос в среднем примерно одинаково — с 45 до 180 дней. У 72% пациентов (18 человек) отмечалось ослабление клиники течения рецидива; у 28% (7 человек) после лечения клиника не изменилась. Как и в первой группе, ухудшений течения заболевания отмечено не было.
Максимальная длительность ремиссии за период наблюдения (2 года) составила 1,9 года в первой группе (у 9 пациентов — 36 %) и 1,1 года во второй группе (у 4 пациентов — 16 %).
До лечения полиоксидонием в обеих группах частота встречаемости и выраженность местных и общих клинических проявлений ХРГВИ была выше по сравнению с теми же показателями на фоне лечения полиоксидонием.
Парентеральное (в/м) введение полиоксидония в соответствии со схемами (см. выше) не вызывало аллергических реакций, не оказывало гепатонефротоксического действия и токсического действия на кроветворные органы; пациенты отмечали хорошую переносимость препарата.
По данным общеклинических и лабораторных методов исследования, побочных эффектов и осложнений при приеме полиоксидония не было.
Использование полиоксидония в комплексной терапии пациентов с генитальной формой хронической рецидивирующей герпесвирусной инфекции является эффективным способом уменьшения клинических проявлений в фазе обострения, сокращения длительности рецидивов и заметного уменьшения их частоты в отдаленном периоде.
Раннее назначение полиоксидония способствует более быстрой реэпителизации и более стойкой ремиссии.
Использование инъекционной формы полиоксидония не вызывает аллергических реакций, а также других побочных эффектов и осложнений.
При соблюдении указанного режима дозирования препарат не обладает нефро- и гепатотоксическим действием.
А. Е. Шульженко, кандидат медицинских наук ГНЦ — Институт иммунологии МЗ РФ, Москва
По данным ВОЗ около 90% населения земного шара инфицированы одним или несколькими видами герпеса. В большинстве случаев первичное инфицирование происходит еще в детстве, после чего вирус переходит в латентное состояние. Он не размножается, его белки не синтезируются в клетках. Чаще всего реактивация вируса происходит на фоне других инфекций, неблагоприятных факторов внешней среды, психоэмоциональных перегрузок, эндокринных нарушений или изменений, а также иммунодефицитных состояний. Одна из самых распространенных детских инфекций – ветряная оспа – вызывается вирусом Varicella zoster (VZV), который относится к 3-му типу вирусов герпесгруппы и вызывает два заболевания: ветряную оспу и опоясывающий герпес (лишай). Причем как правило, при первичном заражении – развивается ветрянка, а впоследствии, – лишай.
Что такое опоясывающий лишай, чем он вызван и при чем здесь детская ветрянка
Это разновидность герпетической инфекции, поражающей нервную систему и имеющей кожные проявления. Вызвано заболевание тем же типом вируса, что и ветряная оспа. Принято считать ветрянку не слишком серьезным детским заболеванием, однако она не проходит бесследно. После перенесенной инфекции в ганглиях задних корешков спинного мозга формируется пожизненное носительство вируса в «дремлющем» состоянии, которое не требует лечения. В момент ослабления иммунитета, вызванного различными факторами, о которых говорилось выше, происходит реактивация вируса. Интересно, что опоясывающий герпес назван именно «опоясывающим», потому что клинически проявляется в виде сыпи, которая располагается вдоль нервных стволов и визуально, особенно при запущенных случаях, напоминает «пояс». Также важно понимать, что только опоясывающий лишай вызывается вирусом VZV. Другие лишаи могут иметь совершенно иное происхождение, от того и подход к их лечению может сильно отличаться.
Симптомы опоясывающего лишая
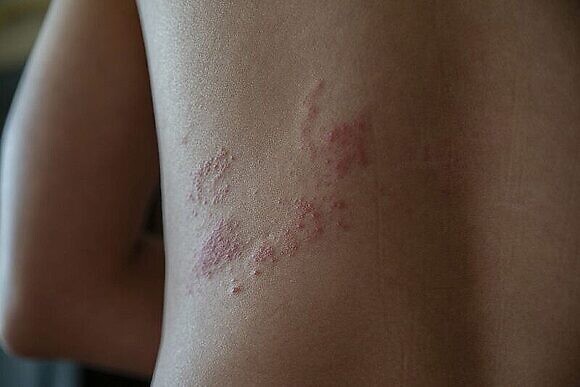
Помимо таких симптомов как увеличение лимфатических узлов, слабость, головная боль, тошнота, озноб и повышенная температура во время опоясывающего лишая на коже появляются участки, покрытые сыпью. Высыпания представлены мелкими сгруппированными пузырьками с прозрачной жидкостью внутри. Чаще они располагаются вдоль ребер, по ходу нервных стволов, как бы опоясывая тело. Однако высыпания при опоясывающем лишае могут появляться и на голове, животе, конечностях, ягодицах. Кожа на поражённых участках отекает, краснеет и нестерпимо зудит. Характерны интенсивные кожно-мышечные боли, обусловленные повреждением нервных волокон.
Кто может заболеть
Случаи заражения взрослых от больных опоясывающим лишаем чрезвычайно редки. При этом у детей, контактирующих с больными опоясывающим герпесом, может развиться ветряная оспа. Взрослые, общающиеся с ребенком, страдающим ветряной оспой, заболевают опоясывающим лишаем крайне редко. Заболевание чаще всего появляется один раз в жизни, эпидемий не наблюдается. Важным фактором риска развития опоясывающего герпеса является возраст. Заболеваемость ОГ в различных странах мира составляет от 0,4 до 1,6 случая заболевания на 1000 человек в год у лиц в возрасте до 20 лет, и от 4,5 до 11,8 случая на 1000 человек в год в старших возрастных группах. Риск развития опоясывающего герпеса у пациентов со сниженной способностью противостоять вирусам в 20-100 раз выше, чем у людей того же возраста с нормальным иммунитетом. К иммунодепрессивным состояниям, ассоциированным с высоким риском развития опоясывающего лишая, относятся: инфекция ВИЧ, пересадка костного мозга, лейкемия и лимфомы, химиотерапия и лечение системными кортикостероидами. Опоясывающий герпес может быть ранним маркером инфицирования ВИЧ, указывающим на первые признаки развития иммунодефицита. К другим факторам, увеличивающим риск развития опоясывающего герпеса, относят: женский пол, специфические поражения участков кожи, генетические нарушения i . Число больных увеличивается зимой и осенью.
Патогенез опоясывающего лишая не вполне ясен, однако, по современным данным, опоясывающий лишай можно расценивать как вторичную инфекцию на фоне частичного снижения иммунитета, развившуюся в результате контакта организма с вирусом в прошлом. Вирус в латентном состоянии находится в нервных ганглиях и при реактивации инфекции продвигается по ходу нерва к коже, где вызывает характерные высыпания. В большинстве случаев болезнь развивается у практически здоровых людей без видимых предрасполагающих факторов. Вместе с тем инфекция может быть спровоцирована травмой, рентгеновским облучением, переохлаждением, рядом других факторов, а также иммунодефицитом. Болезнь не рецидивирует, что отличает ее от ВПГ ii .
Сведения о вирусах герпесгруппы
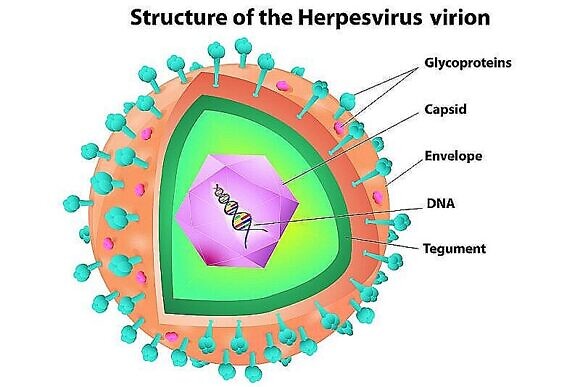
На практике врачи многих специальностей довольно часто сталкиваются с лечением заболеваний, вызванными ВПГ 1 и 2 типа (лабиальный и генитальный герпес), ВВО (ветряная оспа, опоясывающий герпес), для которых разработаны и стандартизированы методы диагностики и терапии. Однако, несмотря на наличие большого арсенала противовирусных препаратов, эффективность системной терапии рецидивирующей герпетической инфекции зачастую, увы, невысока. Для достижения длительной ремиссии в лечении важен комплексный подход: препараты, которые оказывают воздействие непосредственно на вирус плюс стимуляция антивирусного иммунитета.
Герпес 3-го типа (VZV) особенно опасен для беременных женщин, так как негативно влияет на плод. Уровня антител в крови матери бывает недостаточно для защиты плода, это связано со снижением иммунитета во время беременности, могут потребоваться препараты, обладающие иммуномодулирующим действием. Опоясывающий герпес во время беременности является маркером иммунного ответа: если случился рецидив ветрянки, необходимо срочно принимать меры по недопущению заражения плода. Степень опасности для плода зависит от срока беременности и титра защитных антител у матери. Препараты, которые можно использовать при опоясывающем герпесе во время беременности – ВИФЕРОН Гель, ВИФЕРОН Мазь.
Лекарства от опоясывающего герпеса
Лечение тем эффективнее, чем раньше оно начато. Домашнее лечение допустимо в легких случаях. Основной целью лечебных мероприятий является: подавление репродукции вируса в период обострения; формирование адекватного иммунного ответа и его длительное сохранение; предотвращение развития или восстановление тех нарушений, которые вызывает активация инфекции в организме. Разумеется, золотым стандартом лечения герпетических инфекций являются препараты на основе ацикловира или его дериватов. Это препараты прямого противовирусного действия, которые способны достаточно быстро купировать симптомы острой фазы заболевания. Однако у этих препаратов часто имеются противопоказания по возрасту, а также ограничения по использованию во время беременности. Также нужно помнить, что в последние годы растет уровень резистентности вируса опоясывающего герпеса к препаратам на основе ацикловира, что может сказаться на эффективности лечения iv . Являясь препаратами прямого противовирусного действия, ацикловиры не оказывают никакого воздействия на показатели иммунитета, а значит не предотвращают развитие рецидивов. Именно поэтому все чаще и чаще специалисты отдают предпочтение комплексной терапии, которая помимо вышеуказанных методов лечения, включает в себя препараты для поддержания иммунитета, а также витамины группы В.
Клинические рекомендации по лечению герпеса у взрослых v среди прочих содержат препараты интерферона, которые помимо противовирусного действия обладают также выраженным иммуномодулирующими свойствами. К таким препаратам относится ВИФЕРОН Суппозитории/Мазь/Гель. Местная терапия при опоясывающем лишае заключается в соблюдении рационального режима (запрещается мытье, кожу вокруг очагов протирают 2% салициловым спиртом) и применении противовирусных препаратов локального действия и симптоматических средств. Для устранения болевого синдрома используют акупунктуру, физиотерапию, УФ облучение, лазер. К рекомендуемым иногда при опоясывающем лишае кортикостероидным средствам нужно относиться с осторожностью, так как их применение может вызвать распространение процесса. При присоединении вторичной инфекции проводится лечение антибиотиками. Лечение постгерпетических невралгий проводится неврологом. Опоясывающий лишай может приводить к развитию серьёзных осложнений, поэтому даже домашнее лечение опоясывающего лишая должно проводиться согласно врачебным рекомендациям.
Направленное действие интерферона
Целесообразно проводить лечение опоясывающего лишая иммуностимуляторами, так как оно обеспечивает направленное воздействие непосредственно в очаге воспаления. Для лечения герпетической инфекции используют противовирусные средства на основе интерферонов, например, ВИФЕРОН. Терапевтическое действие препарата во многом обусловлено его комплексным составом. Противовирусное и иммуномодулирующее действия интерферона усиливаются благодаря наличию высокоактивных антиоксидантов, витаминов Е и С. Для системной терапии применяются ректальные суппозитории ВИФЕРОН в дозировке 1 000 000 ME 2 раза в сутки, 10 дней. У беременных с 14-й недели используется дозировка 500 000 ME два раза в день, курс лечения – смотрите в инструкции по медицинскому применению.

Для наружной терапии опоясывающего лишая могут быть использованы препараты ВИФЕРОН Мази или ВИФЕРОН Гель. Их наносят 3–5 раз в день 5-7 дней чистым шпателем или ватным тампоном/палочкой на предварительно подсушенную пораженную поверхность до исчезновения клинических проявлений. Врач как правило назначает комплексную схему лечения. Рекомендуется применять ВИФЕРОН при появлении первых признаков: зуд, жжение, покраснение слизистых или кожи.
О безопасности данных средств свидетельствует то, что суппозитории и гель можно использовать у детей с первых дней жизни, а мазь — с одного года. Если высыпания покрыты корками, то для их размягчения следует использовать мазь. Если их нет, то лучше использовать гель, особенно на слизистых оболочках.
Опоясывающий герпес или, как его еще называют, опоясывающий лишай, – одно из самых непонятных для обычного человека заболеваний вирусной природы. Его часто путают с другими видами лишая (розовый, стригущий, чешуйчатый), к которым приводят грибковые инфекции кожи, а также различные аутоиммунные процессы.
В случае опоясывающего лишая к появлению клинических симптомов и высыпаниям на коже приводит вирус герпеса 3 типа, Varicella zoster. Этот вирус также вызывает хорошо известную ветряную оспу. Выходит, что один и тот же вирус вызывает сразу два заболевания? Но как такое может быть? Давайте разбираться!
Когда организм человека встречается с вирусом Varicella zoster впервые, чаще всего развивается ветряная оспа. И обычно это происходит в детском возрасте, хотя в редких случаях заболевание может развиться и у взрослого человека. О том, что происходит, когда вирус дает о себе знать во второй раз, читайте далее. Также узнаете о том, как подобрать лекарство от опоясывающего герпеса.
Всем известно, что вирусы герпеса никогда не покидают организм, и Varicella zoster здесь не исключение. Проникая в скопления нервных клеток, он «впадает в спячку» и часто остается с нами навсегда, никак себя не проявляя. Однако, под воздействием внешних факторов вирус все-таки может «проснуться», вызывая при этом опоясывающий лишай. Также к развитию опоясывающего герпеса может привести контакт с больным ветряной оспой. Это происходит, когда человек, чаще пожилой, у которого снижены показатели иммунитета, контактирует с больным ребенком. Даже самое название вируса представляет интерес: «варицеллой» чаще называют именно ветряную оспу, а «зостер», что в переводе означает «ремень», ассоциируется с лишаем, так как характерная для этого заболевания сыпь появляется именно в области нижней части спины и живота.
Итак, мы выяснили, что опоясывающий герпес (опоясывающий лишай, герпес зостер, herpes zoster, ОГ) является вирусным заболеванием кожи и нервных тканей, которое возникает как результат реактивации вируса герпеса III типа (Human herpesvirus) подсемейства Alphaherpesviridae, семейства Herpesviridae. Встречается он примерно у 15 человек из 100 и проявляется у каждого четвертого взрослого из тех, кто ранее переболел ветряной оспой.
Важно помнить, что опоясывающий герпес у взрослых требует иного подхода к терапии: лекарства, которые педиатр рекомендует детям от ветряной оспы, не помогут. Терапию для лечения опоясывающего герпеса должен назначать врач-терапевт или врач-дерматолог после осмотра пациента и с учетом его анамнеза.
Как вирус герпеса зостер проникает в организм и как проявляется
Чаще всего первичное инфицирование вирусом, вызывающим ОГ, происходит в детском возрасте, когда ребенок заражается ветрянкой воздушно-капельным путем. После выздоровления вирус длительное время продолжает персистировать в области периферических нервных сплетений, спинальных ганглий (ограниченных скоплений нейронов) и ганглий мозга. К реактивации вируса могут привести иммунодефицитные состояния, когда естественная защита ослабевает и заболевание получает возможность «развернуться» в полную мощь.
Главные факторы, которые могут спровоцировать появление ОГ:
- возрастные изменения в организме – согласно данным статистики, это заболевание чаще всего встречается среди людей старше 50 лет;
- аутоиммунные и онкологические заболевания, в том числе сахарный диабет, лучевая и химиотерапия, состояние после тяжелых травм;
- беременность и вследствие этого повышенная нагрузка на организм;
- ВИЧ-инфекция – с ОГ сталкиваются почти 25% ВИЧ-инфицированных лиц, что в восемь раз превышает средний показатель заболеваемости пациентов среднего и старшего возраста;
- трансплантация органов, когда необходим прием иммуносупрессивных препаратов, предназначенных для искусственного угнетения иммунитета в целях предупреждения отторжения органа; i
- рецидив хронических заболеваний, затрагивающих сердечно-сосудистую систему, почки, печень и легкие;
- длительное лечение антибиотиками, цитостатиками, глюкокортикостероидами;
- частые стрессы, отсутствие достаточного отдыха, переутомление, переохлаждение или перегрев.
Опоясывающий герпес: симптомы и лечение
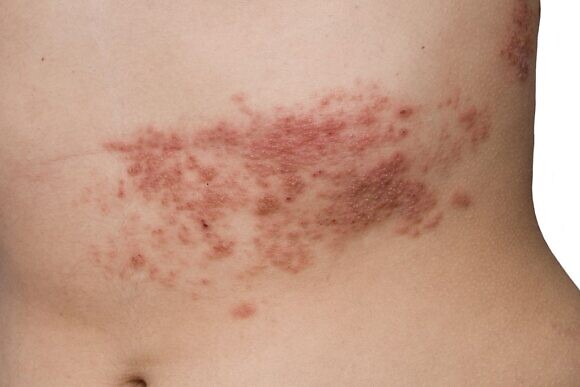
В отличие от ветряной оспы, при опоясывающем лишае не наблюдается резких вспышек заболеваемости, как в детских коллективах, также отсутствует и сезонная зависимость. Хотя некоторые ученые отмечают, что ОГ чаще встречается в теплое время года и поздней осенью. Тяжесть течения заболевания зависит от возраста. Дети, которые тоже болеют опоясывающим лишаем после перенесенной ветрянки, а также лица молодого возраста обычно переносят болезнь более благоприятно, чем пожилые люди.
Среди основных симптомов опоясывающего герпеса – кожные проявления и неврологические расстройства. Большинство инфицированных сталкивается с общеинфекционными клиническими признаками, которые проявляются в виде повышения температуры тела, головной и мышечной боли, тошноты, слабости, увеличения регионарных лимфатических узлов. Интенсивность проявления этих симптомов варьируется у каждого пациента. Продолжительность начального периода составляет примерно четыре-пять дней.
Клинические признаки ОГ могут быть похожими на плеврит, невралгию тройничного нерва и даже синдром острого живота, например, аппендицит, который требует немедленной помощи специалиста. Поэтому при общем плохом самочувствии и появлении на коже высыпаний любой природы необходимо сразу же обратиться к врачу.
В месте высыпаний перед появлением сыпи могут ощущаться легкие зуд и жжение. Потом на коже появляются розовые пятна круглой или неправильной формы, которые не склонны к слиянию, они отечные и немного приподнятые над поверхностью кожи. Затем на коже появляются везикулы с жидким серозным содержимым. Через несколько дней пузырьки подсыхают, на их месте появляются серозные корки, которые со временем отпадают и на их месте появляются пигментированные участки кожи. При правильном лечении снижается температура тела и исчезают симптомы общей интоксикации организма.
Как лечить опоясывающий герпес геморрагической, гангренозной абортивной и других форм
Кроме наиболее часто встречаемой формы опоясывающего лишая, о которой идет речь выше, также встречаются другие, которые могут выглядеть не совсем обычно и даже пугающе для неподготовленного человека. Например, при геморрагической форме везикулы заполняются кровянистым содержимым, поэтому на теле сыпь выглядит как пятна темно-коричневого цвета. Иногда везикулы не заживают бесследно, по разным причинам их дно некротизируется, после чего на коже остаются рубцы. Абортивная форма ОГ характеризуется появлением практически незаметных визуально папул (пузырьки не образуются), поэтому пациент не обращается к врачу.
При буллезной форме пузырьки на коже достаточно крупные, они могут сливаться в единый конгломерат с неровными краями. Их повреждение может приводить к инфицированию ранки, после чего может начаться гнойный процесс. В самых тяжелых случаях везикулы сливаются в обширные области, которые со временем некротизируются. В этом случае речь идет уже о гангренозной форме. Чаще эта форма развивается у пожилых людей, у лиц с язвенной болезнью и сахарным диабетом. В данном случае пациенту может быть необходима госпитализация и комплексное лечение.
Одна из главных целей лечения опоясывающего герпеса у взрослых, которые не требуют лечения в стационаре, – максимально быстрое купирование клинических симптомов заболевания (высыпаний и субъективных ощущений). Это обусловлено тем, что в зависимости от длительности цитопатического (приводящего к дегенеративным изменениям в клеточных структурах) действия вируса варицелла-зостер на клетки пораженных нервов значительно возрастает риск развития постгерпетической невралгии и других осложнений.
Возможные последствия отказа от лечения опоясывающего герпеса
ОГ приводит к многочисленным поражениям периферического и центрального отделов нервной системы. Чаще всего встречается такое осложнение, как постгерпетическая невралгия. Она проявляется в виде сильных болей, которые сохраняются или появляются через несколько недель и даже месяцев после появления первых высыпаний. Человек ощущает жгучие, резкие и приступообразные боли в области расположения сыпи. Этот симптом особенно усиливается по ночам. Особенно часто с таким осложнением болезни сталкиваются пожилые люди. Также встречаются случаи, когда вирус опоясывающего герпеса поражает брюшные мышцы и мочевой пузырь.
Кроме того, ОГ может поразить нервы, которые находятся в черепе. Подобное поражение может затронуть мозговые оболочки, что приводит к массе проблем со здоровьем. Одна из них – это поражение офтальмической ветви тройничного нерва, что неблагоприятно влияет на зрение.
Исследователи утверждают, что персистирующая, т.е. упорно протекающая и периодически вспыхивающая герпетическая инфекция может привести иммунную защиту организма к так называемой клеточной депрессии. Без поддержки в виде правильного лечения и возможности полноценно защитить себя организм может столкнуться с самыми разными осложнениями со стороны функционирования различных органов и систем.
Диагностика и правильное лечение опоясывающего герпеса у взрослых
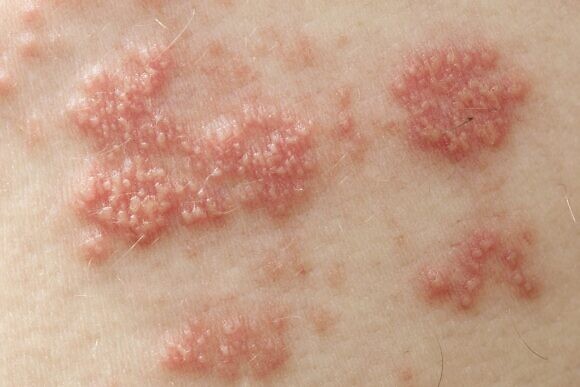
При подозрении на опоясывающий герпес необходимо обращаться к врачу-терапевту для осмотра и начала курса лечения. Также может понадобиться помочь врача-дерматолога и врача-иммунолога, а при выраженном болевом синдроме – врача-невролога.
Диагностика ОГ является преимущественно клинической, для подтверждения диагноза может потребоваться проведение лабораторных исследований. Также необходимо дифференцировать это заболевание от других похожих. Для этой цели широко применяется метод полимеразной цепной реакции (ПЦР), иммуноферментный анализ (ИФА) и иммунофлуоресцентный анализ, которые обычно не оставляют сомнений в диагнозе. Кроме того, могут потребоваться результаты общего и биохимического анализа крови, общего анализа мочи. При развитии генерализованной формы врач может дополнительно назначить анализ на ВИЧ.
Лечение ОГ чаще всего проводят амбулаторно, оно должно быть комплексным и включать как этиологические, так и патогенетические средства. Эффективность терапии во многом зависит от сроков начала лечения: чем раньше вы обратитесь к врачу и начнете лечение, тем быстрее наступит выздоровление и тем ниже будут риски развития осложнений.
Опоясывающий герпес: лечение народными средствами
Не стоит слепо доверять советам родственников и знакомых, не имеющих медицинского образования. Любые настойки, ванночки, растирания и аппликации на кожу могут принести вред, усилить зуд и расширить область появления высыпаний. Ведь во многих случаях народная медицина может не только не помочь избавиться от заболевания, но и быть небезопасной.
Опасность кроется и в том, что во время экспериментов с самолечением заболевание прогрессирует, у человека ухудшается самочувствие и могут развиться осложнения, что усложняет процесс лечения тогда, когда все же появляется решимость обратиться к врачу. Помните, что аргумент «даже если не поможет, то не навредит» в этом случае не работает. При подозрениях на опоясывающий лишай необходимо сразу же обратиться к врачу и начать лечение проверенными лекарственными препаратами.
Опоясывающий герпес: лечение, препараты и методы терапии
В настоящее время все методы лекарственного лечения и профилактики ОГ можно объединить в три основные группы, куда входят химиотерапия (прием ациклических нуклеозидов), иммунотерапия и комбинация этих двух групп, где пациент одновременно принимает химио- и иммуномодулирующие препараты.
Также применяют витамины B1, В6 и В12, аскорбиновую кислоту, рутин и при необходимости – антигистаминные препараты. При сильном болевом симптоме пациенту показан прием НПВП и анальгетиков.
Многие врачи придерживаются мнения, что приема только ациклических нуклеозидов в качестве основного лечения недостаточно, подобная монотерапия себя не оправдала. i Эти препараты наиболее эффективны только в первые 72 часа от начала развития болезни, они способны подавлять только вирусы герпеса в стадии активной репликации – процессе создания двух дочерних молекул ДНК на основе родительской молекулы ДНК. Они не оказывают влияния на те вирусы, которые уже существуют и находятся в латентном, т.е. «спящем» состоянии. Кроме того, ациклические нуклеозиды не помогают восстанавливать иммунитет.
Для лечения опоясывающего герпеса на теле пациентам необходима иммунокоррекция. Поэтому в этом случае будет уместной стратегия сочетания ациклических нуклеозидов и препаратов интерферона альфа-2b, которая признана врачами обоснованной и наиболее эффективной, что отражено в клинических и методических рекомендациях.
Интерфероны – «универсальные» бойцы, которые в отличие от антител не ориентированы на определенные патогены, а представляют неспецифический (врожденный) иммунитет и
способны бороться с любыми вирусными частицами. Интерфероны способны останавливать размножение и распространение вирусных частиц или бактерий.
Противовирусный препарат ВИФЕРОН в лечении опоясывающего герпеса
Одним из препаратов, применяемых для лечения герпеса, является ВИФЕРОН – противовирусный и иммуномодулирующий препарат, который обладает рядом уникальных фармакологических свойств.
ВИФЕРОН в своем составе сочетает рекомбинантный интерферон а-2b и комплекс антиоксидантов (витамины Е и С), в присутствии которых возрастает специфическая противовирусная активность главного действующего вещества, а также усиливается его иммуномодулирующее действие, что позволяет повысить эффективность собственного иммунного ответа организма на патогенные микроорганизмы. ii
Препарат представлен в виде ректальных суппозиториев (свечи), которые обеспечивают системное действие, то есть на весь организм в целом, а также в виде мази и геля, которые способны бороться с вирусами в «воротах» инфекции: в данном случае на поверхности кожи. Наличие как местных, так и системных форм позволяет применять препараты линейки ВИФЕРОН одновременно, усиливая тем самым эффекты проводимой терапии.
Препарат в форме свечей удобен в применении и для взрослых: он не перегружает желудочно-кишечный тракт (ЖКТ), что особенно актуально для людей, страдающих гастритом и другими заболеваниями ЖКТ, а также для тех, кто принимает большое количество таблетированных препаратов (пожилые пациенты и лица с сопутствующими заболеваниями).
Для лечения герпесвирусных инфекций у взрослых применяются свечи в дозировке 1 000 000 МЕ, у беременных женщин – 500 000 МЕ с последующими поддерживающими курсами с использованием дозировки 150 000 МЕ.

ВИФЕРОН Гель в виде полоски не более 0,5 см наносят на предварительно подсушенную пораженную поверхность 3-5 раз в день в течение 5-6 дней.
Сочетание ациклических нуклеозидов с препаратом ВИФЕРОН гарантированно сокращает сроки купирования ОГ и позволяет значительно снизить риск развития осложнений за счет комбинированного противовирусного действия (нарушение размножения вируса варицелла-зостер и препятствие прямому токсическому воздействию). iii
Как применять мазь при опоясывающем герпесе
Любая противогерпетическая мазь при опоясывающем герпесе может применяться в качестве дополнения к системной терапии, но не вместо нее.
Национальное научное общество инфекционистов и Московский научно-практический центр дерматовенерологии и косметологии рекомендуют включать препарат ВИФЕРОН в комплексную терапию опоясывающего герпеса у детей и взрослых, включая беременных женщин. iv
Справочно-информационный материал
Автор статьи
Врач общей практики
iii Халдин А.А., Васильев А.Н., Д.В. Баскаков Д.В. Виферон: опыт применения в дерматологической практике // Ремедиум Приволжье. – январь-февраль 2009. – С.20-22.
iv Потекаев Н.Н., Халдин А.А., Жукова О.В., Дмитриев Г.А. Методические рекомендации. Простой герпес. Опоясывающий герпес. Цитомегаловирусная инфекция. Московский научно-практический центр дерматовенерологии и косметологии ДЗМ. – 2019. – 32 с.
Вирус герпеса третьего типа varicella zoster (VZV) вызывает два клинически обособленных заболевания - ветряную оспу и опоясывающий герпес (Баринский И.Ф. и др., 1986; Haanpaa M., 2001). Оба заболевания, прежде всего, характеризуются везикулярной сыпью. Первичная инфекция манифестирует в форме ветряной оспы (ветрянки), а реактивация латентного VZV обусловливает появление локализованных высыпаний - опоясывающего лишая (Хахалин Н.Н., 2002). Мысль о связи между ветрянкой оспой и опоясывающим лишаем впервые была высказана в 1888 венским врачом Яношом Бокеем (von Bokay J., 1909).
Эпизод ветряной оспы в детстве способствует формированию специфической клеточной и гуморальной иммунной защиты. Считается, что рецидив инфекции у таких пациентов может развиться только на фоне недостаточности иммунной защиты, вследствие снижения активности специфических натуральных киллеров, Т-киллеров и системы интерферонов (Fleming D.M. et al., 2004). После первичной инфекции излюбленным местом персистенции VZV являются ганглий тройничного нерва и спинномозговые ганглии чувствительных корешков грудного отдела спинного мозга, где VZV находится в латентном состоянии. В течение этого времени вирус не размножается и не проявляет патогенных свойств. По-видимому, время латентного состояния вируса определяется уровнем специфических антител к VZV. Снижение их количества ведет к реактивации вируса, вирусной репликации (размножению), что на клиническом уровне и проявляется в виде опоясывающего лишая (Arvin A., 2005). Данный вывод подтверждается высокой корреляцией между вероятностью возникновения опоясывающего лишая у людей пожилого возраста и возрастным ослаблением активности клеточного звена иммунитета (Gilden et al., 2000)., На это также указывают данные, свидетельствующие о более высокой заболеваемости опоясывающим герпесом среди лиц, инфицированных вирусом иммунодефицита человека (Gilson I.H. et al., 1989), однако точные механизмы, лежащие в основе перехода вируса из латентного состояния в активное неизвестны.
В случае реактивации VZV ганглии чувствительных нервов становятся местами репликации вируса, именно в них обнаруживаются наиболее выраженные дегенеративные повреждения нейронов (Zerboni L. et al., 2005; Reichelt M. et al., 2008). В результате развивается ганглионит, сопровождаемый распространением инфекции вниз по нервным аксонам к коже. Каким образом происходит транспортировка вируса в поврежденных аксонах неизвестно. Инфекция также может распространяться центрально, приводя к воспалению оболочек в области передних и задних рогов спинного мозга (Gray F. et al. 1994). Отдельные патолого-анатомические наблюдения также свидетельствуют о наличии воспалительных изменений и в контралатеральных спинномозговых ганглиях (Miller S. E. et al., 1997), отмечается снижение количества нейронов и наличие воспалительных инфильтратов в ганглиях, периферических нервах, и спинномозговых корешках (Gowrishankar K. et al., 2007). В некоторых случаях отмечается выраженные некротические изменения в спинномозговых ганглиях. Большинство изменений в периферическом нерве протекает по типу Валлериановской дегенерации, имеющей место, как в толстых, так и в тонких волокнах. (Denny-Brown et al., 1944).
Доказано, что повреждение нейрональных структур начинается перед появлением кожной сыпи. При этом VZV по ходу чувствительных нервных волокон проникает в кожу, «ускользая» от факторов врожденного и приобретенного иммунитета, что в конечном итоге обусловливает возникновение односторонней везикулярной кожной сыпи, характерной для опоясывающего лишая.
Острая VZV инфекция клинически характеризуется стадией продрома и стадией везикулярных высыпаний (Arvin A., 2005).
Сыпь обычно локализуется в одном или нескольких смежных дерматомах и сопровождается развитием острой невропатической боли. У 50% больных сыпь встречается на туловище, у 20% - на голове, у 15% - на руках, и у 15% - на ногах (Arani R.B. et al., 2001).
Клинический диагноз опоясывающего лишая в типичных случаях достаточно прост. Однако иногда требуется проведение лабораторной диагностики с целью идентификации вируса. Наиболее быстрым и высокочувствительным методом является полимеразная цепная реакция.
В остром периоде болезни или после него возможно развитие осложнений, захватывающих различные системы организма. Наиболее серьезными считаются неврологические осложнения. В структуре неврологических расстройств ведущее место занимает поражение периферической нервной системы. При данном заболевании воспалительный процесс затрагивает региональные, чувствительные ганглии с развитием ганглиолитов. Наличие у больных корешковых болей, парастезий, сегментарных нарушений чувствительности отмечается практически у каждого больного (Stankus S. et al., 2000; Thyregod H. G. et al., 2007). Болевой синдром имеет выраженную вегетативную окраску в виде жгучих, приступообразных, резких болей, усиливающихся в ночное время. В головном мозге при опоясывающем герпесе могут быть обнаружены явления отека, выраженная диффузная инфильтрация подпаутинного пространства, геморрагии в белом веществе, базальных ганглиях (Sissoko D. et al., 1998). Следует заметить, что осложнения со стороны головного и спинного мозга в настоящее время встречаются редко. В случаях развития VZV-инфекции в области тройничного нерва часто наблюдаются осложнения со стороны глаз - кератит, ирит, ретинит, офтальмит. Ранее, при отсутствии специфической противогерпетической терапии, к частым осложнениям VZV-инфекции относились пневмонии, энцефалиты или гепатиты, иногда приводившие к летальному исходу.
Вместе с тем, из всех перечисленных осложнений VZV инфекции самым распространенным считается постгерпетическая невралгия (Dworkin R.H., Portenoy R.K., 1996).
Различают острую герпетическую невралгию (в течение 30 дней после начала заболевания) и постгерпетическую невралгию (Choo P. et al.,1997). К ПГН относят упорные боли в областях, затронутых герпесной инфекцией после заживления кожи (Dworkin R. et al. 2003). Наиболее хорошо установленными факторами риска для ПГН являются пожилой возраст, большая распространенность высыпаний на коже и выраженная боль перед везикулярной сыпью (Desmond R.A. et al., 2002; Fleming D.M. et al., 2004). Все эти факторы находятся во взаимосвязи, поэтому пациенты 50 лет и старше в большинстве случаев испытывают тяжелую, нестерпимую боль и значительные кожные высыпания, что гораздо чаще приводит к развитию ПГН. У пациентов со всеми этими факторами риск развития ПГН превышает 50-75 % (Gnann J., Whitley R. 2002; Jung B.F., 2004). Постгерпетическая невралгия может развиться в любом возрасте, однако для нее характерна прямая корреляция частоты встречаемости и длительности ПГН с возрастом. Более 50% всех пациентов с ПГН - старше 60 лет, 75% больных с указанной патологией приходится на возрастную группу старше 75 лет (Nurmikko T.J., 2001). Половина всех пациентов с ПГН старше 60 лет испытывает постоянную боль более 6 месяцев, в то время как в возрастной группе 30-50 лет ПГН более 6 месяцевь наблюдается у 10% больных (Whitley R. et al. 1996). В США ежегодно регистрируется 100-200 тыс. новых случаев ПГН (Nurmikko T.J., 2001). Однако, истинная распространенность ПГН не известна, не только потому, что эпидемиологические данные недостаточны, но также из-за отсутствия конценсусса по определению ПГН. Некоторые авторы относят к ПГН боли, возникающие в любой период герпесной инфекции, другие считают, что ПГН - это боль, сохраняющаяся спустя 3 месяца после заживления кожи. В первом случае определения ПГН ее распространенность составляет 8%, во втором - 4,5% (Choo P. et al. 1997). Постоянную боль в течение 1 мес после сыпи испытывают до 15% пациентов и около 4% пациентов от общего количества перенесших опоясывающий лишай отмечают сохранение боли в течение года (Lancaster T. et al. 1995).
Классическое проспективное исследование, проведенное Hope-Simpson (1975), продемонстрировало, что из 321 пациента с опоясывающим лишаем 10 % имеют выраженную боль спустя 3 месяца после острой герпетической инфекции, а 4 % - и через 12 месяцев. Подобные результаты были получены и в других проспективных исследованиях (Helgason S. et al. 1996; 2000; Scott F.T. et al., 2006), в которых также было показано, что наибольший риск пролонгации болевого синдрома после перенесенного опоясывающего лишая имеют пациенты в возрасте около 60 лет.
Постгерпетическая невралгия занимает третье место по частоте встречаемости среди различных типов невропатической боли и уступает только болям в нижней части спины и диабетической невропатии (Montero H.J. et al., 2005; Breivik H. et al, 2006; Torrance N. et al., 2006).
Локализация болевого синдрома практически всегда соответствует зоне кожных высыпаний. Интенсивность болевого синдрома как правило высокая. Кроме глубоких ноющих и стреляющих болей очень характерны поверхностные жгучие боли и наличие стимулозависимых болей - динамической гипералгезии и аллодинии (Baron R., 2004).
При клиническом осмотре в зоне болей выявляются нарушения поверхностной чувствительности. Качество боли в острый период опоясывающего лишая и при ПГН различно. Вместе с тем, несмотря на разный выбор дескрипторов из МакГилловского болевого вопросника, пациенты с опоясывающим лишаем и ПГН для описания своих болевых ощущений выбирают похожие по смыслу слова, например, горячая и жгучая боль или пронзающая и простреливающая боль (Bennett M., 2001).
Схожие проявления наблюдаются и при описании вызванной боли пациентами с опоясывающим лишаем и ПГН. И те, и другие отмечают наличие схожих типов гипералгезии и аллодинии (Haanpaa M. et al., 2000; Berry J.D., Rowbotham M.C., 2004).
У большинства пациентов боль, связанная с ПГН, уменьшается в течение первого года. Однако у части больных она может сохраняться годами и даже в течение всей оставшейся жизни, причиняя немалые страдания (Cunningham A.L., Dworkin R.H., 2000). Затяжной, тяжелый характер заболевания с длительным, выраженным болевым синдромом способствует формированию расстройств психики (Dworkin R.H., et al., 1992). У таких пациентов выявляются тревожно-депрессивные расстройства, когнитивные нарушения - снижение активного внимания, памяти, затруднения осмысления происходящего, отмечается некритичность, нетерпеливость, неряшливость, страх боли, неуверенность в завтрашнем дне, отмечается снижение социальной активности (Haythornthwaite J.A. et al., 2003). ПГН оказывает значительное отрицательное влияние на качество жизни и функциональный статус пациентов особенно пожилого возраста (Lydick E. et al., 1995). У пациентов с ПГН отмечается хроническая усталость, снижение массы тела, физической активности, нарушения сна (Morin C.M., Gibson D., Wade J., 1998).
В основе боли, связанной с ПГН, лежат воспалительные изменения или повреждения ганглиев задних корешков спинного мозга и периферических нервов в пораженных зонах тела. Такие боли относят к невропатическим болям, их выделяют в отдельную самостоятельную группу и определяют как боли, возникающие вследствие первичного повреждения соматосенсорной нервной системы (Treede R.D. et al., 2008).
Патофизиологической основой невропатических болевых синдромов являются нарушения генерации и проведения ноцицептивного сигнала в нервных волокнах, а также механизмов контроля возбудимости ноцицептивных нейронов в структурах спинного и головного мозга (Кукушкин М.Л., Хитров Н.К., 2004; Baron R. 2000).
Лечебная тактика при опоясывающем лишае включает два основных направления: противовирусная терапия и купирование невропатической боли, как в острый период заболевания, так и в стадии постгерпетической невралгии. Результаты нескольких рандомизированных контролируемых испытаний свидетельствуют о том, что раннее начало лечения простого герпеса может предотвратить развитие постгерпетической невралгии или способствовать ее скорейшему разрешению (Исаков В.А. и др., 2004; Helgason S. et al., 1996; Jackson J.L. et al., 1997 ; Volmink J. et al., 1996).
Наиболее широкое применение нашли такие специфические противогерпетические препараты, как ацикловир, фамцикловир и валацикловир, которые, являясь нуклеозидными аналогами, блокируют вирусную репликацию (Романцев М.Г., 1996; Beutner K. et al., 1995; Bruxelle J., 1995). Важно, что противовирусное лечение проявляет наивысшую активность, если назначено в течение 72 ч от начала герпетических высыпаний (Johnson R., 2001; Johnson R., Dworkin R.H., 2003). В ряде исследований доказана высокая эффективность ацикловира в уменьшении тяжести, продолжительности острой герпесной инфекции и профилактике ПГН, особенно при его раннем назначении. Оценка эффективности фамцикловира также продемонстрировала уменьшение времени до разрешения сыпи (Dworkin R.H. et al., 1998). В сравнительном исследовании ацикловира и валацикловира показана эквивалентная эффективность в сокращении продолжительности невропатической ПГН (Beutner K. et al. 1995). В другом клиническом испытании установлена терапевтическая эквивалентность фамцикловира и валацикловира для неосложненного герпеса (Tyring S. et al. 2000). Возможно также сочетанное использование противовирусной терапии и глюкокортикостероидов (Whitley R. et al. 1999). Выявлено, что такая комбинация эффективнее монотерапии противовирусными препаратами, особенно для лечения острой боли и коррекции различных аспектов качества жизни пациентов. Комбинация ацикловир+преднизолон значительно быстрее купирует острую невралгию и возвращает пациента к обычной жизнедеятельности, но существенно не влияет на течение ПГН, то есть она наиболее показана в остром периоде в старших возрастных группах для терапии острого болевого синдрома. Доказано, что хотя преднизолон является иммуносупрессором, его использование не увеличивает частоты развития ПГН и в этом смысле его действие сравнимо с влиянием плацебо, то есть данная комбинация может быть спокойно использована в старших возрастных группах. Для некупируемых тяжелых случаев ПГН некоторые исследователи рекомендуют интратекальное введение метилпреднизолона (Kost R., Straus S., 1996).
В настоящее время в США делается акцент на профилактику герпетической инфекции. С 1995 г. в США проводится всеобщая вакцинация от ветряной оспы, особенно пожилых лиц, и с 1999 г. отмечается резкое снижение заболеваемости (Hambleton S., Gershon A., 2005; Oxman M.N. et al., 2005).
При постгерпетической невралгии препаратами с доказанной эффективностью (класс А - терапия первой линии) являются: пластины с 5% лидокаином, габапентин, прегабалин, трициклические антидепрессанты, трамадол (Attal et al., 2006).
На сегодняшний день эффективность применения пластин с 5% лидокаином (Версатис, Grunenthal Gmbh) убедительно доказана при лечении ПГН. Так, в нескольких рандомизированных клинических исследованиях установлено, что применение пластин с 5% лидокаином статистически достоверно более значимо облегчает проявления болевого синдрома у пациентов с постгерпетической невралгией по сравнению с плацебо (Rowbotham M.C., 1996; Galer B.S., 1999, 2002). На основании полученных данных FDA одобрило применение данного препарата в качестве стартовой терапии у пациентов с постгерпетической невралгией. (Richard L. et al., 2004)
Версатис - это топический анальгетик, который действует непосредственно там, где болит. Он выпускается в виде мягких пластин размером 10х14 см, которые наклеиваются на неповрежденную кожу без признаков воспаления. Медленно высвобождающийся из пластины лидокаин создает более или менее значительную концентрацию лишь в поверхностных слоях кожи, где проходят тонкие волокна, обеспечивающие болевую и температурную чувствительность (Gammaitoni AR, Davis MW. 2002.). Лидокаин лишь в незначительной степени проникает в более глубокие слои кожи, где проходят кровеносные сосуды, поэтому его попадание в системный кровоток сведено к минимуму. У пациентов, использовавших пластины Версатис, не наблюдалось никаких известных системных эффектов лидокаина (влияние на деятельность ЦНС и сердечно-сосудистой системы). Таким образом, важнейшим преимуществом пластин Версатис служит отсутствие системного действия, что гарантирует безопасность лечения. Практически полное отсутствие системного эффекта позволяет назначать Версатис совместно с любыми другими препаратами для лечения нейропатической боли.
Механизм лечебного эффекта препарата Версатис не ограничивается только действием высвобождающегося из них лидокаина. Важное значение имеет также то, что пластина выполняет роль механического барьера, препятствуя раздражению участка кожи с измененной чувствительностью (аллодиния), а также оказывает не него легкое охлаждающее действие (Galer BS, Gammaitoni AR, Oleka N et al., 2004)
Пластины Версатис рекомендуется прикреплять на 12 ч в течение суток, затем следует 12-часовой перерыв. Обезболивающий эффект часто начинается в течение 30 мин после прикрепления пластины, но может проявляться и позже, нарастает в течение 4 ч и затем поддерживается в течение длительного времени, пока пластина прикреплена к коже. Более того, он может сохраняться и после ее удаления.
Для объективной оценки эффективности каждого из препаратов при лечении ПГН используется показатель NNT (number needed to treat - количество больных, которых нужно пролечить, чтобы получить у одного 50% снижение боли). Чем ниже NNT, тем более эффективен препарат при данной патологии. NNT для пластин с 5% лидокаином при лечении пациентов с ПГН составляет 2,0; для амитриптилина - 2,6; габапентина - 4,4; прегабалина - 4,6 (Wu C.L., Raja S.N., 2008); для трамадола - 3,9 (Kalso E., 2006).
Кроме того, в клинической практике очень важен показатель NNH (number needed to harm - число пациентов, которых необходимо пролечить данным препаратом, чтобы получить развитие 1 случая неблагоприятной побочной реакции, приводящей к отмене препарата). Он показывает, насколько безопасен данный препарат при его использовании. Величина NNH для трамадола, рассчитанная по результатам нескольких клинических исследований, составила 9.0, для ТЦА 14.7, для габапентина 26.1. Рассчитать показатель NNH для пластин с 5% лидокаином не представляется возможным в связи благоприятным профилем безопасности препарата, сравнимым с плацебо.
Таким образом, оценка препарата Версатис с позиций доказательной медицины делает его препаратом выбора при лечении постгерпетической невралгии, что подтверждено в соответствующих рекомендациях.
СПИСОК ЛИТЕРАТУРЫ
Читайте также:

