Как повысить иммунитет к бородавками
Обновлено: 18.04.2024
Как охотники готовятся к охоте — изучают следы, устанавливают кормушки, размещают загонщиков, ставят стрелков на линию огня, выпускают собак — так же и иммунологи, чтобы избавить организм от вируса, поэтапно готовят и направляют процесс активации иммунной системы. Первое действие — определить мишень.
Мишень — белок вируса
Вирус папилломы, попав в клетки кожи, проявляет себя как двуликий Янус. Его геном может находиться в двух формах: или встроиться в хромосому клетки, или существовать в виде свободной молекулы — ДНК-эписомы. Если он встроился в клеточную хромосому, то при наличии предрасполагающих факторов происходит реализация программы его генома и вирус начинает размножаться. Пораженный участок превращается в папиллому, или бородавку. Причем порой это случается не на руке или ноге, а на слизистой оболочке в самых интимных местах человеческого тела. И если вирус принадлежит к особому подтипу, то лет через десять пораженные клетки, возможно, трансформируются в раковую опухоль.
Для своей успешной жизни вирус должен заставить клетку синтезировать несколько полезных ему белков. В частности, вирусу папилломы нужен белок L1, который идет на строительство оболочки новых вирусных частиц, а также белки Е6 и Е7 — они делают зараженную клетку бессмертной, это онкогенные белки.

Бороться с вирусом можно несколькими принципиально разными способами. Первый — запретить ему связываться с клетками-мишенями, второй — не дать ему в них размножаться, третий — уничтожать больные клетки вместе с вирусом. Поскольку в случае с вирусом папилломы больные клетки не содержат его в традиционном понимании — ведь после попадания в клетку от него остается одна ДНК, которая и задает синтез тех самых опасных белков, — запретить размножение нельзя. Поэтому в руках медиков остаются первый и третий способы, то есть профилактическая вакцина и терапевтическая. Недавно появился еще один — применение коротких, так называемых молчащих РНК, которые принуждают замолкнуть вирусные гены. Но движение по этому пути еще в самом начале.
Ситуация осложняется тем, что у каждого вида млекопитающих имеются свои вирусы папилломы, которые не живут в тканях других видов, а в культуре клеток вирус человека размножается чрезвычайно неохотно. В результате поиск вакцины приходится вести на мышах, а потом надеяться, что эти результаты удастся воспроизвести при испытаниях с участием добровольцев.
Большим успехом в борьбе с вирусом папилломы оказалось открытие в 1991 году интересного феномена, сделанное Чжоу Цзянем и Яном Фрэйзером, работавшими в брисбенском госпитале им. принцессы Александры, Австралия (Яна Фрэйзера в ноябре 2008 года наградили за эту работу итало-швейцарской премией фонда Бальцана в размере 1 млн швейцарских франков. — Примеч. ред.). Они обнаружили, что белки L1 самопроизвольно собираются в вирусоподобные частицы (ВПЧ) даже если внутри них нет никакого генетического материала. Такие белки очень просто и в больших количествах можно синтезировать с помощью дрожжей, встроив в них нужный ген. Из дрожжей они выходят уже в виде готовых частиц, причем их иммунногенные свойства такие же, как и у настоящего вируса. Если ВПЧ ввести в организм, то в нем начнут вырабатываться защитные антитела. Во многих экспериментах такая защита доказала свою надежность, и спустя одиннадцать лет после открытия большой эксперимент с участием 1533 добровольцев показал, что подобная вакцина от вируса папилломы человека подтипа 16 (HPV16), во-первых, вполне безопасна, а во-вторых, обеспечивает полную защиту организма. Этот результат важен еще потому, что именно на подтипы 16 вместе с 18, 31 и 45 приходится 80% всех случаев опухолевого перерождения пораженной вирусом ткани, прежде всего рака шейки матки. За оставшиеся 20% ответственны еще 13 разновидностей этого вируса. За шесть лет, прошедшие с начала эксперимента с участием добровольцев, действие вакцины не ослабло — ни одного случая заражения вирусом среди них зафиксировано не было.
В 2006 году компания «Merck» первой получила разрешение на продажу на территории США и Европы профилактической вакцины «Gardasil», которая защищает от папиллома-вирусной инфекции подтипов 6, 11, 16, и 18. Вакцинацию врачи рекомендуют проводить девочкам в возрасте от 9 до 26 лет. В 2007 году компания «GlaxoSmithKline» получила разрешение на вакцину «Cervarix», которая защищает от 16 и 18 подтипов вируса папилломы.
Пептидные пули
Однако это все — профилактические вакцины, причем пока неизвестно, сколь быстро иммунная система забудет о той информации, которую она получила в момент прививки. Поэтому огромный интерес вызывает терапевтическая вакцина, которая уничтожает уже зараженные клетки.
Для ее создания иммунологи надеются использовать столь яркий след вируса, как те самые два белка, Е6 и Е7. Они обязательно должны быть на поверхности заболевших клеток, и, стало быть, задача состоит в том, чтобы научить клетки-киллеры находить эти следы.
Многие лаборатории в мире соревнуются на этом поприще, ведь цена победы очень велика. Для возбуждения иммунного ответа применяют и сами Е-белки, и их пептидные фрагменты (Т-эпитопы), и химерные конструкции из Е- и L-белков. (Напомним, что вещества, которые возбуждают иммунный ответ, называются антигенами.) Для усиления ответа в вакцину добавляют цитокины, белки теплового шока и другие стимулирующие элементы.
Непременный компонент вакцины — вектор, который обеспечивают доставку антигенов — Е-белков или их пептидных фрагментов — в специальные клетки иммунной системы (макрофаги, дендритные клетки), после чего те начинают вырабатывать особые белки цитокины и давать инструкции клеткам-киллерам, что им, собственно, надо уничтожать. Векторами для антигенов папилломавируса в разных опытах служили вирус осповакцины, аденовирус, альфавирус, бактерии. Надо отметить, что дендритные клетки — самые активные партнеры для возбуждения сильного иммунного ответа, поэтому желательно, чтобы антигены попадали именно в них.
Вот почему большое внимание уделяют химерным конструкциям на основе белков теплового шока, то есть содержащим и Е-белок, и белок-усилитель иммунного ответа. Белок теплового шока имеет сродство к дендритным клеткам. Именно таким методом в модельных экспериментах удалось уже при однократной иммунизации зафиксировать уменьшение размера опухоли. Сейчас несколько кандидатов в терапевтические вакцины находятся на различных проверочных стадиях, но в отличие от профилактических вакцин пока ни одна из них не дала приемлемой эффективности. Возникает мысль, что успеха можно достичь, совершенствуя все части вакцины: пептидные фрагменты, которые наиболее правильно повторяют Т-эпитопы Е-белка, вектор для направленной доставки вакцины в дендритную клетку, стимулятор иммунного ответа, а также носитель вакцины, на котором все это держится.
Работу по реализации программы «Комбинированная вакцина к HPV 16, 18 и 31», которую под руководством академика РАМН М. Р. Хаитова вели коллективы двух институтов — Института иммунологии и ГОСНИИГенетики, мы начали с компьютерных расчетов. Чтобы проводить такое исследование, надо иметь хорошие инструменты — набор специфических антител к различным типам вируса, референс-препараты (вирусные белки), чтобы было с чем сравнивать получаемые продукты. В России ничего из этого купить было нельзя, и даже в США невозможно было купить антитела к некоторым L1-белкам — ни одна фирма их не делала для продажи. И здесь нам здорово помог профессор Нейл Кристенсен из Медицинского центра Милтон Херши в Пенсильвании, предоставив микрообразцы некоторых рекомбинантых белков и моноклонов. Но многое пришлось синтезировать самим, в том числе антитела к белкам L1 и Е7 трех типов и к различным их участкам, которые рассчитывались по компьютерным алгоритмам. Все пептиды синтезировали химическим путем твердофазным методом, их было около 20 штук. Такие пептиды для организма безопасны, и синтезировать их несложно, однако иммунная система недостаточно активно на них реагирует — чистые пептиды почти не индуцируют антител. Поэтому приходится их соединять, во-первых, с носителем, а во-вторых, добавлять вещества, которые стимулируют иммунную систему. В качестве носителей использовали гемоцианин (огромный белок из улитки) «полиоксидоний» на основе которого ранее была создана вакцина «Гриппол» (см. «Химию и жизнь», 2005, № 5. — Примеч. ред.), и некоторые другие стимуляторы.
Параллельно в ГОСНИИГенетики был налажен синтез в дрожжах белков L1 трех типов (с одним из них была проблема), который собирался в правильные вирусоподобные частицы и правильно реагировал с антипептидными антителами и референс-моноклональными антителами.
Ответы на разные пептиды сильно отличались, и эти эксперименты позволили выявить наиболее эффективные фрагменты как белка L1, так и Е7. Окончательная проверка показала, что если в качестве носителя-адъюванта к этим пептидам использовать гемоцианин улитки или специальный иммуностимулятор ПМ, то реакция иммунной системы будет наиболее сильной. Самое главное, что при этом вырабатывается сильный иммунный ответ к L1, а также активируются популяции специфических клеток-киллеров, так называемые цитотоксические Т-клетки CD8 + . Именно они должны уничтожать зараженные клетки. Фактически, полученные данные дают основание считать, что нам удалось создать отдельные компоненты прототипа комбинированной вакцины, профилактической и терапевтической. Пока это еще не вакцина, препарат надо испытывать на приемлемой биологической модели, например на мышах с перевиваемой опухолью, вызываемой онкогенным белком Е7. Причем полученные вакцинные препараты скорее ориентированы на профилактику, поскольку уже доказано, что белок L1 генерирует сильный защитный ответ даже в отсутствие адъюванта.
Пептиды — слабые иммуногены, в этом мы убедились, сделав конъюгат одного пептида из белка Е7 со стандартным адъювантом Фрейнда. Активировать Т-клетки таким путем непросто, и, вероятно, нужно менять тактику. Прежде всего для этого требуется обеспечить целевую доставку пептидных антигенов из Е-белка в дендритные клетки, чтобы достичь специфической и сильной активации киллерных CD8 + лимфоцитов.
И тогда мы решили применить новый подход: использовать как усилитель доставки фуллерены, высокая клеточно-проникающая способность которых хорошо известна, и добавить вектор, который бы направлял их в дендритные клетки. Для этого пришлось заняться работой, не имеющей прямого отношения к созданию вакцины: определить иммуногенность фуллерена и их производных с аминокислотами и пептидами, а также их способность проникать внутрь клеток. И здесь мы получили очень интересные результаты.
Фуллерен и жизнь
О токсичности фуллеренов сказано уже немало, причем есть две противоположные точки зрения: «они чрезвычайно вредны» и «они весьма полезны». Не исключено, что появлению столь разных точек зрения способствуют особенности физико-химических свойств фуллеренов, а именно то обстоятельство, что они в силу своей гидрофобности не растворимы в воде. В результате, чтобы приготовить препарат и ввести его, например, в кровь подопытному животному, молекулу фуллерена нужно как-то модифицировать: присоединить к ней гидрофильные группы или добавить в раствор поверхностно-активные вещества, способные подавить гидрофобность фуллеренов. Эти компоненты могут обладать специфической химической активностью, они оказываются сами по себе токсичными, что вполне способно привести к выводу о токсичности самого фуллерена. И такие случаи широко известны. Например, один из весьма авторитетных специалистов по изучению биологического действия фуллеренов, Г. В. Андриевский из Института терапии АМН Украины, доказал, что данные, приведенные в наиболее часто цитируемой статье о токсичности фуллеренов, связаны именно с артефактом: в изучаемой фуллеренсодержащей жидкости присутствовало токсичное вещество — тетрагидрофуран. Сам же Г. В. Андриевский известен тем, что сумел создать методику получения довольно концентрированного раствора (наносуспензии) фуллерена в воде.
Проблема токсичности фуллеренов и прочих наночастиц давно уже стала весьма актуальной. Сразу же за открытием фуллеренов среди ученых распространилась идея, что эти молекулы могут пригодиться в качестве средства для транспортировки лекарственных препаратов. Сейчас синтезированы сотни соединений фуллеренов, многие из них проявляют биологическую активность, однако до создания коммерческих препаратов дело не дошло. Возможно, потому, что у них нет особых преимуществ по сравнению с нефуллереновыми аналогами, а возможно — из-за недостаточно глубокого понимания механизмов метаболизма фуллеренов и их взаимодействия с живыми клетками.
Однако из-за развития нанотехнологий практически неизбежно возникают условия для загрязнения окружающей среды этими весьма стойкими соединениями, масштаб производства которых возрастает. Пора решать вопрос об опасности или безопасности фуллеренов в том числе и об иммунологической безопасности. Прежде всего речь идет о способности фуллеренов вызывать иммунный ответ, например аллергию.
Безразличный фуллерен
В своих опытах мы использовали кристаллический фуллерен, называемый фуллеритом, наносуспензию гидратированого фуллерена Андриевского, а также соединения фуллерена со всевозможными аминокислотами, пептидами и белками. При этом аминокислоты присоединялись непосредственно к шарику фуллерена. Способ получения таких производных разработали еще в 1994 году в ИНЭОС РАН им. А. Н. Несмеянова. Там же в содружестве с Институтом проблем химической физики РАН был создан еще один функциональный фуллерен, который очень быстро пришивается к пептидам и белкам, содержащим аминокислоту цистеин. Для чего нужно было получать столь сложные соединения?
Дело в том, что еще 12 лет назад мы уже пытались вызвать у мышей специфический иммунный ответ на чистые фуллерены и их аминокислотные производные и нисколько не преуспели в этом деле. Однако в 1998 году появились сведения, что одной американской группе удалось-таки добиться иммунного ответа на фуллерен в присутствии сильного иммуностимулятора. В своих опытах мы как раз и хотели проверить этот результат, а в качестве иммуностимуляторов взяли известные аллергены вроде яичного и сывороточного альбумина. Однако результат оказался тем же: никакого специфического ответа на собственно фуллерен замечено не было. Зато мы обнаружили хорошо выраженную реакцию на аминокислоты, пришитые к фуллерену. (На чистые аминокислоты ответ вообще не развивается, организм к ним толерантен.)
Отсутствие иммунной реакции на фуллерен можно объяснить следующим образом. Теоретически в водной среде молекулы гидрофобного фуллерена не могут существовать в одиночном состоянии, а собираются в кластеры из десятков, а то и сотен молекул. Попав в живой организм, эти кластеры должны взаимодействовать с гидрофобными компонентами среды и электронодонорными молекулами — белками, жирами или аминами. В результате углеродная сфера может быть полностью закрыта этими молекулами, и тогда она не способна связываться с рецептором В-лимфоцита, который дает сигнал на развитие иммунного ответа. Впрочем, само по себе наличие у В-клеток специфического рецептора на фуллерен вызывает серьезные сомнения. Фуллерены как искусственные молекулы получены совсем недавно, в 1991 году, и в процессе эволюции организмы с ним не могли контактировать, следовательно, вряд ли существуют клеточные клоны, распознающие такие молекулы. Как показали работы по созданию углеродных эндопротезов еще в 1979 году, антитела к другим формам углерода — графиту и алмазу получить невозможно. Хотя известен такой фермент, как протеаза ВИЧ, чей активный центр имеет гидрофобную полость: фуллерен (с гидрофильной подвеской) хорошо ее заполняет и тем самым блокирует активность вируса. Но рецепторы на В-лимфоците для улавливания чужеземцев располагаются снаружи, то есть обращены в водную среду, имеют гидрофильную природу и вряд ли будут захватывать фуллерен.
Как нож в масло
Если фуллерен не вызывает иммунного ответа, то может ли он как-то повредить клетку? Ответ на этот вопрос дает серия опытов, проведенная нами с эритроцитами, тромбоцитами человека и симбиосомами — продуктами симбиоза бобовых растений с азотфиксирующими бактериями рода Rhizobium. О том, что фуллерен проник внутрь симбиосомы можно судить по заряду ее мембраны. В присутствии АТФ и ионов магния она способны генерировать на внутренней стороне своей мембраны положительный заряд. Фуллерены с пришитыми аминокислотами пролином или аминокапоновой кислотой — отрицательно заряжены. Попав внутрь симбиосомы, они нейтрализуют заряд на мембране, что можно зафиксировать спектральными методами, используя специальные зонды. Как оказалось, процесс этот весьма быстрый: при добавлении раствора с производными фуллерена, мембрана клетки моментально теряла накопленный ею потенциал.
Фуллерен с другой кислотой, аргинином, наоборот, приобретает положительный заряд, и поэтому его влияние на симбиосому заметить не удалось. Зато оно проявилось на эритроцитах, мембрану которых заряжали отрицательно с помощью валиномицина (из клетки при этом выходит K + ): при добавлении C60-Arg происходила быстрая разрядка потенциала.
Изменение потенциала мембраны оказалось не единственным эффектом. Есть такой флуоресцентный краситель — акридин оранжевый. Он меняет свое свечение при изменении кислотности среды. С его помощью удалось дополнительно подтвердить, что аминокислотные производные фуллеренов в самом деле легко проникают внутрь клеток и меняют кислотность среды.
Мы подтвердили также, что фуллерены легко проникают в разные типы клеток. Например, в тромбоцитах много кальция, поэтому изучать транспорт фуллерена можно с помощью другого красителя, хлортетрациклина, свечение которого зависит от концентрации ионов кальция: если фуллерен с ним взаимодействует, то гасит это свечение. Так оно и вышло: при добавлении к тромбоцитам, нагруженным хлортетрациклином, фуллеренов, в том числе и фуллерена Андриевского, наблюдалось тушение флуоресценции. Правда, оказалось, что фуллерен Андриевского входит в клетку в сто раз медленнее, чем с аминокислотными производными.
Итак, установлено, что фуллерен благодаря своей гидрофобности достаточно свободно проходит сквозь липидную мембрану клетки. Отсюда появляется идея, которая уже у многих на слуху: фуллерен с закрепленным пептидом может протащить его внутрь клетки. А это значит: он может служить отличным средством доставки пептидов в дендритные клетки иммунной системы.
Чтобы проверить этот предположение, мы, во-первых, присоединили к фуллерену найденные на предыдущем этапе пептиды белка Е7, вызывающие наибольший иммунный ответ. Во-вторых, синтезировали носитель для вакцины на основе сополимера винилпирролидона и малеинового ангидрида, к которому были присоединены цепочки жирных кислот. К этим гидрофобным хвостам за счет ван-дер-ваальсовых связей и цеплялись молекулы фуллеренов с пептидами. Результат оказался очень неплохим уже в первом эксперименте. Препарат действительно вел себя, как и положено терапевтической вакцине, генерировал специфические Т-клетки и антитела. Но пока что нам не удалось детально проследить механизм его действия. К сожалению, из-за прекращения финансирования эту работу пришлось прервать. Хотя мы и не теряем надежды на продолжение, но время упущено, а зарубежные исследователи не стоят на месте.
Что такое папилломавирусная инфекция (ВПЧ)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Борисовой Элины Вячеславовны, гинеколога со стажем в 35 лет.
Над статьей доктора Борисовой Элины Вячеславовны работали литературный редактор Юлия Липовская , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Папилломавирусная инфекция — это состояние, развивающееся при заражении какой-либо разновидностью вируса папилломы человека (ВПЧ). Возбудители данной группы могут существовать только в человеческом организме, поражая кожу и слизистые оболочки, приводя к появлению папиллом, бородавок, плоских и остроконечных кондилом. [1] [2] [4]
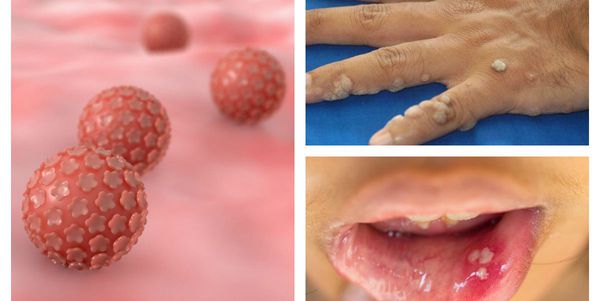
ВПЧ довольно широко распространён в человеческой популяции, особенно среди сексуально активных людей, а это свыше 80% всего населения. До недавнего времени вирусы этой группы считались относительно безобидными, вызывающими лишь косметические дефекты, но последние научные исследования показывают, что проблема гораздо серьёзнее. [9]
На сегодняшний день науке известно несколько сотен штаммов (типов) папилломавирусов . Около 40 из них преимущественно поражают аногенитальную область и передаются половым путём. Особую опасность представляют штаммы высокого онкогенного риска, так как они могут спровоцировать развитие онкологических заболеваний, в том числе рака шейки матки.
Чаще всего заражение происходит в молодом возрасте, как правило, с началом половой жизни, при этом возможно неоднократное инфицирование. Наиболее уязвимой группой в плане вероятности заражения ВПЧ и развития неблагоприятных последствий являются молодые женщины в возрасте 15-30 лет.
Помимо этого ВПЧ может перейти от инфицированной матери к ребёнку, например, при родах. Не исключается и контактно-бытовой способ передачи возбудителя, например, при соприкосновениях и даже при совместном использовании предметов личной гигиены.
К факторам риска, способствующим заражению ВПЧ, развитию хронической папилломавирусной инфекции и её переходу в предраковые состояния с потенциальным перерождением в злокачественную опухоль, относятся:
- иммунодефицит любого происхождения, в том числе вследствие ВИЧ-инфекции, лучевых поражений, применения иммунодепрессантов при трансплантации органов и тканей, лечения цитостатиками и других причин;
- подавленное состояние иммунитета во время беременности;
- раннее начало половой жизни;
- частая смена половых партнёров, незащищённый секс;
- инфицированность высокоонкогенными штаммами ВПЧ;
- заражение одновременно несколькими типами ВПЧ;
- наличие других инфекций, передающихся половым путём, например, герпесвирусной и цитомегаловирусной инфекции, вируса Эпштейна — Барр, гепатитов В и С, гонореи и трихомониаза;
- стресс, истощение, гиповитаминоз, гормональный дисбаланс;
- многократные роды и аборты;
- тяжёлые хронические заболевания, в том числе сахарный диабет;
- вредные привычки (курение, злоупотребление спиртным);
- низкий социальный статус, плохие условия жизни, неудовлетворительная интимная гигиена;
- пренебрежение регулярными профилактическими обследованиями (один из важнейших факторов риска);
- низкий уровень развития медицины в регионе проживания.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы папилломавирусной инфекции
Далеко не всегда человек догадывается о наличии в своём организме папилломавирусной инфекции, оставаясь при этом источником заражения для потенциальных партнёров. [1] [2] Дело в том, что заболевание может долгое время протекать бессимптомно: вирус скрыто существует в организме от нескольких месяцев до нескольких лет, никак себя не проявляя. Кроме того, уже имеющиеся проявления инфекции не всегда доступны для наружного обзора. Например, если папилломы, бородавки и кондиломы на открытых участках тела и поверхности гениталий ещё можно заметить самостоятельно, то патологические изменения, локализующиеся на шейке матки, сможет обнаружить только специалист в ходе осмотра с применением соответствующих инструментов.
И всё же существует несколько симптомов, которые прямо или косвенно могут указывать на наличие папилломавирусной инфекции и её неблагоприятных последствий. [3] К ним относятся:
- появление на коже и/или слизистых оболочках каких-либо разрастаний различных форм (на тонкой ножке или с широким основанием, нитевидной, округлой или плоской конфигурации, в форме цветной капусты или петушиного гребня) и размеров (от образований в несколько миллиметров до разрастаний, занимающих всю промежность);
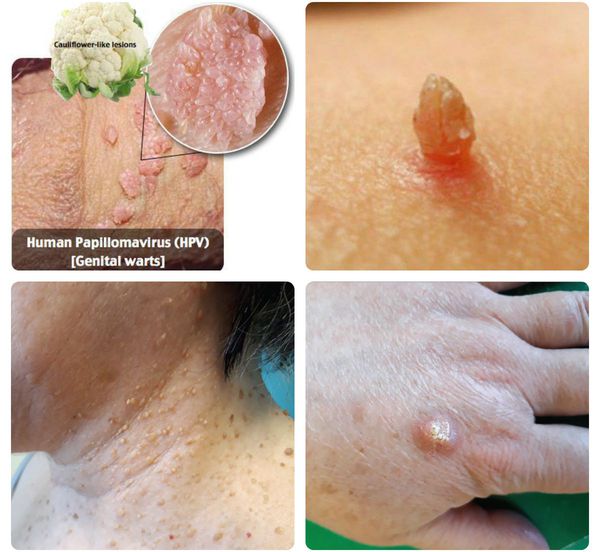
- отёчность и воспалительная инфильтрация папилломатозных разрастаний (остроконечных кондилом), их ранимость и кровоточивость, что приводит к присоединению вторичной инфекции с появлением гнойного отделяемого с неприятным запахом;
- зуд, жжение, мокнутие в области промежности, появление обильных белей, даже при отсутствии видимых патологических образований;
- межменструальные кровянистые выделения, в том числе появляющиеся в результате полового контакта:
- дискомфорт во время полового акта.
Наиболее тревожными признаками заболевания являются:
- постоянные боли в области спины и таза;
- слабость;
- беспричинная потеря веса;
- опухание одной или обеих ног.
Патогенез папилломавирусной инфекции
Заражение папилломавирусной инфекцией происходит при попадании вирусных частиц на кожу или слизистую оболочку. [1] [2] Излюбленная локализация инфекции на теле женщины — промежность, большие и малые половые губы, вульва, влагалище и шейка матки, у мужчин — половой член. Может также произойти поражение слизистой полости рта, пищевода, мочевого пузыря, трахеи, конъюнктивы и других органов и тканей.
Заражению способствуют микротравмы и потёртости. Особенно благоприятные для инфицирования условия создаются при половом акте. В 60–80% случаев достаточно однократного сексуального контакта с больным папилломавирусной инфекцией или бессимптомным носителем ВПЧ. К развитию заболевания может привести попадание в организм буквально единичных вирусных частиц.
При наличии предрасполагающих факторов (микроповреждения, слабого иммунитета и других) возбудитель проникает в эпителиальную ткань до её базального слоя. Там он прикрепляется к оболочке незрелой клетки и внедряется сначала в её цитоплазму, а затем и в ядро, где повреждает генетический аппарат. После этого начинается деление клеток с изменённым геномом, что приводит к появлению в месте внедрения вируса генитальных кондилом (образований, которые постепенно разрастаются), а, например, на шейке матки — к развитию диспластических процессов различной степени тяжести (дисплазия шейки матки).
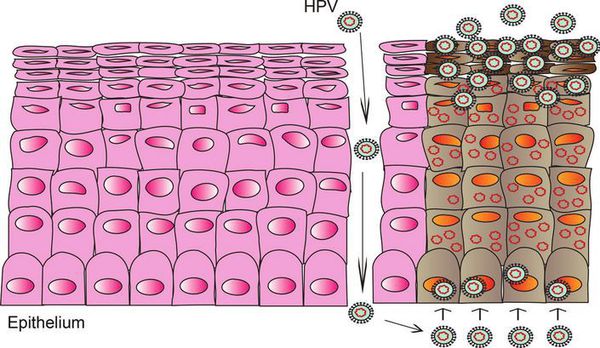
В случае ВПЧ высокого онкогенного риска определённые гены в вирусной ДНК кодируют синтез специфических белков-онкопротеинов (Е6 и Е7), которые подавляют противораковую защиту клеток. Под действием онкопротеинов нарушается стабильность генома клеток, стимулируется их размножение и снижается способность к дифференцировке — всё это со временем может привести к онкопатологии. [12]
Формирование новых полноценных вирусных частиц, способных инфицировать другого человека, происходит уже не в базальном, а в самых поверхностных слоях поражённого эпителия. Возбудитель может содержаться в слущивающихся отмирающих клетках, которые отделаются слизистой оболочкой. Таким образом они переходят к новому хозяину при тесном (сексуальном или бытовом) контакте.
Классификация и стадии развития папилломавирусной инфекции
По способности индуцировать развитие злокачественных новообразований ВПЧ подразделяют на четыре группы: [8]
- неонкогенные штаммы ВПЧ (типы 1-5);
- ВПЧ низкого онкогенного риска (типы 6, 11, 40, 42-44, 54, 61, 70, 72, 81);
- ВПЧ среднего онкогенного риска (типы 26, 31, 33, 35, 51-53, 58, 66);
- ВПЧ высокого онкогенного риска (типы 16, 18, 39, 45, 56, 59, 68, 73, 82).
Клинические формы папилломавирусной инфекции: [5]
- латентная — скрытая форма, не имеющая клинических и морфологических признаков, но обнаруживаемая иммунохимическими и молекулярно-биологическими методами;
- субклиническая — возникает у лиц с нормальным иммунитетом, определяется только специальными диагностическими методами (пробы с растворами-индикаторами, гистологические и цитологические исследования);
- манифестная — появляется у лиц с временным или стойким снижением иммунитета, в случае генитальной папилломавирусной инфекции характеризуется появлением кондилом.
Латентная инфекция может переходить в субклиническую и манифестную форму в случае возникновения предрасполагающих условий (факторов риска), но чаще всего она протекает бессимптомно, не манифестируя.
Клинические проявления папилломавирусной инфекции:
- кожные поражения: подошвенные, плоские и обычные (вульгарные) бородавки, бородавчатая эпидермодисплазия, бородавки Бютчера и небородавчатые поражения кожи;
- поражения слизистых оболочек гениталий: кондиломы, некондиломатозные поражения, карциномы;
- поражения слизистых вне гениталий: папилломатоз гортани, карциномы шеи, языка и другое.
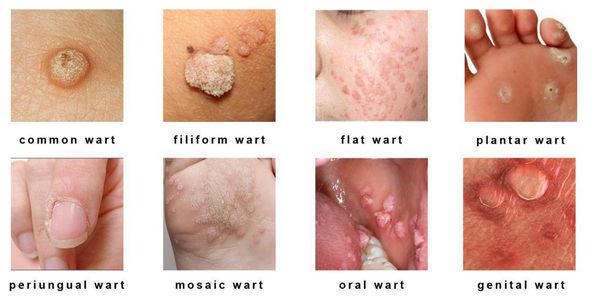
Разновидности поражений:
- экзофитные — видимые разрастания в виде папиллом и бородавок;
- эндофитные — образования, располагающиеся в толще ткани, которые не видны невооружённым глазом.
Осложнения папилломавирусной инфекции
Основными наиболее опасными осложнениями папилломавирусной инфекции являются злокачественные новообразования. Но возможны и другие серьёзные последствия:
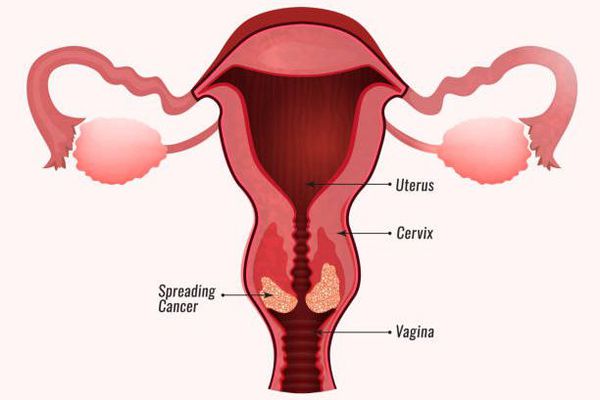
- Злокачественные новообразования заднего прохода, вульвы, полового члена и ротоглотки. Повышение риска их развития также связывают с высокоонкогенными штаммами ВПЧ. [6]
- Остроконечные кондиломы на гениталиях, папилломатоз верхних дыхательных путей (рецидивирующий респираторный папилломатоз, веррукозный ларингит). Причиной возникновения могут стать 6-й и 11-й типы вируса, несмотря на свой низкий онкогенный риск. В случае папилломатоза есть вероятность полной потери голоса, обструкции (перекрытия) гортани с развитием асфиксии. Это довольно редкое заболевание может возникать у детей, рождённых женщинами с папилломавирусной инфекцией. По разным данным, заражение может происходить как во время родов, так и внутриутробно. Как правило, респираторный папилломатоз начинает проявляться в детском и подростковом возрасте, он склонен к неоднократным рецидивам после удаления множественных папиллом, перекрывающих дыхательные пути.
- Гнойно-септические осложнения. Папилломатозные разрастания на слизистых оболочках очень ранимы, легко травмируются, и через участки мокнутия, расчёсов и потёртостей может проникать вторичная инфекция, которая в свою очередь и вызывает нагноение.
Диагностика папилломавирусной инфекции
Основные цели диагностических мероприятий: [3]
- ранняя диагностика папилломавирусной инфекции для динамического наблюдения и лечения;
- своевременное обнаружение и лечение предраковых изменений, что позволяет на 80% предотвратить развитие злокачественных новообразований;
- выявление онкологических новообразований на ранних стадиях, что в большинстве случаев даёт хороший прогноз эффективного излечения;
- решение вопроса о целесообразности вакцинации.
Для выявления папилломавирусной инфекции на сегодняшний день существует целый комплекс диагностических процедур:
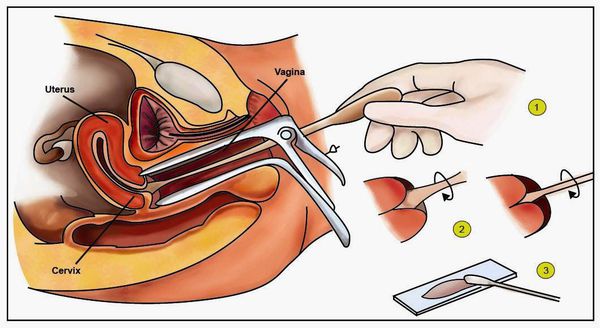
- Гинекологический осмотр в зеркалах — позволяет увидеть папилломатозные разрастания (аногенитальные кондиломы) и другие изменения.
- Классический тест Папаниколау (мазки с поверхности шейки матки и стенок влагалища для цитологического исследования) — обнаруживает ранние признаки дисплазии и злокачественного перерождения.
- Пробы с уксусной кислотой и раствором Люголя — выявляют участки поражения слизистой шейки матки.
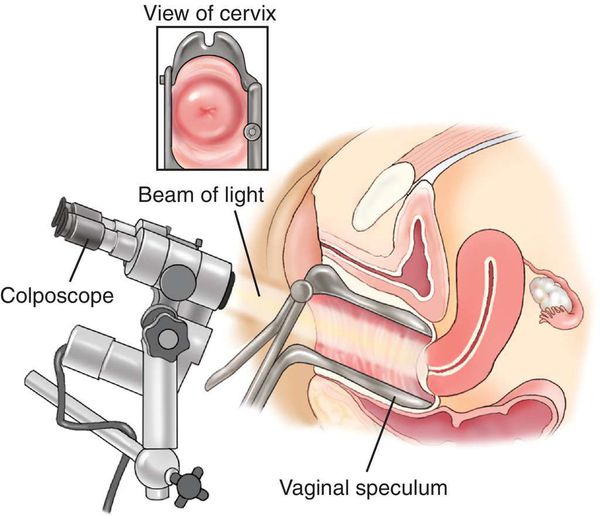
- Кольпоскопия, в том числе с биопсией подозрительных участков и их гистологическим исследованием, — определяет характер имеющегося новообразования.
- Иммунофлюоресцентный анализ (ИФА) обнаруживает в цервикальном соскобе онкопротеины (Е7 и Е6). Этот метод достаточно новый, с его помощью можно различить носительство ВПЧ и первые признаки злокачественного перерождения в клетках, [12] оценить агрессивность данного процесса, сделать предположения относительно прогноза заболевания.
- Полимеразная цепная реакция (ПЦР) находит вирусную ДНК в биологическом материале (соскоб со слизистой), определяет тип ВПЧ, степень его онкогенности, а также количество вирусных частиц, что косвенно позволяет судить о характере течения папилломавирусной инфекции у данного пациента, возможности спонтанного излечения или высокого риска прогрессирования. Обнаружение ВПЧ с помощью этого возможно даже при латентном течении болезни, когда цитологические и гистологические методы не эффективны.
Целесообразно дополнительное обследование пациента на наличие других инфекций, передающихся половым путём, так как папилломавирус в 90% случаев с ними сочетается, и это может осложнять течение заболевания.
Лечение папилломавирусной инфекции
Лечение папилломавирусной инфекции должно быть комплексным и включать следующие составляющие: [3] [5]
- деструкцию (удаление) видимых проявлений (аногенитальных кондилом и др.);
- иммуномодулирующую терапию;
- противовирусную терапию;
- лечение сопутствующих инфекций, передающихся половым путём.
Деструктивные методы делятся на две основные группы:
- химические — с применением трихлоруксусной кислоты, а также таких препаратов, как "Солкодерм", "Колломак", "Ферезол" и др.;
- физические — хирургическое удаление, электрокоагуляция, криодеструкция, радиоволновая и плазменная коагуляция, лазеротерапия.
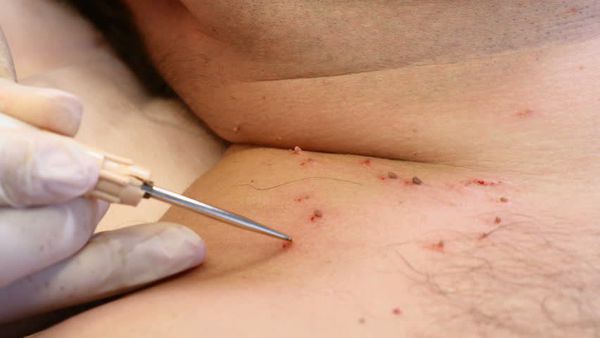
Лечение сопутствующих половых инфекций проводят до начала деструктивной терапии на фоне адекватной иммунокоррекции.
Удаление видимых проявлений папилломавирусной инфекции должно сочетаться с противовирусной терапией — как с общей, так и с применением препаратов местного действия после удаления кондилом.
Следует помнить, что успешно проведённое лечение не исключает развитие рецидивов в дальнейшем, особенно у пациентов с нарушениями иммунитета. Поэтому за ними устанавливается динамическое наблюдение в течение как минимум 1-2 лет.
Прогноз. Профилактика
В 90% случаев здоровая иммунная система человека справляется с папилломавирусной инфекцией самостоятельно за период от полугода до двух лет с момента инфицирования, после чего происходит полное выздоровление с исчезновением вируса из организма. При этом не формируется напряжённого пожизненного иммунитета, то есть человек может заразиться повторно.
В других случаях, при наличии предрасполагающих факторов, заболевание приобретает хроническую форму, склонную к длительному скрытому течению с периодическими рецидивами и возможным развитием тяжёлых осложнений.
От момента попадания вируса в организм до развития предраковых состояний и тем более возникновения рака может пройти достаточно много времени, иногда десятки лет. Поэтому регулярные профилактические обследования, своевременное выявление и лечение предраковых состояний — вполне реальный и эффективный способ избежать самого неблагоприятного варианта развития событий. [13] С этой целью Всемирная организация здравоохранения рекомендует всем женщинам старше 30 лет при первичном скрининге проходить не только “рутинное” цитологическое исследование, но и делать тест на наличие ВПЧ. [10]
Регулярное посещение гинеколога (при отсутствии каких-либо жалоб — раз в год) с проведением теста Папаниколау позволяет своевременно обнаружить начальные признаки дисплазии и предпринять все необходимые меры для предотвращения прогрессирования процесса и его перехода в онкологическое заболевание.
Использование методов барьерной контрацепции хоть и не полностью защищает от инфицирования, но несколько снижает его вероятность.
Главным методом первичной профилактики папилломавирусной инфекции считается вакцинация. [11] Современные вакцины разработаны с целью защиты от наиболее опасных, высокоонкогенных штаммов ВПЧ, ответственных за 70-80% случаев развития рака шейки матки. Стандартный курс, состоящий из трёх прививок, даёт вполне надёжную защиту.
В последние годы увеличивается заболеваемость папилломавирусной инфекцией. По данным ВОЗ, ежегодно в мире около 250 000 женщин с ВПЧ-инфекцией умирает от рака шейки матки. На этом фоне поиск эффективных методов лечения этой инфекции становится чрезвычайно важным. Проблема ее диагностики и лечения привлекает внимание врачей различных специальностей: дерматологов, гинекологов, урологов, онкологов, иммунологов, вирусологов, патоморфологов. На данный момент большинство ученых пришли к единому мнению – с проявлениями вируса папилломы человека можно бороться при помощи применения иммуномодуляторов с противовирусной активностью.
Что такое иммуномодуляторы
К иммуномодулирующим средствам относятся препараты химической и биологической природы, способные модулировать (угнетать или стимулировать) реакции иммунитета. При этом иммунологический эффект иммуномодуляторов зависит от исходного состояния иммунитета человека: эти лекарственные средства понижают повышенные и повышают пониженные показатели иммунитета. Особенно данный постулат относится к препаратам интерферона. К иммунотерапии также относятся методы лечения, основанные на использовании иммунотропных средств при заболеваниях, в патогенезе которых имеются нарушения, затрагивающие систему иммунитета.
Основной критерий для назначения иммуномодуляторов – это клиническая картина заболевания (острого или хронического инфекционно-воспалительного процесса), который сопровождается снижением параметров иммунитета и трудно поддается лечению. В этом случае иммуномодуляторы играют роль главного помощника, который способствует эффективной терапии и избавляет от проявлений многих заболеваний.

Поскольку ВПЧ-инфекция тоже относится к недугам, с которыми достаточно непросто бороться, а исход лечения зависит от состояния иммунитета, при лечении этой инфекции широко применяют различные иммуномодуляторы.
Иммуномодуляторы при ВПЧ: список препаратов
Препараты, которые являются синтетическими комплексными производными пурина
Эта группа иммуномодуляторов, применяющихся при лечении проявлений вируса папилломы человека, обладают иммуностимулирующей активностью и неспецифическим противовирусным действием. Они восстанавливают активность лимфоцитов, которые являются главными клетками иммунной системы. Клинически доказано, что именно низкая активность лимфоцитов является предрасполагающим фактором к яркому развитию клинических проявлений ВПЧ. Также этот вид препаратов повышает функционирование натуральных киллеров и так называемыхТ-хелперов – T-лимфоцитов, главной функцией которых является координация иммунного ответа.
Некоторые из препаратов этой группы имеют обширный список побочных действий, включающих проблемы с работой ЖКТ, печени и желчевыводящих путей. Также возможны побочные реакции в виде головной боли, сонливости, бессонницы, зуда и болей в суставах. Среди противопоказаний – детский возраст до 3 лет, беременность, заболевания почек и повышенная чувствительность к компонентам препарата.
Препараты с действующим веществом глюкозаминилмурамилдипептид (ГМДП)
ГМДП – это фрагмент оболочки патогенных бактерий, вызывающих инфекционно-воспалительные заболевания различных органов и систем. При попадании этого фрагмента в организм иммунная система воспринимает его как чужеродный патогенный агент и сразу же начинает выработку антител. Благодаря этому происходит общая активация всей иммунной системы, что способствует выздоровлению или же снижению частоты рецидивов вирусных инфекций, в том числе ВПЧ.
Среди побочных эффектов – повышение температуры тела до субфебрильных и фебрильных значений, также возможна диарея. Препараты этой группы противопоказаны при нарушениях обмена веществ и женщинам в период беременности и грудного вскармливания.
Препараты, содержащие в качестве активных компонентов натуральное растительное сырье
Эта группа препаратов была создана на основе открытия лауреата Нобелевской премии Н.Н. Семенова о мощных иммуностимулирующих свойствах биологически активных веществ, содержащихся в клетках растений. Экстракты из растений и вспомогательные компоненты усиливают неспецифическое звено иммунитета, что повышает устойчивость организма человека к различным вирусным и некоторым бактериальным инфекциям. Иммуномодулирующий эффект активизирует лейкоциты, что особенно важно при борьбе с хроническими и затяжными воспалительными процессами.
При применении этих препаратов возможны аллергические реакции. Среди противопоказаний к применению – заболевания выделительной системы, беременность, период лактации и детский возраст до 18 лет.
Противовирусные препараты против ВПЧ
После заражения клетки вирус может пребывать в свободном виде или проникает в геном клетки. В любом случае вирус изменяет нормальные клеточные процессы. И вместо того, чтобы производить все необходимое для своей жизнедеятельности, клетка обеспечивает механизмы синтеза вирусных молекул ДНК, которые в дальнейшем будут использоваться для создания новых вирусных частиц. Но не всегда вирусы способны вызывать заболевание. При адекватном иммунном ответе организм самостоятельно избавляется от вируса. При неэффективном иммунном ответе организма возможно долгое носительство вируса, что может привести к доброкачественным или злокачественным, в зависимости от типа вируса, проявлениям болезни.
Чтобы разорвать цепь бесконечного размножения вируса и последующего развития заболевания, признана необходимость лечения ВПЧ-инфекции иммуномодуляторами с противовирусной активностью, т.к. на сегодняшний день не разработано ни одного противовирусного от ВПЧ, действующего прицельно на вирус папилломы человека.
ВИФЕРОН при ВПЧ
Существуют ли препараты, которые борются с вирусами и одновременно способствуют восстановлению иммунной системы? Безусловно, такие препараты есть. Одним из таких препаратов, способствующих восстановлению иммунной системы и обладающих широким спектром противовирусной активности, является препарат ВИФЕРОН.
Рекомбинантный интерферон альфа-2b, который входит в состав этого препарата, препятствует синтезу вирусных ДНК и блокирует размножение вируса, способствует восстановлению иммунной системы, а также обладает антипролиферативными свойствами. Он идентичен человеческому интерферону альфа-2b, но производится с помощью современных технологий без использования донорской крови.
Препарат, который выпускается в виде свечей, геля и мази, разработан в результате фундаментальных исследований в области иммунологии, доказавших, что в присутствии антиоксидантов (витамины С, Е) усиливается противовирусное действие интерферона.
Способ применения и дозировки свечей ВИФЕРОН при ВПЧ
ВИФЕРОН Свечи производятся в виде ректальных суппозиториев пулевидной формы бело-желтого или желтого цвета. В процессе лечения препарат подавляет активность вирусов и повышает эффективность собственного иммунного ответа организма на патогенные микроорганизмы.
Препарат в виде Свечей (суппозиториев) можно применять при беременности (с 14-й недели), а также в период грудного вскармливания и при лечении детей.

Рекомендуемая доза для взрослых – ВИФЕРОН 500 000 ME по 1 суппозиторию 2 раза/сут через 12 ч ежедневно в течение 5-10 суток. По клиническим показаниям терапия может быть продолжена.
Можно ли применять ВИФЕРОН Свечи при ВПЧ вагинально?
Противовирусные суппозитории ВИФЕРОН выпускаются только для ректального использования. Вагинальное использование не предусмотрено в инструкции к лекарству. Применение в комплексной терапии препарата направлено на повышение уровня иммунной защиты организма в целом. Поэтому введение свечей непосредственно в очаг инфекции не требуется.
В прямой кишке присутствует множество кровеносных сосудов, всасывающих лекарство, непосредственно введенное в полость прямой кишки. Кровь от прямой кишки, минуя печень, непосредственно попадает в большой круг кровообращения. Таким образом обеспечивается системное действие препарата. Более того, печень не претерпевает дополнительной нагрузки, что является неоспоримым преимуществом препаратов с ректальным способом введения.
Лечение слизистой при ВПЧ у мужчин
При лечении проявлений вируса папилломы на слизистой у мужчин также применяются суппозитории ректальные ВИФЕРОН, которые помогут избавиться от неприятных проявлений вируса и будут способствовать укреплению иммунной системы.
Без консультации уролога не рекомендуется применять никакие лечебные кремы и мази, заниматься самолечением или вообще отказываться от терапии, назначенной врачом. При отсутствии лечения кондиломы могут разрастаться, охватывая все новые территории и поражая мочеиспускательный канал и другие внутренние органы. Предупредить развитие осложнений можно при помощи своевременного обращения к специалисту и применения противовирусных препаратов.
Альтернативные методы лечения ВПЧ на коже
Медикаментозная терапия проявлений вируса папилломы человека прекрасно сочетается с удалением новообразований в виде бородавок, папиллом на теле и кондилом, которые располагаются у мужчин и женщин в аногенитальной области (включая кожу гениталий, анус и слизистую оболочку влагалища, шейки матки, головки полового члена, прямой кишки).
Сегодня существует несколько продуктивных методов избавления от указанных новообразований, которые в большинстве своем безболезненны, безопасны и не оставляют шрамов.
Методы удаления папиллом и кондилом
Хирургическое иссечение
В настоящее время подобное вмешательство применяется нечасто, в основном используется при лечении злокачественных новообразований, когда необходимо широкое иссечение.
Медикаментозное удаление (прижигание) при ВПЧ
Это удаление наростов на коже при помощи лекарственных препаратов – растворов кислот, щелочей, солей. Новообразования на коже удаляются с помощью этих препаратов путем прижигания. Как правило, на месте удаления образуется корочка, которая отпадает в течение 5-7 дней. Полное заживление тканей происходит в течение 10-14 дней. При множественных новообразованиях могут потребоваться дополнительные процедуры.
Лазерное удаление папилломы
При этом способе удаления папилломы и кондиломы сжигаются при помощи луча лазера. При удалении не повреждаются соседние участки. После процедуры обычно остается микроскопичная ранка, которая заживает в течение 2-3 недель. Удалить лазером можно как единичные, так и множественных образования, расположенные на лице и теле, в том числе в деликатных местах (на веках, подмышками, в промежности).
Радиоволновое удаление при ВПЧ
При этом способе используют прибор Surgitron. Основная рабочая часть аппарата – электрод, который представляет собой тонкую вольфрамовую нить. На конце электрода концентрируются радиоволны высокой частоты. Воздействуя на органическую ткань, пучок волн приводит в движение молекулы воды в клетке, вследствие чего происходит разрыв клетки и она испаряется, в результате происходит «холодный» разрез тканей на нужном участке кожи или слизистой. При этом окружающие ткани, сосуды остаются неповрежденными, что в некоторых случаях позволяет избежать обильного кровотечения. После разреза радионожом на операционной ране образуется фибриновая пленка, а затем корочка, которая постепенно сходит и остается незаметный рубец.
Криодеструкция папиллом
Криодеструкция папиллом заключается в точечном воздействии на образование очень низкой температурой (около -196° С). Для этого обычно применяется жидкий азот и специальная металлическая точечная насадка, выполняющая роль проводника. Во время такой процедуры клетки папилломы погибают. Здоровые ткани в области ее формирования покрываются небольшой коркой, которая через небольшой промежуток времени отваливается.
Электрокоагуляция папиллом при ВПЧ
Этот метод предусматривает удаление патологических тканей путем воздействия на них электрическим током. Процедуру проводят при помощи специальных аппаратов, оснащенных электродом или петлей, которые нагреваются под воздействием электрического тока до высоких температур. На месте удаленной бородавки также образуется корочка, которая со временем отпадает.
Все методы удаления папиллом и кондилом имеют свои плюсы и минусы, оценить которые можно только со своим лечащим врачом с учетом индивидуальных особенностей пациента. Применение любых рецептов народной медицины, найденных на просторах интернета, также допускается только после консультации со специалистом.
Таблеток и процедур, которые раз и навсегда избавят от вируса папилломы человека, пока не существует. Однако уже сегодня существуют препараты и методы лечения, которые помогут сократить рецидивы проявлений инфекции или вообще забыть о них.
Изучены клиническая эффективность и безопасность комбинированной терапии плоских бородавок у детей, включающей в себя иммуномодулирующий препарат с противовирусным действием и криодеструкцию жидким азотом.
The authors studied clinical efficacy and safety of combined therapy of flat warts in children, including the immunomodulatory drug with antiviral effect and cryotherapy with liquid nitrogen.
В своей клинической практике врачам разных специальностей нередко приходится встречаться с вирусом папилломы человека (ВПЧ) — ассоциированными заболеваниями кожи и слизистых. Резкий рост инфицированности населения, разнообразие клинических картин, особенностей течения данных состояний вызывают интерес и активную дискуссию о тактике ведения таких пациентов среди большого числа клиницистов. Актуальность проблемы ВПЧ-инфекции, наряду с негативной тенденцией распространения, связана с существенно выраженным отрицательным влиянием вируса на иммунную систему, что приводит к его длительной персистенции, торпидности к терапии и частому рецидивированию заболевания.
Папилломавирусы были выделены в отдельное семейство Papovaviridae, состоящее, согласно современным представлениям, из 16 родов, представители пяти из которых патогенны для человека [1, 2]. Вирионы не имеют оболочки, диаметр их равен 50–55 мм. Капсид имеет форму икосаэдра и состоит из 72 капсомеров. Геном представлен двуспиральной кольцевидно скрученной ДНК, включает около 8000 оснований пар [3]. В процессе репликационного цикла геном вируса экспрессирует от 8 до 10 белковых продуктов. Ранние белки, контролирующие репликацию вируса, транскрипцию и клеточную трансформацию, представлены онкопротеинами Е6 и Е7. Белки Е1 и Е2 регулируют репликацию вирусной ДНК и экспрессию генов. Поздние белки L1 и L2 — это структурные белки вириона. Белок L1 формирует капсомеры [4]. Инвазия вируса происходит через микроповреждения кожи и слизистых с инфицированием преимущественно незрелых, делящихся клеток базального слоя, далее происходит репликация вируса и сборка вирусных частиц в дифференцированных клетках поверхностного слоя эпидермиса/эпителия. Весь цикл развития инфекционного процесса тесно сопряжен с делением клеток покровного эпителия кожи и слизистых оболочек и не сопровождается признаками воспаления. При этом ВПЧ могут оказывать на эпителий продуктивное или трансформирующее воздействие. При продуктивном воздействии возникают доброкачественные новообразования — папилломы, бородавки и кондиломы кожи и слизистых оболочек. Результатом трансформирующего воздействия являются дисплазии различной степени тяжести, прогрессирующее развитие которых приводит к раку [5].
В настоящее время идентифицировано более 100 видов ВПЧ, способных поражать кожу и слизистые оболочки и провоцировать развитие изменений, характеризующихся папилломатозными разрастаниями. Вирус папилломы человека обладает тканевой специфичностью — способностью определенных типов ВПЧ поражать свойственную для их локализации ткань. При этом тип вируса определяет клинические особенности инфекционного процесса.
Одной из наиболее частых патологий, возникающих в результате инфицирования кожи и слизистых оболочек папилломавирусами, являются бородавки, представляющие собой эпителиальные доброкачественные опухоли.
Групповое распространение бородавок, в результате прямого и непрямого контакта с больными, характеризует высокий уровень заболеваемости, составляя у взрослых 7–12%, а у детей школьного возраста — до 10–20% [1]. Инкубационный период варьирует от 1 до 6 месяцев, однако может быть свыше трех лет. В течение двух лет до 40–65% бородавок самостоятельно регрессируют. В остальных случаях они продолжают увеличиваться в размере и со временем могут стать более резистентными к лечебному воздействию [1, 6].
Наиболее часто в клинической практике встречаются вульгарные и плоские бородавки. Вульгарные бородавки, которые преимущественно вызывают ВПЧ 2-го и 4-го типов, клинически представляют собой множественные безболезненные плотные округлые серые папулы диаметром 0,2–0,5 см с неровной, ороговевшей поверхностью телесного или желто-бурового цвета, чаще всего расположенные на тыльной поверхности кистей рук. Однако высыпания могут располагаться и на других участках кожного покрова [7].
Плоские бородавки, локализующиеся чаще всего на тыле кистей, предплечий, лице и слизистых оболочках, клинически представлены мелкими множественными папулами цвета нормальной кожи. Встречаются в любой возрастной категории, но особенно часто у детей и подростков.
В настоящее время существует достаточно много методов для лечения бородавок, их подразделяют на деструктивные, химические, иммунотропные. В зависимости от конкретной клинической ситуации предпочтение отдается определенному методу терапии.
Наиболее распространенными методами удаления бородавок являются применение препаратов салициловой кислоты и криотерапии жидким азотом. В руководстве J. Sterling и соавт. салициловая кислота названа препаратом выбора при лечении плоских бородавок на лице, а также плоских и обычных бородавок на руках. Безрецептурные лекарственные средства содержат менее 20% салициловой кислоты, в то время как препараты, отпускаемые по рецепту врача, могут содержать до 70% данного вещества. При этом 15–20% салициловой кислоты обычно достаточно для излечения бородавки. Использование препаратов салициловой кислоты относится к терапии первой линии при лечении обыкновенных не генитальных бородавок [1]. Отмечается достаточно высокая эффективность такого воздействия, излечение наблюдается у 70–80% пациентов [1, 8].
Учитывая способность ретиноидов влиять на процессы кератинизации, ускоряя удаление бородавки, некоторыми авторами рекомендуется их использование перорально и местно в качестве второй линии при лечении плоских бородавок [6, 9].
Из деструктивных методов в практике наиболее широко применяется криотерапия с применением аппликаций жидкого азота. В основе метода лежит быстрое замораживание внутри- и внеклеточной жидкости, сопровождающееся в последующем гибелью и лизисом клеток при размораживании. Большинство исследователей оценивают ее эффективность на уровне 70–75% и рекомендуют использовать при лечении плоских и простых бородавок в качестве терапии первой линии. Метод не требует анестезии и специального оборудования, больших материальных затрат, достаточно прост в исполнении, что значительно облегчает его использование.
Лазеротерапия, приводящая к некротизации участка ткани с бородавкой в результате коагуляции кровеносных сосудов, по данным ряда авторов, приводит к положительному результату до 50–80% случаев, однако уровень рецидивирования при этом достаточно высок и составляет 4–22% [10]. Вместе с тем следует помнить, что длительно незаживающие раны чреваты присоединением вторичной инфекции и образованием рубцов на месте удаления. Поэтому использовать лазер при подошвенных бородавках рекомендуется в качестве терапии второй, а при обыкновенных и плоских бородавках — третьей линии [9].
Способность к персистенции ВПЧ в организме человека и формирование вторичного иммунодефицита делает целесообразным включение в комплекс лечения больных препаратов, нарушающих репликацию вируса и улучшающих регенерацию. Поэтому в мировой практике для лечения бородавок широко используют местные средства с противовирусным и иммуномодулирующим эффектом, эффективность которых значительно повышается при последовательном или параллельном использовании их в сочетании с методами деструкции.
Вместе с тем при, казалось бы, широком разнообразии методов терапии бородавок, ни один из них не дает стопроцентной гарантии полного излечения больного. До сих пор, несмотря на фундаментальные открытия и достижения современной медицины, при папилломавирусной инфекции в отличие от других вирусных поражений кожи и слизистых не существует специфических методов лечения с практически полным отсутствуем системной терапии. С каждым годом статистика ВПЧ-обусловленных болезней неуклонно ухудшается, частота рецидивирования патологического процесса остается высокой, что диктует необходимость поиска лекарственных средств и новых методик, повышающих эффективность терапии. Особую актуальность данная проблема приобретает, если дело касается маленьких пациентов, где необходимо максимально исключить риск нежелательных лекарственных реакций и осложнений. Согласно многим исследованиям, наиболее эффективным методом лечения ВПЧ-индуцированных новообразований кожи является комбинированный, сочетающий одновременное либо поэтапное применение местного деструктивного воздействия и системного использования противовирусных и иммунопротективных средств. Так как только деструкция, по данным ряда авторов, дает высокий процент рецидивов уже в течение полугода, причем бородавки в большинстве случаев возникают на тех же участках кожи, что и ранее. Это, вероятно, объясняется как стадиями жизненного цикла ВПЧ, ДНК которого могут выявляться на расстоянии до 1 см от видимых границ опухоли, так и нарушением общего и местного иммунитета [4].
Целью настоящего исследования было оценить эффективность и безопасность комбинированной терапии плоских бородавок у детей, включающей в себя препарат интерферона — Генферон лайт и криодеструкцию жидким азотом.
Материал и методы исследования
Под нашим наблюдением находились 73 ребенка в возрасте от 2 до 9 лет с установленным диагнозом «папилломавирусная инфекция кожи, с клиническими проявлениями в виде ВПЧ-индуцированных плоских бородавок». Длительность заболевания варьировала от двух месяцев до 2,5 лет. Почти 90% детей (65 пациентов) ранее проходили лечение по поводу данного заболевания местными противовирусными препаратами в течение 2–3 месяцев, без эффекта. Бородавки локализовывались преимущественно на лице, тыльной поверхности кистей. Количество элементов на коже составляло от 2 до 9. Все пациенты были условно разделены на две группы, по 35 и 38 детей в первой и второй соответственно.
В первой группе у пациентов применялся деструктивный метод жидким азотом в виде криомассажа. Аппликатор с ватным тампоном располагался параллельно поверхности кожи и перемещался быстрыми вращательными движениями при небольшом давлении по обрабатываемому участку до легкого побледнения кожи. Процедура повторялась 3–5 раз в зависимости от реакции кожи пациента с короткими интервалами (в 1–2 минуты). Более выраженные, выпуклые бородавки замораживались дополнительно, при этом аппликатор располагался перпендикулярно к образованию, без давления в течение 10–15 секунд, не затрагивая окружающей кожи. Количество процедур варьировало от 4 до 5–6. Повторный сеанс проводился по исчезновении реакции (гиперемии), вызванной процедурой. Интервал между процедурами составлял 3–4 дня.
Во второй группе помимо криомассажа (криодеструкции) одновременно назначался иммуномодулирующий препарат с противовирусным действием Генферон лайт по следующей схеме: по 1 суппозитории ректально 2 раза в день с 12-часовым перерывом в течение 10 дней до деструкции и в течение 10 дней после деструкции, в соответствующих возрасту дозах (разовая доза для детей до 7 лет составляла 125 000 МЕ, для детей старше 7 лет — 250 000 МЕ). Генферон лайт, специально созданный для особой категории пациентов (беременных и детей), содержит в своем составе сниженную дозу действующих веществ (интерферона α-2b (ИФНα-2b) в дозе 250 000 МЕ и таурина в дозе 0,005 г). ИФНα-2 обладает выраженной противовирусной, иммуномодулирующей и противовоспалительной активностью. Аминокислота таурин обладает антиоксидантными и мембраностабилизирующими свойствами, что значительно повышает биологическую активность ИФНα. Всем пациентам в качестве ухода за кожей в период лечения рекомендовалось протирание ее 2% раствором салицилового спирта. Для профилактики возникновения гиперпигментации на месте удаленных бородавок рекомендовалось в течение 5–6 месяцев избегать активной инсоляции и использовать солнцезащитный крем. Эффективность проводимого лечения оценивалась по отсутствию клинических проявлений заболевания в течение года.
Результаты
По окончании терапии полное отсутствие высыпаний на коже (в результате отшелушивания рогового слоя кожи вместе с бородавками) в первой группе наблюдалось у 23 детей, что составило 65,7%. У 2 (5,7%) пациентов этой группы плоские бородавки сохранились частично, у 6 (17,1%) детей отмечался рецидив в течение 1–2 месяцев, у 4 (11,5%) — рецидив в течение полугода, что потребовало в дальнейшем дополнительного назначения терапии в варианте сочетания криодеструкции с иммуномодулирующим препаратом Генферон лайт.
У пациентов второй группы, получивших кроме криомассажа препарат Генферон лайт, эффективность терапии составила 92,1% (35 детей), рецидив был зафиксирован у 3 (7,9%) детей к концу года клинического наблюдения, при этом нельзя было исключить реинфекцию.
Переносимость Генферон лайт у всех детей была хорошей. Побочных эффектов от проводимой терапии зафиксировано не было.
Таким образом, включение в состав комплексного лечения плоских бородавок у детей иммуномодулирующего препарата с противовирусным действием Генферон лайт позволяет значительно повысить эффективность терапии, избежать осложнений и нежелательных лекарственных реакций, что крайне важно у данной категории пациентов.
Литература
- Хлебников А. Н., Селезнева Е. В., Дорохина О. В. // Вестник дерматологии и венерологии. 2015. № 1. С. 122–128.
- Manykin A. A. Papillomavirusa // Medical virology under editions Lvova D. K. 2008. P. 269–276.
- Кунгуров Н. В., Кузнецова Ю. Н., Горбунов А. П., Толстая А. И. Комбинированный метод лечения ладонно-подошвенных бородавок // Фармакотерапия в дерматовенерологии. 2011. № 2. C. 62–69.
- Молочков А. В., Хлебникова А. Н., Лавров Д. В., Гуреева М. А. Генитальная папилломавирусная инфекция. Учебное пособие. 2010. 10 с.
- Роговская С. И. Папилломавирусная инфекция у женщин и патология шейки матки. М.: ГЭОТАР-Медиа, 2005. С. 15–17.
- Беляев В. В., Мясников Л. Л. Подошвенные, плоские, вульгарные бородавки: современные подходы к лечению // Клиническая дерматология и венерология. 2012. № 6. С. 55–58.
- Штиршнайдер Ю. Ю., Волнухин В. А. // Вест. дерматологии и венерологии. 2013. С. 65–70.
- Cockayne S., Hewitt C., Hicks K. et al. EVerT Team. Cryotherapy versus salicylic acid for the treatment of plantar warts (verrucae): a randomized controlled trial // Br. Med. J. 2011: 342: d3271.
- Bacelieri R., Johnson S. Cutaneous Warts: An Evidence-Based Approach to Therapy // Am Fam Physician. 2005, Aug 15; 72 (4): 647–652.
- Мавров Г. И., Щербакова Ю. В., Чинов Г. П., Нагорный А. Е. Методы диагностики и лечения поражений кожи, вызванных вирусом папилломы человека // Дерматология и венерология. 2010. № 2. С. 49–60.
Е. И. Юнусова 1 , кандидат медицинских наук
Л. А. Юсупова, доктор медицинских наук, профессор
Г. И. Мавлютова, кандидат медицинских наук
З. Ш. Гараева, кандидат медицинских наук
Читайте также:

