Как посчитать объем гематомы на кт формула
Обновлено: 24.04.2024
Хирургическое лечение внутричерепных гематом, ушибов. Показания
Определение объема сгустка при черепно-мозговой травме. В эпоху визуализации, большинство решений относительно времени устранения сгустка и эффекта массы основывается на данных КТ. Некоторые критерии для удаления сгустка основаны на его объеме, а не на таких показателях как длина и ширина. Многие программы обработки КТ изображений могут рассчитывать объем сгустка, но это может быть недоступно в повседневной практике многих учреждений по различным причинам.
В отсутствии формального вычисления, объем сгустка можно определить по следующей формуле. При КТ с толщиной срезов 10 мм определяется срез с максимальной площадью сгустка, обозначаемый как срез 1. Наибольший диаметр определяется как параметр А. Длина перпендикуляра к А на этом срезе обозначается как В. Сравнивают остальные срезы, на которых виден сгусток, со срезом А. При размере, превышающем срез 1 > 75%, присваивается значение 1. При размерах, составляющих 25-75%, присваивается значение 0,5 и при размере Сумма значений всех срезов даст показатель С. Объем сгустка можно вычислить по формуле (А х В х С)/2.
Острая эпидуральная гематома
Все эпидуральные гематомы объемом > 30 см2 необходимо эвакуировать, независимо от значения шкалы комы Глазго пациента. Критериями неоперативного лечения являются объем при КТ < 30 см2, толщина < 15 мм и смещение средней линии < 0,5 мм у пациента с шкалой комы Глазго >8, при отсутствии очаговой симптоматики. Консервативное лечение проводится в случае удовлетворения всех критериев.
Острая субдуральная гематома
При субдуральных гематомах эвакуации подлежат очаги имеющие толщину более 10 мм или сопровождающиеся смещением средней линии более 5 мм вне зависимости от показателя ШКГ. Пациенту с острой субдуральной гематомой толщиной менее 10 мм и смещением средней линии менее чем на 5 мм, но имеющему неподвижные, расширенные или асимметричные зрачки, ВЧД >20 мм рт. ст. или снижение ШКГ на два или более баллов с момента травмы до госпитализации, также следует удалить гематому. Пациентам с острыми субдуральны-ми гематомами как можно скорее нужно удалять сгустки.50 Субдуральные гематомы удаляются при краниотомии. Всем пациентам с ШКГ < 9 и острой субдуральной гематомой необходим мониторинг ВЧД.
Паренхимные поражения при черепно-мозговой травме
Повреждения паренхимы представлены внутрипаренхимными сгустками и ушибами. Их лечение всегда было менее определенным, чем лечение эпидуральных и субдуральных гематом.
Очаговые паренхимные поражения нужно удалять в трех ситуациях. Каждого пациента с объемным паренхимным поражением и признаками связанного с ним прогрессирующего неврологического нарушения, с устойчивой к медикаментозному лечению внутричерепной гипертензией или признаками эффекта массы при КТ нужно лечить хирургически.
Хирургическое лечение необходимо во всех случаях какого-либо очага объемом более 50 см3. Пациентов с ШКГ 6-8 с ушибами лобной или височной доли больше 20 см3 в объеме со смещением серединных структур не менее чем на 5 мм и/или сдавлением цистерн при КТ следует лечить хирургически. Рекомендуется краниотомия с эвакуацией объемного очага.
Неоперативное лечение с интенсивным мониторигом и повторной визуализацией возможно для пациентов с объемными паренхимными очагами при отсутствии неврологических нарушений, контроле ВЧД и без значительных признаков эффекта массы при КТ.
Повреждения в задней ямке при черепно-мозговой травме
Поражения задней ямки особенно опасны. Масс-эффект этих поражений часто проявляется изменениями не психического состояния, а жизненно важных показателей. Нередко эти изменения незначительны и пропускаются, в результате чего происходит вклинение миндалины мозжечка и сердечно-легочный коллапс.
Пациенты с эффектом массы при КТ или с неврологическим нарушением или ухудшением, которое можно приписать поражению нуждаются в оперативном вмешательстве. Масс-эффект при КТ определяется как деформация, смещение или исчезновение изображения четвертого желудочка; сжатие или потеря визуализации базальных цистерн или наличие обструктивной гидроцефалии. Операцию необходимо провести как можно быстрее. Чаще всего выполняется подзатылочная трепанация.
Пациентов с очагами, не дающими значительного эффекта массы при КТ и без признаков неврологического нарушения, можно оставить под наблюдением при последовательном КТ-контроле.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Городская клиническая больница №12 Департамента здравоохранения Москвы
Городская клиническая больница №12, Москва
Кафедра неврологии и нейрохирургии Российского государственного медицинского университета им. Н.И. Пирогова, Москва
Хирургическое лечение путаменальных гематом
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2015;115(3‑2): 48‑54
Городская клиническая больница №12 Департамента здравоохранения Москвы
Представлены современные данные, касающиеся хирургического лечения путаменальных гематом. Описаны особенности клинической картины заболевания и его диагностики, в частности радиологической. Приведены результаты наиболее значимых исследований, посвященных изучению эффективности хирургического лечения. Обсуждаются показания к хирургическому лечению заболевания.
Городская клиническая больница №12 Департамента здравоохранения Москвы
Городская клиническая больница №12, Москва
Кафедра неврологии и нейрохирургии Российского государственного медицинского университета им. Н.И. Пирогова, Москва
Геморрагический инсульт (ГИ) — разновидность инсульта, при котором происходит разрыв мозгового сосуда с формированием внутримозговой гематомы. Ежегодно в Российской Федерации регистрируется 43 400 случаев ГИ [1, 2]. Примерно при половине ГИ развивается путаменальная гематома (ПГ) [3, 4]. Ввиду близости расположения путамена к проводящим путям головного мозга, проходящим во внутренней капсуле, ПГ даже небольшого объема (до 20 мл) вызывает сдавление или разрушение проводящих путей, что приводит к грубому неврологическому дефициту. В случае образования гематомы объемом, превышающим 30—50 мл, развивается дислокация структур головного мозга, что в свою очередь может привести к фатальному вклинению. В связи с широкой распространенностью ПГ и связанными с ними высокими показателями инвалидизации и летальности ведется поиск наиболее эффективных методов лечения заболевания.
Хирургическое лечение (удаление) жизнеугрожающих внутримозговых гематом мозжечковой и подкорковой локализации является доказанным высокоэффективным методом лечения [5—7]. Также доказанным методом лечения является удаление жизнеугрожающих внутримозговых гематом, возникших вследствие разрыва артериальных аневризм или артериовенозных мальформаций [6—8]. Однако в отношении ПГ до сих пор окончательно не выяснено, является ли хирургический метод лечения более эффективным, чем консервативный. Например, в национальных руководствах по лечению больных с ГИ в США и Европе в настоящее время отсутствуют рекомендации по поводу хирургического лечения ПГ [7—9].
Цель настоящего исследования — анализ современных данных, касающихся диагностики и показаний к операции при ПГ.
Патогенез ПГ
Причина образования ПГ — разрыв лентикулостриарных артерий, структура стенки которых изменена вследствие длительно существующей артериальной гипертензии. Дегенеративные изменения стенок артерий включают липогиалиноз, фибриноидный некроз, формирование микроаневризм; стенка артерии при этом становится хрупкой. Особенностью анатомии лентикулостриарных артерий является их отхождение от ствола средней мозговой артерии (сегмент М1) под прямым углом и отсутствие анастомозов. Вследствие этого при повышении артериального давления (АД) развивается значительная гемодинамическая перегрузка лентикулостриарных артерий. Перечисленные факторы способствуют разрыву артерий на фоне значительного повышения А.Д. При состоявшемся кровоизлиянии течение заболевания в значительной степени определяется объемом внутримозговой гематомы. После формирования внутримозговой гематомы вокруг нее развивается отек, что связано с распадом ткани, находящейся в ее полости, и токсическим влиянием на мозговое вещество. Отек, как правило, развивается на 2-е сутки от момента кровоизлияния и нарастает в течение нескольких дней, обычно — до 2 нед [10]. Выраженность отека определяется объемом гематомы — чем он больше, тем более выражен отек. Развитие отека вызывает вторую волну дислокации головного мозга, что также может привести к височно-тенториальному вклинению. Прогностическим фактором развития отека является повышение гематокрита более чем на 40% [10]. В ряде случаев содержимое ПГ прорывается в желудочковую систему мозга (рис. 1). В случае массивного внутрижелудочкового кровоизлияния возможны тампонада желудочковой системы и развитие острой окклюзионной гидроцефалии, что требует экстренного наружного вентрикулярного дренирования.

Рис. 1. КТ пациента с ГИ с формированием внутримозговой гематомы объемом до 25 мл в проекции правого путамена с прорывом крови в желудочковую систему (белые стрелки).
Важной особенностью ПГ является высокий риск внечерепных осложнений. Чем больше объем гематомы и соответственно более тяжелое состояние больного, тем выше риск их развития. В структуре внечерепных осложнений основное место занимают пневмония, тромбоз глубоких вен нижних конечностей и малого таза с последующей тромбоэмболией легочной артерии, инфекция мочевыделительной системы, желудочно-кишечное кровотечение, сепсис, синдром полиорганной недостаточности, инфаркт миокарда.
Клиническая картина
Заболевание развивается остро, часто на фоне общего удовлетворительного самочувствия, обычно в период активной деятельности. Клиническая картина зависит от объема гематомы и ее локализации (рис. 2), которые определяют сдавление внутренней капсулы и дислокацию головного мозга. При минимальном объеме кровоизлияния (до 5 мл) заболевание может протекать практически бессимптомно. При объеме гематомы 10—30 мл наблюдаются разной степени выраженности гемипарез и расстройства высших мозговых функций, соответствующие локализации П.Г. При объеме гематомы 30—50 мл обычно развиваются гемиплегия и снижение уровня бодрствования до оглушения. При объеме гематомы более 50 мл характерно угнетение сознания до оглушения или сопора. В случае формирования гематомы объемом более 100 мл уровень бодрствования обычно снижен до комы, отмечаются нарушения дыхания и сердечно-сосудистой деятельности. Через 2 сут от начала заболевания неврологический дефицит может нарастать вследствие развития перифокального отека, который способен в 2—3 раза увеличить поперечную дислокацию головного мозга [10].

Рис. 2. КТ пациентов с ПГ. Средняя линия выделена пунктиром, стрелкой указаны срединные структуры головного мозга на уровне прозрачной перегородки. Снимки демонстрируют разную степень дислокации срединных структур головного мозга в зависимости от объема гематомы. а — объем гематомы — 10 мл, дислокации нет, выраженность гемипареза — 4 балла, пациент в ясном сознании; б — объем гематомы — 36 мл, поперечная дислокация — 5 мм, выраженность гемипареза — 1 балл, пациент в оглушении; в — объем гематомы — 60 мл, поперечная дислокация — 9 мм, гемиплегия, пациент в сопоре; г — объем гематомы — 80 мл, поперечная дислокация 14 мм, гемиплегия, пациент находится в коматозном состоянии.
Диагностика ПГ
Точная диагностика ГИ невозможна без применения методов нейровизуализации. В острейшем периоде инсульта (1-е сутки от начала заболевания) компьютерная томографии (КТ) более информативна, чем магнитно-резонансная томография (МРТ). Свежая кровь на КТ характеризуется ярким светлым сигналом в веществе головного мозга, которое имеет более темный серый цвет. По данным КТ возможно точно определить объем, форму и локализацию ПГ, степень поражения внутренней капсулы, оценить степень смещения срединных структур головного мозга, состояние ликворопроводящей системы (рис. 3). В подострой стадии кровоизлияния, спустя 3—5 сут от начала заболевания, гемоглобин крови начинает разрушаться и МРТ становится более информативной, чем К.Т. Проведен ряд исследований, посвященных выявлению прогностически значимых факторов неблагоприятного исхода заболевания по данным К.Т. Таковыми при ПГ являются объем кровоизлияния 44 мл и более и поперечная дислокация срединных структур головного мозга не менее чем на 5 мм в дебюте заболевания. В исследовании участвовали 54 пациента, у 29 из них имелись указанные признаки, умерли 90% [11, 12]. Важным прогностическим фактором наступления летального исхода является объем ПГ более 33 мл, при этом 30-дневная летальность достигает 80% [13, 14]. При обследовании 80 больных с ПГ установлена зависимость между объемом гематомы и риском наступления летального исхода в течение 30 дней после развития ГИ [15, 16]. Летальный исход наступил у 23% больных с объемом гематомы менее 30 мл, 64% пациентов с объемом гематомы 30—60 мл и 93% с объемом гематомы более 60 мл. Показано, что объем гематомы более 60 мл ассоциирован с наступлением летального исхода у 85% больных [17, 18]. Другими факторами, повышающими риск неблагоприятного исхода, являются обширное повреждение внутренней капсулы, внутрижелудочковое кровоизлияние, развитие острой окклюзионной гидроцефалии, наличие аксиальной дислокации [19—22] (рис. 4).

Рис. 3. КТ больного с правосторонней ПГ. Расчет объема гематомы производится по формуле A×B×C/2, объем гематомы составляет 36,4 мл (см3).

Рис. 4. КТ пациентов с ПГ, снимки демонстрируют отношение гематомы к внутренней капсуле (обозначена пунктиром). а — гематома не примыкает к внутренней капсуле; б — гематома примыкает к внутренней капсуле и сдавливает ее.
С целью прогнозирования исхода при внутримозговых кровоизлияниях была разработана шкала ICH-Score (модифицированный вариант — mICH) [20, 23]. Шкала mICH позволяет оценить следующие параметры: уровень бодрствования по шкале комы Глазго (ШКГ), объем гематомы, наличие внутрижелудочкового кровоизлияния. Каждый параметр оценивают в баллах, общая сумма баллов обладает достаточной прогностической значимостью (табл. 1).

Таблица 1. Шкала оценки внутричерепного кровоизлияния mICH
Минимальное возможное значение по шкале mICH — 0, максимальное — 11 баллов. Шкала позволяет прогнозировать 30-дневую летальность при ГИ и функциональный исход через 6 мес на фоне консервативного лечения [24]. Показатели 30-дневней летальности составляют при оценке в 1 балл 3% больных, при 2 баллах — 30%, при 3 баллах — 61%, при 4 баллах — 88%. Показатели благоприятного функционального исхода спустя 6 мес после ГИ следующие: при 1 и 2 баллах — 80% больных, при 3 баллах — 60%, при 4 баллах — 40%, при 5 баллах — 10%.
Лечение
В острейшем периоде ПГ все больные должны проходить лечение в условиях нейрореанимационного отделения. Пациентам проводят терапию, направленную на улучшение микроциркуляции, устранение отека головного мозга, коррекцию АД и деятельности сердечно-сосудистой системы, профилактику внечерепных осложнений. При необходимости осуществляют респираторную поддержку. Важной задачей терапии при крупных гематомах с дислокацией головного мозга является устранение внутричерепной гипертензии, которое включает в себя мероприятия, направленные на снижение внутричерепного давления: возвышенное положение головного конца кровати, введение гиперосмолярных растворов, внутривенное введение тиопентала [1, 2]. Однако, как показывают результаты немногочисленных исследований [14, 25], данные меры не оказывают существенного влияния на исход заболевания.
Хирургическое лечение
Хирургическое лечение пациента с ГИ преследует 2 цели: устранение жизнеугрожающей дислокации головного мозга и уменьшение сдавления структур мозга для улучшения функционального исхода заболевания. При необходимости устранения жизнеугрожающей дислокации применяют декомпрессивную краниотомию с удалением гематомы (рис. 5).

Рис. 5. КТ пациента с левосторонней ПГ объемом 70 мл. Пациенту выполнены декомпрессивная краниотомия, удаление гематомы. а — до операции, пациент в поверхностной коме, поперечная дислокация на уровне прозрачной перегородки — 12 мм (белая стрелка, средняя линия отмечена пунктиром). Аксиальная дислокация в виде сдавления охватывающей цистерны (черная стрелка); б — 3D-КТ-реконструкция сформированного костного дефекта; в — через 1 сут после операции, пациент в оглушении, поперечная дислокация 4 мм на уровне прозрачной перегородки (белая стрелка, средняя линия выделена пунктиром), регресс аксиальной дислокации — охватывающая цистерна не сдавлена (черная стрелка).
Нами наблюдались 33 пациента с ПГ объемом более 60 мл (в среднем — 90 мл), которым были проведены декомпрессивная трепанация черепа и удаление гематомы. Уровень бодрствования до операции по ШКГ составлял 4—10 баллов. Из прооперированных выжили 25 (76%) пациентов, среди них негрубая инвалидизация наступила у 15%, грубая — у 36%, развитие вегетативного состояния — у 24%. У пациентов с благоприятным исходом заболевания была правосторонняя локализация гематомы, ее объем не превышал 90 мл, значения по ШКГ до операции были не менее 7 баллов. При консервативном лечении ПГ объемом более 60 мл летальность достигает 90% [26—28]. В одном исследовании удалось снизить летальность в 3,75 раза, однако пациентов с удовлетворительным функциональным исходом было всего лишь 15%. По данным ряда аналогичных исследований [22—25], при проведении декомпрессивной краниотомии больным с объемом ПГ более 60 мл летальность составляет 10—35%, негрубая инвалидизация наступает у 5—20% выживших. Указывается на улучшение функционального исхода при трансинсулярном удалении ПГ при декомпрессивной краниотомии [27—29]. В случае удаления ПГ объемом более 30 мл с проведением декомпрессивной краниотомии летальность составляет 11—34%, а негрубая инвалидизация наступает у 15—27% [30, 31]. При консервативном лечении ПГ объемом более 30 мл летальность достигает 60—80% [14, 16].
В случае, когда у пациента нет жизнеугрожающей дислокации головного мозга, однако объем ПГ превышает 30 мл и имеется грубый неврологический дефицит, применяют минимально инвазивные методы удаления гематомы (рис. 6). К таковым относятся пункционная аспирация гематомы с возможным проведением локальной фибринолитической терапии, эндоскопическое удаление гематомы [30—34]. Для точного попадания в центр гематомы используют различные методики стереотаксической навигации, ультразвукового сканирования. По данным разных исследований [1, 22], при применении минимально инвазивных методов удаления гематомы показатели негрубой инвалидизации выживших достигают 15—45%, хотя не вполне понятен значительный разброс полученных значений. Повреждение внутренней капсулы значительно ухудшает показатели функционального исхода и у оперированных больных [31—34]. Интересные данные получены D. Cho и соавт. [18] — пациентов с ПГ рандомизировали в группы консервативного лечения (113 человек) и эндоскопического удаления гематомы (также 113 человек). Состояние больных оценивали по шкале mICH. Оказалось, что консервативное лечение было эффективным при значениях 0—1 балл по шкале mICH, при 2 баллах по шкале mICH функциональный исход оказался в 2 раза лучше при хирургическом лечении. При 3—4 баллах по шкале mICH хирургическое лечение снижало летальность более чем в 2 раза, однако функциональный исход выживших достоверно не различался от группы больных, получавших консервативное лечение. При наличии 5 и более баллов по шкале mICH хирургический метод лечения не имеет преимуществ перед консервативным.

Рис. 6. КТ пациента с правосторонней ПГ объемом 65 мл. Пациенту выполнена операция — пункционная аспирация гематомы. а — до операции, пациент в оглушении, левосторонняя гемиплегия, поперечная дислокация — 7 мм на уровне прозрачной перегородки (длинная белая стрелка, средняя линия отмечена пунктиром). Выраженный отек правого полушария со сдавлением субарахноидальных конвекситальных пространств (маленькие белые стрелки); б — краниография после операции, в полости черепа визуализируется мозговой конец катетера (черная стрелка). в — через 1 сут после операции, пациент в ясном сознании, левосторонний гемипарез — 2 балла, поперечная дислокация — 2 мм на уровне прозрачной перегородки (белая стрелка, средняя линия отмечена пунктиром), регресс отека правого полушария в виде раскрытия субарахноидальных конвекситальных пространств (маленькие белые стрелки), остаточная гематома — 7 мл, катетер в области гематомы (черная стрелка).
Заключение
На основании анализа данных литературы можно сделать следующие выводы. Открытое удаление гематомы с проведением декомпрессивной краниотомии достоверно (в 2—4 раза) снижает летальность у больных с объемом ПГ более 50 мл и нарушением уровня бодрствования не глубже умеренной комы. Функциональный исход у таких пациентов неудовлетворительный, у 80% выживших наступает глубокая инвалидизация. Развитие нейрореабилитационных технологий способно улучшить показатели функционального исхода у данной категории пациентов. Наиболее перспективно хирургическое вмешательство у больных с ПГ объемом 30—60 мл и уровнем бодрствования 9—15 баллов по ШКГ без разрушения внутренней капсулы по данным К.Т. Применение минимально инвазивных хирургических методик позволяет достичь негрубой инвалидизации у 15—45% больных данной категории. При решении вопроса о хирургическом лечении целесообразно использовать шкалу оценки состояния больного с внутричерепным кровоизлиянием mICH.
Определение этиологии ВМК может потребовать больше времени, чем срок госпитализации пациента. Состояния, достоверный диагноз которых требует проведения МРТ или КТ исследований в динамике, включают кавернозные мальформации, дуральные фистулы.
КТ головного мозга
Неконтрастная КТ головного мозга является методом, который наиболее часто используется для выявления острого ВМК, признаки которого появляются практически сразу после его развития. По КТ можно определить размер и локализацию кровоизлияния. Она также даёт информацию о распространении крови в желудочковую систему, наличии окружающего отёка, смещении отдельных участков мозга (вклинение). Кровь в острейшем периоде образует участки с повышенной рентгеновской плотностью, за исключением пациентов, страдающих анемией, у которых области кровоизлияния могут быть изоденсивными. Спустя несколько недель, кровь становится изоденсивной. Возможно образование кольцевидного увеличения плотности вокруг очага. В хронической стадии очаг кровоизлияния имеет пониженную рентгеновскую плотность.
МРТ головного мозга
Паренхиматозное кровоизлияние в острейшей стадии с высокой точностью выявляется на МРТ в T2-режимах, таких как градиентное эхо (GRE). Эти последовательности имеют высокую чувствительность к неоднородным статическим магнитным полям, образованным молекулами с парамагнитными свойствами, такими как дезоксигемоглобин. Это свойство парамагнитных молекул определяет эффект магнитной восприимчивости, что приводит к быстрой фазовой релаксации спинов протонов. При этом происходит потеря сигнала (затемнение или гипоинтенсивность), которая более заметна на T2* — взвешенных изображениях. Признаки кровоизлияния по данным компьютерной и магнитно-резонансной томографий на различных стадиях представлены в таблице 1.
Таблица 1. Признаки кровоизлияния по данным компьютерной и магнитно-резонансной томографий на различных стадиях.
| Стадии | КТ | T1-взвешенная МРТ | T2-взвешенная МРТ | градиент эхо МРТ |
|---|---|---|---|---|
| Острейшая ( | Высокая плотность (гиперденсный очаг) | Изоинтенсивный или слегка гиперинтенсивный | Гиперинтенсивный | Гипоинтенсивный ободок |
| Острая (12 ч — 2 дня) | Высокая плотность | Изо — или гипоинтенсивный | Гипоинтенсивный | Гипоинтенсивный ободок, интенсивность которого увеличивается к центру |
| Ранняя подострая (2–7 дней) | Высокая плотность | Гиперинтенсивный | Гипоинтенсивный | Гипоинтенсивный |
| Поздняя подострая (8 дней — 1 месяц) | Плотность, как у окружающей мозговой ткани (изоденсный очаг) | Гиперинтенсивный | Гиперинтенсивный с ободком низкой интенсивности | Гиперинтенсивный с ободком низкой интенсивности |
| Хроническая (>1 месяца) | Низкая плотность (гиподенсный очаг) | Гипоинтенсивный | Гипоинтенсивный | Щелевидное гиперинтенсивное или изоинтенсивное ядро, окружённое гипоинтенсивным ободком |
Определение объёма кровоизлияния
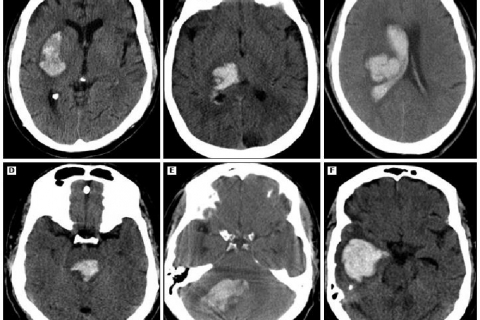
Рисунок 1. Типичные локализации внутримозговых гематом
Скорлупа (A), таламус (B), подкорковое белое вещество (C), Варолиев мост (D) и мозжечок (E).
Таламические и субкортикальные кровоизлияния часто сопровождаются прорывом крови в желудочки мозга (B и C). Церебральная амилоидная ангиопатия, употребление наркотиков и сосудистые аномалии часто приводят к развитию лобарных кровоизлияний (F).
Dastur CK, Yu W. Current management of spontaneous intracerebral haemorrhage. Stroke Vasc Neurol 2017; 2(1): 21–29. Copyright © 2017 BMJ Publishing Group Ltd.
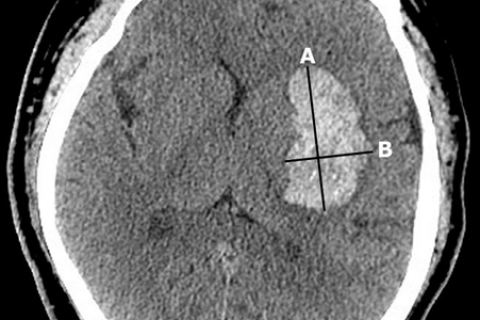
Рисунок 2. Метод оценки объёма внутримозгового кровоизлияния по формуле ABC/2
Использование метода ABC/2 для оценки острого кровоизлияния в подкорковые ядра слева: A = 6 см, B = 4 см и C = 3 см (гематома определяется на 12 срезах толщиной 0,25 см). Объём гематомы 36 см³ ((6×4×3)/2).
Thabet AM, Kottapally M, Hemphill JC 3rd. Management of intracerebral hemorrhage.
А — наибольший диаметр кровоизлияния на срезе КТ с наибольшей площадью кровоизлияния, представленный на рисунке 2 (срез-образец).
В — наибольший диаметр в плоскости, располагающейся под углом в 90 градусов к срезу А (рис. 2).
С — приблизительное количество КТ-срезов, на которых есть кровоизлияние, умноженное на толщину срезов в сантиметрах. Для того, чтобы вычислить С, каждый срез КТ, на котором есть признаки кровоизлияния, визуально сравнивается со срезом-образцом. Каждый срез, на котором есть признаки кровоизлияния, при подсчёте принимается за единицу, если площадь кровоизлияния > 75% от площади на срезе с максимальным размером кровоизлияния. Срез учитывается как 1/2, если площадь кровоизлияния составляет от 25 до 75 процентов площади на срезе с самым большим размером кровоизлияния. Если площадь области кровоизлияния < 25% от площади на срезе с самым большим размером, срез не учитывается при подсчёте. ABC/2 позволяет получить объём кровоизлияния в кубических сантиметрах.
Сравнение возможностей нейровизуализации ВМГ методами КТ и МРТ
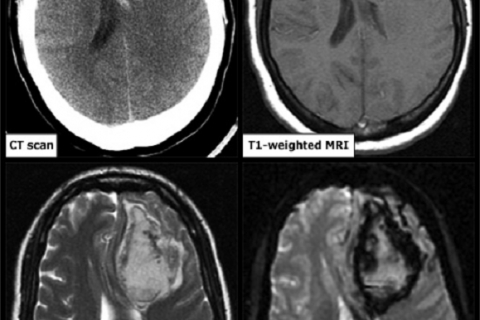
Рисунок 3. Сравнительные характеристики КТ и МРТ
Признаки риска увеличения гематомы
Среди пациентов, которым КТ головного мозга проводится в течение первых трёх часов от дебюта заболевания, доля тех, у кого впоследствии отмечается рост гематомы, составляет 28–38%. Увеличением церебральной гематомы принято считать рост её объёма более чем на 6 мл или повышение относительного размера более чем на 33%.
Наиболее важными независимыми прогностическими факторами увеличения церебральной гематомы являются признаки экстравазации крови на нативных изображения КТ и КТ-ангиографии. В многоцентровом исследовании PREDICT, наличие описанного ниже симптома «кляксы» (англ.blend sign) ассоциировалось с 2,3 (95% CI 1.6–3.1) кратным риском увеличения гематомы (см. рисунок 5).
Таблица 2. Показатели шкалы риска прогрессирования гематомы
| Показатель | Баллы |
|---|---|
| Приём Варфарина | |
| Нет | 0 |
| Да | 2 |
| Время до выявления гематомы на КТ (ч) | |
| ≤6 | 2 |
| >6 | 0 |
| Исходный объём гематомы (мл) | |
| 0 | |
| 30–60 | 1 |
| >60 | 2 |
| Симптом «кляксы» на КТ-ангиографии | |
| Нет | 0 |
| Есть | 3 |
| Нет данных | 1 |
В таблице 2 представлена шкала оценки риска прогрессирования ВМГ у пациентов, находящихся на терапии варфарином. Отсутствие показателей риска по данной шкале ассоциируется с низким риском экспансии роста гематомы с вероятностью не более 5,7%. Наличие у пациента от 1 до 3 баллов по данной шкале ассоциируется со средним риском экспансии роста гематомы с вероятностью 12,4%. С вероятностью в 36,4% риск экспансии роста гематомы будет высоким, если количество баллов по данной шкале составит от 4 до 9 баллов.
На рисунке 4 представлен симптом «водоворота», который демонстрирует на неконтрастной КТ гиподенсивные или изоденсивные области округлой, линейной или неровной формы (по сравнению с нормальной паренхимой мозга) в области повышенной рентгеновской плотности, соответствующей кровоизлиянию. Ограниченные данные указывают на то, что симптом «водоворота» ассоциируется с увеличением размера кровоизлияния, плохим исходом и повышенной смертностью.
На рисунке 5 представлен симптом «кляксы» — феномен, выявляемый у пациентов с внутримозговым кровоизлиянием на церебральной КТ-ангиографии. Определяются единичные или множественные очаги контрастного усиления в пределах острого первичного внутримозгового кровоизлияния (ВМК), расположенные без непосредственного контакта с нормальными или патологически измененными кровеносными сосудами.
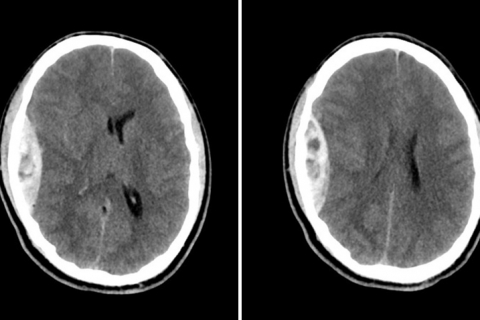
Очаги не должны выявляться до введения контраста. Они соответствуют областям продолжающегося кровотечения. По данным ряда исследований, симптом «кляксы» связан с увеличением кровоизлияния и плохим прогнозом. В ретроспективном анализе группы из 367 пациентов с острым ВМК, симптом «кляксы» отмечался у 19% и был независимым фактором риска увеличения размера кровоизлияния. Сходные результаты были описаны в других сериях ретроспективных наблюдений, где показана связь указанных изменений со смертностью пациентов. Несмотря на меньшую изученность, небольшие «кляксы» контрастного вещества на МРТ — МРТ симптом «кляксы» также выявлялся на T1 и динамических T1-взвешенных изображениях, особенно, если исследование выполнялось в течение первых 6-ти часов после развития ВМК. «Кляксы» на МРТ могут быть связаны с увеличением гематомы и худшим клиническим прогнозом, но точные данные о значимости симптома изучены недостаточно. В ряде исследований было показано, что оценка симптома «кляксы», учитывающая количество очагов, их максимальные размеры и плотность является значимым прогностическим фактором увеличения размера гематомы. Наиболее значимым предиктором являлось количество «клякс».
Диагностика стадии внутричерепного кровоизлияния по КТ, МРТ
а) Терминология:
1. Сокращения:
• Внутримозговая гематома (ВМГ)
2. Синонимы:
• Внутрипаренхиматозное кровоизлияние
б) Визуализация:
1. Общие характеристики стадии внутричерепного кровоизлияния:
• Лучший диагностический критерий:
о Гиперденсное (50-70 HU) объемное образование на КТ; перифокальный отек развивается в течение первых нескольких дней
о Созревание гематомы в центре (в ядре) происходит более медленно, чем на периферии
о МРТ: стадирование внутричерепного кровоизлияния основано на характеристиках сигнала на Т1- и Т2-ВИ
о МРТ также чувствительна, как и КТ в острейшей стадии и более чувствительна в подострой и хронической
• Локализация:
о Супратенториальная > инфратенториальная локализация
• Размеры:
о От почти микроскопических до очень больших; одиночные >> множественные
• Морфология:
о Овоидная форма; большие гематомы имеют более неправильную форму и гетерогенную плотность
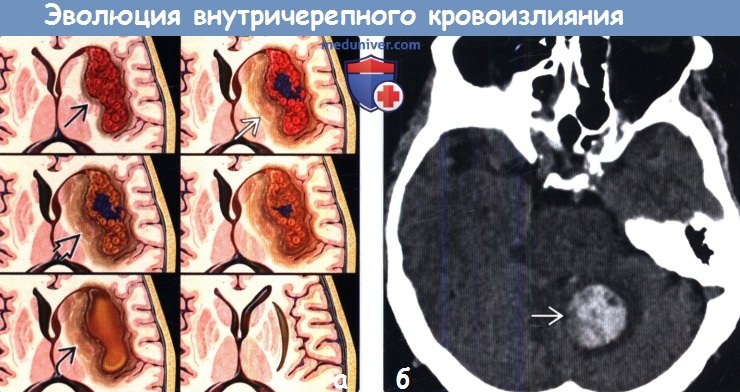
(а) На рисунке аксиального среза показана эволюция внуnрипаренхиматозного кровоизлияния - от острейшей (внутриклеточный окси-Hb) до острой стадии (внутриклеточный деокси-Hb, перифокальный отек). Ранняя и поздняя подострые стадии (интра- и экстрацеллюлярный мет-Hb соответственно) сменяются хронической с образованием кистозной полости с отложением гемосидерина.
(б) Бесконтрастная КТ, аксиальный срез: у пациента с артериальной гипертензией в мозжечке определяется гиперденсное объемное образование, представляющее собой кровоизлияние, с минимальным перифокальным отеком.
4. Рекомендации по визуализации:
• Лучший инструмент визуализации:
о Первичная диагностика: бесконтрастная КТ или МРТ
о Стадирование/исследование в динамике: МРТ, МР-ангиография/МР-венография или КТ-ангиографи/КТ-венография
о Ангиография при отсутствии выявленной причины
(а) МРТ, Т2-ВИ, аксиальный срез: крупное гипертензивное кровоизлияние в базальные ганглии левого полушария, находящееся в ранней подострой стадии, поскольку имеет преимущественно гипоинтенсивный сигнал и окружено перифокальным отеком. Передние отделы гематомы имеют гиперинтенсивный сигнал, что свидетельствует о их более острой стадии.
(б) MPT, SWI, аксиальный срез: гипоинтенсивное кровоизлияние ЕЯ и другие множественные очаги магнитной восприимчивости (вследствие отложения гемосидерина), свидетельствующие о давних кровоизлияниях вследствие артериальной гипертензии. (а) MPT, Т1-ВИ, аксиальный срез: у пациента с амилоидной ангиопатией определяются два кровоизлияния: кровоизлияние в острейшей (изоинтенсивный сигнал) и острой/ранней подострой (гиперинтенсивный сигнал) стадии локализующееся в левой височной доле, а также кровоизлияние в поздней подострой стадии (гиперинтенсивный сигнал), локализующееся в правой височной доле.
(б) МРТ, Т2-ВИ, аксиальный срез: гетерогенный гиперинтенсивный сигнал от участка гематомы в острейшей стадии, а также гипоинтенсивный сигнал от участка гематомы в острой/ранней подострой стадии Кровоизлияние в поздней подострой стадии имеет гиперинтенсивный на Т1 - и Т2-ВИ сигнал. (а) МРТ, выполненная через 21 час после первичного исследования, ДВИ, аксиальный срез: выявляется, что сигнал на ДВИ в большей степени определяется Т2 эффектами: эффект Т2 «просвечивания» в правом кровоизлиянии, находящемся в подострой стадии, и эффект Т2 «затемнения» в гематоме, находящейся в острой/ранней подострой стадии.
(б) МРТ, карта ИКД, аксиальный срез: сигнал на ДВИ в большей степени определяется Т2 эффектами. Только гематома в острой/ранней подострой стадии имеет гипоинтенсивный на карте ИКД сигнал, в то время как повышение диффузии отмечается в кровоизлиянии в поздней подострой стадии, локализующимся в правой височной доле.
в) Дифференциальная диагностика внутричерепного кровоизлияния:
1. Жиросодержащие образования:
• Липома, дермоидная киста
• Имитируют подострую ВМГ (↑ Т1-ВИ, ↑ Т2-ВИ)
• Артефакт химического сдвига, отсутствие отека, потеря интенсивности сигнала на последовательности с подавлением сигнала от жира помогают подтвердить диагноз
2. Кальцифицированные поражения:
• Бляшка в твердой мозговой оболочке, тромбированная аневризма, менингиома
• Гипоинтенсивный сигнал на Т2-ВИ и GRE, вариабельный на Т1-ВИ
3. Скопления белоксодержащей жидкости:
• Умеренно гиперинтенсивный сигнал на Т1-ВИ, гипоинтенсивный на Т2-ВИ
• Коллоидная киста, киста кармана Ратке, краниофарингиома
г) Патология:
1. Общие характеристики стадии внутричерепного кровоизлияния:
• Этиология
о Очень часто: артериальная гипертензия (АГ), церебральная амилоидная ангиопатия, травма, геморрагические сосудистые мальформации
о Часто: инфаркт с реперфузией, коагулопатия, гематологические нарушения, злоупотребление наркотическими средствами, опухоли (глиома, метастазы)
о Менее часто: тромбоз синусов твердой мозговой оболочки, эклампсия, эндокардит с септической эмболией, грибковая инфекция (аспергиллез, мукоромикоз), энцефалит
• Генетика:
о ВЧГ может возникать спорадически или входить в состав семейных синдромов (семейная ЦАА, семейные кавернозные мальформации)
• Ассоциированные аномалии:
о Вазогенный отек формируется быстро, пик его выраженность пятый день
о Возможно вскрытие гематомы в желудочки/субарахноидальное пространство
2. Стадирование и классификация стадии внутричерепного кровоизлияния:
• Согласованное определение стадий эволюции гематомы на МРТ отсутствует:
о Острейшая стадия: < 24 часов; острая стадия - 1 -3 дня; ранняя подострая стадия - 3-7 дней; поздняя подострая стадия - 1-2 недели; хроническая стадия - >1 месяца
3. Макроскопические и хирургические особенности:
• Острая - ранняя подострая стадии: заполненная кровью полость, окруженная вазогенным отеком, воспалением
• Ранняя подострая-ранняя хроническая стадии: организованный тромб, васкуляризованная капсула
• Поздняя хроническая стадия: гемосидериновый рубец с глиозом
4. Микроскопия:
• Непосредственно после начала кровоизлияния:
о Жидкая гематома с высоким содержанием воды; 95-98% окси-Hb
• Острейшая стадия:
о Эритроциты содержат диамагнитный окси-НЬ
о Высокое содержание воды (↑ сигнал на Т2-ВИ и ↓ на Т1-ВИ)
о Начальное появление вазогенного отека по периферии
• Острая стадия:
о Деокси-Hb в интактных эритроцитах:
- Парамагнитный деокси-Hb с четырьмя неспаренными электронами в интактных эритроцитах обусловливает градиент поля по обе стороны от клеточной мембраны → ↓ сигнала на Т2-ВИ и GRE
- Недоступность парамагнитного центра Hgb для молекул воды → отсутствие укорочения Т1
о Выраженный отек
• Ранняя подострая стадия:
о Окислениется деокси-Hb в интактных эритроцитах до парамагнитного мет-Hb, имеющего 5 неспаренных электронов:
- Индуцированный восприимчивостью градиент по обе стороны от клеточной мембраны → гипоинтенсивный на Т2-ВИ и GRE сигнал
о Начало формирования мет-Hb от периферии гематомы к центру → изначальная визуализация гиперинтенсивного сигнала на Т1-ВИ по краям гематомы
• Поздняя подострая - ранняя хроническая стадия:
о Лизис эритроцитов → высвобождение мет-Hb в межклеточное пространство → потеря градиента по обе стороны от мембраны эритроцита:
- Потеря магнитной неоднородности и повышение содержания воды → ↑ интенсивности сигнала на Т2-ВИ и FLAIR
о Стойкое диполь-дипольное взаимодействие → укорочение Т1
о Снижение отека и масс-эффекта
• Хроническая стадия:
о Поглощение макрофагами лизированных эритроцитов и тромба
о Преобразование мет-Hb в ферритин и гемосидерин
о Резидуальные кисты, щелевидные дефекты мозговой ткани с гемосидериновым рубцом сохраняются на неопределенный срок в областях с интактным гематоэнцефалическим барьером
о Разрешение отека, воспалительных изменений
д) Клиническая картина стадии внутричерепного кровоизлияния:
1. Проявления:
• Наиболее частые признаки/симптомы:
о АГ (90%), рвота (50%), i сознания (50%), головная боль (40%), судороги (10%)
• Клинический профиль:
о АГ, ↑ возраст являются наиболее важными факторами риска: о Увеличение доли ВМГ, ассоциированных с антикоагулянтной терапией
2. Демография:
• Заболеваемость:
о 30/100000 (США); 37/100000 (Европа)
• Возраст:
о Риск увеличивается с возрастом (средний возраст- 63 [США], 70 [Европа])
• Пол:
о Мужчины < 65 лет имеют в 3,4 раза более высокий риск; >65 лет: нет существенных гендерных различий
• Этническая принадлежность:
о Более высокий риск внутричерепных кровоизлияний отмечается у афро-американцев (риск в 3.8 раза выше) и латиноамериканцев (риск в 2,6 выше) по сравнению с кавказцами
3. Течение и прогноз:
• Одно или более повторных кровоизлияний в 1/4 случаев: о Повторное кровоизлияние: повышенная смертность:
- В 70% случаев смерть возникает при 2-м или 3-м внутричерепном кровоизлиянии
• Прогноз зависит от размеров, начального уровня сознания и локализации гематомы:
о Более высокая смертность отмечается при локализации кровоизлияния в структурах задней черепной ямки и долях больших полушарий, чем при глубоких кровоизлияниях с кровотечением
о Расширение желудочковой системы: более высокий уровень смертности при долевом кровоизлиянии, но более низкий - при таламическом кровоизлиянии
о Внутримозговая гематома (ВМГ) при терапии варфарином коррелирует с более высокой смертностью (в два раза больше после трех месяцев)
• 20% независимых - после шести месяцев
4. Лечение:
• Хирургическая эвакуация гематомы при необходимости
е) Диагностическая памятка. Советы по интерпретации изображений:
• МРТ является более чувствительным и более точным в стадировании ВЧГ методом
• Большая зона окружающего вазогенного отека чаще наблюдается при новообразовании
• Выраженная гетерогенность острой гематомы на КТ является предиктором роста гематомы в объеме и ↑ смертности
• Симптом «водоворота», экстравазация контрастного вещества и контрастирование гематомы указывают на ее рост в объеме и высокую вероятность летального исхода
• Граница раздела жидкость-жидкость: вопрос о наличии у пациента коагулопатии
Диагностика острой субдуральной гематомы по КТ, МРТ
а) Терминология:
1. Сокращения:
• Острая субдуральная гематома (оСДГ)
2. Определение:
• Острое кровоизлияние внутри/между внутренним слоем пограничных клеток твердой мозговой оболочки и паутинной мозговой оболочкой
б) Визуализация:
1. Общие характеристики острой субдуральной гематомы:
• Лучший диагностический критерий:
о КТ: гиперденсное внемозговое скопление крови в форме полумесяца, диффузно распространяющееся над поверхностью пораженного большого полушария головного мозга
• Локализация:
о Между паутинной мозговой оболочкой и внутренним слоем пограничных клеток твердой мозговой оболочки
о Над большими полушариями головного мозга > межполушарная, перитенториальная локализация
• Морфология:
о Внемозговое скопление крови в форме полумесяца
о Может распространяться за швы, но не за участки прикрепления твердой мозговой оболочки к черепу
о Может простираться вдоль серпа, намета мозжечка, а также до дна передней и средний черепных ямок
2. КТ при острой субдуральной гематоме:
• Бесконтрастная КТ
о Острейшая СДГ (≤ 6 часов) может иметь гетерогенную плотность или быть гиподенсной
о Острая субдуральная гематома (оСДГ) (от шести часов до трех дней):
- оСДГ: 60% гомогенно гиперденсны
- 40% имеют смешанную гипер-, гиподенсную структуру за счетактивного кровотечения (симптом водоворота), скопления СМЖ вследствие разрыва паутинной оболочки, а также ретракции кровяного сгустка
- Редко: изоденсная острая субдуральная гематома (оСДГ) (коагулопатия, анемия с Hb < 80-100 г/л)
- При отсутствии нового кровоизлияния плотность уменьшается + 1,5 HU/день
• КТ с контрастированием:
о Смещение кнутри корковых вен и границы перехода серое-белое вещество
о Твердая мозговая оболочка и мембраны контрастируются в подострой стадии
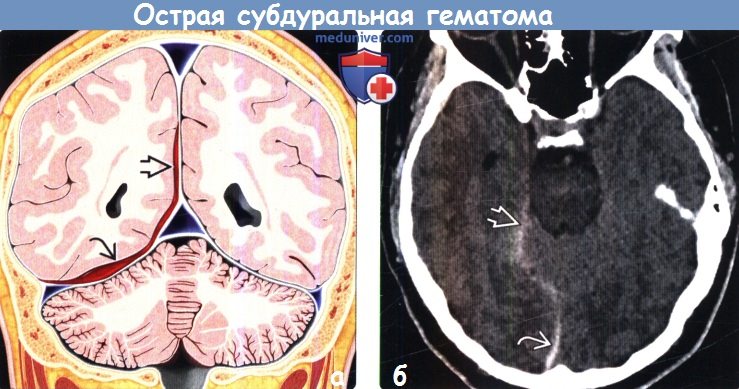
(а) На рисунке коронального среза изображена тонкая острая субдуральная гематома (оСДГ), растекшаяся вдоль серпа и намета мозжечка. При оценке только аксиальных изображений идентификация таких острых субдуральных гематом (оСДГ) может быть затруднена. Мультипланар-ные реформации очень полезны для идентификации небольших тонких острых субдуральных гематом (оСДГ).
(б) Бесконтрастная КТ, аксиальный срез: у мужчины 31 года с легкой черепно-мозговой травмой вдоль намета мозжечка и нижнего отдела серпа возле стока венозных синусов определяется ограниченная гиперденсная зона.
4. Ангиография:
• КТ-ангиография:
о Масс-эффект, оказываемый внемозговым скоплением крови; смещение вен из внутренней пластинки костей черепа
о ЦСА применяется только при возникновении в ходе КТ-ангиографии подозрения на повреждение нижележащих сосудов
5. Рекомендации по визуализации:
• Лучший инструмент визуализации:
о Бесконтрастная КТ в качестве первоначального скринингового исследования:
- Используйте как костный, так и мягкотканный алгоритмы реконструкции
- Используйте как стандартное мозговое, так и широкие окна (150HU)
- Корональная и сагиттальная реформации лучше всего подходят для обнаружения небольших СДГ
о МРТ является более чувствительным методом, но редко используется:
- Более информативна в определении распространенности, давности СДГ
- ± дополнительные данные о черепно-мозговой травме
(а) Бесконтрастная КТ, корональная проекция: у этого же пациента определяется небольшая острая субдуральная гематома (СДГ) перитенториальной локализации. Небольшая слабо выраженая острая субдуральная гематома (СДГ) конвекситальной локализации , не визуализируемая на аксиальном срезе, становится видна на этом срезе.
(б) Бесконтрастная КТ, сагиттальная проекция: у этого же пациента определяется перитенториальная острая субдуральная гематома (СДГ) и слабовыраженная оСДГ конвекситальной локализации, которые не были видны на аксиальных изображениях. (а) Бесконтрастная КТ, аксиальный срез: у мужчины 30 лет с черепно-мозговой травмой над левыми лобной и теменной долями определяется небольшая острая субдуральная гематома (оСДГ), имеющая смешанную плотность. Слабовыраженный гиподенсный участок в острой субдуральной гематоме (оСДГ) вызвал обеспокоенность по поводу возможного быстрого накопления большого объема крови.
(б) Состояние пациента через пять часов после исследования ухудшилось. На аксиальном срезе определяется значительное увеличение объема острой субдуральной гематомы (оСДГ). В гематоме выявляются множественные гиподенсные фокусы, отражающие быстрое кровоизлияние. Обратите внимание на дислокацию желудочковой системы под серп мозга.
в) Дифференциальная диагностика острой субдуральной гематомы (оСДГ):
1. Другое скопление жидкости в субдуральном пространстве:
• Субдуральная гигрома:
о «Чистая» СМЖ, отсутствие инкапсулирующих мембран
• Субдуральный выпот:
о Скопление ксантохромной жидкости при менингите или вследствие транссудацией плазмы через мембрану
о Имеет схожую со СМЖ плотность
• Эмпиема: периферийное контрастирование, гиперинтенсивна на FLAIR; ограничение диффузии на ДВИ
2. Эпидуральная гематома:
• Внемозговое скопление крови двояковыпуклой формы
• Часто сочетается с переломом
• Может распространяться за участки прикрепления твердой мозговой оболочки к костям черепа, ограниченные швами
3. Пахименингопатии (утолщение твердой мозговой оболочки):
• Хронический менингит (может быть неотличим)
• Нейросаркоидоз: изменения часто имеют бугристую структуру
• Послеоперационные (например, шунтирование)
• Внутричерепная гипотензия:
о «Проваливание» среднего мозга, грыжевое выпячивание мозжечка
4. Опухоль:
• Объемное образование с основанием в твердой мозговой оболочке, накапливающее контраст:
о Менингиома, лимфома, лейкоз, метастазы
о Признаки объемного образования, не имеет форму полумесяца:
- ± вовлечение черепа и экстракраниальнх мягких тканей
5. Артефакт химического сдвига (МРТ):
• Сигнал от желтого костного мозга или подкожной жировой клетчатки может «сдвигаться» интракраниально и имитировать гиперинтенсивную СДГ на Т1-ВИ:
о Проявляется при Т поля зрения или I пропускной способности
о Активнее проявляется при большей напряженности магнитного поля
г) Патология:
1. Общие характеристики острой субдуральной гематомы:
• Этиология:
о Травма является наиболее частой причиной:
- Разрыв мостовых корковых вен, которые, пересекая субдуральное пространство, впадают в синусы твердой мозговой оболочки
- Образуются при прямой травме, а также при других воздействиях, не связанных с нанесением удара (падение)
- Травма может быть незначительной, особенно у пожилых:
Часто повторная с начальными субклиническими проявлениями
о Нетравматический генез (спонтанная) острой субдуральной гематомы (оСДГ) реже встречается у лиц не пожилого возраста:
- Вскрытие интрапаренхиматозной гематомы в субарахноидальное, а затем и субдуральное пространство
- Разрыв аневризмы
- Сосудистые мальформации: дуральная артериовенозная фистула, артериовенозная мальформация (АВМ), кавернома:
Как правило, присутствуют и другие кровоизлияния (паренхиматозные и/или субарахноидальные)
- Мойамойа (большая предрасположенность к кровоизлиянию у взрослых, к ишемии у детей)
- Инвазия твердой мозговой оболочки опухолью с вторичным кровоизлиянием (рак предстательной железы)
- Спонтанное кровоизлияние с тяжелой коагулопатией
о Предрасполагающие факторы:
- Атрофия
- Желудочковое шунтирование (→ увеличение тяги на верхние корковые вены)
- Антикоагулянтная терапия, нарушение внешнего или внутреннего пути коагуляции (например, злоупотребление алкоголем)
• Ассоциированные аномалии:
о > 70% пациентов имеют другие существенные сопутствующие травматические повреждения
о Масс-эффект, смещение структур > толщины острой субдуральной гематомы (оСДГ) - подозрение на наличие нижележащего отека/эксайтотоксического повреждения
2. Макроскопические и хирургические особенности:
• Гематома в форме полумесяца, имеющая вид «смородинового желе»
• Мембраны/грануляционная ткань развивается позже
3. Микроскопия:
• Наружная мембрана состоит из пролиферирующих фибробластов и капилляров:
о Хрупкие капилляры могут стать источником повторных кровоизлияний
• Внутренняя мембрана (из фибробластов твердой мозговой оболочки или пограничных клеток) формирует фиброколлагеновую капсулу
д) Клиническая картина острой субдуральной гематомы:
1. Проявления:
• Наиболее частые признаки/симптомы:
о Чаще всего следуют за травмой
о Клинические проявления варьируют от бессимптомного течения до потери сознания:
- «Светлый» промежуток при острой субдуральной гематоме (оСДГ): будучи изначально в сознании, пациент теряет его через несколько часов после травмы
- Пациенты с ранним появлением симптомов (< 4 часов), а также лица преклонного возраста имеют неблагоприятный прогноз
о Другие симптомы (очаговая симптоматика, судороги) обусловлены масс-эффектом, диффузным повреждением мозга, вторичной ишемией
о Коагулопатия или антикоагулянтная терапия увеличивают риск и степень кровоизлияния
2. Демография:
• Любой возраст, чаще встречается у пожилых людей
• М = Ж
• Эпидемиология:
о СДГ обнаруживается в 30% случаев в ходе аутопсии при черепно-мозговой травме
3. Течение и прогноз:
• При отсутствии лечения может медленно увеличиваться в объеме, усиливая масс-эффект
• Компримирует и смещает нижележащий мозг
• Часто возникают повторные кровоизлияния; обнаружение СДГ у детей вызывает подозрение на неслучайную травму
е) Диагностическая памятка острой субдуральной гематомы:
1. Обратите внимание:
• Бесконтрастная КТ является скрининговым исследованием
• МРТ следует выполнять при выявлении большей степени масс-эффекта и/или выраженности симптомов, чем ожидалось для данного размера субдуральной гематомы (СДГ):
о Помогает определить распространенность травматического повреждения мозга
о МРТ позволяет выявить нетравматические причины
• У детей с повторным кровоизлиянием или кровоизлиянием смешанной давности необходимо подозревать неслучайную травму
2. Советы по интерпретации изображений:
• При КТ в широком окне более заметны едва различимые субдуральные гематомы (СДГ)
• FLAIR, Т2*, как правило, являются наиболее чувствительными в выявлении СДГ последовательностями
• КТ-плотность и МР-интенсивность гематомы имеют различные значения в зависимости от давности и обширности повторного кровоизлияния, а также наличия примеси СМЖ (при разрыве паутинной мозговой оболочки)
Читайте также:

