Как лечить трофическую язву актовегином
Обновлено: 19.04.2024
М.Д. Дибиров (1), Р.У. Гаджимурадов (1, 2), О.Х. Халидов (1, 2), М.Р. Какубава (1, 2), М.В. Полянский
(1) Кафедра хирургических болезней и клинической ангиологии ГБОУ МГМСУ им. А.И. Евдокимова Минздрава России, Москва; (2) Городская клиническая больница № 81 ДЗ Москвы
Цель работы составила оценка эффектов препарата Актовегин в комплексном лечении хронических ран различной этиологии. Под наблюдением находились 118 пациентов, госпитализированных в отделение сосудистой хирургии и хирургии гнойных осложнений сахарного диабета. Больные были разделены по этиологическому фактору на три группы, включавшие в себя патологические состояния, вызывающие формирование 90% длительно незаживающих раневых дефектов. Каждая из групп была разделена на пациентов получавших только традиционную терапию, и пациентов получавших помимо традиционной терапии Актовегин. Результаты исследования показали: по сравнению с больными которым была назначена только традиционная терапия, у пациентов получавших Актовегин, на 3-4 суток раньше уменьшались размеры хронических ран, на 2-3 суток раньше снижался болевой синдром,. Вышеперечисленное позволяет рекомендовать Актовегин для лечения хронических ран различной этиологии.
Актуальность проблемы
Хронические раны представляют собой серьезную проблему для мирового здравоохранения на протяжении многих лет. Многие российские и зарубежные авторы занимались ее изучением, принимая различные определения этого понятия и предлагая множество методов лечения при данной патологии [1, 3, 6, 9]. Несмотря на массу научных трудов по этой тематике и сотни предложенных инновационных методов лечения, проблема лечения хронических ран и сейчас остро стоит перед хирургами во всем мире [2–4, 11, 12]. Ежегодные затраты на лечение хронических ран достигают 9 млрд долл. США и требуют массу времени и усилий медицинского персонала для организации длительного адекватного наблюдения за этой категорией пациентов [5, 6, 8, 10, 12].
В 1996 г. Европейское общество репарации тканей на специальном заседании приняло определение: «хронической следует считать рану, не заживающую в течение периода, который является нормальным для ран подобного типа или локализации». Отечественные авторы дополнили это определение и описывают хроническую рану как рану, репарация которой нарушена из-за неблагоприятных фоновых состояний. Понятие «хроническая рана» – очень широкое и включает также трофические язвы, хроническую анальную трещину и другие длительно не заживающие раневые дефекты. Причины, обусловливающие формирование хронических ран, также бывают весьма разнообразными. Хорошо изучены этиологические факторы, приводящие к развитию трофических язв. Они бывают венозными на фоне хронической лимфовенозной недостаточности, артериальными, при хронической ишемии нижних конечностей, на фоне диабетической полинейропатии, микро- и макроангиопатии, гипертоническими (синдром Марторелла), при системных заболеваниях (болезни крови, обмена веществ, коллагенозы, васкулиты), нейротрофическими, рубцово-трофическими; застойными (на фоне недостаточности кровообращения), пиогенными, специфическими и инфекционными, малигнизированными, при синдроме Лайелла, при врожденных пороках развития сосудистой системы, лучевыми, артифициальными [2, 3, 7]. Генез большинства хронических ран полиэтиологичен с вовлечением различных патогенетических механизмов, затрагивающих клеточный и тканевой метаболизм, микрососудистый эндотелий [7, 9, 11]. В связи с этим актуально применение терапевтических методик с использованием, в частности, фармакологических препаратов, влияющих на различные звенья патогенеза. Препарат Актовегин, обладающий плейотропными эффектами, показал свой терапевтический потенциал в отношении пациентов с сахарным диабетом и хронической ишемией нижних конечностей, сопровождающейся язвенно-некротическими осложнениями [1, 3, 4, 7]. С учетом вышесказанного целью нашей работы стала оценка эффектов препарата Актовегин в комплексном лечении хронических ран различной этиологии.

Материал и методы
Под нашим наблюдением находились 118 пациентов в возрасте от 52 до 80 лет, госпитализированных в отделение сосудистой хирургии и хирургии гнойных осложнений сахарного диабета ГКБ № 81. Все пациенты находились на лечении в связи с наличием хронических раневых дефектов. Больные были разделены по этиологическому фактору на три группы, включившие патологические состояния, вызывающие формирование 90% длительно незаживающих раневых дефектов. В 1-ю группу были включены 54 пациента, страдавших длительно незаживающими трофическими язвами нижних конечностей вследствие хронической венозной недостаточности. У всех пациентов при ультразвуковом дуплексном сканировании (УЗДС) вен нижних конечностей диагностирована несостоятельность клапанов подкожных вен и наличие длительно существующих (от 2 до 48 месяцев) незаживающих раневых дефектов в области нижней и средней третях голеней. Всем больным выполнено этиопатогенетическое лечение: после курса антибактериальной терапии с учетом микробного пейзажа и очистки раневых дефектов была проведена кроссэктомия в сочетании с операцией Линтона. В послеоперационном периоде больные были разделены по 27 пациентов на две группы – основную и контрольную, идентичные по полу, возрасту и тяжести сопутствующей патологии. Больным проведена медикаментозная терапия и местное лечение в полном объеме. Пациенты основной группы помимо традиционного лечения получали Актовегин внутривенно (1200 мг 1 раз в сутки в течение 14 дней) и местно в форме геля, мази или крема в зависимости от стадии раневого процесса:
- в стадии экссудации использован Актовегин 20% в форме геля толстым слоем с последующим наложением компресса с Актовегином 5% в форме мази;
- в стадии пролиферации использована повязка с Актовегином 5% в форме крема;
- в стадии грануляции применена повязка с Актовегином 5% в форме геля.
После выписки больным назначен препарат Актовегин по 1 таблетке (200 мг) 3 раза в сутки в течение 30 дней. В контрольной группе местное лечение осуществлено мазевыми повязками (Бетадин, метилурацил, Левосин).
Во 2-ю группу включены 36 пациентов с симптомами хронической артериальной ишемии нижних конечностей, а также длительно незаживающими раневыми дефектами на различных уровнях стоп на фоне облитерирующего атеросклероза и эндартериита. При УЗДС артерий нижних конечностей диагностированы окклюзии бедренно-подколенно-берцового сегмента на различных уровнях. Всем больным по показаниям выполнена коррекция магистрального кровотока: бедренно-дистальные шунтирования аутовенной или синтетическими протезами, проведена консервативная гемореологическая (реополиглюкин, декстран и т.д.), антикоагулянтная (гепарин, Плавикс, Вессел Дуэ Ф), дезагрегантная (пентоксифилин, ацетилсалициловая кислота) терапия в полном объеме. В послеоперационном периоде пациенты были разделены по 18 человек на основную и контрольную группы, идентичные по полу, возрасту и тяжести сопутствующей патологии. Больные основной группы помимо стандартного лечения получали Актовегин внутривенно 1200 мг 1 раз в сутки в течение 14 дней, а также местно в различной лекарственной форме в зависимости от стадии раневого процесса:
- в стадии экссудации использован Актовегин 20% в форме геля толстым слоем с последующим наложением компресса с Актовегином 5% в форме мази;
- в стадии пролиферации использована повязка с Актовегином 5% в форме крема;
- в стадии грануляции применена повязка с Актовегином 5% в форме геля.
После выписки Актовегин назначался по 1 таблетке (200 мг) 3 раза в сутки в течение 30 дней. В контрольной группе Актовегин не применялся, а местное лечение осуществлено раствором Бетадин, мазью Левомеколь, метилурациловой мазью.
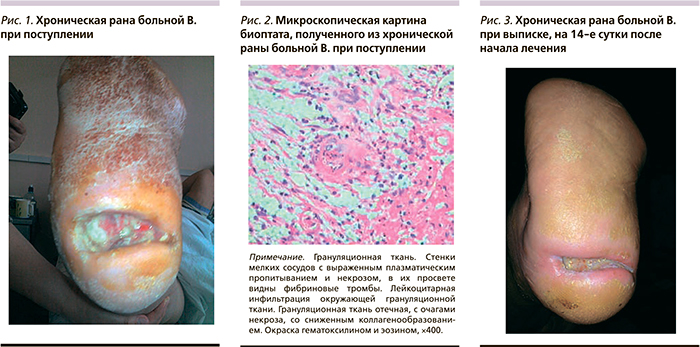
В 3-ю группу включены 28 пациентов, длительное время страдавших сахарным диабетом 2 типа, с клиническими признаками полинейропатии и длительно существующими раневыми дефектами нижних конечностей, не связанными с хронической артериальной или венозной недостаточностью. У этих пациентов проведены коррекция углеводного обмена (инсулинотерапия), местное лечение в объеме некрэктомии (по показаниям), гемореологическая и нейротропная терапия (Октолипен, Берлитион), ультразвуковая кавитация ран в регенерационном режиме через день, перевязки с гелем Hydrosorb, раствором Бетадин. Эти больные также были разделены по 14 человек на основную и контрольную группы, идентичные по полу, возрасту и тяжести сопутствующей патологии.
В основной группе больные помимо общепринятого лечения получали препарат Актовегин внутривенно 1200 мг 1 раз в сутки в течение 14 дней, а также местно в различной лекарственной форме в зависимости от стадии раневого процесса:
- в стадии экссудации использован Актовегин 20% в форме геля толстым слоем с последующим наложением компресса с Актовегином 5% в форме мази;
- в стадии пролиферации использована повязка с Актовегином 5% в форме крема;
- в стадии грануляции применена повязка с Актовегином 5% в форме геля.
После выписки Актовегин назначался по 1 таблетке (200 мг) 3 раза в сутки в течение 30 дней.
Во всех нозологических группах пациентов до и после курсов комплексной терапии произведен визуальный контроль ран по системе MEASURE [11], а также выполнены исследования микроциркуляции методом лазерной допплеровской флоуметрии. Датчик располагался в дне раневых дефектов. Помимо этого всем больным выполнено гистологическое исследование биоптатов из ран на протяжении всего срока стационарного лечения в динамике. Биоптаты фиксировали в 10%-ном нейтральном формалине и,по общепринятой методике заливали в парафиновые блоки. Изготовленные из парафиновых блоков гистологические срезы толщиной 4–5 мкм окрашивали гематоксилином и эозином.
Результаты и их обсуждение
У пациентов 1-й группы, проходивших лечение по поводу хронических ран, вызванных хронической венозной недостаточностью, уменьшение площади раневых дефектов (высчитывалась из линейных размеров ран) в основной группе отмечено на 4–5-е сутки, в контрольной группе – на 7–9-е послеоперационного периода.
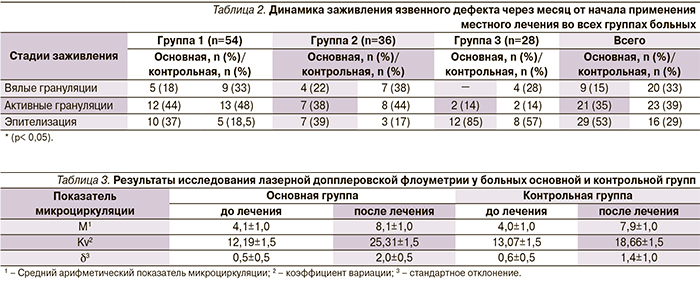
В обеих группах на 3–4-е сутки послеоперационного периода уменьшалось количество экссудата с умеренного до скудного, причем качественно экссудат оценивался нами как серозный или серозно-геморрагический. Дно ран было представлено грануляционной тканью в обеих группах. В основной группе болевой синдром значительно уменьшился на 2–3-е сутки послеоперационного периода, тогда как в контрольной группе его интенсивность уменьшилась лишь на 5–6-е сутки. Деструкции в ранах не наблюдалось в обеих группах. Эпителизация краев раны в основной группе наблюдалась на 3–4-е сутки, тогда как в контрольной группе – на 6–7-е. На момент выписки хронические раны полностью зажили у 10 (37%) пациентов основной группы и у 5 (18,5%) – контрольной. Через 3 недели после выписки раны зажили в основной группе у всех (100%) больных, в контрольной группе – у 15 (55,5%) пациентов.
У пациентов 3-й группы, проходивших лечение по поводу хронических ран, на фоне нейропатической формы синдрома диабетической стопы, уменьшение площади раневых дефектов в основной группе отмечено на 2–3-е сутки, в контрольной группе – на 4–5-е сутки после начала лечения. Количество экссудата уменьшалось с умеренного до скудного в основной группе на 1–2-е сутки, в контрольной группе – на 2–3-е сутки, причем качественно экссудат оценивался нами как серозно-геморрагический. Дно ран было представлено грануляционной тканью в обеих группах. В основной группе болевой синдром значительно уменьшился на 2–3-е сутки послеоперационного периода, тогда как в контрольной группе его интенсивность уменьшилась лишь на 5–6-е сутки. Деструкции в ранах не наблюдалось в обеих группах. Эпителизация краев раны в основной группе наблюдалась на 3–4-е и на 5–6-е сутки в контрольной группе. На момент выписки хронические раны полностью зажили у 12 (85%) пациентов основной группы и у 8 (57%) пациентов контрольной группы. В течение первых 3 недель после выписки раны зажили у всех пациентов основной группы (100%) и у 12 (85,7%) пациентов контрольной группы.
Особое внимание уделено динамике заживления язвенного дефекта в обследуемых группах как одному из важнейших показателей эффективности терапии. Результаты исследования показали, что при сочетании применения Актовегина для наружного использования и внутривенных инфузий через месяц от начала лечения эпителизация язвенного дефекта наблюдалась более чем у половины (53%) пациентов, что статистически достоверно.
При применении Актовегина наружно в виде геля, крема и мази средние сроки очищения ран от гнойных и некротических масс появление грануляций были в среднем меньше по сравнению со сроками в контрольных группах на 3–4-е суток (табл. 1). Через месяц от начала терапии у 29 пациентов основной группы и у 16 контрольной наблюдали эпителизацию язвенного дефекта. У 9 больных основной группы наблюдались вялые грануляции с отложениями фибрина, в контрольной группе – у 20 больных (табл. 2).
Результаты исследования микроциркуляции методом лазерной допплеровской флоуметрии представлены в табл. 3.
При гистологическом анализе биоптатов из ран после срока стационарного лечения у всех пациентов, получавших Актовегин, по сравнению с пациентами контрольных групп отмечалась нормализация процессов пролиферации и дифференцировки грануляционной ткани (коллагенообразования и новообразования сосудов), менее выраженная лейкоцитарная инфильтрация, активные процессы эпидермизации участков поражения кожи (рост эпителиального пласта на границе с грануляционной тканью).
В качестве иллюстрации эффектов комплексной терапии приводим клинический пример.
Пациентка В. 67 лет с синдромом «диабетическая стопа», нейропатией 2-й степени по Wagner, трофической язвой подошвенной поверхности резецированной правой стопы на фоне натоптыша в течение трех месяцев (рис. 1). Больная лечилась амбулаторно в поликлинике, по назначению хирурга применялись перевязки с мазью левомеколь в течение одного месяца без эффекта. Пациентка была направлена в отделение гнойной хирургии и гнойных осложнений сахарного диабета в плановом порядке. При обследовании: клинико-биохимические показатели в пределах нормы, при УЗДС артерий нижних конечностей окклюзия дистальных отделов передней и задней большеберцовой артерий.
В заключение стоит отметить, что назначение препарата Актовегин оказалось не случайным и обусловлено его фармакологическими свойствами: выраженным метаболическим и эндотелиопротекторным действиями на уровне микрососудистого русла. Актовегин улучшает коллатеральный кровоток, трофическое обеспечение кислородом тканей при их хронической ишемии, а также при сосудистых и нейропатических осложнениях сахарного диабета [1–3, 7]. Полученные результаты позволили сделать нам следующие выводы и рекомендации:
В комплексном лечении хронических ран ведущая роль принадлежит патогенетическому лечению.
Для лечения хронических ран различной этиологии применение Актовегина в составе комплексной терапии достоверно позволяет увеличивать ее эффективность. При применении Актовегина на 3–4 суток раньше уменьшаются размеры хронических ран, на 2-3 суток раньше снижается болевой синдром по сравнению с больными контрольной группы.
Назначение Актовегина позволяет достоверно улучшать микроциркуляцию в хронической ране (средний показатель микроциркуляции в среднем выше на 0,2 пФ в группе пациентов, получавших Актовегин).
Мы рекомендуем включать препарат Актовегин в схему комплексного лечения больных с хроническими ранами различной этиологии по следующей схеме: внутривенно по 1200 мг 1 раз в сутки в течение 14 дней. Далее переход на таблетированную форму: по 1 таблетке (200 мг) 3 раза в сутки в течение 30 дней.
Для местного лечения чистых хронических ран различной этиологии мы рекомендуем использовать Актовегин в форме геля 1 раз в сутки до полного заживления.
Литература
Об авторах / Для корреспонденции
М.Д. Дибиров – д.м.н., проф., зав. кафедрой хирургических болезней и клинической ангиологии ГБОУ ВПО МГМСУ им. А.И. Евдокимова Минздрава России, Москва; заслуженный деятель науки РФ, заслуженный врач РФ
Р.У. Гаджимурадов – д.м.н., проф. кафедры хирургических болезней и клинической ангиологии ГБОУ ВПО МГМСУ им. А.И. Евдокимова Минздрава России, врач сердечно-сосудистый хирург ГКБ №81 ДЗ Москвы
О.Х. Халидов – д.м.н., проф. кафедры хирургических болезней и клинической ангиологии ГБОУ ВПО МГМСУ им. А.И. Евдокимова Минздрава России, зам. глав.врача по хирургии ГКБ №81 ДЗ Москвы
М.Р. Какубава – к.м.н., ассистент кафедры хирургических болезней и клинической ангиологии ГБОУ ВПО МГМСУ им. А.И. Евдокимова Минздрава России, врач-хирург отделения гнойной хирургии ГКБ №81 ДЗ Москвы
М.В. Полянский – ГБОУ ВПО МГМСУ им. А.И. Евдокимова Минздрава России, ГКБ №81 ДЗ Москвы
Для цитирования: Учкин И.Г., Мосесов А.Г., Цырульников А.А. Актовегин как компонент комплексной терапии осложненных форм хронической венозной недостаточности нижних конечностей. РМЖ. 2007;12:981.
Хроническая венозная недостаточность (ХВН) нижних конечностей чрезвычайно распространена в современном мире. В России различными ее формами страдают более 35 млн человек, причем у 15% из них имеются трофические изменения кожи, открытые или рецидивирующие трофические язвы [8]. ХВН с проявлениями трофических расстройств, как следствие тромбоза вен нижних конечностей, является причиной длительной нетрудоспособности и инвалидности лиц наиболее трудоспособного возраста.
Литература
1. Абакумов О.Ю., Цветкова Т.А., Щехтер А.Б. Воздействие экзогенного оксида азота на клеточные культуры фибробластов и клеток невриномы. Мат. Научно – практической конференции NO– терапия, Москва, 2001, с.40–43
2. Айтаков Э.Н. Аутодермопластика, как один из методов амбулаторного лечения трофических язв нижних конечностей. Мат. 13–ой Международной конференции Российского общества ангиологов и сосудистых хирургов. Ростов–на–Дону, 2002, С. 3
3. Анисимов В.Н. Шульц А.А. Комплекс лечебных мероприятий у больных хронической венозной недостаточностью нижних конечностей III степени. Мат. 13–ой Международной конференции Российского общества ангиологов и сосудистых хирургов. Ростов–на–Дону, 2002, С. 8
4. Костеноко И. Г. Гемодинамическая характеристика заболеваний сосудов системы нижей полой вены. Автореф. Дис. д–ра мед. наук. – М.,1979.
5. Марков Х.М. Вест. РАМН, 1996, №7, С. 73–77
6. Савельев В.С. Флебология. Руководство для врачей. М., 2001
7. Сатюкова Г.С., Кургузов О.П. Изменения микроциркуляции и возможности их коррекции у людей при варикозной болезни и посттромботическим синдромом. Морфология. М., 2000, №5, С. 29–35
8. Яблоков Е.Г., Кириенко А.И., Богачев В.Ю. Хроническая венозная недостаточность. М., 1999, 126 с.
9. European Venous Forum. Scientific Program and book of Abstracts. Edizioni Minerva Medica.Turin. 2002
10. Handbook of venous disordes. 2th Edition. Guidelines of the American Venous Forum. 2001; C. 557
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Хроническая венозная недостаточность (ХВН) нижних конечностей чрезвычайно распространена в современном мире. В России различными ее формами страдают более 35 млн человек, причем у 15% из них имеются трофические изменения кожи, открытые или рецидивирующие трофические язвы [8]. ХВН с проявлениями трофических расстройств, как следствие тромбоза вен нижних конечностей, является причиной длительной нетрудоспособности и инвалидности лиц наиболее трудоспособного возраста.
Конечной мишенью патофизиологических расстройств при ХВН являются изменения в микроциркуляторном русле. Ряд клинических тестов (лазерная флоуметрия, измерение интерстициального давления, капилляроскопия, микролимфография) подтверждают их наличие в той или иной степени выраженности [1,3,9].
Изучение основных молекулярных и клеточных механизмов формирования ХВН важно с точки зрения разработки патогенетически обоснованных программ профилактики и лечения этого патологического состояния [2].
Основополагающим моментом в лечении осложненных форм ХВН является комплексный подход, этапность и правильный выбор лекарственного средства соответственно стадии раневого процесса. Этапность лечения предусматривает санацию и/или закрытие язвы, после чего возможно хирургическое вмешательство [4,11].
В предоперационной подготовке и послеоперационной реабилитации, а также в качестве самостоятельного вида лечения придается большое значение методам консервативной терапии, оказывающим положительное воздействие на нормализацию микроциркуляторных процессов в тканях [7].
Расширяется спектр лекарственных препаратов для системной фармакотерапии, оказывающих флеботонизирующее и ангиопротективное действие, нормализующих проницаемость каппиляров, укрепляющих сосудистую стенку, уменьшающих агрегацию тромбоцитов [8].
Для местного лечения флебостатических трофических язв нижних конечностей пациентам назначаются биологически активные перевязочные средства: сорбционно–аппликационная терапия с биологически активными сорбентами, гелевыми повязками с антимикробным, обезболивающим и протеолитическим действием, используются биологически активные стимулирующие покрытия со специфическим воздействием на процессы регенерации, эпитализации [5].
В настоящем исследовании пациентам назначали препарат Актовегин в виде геля, мази и крема на различных стадиях заживления раневого процесса.
Актовегин является гемодериватом крови телят, полученным посредством диализа и ультрафильтрации. Препарат вызывает увеличение утилизации и потребления кислорода, повышает энергетический метаболизм и потребление глюкозы. Суммарный эффект всех этих процессов заключается в усилении энергетического состояния клетки, особенно в условиях исходной ее недостаточности. Таким образом, препарат Актовегин, обладая вышеуказанным механизмом действия, способствует ускорению заживления ран, что делает оправданным его применение у пациентов с осложненными формами ХВННК.
Благодаря уникальному механизму действия, Актовегин обеспечивает клиническую эффективность в условиях временно индуцированного стресса и гипоксии тканей у пациентов с ХВН. Являясь мощным антигипоксантом, способствующим активации метаболизма глюкозы и кислорода, Актовегин в виде раствора для внутривенных инфузий используется в качестве препарата для системной фармакотерапии пациентов с осложненными формами ХВННК в настоящем исследовании.
Материалы и методы исследования
Всего обследовали и наблюдали в динамике на фоне лечения 55 пациентов с осложненными формами ХВННК. Все пациенты были рандомизированы на 3 основные группы (табл. 1). В лечении 22 больных (I группа) применялись:
- гидрофильные мази с антимикробным и/или противовоспалительным действием: метилурацил, левомеколь и диоксиколь;
- препарат венотонизирующего и ангиопротективного действия диосмин в дозе 1000 мг/сут.;
- внутривенные инфузии: реополиглюкин 200 мл 10% раствора + 100 мг (5 мл) пентоксифиллина 1 раз в сутки в течение 10 дней.
22 пациентам (II группа) для местного лечения применяли препарат Актовегин по схеме:
- в стадии экссудации использовали Актовегин гель 20% толстым слоем с последующим наложением компресса с Актовегином – 5%–й мазью;
- в стадии пролиферации использовали повязку с Актовегином – 5%–м кремом;
- в стадии грануляции применяли повязку с Актовегином – 5%–м гелем.
Замену повязки осуществляли 1 раз в сутки.
Таблица 1. Характеристика методов лечения
| Группа I (n=22) | Группа II (n=22) | Группа III (n=11) | ||
| Местное лечение (наложение повязок на трофическую язву) | Метилурацил левомеколь диоксиколь | Актовегин 20% гель 5% крем 5% мазь | Актовегин 20% гель 5% крем 5% мазь | |
| Системная фармакотерапия | Таблетированные препараты | Диосмин | Диосмин | Диосмин |
| Внутривенные инфузии | Реополиглюкин Пентоксифиллин | Реополиглюкин Пентоксифиллин | Реополиглюкин Пентоксифиллин Актовегин | |
В лечении 11 пациентов (III группа) наряду с местным применением Актовегина использовали сочетание терапии реополиглюкином, пентоксифиллином и 20%–м раствором Актовегина по 250 мл ежедневно в течение 10 дней.
В исследование включили больных с осложненными формами ХВН как на фоне варикозной болезни, так и с посттромбофлебитическим синдромом. Верификация диагноза осуществлялась согласно клинической международной классификации (система СЕАР): все пациенты имели 4, 5 или 6 стадии ХВННК.
Локализация трофических язв практически у всех пациентов была типичной – нижняя треть голени. Анамнез заболевания ХВННК составил от 6 до 25 лет (средний – 15 лет). Срок появления трофических изменений на коже голени до момента госпитализации колебался от 1 до 36 месяцев. Размер язв – от 2 до 7 см в диаметре.
38 (70%) пациентов имели сопутствующую патологию, по поводу которой получали подобранную симптоматическую и патогенетическую терапию.
Состояние пациентов во всех группах, давность основного заболевания, а также тяжесть трофических дефектов были сходными.
Методы оценки эффективности лечения
Для оценки эффективности проводимой терапии анализировали динамику клинических, инструментальных и лабораторных показателей, отражающих активность заболевания и состояние микроциркуляторного русла через 1 месяц от начала наблюдения.
Клинические, лабораторные и инструментальные показатели исследовались в динамике с целью сравнения течения заболевания и оценки влияния применяемых схем терапии на состояние микроциркуляторного русла (табл. 2).
Таблица 2. Лабораторно–инструментальные методы обследования пациентов
| Лабораторные методы | Инструментальные методы | |
| Оценка состояния микроциркуляторного русла | 1. Определение вязкости крови, плазмы и суспензии эритроцитов 2. Определение индекса ригидности эритроцитов (метод L. Dintenfass) 3. Определение агрегации эритроцитов 4. Определение уровня фибриногена и белковых фракций | Лазерная допплерфлоуметрия |
| Другие методы определения эффективности терапии | 1. Бактериологическое исследование отпечатков с трофической язвы 2. Цитологическое исследование раневого экссудата 3. Фотохемолюминисценция смывов с трофических язв для определения фагоцитарной активности макрофагов | Ультразвуковое дуплексное сканирование |
Клинические параметры оценки эффективности лечения:
- наличие отека, болевого синдрома, ограничение физической активности;
- сроки заживления язвенного дефекта: формирование грануляционной ткани и/или эпителизация трофических дефектов.
Для оценки эффективности воздействия проводимого лечения на состояние микроциркуляторного русла пациентам было выполнено исследование вязкости крови. Исследование проводилось на базе независимого лабораторного комплекса «INVITRO» (Москва).
Метод лазерной допплерофлоуметрии представлял собой исследование с помощью аппарата BLF–21 фирмы Transonic Systems Inc.
Всем больным было выполнено ультразвуковое дуплексное сканирование (УЗДС) вен нижних конечностей. При дуплексном сканировании оценивали проходимость глубоких вен, наличие или отсутствие недостаточности клапанного аппарата глубоких и коммуникантных вен нижних конечностей.
Всем пациентам было выполнено бактериологическое и цитологическое исследование содержимого язв с определением уровня микробной обсемененности и чувствительности флоры к антибиотикам.
Фагоцитарная активность макрофагов оценивалась методом фотохемолюминисценции в камере «Macintosh». Культуру макрофагов получали методом центрифугирования смывов с трофических язв.
Результаты исследования
Известно, что клиническая картина ХВННК может быть весьма вариабельна. В исследовании оценивали динамику наиболее типичных клинических синдромов:
- наличие и/или уменьшение отека дистальных отделов нижних конечностей;
- синдром «тяжелых ног» (боли, тяжесть, утомляемость конечности).
Результаты, полученные при анализе жалоб пациентов и данных осмотра через 1 месяц от момента первого наблюдения, представлены в таблицах 3 и 4.
Таблица 3. Динамика уменьшения отечного синдрома через 1 месяц от момента первого наблюдения
| Группы пациентов | Первое наблюдение | Через 1 месяц | |
| Пациенты с клинически выраженным отечным синдромом (%) | Группа I (n=22) | 79% | 50%* |
| Группа II (n=22) | 78,3% | 49%8* | |
| Группа III (n=11) | 76,7%* | 37,2%* |
Таблица 4. Динамика уменьшения синдрома «тяжелых ног» через 1 месяц от момента первого наблюдения
| Группы пациентов | Первое наблюдение | Через 1 месяц | |
| Пациенты с клинически выраженным синдромом «тяжелых ног» (%) | Группа I (n=22) | 94% | 45%* |
| Группа II (n=22) | 97,1% | 47%* | |
| Группа III (n=11) | 96,3%* | 24%* |
При анализе результатов исследований большое внимание было уделено наиболее типичным клиническим синдромам. Выявлено, что в I и II группах количество пациентов с отечным синдромом через 1 месяц от начала наблюдения уменьшилось, причем это уменьшение было статистически значимым. Однако при введении в комплекс лечебных мероприятий внутривенных инфузий Актовегина (группа III), наблюдали более выраженное уменьшение количества пациентов с отечным синдромом через 1 месяц (более чем в 2 раза), что достоверно отличалось от показателей в группах I и II.
Похожие данные получены в отношении динамики течения синдрома «тяжелых ног»: в I и II группах наблюдали достоверное уменьшение и купирование синдрома через 1 месяц от начала лечения (45 и 47% соответственно). В III группе лишь 24% пациента отмечали проявления синдрома «тяжелых ног», то есть количество пациентов с таким синдромом уменьшилось почти в 4 раза.
Особое внимание уделялось динамике заживления язвенного дефекта в обследуемых группах как одному из важнейших показателей эффективности терапии (рис. 1). Результаты исследования показали, что при использовании Актовегина наружно в виде геля, крема и мази средние сроки очищения ран от гнойных и некротических масс, появление грануляций были значительно меньше (в среднем на 3 суток) (табл. 5).

Рис. 1. Динамика заживления язвенного дефекта – распределение в группах пациентов
Таблица 5. Сроки очищения ран от гнойно–некротических масс
| № | Препараты для наружного применения | Количество больных | Средние сроки (сутки) М±m | ||
| Очищение | Грануляции | Краевая эпителизация | |||
| 1 | Левомеколь, диоксиколь | 22 | 6,3±0,8 | 6,9±0,8 | 7,3±0,9 |
| 2 | Актовегин | 33 | 3,5±0,9* | 4,6±1,2* | 4,6±0,9* |
Через 1 месяц от начала терапии у 17 пациентов наблюдали эпителизацию язвенного дефекта (табл. 6). При этом 13 пациентов были из групп, где в лечении применяли Актовегин в виде геля, крема и мази (группы II III). У 19 больных наблюдались вялые грануляции с отложениями фибрина, причем 11 были из группы I.
Таблица 6. Динамика заживления язвенного дефекта через 1 месяц
| Стадии заживления | Группа I (n=22) | Группа II (n=22) | Группа III (n=11) | Всего |
| Вялые грануляции, фибрин | 11 (50%)* | 6 (27,3%) | 2 (18,2%)* | 19 |
| Активные грануляции | 7 (31,8%) | 9 (40,9%) | 3 (27,3%) | 19 |
| Эпителизация | 4 (18,4%)* | 7 (31,8%)* | 6 (54,5%)* | 17 |
При анализе результатов исследования выявили, что при сочетании наружного применения препаратов Актовегина и внутривенных инфузий Актовегина через 1 месяц от начала лечения эпителизация язвенного дефекта наблюдается более чем у половины пациентов (54,5%), что статистически достоверно.
При анализе результатов бактериологического исследования было выявлено, что до начала лечения все больные имели высокий уровень загрязнения ран (Ig KOE ~ 7,04), микробная флора отличалась разнообразием представителей: S. Aureus, S. Epidermidis, E. Coli, Enterobacter sp., P. Aerugiinosa. и др. При контрольных бактериологических посевах из ран на 5–7–е сутки в группах II, III (33 человека) было отмечено статистически достоверное снижение уровня микробной обсемененности (p≤0,05) (табл. 7).
Таблица 7. Динамика микробной обсемененности в группах
| Первичное обследование | 4 сутки | Через 1 месяц | |
| КОЕ | 1×10 7 * | 9×10 5 | 2×10 5 * |
| Lg КОЕ | 7,04* | 5,09 | 5,03* |
Цитологическое изучение отделяемого из ран до начала лечения выявило преобладание дистрофически–воспалительных типов цитограмм: большое количество свободно лежащей и внутриклеточной микрофлоры (кокковой и палочковой), преобладание нейтрофилов с признаками дистрофии и распада, незавершенный и патологический фагоцитоз микробов. На 3–4–е сутки после начала лечения препаратами Актовегина усиливался фагоцитоз, уменьшалось содержание микрофлоры, распадающихся нейтрофилов. Через 7–14 суток значительно уменьшалась или исчезала микрофлора, появлялись и нарастали активные фагоцитирующие макрофаги и фибропластические клетки (цитограмма воспалительно–репаративного типа). К 21–м суткам признаки репарации (макрофаги, фибробласты и эпителий) в цитограммах еще более усиливались (цитограмма репаративного типа). В группе I динамика этих показателей была замедлена: уменьшение микрофлоры, появление макрофагов и отдельных фибробластов наблюдалась только к 14–21–м суткам.
Таким образом, цитологическое исследование свидетельствует о том, что использование Актовегина ведет к более раннему очищению трофических язв от инфекции и некротического детрита, усилению фагоцитоза, ускорению макрофагальной и фибропластической реакции, т.е. интенсификации раневого процесса.
Через 1 месяц от начала лечения в группе I и II существенного изменения показателей реологического состояния крови не произошло, в то время как в группе III, пациентам которой назначали ежедневные внутривенные инфузии Актовегина, наблюдали достоверное уменьшение всех параметров вязкости крови (вязкость крови на низких скоростях сдвига –ВК–, вязкость крови на высоких скоростях сдвига –ВК–, вязкость суспензии эритроцитов, индекс ригидности эритроцитов –Tk), из чего можно заключить, что Актовегин в виде раствора для внутривенного введения является эффективным компонентом комплексной терапии больных с осложненными формами ХВННК.
При анализе данных лазерной допплерофлоуметрии, используемой для оценки микроциркуляции, выявлено достоверное снижение показателя микроциркуляции (ПМ) к 7–м суткам на фоне дополнительного назначения Актовегина внутривенно (группа III), что свидетельствовало о спаде пика воспалительной реакции микрососудов и улучшении венозного оттока.
К 21–м суткам значение ПМ у пациентов группы III приближалось к значениям показателей симметричных участков голени здоровой конечности (3,8–3,9 пер. ед), что демонстрировало восстановление автономных регуляторных механизмов в системе микроциркуляции кожи. Клинически в это время наблюдали процесс эпителизации язвы.
Таким образом, в настоящем исследовании положительное воздействие препарата Актовегин на микроциркуляторные процессы в тканях было подтверждено путем оценки эффективности терапии пациентов с осложненными формами ХВНК.
Авторы: Акименко А.Б. , Бобровников А.Э. , Максимов М.Л. 1, 2, 3
1 ФГБОУ ДПО РМАНПО Минздрава России, Москва, Россия
2 КГМА — филиал ФГБОУ ДПО РМАНПО Минздрава России, Казань, Россия
3 РНИМУ им. Н.И. Пирогова Минздрава России, Москва, Россия
Для цитирования: Акименко А.Б., Бобровников А.Э., Максимов М.Л. Лечение ХВН и трофических язв. Возможности применения Актовегина в амбулаторной практике. РМЖ. 2014;30:2140.
Среди причин, приводящих к развитию трофических язв нижних конечностей, по данным эпидемиологических исследований, наиболее часто встречается хроническая венозная недостаточность (ХВН) – более 50%. Варикозное расширение вен – довольно распространенное заболевание. В наши дни ХВН страдают каждая третья женщина и каждый десятый мужчина, наиболее часто заболевание начинается в 30–40 лет. Трофические нарушения на фоне ХВН являются причиной длительной нетрудоспособности и инвалидности лиц наиболее активного и трудоспособного возраста.
В последнее время регистрируется рост числа заболеваний периферической венозной системы нижних конечностей не только в нашей стране, но и за ее пределами. По данным XIII Международного конгресса флебологов, патологией вен страдают около 35% трудоспособного населения и свыше 50% населения пенсионного возраста. В нашей стране ХВН наблюдается примерно у 38 млн человек, причем у каждого четвертого – осложненная форма заболевания. Примерно 1–2 млн человек в России являются инвалидами из-за варикозной болезни, а от тромботических осложнений, связанных с венозной недостаточностью, ежегодно умирает 5–6 тыс. человек. Только в г. Москве, по данным Ассоциации флебологов, с этой патологией сталкивается 67% активно работающего населения. Трофические язвы характеризуются низкой склонностью к заживлению, частыми рецидивами, сложностью и высокой стоимостью лечения. Сопровождаясь выраженным болевым синдромом, они обрекают пациентов на длительные, часто многолетние страдания [1–5].
Независимо от причины ХВН в основе патогенеза трофических язв лежат нарушения трофики и защитных свойств кожи, развивающиеся вследствие тканевой гипоксии на фоне патологических рефлюксов. В результате застоя крови в поверхностных венах давление на стенки сосудов увеличивается, и происходит расширение вены, что, в свою очередь, дополнительно способствует застою крови. Ведущим патогенетическим механизмом нарушений микроциркуляции при ХВН является флебогипертензия, что приводит к росту посткапиллярного сопротивления и повышению капиллярного давления. При повышении давления в капиллярах выше 50 мм рт. ст. наблюдается выход из капилляров в интерстициальное пространство крупномолекулярных веществ, которые обладают высоким коллоидно-осмотическим потенциалом. У пациентов с ХВН наличие повышенной проницаемости капилляров отмечается уже на ранних стадиях заболевания, когда характерные морфологические изменения капилляров (расширение, штопорообразная извитость) еще не выражены. При дальнейшем прогрессировании венозной недостаточности происходит истощение компенсаторных механизмов, развиваются грубые нарушения структуры и проницаемости капилляров с нарастанием тканевого отека, уменьшается количество функционирующих капилляров и снижается напряжение кислорода в коже. Все это в итоге приводит к развитию трофических нарушений. В области трофических расстройств отмечается выраженное снижение напряжения кислорода, на этом фоне отмечается повышение уровня перфузии в 3–5 раз. Наличие артериоло-венулярных шунтов в конечном итоге приводит к нарушению транскапиллярного обмена, усугублению микроциркуляторных расстройств с развитием трофических нарушений при ХВН нижних конечностей. Последующая травматизация и бактериальная контаминация кожи приводят к быстрому прогрессированию воспаления и некрозу (рис. 1) [6–13].
В результате нарушений периферической циркуляции крови в конечностях на первый план выходит нарушение функции эндотелия микрососудов, которое проявляется повышенной проницаемостью капилляров уже на ранних стадиях патологии. Являясь единственным видом клеток в человеческом организме, которые непосредственно контактируют с кровью, эндотелий первым принимает на себя удар от всех видов повреждающих агентов (химической или биологической природы), которые тем или иным способом попадают в сосудистое русло (дыхательная система или пищеварительный тракт, непосредственно в/в или трансдермально). Микроциркуляторное русло благодаря большому количеству различных регуляторных механизмов обладает большим запасом прочности и на протяжении длительного времени компенсирует развивающиеся нарушения гемодинамики, поддерживая трофическое обеспечение кожи на достаточном уровне. Но при дальнейшем прогрессировании патологии компенсаторные механизмы системы микроциркуляции истощаются, а развивающиеся трофические нарушения кожи выходят на первый план, что требует активного и чаще всего хирургического лечения. Но хирурги недаром говорят, что самой эффективной операцией является та, которой удалось избежать, поэтому вопрос о медикаментозной коррекции развивающихся нарушений очень важен [6].
В лечении трофических язв всегда необходим комплексный подход, направленный прежде всего на устранение основной причины – заболевания, вызвавшего появление язвы. Иначе в каждом третьем случае не удается полностью заживить язву, а в каждом втором случае после выписки больного из стационара наблюдается рецидив. Основы лечения венозных трофических язв: коррекция патологического рефлюкса, устранение тканевой гипоксии, применение средств, улучшающих микроциркуляцию, использование компрессионной терапии и методов местного лечения. Помимо устранения патологического рефлюкса венозной крови, удаления варикозных вен и восстановления функции «мышечного насоса» голени в настоящее время в арсенале хирургов имеется ряд операций, позволяющих предотвратить развитие клапанной недостаточности или восстановить функцию клапанных синусов и тем самым остановить дальнейшее развитие болезни или уменьшить ее клинические проявления. Органосохраняющие, мини-инвазивные операции, а также интраоперационная склеротерапия дают хороший косметический результат.
Внедрение в практику эндоскопической хирургии позволяет значительно уменьшить операционную травму и избежать осложнений в случаях декомпенсированной ХВН, осложненной дерматитом, целлюлитом и трофической язвой. Сложилось превратное представление о низкой эффективности оперативного лечения варикозной болезни. Рецидивы варикозного расширения вен возникают, по данным различных авторов, в 20–50% случаев. Наши собственные наблюдения позволили убедиться, что основной причиной возникновения рецидивов болезни является выполнение операций в стационарах общехирургического профиля, где хирурги недостаточно знакомы с анатомическими особенностями венозной системы, патогенезом варикозной болезни, что приводит к техническим и тактическим ошибкам, и только 5–7% связаны с дальнейшим развитием болезни [1, 3].
Медикаментозное лечение ХВН включает: флеботоники и ангиопротекторы (например, диосмин + гесперидин); дезагреганты (пентоксифиллин, дипиридамол), противовоспалительные препараты (диклофенак), топические препараты местного применения (гепарин натрий, цинка гиалуронат), антикоагулянты (гепарин, надропарин кальций). C учетом нарастающей гипоксии и нарушений на уровне микроциркуляции важное место занимают препараты, влияющие на метаболизм и улучшающие функцию эндотелия (Актовегин).
Одним из медикаментозных препаратов, который позволяет компенсировать нарушения микроциркуляции при заболеваниях сосудистого русла нижних конечностей различной этиологии, является Актовегин – препарат, который за более чем полувековую историю применения доказал свою высокую метаболическую эффективность. Применение Актовегина способствует развитию коллатерального кровотока и улучшению трофического обеспечения тканей при хронической ишемии нижних конечностей, трофических нарушениях венозной этиологии, а также сосудистых и нейропатических осложнениях сахарного диабета. Клиническая эффективность Актовегина обусловлена его выраженным эндотелиопротекторным действием именно на уровне микрососудистого русла. Через 2 ч после окончания в/в инфузии Актовегина отмечаетюя существенное увеличение вазомоторной активности прекапиллярных артериол и скорости капиллярного кровотока, уменьшение количества элементов артериоло-венулярного шунтирования и снижение степени гидратации (отека) интерстициального пространства. Также отмечены увеличение вазомоторной активности прекапиллярных артериол за счет усиленной выработки эндотелием оксида азота, повышение непосредственно обменной функции эндотелия, проявляющееся в увеличении поступления кислорода в ткани [6, 14–22].
Актовегин представляет собой депротеинизированный гемодериват, получаемый посредством диализа и ультрафильтрации гомогената, которые обеспечивают наличие в препарате только соединений с молекулярной массой менее 5000 дальтон. Препарат содержит более 200 активных компонентов, в числе которых пептиды, аминокислоты, нуклеозиды, липиды, олигосахариды, а также неорганические электролиты и микроэлементы. Активная фракция Актовегина обладает инсулиноподобным действием: увеличивает поступление глюкозы в клетки, активирует процессы аэробного и анаэробного окисления глюкозы, повышает обмен высокоэнергетических фосфатов (аденозинтрифосфата (АТФ), аденозиндифосфата (АДФ), фосфокреатина). Предположительно анаболическое и энергетическое действие компонентов Актовегина опосредовано воздействием на пострецепторные механизмы действия инсулина: активируя пируват-дегидрогеназу, участвующую в метаболическом каскаде окисления глюкозы, он увеличивает утилизацию глюкозы клетками. Под действием Актовегина в клетке возрастает аэробное окисление глюкозы, которое является наиболее энергетически выгодным, активируются ферменты окислительного фосфорилирования (сукцинатдегидрогеназа, цитохром С-оксидаза), ускоряется процесс распада продуктов анаэробного гликолиза (лактата, гидроксибитурата). В эксперименте с применением хроматографических методов было показано, что под влиянием Актовегина биосинтез липидов может возрасти в 5 раз. Препарат увеличивает потребление кислорода тканями, повышает устойчивость к гипоксии. Под его влиянием значительно улучшаются диффузия и утилизация кислорода в нейрональных структурах. Кроме того, Актовегин обладает выраженными антиоксидантными свойствами [1, 23–25].
В одном из проведенных исследований по оценке эффективности применения препарата Актовегин (ранее Nycomed, сейчас Takeda) при лечении трофических язв нижних конечностей венозной этиологии были включены 30 больных с 40 трофическими язвами нижних конечностей (18 женщин, 12 мужчин). Методика лечения трофических язв в 1-й группе заключалась в назначении препарата Актовегин в дозе 5 мл (200 мг) в/м 1 р./сут курсом 25 сут с последующим применением Актовегина внутрь по 1 таблетке (200 мг) 3 р./сут в течение 30 дней. Местно применялись стерильные повязки с гелем Актовегин на 2-й (грануляционной) стадии и 5% мазь Актовегин на стадии эпителизации. Комплексное применение препарата (ампулированная форма + таблетированная + местные формы) позволило достичь отличного результата. Актовегин в лечении трофических язв венозной этиологии продемонстрировал эффективность, способствовал объективному улучшению течения раневого процесса. Это выражалось в уменьшении размеров язвы, уменьшении или исчезновении болевых ощущений при перевязках и вне их. Время достижения стадии эпителизации язвенной поверхности составило 11,1±3,9 дня (от 6 до 16 дней). К этому времени вся язвенная поверхность была покрыта чистыми ярко-красными сочными грануляциями с высокой адгезивностью. Заживление варикозных трофических язв в 1-й группе было достигнуто у 100% пациентов с ХВН. Побочных эффектов, таких как аллергические общие и местные реакции, при использовании Актовегина не наблюдалось, препарат хорошо переносился пациентами [1, 24].
В другом исследовании пациентам назначали препарат Актовегин в виде геля, мази и крема на различных стадиях заживления раневого процесса. Было отмечено, что препарат вызывает увеличение утилизации и потребления кислорода, повышает энергетический метаболизм и потребление глюкозы. Суммарный эффект всех этих процессов заключается в улучшении энергетического состояния клетки, особенно в условиях ее исходной недостаточности. Актовегин способствует ускорению заживления ран, что делает оправданным его применение у пациентов с осложненными формами ХВН нижних конечностей. Благодаря уникальному механизму действия Актовегин обеспечивает клиническую эффективность в условиях временно индуцированного стресса и гипоксии тканей у пациентов с ХВН. Являясь мощным антигипоксантом, способствующим активации метаболизма глюкозы и кислорода, Актовегин в виде раствора для в/в инфузий использовался в качестве препарата для системной фармакотерапии у пациентов как с начальными трофическими нарушениями, так и с осложненными формами ХВН. Применение Актовегина в/в в сочетании с другими препаратами для системной фармакотерапии способствовало купированию отечно-болевого синдрома у половины пациентов через 1 мес. от начала лечения. Дополнительное назначение инфузий Актовегина как компонента системной фармакотерапии способствует улучшению гемореологии: снижению показателей вязкости крови и улучшению микроциркуляторных параметров. Согласно результатам исследования, препарат Актовегин рекомендуется для лечения пациентов с начальными трофическими нарушениями и осложненными формами ХВН нижних конечностей по следующей схеме: 20% раствор Актовегина по 250 мл ежедневно в течение 10 дней + местное лечение трофических язв – Актовегин гель 20% толстым слоем с последующим наложением компресса с 5% мазью Актовегина (7–10 дней с ежедневной сменой повязки) [26].
Среди лекарственных препаратов местного применения Актовегин выделяют за счет его уникальных механизмов, делающих его незаменимым при лечении хронических ран и трофических язв. Актовегин повышает толерантность клеток к дефициту кислорода, что актуально в условиях нарушенной микроциркуляции, а также способствует оптимизации утилизации глюкозы и увеличению энергетических ресурсов клеток. Этот факт подтверждает повышение концентрации макроэргических молекул, таких как АТФ, АДФ, фосфокреатин, а также ряда аминокислот (глутамата, аспартата, γ-аминомасляной кислоты и др.). Актовегин увеличивает митотическую активность клеток, а также ускоряет синтез важного компонента соединительной ткани – гидроксипролина. Местные терапевтические эффекты Актовегина могут быть потенцированы за счет сопутствующего применения его системных форм [27].
По опыту наблюдения 762 пациентов с различными классами ХВН на фоне варикозной болезни за период 2007–2010 гг. было показано, что основой лечения ХВН является компрессионная терапия в сочетании с назначением флеботропных препаратов, в т. ч. препаратов, улучшающих метаболизм. Одна из эффективных схем лечения ХВН включает курс в/в инфузий 10% раствора Актовегина 250 мл № 15, затем прием таблетированной формы Актовегина – по 1 таблетке 3 р./сут на протяжении 45 дней. Такая схема эффективна и характеризуется хорошей переносимостью и безопасностью [28].
Эффективность Актовегина, помимо его применения в лечении трофических язв и ХВН, показана в лечении целого ряда заболеваний, таких как ишемический инсульт, черепно-мозговая травма, хронические энцефалопатии различного генеза, неврологические осложнения сахарного диабета и др., и подтверждена многочисленными клиническими исследованиями.
Таким образом, Актовегин обладает комплексным механизмом действия при ишемии, значительно улучшает функциональное состояние клеток и повышает их шансы на выживание в условиях недостаточного кровоснабжения, оказывает комплексное метаболическое действие, улучшает работу внутриклеточных ферментных систем, усиливает синтетические процессы. В результате улучшается регенерация тканей, ускоряются процессы дифференцировки клеток и репарации повреждений, нормализуются функции тканей и органов. Актовегин рекомендуется применять при периферических (артериальных и венозных) сосудистых нарушениях и их последствиях (артериальная ангиопатия, трофические язвы), а также для заживления ран (язвы различной этиологии, ожоги, трофические нарушения (пролежни), нарушение процессов заживления ран).

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Читайте также:

