Как лечить сепсис при ожогах
Обновлено: 24.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Ожоги: причины появления, симптомы, диагностика и способы лечения.
Определение
Ожоги - это травмы, возникающие в результате высокотемпературного, химического, электрического или радиационного воздействия, которое повреждает кожу и подлежащие ткани. Ингаляционной травмой называют повреждение слизистой оболочки дыхательных путей и/или легочной ткани за счет воздействия термических и/или токсикохимических факторов.
Причины появления ожогов
К наиболее частым относят термические ожоги, которые связаны с воздействием высоких температур. Обычно это ожоги горячими жидкостями и паром, реже – открытым пламенем. Контактные термические ожоги развиваются при контакте с горячими предметами или веществами, например, раскаленным металлом, горячей смолой, битумом, асфальтом и т.д.
Химические ожоги возникают вследствие агрессивного воздействия на кожу или слизистые оболочки химических веществ. Кроме ожогов эти вещества вызывают и другие поражения кожи - контактные дерматиты и экземы.
Электротравма (травма в результате действия на организм электрического тока) также может привести к ожогу и сопровождаться местной и общей реакцией. У взрослых электротравмы, как правило, связаны с профессиональной деятельностью, у детей - с использованием домашних электроприборов.
Поражения молнией встречаются с одинаковой частотой у лиц всех возрастных групп, чаще это происходит за городом у жителей сельской местности.
Лучевые ожоги вызывает ультрафиолетовое, инфракрасное и ионизирующее излучение. Солнечные ожоги кожи знакомы многим, они обусловленные чрезмерным воздействием на нее солнечных лучей. Ионизирующее излучение приводит как к местным, так и к общим изменениям в организме, получившим название «лучевая болезнь».
Ингаляционные травмы происходят при вдыхании горячего воздуха, пара и/или под действием токсичных химических соединений (продуктов горения), попадающих в дыхательные пути вместе с дымом.
Классификация ожогов
По этиологии (причинам) формирования:
- Термические ожоги (пламенем, кипятком, контактные).
- Электрические ожоги.
- Химические ожоги.
- Лучевые ожоги.
- Смешанные ожоги.
- Ингаляционные травмы:
- термические (термоингаляционное поражение дыхательных путей);
- токсикохимические (острые ингаляционные отравления продуктами горения);
- термохимические (смешанные).
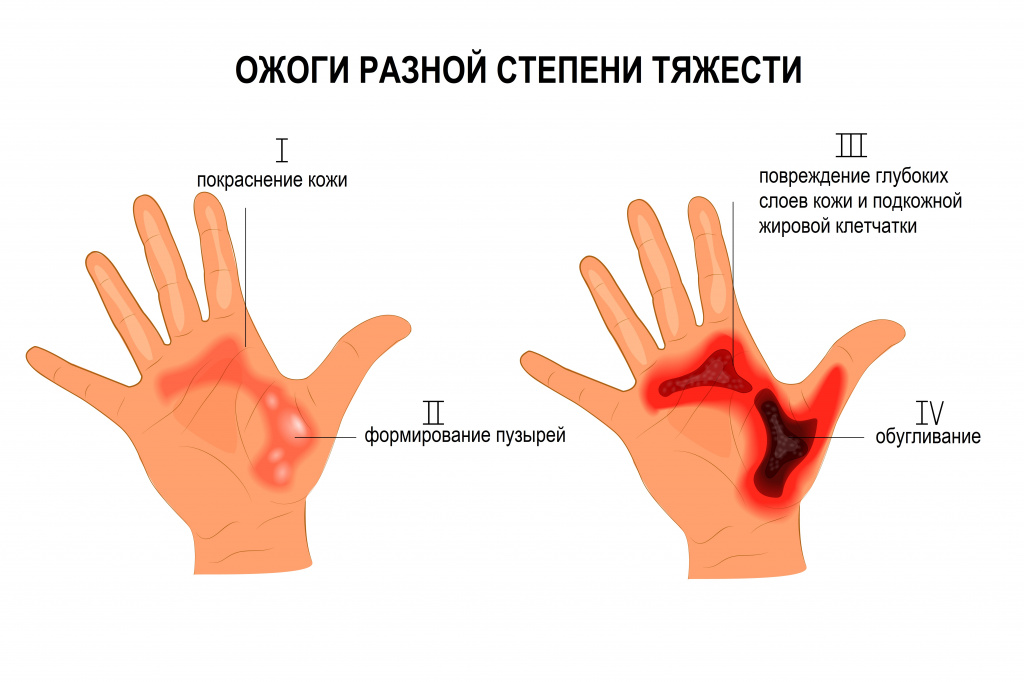
- I степень – ожоги на уровне верхних слоев эпидермиса.
- II степень – поражение на всю глубину эпидермиса.
- III степень – некроз (омертвление) поверхностных и/или глубоких слоев кожи, включая дерму.
- IV степень – некроз всех слоев тканей (обугливание).
По площади повреждения ожоги делятся на ограниченные (локальные) и обширные.
![Степени ожогов.jpg]()
Симптомы ожогов
Клиническая картина ожоговых состояний зависит от глубины и площади поражения и включает местные и общие проявления. Для поверхностных ожогов, площадь которых составляет менее 10% поверхности тела, характерны только местные проявления. Ожоги I степени проявляются отечностью, гиперемией (покраснением) кожи, выраженной болезненностью. При II степени образуются пузыри, заполненные прозрачной жидкостью. Для ожогов III и IV степени характерно появление пузырей с геморрагическим (кровянистым) содержимым, обугливание кожи, подкожной жировой клетчатки и подлежащих тканей вплоть до костей; болевая и тактильная чувствительность отсутствуют.
При поражении органов зрения больной жалуется на сильную резь в глазах, светобоязнь, отек и покраснение век и конъюнктивы.
При ингаляционных ожогах отмечается осиплость голоса, кашель со скудной вязкой, возможно, черной мокротой (копотью). Часто сопровождаются ожогами лица, шеи, передней поверхности грудной клетки.
Распространенные поверхностные ожоги (более 30% поверхности тела у взрослых) и глубокие ожоги (более 10% поверхности тела у взрослых), а также ожоги меньшей площади и глубины у детей и пожилых людей или у лиц с хроническими заболеваниями сопровождаются развитием ожоговой болезни.
Выделяют несколько стадий этого состояния.
Ожоговый шок продолжается от 12 до 72 часов и связан с нарушением кровообращения и водно-солевого баланса. Сразу после травмы пострадавший возбужден, у него может повышаться давление, учащаться пульс и дыхание, через 1-2 часа возбуждение сменяется заторможенностью, наблюдаются озноб, мышечная дрожь, повторяющаяся рвота, температура тела может как повышаться, так и снижаться. Отмечается уменьшение количества мочи, при этом моча приобретает темный цвет.
Следующая стадия – острая токсемия, которая развивается вследствие всасывания в кровь продуктов распада поврежденных тканей и длится до 10-15 дней. Эта стадия проявляется самыми разнообразными нарушениями психики (возбуждением, спутанностью сознания, галлюцинациями, нарушениями сна), а также поражением внутренних органов (сердца, легких, органов желудочно-кишечного тракта), поэтому у пациента наблюдаются перебои в работе сердца, кашель, одышка, боль в животе. Третий период – септикотоксемия, продолжающаяся от 2-3 недель до 2-3 месяцев. Проявления связаны с гнойными осложнениями (обильным гнойным отделяемым из раны, плохо заживающей раной), пациент испытывает вялость, отсутствие аппетита, снижается вес.
Прогноз в каждом конкретном случае определяется распространенностью поражения, исходным состоянием здоровья пострадавшего и адекватностью проводимого лечения.
Диагностика ожогов
Постановка диагноза, как правило, затруднений не вызывает. Для определения тактики лечения врач оценивает выраженность болевого синдрома, площадь и глубину ожогов, наличие признаков сочетанной травмы, поражения дыхательных путей, ожогового шока.Поскольку при обширных, глубоких ожогах в той или иной степени страдают все органы и системы организма, проводится расширенная лабораторная и инструментальная диагностика.
Лабораторная диагностика может включать самый разнообразный спектр анализов.
-
Клинический анализ крови.
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Актуальность проблемы ранней идентификации и адекватного лечения сепсиса у тяжелообожженных определяется высокой летальностью и отсутствием общепринятых критериев диагностики данного осложнения, а также сложностями выявления инфекции на фоне затрудненного контроля течения системной воспалительной реакции и местных проявлений инфекции при критических ожогах [1, 2]. Отечественные исследования последних лет указывают прежде всего на рост частоты развития у пациентов с ожоговой болезнью раннего сепсиса (3-7-е сутки после травмы), который характеризуется сложностью диагностирования, злокачественным течением и высокой летальностью [3, 5].
Известно, что раннее начало адекватной антибактериальной терапии является основным условием благоприятного исхода тяжелой инфекции. При этом предпочтительно применение четких алгоритмов лечения, основанных на объективных показателях, а не на методе проб и ошибок. Однако тактика лечения инфекционных осложнений термической травмы во многом интуитивна. В связи с этим возникает настоятельная необходимость внедрения в клиническую практику простого и надежного способа дифференциации бактериальной колонизации ожоговых ран от их инфицирования, а также корректной идентификации генерализованного характера данного осложнения [2, 11]. Ряд недавних отечественных и зарубежных публикаций свидетельствует о том, что высокочувствительным методом верификации развития сепсиса в остром периоде тяжелой термической травмы является определение содержания в крови прокальциотонина (ПКТ) - прокальциотониновый тест (ПКТ-тест) [4, 5, 8, 9], причем глубина проникновения инфекционных агентов в пораженные ткани и распространенность гнойно-некротических изменений, выявленных в ходе морфологического исследования, могут соответствовать увеличению уровня ПКТ [5].
Таким образом, есть основания полагать, что с помощью этого теста можно будет ответить на вопрос, связана ли тяжесть состояния пострадавшего с присоединением бактериальной инфекции или обусловлена другими причинами. Кроме того, некоторые публикации последних лет свидетельствуют о целесообразности выбора тактики антибактериального лечения инфекционных осложнений на основе мониторинга уровня ПКТ [5, 6].
Целью нашего исследования являлась оптимизация алгоритма диагностики и антибактериального лечения сепсиса, развивающегося в остром периоде тяжелой термической травмы, на основе использования ПКТ-теста.
Материал и методы
Проведено проспективное, нерандомизированное, контролируемое, одноцентровое исследование. Критерии включения: ожог с индексом Frank≥60 ед, возраст старше 18 лет, поступление в отделение реанимации и интенсивной терапии не позднее 6 ч с момента травмы (своевременная инициальная интенсивная терапия), наличие системной воспалительной реакции, микробиологически подтвержденная бактериальная контаминация ожоговых ран (≥10 5 КОЕ/г). Критерий исключения - наличие локального инфекционно-воспалительного процесса за 48 ч до травмы. Конечная точка - смерть больного. Сроки исследования c 01.10.07 по 01.03.09 г. За данный период в клинику поступили 154 пациента со значениями индекса Frank≥60 ед., получивших полноценную интенсивную терапию в 1-е сутки после ожога и не имевших до травмы каких-либо инфекционно-воспалительных заболеваний. У всех больных на 2-5-е сутки (в среднем на 3-и сутки) с момента травмы определялись уровень ПКТ, наличие гемокультуры, бактериальная колонизация ран.
У 47 (31,1%) больных в остром периоде термической травмы (3-7-е сутки) была обнаружена значимая бактериальная контаминация (≥10 5 КОЕ/г) ожоговых ран. Верификацию системного бактериального инфицирования у этих больных осуществляли на основе результата ПКТ-теста. Иccлeдoвaниe уровня прокальциотонина проводили полуколичественным экспресс-методом диагностическими наборами PCT-Q-test (BRAHMS Diagnostica GmbH, Berlin, Germany). Критическое пороговое значение уровня прокальциотонина крови ≥2 нг/мл. Тяжесть ожога оценивали по индексу Frank [7]. Тяжесть состояния пациентов определялась по шкале SOFA [10].
При осуществлении противошокового волемического возмещения в 1-е сутки интенсивной терапии мы ориентировались на формулу Паркланда. Антибактериальную терапию проводили со 2-х суток госпитализации пациента. Использовали традиционную методику местного лечения ожоговых ран закрытым способом со сменой повязок через сутки.
Для определения отношения шансов (ОШ) и 95% доверительного интервала отношения шансов (95% ДИ ОШ) использовали логистический регрессионный анализ, для оценки дискриминационной способности - анализ кривой операционных характеристик (ROC), полученный результат отображали как значение площади под ROC кривой (AUC) с указанием 95% ДИ. Коэффициент ранговой корреляции Спирмена (rho) и 95% ДИ для rho использовали для оценки связи между вариантами, не имеющими установленной причинно-следственной связи. Критический уровень статистической значимости (р) выбрали
Результаты
При оценке дискриминационной способности в отношении исхода термической травмы с индексом Frank≥60 ед. (84 пациента) шкала SOFA показала отличное качество - AUC=0,96 (0,79-0,99) при оптимальной точке отсечения >5 баллов; чувствительность 100% (73-100%) и специфичность 79% (49-95%). Возраст не оказал достоверного влияния на гибель больного - ОШ=1,02 (0,97-1,06; р=0,49), индекс Frank также достоверно не повлиял на смерть больного - ОШ=1,02 (1,00-1,03; р=0,08). Оценка дискриминационной мощности индекса Frank и возраста в отношении исхода термической травмы с индексом Frank≥60 ед. выявила, что индекс Frank показал удовлетворительный результат - AUC=0,72 (0,51-0,88), а возраст пациента практически не определял исхода травмы - AUC=0,56 (0,35-0,75).
![]()
Результаты сравнительного анализа некоторых показателей у пациентов с наличием и отсутствием значимой бактериальной контаминации ран (≥10 5 КОЕ/г) представлены в табл. 1.
![]()
Данные табл. 2 указывают, что высокое содержание патогенных микроорганизмов (≥10 5 КОЕ/г) в ожоговой ране ассоциируется с тяжестью состояния и сопутствующих патологических изменений, но не с тяжестью ожога и возрастом пострадавшего.
У 28 из 47 пострадавших с бактериальной контаминацией ожоговых ран уровень ПКТ был ≥2 нг/мл. Умерли 10 из 28 пациентов с уровнем ПКТ ≥2 нг/мл и 5 из 19 больных при ПКТ≤2 нг/мл. При этом сравниваемые пациенты были сопоставимы по возрасту и тяжести термического поражения, но различались по тяжести состояния (см. табл. 2). Среди данного контингента достоверное влияние на смерть больного оказали значение ПКТ≥2 нг/мл - ОШ=18,2 (1,76-188,07; p=0,01) и показатели по шкале SOFA - ОШ=2,00 (1,19-3,35; p=0,01).
Нами установлена высокая положительная корреляция - rho=0,68 (0,40-0,85; p=0,0006) - между оценкой по шкале SOFA и уровнем ПКТ. Возраст - ОШ=1,01 (0,96-1,06; p=0,8), а также индекс Frank - ОШ=1,01 (0,99-1,02; p=0,28) - не оказали влияния на уровень ПКТ≥2 нг/мл.
![]()
Ни в одном наблюдении не было получено положительного результата бактериологического посева крови, но у всех больных обнаружена значимая (≥10 5 КОЕ/г) колонизация ран нозокомиальной флорой (см. рисунок). Рисунок 1. Оценка характера бактериальной колонизации ожоговых ран у обследуемых больных. MRSA - methicillin - resistant Staphylococcus aureus.
У 28 пациентов с уровнем ПКТ ≤2 нг/мл нами были выявлены грамотрицательные патогены. У 64% (18 из 28) больных в качестве стартовой эмпирической антибактериальной терапии использовали меропенем и у 36% (10 из 28) - комбинацию цефтриаксона с амикацином. Характер базовой интенсивной терапии был одинаков, у всех больных. Среди пациентов, получавших меропенем, деэскалация проводимой антибактериальной терапии стала возможной у 8 на 5-е сутки лечения, остальные получили более длительные курсы лечения, умерли 4 пострадавших. 8 из 10 тяжелообожженных, получавших комбинацию цефтриаксона с амикацином, через 5 сут лечения потребовалась эскалация терапии, умерли 6 пациентов. Выбор деэскалационного режима антибактериальной терапии уменьшил риск развития летального исхода у данного контингента больных - ОШ=0,191 (95% ДИ ОШ=0,035-1,026; р=0,054).
Результаты нашей работы позволяют утверждать, что наличие выраженной микробной обсемененности ожоговых ран (≥10 5 КОЕ/г) ассоциировано с повышением риска как летального исхода, так и системного инфицирования у пострадавших, но не подтверждает наличия сепсиса у тяжелообожженного. Мы предполагаем, что при критических ожогах для верификации системного инфицирования необходим мониторинг уровня ПКТ крови. Этот тест показал высокую ценность положительного результата (ПКТ≥2 нг/мл - специфичность 91%) в прогнозировании риска смерти больного с тяжелой термической травмой.
Высокая дискриминационная мощность шкалы SOFA в прогнозировании адверсивных исходов термической травмы, вероятно, указывает на то, что ведущей причиной смерти больных является не только инфицирование, но и развитие мультиорганной дисфункции (МОД). Нами обнаружена высокая корреляция МОД с уровнем ПКТ, но остается дискутабельным вопрос о причинно-следственной связи системной бактериальной инфекции с МОД у больных в остром периоде тяжелой термической травмы.
Нами подтверждаются данные А.У. Лекманова и соавт. [4] и В.В. Сошкиной [5], свидетельствующие о высокой прогностической ценности ПКТ-теста в диагностике и выборе тактики антибактериального лечения раннего сепсиса у тяжелообожженных детей. Кроме того, наша работа подтверждает высказанное М. Christ-Crain и соавт. [6] мнение о целесообразности мониторинга уровня ПКТ для выбора и оценки клинической эффективности антибактериальной терапии у больных, находящихся в критическом состоянии.
Таким образом, сочетание высоких значений бактериального обсеменения ожоговых ран с уровнем прокальциотонина крови, большим или равным 2 нг/мл, является надежным маркером сепсиса в остром периоде тяжелой термической травмы.
Уровень прокальциотонина крови ≥2 нг/мл при термической травме с индексом Frank≥60 ед. в остром ее периоде свидетельствует о целесообразности проведения деэскалационного режима антибактериальной химиотерапии.
Тяжесть состояния больных с ранним ожоговым сепсисом необходимо оценивать с помощью шкалы SOFA.
Красноярский филиал ФГБУ «Гематологический научный центр» Минздрава России
БУЗ Воронежской области «Воронежское областное бюро судебно-медицинской экспертизы», Воронеж, Россия, 394068
Экспертная оценка случаев смерти от ожоговой болезни в отдаленном посттравматическом периоде
Журнал: Судебно-медицинская экспертиза. 2018;61(6): 8‑12
Красноярский филиал ФГБУ «Гематологический научный центр» Минздрава России
Проведен комплексный клинико-морфологический анализ случаев наступления смерти пострадавших от осложнений ожоговой болезни, включающий исследование медицинской документации, данных секционного исследования, гистологического и биохимического исследований объектов. На основании выполненного исследования определены наиболее характерные, достоверные и устойчивые прижизненные клинико-лабораторные, посмертные патоморфологические и биохимические признаки ожогового сепсиса, а также характерные для него осложнения, явившиеся непосредственной причиной смерти. Полученные результаты позволяют повысить объективность и доказательность экспертных выводов о причинах наступления смерти ожоговых больных в отдаленном периоде.
Красноярский филиал ФГБУ «Гематологический научный центр» Минздрава России
БУЗ Воронежской области «Воронежское областное бюро судебно-медицинской экспертизы», Воронеж, Россия, 394068
Ожоговой травме, как и любой другой, свойственны закономерности течения, выражающиеся в определенной последовательности развития посттравматических изменений (функциональных и морфологических), а также их исчезновение. Такой закономерностью при ожогах, превышающих определенную критическую степень глубины и распространенности (площади), является развитие ожоговой болезни (ОБ). Она развивается ориентировочно при поверхностных ожогах площадью более 10—30%, при глубоких — площадью более 5—10% [1—3].
В клинической практике используют следующую периодизацию ОБ: ожоговый шок (до 3 сут), острая ожоговая токсемия (до 10—15 сут), септикотоксемия (от 2—3 нед до восстановления кожного покрова) и период реконвалесценции [4—6].
В отечественной литературе [7] широко применяется термин «ожоговая болезнь». В иностранных медицинских источниках он практически не встречается. Вместо него используют понятие «тяжелая ожоговая травма» (severe burn injury), которая развивается при ожогах площадью более 20% от поверхности тела. Кроме того, зарубежные исследователи [8] к периодизации течения тяжелой ожоговой травмы подходят с позиции системного воспалительного ответа организма. Это предполагает деление ОБ на следующие стадии: ожоговый шок, системный воспалительный ответ (СВО), сепсис, полиорганная дисфункция (ПОД), полиорганная недостаточность (ПОН), при этом отмечается возможное изменение порядка перечисленных стадий.
В настоящее время клинико-лабораторная характеристика периодов течения тяжелой ожоговой травмы, патоморфологические изменения во внутренних органах, осложнения, непосредственные причины смерти и другие аспекты ОБ достаточно хорошо изучены. Знания в данной области клинической медицины продолжают пополняться.
Понимание патогенеза ОБ, прогностических оценок и исходов приобретает для эксперта особую ценность в свете современных подходов, связанных с необходимостью критической оценки информации, определении степени достоверности предлагаемых данных, а также выбором наиболее объективных, лишенных субъективной оценки, данных.
Информация, полученная из медицинской документации, в совокупности с патоморфологическими признаками, выявленными на вскрытии и в ходе дополнительных лабораторных исследований, при наличии соответствующих экспертных критериев объективной оценки причин смерти при ОБ позволит эксперту не только избежать ошибок при формулировании выводов и диагноза, но и обеспечит реализацию главных принципов экспертной работы — объективность, всесторонность и полнота исследований, проводимых с использованием современных достижений науки.
Цель исследования — разработка судебно-медицинских экспертных критериев объективной оценки причин смерти при ОБ в отдаленном периоде.
Материал и методы
Изучили архивные экспертные документы Воронежского областного БСМЭ за 2010—2016 гг. в отношении 63 умерших от ожоговой травмы: протоколы судебно-медицинского исследования трупа, судебно-гистологического и судебно-биохимического исследований, медицинские карты стационарного больного. Кроме того, проанализировали научную и специальную литературу о клинических проявлениях III стадии ОБ, особенностях течения ожогового сепсиса, его проявлений и патогенеза. Исследовали патоморфологические признаки и посмертные биохимические изменения, позволяющие верифицировать проявления сепсиса.
Умершие — лица мужского и женского пола в возрасте от 22 до 74 лет без клинически выраженных хронических заболеваний органов и систем. Смерть от ОБ наступила в медицинских организациях в сроки госпитализации более 5, но не более 30 сут, с клинико-лабораторными признаками сепсиса.
Выделили две возрастные группы: 1-ю группу составили 33 умерших (10 женщин 22–55 лет и 23 мужчины 22—60 лет), 2-ю — 30 умерших (17 женщин 56—74 лет и 13 мужчин 61—74 лет). Разделение произвели в соответствии с отечественной возрастной периодизацией с учетом относительно общих способов реагирования организма на факторы внешней среды в каждой из групп, схожим течением патологических процессов и влиянием сопутствующей патологии на течение травмы. Группы были сопоставимы по количеству наблюдений и тяжести ожоговой травмы.
Составили «Карту ретроспективной оценки случая смерти в медицинской организации», состоящую из нескольких блоков информации: 1) общие и регистрационные сведения (наименование медицинской организации, номер медицинской карты стационарного больного, номер экспертного документа, год исследования, пол и возраст умершего, срок госпитализации, площадь и степень ожогов, срок появления первых признаков сепсиса); 2) клинико-лабораторные признаки (данные физикального обследования, результаты прижизненного исследования крови и инструментальных методов исследования); 3) патоморфологические (макро- и микроскопические) признаки, характеризующие сепсис и его осложнения; 4) посмертные биохимические признаки, характеризующие осложнения ожогового сепсиса. Далее сравнили качественные и количественные показатели частоты встречаемости признаков в группах.
Клинико-лабораторные признаки сепсиса определяли с помощью международных диагностических критериев сепсиса [9], тяжесть ПОН оценивали по шкале SOFA (Sepsis-related Organ Failure Assessments Score/ Sequential Organ Failure Assessment), адаптированной и дополненной Т.Г. Спиридоновой [10].
Результаты и обсуждение
У подавляющего большинства пострадавших при поступлении в стационар прогноз исхода ожоговой травмы с учетом площади и глубины ожогов был сомнительный: в 1-й группе — у 84,8%, во 2-й — у 93,3%, а у остальных неблагоприятный — у 15,2 и 6,7% соответственно. Ожоги превышали 30% поверхности тела, при этом площадь глубоких ожогов составляла не более 10—15%.
Известно, что главным источником бактериемии и сепсиса являются длительно не заживающие ожоговые поверхности с влажным некрозом и воспалительным отеком [1, 11, 12]. Исследование показало, что во всех наблюдениях в медицинской документации отмечено гнойно-некротическое воспаление ожоговых ран, которое было подтверждено на вскрытии и при гистологическом исследовании.
В преобладающем большинстве случаев первые клинические признаки ожогового сепсиса наблюдались с 5-х по 14-е сутки: в 1-й группе у 97%, во 2-й у 83,3%, что соответствовало периоду раннего сепсиса [13]. Он начинался относительно остро, чаще на 5—7-е сутки ОБ, с повышения температуры тела (чаще до 39 °C или несколько выше), появления тахикардии (более 100 в 1 мин), тахипноэ (более 20 в 1 мин) и расстройства сознания (бред, галлюцинации и т. п.). В это же время в обеих группах при проведении рентгенологического исследования органов грудной клетки выявили признаки пневмонии. Наряду с этим у большей части пострадавших обнаружили характерные лабораторные признаки генерализации инфекционного процесса: снижение содержания гемоглобина (менее 90 г/л) и общего белка (менее 60 г/л), лейкоцитоз (более 12·10 9 /л), повышение СОЭ (более 60 мм/ч). Такая клинико-лабораторная картина совпадала по времени с выявлением повышенного количества С-реактивного белка (более 40 мл/л), а через 2—3 сут и диагностического маркера сепсиса — прокальцитонина (более 2 нг/мл).
Вместе с появлением признаков ожогового сепсиса последовательно нарастали изменения клинико-лабораторных параметров, характеризующих развивающуюся ПОН: легких, почек, системы крови, пищеварительного тракта и др. В большинстве случаев это проявлялось прогрессированием легочной недостаточности, снижением температуры тела (до 36 °C и ниже), нарушением сознания (от оглушения до комы) с последующим нарастанием или присоединением почечной недостаточности, нарушением функции печени, явлениями сердечно-сосудистой недостаточности и артериальной гипотензии. Изменения лабораторных показателей крови характеризовались следующими показателями: повышением содержания креатинина (более 44 мкмоль/л), мочевины (более 15 ммоль/л), трансаминаз (в 1,5 раза и более); в ряде наблюдений — повышением количества билирубина (более 70 мкмоль/л), гипергликемией (более 7,7 ммоль/л), снижением фибриногена (менее 1,5 г/л), тромбоцитопенией (менее 100·10 9 /л) и удлинением активированного частичного тромбопластинового времени (АЧТВ) более 60 с. При проведении инструментальных исследований (УЗИ, рентгенография, ЭКГ, ФГДС и др.) определялось наличие свободной жидкости в полостях тела, увеличение печени, отек легких, нарушение ритма, проводимости и других функций сердца, наличие эрозивно-язвенных поражений пищеварительного тракта и признаков кровотечения.
Непосредственной причиной смерти при тяжелом ожоговом сепсисе в значительном большинстве случаев стала ПОН (в 1-й группе — у 81,8%, во 2-й — у 90%) вследствие декомпенсации функций органов и систем, в остальных – септический шок. Критериями диагностики септического шока считали признаки полиорганной (более 3—4 органов) недостаточности, повышение содержания прокальцитонина в плазме крови более 10 нг/мл, артериальную гипотензию, не устраняющуюся с помощью инфузионной терапии.
![]()
Распределение диагностически значимых клинико-лабораторных признаков ожогового сепсиса и его осложнений представлено в табл. 1. Таблица 1. Диагностически значимые клинико-лабораторные признаки, характеризующие ожоговый сепсис и его осложнения
Результаты вскрытий и судебно-гистологического исследования тканей и органов выявили относительно схожую частоту встречаемости патоморфологических признаков ожогового сепсиса в разных возрастных группах.
Наиболее часто наблюдали следующие признаки:
— воспалительные изменения в тканях и органах, преимущественно в легких и верхних дыхательных путях, реже — в почках, печени, головном мозге, сердце, перикарде (в среднем 98,5% наблюдений в обеих группах);
— жидкое состояние крови в полостях сердца и сосудах трупа (100% случаев);
— дистрофические изменения и некрозы внутренних органов: дистрофия в сердце, печени, почках, головном мозге (в среднем в двух группах 85,9%); некроз преимущественно в почках (в 1-й группе — 60,6%, во 2-й — 46,7%), единичные изменения — в сердце, головном мозге, надпочечниках;
— наличие изменений в гипофизарно-адреналовой системе, связанных с повышением ее активности.
Остальные макро- и микроскопические признаки в виде вторичных септических очагов (гнойники и инфаркты), гиперплазии и других изменений селезенки, увеличения печени, желтушности кожного покрова и слизистых оболочек, изменений в гипофизарно-адреналовой системе, обусловленных ее истощением, респираторного дистресс-синдрома легких, геморрагического и ДВС-синдрома, лейкостазов и расстройства микроциркуляции во внутренних органах встречались значительно реже.
![]()
В заключительном клиническом диагнозе непосредственной причиной смерти указан септический шок, а морфологическими признаками в большинстве случаев являлись расстройства микроциркуляции и некрозы внутренних органов, ДВС-синдром, кровоизлияния в надпочечники (табл. 2). Таблица 2. Диагностически значимые патоморфологические признаки ожогового сепсиса и его осложнений
Посмертное биохимическое исследование крови и печени позволило оценить изменения, непосредственно предшествующие смерти, установить и объективизировать непосредственную причину смерти при ожоговом сепсисе.
Полученные данные свидетельствовали о наличии признаков почечной недостаточности, поражения печени и сердца, гипоксическом состоянии и лихорадке [14, 15]. Все эти признаки свойственны ПОН, развивающейся при ожоговом сепсисе: значительное повышение содержания креатинина, мочевины, АлАТ, АсАТ и гамма-ГТФ в крови, снижение содержания белка в крови, а также резкое снижение гликогена в печени.
![]()
Сравнительный анализ выявленных биохимических сдвигов, являющихся критериями диагностики ПОН, не выявил принципиально значимых различий в возрастных группах (табл. 3). Таблица 3. Диагностически значимые биохимические сдвиги, характерные для недостаточности функции органов и систем при ожоговом сепсисе
Полученные данные укладываются в изученные и описанные клинико-лабораторные и морфологические проявления сепсиса и его осложнений, а изменения посмертных биохимических показателей – предшествующим смерти патологическим процессам, свойственным ПОН.
Выводы
1. Сравнительный анализ установленных клинико-лабораторных, патоморфологических и посмертных биохимических признаков, являющихся критериями диагностики ожогового сепсиса и его осложнений, не выявил принципиально значимых различий в возрастных группах.
2. Секционное исследование случаев смерти от ОБ и забор биологического материала для дополнительных (гистологического, биохимического) лабораторных исследований должны производиться с обязательным учетом клинико-лабораторных признаков сепсиса, его осложнений и проявлений.
3. Морфологические изменения внутренних органов у лиц, умерших от осложнений ожогового сепсиса, характеризуются комплексом неспецифических проявлений в виде расстройства микроциркуляции, дистрофических и воспалительных изменений, явлений некроза и других признаков. Посмертные биохимические сдвиги отражают патологические процессы, предшествующие смерти, и не являются патогномоничными для осложнений сепсиса. В силу вышеизложенного диагностика ожогового сепсиса и его осложнений как причины смерти должна базироваться на комплексной экспертной оценке и анализе всех признаков, ведущими из которых являются клинико-лабораторные данные.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Сепсис: причины появления, симптомы, диагностика и способы лечения.
Определение
Сепсис – это патологический процесс, в основе которого лежит реакция организма в виде генерализованного воспаления на инфекцию различной природы. При сепсисе бактерии преодолевают иммунную защиту человека и распространяются из очага воспаления по всему организму. Местное воспаление, сепсис, тяжелый сепсис и септический шок – это различные формы выраженности воспалительной реакции организма на инфекционный процесс.
![Сепсис_дисфункция.jpg]()
Истинная частота возникновения случаев сепсиса остается неизвестной, однако по оценкам исследователей, во всем мире сепсис является лидирующей причиной летальности у пациентов в критическом состоянии. Согласно результатам большого европейского исследования SOAP, включившего 3147 пациентов из 198 европейских медицинских центров, сепсис развился в 37,4% случаев, а госпитальная летальность от него колебалась от 14% случаев в Швейцарии до 41% в Португалии, в среднем составив 24,1%. Данные другого крупного исследования PROGRES (12 881 больной тяжелым сепсисом в 37 странах) показали, что госпитальная летальность в среднем составила 49,6%.
Причины возникновения сепсиса
Возбудителями сепсиса могут быть бактерии, вирусы или грибы. Но чаще сепсис имеет бактериальную природу - его причиной становятся стафилококки, стрептококки, пневмококки, менингококки, сальмонеллы, синегнойная палочка и др.
В большинстве случаев патологический процесс вызывают условно-патогенные микроорганизмы, которые присутствуют на коже, слизистых оболочках дыхательного и пищеварительного трактов, мочевыводящих путей и половых органов. Иногда при сепсисе выделяют сразу 2-3 микроорганизма.
Причиной сепсиса могут стать гнойно-воспалительные заболевания кожи (абсцессы, фурункулы, флегмоны), обширные травмы, ожоги, инфекционно-воспалительные заболевания мочевыводящей системы (пиелонефрит), живота (например, гнойно-некротический деструктивный панкреатит), тяжелая ангина, гнойный отит, пневмония, инфицирование во время родов или абортов и др.
![Сепсис.jpg]()
Возможность возникновения сепсиса зависит не только от свойств возбудителя, но и от состояния иммунной системы человека - нарушения в ее работе предрасполагают к распространению инфекции. Причинами таких нарушений могут быть врожденные дефекты иммунитета, хронические инфекционные болезни (ВИЧ, гнойные процессы), эндокринные заболевания (сахарный диабет), онкологические болезни, хронические интоксикации (алкоголизм, наркомания), проникающая радиация, прием иммуносупрессоров (кортикостероидов, цитостатиков) и др.
Первичный гнойно-воспалительный очаг может возникать прямо у места входных ворот или во внутренних органах. В норме иммунные клетки организма быстро очищают кровь от чужеродных агентов. Но при ослабленном иммунитете инфекционный процесс распространяется и генерализуется, формируются вторичные септические очаги. Бактерии, «путешествуя» по крово- и лимфотоку, активно производят токсины, что приводит к интоксикации и может стать причиной инфекционно-токсического (септического) шока.
В ответ на внедрение возбудителя вырабатываются цитокины – особые белковые молекулы, которые выполняют защитные функции сначала на местном уровне, а затем, попадая в системный кровоток, продолжают работать уже на уровне всего организма. Цитокины бывают провоспалительными и противовоспалительными. В самом начале инфекционного процесса их количество находится в равновесии. Если регулирующие системы организма не способны поддерживать это равновесие, то цитокины накапливаются в кровотоке в сверхвысоких объемах, начинают доминировать их деструктивные, разрушающие эффекты, в результате повреждается сосудистая стенка, запускается синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром) и полиорганная дисфункция. Вследствие полиорганной дисфункции печени, почек, кишечника появляются новые повреждающие факторы (лактат, мочевина, билирубин и др.), которые усиливают деструктивные процессы. При ДВС-синдроме в сосудах микроциркуляторного русла образуются множественные тромбы в сочетании с несвёртываемостью крови, приводящей к множественным кровоизлияниям.
Классификация заболевания
В зависимости от локализации входных ворот и первичного очага сепсис подразделяют на:
- перкутанный (чрескожный) – развивается при попадании возбудителя в организм через поврежденный кожный покров (ранки, царапины, фурункулы и др.);
- акушерско-гинекологический – развивается после родов и абортов;
- оральный (одонтогенный и тонзиллогенный) – развивается в результате первичной инфекции в полости рта;
- оториногенный – развивается в результате распространения инфекции из полости уха и/или носа;
- пневмогенный – при наличии инфекционного очага в нижних дыхательных путях;
- хирургический;
- урологический;
- пупочный – развивается у новорожденных вследствие проникновения инфекционных агентов в кровь через пупочную ранку;
- криптогенный (идиопатический, эссенциальный, генуинный) – сепсис неизвестного происхождения: первичный очаг гнойного воспаления неизвестен.
- молниеносный сепсис,
- острый сепсис,
- подострый сепсис,
- хронический сепсис (хрониосепсис).
По клиническим признакам:
1. Синдром системного воспалительного ответа (ССВО) – системная реакция организма на воздействие различных сильных раздражителей (инфекции, травмы, операции и др.) характеризуется двумя или более признаками:
- температура тела ≥ 38°С или ≤ 36°С;
- частота сердечных сокращений (ЧСС) ≥ 90 ударов в минуту;
- частота дыхания (ЧД) > 20 в минуту или гипервентиляция (РаСО2 ≤ 32 мм рт. ст.);
- лейкоциты крови > 12х109 /л или < 4х109 /л, или незрелых форм >10%.
По виду и характеру возбудителя:
- аэробный сепсис,
- анаэробный сепсис,
- смешанный сепсис,
- грибковый сепсис,
- вирусный сепсис.
Клинические проявления сепсиса могут варьировать от незначительных до критических. При молниеносном течении патологическое состояние развивается бурно - за несколько часов или суток. При остром сепсисе симптомы развиваются за несколько дней. Для хрониосепсиса характерно вялое течение и наличие малозаметных изменений, формирующихся месяцами. Рецидивирующий сепсис протекает с эпизодами обострений и затуханий.
Инкубационный период после выявления ворот инфекции или первичного очага составляет от 1 до 3-5 суток. Начало сепсиса, как правило, острое, хотя иногда может быть подострым или постепенным. Интоксикация проявляется резкой слабостью, адинамией, анорексией, нарушением сна, головной болью, расстройством сознания, менингеальным синдромом (поражением оболочек головного и спинного мозга), тахикардией, артериальной гипотензией. Температура тела держится высокой, со скачками утром и вечером. Признаки интоксикации особенно выражены на высоте лихорадки. На коже у трети больных появляется геморрагическая сыпь.
Со стороны дыхательной системы наблюдаются одышка и хрипы в легких. При нарушении функции почек снижается количество выделяемой мочи (олигурия) вплоть до полного прекращения мочеиспускания (анурия), в моче появляются следы крови, гноя. Наблюдается ухудшение функции печени с развитием желтухи и явлениями гепатита, увеличивается селезенка. Повреждение органов ЖКТ проявляется нарушением пищеварения, отсутствием аппетита, язык сухой, обложенный, нередко наблюдаются упорные септические поносы, тошнота и рвота. Метастазирование возбудителя из первичного очага с образованием вторичных очагов инфекции может приводить к инфаркту легкого, гангрене легкого, гнойному плевриту, эндокардиту (поражению внутренней оболочки сердца), воспалению сердечной мышцы (миокардиту), воспалению околосердечной сумки (перикардиту), гнойному циститу, абсцессам мозга и воспалению оболочек мозга (гнойному менингиту), гнойным артритам, флегмонам и абсцессам в мышцах.
Недостаточность функции одного органа длительностью более суток сопровождается летальностью до 35%, при недостаточности двух органов – 55%, при недостаточности функции трех и более органов летальность к четвертому дню возрастает до 85%.
Диагностика сепсиса
Для постановки диагноза «сепсис» необходимо наличие установленного или предполагаемого очага инфекционного процесса и два или более признака синдрома системной воспалительной реакции.Производят посевы крови, мочи, ликвора, мокроты, гнойного экссудата из элементов сыпи, абсцессов, пунктатов плевры, суставов и других септических очагов. Посевы делают многократно, чтобы определить чувствительность к максимальному количеству антибиотиков. Используется также обнаружение антигенов в крови методом ИФА и определение генома возбудителя методом ПЦР.
Одним из наиболее специфичных и чувствительных маркеров бактериальной инфекции служит прокальцитониновый тест. Прокальцитонин – один из основных маркёров системного воспаления, вызванного бактериями.
Синонимы: Анализ крови на прокальцитонин; ПКТ. Procalcitonin; PCT. Краткая характеристика определяемого вещества Прокальцитонин Прокальцитонин является прогормоном кальцитонина, состоящим из 116 аминокислот с молекулярной массой 14,5 кDa. Биосинтез прокальцитонина в физиологических условиях прои.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Столбняк: причины появления, симптомы, диагностика и способы лечения.
Определение
Столбняк представляет собой опасное инфекционное заболевание, вызванное столбнячной палочкой Clostridium tetani. Эта бактерия отличается крайней устойчивостью в окружающей среде: ее споры сохраняют жизнеспособность годами, а при температуре 90°С – около двух часов. Вегетативные формы клостридий погибают через несколько минут в кипящей воде и в течение 3-6 часов после обработки антисептическими и дезинфицирующими средствами. Попадая в рану, бактерии начинают вырабатывать токсин, который оказывает влияние нервную систему, приводя к тяжелым мышечным спазмам и судорогам.
По мере развития болезни спазм мышц вызывает серьезные проблемы с дыханием и в конечном итоге может привести к летальному исходу.
Столбняком можно заразиться в любом уголке земного шара, однако больше всего случаев заражения отмечается в жарких странах с плохой санитарно-гигиенической обстановкой. В странах с умеренным климатом пик заболеваемости приходится на летне-осенний период.
Причины появления столбняка
Огромную роль в распространении инфекции играет отсутствие профилактической вакцинации населения.Столбнячные палочки живут в почве. Путь заражения – контактный. Бактерии попадают в организм через раны, ссадины, при ожогах, обморожениях и т.д.
После попадания в рану бактерии начинают вырабатывать токсин, который проникает в отростки нервных клеток, вызывая спастические сокращения мышц и судороги.
В связи со способностью продолжительно существовать в виде спор в почве, водоемах, на предметах возбудитель столбняка может попасть с пылью и грязью в любые помещения и инфицировать любые поверхности, включая медицинские.
- раневой,
- послеоперационный,
- послеродовой,
- послеожоговый,
- после обморожения,
- постинъекционный,
- столбняк новорожденных.
- локальный (поражаются только близлежащие к ране мышцы),
- генерализованный (поражаются все мышцы организма).
По степени тяжести: легкая форма (от момента заражения до первых симптомов проходит около 3 недель), средняя форма (симптомы появляются спустя 2 недели с момента заражения), тяжелая (симптомы возникают через 9–15 дней с момента заражения), крайне тяжелая (инкубационный период длится всего 3-5 дней).
Симптомы столбняка
Первые симптомы появляются в среднем через 7–10 дней от момента заражения, в редких случаях заболевание может развиться и раньше.
Различают три классических симптома столбняка:
- тризм, то есть судороги и скованность челюстных мышц, открывание рта затруднено, а на поздних стадиях болезни становится невозможным. Сокращение мышц лица создает специфическое выражение «сардонической гримасы» – одновременное выражение страдания и улыбки;
- ригидность затылочных мышц, что вызывает скованность и болезненность мышц шеи, ограничение подвижности шеи при наклоне головы вперед;
- дисфагия (нарушение функции глотания).
- боль в области раны и иногда подергивание близлежащих мышц;
- скованность мышц живота;
- болезненные спазмы тела, продолжающиеся в течение нескольких минут, как правило, вызванные незначительными явлениями - сквозняком, громким шумом, прикосновением, светом;
- головная боль;
- боль в спине и затылке;
- повышенная потливость.
При прогрессировании заболевания судороги распространяются на мышцы всего тела (опистотонус), больной для облегчения состояния принимает различные вынужденные позы - выгибается дугой, сгибается в сторону или застывает как столб (отсюда и произошло название болезни).
В тяжелых случаях судороги настолько сильны, что могут приводить к разрывам мышц и перелому костей.
Тяжелое течение заболевания сопровождается повышением температуры тела, снижением артериального давления, увеличением частоты сердечных сокращений.
Диагностика столбняка
Как правило, поставить точный диагноз удается на фоне клинической картины при наличии раны, указывающей на возможное заражение.Лабораторная диагностика не проводится, поскольку присутствие антител в крови может указывать на вакцинацию в детстве. При столбняке нарастания титров антител не происходит, так как даже летальные дозы экзотоксина не вызывают иммунного ответа. Ликвор (спинномозговая жидкость) также остается неизмененным, несмотря на поражение нервной системы.
В отдельных случаях применяют бактериологические методы (микроскопию мазков-отпечатков, гистологическое исследование тканей, иссекаемых при хирургической обработке ран, посевы раневого отделяемого на питательные среды в анаэробных условиях), позволяющие обнаружить возбудитель в месте расположения раны. Однако выделить культуру возбудителя из раны удается лишь у 30% больных.
К каким врачам обращаться
При травме с нарушением целостности кожных покровов, обморожении или ожоге следует обратиться к врачу-травматологу или врачу-хирургу, который после осмотра, сбора анамнеза и жалоб направит больного к узким специалистам: врачу-инфекционисту, врачу-неврологу.Лечение столбняка
Лечение больных столбняком проводится только в стационаре. При тяжелом течении заболевания больного госпитализируют в реанимационное отделение.
Для купирования судорог применяют миорелаксанты, нейролептики. В связи с нарушением глотания введение препаратов зачастую осуществляется внутримышечно или внутривенно.
При поражении дыхательных мышц может потребоваться искусственная вентиляция легких.
Обязательным является введение антистолбнячной сыворотки. Причем чем скорее она будет введена, тем больше вероятность нейтрализации токсина.
Хирургическое лечение заключается в обработке раны, удалении инородных тел, назначении антибактериальной терапии при подозрении на присоединение бактериальной инфекции и в целях предупреждения развития гнойного процесса. Зашивать рану нельзя, чтобы не допустить размножения противостолбнячной палочки, поскольку закрытая рана без доступа кислорода является благотворной средой для данной бактерии.
Особое внимание уделяется восполнению жидкости, обеспечению питания с достаточным количеством калорий, насыщенного витаминами и микроэлементами. При выраженном нарушении глотания питание осуществляется жидкими питательными смесями с помощью зонда - специальной тонкой трубки, которую вводят через нос в полость желудка.
Осложнения
Осложнения делятся на ранние, возникающие в самый разгар болезни, и поздние, которые могут оставаться после выздоровления.К ранним осложнениям относятся:
- Инфекции органов дыхания (бронхит, пневмония) - возникают в результате нарушения вентиляции легких, связанного с мышечным спазмом и длительным постельным режимом.
- Инфаркт миокарда – отмечается при тяжелом и крайне тяжелом течении столбняка, поскольку сердечная мышца, как и остальные мышцы организма, может подвергаться воздействию столбнячного токсина. Токсин особенно опасен для пожилых людей и пациентов с заболеваниями сердечно-сосудистой системы.
- Сепсис представляет собой системную воспалительную реакцию в ответ на попадание микроорганизмов в кровоток. Опасность сепсиса состоит в том, что воспалительный процесс затрагивает все органы и системы организма, нарушая их правильную работу, и в ряде случаев может привести к летальному исходу. Лечение сепсиса требует одновременного назначения нескольких внутривенных антибиотиков, постоянного контроля лабораторных показателей крови, пульса, артериального давления, температуры тела, мочеиспускания.
- Переломы костей, вывихи, разрывы мышц характерны для крайне тяжелого течения столбняка.
- Деформация позвоночника.
- Контрактуры мышц и суставов - состояние, при котором мышца или сустав сохраняют ограничение, скованность в движении даже после излечения от основного заболевания.
- Нарушение ритма сердца.
- Временный паралич черепных нервов, самым частым проявлением которого является нарушение функции глотания, двоение в глазах, птоз (опущение) века.
Плановая профилактики включает вакцинацию, которая проводится с рождения ребенка.
В России курс вакцинации против столбняка состоит из 3 прививок АКДС (в возрасте 3, 4,5 и 6 месяцев) и однократной ревакцинации в возрасте 18 месяцев. Далее ревакцинация проводится в 6–7 лет и в 14 лет вакциной АДС-М анатоксином. Последующие ревакцинации проводятся через каждые 10 лет.
Все прививки должны быть внесены в прививочные сертификаты. Полный курс прививок обеспечивает защиту у 95–100% привитого населения.
Экстренную профилактику необходимо проводить у непривитых или неправильно привитых людей при получении любых механических повреждений кожных покровов. Для этого как можно раньше (допустимо до 20 дня с момента травмы) вводят противостолбнячную сыворотку. Перед ее введением проводят пробу с разведенной сывороткой: если диаметр покраснения менее 1 см — проба отрицательная, если 1 см и более — положительная. При отрицательной пробе вводят сыворотку подкожно в наружную поверхность плеча или подлопаточную область. При положительной пробе введение сыворотки противопоказано. В этом случае вводят иммуноглобулин человека.
- Инфекционные болезни: национальное руководство / Под ред. Н.Д. Ющука, Ю.Я. Венгерова. - М.: ГЭОТАР-Медиа, 2009. С. 521–529.
- Рюмин А.М., Соболевская О.Л., Корочкина О.В., Волский Н.Е., Михайлова Е.А., Отмахова И.А., Собчак Д.М., Хряева О.Л. Случай столбняка легкого течения: тактические особенности ведения // Нижегородская государственная медицинская академия. 2017. С. 98–100.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Читайте также: