Как лечить дерматиты после облучения
Обновлено: 01.05.2024
Осложнения лучевой терапии головы, шеи и ее побочные эффекты
Все побочные эффекты лучевой терапии можно подразделить на острые и хронические. Их возникновение зависит от общей дозы облучения, однократной дозы облучения, предыдущего или сопутствующего лечения (хирургического вмешательства и/или химиотерапии), объема опухоли.
Одним из главных факторов, ограничивающих дозу лучевой терапии, является мукозит. Выраженный лучевой мукозит может стать причиной перерывов в лечении с последующим рецидивом опухолевого роста. Если иммунная система больного подорвана химиотерапией, слизистые оболочки могут инфицироваться. Наиболее распространенным хроническим побочным эффектом является ксеростомия.
С целью повышения вероятности успеха лучевой терапии пациент должен отказаться от курения (курение повышает сопротивляемость опухолевых клеток облучению), тщательно следовать схеме лечения, избегая перерывов более чем на пять дней, активно искать поддерживающей терапии. Перед началом лечения пациента должен обследовать фониатр/специалист по глотанию, диетолог, специалист по контролю боли и психолог.

а) Острые побочные эффекты лучевой терапии головы и шеи. Побочные эффекты обычно появляются на третьей неделе лечения. Развивается дерматит, снижается секреция слизи, появляются охриплость, боли в горле, дисфагия, утомляемость, нарушения вкуса, ксеростомия. В редких случаях на первой неделе может развиваться паротит (вследствие закупорки выводных протоков железы густой слизью).
Ближе ко второй половине курса, когда симптомы усиливаются, у пациентов появляется необходимость в использовании кремов и масел для кожи, муколитиков, наркотических анальгетиков, противорвотных препаратов, изменений в диете (переход на жидкую пищу и жидкие питательные смеси). Пациентам, которые не способны перенести весь курс лечения (особенно в сочетании с химиотерапией), может быть наложена гастростома.
Пациенты могут сильно терять в весе, у них нарушается заживление ран. Все это ведет к сложностям с завершением курса лечения. Важно минимизировать любые перерывы в лечении, поскольку подавление роста опухоли нарушается при прерывании лечения на пять дней и более.
б) Хронические побочные эффекты лучевой терапии головы и шеи. Полное восстановление после курса лучевой терапии занимает несколько недель или месяцев. Отказаться от приема дополнительных препаратов пациенты обычно могут спустя 4-6 недель после окончания лечения. Наиболее тяжелыми хроническими побочными эффектами являются фиброз мягких тканей шеи и жевательной мускулатуры, выпадение волос, хондронекроз, дисфагия, гипотиреоз, ксеростомия.
Избежать образования стриктур верхнего сфинктера пищевода и фиброза мышц, участвующих в глотании, можно при раннем начале специальных глотательных упражнений. Невозможность нормального глотания может вести к хронической аспирации и необходимости постоянного использования назогастрального зонда. Для предотвращения распада зубов и остеорадионекроза пациенты должны тщательно соблюдать гигиену полости рта, избегать удаления или имплантации зубов.
в) Направление будущих исследований. В рандомизированном исследовании RTOG-H5022 будет оценена эффективность добавления С225 к курсу химиолучевой терапии (ускоренный курс облучения с двумя курсами цисплатина).
С учетом того, что у пациентов с раком ротоглотки, ассоциированным с ВПЧ, удается достичь превосходных результатов при использовании традиционных методов лечения, многие лечебные учреждения и исследовательские группы занимаются поиском наименее агрессивного варианта. Аналогичных результатов можно достичь использованием меньших доз облучения и меньшим количеством курсов химиотерапии, снизив при этом общую токсичность.
У пациентов с крайне агрессивными опухолями, которым требуется более радикальное лечение, возможно применение нескольких подходов: использование индукционной химиотерапии, эскалация дозы облучения, подключение брахитерапии или биологической терапии.
С другой стороны, ведется поиск радиопротективных препаратов, которые помогут предотвратить развитие мукозита и других побочных эффектов и одновременно с этим увеличить вероятность сохранения функции пораженного органа, поскольку целью лечения является не только подавление опухолевого роста, но и поддержание общего качества жизни на достойном уровне.
Например, исследуется возможность использования лучевой терапии с модулированной интенсивностью (ЛТМИ) для снижения риска развития дисфагии и снижения дозы химиолучевой терапии. Это позволит сохранить пациентам глотание и устранит необходимость в использовании назогастрального зонда.
С целью дальнейшей персонализации лечения разрабатываются новые методы лучевой диагностики и молекулярной диагностики, с помощью которых, как мы надеемся, удастся найти сбалансированный способ излечения с использованием минимально допустимых доз и косметическими и функциональными результатами лечения.
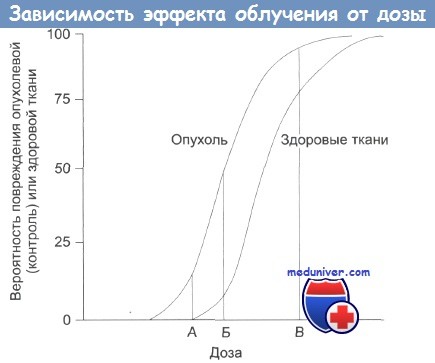
Зависимость терапевтического эффекта от дозы облучения.
А — нижняя безопасная доза;
Б — увеличение дозы: растет поражение здоровых тканей;
В — наивысшая вероятность успешного лечения, но и высокая вероятность поражения здоровых тканей, многочисленные побочные эффекты, некоторые из которых могут проявиться в отдаленном будущем
г) Ключевые моменты лучевой терапии:
• В основе лучевой терапии лежит нарушение способности опухолевых клеток к делению. Ионизирующее излучение вызывает формирование свободных радикалов, которые разрывают двухспиральную цепь ДНК.
• Здоровые ткани обладают большей репаративной активностью, чем опухолевые, поэтому они более устойчивы к действию ионизирующего излучения. Именно эта разница в репаративных свойствах нормальных и опухолевых тканей и позволяет убивать злокачественные клетки, сохраняя целостность и функциональность окружающих тканей.
• Как правило, для избирательной терапии используется доза в 50 Гр (грэй), для лечения остаточных микроскопических опухолей — 60 Гр, для лечения крупных новообразований — 70 Гр.
• В случае плоскоклеточного рака головы и шеи время и частота использования лучевых методов лечения имеют особое значение, т.к. данные опухоли способны к отложенной ускоренной репопуляции на фоне проводимой лучевой терапии. Феномен репопуляции во время терапии и способность раковых клеток к дифференциальной репарации часто обусловливает необходимость использования различных фракционных режимов подачи ионизирующего излучения.
Улучшить результаты лечения можно сокращением общего курса терапии и эскалацией дозы с гиперфракционированием.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
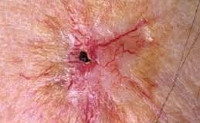
Лучевой дерматит (радиационный или рентгеновский дерматит) — это воспалительные изменения, происходящие в коже в результате воздействия ионизирующего излучения. Клинические проявления лучевого дерматита зависят от дозы облучения. В остром периоде возможно покраснение, возникновение пузырей и образование плохо заживающих язв. В более позднем периоде возникает сухость и атрофические изменения, может развиться рак кожи. Характерная клиническая картина и четкая связь возникновения заболевания с ионизирующим излучением обычно не вызывает сомнений в постановке диагноза.
Общие сведения
В наше время лучевой дерматит может возникать в связи с профессиональной деятельностью (у рентгенологов) и при аварийных ситуациях. Он также может быть терапевтическим, то есть развившимся в результате лучевой терапии, которая применяется в лечении злокачественных опухолей и некоторых болезней кожи.

Симптомы лучевого дерматита
Повреждения кожи ионизирующим излучением делят на ранние и поздние. Ранние проявляются в период облучения или в течение 3-х месяцев после него. Поздние повреждения кожи могут развиваться спустя годы после лучевого воздействия. Между ранними и поздними лучевыми повреждениями существует промежуточный период длительностью от нескольких месяцев до многих лет.
Облучение кожи в дозе 12-20 Гр приводит к развитию буллезной формы лучевого дерматита. Она возникает на фоне покраснения, зуда, болезненности, отечности кожи и характеризуется появлением серозных пузырей. Когда пузыри вскрываются, на их месте образуются эрозии, которые покрываются корками и заживают в течение 2-3 месяцев. Буллезный лучевой дерматит сопровождается увеличением регионарных лимфоузлов, повышением температуры тела и выпадением волос.
При дозе облучения более 25 Гр развивается некротическая форма лучевого дерматита. Она сопровождается выраженными болями, высокой температурой, слабостью, бессонницей. Тяжесть состояния пациента зависит от площади пораженного участка кожи. Кожные проявления проходят от стадии покраснения и пузырей до образования длительно незаживающих язв. Причем язвы могут возникать в обход буллезной стадии.
Хронический лучевой дерматит может быть следствием острого или развивается первично в результате многократного воздействия на кожу малых доз ионизирующего излучения. Его возникновению способствуют повышенная инсоляция, сахарный диабет, воздействие на кожу химических раздражителей, сосудистая патология, гнойная инфекция и др. К проявлениям хронического лучевого дерматита относятся: сухость кожи, образование трещин, гиперкератоз, участки гипо- и гиперпигментации, атрофические лучевые язвы.
Лечение лучевого дерматита
Лечение эритематозной формы лучевого дерматита проводится кортикостероидными кремами. При буллезной и некротической формах показано купирование болевого синдрома и противовоспалительная терапия. Пузыри вскрывают или отсасывают их содержимое. Для улучшения заживления эрозий и язв применяют кортикостероидные мази и 10% метилурациловую мазь. Некротическая форма дерматита часто требует хирургического иссечения некротизированного участка.
Хронический лучевой дерматит с невыраженной кожной атрофией не нуждается в активном лечении. Необходимым является исключение раздражающих факторов и применение питательных кремов. При выраженной симптоматике назначают противовоспалительные и эпителизирующие средства (кортикостероидные мази, препараты из сыворотки крови молочных телят и др.). При образовании длительно незаживающей лучевой язвы показано ее иссечение.
Прогноз при лучевом дерматите
На фоне хронического лучевого дерматита может начаться развитие базалиомы или плоскоклеточного рака кожи. Примерно в половине случаев это происходит через 7-12 лет после многократного и длительного облучения. Однако возникновение подобных осложнений может наблюдаться и через десятки лет.
Местные лучевые повреждения, развивающиеся преимущественно при лучевой терапии злокачественных опухолей, отличаются торпидностью к лечению различными медикаментозными средствами. Лучевые повреждения покровных тканей (кожи, слизистых) и внутренних органов
Местные лучевые повреждения, развивающиеся преимущественно при лучевой терапии злокачественных опухолей, отличаются торпидностью к лечению различными медикаментозными средствами. Лучевые повреждения покровных тканей (кожи, слизистых) и внутренних органов, как следствие воздействия ионизирующего излучения в суммарной очаговой дозе 60—70 Гр., проявляются в виде хронических эпителиитов и дерматитов, с прогрессированием их в лучевые язвы кожи, лучевые проктиты, циститы и т. п. В патогенезе таких повреждений, наряду с нарушением микроциркуляции, ведущее значение играет прямое воздействие излучения на клетки и подавление репаративных процессов. В дальнейшем на передний план выходят присоединение инфекции поврежденных тканей и усугубление негативных процессов заживления поврежденных тканей [1]. Вот почему в комплекс медикаментозных средств при лечении местных лучевых повреждений включаются вещества, воздействие которых направлено на улучшение тканевой микроциркуляции, повышение репараторных процессов и подавление инфекционного процесса. Для лечения местных лучевых повреждений апробированы практически все известные медикаментозные средства, удовлетворяющие перечисленным требованиям. Низкая терапевтическая эффективность имеющихся средств явилась основанием для поиска новых методов лечения. В отделении лечения лучевых повреждений МРНЦ РАМН ежегодно проходит лечение значительное число больных с лучевыми язвами конечностей и других областей тела, лучевыми повреждениями кишечника, мочевого пузыря и др. Основным компонентом местного лечения является препарат димексид (диметилсульфоксид, или ДМСО), применяющийся в виде перевязок раствора 5—10% или мази 10%. Это базовое лечение, назначаемое с учетом конкретных особенностей каждого больного, может дополняться назначением других антисептиков (диоксидин, хлоргексидин и др.), протеолитических ферментов, средств, стимулирующих репараторные процессы (куриозин, витаминизированные масла и др.). Разработанные схемы местного и общего лечения позволяют добиться благоприятных результатов у 57% пациентов [1, 2].
С сентября 2002 г. мы исследовали терапевтическую эффективность препарата гепон для лечения больных местными лучевыми повреждениями (см. таблицу 1).
Лучевые язвы у больных развились после лучевой терапии злокачественных опухолей (рак кожи — 16 пациентов, рак молочной железы — шесть, саркомы — четыре). Суммарная очаговая доза (СОД) составляла 45—70 Гр. Лучевые проктиты явились следствием лучевой терапии рака шейки и тела матки (13), рака мочевого пузыря (3) и прямой кишки (2). Лучевые циститы также наблюдались после лучевой терапии рака шейки и тела матки (13) и рака мочевого пузыря (4). Пневмофиброз — это следствие лучевой терапии лимфогранулематоза (6) и рака молочной железы (5 больных).
При лечении лучевых язв гепон применялся на первом этапе (7—10 дней) в виде орошения язвы раствором. Гепон (0,002) растворяли перед употреблением в 5 мл стерильного физиологического раствора. Орошение полученным раствором 0,04% гепона производилось ежедневно. На втором этапе, по мере развития грануляции, применялась мазь 0,04% (10—18 дней). Результаты лечения лучевых язв гепоном сопоставлялись с динамикой течения раневого процесса у более 800 больных, которым терапию проводили с принятыми в отделении методами лечения, состоящими в местном применении раствора 10% димексида (аппликации или электрофорез), электрофореза протеолитических ферментов и гепарина, использовании мазей левомиколя, ируксола, куриозина и эплана.
Эффективность применения гепона оценивалась клинически по состоянию раневой поверхности (уменьшение экссудации, скорости развития грануляций и скорости эпителизации язвы по Л. Н. Поповой (см. таблицу 2)), исчисляемой по формуле:
В оценке динамики заживления информативным оказалось изучение микрофлоры лучевых язв и чувствительности ее к антибиотикам. До применения гепона в раневом отделяемом у 67,5% посевов была установлена моноинфекция, преимущественно ассоциации стафилококка, а у 16,3% определялись и другие микробы (Escherichia coli, грамотрицательные ассоциации микробов и Candida). После 12–15-дневного применения гепона в 18,9% случаев выявлялась стерильность либо определялись сапрофиты (27%), характерные для нормальной кожи. По сравнению с исходным уровнем, 10 7-8 микробов на грамм ткани, к концу лечения гепоном обсемененность сокращалась до 10 2-3 , значительно повышалась чувствительность флоры к антибиотикам. Все вышеуказанное свидетельствует о несомненной эффективности проведенного лечения.
Положительный терапевтический эффект использования гепона мы склонны связывать в первую очередь с благоприятным его действием на микрофлору, что способствовало снижению воспалительного процесса и его негативных последствий (отек окружающих тканей, нарушение микроциркуляции и т. п.). Кроме того, важным аспектом действия гепона является его иммуномоделирующее действие, проявляющееся в активизации секреторного иммуноглобулина, снижении уровня противовоспалительных цитокинов, активизации a-интерферона, снижении адгезивной функции клеток и их апоптоза, прекращении вирусной репликации и повышении резистентности организма к бактериальной флоре.
В настоящее время, когда ранозаживляющее действие гепона доказано, лечение больных лучевыми язвами начинается с применения гепона, а затем дополняется, по показаниям, другими лекарственными средствами. Лечение лучевых ректитов (18 больных) и лучевых циститов (17 больных) проводилось в виде ежедневных двукратных микроклизм или инстилляций водного раствора 0,04% в течение 12—18 дней. Результаты применения гепона также сравнивались с результатами «традиционного» лечения, практиковавшегося в отделении в течение последних 25—30 лет (микроклизмы димексида 5—10%, эмульсии синтозона, витаминизированных масел и т. п.). Внутриполостное введение гепона уменьшало интенсивность болей и геморрагий и сокращало продолжительность лечения с 28—36 до 15—23 дней. Применение гепона активировало показатели иммунитета и у этой группы больных.
Таким образом, иммуномодулятор гепон в лечении больных с местными лучевыми повреждениями (лучевые язвы, лучевые ректиты и циститы) проявил себя как эффективное медикаментозное средство, способствующее быстрому снижению выраженности воспалительного процесса в поврежденных облучением тканях и ускорению репараторных процессов в них.
Литература
М. С. Бардычев, доктор медицинских наук, профессор
Медицинский радиологический научный центр РАМН (г. Обнинск)
Хронический радиационный дерматит. Лечение радиационного дерматита.
Хронический радиационный дерматит (син.: поздний рентгеновский дерматит, хронический радиационный кератоз) — термин, используемый для обозначения кожных поражений ин дуцированных спектром электромагнитных лучей, за исключением ультрафиолетовых.
Впервые рак кожи, возникший под действием рентгеновских лучей, описал в 1902 г. G. Frieben. Развивается спустя годы и десятилетия после воздействий ионизирующего облучения, в том числе, лучевой терапии. Локализуется в местах предшествующего лучевого повреждения. Вопрос о том, разовьется ли в ответ на подобное воздействие радиационный дерматит, радиационный кератоз, плоскоклеточный рак кожи, базалиома или кожная саркома, определяется местом облучения и его проникающей способностью.
Клинически поздний радиационный дерматит характеризуется пестрой картиной: участками гипер- и депигментации, атрофии, очагами рубцовых изменений, телеангиэктазиями длительно незаживающими язвами. На определенном этапе на фоне участков атрофии развивается радиационный кератоз: появляются плотные очаги ограниченного гиперкератоза попытки удаления которых вызывают боль и кровоточивость.
Хронический радиационный дерматит трансформируется чаще всего в болезнь Боуэна и плоскоклеточный рак кожи, который в таких случаях отличается высоким метастатическим потенциалом. Источником злокачественного перерождения служат участки пролиферируюшего эпидермиса в зоне рубцовой атрофии и в краях длительно незаживающих трофических (рентугдажских) яж. Признаком малигнизации рентгеновской язвы является краевое уплотнение, которое в дальнейшем приобретает вид валика.
Плоскоклеточный рак кожи в ответ на ионизирующее излучение возникает через 24,8±16,7 лет.
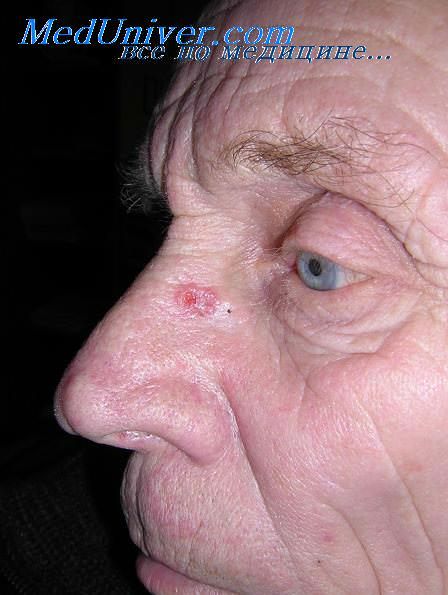
Базалиома на фоне хронического рентгеновского дерматита развивается сравнтельно редко. Источником ее также является краевая зона длительно незаживающих рентгеновских язв. Латентный период находится в обратной зависимости от дозы облучения и достигает 56 лет.
Гистологические изменения при радиационном дерматите подобны таковым при солнечном кератозе и проявляются дискератозом с гиперхроматозом ядер и повышенной митотической активностью. В дерме и подкожных тканях имеются поздние последствия радиационного повреждения, включающие гиалини-зацию коллагеновых волокон, утолщение и окклюзию глубоких кровеносных сосудов дермы, деструкцию сально-волосяных структур.
Диагноз радиационного дерматита устанавливается на основании характерной клинической картины и анамнес тических данных.
Дифференциальный диагноз радиационного дерматита проводится с болезнью Боуэна, плоско клеточным раком кожи, базалиомой. При этом важное значение имеют данные анамнеза, указывающие на предшествующее ионизирующее облучение: результаты цитологического и гистологического исследований. Радиационный кератоз также следует дифференцировать с солнечным кератозом и атрофической сосудистой пойкилодер-мией Якоби.
Течение радиационного дерматита. Радиационный кератоз имеет более выраженную тенденциею к трансформации в плоскоклеточный рак кожи, чем солнечный кератоз.
Лечение позднего радиационного дерматита должно быть комплексным с использованием общих и наружных лекарственных средств. В качестве общих методов лечения применяют препараты общеукрепляющего действия (инъекции солкосерила, экстракта алоэ, лидазы), витамины (витамин В1, аевит), противосклерети-ческие препараты и препараты, улучшающие микроциркуляцию крови в тканях(ксантинола никотинат внутрь, инъекции андекалина и др.). Наружные препараты: для лечения глубоких радиационных язв — влажные повязки с 2% раствором борной кислоты, винилин (бальзам Шостаковского), мазь или гель «Солкосерил». При эрозивно-язвенных проявлениях показано применение гелий-неонового лазера.
Профилактикой развития злокачественных новообразований на фоне хронического радиационного дерматита является эффективное лечение трофических язв, предупреждение травмы, инсоляции. Больные с поздним радиационным дерматитом должны находиться под постоянным наблюдением дерматоонколога
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Лучевая терапия опухоли. Значение лучевой терапии в дерматоонкологии.
До настоящего времени не утратила своего значения лучевая терапия эпителиальных новообразований кожи, обеспечивающая гибель опухолевых клеток путем повреждения хромосомного аппарата и торможения митотическои активности. При этом следует учитывать, что большинство пролиферирутощих клеток опухоли радиочувствительны на стадии митоза и сразу после нее, непролиферирующие же клетки отличаются очень низкой радиочувствительностью и легко восстанавливают повреждения, давая рост новым клеткам. Невозможность уничтожения 100% злокачественных клеток из-за нахождения их в разных периодах жизненного цикла требует фракционирования суммарной дозы облучения.
Применяют следующие методы лучевой терапии: использование электронного пучка, низковольтную или ортовольтную рентгенотерапию, а также близкофокусную рентгенотерапию и имплантацию радиевых игл. Показаниями для проведения лучевого лечения являются: плоскоклеточный рак кожи, базалиома (в частности, кистозная и язвенная формы), эритроплазия Кейра, болезнь Боуэна, рецидивные эпителиальные новообразования кожи, возникшие после других методов лечения и локализующиеся вблизи естественных отверстий (глаза, носа, ушные раковины и т.д.). Лучевое лечение проводят больным с наличием противопоказаний к хирургическому лечению, лицам пожилого возраста, а также при диаметре новообразования, не превышающем 20 мм. Оно также проводится в качестве адъювантной герапии при глубоких инвазивных и метастатических раках кожи.
Лучевая терапия обычно безболезненна и хорошо переносится больными. В то же время она сопровождается развитием местных лучевых реакций нормальных тканей в облучаемой зоне. Степень их выраженности зависит как от методики облучения (уровень разовых и суммарных поглощенных доз, ритм облучения, размер полей), так и от распространенности опухоли, состояния нормальных окружающих тканей и др. Существенное влияние на течение лучевых реакций оказывает и общее состояние больного. Острые лучевые реакции кожи, как правило, ограничиваются эритемой и явлениями сухого эпидермита, которые не требуют перерыва в лечении, проходят самостоятельно или купируются 5% метилурациловой или пар-мидиновой мазью. При проведении лучевой терапии нередко имеется и риск развития лучевых осложнений (лучевых дерматитов, конъюнктивитов, катаракты, перихондритов, трофических язв, общей слабости, потери аппетита, головных болей и головокружения, лейко- и лимфопении, тромбоцитопении идр.), наблюдающихся примерно в 18% случаев. Это требует постоянного контроля состояния периферической крови и коррекции осложнений путем назначения гемостимулирующих препаратов, витаминов, дезинтоксикационной терапии, симптоматического лечения и т.д. Лучевая терапия неэффективна при склерозирующих формах опухолей и малоэффективна при наличии фистул и рубцов.
В ряде случаев, особенно в зависимости от площади воздействия, период заживления кожи после лучевой терапии может продлиться до 8 недель. Ограничивает ее применение и развитие неудовлетворительных в косметическом отношении атрофических рубцов с депигментацией и телеангиэктазиями, особенно часто возникающих в области груди и конечностей, а также невозможность повторного использования при развитии рецидива опухоли. Рубец после лучевой терапии существенно затрудняет диагностику рецидива. Важно отметить, что лучевая терапия приводит к нарушению кровоснабжения кожи, костей и мягких тканей, ухудшая заживление ран, в связи с чем рецидив после применения лучевой терапии очень сложно поддается и хирургическому лечению. В таких случаях также затруднено проведение пластических реконструктивных операций.
Для лечения эпителиальных новообразований кожи наиболее широко применяется фракционная близкофокусная рентгенотерапия, которая осуществляется путем ежедневного воздействия на очаг; поглощенная разоваядоза составляет 3-5 Гр (300-500 рад), общая суммарная доза — 50-70 Гр (5000-7000 рад).
При опухолях, расположенных в области губ, ушных раковин, век, с выраженной инфильтрацией подлежащих тканей методом выбора является внутритканевая гамма-терапия.
По данным литературы, косметический эффект после проведения лучевой терапии в 57,2% случаев был хорошим, в 24,8% — удовлетворительным и в 11,1% — плохим; однако частота осложнений варьировала от 4,9 до 80% случаев; рецидивы же после лучевой терапии базалиомы отмечались в 5-20% случаев.
Частота рецидивирования выше при локализации опухоли на волосистой части головы, носу, в периорбитальной области, а также при большей площади очагов поражения.
Суммируя приведенные данные, необходимо отметить, что несмотря на появление новых, более эффективных и более безопасных методов, рентгенотерапия не утратила своего значения при ряде злокачественных новообразований кожи и может явиться методом выбора при лечении некоторых форм базалиомы, плоскоклеточного рака кожи, эритроплазии Кейра, болезни Боуэна.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

