Как анестезия на герпес
Обновлено: 19.04.2024
Вирус герпеса третьего типа varicella zoster (VZV) вызывает два клинически обособленных заболевания - ветряную оспу и опоясывающий герпес (Баринский И.Ф. и др., 1986; Haanpaa M., 2001). Оба заболевания, прежде всего, характеризуются везикулярной сыпью. Первичная инфекция манифестирует в форме ветряной оспы (ветрянки), а реактивация латентного VZV обусловливает появление локализованных высыпаний - опоясывающего лишая (Хахалин Н.Н., 2002). Мысль о связи между ветрянкой оспой и опоясывающим лишаем впервые была высказана в 1888 венским врачом Яношом Бокеем (von Bokay J., 1909).
Эпизод ветряной оспы в детстве способствует формированию специфической клеточной и гуморальной иммунной защиты. Считается, что рецидив инфекции у таких пациентов может развиться только на фоне недостаточности иммунной защиты, вследствие снижения активности специфических натуральных киллеров, Т-киллеров и системы интерферонов (Fleming D.M. et al., 2004). После первичной инфекции излюбленным местом персистенции VZV являются ганглий тройничного нерва и спинномозговые ганглии чувствительных корешков грудного отдела спинного мозга, где VZV находится в латентном состоянии. В течение этого времени вирус не размножается и не проявляет патогенных свойств. По-видимому, время латентного состояния вируса определяется уровнем специфических антител к VZV. Снижение их количества ведет к реактивации вируса, вирусной репликации (размножению), что на клиническом уровне и проявляется в виде опоясывающего лишая (Arvin A., 2005). Данный вывод подтверждается высокой корреляцией между вероятностью возникновения опоясывающего лишая у людей пожилого возраста и возрастным ослаблением активности клеточного звена иммунитета (Gilden et al., 2000)., На это также указывают данные, свидетельствующие о более высокой заболеваемости опоясывающим герпесом среди лиц, инфицированных вирусом иммунодефицита человека (Gilson I.H. et al., 1989), однако точные механизмы, лежащие в основе перехода вируса из латентного состояния в активное неизвестны.
В случае реактивации VZV ганглии чувствительных нервов становятся местами репликации вируса, именно в них обнаруживаются наиболее выраженные дегенеративные повреждения нейронов (Zerboni L. et al., 2005; Reichelt M. et al., 2008). В результате развивается ганглионит, сопровождаемый распространением инфекции вниз по нервным аксонам к коже. Каким образом происходит транспортировка вируса в поврежденных аксонах неизвестно. Инфекция также может распространяться центрально, приводя к воспалению оболочек в области передних и задних рогов спинного мозга (Gray F. et al. 1994). Отдельные патолого-анатомические наблюдения также свидетельствуют о наличии воспалительных изменений и в контралатеральных спинномозговых ганглиях (Miller S. E. et al., 1997), отмечается снижение количества нейронов и наличие воспалительных инфильтратов в ганглиях, периферических нервах, и спинномозговых корешках (Gowrishankar K. et al., 2007). В некоторых случаях отмечается выраженные некротические изменения в спинномозговых ганглиях. Большинство изменений в периферическом нерве протекает по типу Валлериановской дегенерации, имеющей место, как в толстых, так и в тонких волокнах. (Denny-Brown et al., 1944).
Доказано, что повреждение нейрональных структур начинается перед появлением кожной сыпи. При этом VZV по ходу чувствительных нервных волокон проникает в кожу, «ускользая» от факторов врожденного и приобретенного иммунитета, что в конечном итоге обусловливает возникновение односторонней везикулярной кожной сыпи, характерной для опоясывающего лишая.
Острая VZV инфекция клинически характеризуется стадией продрома и стадией везикулярных высыпаний (Arvin A., 2005).
Сыпь обычно локализуется в одном или нескольких смежных дерматомах и сопровождается развитием острой невропатической боли. У 50% больных сыпь встречается на туловище, у 20% - на голове, у 15% - на руках, и у 15% - на ногах (Arani R.B. et al., 2001).
Клинический диагноз опоясывающего лишая в типичных случаях достаточно прост. Однако иногда требуется проведение лабораторной диагностики с целью идентификации вируса. Наиболее быстрым и высокочувствительным методом является полимеразная цепная реакция.
В остром периоде болезни или после него возможно развитие осложнений, захватывающих различные системы организма. Наиболее серьезными считаются неврологические осложнения. В структуре неврологических расстройств ведущее место занимает поражение периферической нервной системы. При данном заболевании воспалительный процесс затрагивает региональные, чувствительные ганглии с развитием ганглиолитов. Наличие у больных корешковых болей, парастезий, сегментарных нарушений чувствительности отмечается практически у каждого больного (Stankus S. et al., 2000; Thyregod H. G. et al., 2007). Болевой синдром имеет выраженную вегетативную окраску в виде жгучих, приступообразных, резких болей, усиливающихся в ночное время. В головном мозге при опоясывающем герпесе могут быть обнаружены явления отека, выраженная диффузная инфильтрация подпаутинного пространства, геморрагии в белом веществе, базальных ганглиях (Sissoko D. et al., 1998). Следует заметить, что осложнения со стороны головного и спинного мозга в настоящее время встречаются редко. В случаях развития VZV-инфекции в области тройничного нерва часто наблюдаются осложнения со стороны глаз - кератит, ирит, ретинит, офтальмит. Ранее, при отсутствии специфической противогерпетической терапии, к частым осложнениям VZV-инфекции относились пневмонии, энцефалиты или гепатиты, иногда приводившие к летальному исходу.
Вместе с тем, из всех перечисленных осложнений VZV инфекции самым распространенным считается постгерпетическая невралгия (Dworkin R.H., Portenoy R.K., 1996).
Различают острую герпетическую невралгию (в течение 30 дней после начала заболевания) и постгерпетическую невралгию (Choo P. et al.,1997). К ПГН относят упорные боли в областях, затронутых герпесной инфекцией после заживления кожи (Dworkin R. et al. 2003). Наиболее хорошо установленными факторами риска для ПГН являются пожилой возраст, большая распространенность высыпаний на коже и выраженная боль перед везикулярной сыпью (Desmond R.A. et al., 2002; Fleming D.M. et al., 2004). Все эти факторы находятся во взаимосвязи, поэтому пациенты 50 лет и старше в большинстве случаев испытывают тяжелую, нестерпимую боль и значительные кожные высыпания, что гораздо чаще приводит к развитию ПГН. У пациентов со всеми этими факторами риск развития ПГН превышает 50-75 % (Gnann J., Whitley R. 2002; Jung B.F., 2004). Постгерпетическая невралгия может развиться в любом возрасте, однако для нее характерна прямая корреляция частоты встречаемости и длительности ПГН с возрастом. Более 50% всех пациентов с ПГН - старше 60 лет, 75% больных с указанной патологией приходится на возрастную группу старше 75 лет (Nurmikko T.J., 2001). Половина всех пациентов с ПГН старше 60 лет испытывает постоянную боль более 6 месяцев, в то время как в возрастной группе 30-50 лет ПГН более 6 месяцевь наблюдается у 10% больных (Whitley R. et al. 1996). В США ежегодно регистрируется 100-200 тыс. новых случаев ПГН (Nurmikko T.J., 2001). Однако, истинная распространенность ПГН не известна, не только потому, что эпидемиологические данные недостаточны, но также из-за отсутствия конценсусса по определению ПГН. Некоторые авторы относят к ПГН боли, возникающие в любой период герпесной инфекции, другие считают, что ПГН - это боль, сохраняющаяся спустя 3 месяца после заживления кожи. В первом случае определения ПГН ее распространенность составляет 8%, во втором - 4,5% (Choo P. et al. 1997). Постоянную боль в течение 1 мес после сыпи испытывают до 15% пациентов и около 4% пациентов от общего количества перенесших опоясывающий лишай отмечают сохранение боли в течение года (Lancaster T. et al. 1995).
Классическое проспективное исследование, проведенное Hope-Simpson (1975), продемонстрировало, что из 321 пациента с опоясывающим лишаем 10 % имеют выраженную боль спустя 3 месяца после острой герпетической инфекции, а 4 % - и через 12 месяцев. Подобные результаты были получены и в других проспективных исследованиях (Helgason S. et al. 1996; 2000; Scott F.T. et al., 2006), в которых также было показано, что наибольший риск пролонгации болевого синдрома после перенесенного опоясывающего лишая имеют пациенты в возрасте около 60 лет.
Постгерпетическая невралгия занимает третье место по частоте встречаемости среди различных типов невропатической боли и уступает только болям в нижней части спины и диабетической невропатии (Montero H.J. et al., 2005; Breivik H. et al, 2006; Torrance N. et al., 2006).
Локализация болевого синдрома практически всегда соответствует зоне кожных высыпаний. Интенсивность болевого синдрома как правило высокая. Кроме глубоких ноющих и стреляющих болей очень характерны поверхностные жгучие боли и наличие стимулозависимых болей - динамической гипералгезии и аллодинии (Baron R., 2004).
При клиническом осмотре в зоне болей выявляются нарушения поверхностной чувствительности. Качество боли в острый период опоясывающего лишая и при ПГН различно. Вместе с тем, несмотря на разный выбор дескрипторов из МакГилловского болевого вопросника, пациенты с опоясывающим лишаем и ПГН для описания своих болевых ощущений выбирают похожие по смыслу слова, например, горячая и жгучая боль или пронзающая и простреливающая боль (Bennett M., 2001).
Схожие проявления наблюдаются и при описании вызванной боли пациентами с опоясывающим лишаем и ПГН. И те, и другие отмечают наличие схожих типов гипералгезии и аллодинии (Haanpaa M. et al., 2000; Berry J.D., Rowbotham M.C., 2004).
У большинства пациентов боль, связанная с ПГН, уменьшается в течение первого года. Однако у части больных она может сохраняться годами и даже в течение всей оставшейся жизни, причиняя немалые страдания (Cunningham A.L., Dworkin R.H., 2000). Затяжной, тяжелый характер заболевания с длительным, выраженным болевым синдромом способствует формированию расстройств психики (Dworkin R.H., et al., 1992). У таких пациентов выявляются тревожно-депрессивные расстройства, когнитивные нарушения - снижение активного внимания, памяти, затруднения осмысления происходящего, отмечается некритичность, нетерпеливость, неряшливость, страх боли, неуверенность в завтрашнем дне, отмечается снижение социальной активности (Haythornthwaite J.A. et al., 2003). ПГН оказывает значительное отрицательное влияние на качество жизни и функциональный статус пациентов особенно пожилого возраста (Lydick E. et al., 1995). У пациентов с ПГН отмечается хроническая усталость, снижение массы тела, физической активности, нарушения сна (Morin C.M., Gibson D., Wade J., 1998).
В основе боли, связанной с ПГН, лежат воспалительные изменения или повреждения ганглиев задних корешков спинного мозга и периферических нервов в пораженных зонах тела. Такие боли относят к невропатическим болям, их выделяют в отдельную самостоятельную группу и определяют как боли, возникающие вследствие первичного повреждения соматосенсорной нервной системы (Treede R.D. et al., 2008).
Патофизиологической основой невропатических болевых синдромов являются нарушения генерации и проведения ноцицептивного сигнала в нервных волокнах, а также механизмов контроля возбудимости ноцицептивных нейронов в структурах спинного и головного мозга (Кукушкин М.Л., Хитров Н.К., 2004; Baron R. 2000).
Лечебная тактика при опоясывающем лишае включает два основных направления: противовирусная терапия и купирование невропатической боли, как в острый период заболевания, так и в стадии постгерпетической невралгии. Результаты нескольких рандомизированных контролируемых испытаний свидетельствуют о том, что раннее начало лечения простого герпеса может предотвратить развитие постгерпетической невралгии или способствовать ее скорейшему разрешению (Исаков В.А. и др., 2004; Helgason S. et al., 1996; Jackson J.L. et al., 1997 ; Volmink J. et al., 1996).
Наиболее широкое применение нашли такие специфические противогерпетические препараты, как ацикловир, фамцикловир и валацикловир, которые, являясь нуклеозидными аналогами, блокируют вирусную репликацию (Романцев М.Г., 1996; Beutner K. et al., 1995; Bruxelle J., 1995). Важно, что противовирусное лечение проявляет наивысшую активность, если назначено в течение 72 ч от начала герпетических высыпаний (Johnson R., 2001; Johnson R., Dworkin R.H., 2003). В ряде исследований доказана высокая эффективность ацикловира в уменьшении тяжести, продолжительности острой герпесной инфекции и профилактике ПГН, особенно при его раннем назначении. Оценка эффективности фамцикловира также продемонстрировала уменьшение времени до разрешения сыпи (Dworkin R.H. et al., 1998). В сравнительном исследовании ацикловира и валацикловира показана эквивалентная эффективность в сокращении продолжительности невропатической ПГН (Beutner K. et al. 1995). В другом клиническом испытании установлена терапевтическая эквивалентность фамцикловира и валацикловира для неосложненного герпеса (Tyring S. et al. 2000). Возможно также сочетанное использование противовирусной терапии и глюкокортикостероидов (Whitley R. et al. 1999). Выявлено, что такая комбинация эффективнее монотерапии противовирусными препаратами, особенно для лечения острой боли и коррекции различных аспектов качества жизни пациентов. Комбинация ацикловир+преднизолон значительно быстрее купирует острую невралгию и возвращает пациента к обычной жизнедеятельности, но существенно не влияет на течение ПГН, то есть она наиболее показана в остром периоде в старших возрастных группах для терапии острого болевого синдрома. Доказано, что хотя преднизолон является иммуносупрессором, его использование не увеличивает частоты развития ПГН и в этом смысле его действие сравнимо с влиянием плацебо, то есть данная комбинация может быть спокойно использована в старших возрастных группах. Для некупируемых тяжелых случаев ПГН некоторые исследователи рекомендуют интратекальное введение метилпреднизолона (Kost R., Straus S., 1996).
В настоящее время в США делается акцент на профилактику герпетической инфекции. С 1995 г. в США проводится всеобщая вакцинация от ветряной оспы, особенно пожилых лиц, и с 1999 г. отмечается резкое снижение заболеваемости (Hambleton S., Gershon A., 2005; Oxman M.N. et al., 2005).
При постгерпетической невралгии препаратами с доказанной эффективностью (класс А - терапия первой линии) являются: пластины с 5% лидокаином, габапентин, прегабалин, трициклические антидепрессанты, трамадол (Attal et al., 2006).
На сегодняшний день эффективность применения пластин с 5% лидокаином (Версатис, Grunenthal Gmbh) убедительно доказана при лечении ПГН. Так, в нескольких рандомизированных клинических исследованиях установлено, что применение пластин с 5% лидокаином статистически достоверно более значимо облегчает проявления болевого синдрома у пациентов с постгерпетической невралгией по сравнению с плацебо (Rowbotham M.C., 1996; Galer B.S., 1999, 2002). На основании полученных данных FDA одобрило применение данного препарата в качестве стартовой терапии у пациентов с постгерпетической невралгией. (Richard L. et al., 2004)
Версатис - это топический анальгетик, который действует непосредственно там, где болит. Он выпускается в виде мягких пластин размером 10х14 см, которые наклеиваются на неповрежденную кожу без признаков воспаления. Медленно высвобождающийся из пластины лидокаин создает более или менее значительную концентрацию лишь в поверхностных слоях кожи, где проходят тонкие волокна, обеспечивающие болевую и температурную чувствительность (Gammaitoni AR, Davis MW. 2002.). Лидокаин лишь в незначительной степени проникает в более глубокие слои кожи, где проходят кровеносные сосуды, поэтому его попадание в системный кровоток сведено к минимуму. У пациентов, использовавших пластины Версатис, не наблюдалось никаких известных системных эффектов лидокаина (влияние на деятельность ЦНС и сердечно-сосудистой системы). Таким образом, важнейшим преимуществом пластин Версатис служит отсутствие системного действия, что гарантирует безопасность лечения. Практически полное отсутствие системного эффекта позволяет назначать Версатис совместно с любыми другими препаратами для лечения нейропатической боли.
Механизм лечебного эффекта препарата Версатис не ограничивается только действием высвобождающегося из них лидокаина. Важное значение имеет также то, что пластина выполняет роль механического барьера, препятствуя раздражению участка кожи с измененной чувствительностью (аллодиния), а также оказывает не него легкое охлаждающее действие (Galer BS, Gammaitoni AR, Oleka N et al., 2004)
Пластины Версатис рекомендуется прикреплять на 12 ч в течение суток, затем следует 12-часовой перерыв. Обезболивающий эффект часто начинается в течение 30 мин после прикрепления пластины, но может проявляться и позже, нарастает в течение 4 ч и затем поддерживается в течение длительного времени, пока пластина прикреплена к коже. Более того, он может сохраняться и после ее удаления.
Для объективной оценки эффективности каждого из препаратов при лечении ПГН используется показатель NNT (number needed to treat - количество больных, которых нужно пролечить, чтобы получить у одного 50% снижение боли). Чем ниже NNT, тем более эффективен препарат при данной патологии. NNT для пластин с 5% лидокаином при лечении пациентов с ПГН составляет 2,0; для амитриптилина - 2,6; габапентина - 4,4; прегабалина - 4,6 (Wu C.L., Raja S.N., 2008); для трамадола - 3,9 (Kalso E., 2006).
Кроме того, в клинической практике очень важен показатель NNH (number needed to harm - число пациентов, которых необходимо пролечить данным препаратом, чтобы получить развитие 1 случая неблагоприятной побочной реакции, приводящей к отмене препарата). Он показывает, насколько безопасен данный препарат при его использовании. Величина NNH для трамадола, рассчитанная по результатам нескольких клинических исследований, составила 9.0, для ТЦА 14.7, для габапентина 26.1. Рассчитать показатель NNH для пластин с 5% лидокаином не представляется возможным в связи благоприятным профилем безопасности препарата, сравнимым с плацебо.
Таким образом, оценка препарата Версатис с позиций доказательной медицины делает его препаратом выбора при лечении постгерпетической невралгии, что подтверждено в соответствующих рекомендациях.
СПИСОК ЛИТЕРАТУРЫ
Постгерпетическая невралгия (ПГН) — это осложнение опоясывающего герпеса, вызванного тем же вирусом, что и ветряная оспа (лат. herpes zoster virus). При этом заболевании поражаются кожа и нервные волокна, что проявляется сильной жгучей болью уже после заживления герпетических пузырей.
Риск возникновения постгерпетической невралгии увеличивается с возрастом; чаще всего этому заболеванию подвержены люди старше 60-ти лет. Данное состояние возникает примерно у 10–20% пациентов, перенесших опоясывающий герпес . Его вылечить нельзя, но лечение постгерпетической невралгии может облегчить симптомы и снять боль. Больше чем у половины пациентов боли проходят сами по себе спустя некоторое время.
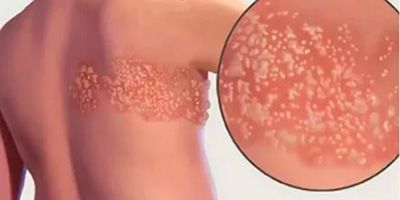
Симптомы постгерпетической невралгии, как правило, ограничиваются той областью кожи, где впервые возникли высыпания — чаще всего они опоясывают туловище или появляются сбоку, впрочем заболевание может поражать и лицо.
Болевые ощущения могут длиться в течение 3-х месяцев и дольше после заживления герпетических пузырьков. Пациенты описывают её, как жгучую, острую, пронзающую или глубокую, она возникает даже при малейшем прикосновении к коже в поражённой области, в том числе и от лёгкого прикосновения одежды (аллодиния). Гораздо реже больные чувствуют зуд и онемение.
Причины постгерпетической невралгии
После того как человек перенёс ветряную оспу, вирус остаётся в организме на всю жизнь. С возрастом иммунная система ослабевает (в частности — от приёма лекарств или химиотерапии) и вирус может активизироваться, в результате чего возникает опоясывающий лишай.
Повреждение нервных окончаний при высыпаниях приводит к возникновению постгерпетической невралгии. Будучи повреждёнными, нервные волокна не могут посылать сигнал от кожи к мозгу так, как они это делают в норме. Вместо этого, ими передаются усиленные сигналы, а пациент чувствует мучительную боль, которая может длиться месяцами или даже годами.
Факторы риска
Если у вас появились признаки опоясывающего лишая, то риск возникновения постгерпетической невралгии значительно усиливается при следующих условиях:
- возраст старше 50-ти лет;
- ярко выраженные симптомы опоясывающего лишая, имеются обильные высыпания и интенсивная боль;
- наличие сопутствующих заболеваний, в том числе сахарного диабета;
- наличие высыпаний на лице.
Осложнения
При длительном течении заболевания, особенно если оно сопровождается очень сильным болевым синдромом, у пациентов часто возникают следующие осложнения:
При наличии герпетической инфекции следует проводить адекватную терапию с учетом характера поражения (локальная, генерализованная форма), первичного или рецидивирующего течения заболевания.
- купирование клинических симптомов, ускорение разрешения клинических проявлений, уменьшение площади поражения, снижение общей интоксикации;
- предупреждение развития острого процесса или рецидива,
- уменьшение частоты рецидивов, укорочение их длительности, увеличение временного периода между рецидивами заболевания, а также облегчение их течения;
- улучшение качества жизни пациентов;
- предупреждение развития осложнений;
- предупреждение дальнейшего распространения возбудителя, снижение риска инфицирования полового партнера или новорожденного.
Половые партнеры пациентов с герпетической инфекцией (ГИ) урогенитального тракта подлежат активному выявлению. Лечение необходимо прово дить у них при клинических проявлениях герпеса. Следует рекомендовать воздерживаться от половой жизни или использовать презервативы во время обострений. Лечение должно проводиться с учетом образа жизни и потребности в подавлении, связанной с влиянием физических и психосоциальных факторов.
Важно при этом учитывать, что достижение положительного результата при лечении генитального герпеса (ГГ) сопряжено с рядом сложностей. Полная элиминация возбудителя – вируса простого герпеса (ВПГ) – невозможна. Несмотря на достигнутые успехи в лечении ГГ, существующие методы не обеспечивают полной элиминации вирусов из организма.
Методы лечения герпетической инфекции
- применяют эффективные противовирусные химиопрепараты
- применяют средства, повышающие специфическую и неспецифическую резистентность организма (интерферон и его индукторы, иммуномодуляторы, вакцины);
- проводят серотерапию и серопрофилактику (лечение и профилактику иммунными сыворотками) с использованием специфических иммуноглобулинов человека или иммунизированных животных;
- применяют местные и антисептические средства для купирования кожно-слизистых поражений.
Противовирусная терапия генитального герпеса
- лечение первичного эпизода ГГ;
- эпизодическая противовирусная терапия (для купирования каждого отдельного эпизода обострения ГИ);
- профилактическая (превентивная или супрессивная) терапия (непрерывное лечение на протяжении определенного времени для предупреждения рецидивов и предотвращения передачи инфекции другим лицам).
Существует ряд противовирусных препаратов, способные быстро и эффективно купировать острые проявления генитального герпеса. В адекватной дозировке большинство этих препаратов одинаково эффективно уменьшают тяжесть и продолжительность обострений генитального герпеса. Однако клинический опыт их применения показал, что, облегчая выраженность симптомов болезни, они не предотвращают наступление рецидивов и, в большинстве случаев, не снижают их частоту.
Профилактическая (супрессивная) противовирусная терапия
В многочисленных исследованиях показано, что продолжительная профилактическая терапия противовирусными препаратами значительно уменьшает бессимптомное и субклиническое (в продромальный период) выделение вируса.
При выборе супрессивной терапии следует принимать во внимание не только частоту рецидивов и их влияние на качество жизни конкретного пациента, но и стоимость и неудобство режима дозировки такой терапии. Редкие клинически выраженные рецидивы все же будут возникать у большинства пациентов и на фоне супрессивного лечения. До настоящего времени отсутствуют лекарственные средства системного действия, обладающие длительным периодом полувыведения, способные уменьшить вероятность «прорывов» инфекции в период профилактической (супрессивной) терапии.
Изученные в настоящее время иммунопатогенетические особенности рецидивирующей герпетической инфекции убедительно указывают на нарушения клеточного иммунного ответа у данной категории больных. При герпесе развиваются иммунодефицитные состояния, обусловленные недостаточностью различных звеньев иммунной системы. Чтобы добиться нормализации иммунологических показателей у больных с данной патологией, необходимо продолжать лечение и в межрецидивный период для коррекции остаточных иммунологических нарушений.
Важным благоприятным эффектом профилактической терапии является снижение психологического давления на пациентов.
Вакцина от герпеса
Вакцино-профилактика ГГ находится в стадии научных и экспериментальных разработок. До настоящего времени не получено ни одной эффективной профилактической вакцины против ВПГ. Природа ВПГ-инфекции, заключающаяся в локальном поражении с последующим латентным периодом без системной вирусемии, приводит к тому, что даже успешная выработка специфических антител не предохраняет от последующего рецидива.
Разработанные вакцины (живые, убитые и рекомбинантные) не нашли широкого применения из-за отсутствия надежных методов оценки эффективности курсов вакцинации, критериев продолжительности вакцинации и дальнейшей реабилитации больных.
Генитальный герпес можно и нужно лечить
Лечение генитального герпеса - это многоплановая задача, сложный и длительный процесс. Правильное лечение и назначение лекарственных средств может проводиться только квалифицированным специалистом с учетом проведенной диагностики и истории болезни. Для каждого пациента терапия должна подбираться индивидуально. При тяжелом течении заболевания показано лечение в стационаре.
Результат лечения в значительной мере зависит от опыта врача, а также от терпения и тщательного выполнения пациентом рекомендаций врача. Существующий сегодня арсенал противовирусных и иммунных препаратов позволяет решить очень многие проблемы, возникающие у лиц, страдающих рецидивирующими формами ГГ с поражением гениталий, ягодиц и другими более редкими локализациями. Раннее начало лечения имеет большое значение для получения значительного противовирусного эффекта.

Основным местом локализации первичной генитальной инфекции ВПГ у женщин является шейка матки. Чаще всего, герпетические поражения у женщин локализуются на больших и малых половых губах (68,6%), в области вульвы (41,8%), клитора (35,7%), влагалища и шейки матки (84,4%).
ВПГ был изолирован из шейки матки во время первичного заражения у 88—90 % женщин с первичной инфекцией ВПГ-2, которые имели везикулезную сыпь на наружных гениталиях, у 65 % — с повторным эпизодом инфекции ВПГ-2, и у 80 % женщин с ВПГ-1. Большинство (89 %) женщин, выделяющих вирус при первичном эпизоде заболевания, имели изменения на шейке матки.
Особенностью генитального герпеса (Herpes genitalis) женских половых органов является многоочаговость. В патологический процесс нередко вовлекаются нижний отдел мочеиспускательного канала, слизистая оболочка ануса и прямой кишки. Вовлечение в инфекционный процесс этих органов может происходить вторично, вслед за возникновением герпеса наружных гениталий, но может протекать и как изолированное поражение.
Рецидивирующая герпетическая инфекция (РГИ) может проявляться клиникой вульвовагинита и цервицита, вызывать поражения слизистой матки, труб и придатков. В 83,6 % случаев при стойких, не поддающихся терапии кольпитах, лейкоплакиях шейки матки выделяют вирус простого герпеса (ВПГ) как один из ведущих этиологических факторов заболевания.
По некоторым данным, в 66 % случаев у женщин герпетическая инфекция (ГИ) протекает атипично. Об имеющейся длительно текущей хронической ГИ можно говорить на основании особенностей клинического течения, наличия герпетического антигена в эпителиальных клетках вульвы, влагалища и периферической крови.
д) хронических часто рецидивирующих сальпингоофоритах (воспаление маточных труб и яичников) и эндометритах, не поддающихся стандартной антибактериальной терапии;
У 1–2% женщин, поступающих в гинекологическую клинику, независимо от основного заболевания, обнаруживают цитологические доказательства ВПГ-инфекции.
Герпес наружных половых органов у женщин
При рецидивирующем герпесе (РГ) наружных половых органов у женщин, очаг поражения находится в области наружных гениталий и перианальной области. Герпетические высыпания у женщин возникают на больших и малых половых губах, области лобка и промежности.
Типичная форма РГ наружных гениталий характеризуется ярко выраженными симптомами болезни, классическим развитием очага поражения (эритема, образование везикул, развитие эрозивно-язвенных элементов, эпителизация) и субъективными ощущениями (зуд, чувство жжения, болезненность, недомогание). проявляется повторяющимися пузырьковыми высыпаниями. Выраженная симптоматика позволяет врачам визуально поставить диагноз РГГ, своевременно назначить лечение и информировать больного об инфекционном характере заболевания и опасности заражения полового партнера.
Герпес нижнего отдела урогенитального тракта, анальной области и ампулы прямой кишки
Поражение слизистых оболочек входа во влагалище, влагалища, влагалищной части шейки матки, цервикального канала, уретры, мочевого пузыря, анальной области и ампулы прямой кишки проявляется в двух клинических формах:
- очаговой, характеризующейся появлением типичных для простого герпеса слизистых оболочек везикулезно-эрозивных элементов,
- диффузной, при которой патологический процесс протекает по типу неспецифического воспаления.
Герпес верхнего отдела полового тракта (поражение матки, маточных труб).
Типичная клиническая картина герпетических поражений органов верхнего отдела мочеполового тракта проявляется симптомами неспецифического воспаления. Неспецифические герпетические поражения внутренних половых органов проявляются эндоцервицитом, эрозией шейки матки, вагинитом. Ряд авторов цервициты без наружных язв также относят к атипичным проявлениям ГГ.
Клинические проявления герпетических поражений внутренних половых органов не имеют специфических особенностей по сравнению с воспалительными процессами невирусной этиологии. Обычно больные предъявляют жалобы на выделения из влагалища, периодически появляющиеся боли в малом тазу, области проекции матки, яичников.
Герпетические поражения шейки матки
Герпетические поражения шейки матки могут носить типичный и нетипичный характер. В типичном варианте генитального герпеса – это всегда хорошо заметные множественные, довольно мелкие, с четкими границами округлые эрозии; высыпные элементы быстро минуют везикулярную стадию, в которой, кстати, эти элементы плохо различимы без применения кольпоскопии. Проблема причастности ВПГ к развитию нетипичных герпетических изменений слизистой шейки матки в настоящее время находится в стадии исследований.
При кольпоскопии в острый период герпетической инфекции шейки матки определяют изъязвление с неровными краями с сукровицей в области дна. Эволюция этого поражения идет от изъязвления с красным дном к простой эрозии до полного исчезновения в течение 3-х недель. К предшествующим изменениям относят маленькие буллезные образования, затем округлые микроэрозии с последующим формированием простых красных пятен, которые похожи на местный пятнистый кольпит.
Исследования показали, что выделение ДНК ВПГ с поверхности эрозии шейки матки в 60 % случаев сопровождается репликативной фазой ГИ (репликация и сборка вирусных частиц в инфицированных клетках). При эрозии и дисплазии шейки матки ВПГ-2 выявляется в 27,2% случаев непосредственно в соскобах со слизистой цервикального канала и сопровождается повышением титра специфических иммуноглобулинов в крови до диагностических уровней.
Особое значение влияние герпетической инфекции на состояние эпителия шейки матки имеет у женщин, длительно принимающих оральные гормональные контрацептивы. Известно, что длительный прием комбинированных стероидов в той или иной мере усиливает процессы плоскоклеточной метаплазии, а также может вызывать эффект эндоцервикальной гиперплазии, причем этот эффект в случае его развития наблюдается как в эпителии цервикального канала, так и в участках псевдоэрозии на фоне эктропиона, в полипах слизистой цервикального канала. В связи с этим прием оральных комбинированных контрацептивов может являться кофактором в развитии рака шейки матки, особенно в сочетании с герпетической инфекцией.
Герпетический цервицит
В настоящее время под термином экзоцервицит (эктоцервицит) понимают воспаление влагалищной части шейки матки. Эндоцервицит - воспаление слизистой оболочки канала шейки матки (цервикального канала). Понятие «цервицит» объединяет эти два термина.
Герпетический цервицит – это воспалительный процесс, вызванный ВПГ. Для клинических проявлений герпетического цервицита характерно разнообразие проявлений — от легкой гиперемии с небольшим количеством эрозий до тяжелого некротического поражения (под эрозией шейки матки понимают дефект эпителия в результате воспаления). Цервицит диагностируется у 70-90% женщин с герпетическим поражением половых органов. Шейка матки при герпетическом эндоцервиците отечна, часто имеет эрозии, легко кровоточит при манипуляциях.
Герпетический эндометрит
Эндометрит — это воспаление внутренней (слизистой) оболочки матки (эндометрия) с поражением как функционального, так и базального слоя. Эндометрит, вызванный вирусом простого герпеса, является следствием длительной персистенции (существования) вируса в эндометрии. Герпетический эндометрит, как правило, возникает при атипичном или бессимптомном течении ГГ, типичная форма отмечается редко (~20% случаев). Клинические симптомы при вирусном поражении эндометрия чаще всего отсутствуют или проявляются нетипично, что приводит к ошибкам в диагностике и позднему началу лечения.
При герпетическомпоражении ткани нарушаются факторы местного и общего иммунитета, целостность поверхности эпителия, что приводит к созданию благоприятных условий для развития других инфекционных процессов .
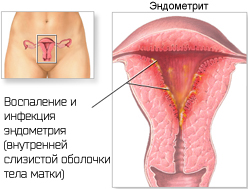
Клинически герпетический эндометрит чаще проявляется во второй фазе менструального цикла или во время беременности, что, возможно, обусловлено повышением уровня простагландинов в этот период или супрессией Т-клеточного звена иммунитета, способствующих реактивации ВПГ, персистирующего в эндометрии. Субклиническая латентная внутриматочная герпетическая инфекция является важным фактором невынашивания беременности. Эндометриты ВПГ-этиологии встречаются нечасто, но эти заболевания очень опасны и могут вызвать гибель женщины и плода.
Герпес уретры и мочевого пузыря (герпетический уретрит)
Герпетический уретрит у женщин субъективно проявляется болями и резями в начале мочеиспускания, частыми позывами к мочеиспусканию. У 4,8% женщин имеет место очень болезненное мочеиспускание, или задержка мочеиспускания в результате инфекции уретры и слизистой оболочки мочевого пузыря. Нормализация функции мочевого пузыря у больных с задержкой мочеиспускания обычно происходит в течение 6–10 дней.
При осмотре наблюдаются гиперемия наружного отверстия уретры, наличие скудных слизистых выделений; при уретроскопии в передней части уретры иногда удается обнаружить мелкие поверхностные эрозии, катаральное воспаление.
Герпетический цистит
Ведущими симптомами герпетического цистита являются цисталгия, появление болей в конце мочеиспускания, дизурические явления. При герпетическом цистите появляются гематурия (кровь в моче), появление болей в конце мочеиспускания, боли в области мочевого пузыря. У женщины это может быть первым и единственным признаком ВПГ-инфицирования мочеполовой сферы. Он нередко возникает в первые 1-3 месяца после начала половой жизни или после смены полового партнера.
Герпес анальной области и прямой кишки
Очаг поражения в анальной области обычно представляет собой рецидивирующую трещину, что нередко является поводом для диагностических ошибок. Такие больные с ошибочным диагнозом "трещина заднего прохода" попадают к хирургам. Зудящая форма герпеса ануса и герпетическое поражение геморроидальных узлов, также трудны для диагностики.
Поражение анальной области может возникнуть первично как самостоятельное заболевание или вторично – в результате затекания отделяемого влагалища и мацерации слизистой оболочки ануса при наличии у пациентки герпетического кольпита, сопровождающегося обильной экссудацией.
При поражении сфинктера и слизистой оболочки ампулы прямой кишки (герпетический проктит) больных беспокоят зуд, чувство жжения и болезненность в очаге поражения, возникают мелкие эрозии в виде поверхностных трещин с фиксированной локализацией, кровоточащие при дефекации. При ректоскопии определяется катаральное воспаление, иногда эрозии.
Герпес внутренних гениталий - субклиническая и бессимптомная формы.
Для субклинической формы герпеса внутренних гениталий (влагалища, матки, яичников и т.д.) типично отсутствие у пациентки жалоб, иногда имеются указания на периодически появляющиеся необильные слизистые выделения из влагалища. При гинекологическом осмотре симптомы воспаления не выявляются. При динамическом лабораторном исследовании мазков отделяемого канала шейки матки, влагалища и уретры периодически выявляется повышенное количество лейкоцитов (до 200–250 и выше в поле зрения), свидетельствующее о наличии воспалительного процесса. При вирусологическом исследовании мазков методом иммунофлюоресценции в лейкоцитах определяется антиген ВПГ.
Бессимптомная форма герпеса внутренних гениталий характеризуется отсутствием у больных каких-либо жалоб на половую сферу, объективных клинических данных, подтверждающих воспаление. При лабораторном исследовании отделяемого урогенитального тракта выделяется ВПГ, в то время как в мазках признаков воспаления (лейкоцитоза) нет. Бессимптомная форма герпеса внутренних гениталий выявляется у 20–40% женщин, страдающих РГГ ягодицы и бедра. Это важное обстоятельство необходимо учитывать при планировании беременности у женщин с этой формой РГГ в связи с существующей вероятностью развития во время беременности осложнений ВПГ-инфекции.
Согласно данным литературы, у 83,6% женщин, страдающих не поддающимися терапии кольпитами и лейкоплакией шейки матки, ВПГ является одним из факторов заболевания. Доказано, что ВПГ может быть причиной развития эндометрита и сальпингоофорита.
Герпетический вульвовагинит
У женщин часто встречаются герпетический вульвовагинит, особенностью течения которого является нередкое присоединение отека пораженной области. Вирус герпеса могут изолированно поражать вульву и влагалище. Заражение происходит от больных. Герпетический вульвовагинит проявляется мелкими пузырьками на гиперемированной вульве. Пузырьки содержат прозрачную, а при присоединении вторичной инфекции — гнойную жидкость. Через 5—7 дней пузырьки вскрываются с образованием эрозий и язвочек, которые покрываются струпом. В начале заболевания выражены жжение, боли и зуд в области вульвы. Общие симптомы включают головную боль, озноб, повышение температуры тела.
У женщин диагноз «атипичная форма генитального герпеса» ставится гинекологами для обозначения хронического воспалительного процесса вульвы при наличии лабораторно подтвержденной герпетической природы заболевания, в отличие от типичной картины болезни, при которой на слизистой оболочке этих органов имеются очаги поражения с везикулезно-эрозивными элементами.
Генитальный герпес во время беременности
Заболевание ВПГ женщин во время беременности может явиться причиной гибели плода, мертворождения, преждевременных родов. Герпесвирусы вызывают до 30% спонтанных абортов на ранних сроках беременности и свыше 50% поздних выкидышей, занимают второе место после вируса краснухи по тератогенности (развитие уродств плода).
Тяжелейшие формы неонатального герпеса развиваются при инфицировании новорожденного вирусом простого герпеса в родах. При первичном ГГ у матери инфицируется от 30% до 80% детей, при рецидивирующем герпесе – 3–5%. Инфицирование плода во время родоразрешения, если у матери в конце беременности имели место герпетические высыпания, происходит у 50% женщин, больных РГГ; при этом у 60–80% инфицированных детей развивается энцефалит.
Герпес менструальный
Менструальный герпес — это генитальный герпес (ГГ) с монотонным типом рецидивирования и тяжелым течением, характеризующийся ежемесячными обострениями инфекционного процесса до, во время или после менструации. Такое течение заболевания может стать для женщины сильнейшим психотравмирующим фактором, ограничивающим ее социальную активность и снижающим качество жизни.
Этот вариант ГИ является сложным для лечения. Поэтому разработка адекватных и эффективных способов лечения и профилактики рецидивов у больных с данными формами ГГ остается актуальной. Европейские стандарты лечения пациенток предусматривают длительную (годами) супрессивную терапию противовирусными препаратами , что не исключает повторного рецидирования ГГ и бессимптомного вирусовыделения, появления побочных эффектов и резистентности вирусов герпеса к лекарственной терапии.
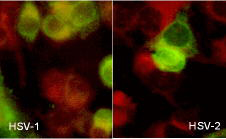
Иммунофлюоресценция - антитела ВПГ-1 и ВПГ-2
Зачем нужна лабораторная диагностика, её роль в постановке диагноза.
Чтобы установить точный и полный диагноз необходимо учитывать особенности клинического развития болезни и использовать комплекс адекватных методов обследования. В каждом конкретном случае недопустимо устанавливать диагноз «генитальный герпес» только при визуальном осмотре и наличии везикул (мелких кожных пузырьков, содержащих жидкость). Подобные эрозивно-язвенные высыпания могут быть обусловлены и другими возбудителями (стрептококковой, стафилококковой, микотической, папилломавирусной инфекцией) а также наблюдаться при сифилисе, трихомониазе, аллергических реакциях и некоторых дерматозах. Более того, визуальная диагностика невозможна при глубоком поражении тканей и органов, при бессимптомном развитии заболевания.
Вирус простого герпеса (ВПГ) является одним из немногих вирусов, для выявления этиологической роли которого при инфекционных заболеваниях используются все лабораторные диагностические реакции – от цитологических исследований до молекулярно-биологических методов верификации. Одновременно необходимо проводить обследование на наличие сопутствующих возбудителей (хламидий, микоплазм, уреаплазм, простейших и других бактерий, вирусов).
Что исследуется - биологический материал из очага инфекции
Для постановки диагноза генитального герпеса (ГГ) необходимо исследовать материал, полученный непосредственно из полового тракта, а также биологические жидкости и секреты организма.
содержимое герпетических пузырьков, кровь, слюна, спинномозговая жидкость, биоптаты шейки матки и других органов, цервикальный секрет, уретральные пробы, эякулят, секрет предстательной железы, соскобы и смывы с тканей и органов, моча, слизь, мазки-отпечатки с высыпаний и т.д
Что ищут в процессе исследования
Лабораторная диагностика заболеваний, вызванных ВПГ включает комплекс методологических подходов, цель которых состоит в обнаружении маркеров герпесвирусной инфекции, среди которых:
- геном вируса
- вирусные белки (антигены)
- инфекционные вирусные частицы
- цитопатогенное действие на клетки
- специфический иммунный ответ организма больного (его антитела)
Методы лабораторной диагностики
До недавнего времени лабораторная диагностика герпесвирусных инфекций (ГВИ) производилась только в специализированных вирусологических центрах. Появление новых методов исследования привело к расширению возможностей вирусологической диагностики ГВИ в практическом здравоохранении.
Современные методы лабораторной диагностики ГВИ позволяют: получать результаты анализа в короткие сроки (часы, иногда — минуты), проводить и завершать анализ без выделения культуры вируса, используя только нативный материал; получать надлежащую достоверность анализа, учитывая высокую специфичность и чувствительность методов исследования.
- молекулярно-биологические – детекция вирусного генома методом полимеразной цепной реакции (ПЦР);
- иммуноморфологические – выявление антигена ВПГ с помощью прямой и непрямой иммунофлюоресценции (ПИФ и НИФ);
- серологические – выявление специфических антител к ВПГ (IgA, IgM, IgG) и антигена методом иммуноферментного анализа (ИФА);
- вирусологические – выделение вируса в культуре ткани из клинического материала и его идентификация;
- цитологические.
Молекулярно-биологические методы диагностики
К молекулярно-биологическим методам относится один из самых перспективных современных методов лабораторной диагностики – метод полимеразной цепной реакции (ПЦР). Метод ПЦР, позволяет обнаружить единичные копии вирусной ДНК в клетках, биологических жидкостях (кровь, слюна, материал, взятый из уретры или цервикального канала) и биопсированных тканях.
Иммуноморфологические методы
Обнаружение вирусного антигена в клетках и жидкостях организма (клетках осадка мочи, слюны, лейкоцитах крови, мазков-отпечатков с герпетических высыпаний, шейки матки, биопсийного и аутопсийного материала) осуществляют с помощью метода иммунофлюоресценции, иммунопероксидазного и лантанидного методов.
В прямой монофлюоресценции используют антитела, меченные люминесцирующей сывороткой (изотиоционатом флюоресцеина), что позволяет выявить вирусный антиген по свечению клеток в люминесцентном микроскопе. Во втором случае применяют антитела, меченные пероксидазой. Вирусный антиген выявляют в обычном световом микроскопе по окрашиванию антигенсодержащих клеток хромогеном в темно-коричневый цвет. Разрабатываются также лантанидные методы, основанные на амплификации свечения.
Непосредственное выявление антигена в клиническом образце указывает на активную репликацию вируса и является методом, конкурирующим по надежности с методом выделения вируса в культуре тканей.
Серологические методы
Обнаружение в крови антител к ВПГ-2 не позволяет достоверно судить о наличии у больного ГГ, так как многие используемые коммерческие серологические наборы не способны точно различать антитела к ВПГ-1 и ВПГ-2 из-за высокого (70%) антигенного сродства обоих типов вируса.
Чувствительность большинства известных ИФА тест-систем для выявления ВПГ-инфекции варьируется в пределах 48–98,7% и зависит от исследуемого материала. Наличие перекрестных антигенных связей между штаммами, принадлежащими к ВПГ-1 и ВПГ-2 и другими типами герпесвирусов, требует определенной осторожности при интерпретации результатов лабораторных исследований.
В этой группе существует еще один метод – так называемый Western blot analysis: тестирование с помощью твердофазного иммунологического анализа электрофоретически разделенных белков или полипептидов. Метод высокоточен и позволяет дифференцировать антитела к ВПГ-1 и ВПГ-2.
Окончательные тесты на определение антител к ВПГ-2 должны основываться на детекции ВПГ2-типоспецифического поверхностного антигена – гликопротеина gG1–gG2. Чувствительность и специфичность серологических тестов на его основе при исследовании крови составляют 95–99 и 100% соответственно. В настоящее время типоспецифическая серология используется преимущественно в научно- исследовательских целях и не применяется в широкой клинико-лабораторной практике.
Вирусологическое исследование
Для диагноза заболевания важное значение имеет выделение вируса из пораженных тканей. Выделение вирусов в клеточной культуре включает выявление (индикацию) вируса и последующее его серотипирование. При подозрении на герпетическую инфекцию необходимо проводить многократное вирусологическое исследование материала, отделяемого из мочеполовой системы у пациентов, т.к. отрицательный результат однократного вирусологического исследования не исключает наличие урогенитальной герпетической инфекции. Повторное 2–4-кратное исследование (1 раз в неделю) повышает шанс выделения вируса в 2–3 раза.
Цитологическое исследование
Наиболее доступным, быстрым и дешевым методом исследования является цитологическое исследование инфицированного материала на ВПГ. Материалом для цитологического исследования может служить содержимое везикул, соскоб со дна эрозии, слизистой уретры, стенок влагалища, канала шейки матки.
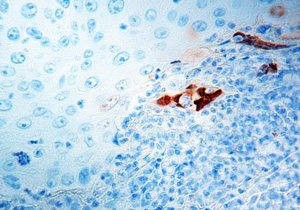
Антитела к ВПГ-2. Подготовленный лабораторный препарат (ткань, зараженная ВПГ-2)
Специальным образом подготовленные образцы исследуют с помощью световой микроскопии. При цитологическом исследовании обнаруживаются многоядерные гигантские клетки с внутриядерными включениями.
Недостатками метода являются низкая чувствительность, сложность дифференциальной диагностики с другими вирусными инфекциями и зависимость от квалификации специалиста, проводящего исследование. Однако этот метод может быть применен как вспомогательное диагностическое средство. Электронная микроскопия в диагностике герпетической инфекции также рекомендована для экспресс-диагностики ВПГ-инфекции.
Выявление противовирусных антител классов M и G
Для подтверждения инфицирования вирусом герпеса определяют уровни специфических иммуноглобулинов Ig, относящихся к различным классам G и M (IgM, IgG), циркулирующих в биологических жидкостях и секретах организма больного (сыворотке крови, ликворе, слюне, слезной жидкости). Выявление специфических противогерпетических антител (IgM, IgG,) чаще всего осуществляют методом иммуноферментного анализа (ИФА). Редко используют классические методы: реакцию нейтрализации, реакцию связывания комплемента вируса герпеса (РСК). Из новых методов следует отметить иммуноблот (western blot) и иммунодот.
Детекция типоспецифических антител позволяет определить наличие и тип герпетической инфекции по наличию М-антител, нарастанию G-антител к одному или двум вирусам. Достоверные результаты получают при исследовании парных сывороток крови больного, взятых в начале заболевания (3-7 день) и через 10-12 дней. В этом случае удается наблюдать динамику нарастания антител. При вирусных инфекциях лишь четырехкратное и большее повышение титра антител во второй сыворотке имеет диагностическое значение.
IgM детектируются через неделю после заражения. Специфические IgG антитела обычно появляются через 2-3 недели после первичного инфицирования.
Выявление специфических иммуноглобулинов IgM в отсутствии IgG или при 4-кратном увеличении титров специфических IgG в парных сыворотках крови, полученных от больного с интервалом 10-12 дней, свидетельствует о первичном заражении.
Выявление специфических иммуноглобулинов IgM на фоне IgG при отсутствии достоверного роста титров IgG в парных сыворотках говорит об обострении хронической герпетической инфекции.
Выявление титров IgG выше средних является показанием к дополнительному обследованию пациента и выявлению выделения вируса герпеса в средах.
Итоговый вывод
Таким образом, анализ методов, позволяющих подтвердить клинический диагноз «генитальный герпес», свидетельствует о разнообразии подходов к детекции вируса простого герпеса с учетом различных локализаций, манифестных и бессимптомных (наиболее проблематичных) стадий заболевания. Следует подчеркнуть, что ни один из методов лабораторной диагностики не обладает 100%-ной чувствительностью и специфичностью. Повышение достоверности лабораторной диагностики за счет исключения ложноотрицательных и ложноположительных результатов достигается путем одновременного применения нескольких методов тестирования, базирующихся на разных принципах.
Читайте также:

