Изменения соединительной ткани при старении и коллагенозах
Обновлено: 23.04.2024
Как уже говорилось, межклеточный матрикс представляет собой супрамолекулярный комплекс, образованный сложной сетью связанных между собой макромолекул. В организме человека межклеточный матрикс формирует такие высокоспециализированные структуры, как хрящ, сухожилия, базальные мембраны, а также (при вторичном отложении фосфата кальция) кости и зубы. Эти структуры различаются между собой как по молекулярному составу, так и по способам организации основных компонентов (белков и полисахаридов) в различных формах межклеточного матрикса.
Межклеточный матрикс костной и зубной ткани.Костная и зубная ткань - специализированный тип соединительной ткани. Эти ткани выполняют в организме человека следующие важные функции:
из костей образуется скелет организма;
кости защищают и поддерживают внутренние органы;
кости служат местом депонирования кальция и неорганического фосфата;
костный мозг входит в состав кроветворной и иммунной систем;
зубы как часть жевательного аппарата входят в состав пищеварительной системы;
зубы - часть речевого аппарата человека.
Замечательным свойством костей является сочетание в них таких качеств, как высокая прочность на разрыв с очень лёгким весом. Костная и зубная ткань отличаются высокой минерализацией (или кальцификацией) межклеточного матрикса и содержат по массе -50% неорганических соединений, 25% органических компонентов и 25% воды.
Неорганическая часть.В состав костей входит 99% всего кальция организма, 87% фосфора, ~ 60% магния и -25% натрия. Кальций в костях находится в форме минерала гидроксиапатита, примерный состав которого Са10(РО4)6(ОН)2. Гидроксиапатит образует кристаллы, имеющие обычно размер 20 × 5 × 1,5 нм. В костной ткани содержится много микроэлементов, таких как медь, стронций, барий, цинк, фтор и др., которые играют важную роль в обмене веществ в организме. Минеральная часть костей включает также карбонаты, гидроксиды и цитраты. Минеральный состав зуба различен в разных его частях. Твёрдые части зуба (эмаль, дентин и цемент) содержат от 70% (цемент и дентин) до 96 - 97% (эмаль) неорганических веществ. Основную часть этих веществ составляют фосфат кальция, входящий в состав кристаллов гидроксиапатита (75%), а также карбонат и фторид кальция. Мягкие части зуба (пульпа и периодонт) не относят к тканям с высокой степенью минерализации. Пульпа состоит из рыхлой волокнистой соединительной ткани (такая ткань находится практически во всех органах и образует их строму, или каркас), а периодонт образован плотной волокнистой соединительной тканью, которая также входит в состав сухожилий и связок.
Органическая часть.Органические вещества костного матрикса представлены белками, липидами и небольшим количеством протеогликанов. Основной белок костной ткани - коллаген I типа (90 - 95%). Кроме него, в матриксе костей присутствуют такие белки, как коллаген V типа, остеонектин, остеокальцин, так называемые морфогенетические белки кости (BMP) и ферменты - щелочная фосфатаза (в остеобластах) и кислая фосфатаза (в остеокластах). Оба эти фермента служат маркёрами соответствующих клеток костной ткани. Углеводная часть протеогликанов костного матрикса представлена дерматан- и кератансульфатами. Главный компонент органических веществ зубной ткани - коллаген I типа. Углеводы и липиды присутствуют в небольших количествах. Содержание органических веществ в твёрдых частях зуба варьирует от 2% (эмаль) до 30% (дентин и цемент). Содержание органических веществ в мягких частях зуба такое же, как в соответствующих видах соединительной ткани.
Mежклеточный матрикс суставного хряща. Основные компоненты межклеточного хрящевого матрикса - коллаген II типа, агрекан, гиалуроновая кислота и вода. Кроме них, в мат-риксе находятся малые протеогликаны, коллагены VI, IX, XI типов, связывающий белок, другие неколлагеновые белки (фибронектин, анкорин, хрящевой олигомерный белок, хонд-роадгерин), разнообразные ростовые факторы. "Эндоскелет" хрящевого матрикса образован фибриллярной сетью, которая состоит из коллагенов II, IX и XI типов и придаёт хрящу прочность. Коллаген XI типа находится внутри фибрилл, образованных коллагеном II типа, он играет определённую роль в сборке этих фибрилл. Коллаген IX типа антипараллельно присоединяется к фибриллам коллагена II типа. Его глобулярный НК4-домен - основный, он не связан с фибриллами коллагена II типа, и поэтому к нему может присоединяться такой компонент матрикса, как гиалуроновая кислота. Микрофибриллы, которые образуются тетрамерами коллагена VI типа, присоединяются к фибриллам коллагена II типа и к гиалуроновой кислоте. Кроме того, они могут присоединяться к клеткам, поэтому коллаген VI типа называют "мостовой" молекулой между поверхностью клетки и фибриллами коллагена во внеклеточном матриксе. Высокомолекулярные агрегаты, состоящие из агрекана и гиалуроновой кислоты, являются полианионами, так как содержат большое количество кислых групп. Это способствует высокой гидратации хрящевого матрикса и обеспечивает выполнение им рессорных функций. Содержание воды в суставном хряще непостоянно: при нагрузке жидкость вытесняется, пока давление набухания не уравновесит внешнюю нагрузку. Когда нагрузка прекращается, вода вновь возвращается в хрящ. Очень наглядно это проявляется в межпозвоночных дисках. Утром, после ночного сна, на долю воды приходится около 75% массы диска. При внешней нагрузке на диски в течение дня содержание воды уменьшается примерно на 20%. Вследствие того рост человека к вечеру на 1-2 см меньше, чем утром. У космонавтов в условиях невесомости отмечается увеличение роста даже на 5 см. Малые протеогликаны, например, декорин, присоединяются к фибриллам коллагена II типа; они влияют на фибриллогенез, так как ограничивают диаметр этих фибрилл. Важную роль в организации хрящевого межклеточного матрикса играет также фибронек-тин. Биологическое значение этих и других минорных компонентов хрящевого матрикса заключается в том, что они участвуют в сборке и организации высокомолекулярных компонентов межклеточного вещества и в регуляции функции хондроцитов.
Mежклеточный матрикс кожной ткани. Основной организующий компонент матрикса кожной ткани - коллаген VII типа. Пучки фибрилл, образованные димерами этого коллагена, своими С-концами могут присоединяться к lamina densa базальной мембраны (как бы "заякориваться" в ней) и образовывать петли в субэпидермисе. Такие "заякоренные" фибриллы могут соединять lamina densa базальной мембраны с "якорными дисками", которые находятся в более глубоких субэпителиальных слоях и по своему составу похожи на базальные мембраны (содержат коллаген IV типа). "Заякоренные" фибриллы также захватывают фибриллы коллагена I и III типов. Таким способом "заякоренные" фибриллы коллагена VII типа обеспечивают присоединение эпидермиса к дерме.
Базальные мембраны. Базальные мембраны - специализированная форма межклеточного матрикса. Они синтезируются различными клетками: эндотелиальными, эпителиальными, мышечными, нервными, жировыми. Базальные мембраны представляют собой тонкие слои, которые обычно отделяют клетки и клеточные слои от окружающей соединительной ткани. Например, они окружают отдельные мышечные волокна, жировые и шванновские клетки. В таких структурах, как почечные клубочки и лёгочные альвеолы, ба-зальные мембраны расположены между двумя различными слоями клеток и играют роль высокоселективного фильтрационного барьера. С помощью электронной микроскопии выявлена двухслойная структура базальных мембран:lamina mm, которая находится со стороны клеточной мембраны, и lamina densa, которая соединена с подлежащей соединительной тканью. Основными компонентами базальных мембран являются коллаген IV типа, ламинин, гепарансульфатсодержащие протеогликаны (ГСПГ). Нерастворимость и механическую стабильность базальных мембран обеспечивают молекулы коллагена IV типа, которые организуются в специальную опорную сеть. Эта эластичная трёхмерная сеть образует структурный остов, к которому прикрепляются другие компоненты базальных мембран. Ламинин взаимодействует практически со всеми структурными компонентами базальных мембран: коллагеном IV типа, нидогеном, ГСПГ.Нидоген формирует с ламинином нековалентно связанный комплекс. Кроме этого, нидоген имеет центр связывания коллагена IV типа и, таким образом, может играть роль "мостовой" молекулы между различными компонентами базальной мембраны.ГСПГ базальных мембран могут образовывать олигомеры, соединяясь концевыми доменами белкового ядра, а также связываться с ламинином и коллагеном IV типа. Базальные мембраны выполняют разнообразные и сложные функции. В почечных клубочках базальная мембрана служит полупроницаемым фильтром, препятствующим переходу макромолекул из плазмы в первичную мочу. Большое значение в этом процессе имеет высокий отрицательный заряд протеогликанов, который препятствует прохождению через базальную мембрану других отрицательно заряженных молекул (например, белков), а также отрицательно заряженных эритроцитов. Кроме этого, базальные мембраны играют важную роль в прикреплении и ориентации клеток в пространстве, в процессах эмбрионального развития и тканевой регенерации.
Известны 2 типа коллагеназ:
Тканевая коллагеназа присутствует у человека в различных органах и тканях. В норме она синтезируется клетками соединительной ткани, прежде всего, фибробластами и макрофагами. Тканевая коллагеназа - металлозависимый фермент, который содержит Zn 2+ в активном центре. В настоящее время известно 4 изоформы этого фермента. Активность коллагеназы зависит от соотношения в межклеточном матриксе её активаторов и ингибиторов. Среди активаторов особую роль играют плазмин, калликреин и катепсин В (см. раздел 14). Тканевая коллагеназа обладает высокой специфичностью, она перерезает тройную спираль коллагена в определённом месте, примерно на 1/4 расстояния от С-конца, между остатками глицина и лейцина (или изолейцина). Образующиеся фрагменты коллагена растворимы в воде, при температуре тела они спонтанно денатурируются и становятся доступными для действия других протеолитических ферментов. Нарушение катаболизма коллагена ведёт к фиброзу органов и тканей (в основном печени и лёгких). А усиление распада коллагена происходит при аутоиммунных заболеваниях (ревматоидном артрите и системной красной волчанке) в результате избыточного синтеза коллагеназы при иммунном ответе.
Бактериальная коллагеназа синтезируется некоторыми микроорганизмами. Например,Clostridium histolyticum (возбудитель газовой гангрены) выделяет коллагеназу, расщепляющую пептидную цепь коллагена более чем в 200 местах. Этот фермент гидролизует следующую связь -X-Гли-Про-У- между звеньями X и Гли. Таким образом разрушаются соединительнотканные барьеры в организме человека, что обеспечивает проникновение (или инвазию) этого микроорганизма и способствует возникновению и развитию газовой гангрены. Сам возбудитель не содержит коллагена и поэтому не подвержен действию коллагеназы.
Заболевания, связанные с нарушением синтеза и созревания коллагена
Коллагенозы – группа заболеваний, объединенных однотипными функционально-морфологическими изменениями со стороны соединительной ткани (главным образом, коллагенсодержащих волокон). Характерным проявлением коллагенозов является прогрессирующее течение, вовлечение в патологический процесс различных внутренних органов, сосудов, кожи, опорно-двигательной систем. Диагностика коллагенозов основана на полиорганности поражения, выявлении положительных лабораторных маркеров, данных биопсии соединительной ткани (кожи или синовиальных оболочек суставов). Чаще всего для лечения коллагенозов применяются кортикостероиды, иммунодепрессанты, НПВС, аминохинолиновые производные и др.
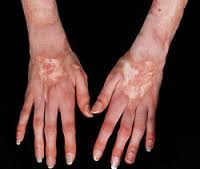
Общие сведения
Коллагенозы (коллагеновые болезни) – иммунопатологические процессы, характеризующиеся системной дезорганизацией соединительной ткани, полисистемным поражением, прогрессирующим течением и полиморфными клиническими проявлениями. В ревматологии к числу коллагенозов принято относить ревматоидный артрит, ревматизм, системную красную волчанку, системную склеродермию, узелковый периартериит, дерматомиозит, гранулематоз Вегенера и др. Эти заболевания объединены в единую группу на основании общего патоморфологического признака (фибриноидного изменения коллагена) и патогенетического механизма (нарушения иммунного гомеостаза).
Соединительная ткань формирует скелет, кожу, строму внутренних органов, кровеносные сосуды, заполняет промежутки между органами и составляет более половины массы человеческого тела. К основным функциям соединительной ткани в организме относятся защитная, трофическая, опорная, пластическая, структурная. Соединительная ткань представлена клеточными элементами (фибробластами, макрофагами, лимфоцитами) и межклеточным матриксом (основное вещество, коллагеновые, эластические, ретикулярные волокна). Таким образом, термин «коллагенозы» не в полной мере отражает происходящие в организме патологические изменения, поэтому в настоящее время данную группу принято называть «диффузными заболеваниями соединительной ткани».
Классификация коллагенозов
Различают врожденные (наследственные) и приобретенные коллагенозы. Врожденные соединительнотканные дисплазии представлены, в частности, мукополисахаридозами, синдромом Марфана, несовершенным остеогенезом, синдромом Элерса-Данлоса, эластической псевдоксантомой, синдромом Стиклера и др.
Приобретенные коллагенозы, в свою очередь, включают СКВ, склеродермию, узелковый периартериит, дерматомиозит, ревматоидный полиартрит, синдром Шегрена, ревматизм, системный васкулит, диффузный эозинофильный фасциит и др. Из них первые четыре нозологические единицы причисляют к большим коллагенозам, отличающимся истинно системным характером поражения и тяжестью прогноза; остальные – к малым коллагеновым болезням. Также принято выделять переходные и смешанные формы диффузных заболеваний соединительной ткани (синдром Шарпа).

Причины коллагенозов
Врожденные коллагенозы обусловлены наследственным (генетическим) нарушением структуры коллагена или обмена веществ. Менее изучена и понятна этиология приобретенных системной заболеваний соединительной ткани. Она рассматривается с точки зрения мультифакторной иммунопатологии, обусловленной взаимодействием генетических, инфекционных, эндокринных факторов и влияний внешней среды. Многочисленные исследования подтверждают связь между конкретными системными заболеваниями соединительной ткани и носительством определенных HLA-антигенов, главным образом, антигенов гистосовместимости II класса (HLA-D). Так, системная красная волчанка ассоциирована с носительством DR3-антигена, склеродермия - А1, В8, DR3 и DR5-антигенами, синдром Шегрена - с HLA-B8 и DR3. В семьях больных коллагенозами, чаще, чем в популяции в целом, системные заболевания регистрируются среди родственников первой степени родства.
В отношении инфекционных агентов, причастных к развитию коллагенозов, до сих пор ведутся научные исследования. Не исключается инфекционно-аллергический генез диффузных заболеваний соединительной ткани; рассматривается возможная роль внутриутробных инфекций, стафилококков, стрептококков, вирусов парагриппа, кори, краснухи, паротита, простого герпеса, цитомегаловируса, Эпштейна-Барр, Коксаки А и др.
Следует отметить связь коллагенозов с изменениями эндокринно-гормональной регуляции: с началом менструального цикла, абортами, беременностью или родами, климаксом. Внешнесредовые факторы, как правило, провоцируют обострение скрыто протекающей патологии либо выступают триггерами возникновения коллагенозов при наличии соответствующей генетической предрасположенности. Такими пусковыми механизмами могут являться стресс, травма, переохлаждение, инсоляция, вакцинация, прием лекарств и пр.
Патогенез и патоморфология коллагенозов
Патогенез коллагенозов можно представить в виде следующей общей схемы. На фоне бактериально-вирусной сенсибилизации организма формируются патогенные иммунные комплексы, которые оседают на базальной мембране сосудов, синовиальных и серозных оболочках и провоцируют развитие неспецифического аллергического воспаления. Эти процессы вызывают аутоаллергию и аутосенсибилизацию к собственным тканям, нарушение клеточного и гуморального факторов иммуногенеза, гиперпродукцию аутоантител к ядрам клеток, коллагену, эндотелию сосудов, мышцам.
Извращенные иммунные, сосудистые и воспалительные реакции при коллагенозах сопровождаются патологической дезорганизацией соединительной ткани. Патоморфологические изменения проходят 4 стадии: мукоидного набухания, фибриноидного некроза, клеточной пролиферации и склероза.
Коллагенозы сопровождаются различными патологоанатомическими изменениями, однако все заболевания объединяет диффузное вовлечение в патологический процесс соединительной ткани организма, которое может встречаться в различных сочетаниях. Так при узелковом периартериите преимущественно поражаются сосуды мышечного типа, что приводит к рубцеванию и запустеванию последних, поэтому в клиническом течении нередко отмечаются аневризмы сосудов, кровоизлияния, кровотечения, инфаркты. Для склеродермии типично развитие распространенного склероза (поражения кожи и подкожной клетчатки, пневмосклероза, кардиосклероза, нефросклероза). При дерматомиозите преобладает поражения кожи и мышц, а также расположенных в них артериол. Системная красная волчанка характеризуется полисиндромным течением с развитием дерматоза, полиартрита, синдрома Рейно, плеврита, нефрита, эндокардита, менингоэнцефалита, пневмонита, невритов, плекситов и пр.
Симптомы коллагенозов
Несмотря на многообразие клинико-морфологических форм коллагенозов, в их развитии прослеживаются общие черты. Все заболевания имеют длительное волнообразное течение с чередованием обострений и ремиссий, неуклонным прогрессированием патологических изменений. Характерна стойкая лихорадка неправильного типа с ознобами и профузными потами, признаки аллергии, необъяснимая нарастающая слабость. Общими для всех коллагенозов являются системный васкулит, мышечно-суставной синдром, включающий миалгии, артралгии, полиартриты, миозиты, синовиты. Часто отмечается поражение кожи и слизистых оболочек - эритематозная сыпь, петехии, подкожные узелки, афтозный стоматит и др.
Поражение сердца при коллагенозах может сопровождаться развитием миокардита, перикардита, миокардиодистрофии, кардиосклероза, артериальной гипертензии, ишемии, стенокардии. Со стороны органов дыхания отмечаются пневмониты, плевриты, инфаркт легкого, пневмосклероз. Почечный синдром включает в себя гематурию, протеинурию, амилоидоз почек, хроническую почечную недостаточность. Нарушения деятельности ЖКТ могут быть представлены диспепсией, желудочно-кишечными кровотечениями, приступами абдоминальных болей, симулирующими холецистит, аппендицит и др.
Полиморфизм клинической картины объясняется органоспецифичностью поражения при различных формах коллагенозов. Обострения диффузных заболеваний соединительной ткани обычно связаны с инфекциями, переохлаждением, гиперинсоляцией, травмами.
Диагностика коллагенозов
Основанием для предположения той или иной формы коллагеноза служит наличие классических клинико-лабораторных признаков. Типично появление в крови неспецифических маркеров воспаления: С-реактивного белка, повышение α2-глобулинов, фибриногена, серомукоида, СОЭ и др. Большое диагностическое значение имеет определение иммунологических маркеров, характерных для каждого заболевания: ЦИК, антинуклеарного и ревматоидного факторов, антител к одно- и двухспиральной ДНК, антистрептолизина-0, антител к ядерным антигенам, уровня комплемента и др. Нередко для постановки патоморфологического диагноза приходится прибегать к биопсии кожи, мышц, синовиальной оболочки суставов, почки.
Определенную помощь в диагностике коллагенозов может оказать рентгенологическое исследование костей и суставов, при котором выявляются общие (остеопороз, сужение суставных щелей), а также частные рентгенологические признаки (узурация суставных поверхностей при ревматоидном артрите, асептические некрозы суставных поверхностей при СКВ, остеолизы дистальных фаланг при склеродермии и т. п.). Для выявления характера и степени поражения внутренних органов используются ультразвуковые методы диагностики (ЭхоКГ, УЗИ плевральной полости, УЗИ почек, УЗИ органов брюшной полости), МРТ, КТ. Дифференциальная диагностика различных форм коллагенозов проводится ревматологом; при необходимости пациента консультируют другие специалисты: кардиолог, пульмонолог, иммунолог, дерматолог и др.
Лечение и прогноз коллагенозов
Течение большинства коллагеновых болезней прогрессирующее и рецидивирующее, что требует поэтапного, длительного, нередко пожизненного лечения. Чаще всего для терапии различных форм коллагенозов используются следующие группы препаратов: стероидные (глюкокортикоиды) и нестероидные противовоспалительные средства, цитостатики, аминохинолиновые производные, препараты золота. Дозировка и длительность курсов определяется строго индивидуально с учетом типа заболевания, остроты и тяжести течения, возраста и индивидуальных особенностей больного.
Для всех видов коллагенозов характерно хроническое прогрессирующее течение с многосистемным поражением. Назначение кортикостероидной или иммуносупрессивной терапии помогает уменьшить остроту клинических симптомов, привести к более или менее длительной ремиссии. Наиболее скоротечное развитие и тяжелое течение имеют так называемые большие коллагенозы. Гибель больных может наступить в результате почечной, сердечно-сосудистой, дыхательной недостаточности, присоединения интеркуррентной инфекции. Для профилактики обострений коллагенозов важно устранить очаги хронической инфекции, проходить диспансерное обследование, избегать избыточной инсоляции, переохлаждения и других провоцирующих факторов.
Соединительнотканная дисплазия – группа полиморфных в клиническом отношении патологических состояний, обусловленных наследственными или врожденными дефектами синтеза коллагена и сопровождающихся нарушением функционирования внутренних органов и опорно-двигательного аппарата. Наиболее часто соединительнотканная дисплазия проявляется изменением пропорций тела, костными деформациями, гипермобильностью суставов, привычными вывихами, гиперэластичной кожей, клапанными пороками сердца, хрупкостью сосудов, мышечной слабостью. Диагностика основана на фенотипических признаках, биохимических показателях, данных биопсии. Лечение соединительнотканной дисплазии включает ЛФК, массаж, диету, медикаментозную терапию.

Общие сведения
Соединительнотканная дисплазия – понятие, объединяющее различные заболевания, обусловленные наследственной генерализованной коллагенопатией и проявляющиеся снижением прочности соединительной ткани всех систем организма. Популяционная частота соединительнотканной дисплазии составляет 7-8%, однако предполагается, что отдельные ее признаки и малые недифференцированные формы могут встречаться у 60-70% населения. Соединительнотканная дисплазия попадает в поле зрения клиницистов, работающих в разных медицинских областях – педиатрии, травматологии и ортопедии, ревматологии, кардиологии, офтальмологии, гастроэнтерологии, иммунологии, пульмонологии, урологии и др.

Причины
В основе развития соединительнотканной дисплазии лежит дефект синтеза или структуры коллагена, белково-углеводных комплексов, структурных белков, а также необходимых ферментов и кофакторов. Непосредственной причиной рассматриваемой патологии соединительной ткани выступают различного рода воздействия на плод, приводящие к генетически детерминированному изменению фибриллогенеза внеклеточного матрикса. К таким мутагенным факторам относятся:
- неблагоприятная экологическая обстановка,
- неполноценное питание и вредные привычки матери,
- стрессы,
- отягощенное течение беременности и пр.
Некоторые исследователи указывают на патогенетическую роль гипомагниемии в развитии соединительнотканной дисплазии, основываясь на выявлении дефицита магния при спектральном исследовании волос, крови, ротовой жидкости. Синтез коллагена в организме кодируется более 40 генами, в отношении которых описано свыше 1300 видов мутаций. Это обусловливает разнообразие клинических проявлений соединительнотканных дисплазий и усложняет их диагностику.
Классификация
Соединительнотканная дисплазия подразделяются на дифференцированные и недифференцированные. К числу дифференцированных дисплазий относятся заболевания с определенным, установленным типом наследования, четкой клинической картиной, известными генными дефектами и биохимическими нарушениями. Наиболее типичными представителями данной группы наследственных заболеваний соединительной ткани служат синдром Элерса-Данлоса, синдром Марфана, несовершенный остеогенез, мукополисахаридозы, системный эластоз, диспластический сколиоз, синдром Билса (врожденная контрактурная арахнодактилия) и др. Группу недифференцированных соединительнотканных дисплазий составляют различные патологии, чьи фенотипические признаки не соответствуют ни одному из дифференцированных заболеваний.
По степени выраженности выделяют следующие виды соединительнотканных дисплазий: малые (при наличии 3-х и более фенотипических признаков), изолированные (с локализацией в одном органе) и собственно наследственные заболевания соединительной ткани. В зависимости от преобладающих диспластических стигм различают 10 фенотипических вариантов соединительнотканной дисплазии:
- Марфаноподо6ная внешность (включает 4 и более фенотипических признака скелетной дисплазии).
- Марфаноподо6ный фенотип (неполный набор признаков синдрома Марфана).
- МАSS-фенотип (включает поражение аорты, митрального клапана, скелета и кожи).
- Первичный пролапс митрального клапана (характеризуется ЭхоКГ-признаками митрального пролапса, изменениями со стороны кожи, скелета, суставов).
- Классический элерсоподобный фенотип (неполный набор признаков синдрома Элерса-Данлоса).
- Гипермобильный элерсоподобный фенотип (характеризуется гипермобильностью суставов и сопутствующими осложнениями – подвывихами, вывихами, растяжениями, плоскостопием; артралгиями, вовлечением костей и скелета).
- Гипермобильность суставов доброкачественная (включает повышенный объем движений в суставах без заинтересованности костно-скелетной системы и артралгий).
- Недифференцированная соединительнотканная дисплазия (включает 6 и более диспластических стигм, которых, однако, недостаточно для диагностики дифференцированных синдромов).
- Повышенная диспластическая стигматизация с преимущественными костно-суставными и скелетными признаками.
- Повышенная диспластическая стигматизация с преимущественными висцеральными признаками (малыми аномалиями сердца или других внутренних органов).
Поскольку описание дифференцированных форм соединительнотканной дисплазии подробно дано в соответствующих самостоятельных обзорах, в дальнейшем речь пойдет о ее недифференцированных вариантах. В том случае, когда локализация соединительнотканной дисплазии ограничена одним органом или системой, она является изолированной. Если дисплазия соединительной ткани проявляется фенотипически и захватывает, как минимум, один из внутренних органов, данное состояние рассматривается как синдром соединительнотканной дисплазии.
Симптомы соединительнотканной дисплазии
Фенотипические признаки
Внешние признаки соединительнотканной дисплазии представлены конституциональными особенностями, аномалиями развития костей скелета, кожи и др. Пациенты с дисплазией соединительной ткани имеют астеническую конституцию: высокий рост, узкие плечи, дефицит массы тела. Нарушения развития осевого скелета могут быть представлены сколиозом, кифозом, воронкообразной или килевидной деформациями грудной клетки, ювенильным остеохондрозом.
Краниоцефальные стигмы соединительнотканной дисплазии нередко включают долихоцефалию, нарушения прикуса, аномалии зубов, готическое небо, несращение верхней губы и нёба. Патология костно-суставной системы характеризуется О-образной или Х-образной деформацией конечностей, синдактилией, арахнодактилией, гипермобильностью суставов, плоскостопием, склонностью к привычным вывихам и подвывихам, переломам костей.
Со стороны кожных покровов отмечается повышенная растяжимость (гиперэластичность) или, напротив, хрупкость и сухость кожи. Нередко на ней без видимых причин возникают стрии, пигментные пятна либо очаги депигментации, сосудистые дефекты (телеангиэктазии, гемангиомы). Слабость мышечной системы при соединительнотканной дисплазии обусловливает склонность к опущению и выпадению внутренних органов, грыжам, мышечной кривошее. Из других внешних признаков соединительнотканной дисплазии могут встречаться такие микроаномалии, как гипо- или гипертелоризм, лопоухость, асимметрия ушей, низкая линия роста волос на лбу и шее и др.
Изменения со стороны внутренних органов
Висцеральные поражения протекают с заинтересованностью ЦНС и вегетативной нервной системы, различных внутренних органов. Неврологические нарушения, сопутствующие соединительнотканной дисплазии, характеризуются вегето-сосудистой дистонией, астенией, энурезом, хронической мигренью, нарушением речи, высокой тревожностью и эмоциональной неустойчивостью. Синдром соединительнотканной дисплазии сердца может включать в себя пролапс митрального клапана, открытое овальное окно, гипоплазию аорты и легочного ствола, удлинение и избыточную подвижность хорд, аневризмы коронарных артерий или межпредсердной перегородки.
Следствием слабости стенок венозных сосудов служит развитие варикозного расширения вен нижних конечностей и малого таза, геморрой, варикоцеле. Пациенты с соединительнотканной дисплазией имеют склонность к возникновению артериальной гипотензии, аритмий, атриовентрикулярных и внутрижелудочковых блокад, кардиалгий, внезапной смерти.
Кардиальным проявлениям нередко сопутствует бронхолегочный синдром, характеризующийся наличием кистозной гипоплазии легких, бронхоэктазов, буллезной эмфиземы, повторных спонтанных пневмотораксов. Характерно поражение ЖКТ в виде опущения внутренних органов, дивертикулов пищевода, гастроэзофагеального рефлюкса, грыжи пищеводного отверстия диафрагмы. Типичными проявлениями патологии органа зрения при соединительнотканной дисплазии служат близорукость, астигматизм, дальнозоркость, нистагм, косоглазие, подвывих и вывих хрусталика.
Со стороны мочевыделительной системы может отмечаться нефроптоз, недержание мочи, почечные аномалии (гипоплазия, удвоение, подковообразная почка) и пр. Репродуктивные нарушения, ассоциированные с соединительнотканной дисплазией, у женщин могут быть представлены опущением матки и влагалища, метро- и меноррагией, самопроизвольными абортами, послеродовыми кровотечениями; у мужчин возможен крипторхизм. Лица, имеющие признаки соединительнотканной дисплазии, склонны к частым ОРВИ, аллергическим реакциям, геморрагическому синдрому.
Диагностика
Заболевания из группы соединительнотканных дисплазий не всегда диагностируются правильно и своевременно. Часто больные с теми или иными признаками дисплазии наблюдаются у врачей разных специальностей: травматологов, неврологов, кардиологов, пульмонологов, нефрологов, гастроэнтерологов, офтальмологов и др. Распознавание недифференцированных форм соединительнотканной дисплазии усложняется отсутствием единых алгоритмов диагностики.
Наибольшей диагностической значимостью обладает выявление совокупности фенотипических и висцеральных признаков. С целью обнаружения последних широко применяются ультразвуковые (ЭхоКГ, УЗИ почек, УЗИ органов брюшной полости), эндоскопические (ФГДС), электрофизиологические (ЭКГ, ЭЭГ), рентгенологические (рентгенография легких, суставов, позвоночника и др.) методы. Выявление характерных полиорганных нарушений, главным образом, со стороны опорно-двигательной, нервной и сердечно-сосудистой систем с высокой степенью вероятности свидетельствует о наличии соединительнотканной дисплазии.
Дополнительно исследуются биохимические показатели крови, система гемостаза, иммунный статус, проводится биопсия кожи. В качестве метода скрининг-диагностики соединительнотканной дисплазии предложено проводить исследование папиллярного рисунка кожи передней брюшной стенки: выявление неоформленного типа папиллярного рисунка служит маркером диспластических нарушений. Семьям, где имеются случаи соединительнотканной дисплазии, рекомендуется пройти медико-генетическое консультирование.
Лечение соединительнотканной дисплазии
Специфического лечения соединительнотканной дисплазии не существует. Пациентам рекомендуется придерживаться рационального режима дня и питания, оздоровительных физических нагрузок. С целью активизации компенсаторно-приспособительных возможностей назначаются курсы ЛФК, массажа, бальнеотерапии, физиотерапии, иглорефлексотерапии, остеопатии.
В комплексе лечебных мероприятий, наряду с синдромальной медикаментозной терапией, используются метаболические препараты (L-карнитин, коэнзим Q10), препараты кальция и магния, хондропротекторы, витаминно-минеральные комплексы, антиоксидантные и иммуномодулирующие средства, фитотерапия, психотерапия.
Прогноз
Прогноз соединительнотканной дисплазии во многом зависит от степени выраженности диспластических нарушений. У пациентов с изолированными формами качество жизни может не нарушаться. У больных с полисистемным поражением повышен риск ранней и тяжелой инвалидизации, преждевременной смерти, причинами которой могут выступать фибрилляция желудочков, ТЭЛА, разрыв аневризмы аорты, геморрагический инсульт, тяжелые внутренние кровотечения и др.
Общим возрастным изменением, которое свойственно всем видамсоединительной ткани, является уменьшение содержания воды и отношения основное вещество/волокна. Показатель этого соотношения уменьшается как за счет нарастания содержания коллагена, так и в результате снижения концентрации гликозаминогликанов. В первую очередь значительно снижается содержание гиалуроновой кислоты. Однако не только уменьшается общее количество кислых гликозаминогликанов, но изменяется и количественное соотношение отдельных гликанов. Одновременно происходит также изменение физико-химических свойств коллагена (увеличение числа и прочности внутри- и межмолекулярных поперечных связей, снижение эластичности и способности кнабуханию, развитие резистентности к кол-лагеназе и т.д.), повышается структурная стабильность коллагеновых волокон (прогрессирование процесса «созревания» фибриллярных структур соединительной ткани). Следует помнить, что старение коллагена in vivo неравнозначно износу. Оно является своеобразным итогом протекающих в организме метаболических процессов, влияющих на молекулярную структуру коллагена.
Среди многих поражений соединительной ткани особое место занимаютколлагенозы. Для них характерно повреждение всех структурных составных частей соединительной ткани: волокон, клеток и межклеточного основноговещества. К коллагенозам обычно относят ревматизм, ревматоидный артрит, системную красную волчанку, системную склеродермию, дерма-томиозит и узелковый периартериит. Каждое из этих заболеваний имеет своеобразное течение и сугубо индивидуальные проявления. Среди многочисленных теорий развития коллагенозов наибольшее признание получила теория инфекционно-аллергического происхождения.
Наконец, необходимо отметить, что нарушение процесса гидроксилирования коллагена – один из биохимических дефектов при цинге. Коллаген, синтезированный в отсутствие или при дефиците аскорбиновой кислоты, оказывается недогидроксилированным и, следовательно, имеет пониженную температуру плавления. Такой коллаген не может образовать нормальные по структуре волокна, что и приводит к поражению кожи и ломкости сосудов, столь четко выраженных при цинге.
Мукополисахаридозы — группа наследственных болезней соединительной ткани, обусловленных нарушением обмена гликозаминогликанов (кислых мукополисахаридов) в результате генетически обусловленной неполноценности ферментов, участвующих в их расщеплении. Наследуется по аутосомно-рецессивному типу.
При М. поражается система лизосомных ферментов, участвующих в катаболизме гликозаминогликанов. Вследствие ферментативной недостаточности последние накапливаются в большом количестве в органах и тканях, поэтому М. относят к болезням накопления. В результате нарушается функциональное состояние различных органов и систем, а поскольку гликозаминогликаны входят в состав соединительной ткани, то одним из ведущих проявлений мукополисахаридоза является системное поражение скелета, задержка физического развития, особенно при I-S, IV и VI типах.
По современной классификации, в зависимости от характера ферментативного дефекта выделяют восемь основных типов М.
Лечение симптоматическое. При этом больных наблюдают разные специалисты — хирурги (удаление грыж), ортопеды (ортопедическая коррекция нарушений опорно-двигательного аппарата), педиатры (в связи с частыми острыми респираторными вирусными инфекциями, сердечно-сосудистой недостаточностью), оториноларингологи (в связи с нарушениями слуха, хроническими отитами и синуситами), офтальмологи, нейрохирурги и невропатологи (внутричерепная гипертензия). Использование для лечения гормональных препаратов (кортикотропина, глюкокортикоидов, тиреоидина), витамина А, переливаний препаратов крови плазмы, введения декстрана-70 приводит лишь к временному улучшению.
Прогноз при всех формах неблагоприятный, т.к. с возрастом нарастают изменения скелета, нарушения функций различных органов и систем.
Заживление ран — процесс репарации повреждённой ткани с восстановлением её целостности и прочности.
Заживление ран включает три основных процесса.
1. Образование коллагена (соединительной ткани) фибробластами.
2. Эпителизация раны происходит по мере миграции клеток эпителия от краёв раны на её поверхность.
3. Сокращение раневых поверхностей и закрытие раны обеспечивает эффект тканевого стяжения, в определённой степени обусловленный сокращением миофибробластов.
В течение первой и второй недели фибробласты мигрируют в область раны. Под действием ферментов, выделяемых клетками крови и близлежащих тканей, фибробласты формируют коллагеновые волокна и основное вещество раны (например, фибронектин). Эти вещества способствуют фиксации фибробластов к подлежащему слою. Коллагенизация раны начинается приблизительно с пятого дня и приводит к быстрому нарастанию прочности раны. Восстанавливаются и остальные компоненты повреждённой соединительной ткани. Происходит реканализация лимфатических сосудов, начинается прорастание кровеносных сосудов, формируется множество капилляров, питающих фибробласты. В последних стадиях заживления многие из этих капилляров исчезают.
Патологические компоненты мочи: белки, глюкоза, ацетоновые (кетоновые) тела, желчные и кровяные пигменты.
Белки. В норме белок в моче практически отсутствует. Нормальные величины: белок 10-140 мг/л или 50-150 мг/сут.
Клинико-диагностическое значение: появление белка в моче называется протеинурией. По степени потери белка различают от 0,003 до 1 г/сут, от 1 до 3 г/сут, от 3 г/сут и более. Самая большая потеря белка происходит при поражении гломерулярного аппарата. Почечная протеинурия возникает при поражении почек:
- поражение почечного фильтра – повышение проницаемости гломерул (нарушение эндотелия, базальной мембраны, дефект подоцитов),
- снижение кровотока в почках (замедление, уменьшение объема крови).
- данный вид протеинурия возникает при воспалении в мочеточниках, мочевом пузыре, уретре, предстательной железе,
- также в моче определяют белок Бенс-Джонса, что характерно для миеломной болезни, макроглобулинемии Вальденстрема.
Функциональная почечная протеинурия (временная) – при стрессах, отрицательных эмоциях, при длительной физической нагрузке (маршевая), при длительном нахождении в положении стоя (чаще у детей), холодовая.
Глюкоза. Моча здорового человека содержит минимальное количество глюкозы, которое обычными лабораторными пробами не обнаруживается.
Нормальные величины: глюкоза 0,06-0,83 ммоль/л или менее 2,78 ммоль/сут).
Клинико-диагностическое значение: появление глюкозы в моче называется глюкозурия. Для более достоверной оценки исследуют мочу, собранную за сутки. Существуют две основные причины, обуславливающие появление глюкозы в моче:
- гипергликемия, при которой концентрация глюкозы в ультрафильтрате превышает способность почек к ее реабсорбции (сахарный и стероидный диабет, тиреотоксикоз),
- нарушение канальцевой реабсорбции, при которой даже низкие количества глюкозы не реабсорбируются (нефроз, нефрит, нефротический синдром, ренальный диабет).
Физиологическая глюкозурия наблюдается при употреблении большого количества сладостей (только при наличии нарушений в почках или инсулярного аппарата), при стрессе, после приема лекарств (кофеин, кортикостероидные гормоны).
Кетоновые (ацетоновые) тела. Нормальные величины: ацетоацетат отрицательна. В нормальной моче эти соединения встречаются лишь в самых ничтожных количествах (не более 0,01 г в сутки). Они не обнаруживаются обычными качественными пробами (нитропруссидные пробы Легаля, Ланге и др.). При выделении больших количеств кетоновых тел качественные пробы становятся положительными. Это явление патологическое и называется кетонурией. Например, при сахарном диабете ежедневно может выделяться до 150 г кетоновых тел
Клинико-диагностическое значение: наличие кетоновых тел в моче называют кетонурией. Чаще всего наблюдают при тяжелом сахарном диабете, диабетической коме, голодании, тяжелых токсикозах.
Определение кетонов в моче может использоваться для оценки эффективности диеты при снижении веса.
Кровь. В моче кровь может быть обнаружена либо в форме красных кровяных клеток (гематурия), либо в виде растворенного кровяного пигмента (гемоглобинурия). Гематурии бывают почечные и внепочечные. Почечная гематурия – основной симптом острого нефрита. Внепочечная гематурия наблюдается при воспалительных процессах или травмах мочевых путей. Гемоглобинурии обычно связаны с гемолизом и гемоглобинемией. Принято считать, что гемоглобин появляется в моче после того, как содержание его в плазме превысит 1 г на 1 л. Гематурию диагностируют, как правило, с помощью цитологического исследования (исследование осадка мочи под микроскопом), а гемоглобинурию – химическим путем.
В моче при патологиях может обнаруживаться и продукт распада гема билирубин. Нормальные величины: билирубин отрицательный
Клинико-диагностическое значение: билирубинурия может развиться при инфекционных заболеваниях, диффузном токсическом зобе. При заболеваниях печени он появляется в моче в виде билирубина глюкуронида (прямой билирубин) – паренхиматозные желтухи при вирусных гепатитах или нарушение оттока желчи при механических желтухах. Для гемолитических желтух билирубинурия не характерна, т.к. непрямой билирубин не проходит через почечный фильтр.
112. Особенности биохимического состава нервной ткани: а) аминокислоты, пептиды и белки нервной ткани:биологическая роль в функционировании нервной ткани;
В нервной ткани концентрация свободных аминокислот в 8 раз больше, чем в плазме крови. Центральное место в обмене принадлежит глутаминовой кислоте, глутамину, аспарагиновой кислоте, ацетиласпарагиновой кислоте, у-аминомасляной кислоте. Глутаминовая кислота нейтрализирует аммиак в нервной ткани, превращаясь в глутамин, который удаляется через ГЭБ в кровь. у-Аминомасляная кислота образуется путем декарбоксилирования глутаминовой кислоты. Ацетиласпарагиновая кислота — это запасная форма хранения аминокислот в нервной ткани В тканях мозга интенсивно протекают метаболические превращения аминокислот, такие, как окислительное дезаминирование, трансаминирование, модификация боковой цепи и др. В особенности важной для нормального функционирования головного мозга является реакция декарбоксилирования, в результате которой образуется γ-аминомасляная кислота (γ-аминобутират) (ГАМК) (предшественник — глутамат) и биогенные амины. Некоторые аминокислоты, например глицин, аспартат, глутамат, ГАМК, выполняют в нейронах функцию медиаторов. Они хранятся в синапсах и выделяются при поступлении нервного импульса. Переносчики индуцируют или ингибируют потенциал действия, контролируя тем самым возбуждение соседних нейронов. Специфическими белками являются белок S-100, белок 14-3-2, снейрофизин, нейротубулин, нейростенин Пептиды: карнозин, анзерин, гомокарнозин, гомоанзерин, энкефалины, эндорфины, пептид сна
б) особенности липидного состава нервной ткани и биологическая роль липидов функционировании нервной ткани;
Особенностью нервной ткани является использование липидов в качестве пластического (структурного) материала, в то время как в других тканях эту функцию выполняют белки. Липиды представлены цереброзидами, ганглиозидами, сфингомиелинами, плазмалогенами, фосфатидилсеринами, фосфатидилхолинами, фосфатидилинозитами, фосфатидилэтаноламинами и холестерином. Миелиновые мембраны имеют 3 слоя белка и 2 слоя липидов, в которые входят фосфатидилсерин, цереброзиды, сфингомиелины и холестерин. В сером веществе головного мозга 5% липидов, в белом веществе — 17%. Доказательством пластической роли липидов является замедленный обмен ВЖК в нервной ткани в сравнении с другими тканями организма
в) биохимический состав и функции миелина;
миелин - система, образованная многократно наслаивающимися мембранами клеток нейроглии 2 вокруг нервных отростков (в периферических нервных стволах нейроглия представлена леммоцитами, или шванновскими клетками, а в белом веществе ЦНС - астроцитами макроглии).
По химическому составу миелиновое вещество является сложным белково-липидным комплексом. На долю липидов приходится до 80% плотного остатка; 90% всех липидов миелина представлено холестерином, фосфолипидами и цереброзидами.
Уникальной особенностью миелина является его формирование в результате спирального обвития отростков глиальных клеток вокруг аксонов, настолько плотного, что между двумя слоями мембраны практически не остается цитоплазмы. Миелин представляет собой эту двойную мембрану, то есть состоит из липидного бислоя и белков, связанных с ним.
Среди белков миелина выделяют так называемые внутренние и внешние белки. Внутренние интегрированы в мембрану, внешние расположены поверхностно, и поэтому связаны с ней слабее. Миелин также содержит гликопротеиды и гликолипиды.
Белки составляют 25—30 % массы сухого вещества миелиновой оболочки нейронов ЦНС млекопитающих. На долю липидов приходится приблизительно 70—75 % от сухой массы. В миелине спинного мозга процент содержания липидов выше, чем в миелине головного. Большую часть липидов составляют фосфолипиды (43 %), остальное — холестерин и галактолипиды в примерно равном соотношении.
Среди основных функций миелина можно выделить, то как он быстро проводит нервный импульс по окружающим его аксонам. При формировании миелина мембраны окружающих его клеток, плотно соприкасаются, что дает ему высокое сопротивление а также малую емкость, и таким образом обеспечивая эффективную изоляцию аксону и предотвращает распространение импульса в продольном направлении. Прерываться миелин может только в области перехватов Ранвье, которые можно встретить через равные промежутки, длиной приблизительно 1мм. Помимо того, что миелин участвует в передачах нервного импульса, также он помогает в питании нервного волокна и выполняет некоторые функции, такие как : защитная и структурная.
г) углеводы нервной ткани.
Углеводы нейронов являются основным источником энергии для них. Глюкоза является почти единственным энергетическим субстратом, поступающим в нервную ткань, который может быть использован ее клетками для образования АТФ. Глюкоза, поступая в нервную клетку, превращается в гликоген, который при необходимости под влиянием ферментов самой клетки превращается вновь в глюкозу. Вследствие того что запасы гликогена при работе нейрона не обеспечивают полностью его энергетические траты, источником энергии для нервной клетки служит глюкоза крови.
Глюкоза расщепляется в нейроне аэробным и анаэробным путем. Расщепление идет преимущественно аэробным путем, этим объясняется высокая чувствительность нервных клеток к недостатку кислорода. Увеличение в крови адреналина, активная деятельность организма приводят к увеличению потребления углеводов. При нар козе потребление углеводов снижается.
113. Энергитический обмен в головном мозге.
Биоэнергетика мозга значительно зависит от поставки кислорода, который используется на аэробное окисление глюкозы. Газообмен в головном мозге значительно выше,чем в других тканях и превышает его в мышцах в 20 раз.
Основной потребитель энергии АТФ –это проценс генерации ПД на мембране нейронов ,который требует постоянного функционирования K-Na насоса –мемтбранной NA-K-АТФ-азы.
Из всех субстратов ,глюкоза,поступающая из крови, потребляется в г.м. в самой большей степени.
НО в уловиях голодания или изнуритальной физ.работы г.м. может переходить на окисление АЦЕТОАЦЕТАТА.
Резервы гликогена в орг. Ограничены, поэтому нарушение потребления глюкозы и О2 головным мозгом (в условиях гипоглюкозэмии) уже через несколько минут приводит к глубоким нарушениям обмена веществ и развитию каматозного состояния.
В ткани г.м. в реакции гидролитического дезаминирования АМФ постоянно обр. свободный АММИАК ,который обезвреживается взаимодействием с ГЛУТАМАТОМ , с образованием Глутамина,который выходит в кровь .

Коллагеноз представляет собой группу заболеваний, характеризующихся поражением соединительной ткани, в том числе и волокон, содержащих в своем составе коллаген. Коллагенозы относятся к группе патологий с участием тканей, богатых белком, поддерживающих на должном уровне функционирование органов и частей тела. Результатом коллагеноза становятся нарушения работы мышц, суставов и других органов, а также ухудшение состояния кожного покрова.
Симптомами коллагеноза могут быть:
- слабость;
- болезненные ощущения в мышцах и суставах;
- субфебрильная температура – повышение температуры тела на протяжении продолжительного временного отрезка в пределах 37 – 37,5°C;
- кожные высыпания;
- чрезмерная потливость.
Существует более 200 патологий соединительной ткани, симптомы и причины возникновения которых тесно взаимосвязаны. Попробуем разобраться с некоторыми самыми распространенными типами коллагенозов.
2. Наследственные заболевания соединительной ткани
Некоторые болезни соединительной ткани являются результатом изменений в определенных генах. Вот наиболее распространенные из них:
Синдром Элерса-Данло
Данный синдром представляет собой группу заболеваний наследственного характера, отличительной особенностью которых являются гипермягкие суставы, повышенная эластичность кожи, подверженные повреждениям кровеносные сосуды, аномальный рост рубцовой ткани и синяки. Симптоматика данного синдрома может варьироваться от легкой степени до высокой. В зависимости от конкретного вида Элерса-Данло признаки этого заболевания могут включать следующее:
- кровоточивость десен,
- слабые сосуды,
- медленное заживление ран,
- изогнутый позвоночник,
- плоскостопие,
- проблемы с легкими, сердечными клапанами и органами пищеварения.
Врожденный буллезный эпидермолиз
Люди с данным заболеванием имеют настолько хрупкую кожу, что практически любое соприкосновение с ней сопровождается возникновением тонкостенных волдырей с серозным содержимым. Подобные пузыри могут возникнуть при ударе, падении человека на землю и даже от трения одежды на определенных участках кожи.
В зависимости от какого-либо конкретного вида врожденного буллезного эпидермолиза подвергаться неблагоприятному воздействию могут дыхательные пути, пищеварительный тракт, мочевой пузырь, мышцы или другие органы. Как правило, буллезный эпидермолиз проявляется сразу при рождении ребенка, так как сам акт родов в некоторой степени является первой механической травмой.
Синдром Марфана
Клиническая картина данного заболевания характеризуется поражением большинства жизненно важных органов и систем: сердечно-сосудистой и центральной нервной системы, опорно-двигательного аппарата, органов зрения и дыхания. Люди с синдромом Марфана имеет высокий рост, а также чрезмерно длинные кости и тонкие «паукообразные» пальцы ног, рук.
Среди других проблем, сопровождающих синдром Марфана, можно выделить проблемы со зрением по причине аномального размещения хрусталика глаза и расширения аорты. Синдром Марфана провоцируется мутациями в гене, который регулирует структуру белка фибриллина.
Несовершенный остеогенез
Данная патология является врожденным расстройством, характеризующимся хрупкостью костей, низкой мышечной массой. Существует несколько типов этого заболевания. Специфические симптомы несовершенного остеогенеза зависят от конкретного вида заболевания и могут включать в себя следующие признаки:
- серый или синий оттенок склеры – белка глаз;
- тонкая кожа;
- снижение слуха;
- незначительное искривление позвоночника;
- проблемы с дыханием.
Причина возникновения данной патологии заключается в мутации генов COL1A1 и COL1A2, ответственных за коллаген типа 1, а также изменение качества протеина.
3. Аутоиммунные заболевания
Аутоиммунные заболевания представляют собой совокупность заболеваний, при которых под действием собственной иммунной системы происходит деформация и разрушение тканей, органов организма человека. Исследователи полагают, что это расстройство возникает у генетически восприимчивых людей. У них защитная иммунная система вырабатывает антитела, атакующие собственные ткани. К этому типу патологий можно отнести следующие заболевания.
Дерматомиозит и полимиозит
В основе этих заболеваний лежат воспалительные процессы, протекающие на фоне специфического действия иммунной системы человека. Дерматомиозит характеризуется воспалением кожного покрова, а полимиозит – мышц. Для симптоматики обоих заболеваний характерны:
- усталость,
- мышечная слабость,
- одышка,
- затруднение глотания,
- потеря в весе,
- лихорадка.
Ревматоидный артрит
При данном заболевании иммунная система атакует синовиальную оболочку – оболочку мембран, выстилающих полость суставов. В результате подобного воздействия она воспаляется, появляется боль и отечность, ощущение скованности во всем теле. Среди других симптомов ревматоидного артрита можно выделить:
- потерю аппетита;
- усталость;
- лихорадку;
- анемию.
Склеродермия
Этот термин обозначает группу заболеваний из группы коллагенозов, которые характеризуются уплотнением кожи, наращиванием рубцовой ткани и повреждением внутренних органов. Эти нарушения подразделяются на две основные категории: системная и очаговая склеродермия.
Синдром Шегрена
Синдром Шегрена представляет собой хроническое системное заболевание, при котором атаке иммунной системы подвергается слезные и слюнные железы, а также железы слизистых оболочек. Результатом данного патологического процесса становится дисфункция данных желез с последующим уменьшением количества вырабатываемого секрета. Основными синдрома Шегрена являются сухость в глазах и во рту, а также постоянная усталость и боль в суставах.
Системная красная волчанка
Системная красная волчанка, поражая капилляры и соединительную ткань, оказывает отрицательное влияние на весь организм в целом. Для симптоматики красной волчанки характерны следующие признаки:
- чувствительность к солнечному свету;
- высыпания на щеках и переносице;
- выпадение волос;
- нарушения работы почек;
- проблемы с концентрацией внимания и памятью;
- анемия.
Данный термин характерен более чем для 20 различных состояний, характеризующихся воспалением стенок сосудов. Как следствие, васкулит может ухудшать кровообращения органов и других тканей организма.
Смешанное заболевание соединительной ткани – смешанный коллагеноз.
При таком коллагенозе у людей выявляются черты одновременно нескольких болезней: красной волчанки, дерматомиозита, ревматоидного артрита и т.д. Многогранные проявления этой патологии у больных проявляются по-разному: кто-то жалуется на легкие симптомы, а у кого-то могут возникнуть и серьезные осложнения, в том числе и инфекции, инсульты, почечная недостаточность и другие опасные явления.
Лечение коллагеноза зависит от множества различных факторов: типа заболевания и его симптоматики, тяжести течения болезни, а также от индивидуальных особенностей организма больного. Чаще всего меры по лечению коллагеноза помогают если не вылечить болезнь полностью, то хотя бы контролировать неприятные симптомы коллагеноза.
Читайте также:

