Из какого эпителия развивается хорионкарцинома
Обновлено: 23.04.2024
Аденокарцинома матки — онкологическое заболевание женских внутренних половых органов. Данная опухоль развивается из секреторного эпителия слизистой оболочки тела матки. Именно этот вид рака считается наиболее распространенным среди данной локализации.
Этиология
К основным факторам, которые способны вызвать развитие данной опухоли, относят:
- Повышенное содержание эстрогенов в крови (гиперэстрогения).
- Отсутствие родов.
- Прием некоторых лекарственных препаратов (например, тамоксифен).
- Ранняя менархе (первая менструация).
- Позднее наступление климактерического периода.
- Возраст более 55 лет.
В большинстве случаев аденокарцинома матки не связана с наследственной предрасположенностью, так как среди близких родственников пациенток не выявляется данный вид злокачественной опухоли. Генетический фактор становится причиной заболевания лишь в 5% случаев. Наиболее часто встречается синдром Линча — генетически обусловленное состояние, которое включает в себя опухолевое поражение толстой кишки, матки, яичников, поджелудочной железы и головного мозга.
Клиническая картина
Основными симптомами аденокарциномы матки является аномальное маточное кровотечение и нарушение менструального цикла. У пациенток репродуктивного возраста наблюдается увеличение объема теряемой крови, повышение длительности менструации, сокращение продолжительности или нерегулярные промежутки времени между менструальными кровотечениями. Для женщин климактерического периода характерны цикличные или нецикличные кровотечения из половых путей.
Также следует помнить, что аденокарцинома эндометрия матки, как и другие онкологические заболевания, может протекать бессимптомно, особенно на начальной стадии развития. Если опухоль достигает больших размеров, пациентка может испытывать боли внизу живота. Аденокарцинома матки может сдавливать или вызывать метастатические поражения соседних органов — прямой кишки и мочевого пузыря, за счет чего может возникать нарушение мочеиспускания и акта дефекации. Эти процессы могут сопровождаться болевым синдромом. При наличии метастазов в лимфатических узлах, наблюдается их увеличение. В некоторых случаях развивается односторонний отек нижней конечности из-за нарушения оттока лимфатической жидкости.
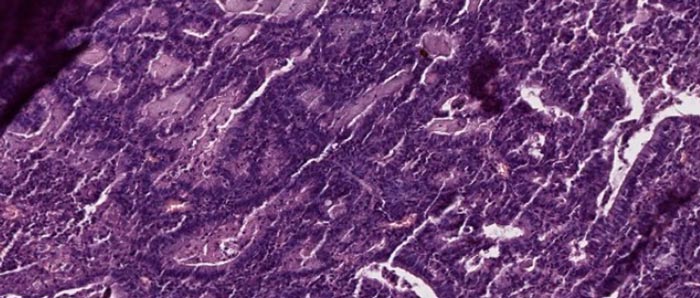
Классификация
Аденокарцинома матки делится на несколько видов, в зависимости от той или иной характеристики. Очень важно правильно классифицировать и определить тип опухоли, так как от этого зависит выбор лечения пациентки и прогноз заболевания.
В зависимости от направленности роста аденокарциномы матки различают экзофитную форму — разрастание опухоли в полость матки и эндофитную — характеризуется ростом вглубь просвета органа.
Исходя из строения тканей опухоли, выделяют несколько форм аденокарциномы матки:
- Эндометриоидная.
- Серозная.
- Смешанная.
- Муцинозная.
Также существует классификация, основанная на степени дифференцировки клеток, из которых состоит опухоль. По этому признаку выделяют три варианта аденокарциномы: G1 — высокодифференцированная, G2 — умереннодифференцированная, G3 — низкодифференцированная. Чем меньше зрелость клеток, образующих аденокарциному матки, тем выше степень ее агрессивности.
Стадии

Диагностика
Для уточнения стадии аденокарциномы матки и общего состояния пациентки может потребоваться проведение следующих диагностических мероприятий:
- Гинекологический осмотр пациентки.
- Раздельное диагностическое маточное выскабливание или аспирационная биопсия. Лабораторное исследование полученного материала позволяется подтвердить диагноз, определить гистологический тип и степень дифференцировки опухоли.
- Общий анализ крови, мочи, коагулограмма (АЧТВ, ПТВ, фибриноген, D-димеры), биохимический анализ крови (общий белок, глюкоза, билирубин, мочевина).
- Электрокардиография.
- Рентген грудной клетки.
- УЗИ органов малого таза, брюшной полости и забрюшинного пространства. Предоставляет врачу информацию о локализации, размере и форме опухоли.
- Определение концентрации СА-125 в крови.
- Кольпоскопия.
- Цистоскопия.
- Ректороманоскопия.
- Экскреторная урография.
- Рентгенологическое исследование костей.
- Консультации узких специалистов — терапевта, эндокринолога, уролога и других по показаниям.
Точный план обследования составляется индивидуально. При необходимости, объем исследований может быть уменьшен или увеличен. Дополнительно врач может назначить КТ, МРТ органов малого таза, ПЭТ-КТ, ЭХО—кардиографию, УЗДГ нижних вен и др.
Лечение
В лечении аденокарциномы матки используются несколько методов, выбор которых зависит от стадии и особенностей течения заболевания у конкретного пациента. При этом главную роль играет именно оперативное вмешательство. Однако провести его удается не всегда.
Если аденокарцинома выявлена на первой стадии, то назначается хирургическое вмешательство в объеме гистерэктомии с удалением придатков матки (маточных труб и яичников). В случае обнаружения метастазов в яичниках, рекомендуется удалять большой сальник. По показаниям также могут быть удалены тазовые и поясничные лимфатические узлы, так как в них могут находиться вторичные опухолевые очаги. Во время операции рекомендуется провести смыв брюшной полости. Данная процедура носит диагностический характер. Наличие или отсутствие клеток дает врачу возможность оценить распространенность опухолевого процесса. В послеоперационном периоде в случае необходимости может быть назначена химиотерапия — применение специальных цитостатических препаратов, которые блокируют деление клеток, нарушая, таким образом, развитие опухоли и метастазов. После проведенного лечения, за пациентом устанавливается регулярное наблюдение.
На второй стадии аденокарцинома эндометрия матки требует более радикального лечения. Во время хирургического вмешательства удаляется матка, придатки, тазовые и поясничные лимфатические узлы. В некоторых случаях также резецируется параметрий (клетчатка, окружающая орган). После проведения операции обязательно назначается лучевая терапия, иногда в комбинации с цитостатиками.

На третьей стадии аденокарциномы матки лечение начинается с лучевой терапии. Датчик могут вводить в половые органы (такое облучение называется внутриполостным или контактным) либо располагают на расстоянии от пациентки (дистанционное облучение). Продолжительность лучевой терапии зависит от размера опухоли и ее локализации. Затем проводится радикальная гистерэктомия, удаление тазовых и поясничных узлов, сальника. В послеоперационном периоде назначают лучевую терапию или химиотерапию. Наиболее результативной признана схема лечения, при которой данные консервативные методы последовательно чередуются друг с другом. Вначале пациентка получает лучевую терапию, затем переходит на цитостатическое лечение и снова возвращается к лучевой терапии.
На четвертой стадии аденокарциномы матки лечение носит паллиативный характер. Используется несколько видов хирургических вмешательств. Например, если опухоль проросла в мочевой пузырь и/или прямую кишку, но при этом отсутствуют метастазы в тазовой клетчатке и общее состояние пациентки относительно удовлетворительное, производится экзентерация (полное удаление) органов таза. В других случаях операции направлены на максимальное удаление опухолевой ткани. Это позволяет улучшить состояние пациентки и снизить степень выраженности симптомов. В послеоперационном периоде используются различные схемы лучевой и цитостатической терапии.
Медицинское наблюдение после лечения
После проведения лечения, пациентке необходимо регулярное медицинское наблюдение. В течение первых трех лет каждые три месяца необходимо проходить гинекологический осмотр и сдавать мазки на цитологию. В течение последующих двух лет данные исследования проводятся два раза в год. Затем пожизненно один раз в год. Также следует ежегодно проводить рентгенографию органов грудной клетки, чтобы исключить метастазирование в легкие.
Если в процессе диагностики аденокарциномы матки была обнаружена повышенная концентрация маркера CA-125, то после проведения операции необходимо контролировать его уровень при каждом посещении врача по описанному выше плану. Увеличение концентрации СА-125 может свидетельствовать о рецидиве заболевания. Если у женщины появляются жалобы, то следует выполнить ультразвуковое исследование или КТ малого таза и брюшной полости. Не реже одного раза в год следует проводить осмотр молочных желез.
Прогноз
Прогноз при аденокарциноме матки, в первую очередь, определяется ее стадией. Ранняя диагностика и своевременное лечение сопровождается более высокой выживаемостью пациентов и более редкими рецидивами. Более поздние стадии, соответственно, имеют менее благоприятный прогноз. К другим отрицательным прогностическим факторам относят:
- Аденокарцинома матки с низкодифференцированными (незрелыми) клетками.
- Малое число рецепторов к эстрогену и/или прогестерону на опухолевых клетках.
- Анеуплоидия опухоли. То есть изменение нормального числа хромосом в ее клетках.
- Опухолевое поражение более половины стенки матки.
- Метастазы в яичниках и лимфатических узлах.
- Выявление опухолевых клеток в смывах с брюшной полости.
- Большой размер опухоли.
- Распространение опухоли на шейку матки.
- Возраст пациентки более 60 лет.
Поскольку имеется тесная связь между стадией и прогнозом заболевания, женщинам необходимо проходить регулярные гинекологические осмотры и исследования. При первых признаках, сигнализирующих о нарушениях в работе половой системы, следует обратиться к доктору для проведения тщательного обследования. Данные мероприятия позволяют своевременно диагностировать аденокарциному матки и провести эффективное лечение.
Хорионкарцинома – это трофобластическая опухоль, развивающаяся в результате злокачественной трансформации эпителия хориона. Клиника хорионкарциномы характеризуется кровянистыми, серозными или гнойными выделениями из половых путей, болями внизу живота; при метастазировании – симптоматикой со стороны соответствующих органов. Диагностика хорионкарциномы требует определения уровня ХГ и трофобластического глобулина в крови, проведения гистологического анализа соскоба, УЗИ. Лечение хорионкарциномы может включать химиотерапию, хирургическое вмешательство.
МКБ-10
Общие сведения
Хорионкарцинома (или хорионэпителиома) относится к злокачественным формам трофобластической болезни, которая встречается 0,5-8,3 случаях на 1000 родов. Чаще всего развитию хорионкарциномы предшествует пузырный занос (40% наблюдений), аборт (25%), роды (22,5%), внематочная беременность (2,5%). Реже встречаются тератогенные хорионкарциномы, не связанные с беременностью. В редких случаях возможно одновременное сочетание пузырного заноса и хорионкарциномы. Хорионкарцинома чаще диагностируется у жительниц азиатского региона.
Причины хорионкарциномы
Вопрос о причинах развития хорионкарциномы, как других форм трофобластической болезни, требует дальнейшего изучения. В качестве ведущего этиопатогенетического звена рассматривается вирусная трансформация трофобласта, иммунодепрессивное действие гормонов беременности (ХГ, прогестерона, эстрогенов), метаболические нарушения, иммунологический конфликт, дефицит белка, повышение ферментативной активности гиалуронидазы.
К категориям риска по развитию хорионкарциномы относят:
- беременных старше 40 лет;
- повторнобеременных;
- женщин, имеющих в анамнезе аборты, самопроизвольное прерывание беременности, внематочную беременность;
- пациенток, перенесших пузырный занос.
Патанатомия
Хорионкарцинома формируется из структур трофобласта, синцитиальной ткани ворсин хориона, иногда – из зародышевых клеток гонад. По макроскопической структуре хорионкарцинома представляет темную геморрагическую массу мягкой консистенции с зонами изъязвлений и распада. При микроскопическом исследовании хорионкарциномы определяется беспорядочная пролиферация ткани трофобласта, отсутствие стромы, сосудов и ворсин хориона; наличие клеток Лангханса и синцитиальных элементов.
Обычно хорионкарцинома располагается в теле матки (в зоне предшествующей имплантации эмбриона), где может иметь субмукозную (83%), интрамуральную – (5, 6%) или субсерозную (7%) локализацию. При внематочной форме первичные очаги хорионкарциномы могут выявляться в яичниках и маточных трубах (1-4%); головном мозге, легких, влагалище (17%).
Классификация
По месту развития первичного очага в клинической гинекологии выделяют ортотопную, гетеротопную и тератогенную хорионкарциному. При ортотопной хорионкарциноме опухоль локализуется в месте предшествующей имплантации плодного яйца – матке, трубах, брюшной полости. По мере своего прогрессирования хорионкарцинома прорастает и метастазирует во влагалище, параметрий, большой сальник, мочевой пузырь, прямую или сигмовидную кишку, легкие.
Хорионкарцинома с гетеротопной локализацией изначально выявляется вне зоны имплантации эмбриона, чаще – в стенках влагалища, легких, головном мозге. Тератогенная хорионкарцинома не связана с предшествующей беременностью и относится к смешанным опухолям эмбрионального генеза. Расположение тератогенных хорионкарцином экстрагонадное - в эпифизе, легких, средостении, желудке, забрюшинном пространстве, мочевом пузыре.
В стадировании хорионкарциномы придерживаются классификации ВОЗ, выделяя IV стадии:
- I – локализация хорионкарциномы ограничивается маткой
- II – рост опухоли распространяется за пределы матки, но ограничивается половыми органами
- III – выявляются метастазы в легкие
- IV стадия - выявляются метастазы других органах, кроме легких.
Симптомы хорионкарциномы
Хорионкарцинома может развиваться одновременно с беременностью, вскоре после окончания гестации или возникать спустя несколько лет после беременности. Вначале у 80% пациенток появляются кровянистые выделения различной интенсивности и длительности. Специфично периодическое самостоятельное прекращение кровотечений и неэффективность раздельного лечебно-диагностического выскабливания.
Кровотечение, как правило, начинается вскоре после медаборта, родов, выкидыша; иногда – после длительной задержки месячных или в межменструальный промежуток. Наряду с кровяными выделениями при хорионкарциноме возможно выделение серозных или гнойных белей, связанных с некрозом или инфицированием опухолевого узла. Нередко выявляется нагрубание молочных желез с выделением из сосков молозивоподобного секрета.
Осложнения
Повторяющиеся кровотечения приводят к анемизации; интоксикация сопровождается лихорадкой и ознобами. При прорастании опухолевыми массами тела матки отмечается появление болевого синдрома внизу живота и пояснице. О наличии метастазов в легкие свидетельствуют кашель и кровохарканье; в головной мозг – неврологические симптомы (ухудшение зрения, головная боль, головокружение, двигательные нарушения). При хорионкарциноме чаще происходит метастатическое поражение легких (45-50%), влагалища (35%), придатков, шейки матки, головного мозга. В яичниках при хорионкарциноме нередко выявляются текалютеиновые кисты.
Диагностика
Поскольку симптомы хорионкарциномы малоспецифичны, важное значение придается объективной диагностике. При изучении анамнеза учитывается связь с предшествующей беременностью, пузырным заносом. Для оценки объективного статуса производится:
- Осмотр на кресле. Гинекологическое исследование позволяет обнаружить наличие синюшных узлов, прорастающих во влагалище; при развитии хорионкарциномы на фоне беременности отмечается увеличение размеров матки по сравнению с гестационным сроком.
- Лучевые методы. Посредством УЗИ органов малого таза выявляется увеличение матки, наличие в матке мелкокистозной ткани, двусторонние текалютеиновые кисты. Опухолевый узел хорионкарциномы может иметь размеры от нескольких сантиметров до размеров головы взрослого человека. С уточняющей целью применяется гистерография – рентгеновское исследование матки.
- РДВ. Проведение диагностического выскабливания полости матки с гистологическим исследованием соскоба бывает не всегда информативным, поскольку микропрепараты часто содержат сгустки крови, некротизированные ткани эндометрия и единичные элементы трофобласта. За хорионкарциному свидетельствует обнаружение атипичных клеток синцитиотрофобласта в соскобе. Возможно проведение цитологического исследования мазков-отпечатков с пораженных тканей влагалища, вульвы, шейки матки, а также биопсии этих участков.
Хорионкарциному бывает сложно дифференцировать от трофобластической опухоли плацентарной площадки и инвазивного пузырного заноса, которые также отличаются инфильтрирующим ростом. Типичным диагностическим признаком хорионкарциномы служит определение повышенного содержания ХГЧ, АФП и трофобластического β-глобулина в сыворотке крови, которые избыточно продуцируются опухолью. С помощью рентгенографии, томографии легких и КТ головного мозга определяется наличие метастазов хорионкарциномы в отдаленных органах.
Лечение хорионкарциномы
К хирургическому лечению хорионкарциномы прибегают при угрожающем кровотечении, риске перфорации матки, септических состояниях, неэффективности химиотерапии, значительном поражении матки и яичников. Рекомендуемым объемом вмешательства служит удаление матки: гистерэктомия (при отсутствии метастазов у молодых женщин) или пангистерэктомия (у женщин старше 40 лет). Удаление хорионкарциномы в дальнейшем дополняется химиотерапевтическим лечением. Критерием излеченности служит нормализация уровня ХГ в трех анализах, выполненных с интервалом в 1 неделю.
Прогноз и профилактика
Во время ремиссии необходим регулярный контроль за титром ХГ (1 раз в 2 недели в течение 3-х месяцев, далее – 1 раз в 6 месяцев в течение 2-х лет); проведение рентгенографии легких (каждые 3 месяца в течение года). Длительно, не менее чем на 1 год, пациентке назначается гормональная контрацепция КОК.
Пациенткам с пузырным заносом, имеющим высокий риск трансформации в хорионкарциному, показано проведение профилактической химиотерапии. Наличие метастазов снижает возможность излечения до 70%. При хорионкарциноме яичников, которая плохо откликается на химиотерапию, прогноз практически всегда неблагоприятный.
Холангиокарцинома – это злокачественная опухоль желчных протоков. Симптомы заболевания в основном связаны с холестазом (желтуха, кожный зуд), также у больных могут возникать боли в правом подреберье, резкая потеря массы тела. Для постановки диагноза используют УЗИ органов брюшной полости, компьютерную томографию (КТ), позитрон-эмиссионую томографию (ПЭТ), магнитно-резонансную томографию (МРТ), чрескожную холангиографию, определение онкомаркеров в крови. Основной метод лечения холангиокарциномы – оперативный. Химиотерапия и радиотерапия используются в комплексе с хирургическим методом или в качестве паллиативного лечения.
МКБ-10


Общие сведения
Холангиокарцинома – злокачественное новообразование, которое развивается из клеток эпителия желчных протоков. Встречается на всех континентах, но больше распространена в Юго-Восточной Азии. Частота выявления холангиокарциномы в странах Европы и Северной Америки - 1-3 случая на 100 тысяч населения, в Японии – 5,5 случаев, в Израиле около 7 случаев. Холангиокарцинома составляет приблизительно 3% от всех злокачественных заболеваний желудочно-кишечного тракта.
Несмотря на то, что опухоль встречается не очень часто, проблема эта достаточно актуальна. Прогноз при данной патологии очень неблагоприятный. На сегодняшний день излечение холангиокарциномы возможно только при выявлении процесса на ранних стадиях. Первичную диагностику чаще всего проводит врач гастроэнтеролог, так как именно к нему сначала обращаются пациенты. Лечением занимаются хирурги и онкологи.

Причины холангиокарциномы
Этиология холангиокарциномы до конца не выяснена. К факторам риска относят желчнокаменную болезнь, врожденные пороки развития желчевыводящих путей. Высокую заболеваемость в странах Азии объясняют распространенностью на этой территории паразитарных заболеваний, таких как описторхоз и клонорхоз.
Многие специалисты отмечают увеличение частоты злокачественных опухолей желчевыводящих путей у пациентов с первичным склерозирующим холангитом, хроническими воспалительными заболеваниями кишечника, такими как болезнь Крона или неспецифический язвенный колит. Также холангиокарциному связывают с воздействием токсических веществ, например диоксида тория, который используют в качестве рентгенконтрастного препарата. Связь между гепатитом С и холангиокарциномой до конца не установлена.
Патанатомия
Предположительно, опухоли формируются из-за повреждения клеток эпителия желчевыводящих путей (механического либо токсического). По гистологической структуре большая часть из них является аденокарциномой (опухоль, развивающаяся из железистой ткани), только 10% идентифицируют, как сквамозокарциному (плоскоклеточный рак). По своей структуре холангиокарцинома плотная, железистого строения, белого цвета, иногда мало отличается от участков, пораженных склерозирующим холангитом.
Классификация
По локализации различают следующие виды холангиокарциномы: внутрипеченочные, внепеченочные в области бифуркации общего желчного протока (наиболее частая локализация), внепеченочные дистальные опухоли, возникающие на отрезке между фатеровым сосочком и верхним краем поджелудочной железы.
Кроме того, для классификации используют систему TNM, где T (tumor) определяет глубину прорастания опухоли, N (nodulus) – наличие или отсутствие метастазов в региональных лимфатических узлах, M (metastasis) – наличие или отсутствие отдаленных метастазов.
Размеры и степень распространения опухолевого процесса:
- Tx – опухоль невозможно оценить;
- T0 – признаков, свидетельствующих о наличии опухоли, нет;
- Tis – карцинома либо опухоль in situ (на месте);
- T1 – опухоль ограничивается пределами желчных протоков, прорастает в слой гладких мышц и в фиброзный;
- T2a – распространение опухоли за пределы желчных протоков и окружающей их ткани;
- T2b – распространение опухоли на близлежащие печеночные ткани;
- T3 – распространение опухоли на печеночные артерии и воротную (портальную) вену;
- T4 – прорастание опухолью печеночных протоков либо вовлечение в процесс близлежащих вен и артерий.
Вовлечение лимфатических узлов: Nx – невозможно оценить степень вовлечения регионарных лимфоузлов в процесс; N0 – отсутствуют какие-либо метастазы в регионарных лимфоузлах; N1 – есть метастазы в разных регионарных лимфоузлах, которые располагаются вдоль вен, желчных протоков и артерий брюшной полости; N2 – поражены лимфоузлы вдоль верхних мезентеральных артерий либо вдоль чревной артерии, вблизи других органов брюшной полости. Оценка метастазов: Mx – неизвестно или невозможно определить, есть ли метастазы; M0 – метастазов у пациента нет; M1 – выявлены отдаленные метастазы.
По характеру роста холангиокарциному классифицируют следующим образом:
- инфильтративная (проявляется диффузным прорастанием стенок пузыря и окружающих тканей);
- полиповидная (растет в просвет протоков, часто имеет тонкую ножку);
- экзофитная (прорастает на внешнюю сторону желчных протоков);
- смешанная (имеет характеристики всех вышеперечисленных типов).

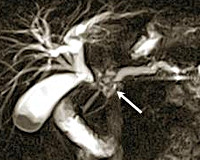
КТ ОБП. Внутрипротоковая холангиокарцинома (опухоль Клацкина) холедоха (красная стрелка). Расширенный холедох (зеленая стрелка). Расширенный главный панкреатический проток (желтая стрелка).
Симптомы холангиокарциномы
Первые симптомы обычно связаны с непроходимостью желчных протоков. Больной обращается с жалобами на пожелтение кожных покровов, зуд. Часто наблюдается потемнение мочи и обесцвечивание каловых масс. Из-за нарушения усвоения жиров пациенты теряют вес. Снижение массы тела также может быть связано с отсутствием аппетита, тошнотой, рвотой, раковой интоксикацией. На поздних стадиях заболевания появляются боли в правом подреберье.
Холангиокарцинома может осложняться холангитом (воспалением желчных протоков). У больных повышается температура, появляются симптомы лихорадки. Если опухоль возникла на фоне склеротических процессов или при желчнокаменной болезни, отмечается ухудшение состояния пациента. Усиливаются боли, желтушность, зуд, появляется слабость, тошнота, снижение аппетита.
Диагностика
Симптомы холангиокарциномы не являются специфическими. Поставить диагноз исключительно на основе анамнеза и осмотра практически невозможно. Для уточнения данных используются инструментальные и лабораторные методы:
- Биохимические анализы. Обычные биохимические пробы печени дают информацию о степени нарушения функции этого органа, но не позволяют провести точную диагностику холангиокарциномы. В крови выявляют повышение билирубина за счет прямой фракции, щелочной фосфатазы. Аланинаминтрансфераза и аспартатаминотрансфераза, уровень альбуминов обычно в пределах нормы.
- Онкомаркеры. Большее значение для диагностики холангиокарциномы имеют специфические маркеры онкологических заболеваний. У больных выявляют антиген СА 19-9, хотя повышенный уровень его может наблюдаться и при раке поджелудочной железы или холангите. Значительное повышение антигена до 100 U/ml и больше у пациентов с хроническим холангитом, скорее всего, свидетельствует в пользу холангиокарциномы. Иногда можно выявить повышение карциноэмбрионального антигена; альфа-фетопротеин в пределах нормы.
- Эхография. Чаще всего для диагностики холангиокарциномы на начальном этапе обследования используют УЗИ печени и желчного пузыря. Этот метод позволяет выявить опухоли большого размера, расширение протоков на некоторых участках. Допплерометрия сосудов печени определяет изменения в кровотоке, которые свидетельствуют о наличии новообразования. Опухоли маленького размера часто не визуализируются.
- Томография. Компьютерная томография (КТ) желчевыводящих путей несколько более информативна. Она помогает выявить увеличение лимфатических узлов, увидеть опухоли меньшего размера. МСКТ органов брюшной полости определяет уровень обструкции желчных путей. Усовершенствованная позитронно-эмиссионная томография дает возможность увидеть опухоли размером меньше 1 сантиметра узлового типа. Но с помощью этой методики трудно выявить инфильтрационные формы холангиокарциномы.
- Контрастная рентгенография. Для уточнения диагноза используют и некоторые рентгенографические методы исследования. Эндоскопическая ретроградная холецистография проводится с целью выявления места обструкции, патологических изменений в области фатерова сосочка. Метод позволяет взять материал для гистологического анализа. Чрескожная чреспеченочная холангиография проводится перед оперативным вмешательством. Она помогает выявить холангиокарциному в месте бифуркации общего желчного протока.
- МРТ. Наиболее информативным методом на сегодняшний день является магнитно-резонансная томография (МРТ) печени и желчных путей. Метод неинвазивный, не требует введения контраста, следовательно, достаточно безопасный. МРТ печени позволяет увидеть желчные протоки и сосудистые структуры в трехмерном изображении, выявить опухоли небольшого размера, правильно оценить степень поражения, определить тактику операции и дальнейший прогноз для пациента.
Заболевание приходится дифференцировать с острыми вирусными гепатитами, лептоспирозом, холангитом, камнями или склеротическими процессами в желчном пузыре, циррозом печени, раком головки поджелудочной железы.

КТ ОБП (этот же пациент). Опухоль Клацкина холедоха (красная стрелка). Расширенный просвет холедоха до зоны обструкции (зеленая стрелка).
Лечение холангиокарциномы
Основной метод лечения холангиокарциномы – оперативный, хотя он показан не во всех случаях. Если размеры опухоли небольшие, и она не прорастает стенки желчных протоков, проводится холедохотомия. В более сложных ситуациях показана резекция доли печени (лобэктомия). Крупная опухоль с поражением близлежащих структур требует более радикального вмешательства. В таких случаях проводят операцию Уиппла: удаляется часть печени, желудка и двенадцатиперстной кишки, желчный пузырь с протоками, поджелудочная железа и регионарные лимфатические узлы.
Консервативное лечение холангиокарциномы осуществляют после хирургического вмешательства или в тех случаях, когда операцию выполнить невозможно (паллиативная терапия). Оно включает химиотерапию и лучевую терапию. Для химиотерапии чаще всего используют 5-фторурацил. Также проводят курсы с гемцитабином, цисплатином.
Прогноз и профилактика
Прогноз при холангиокарциноме неблагоприятный. В среднем выживаемость пациентов составляет 14 месяцев. Если опухоль выявлена вовремя, благодаря лечению жизнь пациента можно продолжить до трех и даже до пяти лет. Но поскольку в начальной стадии заболевание проходит практически бессимптомно, случаи ранней диагностики редки.
Основа профилактики холангиокарциномы – адекватное лечение тех болезней, которые могут привести к злокачественному перерождению. Это камни в желчном пузыре, склеротические процессы, гельминтозы, хронические воспалительные заболевания толстого кишечника.
Эмбриональный рак — злокачественное новообразование из группы несеминомных герминогенных опухолей. Является наиболее частой герминогенной опухолью яичка (40% от всех герминогенных опухолей и 87% несеминомных в структуре заболеваемости).
К герминогенным ракам относятся опухоли, развивающиеся из клеток-предшественников высокоспециализированного герминогенного эпителя половых желез. Один из подвидов этой группы злокачественных новообразований — семинома, злокачественная опухоль, построенная из герминогенного атипичного эпителия. Остальные — собственно эмбриональный рак, тератома и хорионкарцинома — относятся к несеминомным опухолям. Опухолевый узел может содержать как морфологические признаки только одного вида рака, так и сочетания структур различных новообразований. Только 2,3-16% опухолей являются чистым эмбриональным раком.
Причины развития эмбрионального рака
Этиология до сих пор неизвестна. Фактором риска развития эмбрионального рака считается наследственность — наблюдения показывают, что риск выше у тех лиц, братья или сёстры которых также болеют этим видом рака. Кроме того эмбриональный рак может быть ассоциирован с пороками развития гонад, например, крипторхизмом или дисгенезией гонад. Кроме того, предрасполагающим фактором может быть синдром Кляйнфельтера, так как одним из его морфологических проявлений является атрофия гонад и нарушение сперматогенеза. Наконец, определенную роль играет гормональный фон — в частности, продолжительный прием препаратов эстрогена матерью в период беременности.
В каких органах возникает эмбриональный рак
Эмбриональный рак может локализоваться как в половых железах (яичках или яичниках), так и вне них — в пресакральной области, забрюшинном пространстве, средостении, в сосудистых сплетениях желудочков головного мозга, в области шишковидного тела, в полости носа и челюстях. Такая широкая вариативность расположения эмбрионального рака объясняется возможной задержкой зачатков герминогенного эпителия при его миграции из стенки желточного мешка к месту закладки гонад на 4-5 неделе эмбрионального развития.
Диагностика
Клиническая картина заболевания определяется локализацией процесса, морфологическим строением опухоли и возрастом пациента. Наиболее частыми жалобами являются увеличение размеров пораженного органа или лимфатических узлов и болевой синдром. Могут быть, в зависимости от локализации опухолевого узла, жалобы на затрудненное мочеиспускание, кишечную непроходимость, появления клинических признаков сдавления органов средостения или поражения центральной нервной системы.
Из инструментальных методов диагностики больным с подозрением на эмбриональный рак показаны следующие:
- УЗИ области первичной опухоли и регионарных лимфоузлов,
- Рентгенография или КТ органов грудной клетки для исключения метастатического процесса в лёгких и поражения средостения,
- Магнитно-резонансная томография или УЗИ брюшной полости, малого таза, печени.

Большое значение имеют данные лабораторной диагностики:
- Альфа-фетапротеин (АФП). АФП является онкофетальным маркером, то есть в норме вырабатывается только тканями плода. Уровень АФП в сыворотке крови повышается у 60−70% мужчин с несеминомными опухолями яичек, особенно при наличии метастазов. При несеминомном раке отмечается прямая связь между частотой выявления увеличенного уровня АФП и стадией заболевания.
- Хорионгонадотропин человека (ХГЧ). При чистом эмбриональном раке сывороточный уровень ХГЧ не увеличен, но поскольку чистый эмбриональный рак встречается довольно редко, то наличие структур, связанных с другими гистологическими вариантами несеминомного рака, или же наличие синцитиотрофобласта могут приводить к повышению данного маркера.
- Лактатдегидрогеназа (ЛДГ). У пациентов с метастатической болезнью рекомендуется дополнительно определять уровень ЛДГ, так как она является маркером тканевой деструкции. ЛДГ характеризуется меньшей специфичностью, но его концентрация пропорциональна объему опухоли, поэтому его уровень может быть косвенным маркером распростраённости опухолевого процесса.
- Также может быть повышен уровень онкомаркера СА19-9.
Увеличение уровней этих маркеров встречается в 51% случаев опухолей яичка. АФП повышен у 50–70%, ХГЧ — у 40–60% пациентов с несеминомными герминогенными опухолями яичка. Таким образом, нормальный уровень маркеров не исключает диагноза герминогенной опухоли.
При иммуногистохимическом исследовании часто определяется маркер CD30 (но его уровень может падать после проведенной химиотерапии), а p53 позитивен в половине случаев эмбрионального рака.
Гистологическое строение эмбрионального рака многообразно. Выделяют следующие подтипы эмбрионального рака:
- Взрослого типа,
- Юношеского типа,
- Полиэмбриому.
Эти подтипы могут сочетаться между собой или с другим герминогенным раком в одном опухолевом узле.
Эмбриональный рак взрослого типа наиболее часто локализуется в яичках, дебютирует в возрасте 20-30 лет. Рак юношеского типа также локализуется преимущественно в яичках, но диагностируется обычно у детей в возрасте от 3 месяцев до 3 лет.
Эмбриональный рак, особенно взрослого типа, отличается высокой степенью злокачественности, что и обуславливает его высокую химиочувствительность.
Течение заболевания
Средний возраст пациентов на момент выявления заболевания — 25-32 лет, но эмбриональный рак может быть диагностирован и у детей, так как предпосылки к его развитию формируются ещё на этапе эмбрионального развития. Эмбриональный рак характеризуется очень быстрым ростом — у 10% пациентов на момент диагностики рака уже выявляются метастазы. Наиболее часто поражаются забрюшинные лимфатические узлы, а у 20% пациентов выявляется поражение наддиафрагмальных лимфоузлов; также могут быть поражены надключичные лимфоузлы и лимфоузлы средостения. Эмбриональный рак метастазирует также гематогенно — в лёгкие и печень, реже в кости и головной мозг.
Лечение
Эмбриональный рак требует комплексного подхода к лечению, в основе которого лежит операция, которая имеет не только куративное, но и диагностическое значение, так как позволяет получить весь опухолевый узел в качестве материала для гистологического и иммуногистохимического исследований.
Требуемые методики лечения эмбрионального рака и их последовательность определяются стадией и прогнозом заболевания.
- При I стадии на первом этапе лечения рака показано хирургическое лечение. Если послеоперационное гистологическое исследование не выявило сосудистой или лимфатической инвазии, то пациент может быть оставлен под наблюдением; в противном случае увеличивается риск развития рецидива, поэтому может быть назначено 1-2 курса полихимиотерапии по схеме BEP, или же, в случае отказа, профилактическое нервосберегающее удаление забрюшинных лимфоузлов.
- При IIА стадии заболевания, когда в забрюшинных лимфатических узлах уже определяются метастазы, но их размер менее 2 см, также рекомендуется начать комбинированное лечение с хирургического метода. Но в этой клинической ситуации основным методом лечения рака является химиотерапия. Выбор терапии осуществляется на основе прогностической классификации IGCCCG (см. ниже): больным с благоприятным прогнозом показано проведение 2-3 курсов полихимиотерапии по схеме ВЕР или 4 курса ЕР, а больным с промежуточным и неблагоприятным прогнозом необходимо назначить 4 курса химиотерапии по схеме BEP. Альтернативой химиотерапевтическому лечению является удаление забрюшинных лимфоузлов или же является выполнение КТ в динамике при условии проведения химиотерапии при появлении признаков прогрессирования заболевания.
- При IIB стадии заболевания, для которой характерны метастазы в забрюшинных лимфатических узлах размером 2-5 см, допустимо использование той же схемы лечения, что и при IIA стадии, если уровень опухолевых маркеров нормальный, а метастазы в лимфоузлах малочисленны, не проявляют себя симптоматикой и локализуются в одной зоне. При множественных симптомных метастазах показано проведение 2-3 курсов полихимиотерапии по схеме ВЕР а при повышенном уровне опухолевых маркеров химиотерапия проводится сообразно прогностической группе.
- IIC и III стадии требуют химиотерапевтического лечения согласно тому, к какой прогностической группе по классификации IGCCCG отнесен пациент.
Отдельно хотелось бы остановиться на лечении рецидивных опухолей. Согласно рекомендациям Европейской Ассоциации Урологов, в случае, если рецидив произошёл при изначальной I стадии заболевания, лечение начинается с химиотерапии (3–4 курса BEP (или VIP)), и только после её завершения проводится хирургическое удаление опухоли при ее наличии. Рекомендации RUSSCO допускают выполнение хирургического лечения при его технической возможности на первом этапе, так как удаление рецидивной опухоли позволит провести гистологическое исследование на большом количестве материала. Для химиотерапевтического лечения рекомендуются иные схемы, нежели при лечении первичного рака, — TIP, VeIP. При поздних рецидивах, которые возникают в срок более 2 лет после завершения первичного лечения, отмечается низкая их чувствительность к химиотерапии, поэтому основным методом лечения становится хирургический.

Возможные осложнения проводимого лечения
При лечении эмбрионального рака встречаются типичные для хирургического и химиотерапевтического методов лечения осложнения, и хотелось бы отдельно выделить характерные осложнения лечения именно для этой патологии:
- Как уже упоминалось ранее, при ранних стадиях эмбрионального рака, особенно локализованного в яичке, одним из возможных методов лечения может быть удаление забрюшинных лимфоузлов — с профилактической или, при их поражении, лечебной целью. Осложнением этой операции является развитие ретроградной эякуляции, имеющей место в 3–8% случаев даже при выполнении нервосберегающей операции. Пациент должен быть предупрежден о риске развития такого осложнения при разработке тактики лечения.
- Проводимая химиотерапия может вызвать угнетение сперматогенеза. Несмотря на то, что в 50% это обратимое состояние, следует рассмотреть вопрос о возможности криоконсервации спермы.
Динамическое наблюдение
Пациенты с эмбриональным раком после завершения активного лечения нуждаются в активном динамическом наблюдении. Оно включает в себя определение уровней маркеров АФП и ХГЧ, выполнение рентгенографии грудной клетки и УЗИ забрюшинного пространства с периодичностью:
- каждые 4-6 недель в течение первого года,
- каждые 2 месяца в течение второго года,
- ежеквартально — на третьем году
- и далее каждые полгода до 5 лет.
Такое наблюдение показано больным с опухолями яичка после проведения хирургического лечения, а также больным с диссеминированным процессом, у которых установлена полная или частичная регрессия на фоне проведенной химиотерапии и операции. Столь интенсивный мониторинг, особенно в первый год, объясняется тем, что около 80% рецидивов заболевания возникают именно в этот период. Такой подход позволяет выявить прогрессирование на ранних стадиях, что улучшает результаты последующего лечения.
Прогноз
В общем и целом, эмбриональный рак характеризуется благоприятным прогнозом, но выживаемость может варьировать в зависимости от течения заболевания. Так, согласно классификации International Germ Cell Cancer Collaborative Group (IGCCCG), выделяются три группы сообразно прогнозу заболевания:
- Благоприятный прогноз. К этой группе относится около 56% больных несеминомными раками, пятилетняя общая выживаемость составляет 92%. Характерны локализация первичной опухоли в яичке или забрюшинном пространстве, отсутствие метастазов вне лёгких и следующие лабораторные показатели: АФП < 1000 МЕ/мл, ХГЧ < 5000 мМЕ/мл и ЛДГ превышает верхнюю границу нормы не более, чем в 1,5 раза.
- Промежуточный прогноз. К этой группе можно отнести до 28% больных, 5-летняя общая выживаемость составляет 80%. У пациентов этой группы также наблюдается локализация первичной опухоли в яичке или забрюшинном пространстве, отсутствие метастазов вне лёгких, но лабораторные показатели уже выше по сравнению с группой благоприятного прогноза: АФП 1000–10000 МЕ/мл и/или ХГЧ 5000–50000 мМЕ/мл и/или ЛДГ превышает верхнюю границу нормы в 1,5–10 раз.
- Неблагоприятный прогноз. К данной группе относится наименьшее количество больных несеминомными раками, 5-летняя общая выживаемость составляет всего 48%. У этих пациентов первичная опухоль располагается в средостении и\или уже дала метастазы в другие органы, кроме лёгких; также эти аспекты могут сочетаться со следующими лабораторными показателями АФП > 10000 МЕ/мл и/или ХГЧ > 50000 мМЕ/ мл и/или ЛДГ превышает верхнюю границу нормы более чем в 10 раз.
В зависимости от стадии, на которой был выявлен эмбриональный рак, общая выживаемость пациентов составляет:
- при I стадии — 95%,
- при II стадии — 80%,
- при III стадии — 70%,
- при IV стадии — 55%.
Кроме того, неблагоприятными факторами прогноза являются разрыв опухоли и её химиорезистентность. Рецидивная опухоль также характеризуется худшим прогнозом заболевания.
Наконец, прогноз различается в зависимости от гистологического подтипа — эмбриональный рак юношеского течения имеет относительно благоприятное течение, при эмбриональном раке взрослого типа — прогноз наименее благоприятный.
Хориокарцинома относится к трофобластическим опухолям. Она считается крайне злокачественным новообразованием из-за склонности к быстрому росту и активному метастазированию. В то же время хориокарцинома успешно поддается терапии при даже в запущенных случаях. После проведения курса лечения репродуктивная функция у большинства молодых пациенток остается сохранной.
Общая информация
Хориокарцинома — одна из разновидностей трофобластической болезни. В основе этой группы заболеваний лежат патологические изменения в процессах роста и развития трофобласта — внешней оболочки зародыша. Трофобластические опухоли относятся к редким злокачественным новообразованиям. Они всегда ассоциированы с беременностью (с нормальной, патологической или прерванной). Они могут начаться как во время вынашивания плода, так и в послеродовом периоде (в сроки от нескольких дней до нескольких лет). Хориокарцинома также может развиться при внематочной беременности или после аборта.
Первоначально нормальный трофобласт представлен лишь одним слоем клеток, который образует первичные ворсинки. Трофобласт необходим для нормальной имплантации зародыша в стенку матки. Ворсины выделяют особые протеолитические ферменты, разрушающие слизистый покров матки в месте внедрения плодного яйца. Начиная со второй недели с момента оплодотворения, трофобласт преобразуется в двухслойную пластинку. В дальнейшем к нему изнутри прирастает мезодерма, и образуются вторичные, а затем и третичные ворсины.
С этого периода (начало-конец 3-й недели внутриутробного развития) он становится хорионом — ворсинчатой оболочкой, ответственной за маточно-плацентарную циркуляцию и питание плода. Ворсины погружаются в специальные полости в эндометрии матки и, омываясь кровью разрушенных сосудов матери, получают все необходимые питательные вещества.
О трофобластической болезни говорят в случаях, когда описанные процессы нарушаются и начинается активная пролиферация элементов трофобласта, а затем и его злокачественное перерождение. При этом происходят последовательные изменения начиная от простого пузырного заноса до хориокарциномы.
Причины и механизм развития
До сих пор отсутствует единая теория происхождения трофобластических злокачественных новообразований. В настоящее время доминирующей является иммунологическая теория, согласно которой основная роль в патогенезе развития хориокарциномы отводится иммунным факторам. По своей сущности зародыш и его оболочки являются чужеродным генетическим материалом, а организм матери запускает защитную иммунную реакцию в ответ на имплантацию плодного яйца в полость матки.
Среди факторов риска выделяют:
- высокий паритет родов — заболеванию более подвержены повторнородящие женщины;
- аборты в анамнезе;
- белковая недостаточность в рационе;
- гормональные сбои, сопровождающиеся нарушением менструального цикла;
- прием оральных контрацептивов;
- вирусные инфекции;
- сопутствующие аутоиммунные и генетические заболевания.
В большинстве случаев хориокарцинома расположена в теле матки, в области прикрепления зародыша. Реже она обнаруживается в месте патологической имплантации при внематочной беременности — в фаллопиевых трубах, яичнике или брюшной полости. Первичное новообразование характеризуется агрессивным ростом и отличается глубоким прорастанием в маточную стенку или в придатки. С прогрессированием заболевания возможна перфорация органа. Клетки опухоли активно продуцируют хорионический гонадотропин (ХГ). Повышение его уровня в моче и крови является одним из диагностических критериев заболевания.
Основной путь метастазирования хориокарциномы — гематогенный. Вместе с током крови злокачественные клетки попадают в различные органы. Чаще всего поражаются легкие, головной мозг, влагалище и печень, реже — почки, надпочечники, желудочно-кишечный тракт.
Клиническая картина
Ранний и ведущий признак заболевания — маточные кровотечения различной интенсивности и выраженности (от скудных мажущих до профузных, представляющих угрозу для жизни). Этот симптом встречается у 50-98% пациенток и не должен быть оставлен без должного внимания. Любые патологические маточные кровотечения у женщин с репродуктивным анамнезом следует рассматривать как возможное проявление хориокарциномы.
Еще один признак — увеличение объема матки, не соответствующее сроку гестации. Уже на 4-5 неделе беременности размеры матки могут становиться больше нормы. К симптомам заболевания также можно отнести постоянную тошноту, многократную рвоту и поздний гестоз.
Признаки метастазирования практически не выражены, что еще больше затрудняет диагностику хориокарциномы. При поражении головного мозга возможно появление неврологической симптоматики в виде головной боли, нарушения движений и чувствительности в конечностях, рвоты, судорог. Метастазы в легких могут сопровождаться дыхательной недостаточностью (одышка, синюшность носогубного треугольника) и сухим надсадным кашлем, который сопровождается кровохарканьем. Поражение влагалища и вульвы может сопровождаться образованием безболезненных опухолевых узлов насыщенного багрового цвета.
Диагностика
Важную роль в выявлении заболевания играет правильно и детально собранный акушерско-гинекологический анамнез. После беседы с пациенткой проводится гинекологический осмотр с помощью зеркал, двуручное исследование и забор мазков. Среди методов лабораторно-инструментальной диагностики применяются:
- определение концентрации ХГ и плацентарного лактогена в сыворотке крови;
- трансвагинальное УЗ-исследование и контрастная компьютерная томография органов малого таза;
- МРТ репродуктивной системы и рядом расположенных анатомических структур.
Обязательно проводятся рутинные исследования в виде общих анализов крови, мочи, электрокардиограммы, определения гормонального статуса. Для поиска отдаленных метастазов используются методы визуализации: рентгенография, контрастная компьютерная и магнитно-резонансная томография органов грудной клетки, брюшной полости, головного мозга.
Лечение
План лечения хориокарциномы зависит от ее морфологических характеристик, локализации и распространенности, выраженности клинических симптомов и уровня ХГ. Основной метод лечения — химиотерапевтический. Он может использоваться как самостоятельно, так и в комплексе с хирургическим лечением или лучевой терапией.

Выбор химиотерапевтического режима определяется индивидуально. Стандартная химиотерапия первой линии состоит из двух препаратов — метотрексата и лейковорина. Они обладают цитотоксическим действием на опухолевые клетки, способствуя их гибели. Лечение продолжается до стабилизации концентрации ХГ. В дальнейшем проводятся сеансы профилактической химиотерапии в количестве до 3-4.
При обнаружении признаков нечувствительности хориокарциномы к лечению, схему меняют. Достоверными критериями резистентной опухоли является плато или увеличение концентрации ХГ в нескольких последовательно проведенных анализах в течение 10-14 дней.
Еще один метод лечения — хирургический. В последнее время оперативные вмешательства используются весьма ограниченно — предпочтение отдается комбинированной химиотерапии. Из хирургических способов лечения применяется органосохраняющая операция, предполагающая иссечение только злокачественного новообразования. Она может проводиться пациенткам детородного возраста в следующих случаях:
- перфорация хориокарциномой маточной стенки и последующим внутрибрюшным кровотечением;
- резистентность хориокарциномы к химиотерапевтическому лечению;
- отсутствие гематогенного метастазирования.
При больших размерах хориокарциномы может быть проведена экстирпация матки вместе с придатками. После иссечения хориокарциномы возможно проведение курсов химиотерапии. Их необходимость определяется по результатам еженедельного контроля концентрации ХГ в сыворотке крови. При наличии отдаленных метастазов также проводится химиотерапия по имеющимся схемам.
В состав комплексной терапии обязательно добавляют симптоматическое лечение: обезболивающие, противовоспалительные, антибактериальные, спазмолитические средства, глюкокортикостероиды, мочегонные препараты. Лечение пациенток проводится только в узкоспециализированных стационарах с участием нескольких врачей (онкогинеколог, химиотерапевт, невролог или нейрохирург, врач-терапевт, пульмонолог).

Прогноз
При своевременном лечении прогноз благоприятный. Хориокарцинома и ее отдаленные метастазы хорошо поддаются химиотерапии. По завершению курса лечения полного выздоровления удается добиться в подавляющем большинстве случаев (90%).
Все пациентки, имеющие в анамнезе трофобластическую опухоль, подлежат диспансерному наблюдению не менее 5 лет. Кратность профилактических осмотров определяется лечащим врачом. В первый год их количество может составлять 3-4, в дальнейшем контрольные осмотры назначают 1 раз в год.
Читайте также:

