Истинный полиморфизм при аллергическом дерматите
Обновлено: 18.04.2024
ФГАОУ ВО «Белгородский государственный национальный исследовательский университет»
ФГАОУ ВО «Белгородский государственный национальный исследовательский университет»
ФГАОУ ВО «Белгородский государственный национальный исследовательский университет»
Молекулярно-генетические детерминанты атопического дерматита (данные полногеномных исследований)
Журнал: Клиническая дерматология и венерология. 2020;19(5): 615‑621
ФГАОУ ВО «Белгородский государственный национальный исследовательский университет»
Приведен анализ результатов 11 полногеномных исследований атопического дерматита (АД) различными научными коллективами, выявивших более 100 GWAS-значимых полиморфных локусов, вовлеченных в формирование заболевания. Следует отметить, что, во-первых, все эти исследования АД выполнены за рубежом на выборках из различных зарубежных популяций. Выборки из российских популяций в эти исследования не включены, поэтому можно констатировать, что к настоящему времени полногеномные исследования АД в популяциях России не проводились. Во-вторых, лишь небольшое количество GWAS-значимых для АД полиморфных локусов реплицированы в различных популяциях на полногеномном уровне. В-третьих, обращает на себя внимание то, что с увеличением объема выборок больных и лиц контроля, включенных в полногеномные исследования (как правило, каждое последующее полногеномное исследование выполняется на более многочисленной выборке, чем предыдущее), количество GWAS-значимых локусов будет расти. В-четвертых, важный вклад в формирование подверженности к развитию АД, по данным полногеномных исследований, вносят мутации в гене филаггрина, не только связанные с потерей функции (loss-of-function variants) (например, rs61816761 — R501X), но и полиморфные локусы в этом гене (синонимические мутации), не связанные с аминокислотными заменами в белке филаггрина и, соответственно, не приводящие изначально к нарушению его функции.
ФГАОУ ВО «Белгородский государственный национальный исследовательский университет»
ФГАОУ ВО «Белгородский государственный национальный исследовательский университет»
ФГАОУ ВО «Белгородский государственный национальный исследовательский университет»
Дата принятия в печать:
Атопический дерматит (АД) — воспалительное заболевание кожи, характеризуемое зудом, хроническим рецидивирующим течением и возрастными особенностями локализации и морфологии очагов поражения [1]. Распространенность АД среди населения мира составляет 10–20% [2, 3]. При этом встречаемость АД в странах Западной Европы выше, чем в странах Восточной Европы, Африки, Центральной Азии и Китае [4]. Заболевание оказывает серьезное негативное влияние на качество жизни больных [5]. АД распространен у 10–20% детей, нередко манифестирует в раннем детстве, причем до 45% всех случаев заболевания проявляется в первые 6 мес жизни [6]. Согласно данным литературы [7], в США общие экономические затраты на лечение АД составляют более 4,2 млрд долл. в год.
АД является мультифакторным заболеванием, в патогенезе которого важную роль играет наследственная детерминированность, приводящая к нарушению состояния кожного барьера, дефектам иммунной системы (стимуляция Th2-клеток с последующей гиперпродукцией IgE), гиперчувствительности к аллергенам и неспецифическим раздражителям, колонизации патогенными микроорганизмами (Staphylococcus aureus, Malassezia furfur), а также к дисбалансу вегетативной нервной системы с повышением продукции медиаторов воспаления [1, 4, 8]. Близнецовые и семейные исследования свидетельствуют о существенной роли наследственных факторов (72–90%) в формировании АД [9]. АД развивается у 80% детей, оба родителя которых страдают этим заболеванием, и более чем у 50% детей в случае, если болен только один родитель, при этом риск развития заболевания увеличивается в 1,5 раза, если больна мать [1].
Первое GWAS исследование АД выполнено J. Esparza-Gordillo и соавт. (2009) на выборке европеоидного происхождения из 939 больных и 975 лиц контрольной группы, а также 270 «нуклеарных» семей с двумя пораженными сибсами. Полученные результаты подтверждены в репликативном исследовании (рассмотрены 2 независимые выборки с общей численностью 2637 больных и 3957 лиц контроля). Установлена статистически значимая для полногеномного уровня (p=7,6·10 −10 ) ассоциация аллеля А полиморфизма rs7927894, расположенного в регионе гена C11orf30 (11q13.5) с заболеванием. Показано, что у гомозигот по аллелю А полиморфизма rs7927894 (генотип АА) риск развития АД в 1,47 раза выше, чем у индивидуумов, не являющихся носителями данного генетического варианта.
Следующее полногеномное исследование АД выполнено научным коллективом L. Sun и соавт. (2011) в китайской популяции (этническая группа Han). Выборка для исследования включила 1012 больных АД и 1362 индивидуума контрольной группы. Репликативное исследование проведено как на выборке из китайской популяции (3624 пациента с АД и 12 197 индивидуумов контроля), так и на выборке из европейской популяции (1806 больных и 3256 лиц контрольной группы из Германии). Для населения Китая установлены статистически значимые ассоциации с развитием АД двух новых локусов, расположенных в регионах 5q22.1 (rs7701890 TMEM232/SLC25A46, p=3,15·10 −9 , OR 1,24) и 20q13.33 (rs6010620 TNFRSF6B/ZGPAT, p=3,0·10 −8 , OR 1,17), а также подтверждена статистически значимая роль в развитии заболевания ранее установленного полиморфизма, локализованного в регионе 1q21,3 (rs3126085 FLG, p=5,90·10 –12 , OR 0,82). Наряду с этим продемонстрирована связь с формированием АД в немецкой популяции полиморфного локуса из региона 20q13.33 (rs6010620, p=2,87·10 –5 , OR 1,25).
В 2011 г. L. Paternoster и соавт. представили результаты метаанализа GWAS-данных, полученных в выборке из 5606 больных АД и 20 565 лиц контрольной группы из 16 популяционных когорт европеоидного происхождения. Проведено также репликативное исследование 10 наиболее значимых полиморфных маркеров в выборке из 5419 больных АД и 19 833 индивидуумов контрольной группы. В результате авторы выявили 3 новых полиморфных локуса, ассоциированных с развитием заболевания: rs479844 гена OVOL1, расположенный в регионе 11q13.1 (OR 0,88, p=1,1·10 −13 ), rs2164983 гена ACTL9, локализованный в регионе 19p13.2 (OR 1,16, p=7,1·10 −9 ) и rs2897442 гена KIF3A, расположенный в регионе 5q31,1 (OR 1,11, p=3,8·10 −8 ). Помимо этого, реплицированы полиморфные маркеры, продемонстрировавшие статистически значимые ассоциации с формированием АД, в ранее проведенных полногеномных исследованиях: rs7927894 (11q13.5, p=0,008) [12] и rs6010620 (20q13.3, p=0,002) [13].
В следующей работе L. Paternoster и соавт. (2015) провели мультиэтнический метаанализ GWAS-данных (проанализировано более 15 млн полиморфных вариантов) в выборке из 21 399 больных АД и 95 464 лиц контроля (выборка сформирована из индивидуумов европеоидного, африканского, японского и латиноамериканского происхождения). Репликативное исследование выполнено на выборке из 32 059 больных АД и 228 628 индивидуумов контрольной группы. Выявлено 10 новых локусов генов-кандидатов, вовлеченных в развитие заболевания: rs203825514 PPP2R3C (q13.2, p=1,8·10 −10 ), rs7127307 ETS1 (11q24.3, p=3,9·10 −10 ), rs7512552 C1orf51/MRPS21 (1q21.2, p=9,1·10 −10 ), rs6473227 MIR5708/ZBTB10 (8q21.13, p=1,4·10 −9 ), rs6602364 IL15RA/IL2RA (10p15.1, p=1,5·10 −9 ), rs10214237 IL7R/CAPSL (5p13.2, p=2,9·10 −8 ), rs10199605 LINC00299 (2p25.1, p=3,4·10 −8 ), rs4643526 PUS10 (2p16.1, p=3,5·10 −8 ), rs12951971 STAT3 (17q21.2, p=4,1·10 −8 ), rs7625909 SFMBT1/RFT1 (3p21.1, p=4,9·10 −8 ).
В 2012 г. T. Hirota и соавт. опубликовали работу, в которой представлены результаты GWAS-исследования АД среди населения Японии на выборке из 3 328 больных и 14 992 индивидуумов контрольной группы. Авторы установили 8 новых локусов, связанных с развитием АД, расположенных в регионе генов IL1RL1-IL18R1-IL18RAP (p=8,36·10 −18 ), главного комплекса гистосовместимости (MHC) (p=8,38·10 −20 ), OR10A3-NLRP10 (p=1,54·10 −22 ), GLB1 (p=2,77·10 −16 ), CCDC80 (p=1,56·10 −19 ), CARD11 (p=7,83·10 −9 ), ZNF365 (p=5,85·10 −20 ) и CYP24A1-PFDN4 (p=1,65·10 −8 ). В работе также были подтверждены ассоциации с АД 7 локусов, находящихся в области генов FLG, C11orf30, TMEM232-SLC25A46, TNFRSF6B-ZGPAT, OVOL1, ACTL9 и KIF3A-IL13, вовлеченность которых в развитие заболевания впервые установлена в ранее проведенных исследованиях J. Esparza-Gordillo и соавт. (2009), L. Sun и соавт. (2011) и L. Paternoster и соавт. (2011).
В работе S. Weidinger и соавт. (2013) получены результаты полногеномного исследования АД у детей. Выборка для исследования составила 1563 больных и 4054 индивидуумов контроля европеоидного происхождения. Репликативное исследование проведено на выборке из 2286 пациентов с АД и 3160 индивидуумов контроля. Показаны ассоциации на полногеномном уровне значимости с развитием АД 4 полиморфных локусов, расположенных в области генов комплекса эпидермальной дифференцировки (EDC) (хромосома 1), LRRC32 (хромосома 11), RAD50/IL13 (хромосома 5) и главного комплекса гистосовместимости (MHC) (хромосома 6).
Интересные данные представлены в работе H. Baurecht и соавт. (2015), посвященной полногеномному исследованию 2 наиболее распространенных кожных заболеваний — АД и псориазу. Выборка для исследования включила 2115 больных АД, 4212 пациентов с псориазом и 11 834 индивидуума контрольной группы (европеоидного происхождения). Установлены как «общие» GWAS-значимые полиморфные локусы для АД и псориаза (например, полиморфизм rs77199844 (del) ассоциирован с развитием и АД (OR 2,01; 95% ДИ 1,72–2,35), и псориаза (OR 1,16; 95% ДИ 1,01–1,33)), так и разнонаправленные ассоциации одних и тех же полиморфных локусов генов-кандидатов с развитием АД и псориаза — выявлено 6 полиморфных локусов из 25 GWAS-значимых для полиморфизма (так, например, полиморфизм rs4363385 является фактором риска для АД (OR 1,23; 95% ДИ 1,15–1,32) и протективным фактором для псориаза (OR 0,89; 95% ДИ 0,85–0,94)). Следует также отметить, что ряд полиморфных локусов были GWAS-значимыми для одного заболевания и не были ассоциированы с другим заболеванием (например, полиморфизм rs471144 является фактором риска для АД (OR 1,54; 95% ДИ 1,37–1,73) и не ассоциирован с развитием псориаза (OR 1,03; 95% ДИ 0,94–1,14), наоборот, полиморфизм rs77614545 (del) определяет повышенный риск развития псориаза (OR 1,21; 95% ДИ 1,15–1,28), но не связан с формированием АД (OR 0,99; 95% ДИ 0,92–1,07)). В работе H. Baurecht и соавт. (2015) дополнительно проведен анализ ассоциаций полиморфных локусов, сильно сцепленных с известными мутациями в гене FLG, связанными с потерей функции филаггрина, в выборке из 2865 больных АД и 5540 индивидуумов контроля. Рассматривались гаплоблоки (всего авторы выявили 7 гаплоблоков) в регионе следующих 4 мутаций в гене филаггрина (1q21.3): p.Arg501* (c.1501C>T), p.Ser761Cysfs*36 (c.2282_2285del), p.Arg2447* (c.7339C>T), и p.Ser3247* (c.9740C>A) (R501X, 2282del4, R2447X и S3247X соответственно). Полученные результаты также свидетельствуют о различных, в том числе и о разнонаправленных, ассоциациях полиморфных локусов, сильно сцепленных с известными мутациями в гене филаггрина (loss-of-function variants) при АД и псориазе. Так, полиморфизм rs12144049 ассоциирован с развитием АД (OR 1,53; 95% ДИ 1,42–1,64) и не значим для псориаза (OR 0,98; 95% ДИ 0,92–1,03), наоборот, полиморфизм rs1581803 связан с развитием псориаза (OR 1,22; 95% ДИ 1,16–1,30) и не вовлечен в формирование АД (OR 0,97; 95% ДИ 0,90–1,04). Два полиморфных локуса в гене филаггрина — rs12130219 и rs35722864 — демонстрируют разнонаправленные ассоциации с развитием АД и псориаза: полиморфизм rs12130219 является фактором риска для псориаза (OR 1,15; 95% ДИ 1,09–1,22) и имеет протективное значение для АД (OR 0,66; 95% ДИ 0,60–0,73), кроме того, полиморфизм rs35722864 повышает риск развития псориаза (OR 1,13; 95% ДИ 1,07–1,20) и оказывает протективное влияние на формирование АД (OR 0,81; 95% ДИ 0,75–0,88). На основании полученных данных авторы делают вывод, что АД и псориаз имеют различные генетические механизмы с противоположными эффектами полиморфных локусов генов-кандидатов, вовлеченных в общие для этих двух изучаемых заболеваний биологические пути, определяющие дифференцировку эпидермиса и иммунный ответ.
В работе H. Schaarschmidt и соавт. (2015) представлены данные GWAS-исследования более 1,6 млн генетических маркеров у 924 больных АД и 5506 лиц контроля из немецкой популяции. Для репликативного исследования была сформирована выборка из 1383 больных и 1728 индивидуумов контроля. Показаны ассоциации на полногеномном уровне значимости pEDC, rs6720763 XIRP2, rs3091307 RAD50/IL13/KIF3A, rs10738626 DMRTA1, rs1665050 RNF111.
Данные по GWAS-исследованию АД в корейской популяции опубликованы K. Kim и соавт. в 2015 г. Работа выполнена на выборке из 246 больных детей и 551 индивидуума контрольной группы. Авторы установили ассоциации с развитием заболевания на полногеномном уровне значимости ppNBAS), 6q22.33 (THEMIS), 10p14 (GATA3-CELF2) и 15q24.3 (SCAPER).
I. Marenholz и соавт. (2015) провели метаанализ GWAS-данных на выборке из 2428 больных детей, страдающих АД и бронхиальной астмой, и 17 034 лиц контрольной группы из 12 популяций (индивидуумы европеоидного происхождения). Установлено 2 новых SNPs, специфичных для данной комбинации фенотипов: rs9357733, расположенный в регионе гена EFHC1 (6p12.3) (OR 1,27; p=2,1·10 −8 ) и rs993226, локализованный в регионе генов TMTC2 и SLC6A15 (12q21.3) (OR 1,58; p=5,3·10 −9 ). В этой работе также подтверждена на полногеномном уровне значимости вовлеченность в развитие сочетания АД и бронхиальной астмы полиморфных локусов уже «известных» генов-кандидатов: FLG (rs12081541, 1q21.3), IL4/KIF3A (rs17690965, 5q31.1), AP5B1/OVOL1 (rs479844, 11q13.1), C11orf30/LRRC32 (rs2155219, 11q13.5) и IKZF3 (rs10445308, 17q21).
В 2019 г. Å. Johansson и соавт. представили результаты полномасштабного GWAS-исследования трех заболеваний — АД, астмы и сенной лихорадки. Исследование проведено на многочисленной выборке, включающей 346 545 индивидуумов европеоидного происхождения из Британского биобанка (9578 больных АД, 229 19 больных сенной лихорадкой, 51 645 больных астмой, 102 862 больных с сочетанием АД и сенной лихорадки, 130 865 — с сочетанием АД, сенной лихорадки и астмы, 294 477 лиц — контрольная группа). Ученые идентифицировали 141 локус, вовлеченный в развитие исследуемых заболеваний и их сочетаний (p≤3·10 −8 ), из которых 41 SNPs впервые выявлены. Продемонстрировано, что большинство GWAS-значимых локусов ассоциированы с различными комбинациями исследуемых фенотипов (АД/астма/сенная лихорадка). При этом установлено, что 20 полиморфных локусов проявляли наиболее значимые эффекты для сочетания АД и сенной лихорадки по сравнению с АД, тогда как 26 SNPs были наиболее значимыми для астмы при сравнении с сочетанием АД и сенной лихорадки. Показано, что 4 «новых» GWAS-значимых локуса, локализованных в регионах генов TNFRSF8, MYRF, TSPAN8 и BHMG1, находятся в неравновесии по сцеплению (r 2 >0,8) с полиморфизмами, определяющими несинонимические замены в кодируемых полипептидах.
Таким образом, резюмируя представленные данные литературы, можно заключить, что к февралю 2020 г. в мире различными научными коллективами проведено 11 полногеномных исследований (GWAS) АД, в результате которых выявлено более 100 GWAS-значимых полиморфных локусов, вовлеченных в формирование заболевания (табл. 1). При этом следует отметить, что, во-первых, все 11 полногеномных исследований АД выполнены за рубежом на выборках из различных зарубежных популяций. Выборки из российских популяций в эти исследования не включались. Следовательно, можно констатировать, что до сих пор полногеномные исследования АД в популяциях России не проводились. Во-вторых, лишь небольшое количество GWAS-значимых для АД полиморфных локусов реплицированы в различных популяциях на полногеномном уровне (см. табл. 1). Так, например, GWAS-значимый полиморфизм rs1295686 (5q31.1) ассоциирован с развитием АД по данным 3 различных исследований [16—18], а для полиморфного локуса rs2212434 (11q13.5) ассоциации с формированием заболевания выявлены в 2 исследованиях [15, 18].
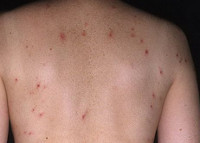
Герпетиформный дерматит Дюринга — хроническое рецидивирующее поражение кожи, проявляющееся полиморфной сыпью в виде эритематозных пятен, пузырей, папул, волдырей и сопровождающиеся выраженным зудом и жжением. Заболевание получило свое название благодаря тому, что элементы сыпи при дерматите Дюринга группируются таким же образом, как высыпания при герпесе. Диагностика проводится при помощи гистологического исследования, анализа содержимого пузырей и реакции прямой иммунофлуоресценции. В лечении герпетиформного дерматита Дюринга эффективна сульфоновая группа препаратов и кортикостероиды.
Общие сведения
Герпетиформный дерматит Дюринга встречается в любом возрасте, но наиболее часто он развивается в 30-40 лет. Мужчины более подвержены этому заболеванию, чем женщины. В некоторых случаях герпетиформный дерматит Дюринга является кожной реакцией на имеющуюся в организме злокачественную опухоль внутренних органов, то есть выступает в качестве параонкологического дерматоза.

Причины возникновения
Причины и механизм развития герпетиформного дерматита Дюринга неизвестны. У многих пациентов выявляется непереносимость белка глютеина, содержащегося в злаковых растениях. В пользу аутоиммунного компонента в развитии заболевания говорит обнаружение IgA-антител на границе дермы и эпидермиса — в области базальной мембраны. Предполагают, что определенную роль в возникновении герпетиформного дерматита Дюринга играют повышенная йодная чувствительность, наследственность, аскаридоз, воспалительные процессы желудочно-кишечного тракта (гастрит, язвенная болезнь), вирусные заболевания (ОРВИ, герпетическая инфекция и др.).
Симптомы
Обычно герпетиформный дерматит Дюринга имеет острое начало с появлением очагов полиморфной сыпи. Высыпаниям могут предшествовать умеренный подъем температуры тела, общая слабость, зуд и чувство покалывания. Элементы сыпи могут возникать на любом участке кожного покрова, кроме подошв и ладоней. Но наиболее частое их расположение — это разгибательные поверхности рук и ног, область лопаток, плечи, поясница и ягодицы. На ладонях могут возникать петехии и экхимозы — крупные (больше 3мм) пятна внутрикожных кровоизлияний. Высыпания сопровождаются выраженным дискомфортом: ощущением жжения, интенсивным зудом и парестезиями. Поражение слизистых оболочек при герпетиформном дерматите Дюринга, как правило, отсутствует. В редких случаях в полости рта могут возникать пузыри, быстро переходящие в эрозии.
Истинный полиморфизм сыпи при герпетиформном дерматите Дюринга связан с одновременным появлением на коже различного размера эритематозных пятен, волдырей, папул и пузырей. Со временем к истинному полиморфизму присоединяется ложный: образуются связанные с трансформацией высыпаний эрозии и корочки, а также вызванные сильным расчесыванием кожи экскориации. При заживлении элементов сыпи на коже остаются очаги гипо- и гиперпигментации, иногда рубцы.
Эритематозные пятна при герпетиформном дерматите Дюринга имеют четкий контур и округлую форму. Их гладкая поверхность часто покрыта расчесами, кровянистыми и серозными корочками. Со временем они пропитываются выпотом из расширенных сосудов и превращаются в похожие на волдыри (уртикароподобные) образования. Последние растут по периферии и сливаются, трансформируясь в розово-синюшные очаги, покрытые корочками, расчесами и пузырьками. Наряду с этим эритематозные пятна могут переходить в сочные розово-красные папулы. Кроме того, возникновение папул и уртикароподобных высыпаний может происходить без стадии эритематозного пятна.
Пузырные элементы сыпи при герпетиформном дерматите Дюринга могут быть небольшого размера — везикулы и диаметром более 2 см — буллезные высыпания. Они заполнены прозрачной жидкостью, помутнение которой говорит о присоединении инфекции. Пузыри вскрываются и подсыхают с образованием корки. Из-за расчесывания происходит снятие корки и на месте пузыря остается эрозия.
В зависимости от преобладания того или иного вида сыпи над остальными выделяют следующие виды герпетиформного дерматита Дюринга: папулезную, везикулезную, буллезную и уртикароподобную. Возможны атипичные варианты заболевания: трихофитоидные, экзематоидные, строфулоидные и др.
Острые периоды герпетиформного дерматита Дюринга сочетаются с довольно продолжительными ремиссиями (от нескольких месяцев до года и более). Обострения часто протекают с ухудшением общего состояния больного, подъемом температуры, нарушениями сна.
Диагностика
При подозрении на герпетиформный дерматит Дюринга проводят йодную пробу Ядассона. На здоровый участок кожи накладывают компресс с мазью, содержащей 50% йодида калия. Через 24 ч компресс снимают. Выявление на его месте покраснения, везикул или папул говорит в пользу герпетиформного дерматита Дюринга. Если проба отрицательна, то ее повторяют. Для этого через 48 ч накладывают такой же компресс на область пигментации, оставшейся после бывших высыпаний. Пробу Ядассона можно проводить с приемом препарата йода внутрь. Но такое исследование чревато резким обострением заболевания.
При герпетиформном дерматите Дюринга в клиническом анализе крови обнаруживается повышенное содержание эозинофилов. При цитологическом исследовании содержимого пузырей также выявляется большое количество эозинофилов. Однако эти данные, как и проба Ядассона, не являются обязательными или строго специфичными для заболевания.
Наиболее надежным способом диагностики герпетиформного дерматита Дюринга считается гистологическое исследование участков пораженной кожи. Оно выявляет расположенные под эпидермисом полости, скопления эозинофилов, нейтрофилов и остатков их разрушенных ядер. Реакция прямой иммунофлуоресценции (РИФ) обнаруживает на верхушках дермальных сосочков отложения IgA.
В диагностике буллезной формы герпетиформного дерматита Дюринга необходима дифференциация с другими буллезными дерматитами: буллезным пемфигоидом, вульгарной пузырчаткой и другими видами пузырчатки.
Поскольку герпетиформный дерматит Дюринга является параонкологическим заболеванием, для пациентов пожилого возраста желательно проведение дополнительных обследовании для исключения онкологической патологии внутренних органов: УЗИ органов брюшной полости и моче-половой системы, рентгенограмму легких, КТ почек и т. п.
Лечение герпетиформного дерматита Дюринга
Больным герпетиформным дерматитом Дюринга показано лечение у дерматолога. Назначают диету, исключающую злаки и йодосодержащие продукты (морская рыба, морепродукты, салат и др.). Медикаментозная терапия проводится препаратами сульфоновой группы: диафенилсульфон, сульфасалазин, солюсульфон и другие. Эти препараты обычно назначают внутрь циклами по 5-6 дней с перерывами в 1-3 дня. В случаях неэффективности сульфоновой терапии лечение проводят средними дозами кортикостероидов (преднизолон, дексаметазон и др.) Для купирования зуда применяют антигистаминные препараты: лоратадин, цетиризин, дезлоратадин.
Местное лечение герпетиформного дерматита Дюринга включает теплые ванны с раствором марганцовки, вскрытие пузырей и их обработку зеленкой или фукарцином, наложение кортикостероидных мазей или аэрозолей, применение 5% дерматоловой мази.
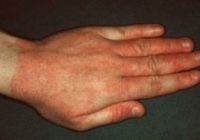
Аллергический контактный дерматит — это воспалительное заболевание кожи, возникающее в месте ее непосредственного контакта с аллергеном. Аллергический контактный дерматит характеризуется отечностью и покраснением тканей, контактровавших с аллергеном, зудом, появлением папул и пузырьков. Диагностика основывается на анамнезе и клинических данных, результатах аллергопроб и лабораторных анализов. В лечении основная роль принадлежит устранению контакта с веществом или предметом, обусловившим возникновение дерматита. Для устранения отечности и зуда возможно применение кортикостероидных мазей, современных антигистаминных препаратов.
МКБ-10
Общие сведения
Аллергический контактный дерматит — распространенный аллергодерматоз, которым страдает 1-2% населения. Заболевание чаще регистрируется у жителей промышленно развитых стран, являющихся активными потребителями бытовой химии, лекарственных препаратов, косметических средств, химических реагентов и т.п. В отличие от обычного контактного дерматита, аллергический дерматит развивается у сенсибилизированных лиц, т. е. у лиц с аллергической настроенностью организма. Большую часть пациентов в клинической дерматологии и аллергологии-иммунологии составляют люди молодого и среднего возраста.

Причины
Современная промышленность выпускает огромное число химических веществ, которые могут стать причиной аллергического контактного дерматита. Это краски и лаки, стиральные порошки и другие средства бытовой химии, некоторые составляющие парфюмерной продукции и косметики, синтетические материалы, из которых сделана одежда и красители, которыми она окрашена. Химические вещества, с которыми человек постоянно контактирует на работе, приводят к развитию профессионального дерматита. Аллергический контактный дерматит может быть вызван некоторыми лекарствами. Растения, такие как борщевик, примула, ясенец белый, и другие, также могут стать причиной аллергического контактного дерматита, который относится к фитодерматиту.
Аллерген воздействует на кожу, но происходящие в результате этого аллергические изменения затрагивают весь организм. Время, за которое развивается сенсибилизация, и возникает аллергическая реакция, зависит от того, насколько сильный аллерген воздействовал на кожу. Большую роль в этом процессе играет и состояние самого организма: предрасположенность к аллергическим реакциям, нарушения иммунитета при хронических воспалительных процессах, истончение рогового слоя кожи и др. Например, при повышенной потливости чаще наблюдается аллергический контактный дерматит, спровоцированный одеждой из окрашенных тканей.
Патогенез
Воспаление развивается по замедленному типу аллергической реакции, то есть при регулярном и достаточно длительном контакте с веществом-аллергеном. За время этого контакта происходит сенсибилизация организма и развивается повышенная чувствительность к аллергену. Местное воздействие на кожу запускает туберкулиноподобную реакцию гиперчувствительности клеточного типа. При связывании аллергена с тканевыми белками образуются антигены, которые вызывают активацию клеток Лангерганса и Т-лимфоцитов. Последние в свою очередь начинают синтезировать интерлейкины 1 и 2, гамма-интерферон, которые стимулируют иммунный ответ и воспалительную реакцию. При повторной встрече с аллергеном Т-лимфоциты (клетки памяти) быстро активируются, обусловливая развитие аллергических проявлений. Обычно от момента первого контакта с веществом-аллергеном до возникновения симптомов проходит от 7 до 10-14 суток.
Симптомы
Изменения кожи при остром аллергическом контактном дерматите всегда локализуются в месте контакта кожи с аллергеном и немного выходят за пределы этого контакта. Характерным является наличие четких границ очага поражения. Вначале развивается покраснение кожи и отечность тканей. Затем возникают папулы, довольно быстро наполняющиеся жидкостью и переходящие в стадию пузырьков. После вскрытия последних на коже образуются эрозии. При заживлении они покрываются корочками. Эти изменения на коже сопровождаются сильным зудом. Процесс заканчивается шелушением.
При продолжающемся воздействии аллергена на фоне уже возникшей аллергической реакции, развивается хроническая форма аллергического контактного дерматита. Для нее характерны размытые границы очагов поражения на коже и распространение воспалительных изменений на участки кожи, не контактирующие с аллергеном. При сильной сенсибилизации организма наблюдается генерализация процесса. Кожные проявления хронического аллергического контактного дерматита характеризуются образованием папул, сухостью и шелушением, утолщением кожи с усилением кожного рисунка (лихенизация). Постоянный зуд приводит к появлению вторичных повреждений кожи из-за ее постоянного расчесывания (экскориация).
Диагностика
Аллергический контактный дерматит достаточно легко диагностируется по характерным для него симптомам и выявлению связи с воздействием на кожу вещества, являющегося потенциальным аллергеном. Точно определить причину возникновения дерматита помогают кожные пробы. Их проводят практикующие аллергологи при помощи специальных тест-полосок, с нанесенными на них аллергенами. Полоски приклеивают на предварительно очищенную кожу. Аллергическую реакцию определяют по возникновению покраснения и отечности в месте наклеивания полоски.
Для выявления сопутствующих заболеваний и дифференциальной диагностики аллергического контактного дерматита проводят дополнительные обследования: клинический и биохимический анализ крови и мочи, анализ крови на сахар, кал на дисбактериоз. При необходимости выполняют обследование желудочно-кишечного тракта и исследование функции щитовидной железы.
Лечение аллергического дерматита
Главным условием успешного лечения контактного дерматита является полное устранение вызвавшего его аллергена. Так при аллергии на средства бытовой химии следует пользоваться защитными перчатками. При аллергии на синтетические материалы — носить только хлопчатобумажное белье, а при покупке одежды тщательно изучать состав ткани. При аллергии на металл металлические части одежды (молнии, пуговицы, крючки и кнопки) не должны соприкасаться с кожей, ножницы и другие инструменты должны иметь пластмассовые или деревянные ручки, необходимо также исключить ношение бижутерии из металла.
В лечении острого аллергического контактного дерматита эффективно применение кортикостероидных мазей. При образовании больших пузырей производят их прокалывание. Для снятия зуда и отечности назначают современные антигистаминные препараты: цетиризин, лоратадин, дезлоратадин и др. В тяжелых случаях принимают внутрь кортикостероидные препараты.
Прогноз и профилактика
При исключении контакта пациента с аллергеном происходит полное выздоровление. Однако повторных контактов с аллергеном не всегда удается избежать, особенно, если речь идет о профессиональной деятельности. В таких случаях аллергический контактный дерматит продолжает развиваться, сенсибилизация организма нарастает, происходит генерализация процесса и клинические проявления захватывают весь организм. Профилактика предполагает исключение контактирования с причинными аллергенами, а при неизбежности контакта - превентивный прием антигистаминных средств.
1. Аллергический контактный дерматит: основные подходы к диагностике, лечению и профилактике/ Степанова Е.В.// Лечащий врач. - 2009.
2. Новые возможности диагностики аллергического контактного дерматита/ Лусс Л. В., Ерохина С. М., Успенская К. С.// Российский аллергологический журнал. - 2008 - № 2.
3. Выбор тактики терапии аллергического контактного дерматита на лице/ Корсунская И.М. и др.// Эффективная фармакотерапия. - 2010 - №2.
4. Аллергические болезни: диагностика и лечение/ Паттерсон Р., Грэммер Л. К., Гринбергер П. А. - 2000.
Новосибирский государственный медицинский университет
Лечебно-оздоровительный центр "Eurofemme"
НИИ терапии СО РАМН, Новосибирск
ФГБНУ «Научно-исследовательский институт терапии и профилактической медицины», Новосибирск, Россия, 630089
ФГБНУ «Научно-исследовательский институт терапии и профилактической медицины», Новосибирск, Россия, 630089
ФГБНУ «Научно-исследовательский институт терапии и профилактической медицины», Новосибирск, Россия, 630089
ГБОУ ВПО «Новосибирский государственный медицинский университет» Минздрава России, Новосибирск, Россия, 630091
Полиморфизм некоторых генов иммунного ответа при атопическом дерматите
Журнал: Клиническая дерматология и венерология. 2015;14(5): 24‑27
Новосибирский государственный медицинский университет
Цель исследования — оценить ассоциации полиморфизмов rs1800795 гена IL6, VNTR в интроне 2 гена IL1RN и rs763780 гена IL17F с атопическим дерматитом (АтД) в русской популяции. Материал и методы. Группа больных с АтД (n=100, 25% мальчиков/мужчин, 75% девочек/женщин). В качестве контроля сформирована группа из двух подгрупп: 100 человек из популяционной выборки 25—35-летних жителей Октябрьского района Новосибирска, и 100 учащихся общеобразовательных школ. Геномную ДНК выделяли из венозной крови методом фенол-хлороформной экстракции. Генотипирование выполнялось с помощью полимеразной цепной реакции (VNTR, ген IL1RN) с последующим анализом полиморфизма длин рестрикционных фрагментов (ПДРФ) (rs1800795 и rs763780). Результаты. При сравнении исследуемых групп по частотам генотипов rs1800795 гена IL6 обнаружено достоверное различие (р=0,041). Отношение шансов у носителей генотипа СС попасть в группу с АтД в 1,7 раза выше, чем у носителей двух других генотипов (95% ДИ 1,1—2,9; р=0,028). Однако при разделении по полу оказалось, что у мужчин с АтД отсутствуют значимые различия при сравнении с группой контроля. По частотам генотипов и аллелей VNTR гена IL1RN и rs763780 гена IL17F значимых различий между группами не получено. Выводы. Полиморфизм rs1800795 гена IL6 ассоциирован с АтД. Носительство генотипа СС повышает риск развития АтД. Ассоциация VNTR гена IL1RN и rs763780 гена IL17F с АтД не обнаружена.
Новосибирский государственный медицинский университет
Лечебно-оздоровительный центр "Eurofemme"
НИИ терапии СО РАМН, Новосибирск
ФГБНУ «Научно-исследовательский институт терапии и профилактической медицины», Новосибирск, Россия, 630089
ФГБНУ «Научно-исследовательский институт терапии и профилактической медицины», Новосибирск, Россия, 630089
ФГБНУ «Научно-исследовательский институт терапии и профилактической медицины», Новосибирск, Россия, 630089
ГБОУ ВПО «Новосибирский государственный медицинский университет» Минздрава России, Новосибирск, Россия, 630091
В последние годы отмечается значительный рост частоты аллергических заболеваний, одно из ведущих мест среди которых занимает атопический дерматит (АтД) [1]. По данным литературы [1, 2], у 80% детей, страдающих АтД, отмечается отягощенный семейный анамнез. При атопии у одного из родителей риск развития АтД у ребенка составляет 45—50%. Как фенотип, он представляется очень гетерогенным с позиции этиологии. В известном руководстве по дерматологии выделяют три основных вида дефектов при АтД:
1. Дефекты барьерной функции эпидермиса.
2. Дефекты врожденного иммунитета.
3. Дефекты иммунной регуляции [2].
Согласно последним западноевропейским данным [3], около половины больных c АтД имеют мутацию в гене филаггрина (FLG). Однако остаются неясными причины развития заболевания у другой половины больных с АтД и факторы, способствующие мутациям в гене FLG и проявлению АтД. Одно из возможных объяснений заключается в наличии других генов в рамках модели АтД как олигогенного заболевания, или наличия генов-модификаторов. Логично искать такие гены из числа известных генов-кандидатов. К таким генам относятся гены иммунного ответа, один из которых — интерлейкин 6 (IL6; OMIM 147620) [4].
Ген IL6 находится на коротком плече 7-й хромосомы (7p15.3), с него синтезируется 9 транскриптов. Этот ген кодирует цитокин, который участвует в воспалительных реакциях и созревании В-клеток. Кроме того, этот белок, как было показано, способен индуцировать лихорадку при аутоиммунных и инфекционных заболеваниях, участвовать в остром и хроническом воспалении, где он секретируется в сыворотке крови и индуцирует транскрипцию воспалительных белков через воздействие на α-рецепторы IL6. Функционирование этого гена проявляется в самых разнообразных болезненных состояниях, ассоциированных с воспалением, в том числе в предрасположенности к сахарному диабету (OMIM 222100), к системному ювенильному ревматоидному артриту (OMIM 604302), к саркоме Капоши (OMIM 148000), к болезни Крона, ассоциированной с нарушением роста (OMIM 266600) и к внутричерепным кровоизлияниям при пороках развития сосудов мозга (OMIM 108010). В настоящее время в базе dbSNP (database single nucleotide polymorphisms) содержится информация о 824 полиморфизмах в этом гене [5]. Согласно данным базы HuGE Navigator (Navigator for Human Genome Epidemiology, version 2.0), исследованы ассоциации этого гена с несколькими сотнями патологических фенотипов, в том числе с АтД [6]. Замена G на С в 174-м положении в промоторе гена IL6 (rs1800795) была описана в 1998 г. [7]. Эти же авторы показали снижение экспрессии гена у носителей С аллеля по сравнению с аллелем G. Данные по ассоциации rs1800795 гена IL6 с АтД далеко неоднозначны [8—12].
IL1RN (OMIM 147679), ген антагониста рецептора IL1, находится на длинном плече 2-й хромосомы (2q13). Белок, который связывается с рецепторами IL1, ингибирует связывание с ними IL1α и IL1β. Как следствие, биологическая активность этих цитокинов нейтрализуется в физиологических и патофизиологических иммунных и воспалительных реакциях. Согласно данным базы HuGE Navigator (version 2.0), исследованы ассоциации этого гена с несколькими сотнями патологических фенотипов, в том числе с АтД [6]. В настоящее время в базе dbSNP содержится информация о 2525 полиморфизмах в этом гене [5]. В двух исследованиях, выполненных в Германии, не обнаружили ассоциации VNTR полиморфизма гена IL1RN с АтД [9,10], тогда как в Иране нашли ассоциацию другого полиморфизма (Pst-I 1970) с АтД [13].
IL17F (OMIM 606496), ген семейства IL17, находится на коротком плече 6-й хромосомы (6p12.2), участвует в регуляции нормального Т-клеточного ответа. Согласно данным базы HuGE Navigator (version 2.0), исследованы ассоциации этого гена с 59 патологическими фенотипами, в том числе с АтД [6]. В настоящее время в базе dbSNP содержится информация о 746 полиморфизмах в этом гене [5]. В Японии не нашли ассоциации полиморфизма IL17 °F с АтД [14].
Учитывая такую неоднородность данных, возможность использования этих полиморфизмов в качестве маркеров предрасположенности к развитию АтД необходимо проверять в каждой конкретной популяции.
Материал и методы
Обследованы 100 больных АтД в возрасте 15—35 лет, из которых 25% составляли мальчики/мужчины, а 75% — девочки/женщины. Диагностика АтД основывалась на жалобах, анамнезах жизни и заболевания. Диагноз АтД устанавливали при наличии классических диагностических критериев J. Hanifin и G. Rajka. Кроме того, учитывали стадию заболевания, клинико-морфологическую форму, распространенность процесса на коже. Степень тяжести заболевания определяли с учетом индекса SCORAD (Scoring of Atopic Dermatitis). Фиксировались также возраст начала заболевания, его продолжительность, выполнение и результат кожных аллергических проб, наличие сопутствующих аллергических заболеваний, семейный анамнез.
Для оценки частот генотипов и аллелей изучаемых полиморфизмов сформировали группу контроля из двух подгрупп. В 1-ю вошла популяционная выборка 25—35-летних жителей Новосибирска (n=100), обследованных в рамках международного проекта ВОЗ MONICA (Мониторинг заболеваемости и смертности от сердечно-сосудистых заболеваний) [15]. Во-2-ю подгруппу — учащиеся общеобразовательных школ Октябрьского района Новосибирска, сформированная из 10% выборки от всех учащихся общеобразовательных школ этого района (n=100).
Геномную ДНК выделяли из венозной крови методом фенол-хлороформной экстракции [16]. Генотипирование rs1800795 гена IL6 выполняли по методике: прямой праймер 5-AGCCTGTTAATCT GGTCACTGAAAA-3, обратный, 5-TGTGCAATG TGACGTCCTTTAGAAT-3. К ПЦР продуктам добавлялась эндонуклеаза рестрикции HinfI («Сибэнзим», Россия). Результат оценивался после электрофореза в 4% полиакриламидном геле и окраски 0,1% бромистым этидием.
Генотипирование VNTR в интроне 2-го гена IL1RN: прямой праймер 5-CTCAGCAACACTC CTAT-3, обратный, 5-TCCTGGTCTGCAGGTAA-3. Результат оценивался после электрофореза в 4% полиакриламидном геле и окраски 0,1% бромистым этидием.
Генотипирование rs763780 гена IL17F: прямой праймер 5-TGCTCTGTTTCTTTCCAGTTGGA-3, обратный, 5-TGGATATGCACCTCTTACTGCCCA-3. К ПЦР продуктам добавлялась эндонуклеаза рестрикции BssT1I («Сибэнзим», Россия). Результат оценивался после электрофореза в 4% полиакриламидном геле и окраски 0,1% бромистым этидием.
Статистический анализ проводили с использованием пакета программ SPSS 11.5. На I этапе определяли частоты генотипов и аллелей изучаемого полиморфизма в группе больных АтД и в группах контроля, затем оценивали соответствие частот генотипов равновесию Харди—Вайнберга в контрольной группе (по критерию χ 2 ). Ассоциацию однонуклеотидного полиморфизма (ОНП) с развитием АтД проверяли с помощью таблиц сопряженности с использованием критерия χ 2 по Пирсону. В случае четырехпольных таблиц для сравнения выборок по частотам генотипов и аллелей применяли точный двусторонний критерий Фишера. Относительный риск заболевания по конкретному аллелю или генотипу вычисляли как отношение шансов (ОШ).
Результаты и обсуждение
Частота генотипов в контрольной группе соответствует равновесию Харди—Вайнберга (χ 2 =0,76). При сравнении группы больных АтД с лицами контрольной группы по частотам генотипов полиморфизма rs1800795 гена IL6 получено достоверное различие (р=0,041) (см. таблицу). По частоте аллелей различия между группами отсутствуют. Отношение шансов у носителей генотипа СС попасть в группу с АтД в 1,7 раза выше, чем у носителей двух других генотипов (95% ДИ 1,1—2,9; р=0,028). Генотип GС, наоборот, чаще встречается в группе контроля, чем в группе с АтД (р=0,020) (см. таблицу). Факторы, уровень которых выше в группе здоровых по сравнению с группой больных, принято называть протективными или защитными. Отношение шансов у носителей генотипа GС попасть в группу больных АтД составляет 0,5 по сравнению с носителями двух других генотипов (95% ДИ 0,3—0,9).

Частота генотипов полиморфизмов генов в группе больных атопическим дерматитом и в контрольной группе
В контрольной группе различия по частоте генотипов при разделении по полу отсутствовали, поэтому при сравнении с группой больных АтД ее не делили по полу. При разделении группы с АтД по полу оказалось, что у мужчин с АтД отсутствуют значимые различия при сравнении с группой контроля, тогда как при сравнении частоты генотипов в группе женщин с АД с частотами в группе контроля различия сохраняются (р=0,040) (см. рисунок).

Частота генотипов rs1800795 гена IL6 у женщин.
Отношение шансов у женщин-носительниц генотипа СС попасть в группу с АтД в 1,8 раза выше, чем у носительниц двух других генотипов (95% ДИ 1,1—3,2; р=0,043). В работе, посвященной исследованию [17], связи этого ОНП с инсулинзависимым сахарным диабетом обнаружили ассоциацию генотипа СС с заболеванием у женщин: у носительниц генотипа СС клинические признаки появлялись раньше.
Первые две работы по изучению ассоциации АтД с rs1800795 гена IL6 были выполнены в Германии и опубликованы в 2003 г. K. Reich и соавт. [9] не обнаружили ассоциации с АтД. G. Westphal и соавт. [10] проверяли ассоциацию с контактным аллергическим дерматитом и не обнаружили ее. Однако у них получились сходные с нашими результаты по частотам генотипов этого полиморфизма при разделении групп на лиц с экземой в анамнезе и без нее, с существенным повышением частоты носительства генотипа СС (47,4%) и снижением частоты носительства генотипа GС (29,8%) в группе с экземой, по сравнению с лицами без экземы (30,3 и 50,3% соответственно). В Македонии не обнаружили ассоциации этого ОНП с АтД [15]. В Чехии обнаружили достоверные различия частот генотипов у лиц контрольной группы и больных АтД, но генотипом «риска» у них оказался генотип GG [8], равно как и в исследовании иранских авторов [12]. Но в последнем случае имеется значительное отклонение частот генотипов от равновесия Харди—Вайнберга в контрольной группе.
По частоте генотипов и аллелей VNTR гена IL1RN и rs763780 гена IL17F значимых различий между группами не получено (см. таблицу), в том числе и при разделении по полу.
Мы пока недостаточно хорошо представляем роль генов иммунного ответа в развитии патологических процессов, все их взаимодействия, положительные и отрицательные обратные связи. Мы до сих пор находимся на этапе накопления знаний и каждое новое исследование — это еще один шаг к лучшему пониманию патогенеза заболевания.
Выводы
Полиморфизм rs1800795 гена IL6 ассоциирован с АтД. Носительство генотипа СС повышает риск развития АтД. Ассоциация VNTR гена IL1RN и rs763780 гена IL17 °F с АтД не обнаружена.
Контактный аллергический дерматит (синонимы – сенсибилизационный, аллергический) – воспалительное заболевание кожи, возникающее в результате воздействия на кожу аллергена у людей с повышенной чувствительностью к различным веществам (химические раздражители, натуральные и синтетические полимеры, пищевые, растительные и т.д.) [1,2,3,4].
Пользователи протокола: дерматовенерологи, аллергологи, терапевты, врачи общей практики.
Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+).
Результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++или+), результаты которых не могут быть непосредственно распространены на соответствующую популяцию.

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
• Острое (выраженная гиперемия ярко-красного цвета). Кожный процесс представлен преимущественно экуссудативными морфологическими элементами пузырьками, эрозиями, мокнутием, пятнами, папулами. Дермографизм красный, стойкий);
• Подострое (менее выраженная гиперемия розовато-красного цвета). Наряду с экссудативными элементами встречаются корочки, чешуйки, инфильтрация в основании морфологических элементов более выражена, мокнутия нет. Дермографизм красный);
• Хроническое (гиперемия красновато-синюшного цвета). Экссудативных элементов мало или почти, корки, чешуйки, местами лихенификация, мокнутия нет. Дермографизм может быть смешанным – красным с переходом в белый).
Диагностика
II. МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Минимальный перечень обследования, который необходимо провести при направлении на плановую госпитализацию: согласно внутреннему регламенту стационара с учетом действующего приказа уполномоченного органа в области здравоохранения.
Основные (обязательные) диагностические обследования, проводимые на стационарном уровне (при плановой госпитализации проводятся диагностические обследования непроведенные на амбулаторном уровне): нет.
Дополнительные диагностические обследования, проводимые на стационарном уровне (при плановой госпитализации проводятся диагностические обследования непроведенные на амбулаторном уровне):
Диагностические мероприятия, проводимые на этапе скорой неотложной помощи: нет.
• эффективность ранее проводимой терапии.
• локализация (в отличие от контактного дерматита) – высыпания могут располагаться не только в местах воздействия аллергена;
• Кожные тесты с аллергенами – позволяют выявить аллергены, что служит основанием для формирования индивидуального комплекса профилактических мероприятий [5].
• аллерголог – отсутствие указаний на провоцирующий фактор, отсутствие эффекта от проводимой терапии, проведение аллергологических исследований;
• терапевт – при наличии сопутствующей патологии внутренних органов или систем в стадии обострения и/или декомпенсации;
• гастроэнтеролог – при наличии сопутствующих патологий со стороны желудочно-кишечного тракта в стадии обострения и/или декомпенсации.
Дифференциальный диагноз
| Простой контактный (артифициальный дерматит) | В основном характеризуется аналогичными морфологическими элементами на коже, как и при контактном аллергическом дерматите. Однако сыпь локализуется строго в местах контакта с раздражителем. При длительном воздействии раздражителя (даже в низких концентрациях), кожный процесс представлен очагами эритемы, лихенизации, экскориациями и гиперпигментацией. Интенсивность клинических проявлений контактного дерматита зависит от концентрации раздражителя, длительности воздействия, индивидуальной чувствительности и возраста пациента. |
| Токсикодермия | В основном характеризуется аналогичными морфологическими элементами на коже, как и при контактном аллергическом дерматите. Однако появление сыпи на коже четко ассоциировано с приемом медикаментозных средств (перорально, ингаляционно, парентерально, вагинально и ректально) и пищевых продуктов, обладающих аллергизирующими и токсическими свойствами. |
| Атопический дерматит | Характеризуется папулезными высыпаниями, выраженным зудом, лихенизацией. Высыпания локализуются преимущественно в области верхней половины туловища, шеи, лица и верхних конечностей с признаками папулезной инфильтрации. Для атопического дерматита характерен эволюционный патоморфоз – стадия заболевания и его течение меняется в зависимости от возраста. |
| Экзема истинная | Клиническая картина представлена зудом, эритематозно-везикулезными, папуло-везикулезными элементами, эрозиями, «серозными колодцами», мокнутием, корками. Очаги поражения не имеют четких границ. В большинстве случаев хроническое течение. |
| Розовый лишай Жибера | Клинически характеризуется появлением «материнского пятна» - розового пятна, центральная часть которого имеет желтоватый оттенок и шелушение. Затем появляются распространенные пятна, локализующиеся на туловище по линиям Лангера; нижние конечности, как правило, в процесс не вовлекаются. Зуд слабо выражен. |
Лечение
Элиминационные мероприятия: исключение контакта с различными аллергенами, ограничение использования синтетических моющих средств и др.
Медикаментозное лечение, оказываемое на амбулаторном и стационарном уровне [1,2,3,13,14,15,16,17,18,19,20,21,22]:
При комбинированном лечении антигистаминные препараты первого поколения назначаются в вечернее время, антигистаминные препараты второго поколения – утром.
Используется один из нижеперечисленных препаратов, при любом течении патологического процесса на коже - как при остром, так и при подостром и хроническом.
• Дифинилгидрамин, 20 мг или 30 мг или 50 мг, перорально 1–3 раза в день в течение, в среднем, 10–15 дней; или дифинилгидрамин 1% в\м или в\в по 1,0–2,0 мл в сутки, в течение, в среднем, 10–15 дней;
• Диметинден, капли (1 мл– 20 капель– 1 мг), перорально 20–40 капель 3 раза в день в течение, в среднем 10–15 дней.
Используются при любом течении патологического процесса на коже - как при остром, так и при подостром и хроническом.
Используются при остром и подостром течении патологического процесса на коже. При условии если не проводится дезинтоксикационная терапия.
• Кальция глюконат, 10%, в\в и в\м, по 5–10 мл 1 раз в день, в течение, в среднем 10–15 дней.
Применятся один из нижеперечисленных препаратов при любой форме течения патологического процесса на коже. В процессе терапии возможен переход на другой препарат или комбинированное лечение (с другим препаратом из списка).
• Клобетазол пропионат, 0,05%, 1–2 раза в день, наружно в течение 7–10 дней с учетом количества очагов поражений на коже;
• Бетаметазона валерианат, 0,1%, 1–2 раза в день наружно в течение 7–10 дней с учетом количества очагов поражений на коже;
• Метилпреднизолона ацепонат, 0,05%, 1–2 раза в день наружно в течение 7–10 дней с учетом количества очагов поражений на коже;
• Мометазона фуроат, 0,1%, 1–2 раза в день наружно в течение 7–10 дней с учетом количества очагов поражений на коже;
• Гидрокортизона–17 бутират, 0,1%, 1–2 раза в день наружно в течение 7–10 дней с учетом количества очагов поражений на коже;
• Бетаметазона дипропионат, 0,05%, 1–2 раза в день наружно в течение 7–10 дней с учетом количества очагов поражений на коже;
• Десонид, 0,1%, 1–2 раза в день наружно в течение 7–10 дней с учетом количества очагов поражений на коже;
• Флуционола ацетонид, 0,025%, 1–2 раза в день наружно в течение 7-10 дней с учетом количества очагов поражений на коже;
• Триамцинолона ацетонид, 0,1%, 1–2 раза в день наружно в течение 7-10 дней с учетом количества очагов поражений на коже;
• Аклометазона дипропионат, 0,05%, 1–2 раза в день наружно в течение 7-10 дней с учетом количества очагов поражений на коже;
• Преднизолон, 0,25% или 0,5%, 1–2 раза в день наружно в течение 7–10 дней с учетом количества очагов поражений на коже;
• Гидрокортизона ацетат 0,1% или 0,25% или 1,0% или 5,0%, 1–2 раза в день наружно в течение 7-10 дней с учетом количества очагов поражений на коже.
• Бетаметазона дипропионат (1мг) + гентамицина сульфат (1 мг) + клотримазол (10 мг), 1–2 раза в день наружно в течение 7–10 дней с учетом количества очагов поражений на коже;
• Гидрокортизон (1мг) + натамицин(10 мг) + неомицин (3500 ЕД), 1–2 раза в день наружно в течение 7–10 дней с учетом количества очагов поражений на коже;
• Бетаметазон (1 мг) + гентамицин (1 мг), 1–2 раза в день наружно в течение 7-10 дней с учетом количества очагов поражений на коже.
• Нитрофурал 20 мг, для приготовления раствора (1:5000), наружно 1–3 раза в течение, в среднем 1–3 дня.
• Диметинден, наружно 2–4 раза в день в течение, в среднем 1–7 дней.
Системные ГКС назначают в случае длительного выраженного обострения распространенных форм АКД при неэффективности наружной терапии, нестерпимом зуде, не купирующимся другими средствами. Применение системных ГКС при АКД.
Доза и продолжительность лечения устанавливается врачом индивидуально в зависимости от показаний и тяжести заболевания для снятия остроты приступа с постепенным снижением дозы, назначение препарата обосновывать сопоставляя ожидаемую пользу и возможные нежелательные эффекты значительно ограничивающие использование этих препаратов до непродолжительного времени, системные ГКС назначают в случае длительного выраженного обострения распространенных форм АКД при неэффективности наружной терапии, нестерпимом зуде, не купирующимся другими средствами. Применение системных ГКС при АКД необходимо тщательно обосновывать.
• Триамцинолон 4 мг.
• с целью восстановление барьерных свойств кожи применение эмолентов, корнеопротекторов, других смягчающих средств [22,23,24,25].
Препараты (действующие вещества), применяющиеся при лечении
| Алклометазон (Alclometasone) |
| Бетаметазон (Betamethasone) |
| Гентамицин (Gentamicin) |
| Гидрокортизон (Hydrocortisone) |
| Дезлоратадин (Desloratadine) |
| Десонид (Desonide) |
| Диметинден (Dimetindene) |
| Дифенгидрамин (Diphenhydramine) |
| Кальция глюконат (Calcium gluconate) |
| Кетотифен (Ketotifen) |
| Клемастин (Clemastine) |
| Клобетазол (Clobetasol) |
| Клотримазол (Clotrimazole) |
| Лоратадин (Loratadine) |
| Мебгидролин (Mebhydrolin) |
| Метилпреднизолон (Methylprednisolone) |
| Метилтиониния хлорид (Methylthioninium chloride) |
| Мометазон (Mometasone) |
| Натамицин (Natamycin) |
| Натрия тиосульфат (Sodium thiosulfate) |
| Неомицин (Neomycin) |
| Нитрофурал (Nitrofural) |
| Преднизолон (Prednisolone) |
| Триамцинолон (Triamcinolone) |
| Флуоцинолона ацетонид (Fluocinolone acetonide) |
| Фукорцин (Fucorcin) |
| Хифенадин (Quifenadine) |
| Хлоропирамин (Chloropyramine) |
| Цетиризин (Cetirizine) |
| Цинка оксид (Zinc oxide) |
Госпитализация
Информация
Источники и литература
Информация
1) Батпенова Гульнар Рыскельдиевна – доктор медицинских наук, АО «Медицинский университет Астана», профессор, заведующая кафедрой дерматовенерологии, главный внештатный дерматовенеролог МЗ РК;
2) Джетписбаева Зульфия Сейтмагамбетовна – кандидат медицинских наук, АО «Медицинский университет Астана», доцент кафедры дерматовенерологии;
3) Баев Асылжан Исаевич – кандидат медицинских наук, РГП на ПХВ «Научно-исследовательский кожно-венерологический институт» МЗ РК, старший научный сотрудник;
4) Шортанбаева Жанна Алихановна – кандидат медицинских наук, Казахский Национальный Медицинский Университет имени С.Д. Асфендиярова, доцент модуля дерматовенерологии;
Рецензенты:
Нурушева Софья Мухитовна – доктор медицинских наук, РГП на ПХВ «Казахский национальный медицинский университет имени С.Д. Асфендиярова», руководитель модуля дерматовенерологии.
Указание условий пересмотра протокола: Пересмотр протокола через 3 года после его опубликования и с даты его вступления в действие или при наличии новых методов с высоким уровнем доказательности.
Читайте также:

