Интрамуральная гематома аорты это
Обновлено: 19.04.2024
Российский научный центр хирургии им. акад. Б.В. Петровского РАМН, Москва
Российский научный центр хирургии им. акад. Б.В. Петровского, Москва, Россия
ФГБУ РНЦХ им. акад. Б.В. Петровского РАМН, Москва
ФГБНУ «Национальный медицинский исследовательский центр гематологии» Минздрава России, Москва, Россия
Интрамуральная гематома аорты после транспедикулярной фиксации грудного отдела позвоночника
Журнал: Хирургия. Журнал им. Н.И. Пирогова. 2020;(2): 84‑88
Российский научный центр хирургии им. акад. Б.В. Петровского РАМН, Москва
Пациенту М. 55 лет, 31.01.17 по поводу компрессионных переломов Th—Th выполнено оперативное вмешательство — декомпрессионная ламинэктомия Th—Th, транспедикулярная фиксация Th—Th. Затем в НМИЦ гематологии, где пациент проходил лечение, установлен диагноз множественной миеломы. При плановой КТ грудного отдела позвоночника выявлено выстояние транспедикулярно винта Thслева за пределы тела позвонка и его интимное прилежание к стенке аорты, причем в зоне контакта винта с сосудом определены признаки интрамуральной гематомы. Пациент направлен на консультацию в РНЦХ им. акад. Б.В. Петровского. По результатам консилиума рекомендовано проведение оперативного вмешательства в два этапа: эндопротезирование грудного отдела аорты и затем ревизия системы транспедикулярной фиксации и перемонтаж системы. 14.07.17 выполнено двухэтапное оперативное вмешательство. Послеоперационный период протекал гладко. Пациент полностью вернулся к повседневной жизни.
Российский научный центр хирургии им. акад. Б.В. Петровского РАМН, Москва
Российский научный центр хирургии им. акад. Б.В. Петровского, Москва, Россия
ФГБУ РНЦХ им. акад. Б.В. Петровского РАМН, Москва
ФГБНУ «Национальный медицинский исследовательский центр гематологии» Минздрава России, Москва, Россия
Введение
Согласно данным разных авторов, переломы позвонков составляют от 2 до 12% случаев травматических повреждений опорно-двигательного аппарата. Среди переломов позвонков выделяют неосложненные (без неврологической симптоматики) и осложненные (с неврологической симптоматикой), которые могут приводить к стойкой инвалидизации, а порой и к летальным исходам. При лечении переломов позвонков применяются как консервативные, так и оперативные методы. От 10 до 15% переломов лечат оперативно.
Множественная миелома — клональное В-клеточное заболевание, характеризующееся пролиферацией и накоплением В-лимфоцитов и плазматических клеток в костном мозге и реже экстрамедуллярно. Миеломная болезнь — второе по распространенности гематологическое заболевание, встречается с частотой 3—6 случаев на 100 000 населения в год, причем мужчины страдают данным заболеванием чаще [1]. Именно при данном новообразовании чаще всего поражаются кости скелета [2]. Поражение костной ткани устанавливают в 80% случаев, при этом в 70% случаев боль в костях — первый симптом, в 30% случаев выявляют переломы костей, при этом около 60% составляют переломы позвонков (чаще других костей скелета). Как правило, поражаются ThXII-, ThVII-, LI-позвонки [3]. В 11—24% случаев переломы являются осложненными [4].
В лечении миеломной болезни применяют комплексный подход: таргетную антимиеломную химиотерапию, терапию костных изменений (бисфосфонатами), радио- и симптоматическую терапию [1]. В 3—4% проводят оперативное лечение. С этой целью применяют транскутанные транспедикулярные методики (вертебропластика, кифопластика), реже — открытые оперативные вмешательства с использованием транспедикулярных систем стабилизации. В случае миеломной болезни предусмотрены различные программы химиотерапии. При проведении транспедикулярной фиксации неверное расположение винтов, по данным разных авторов [5], отмечается в 4—30% случаев. Во время таких оперативных манипуляций повреждения аорты крайне редки, но являются весьма опасным осложнением, причем частота осложнений данного типа выше в грудном отделе позвоночника из-за анатомических особенностей позвонков [6]. К ним относят перфорацию с развитием кровотечения или образованием гематомы, эрозии стенки или образование псевдоаневризмы [7]. Обычно осложнения, связанные с повреждением аорты, проявляются в момент травмы, но довольно часто могут иметь отсроченный характер, их обнаруживают через годы или случайно [8]. В таких ситуациях прибегают к различным комбинациям оперативных техник — открытым или эндоваскулярным вмешательствам с переустановкой (чаще) винта или дальнейшему динамическому наблюдению [9].
Пациент М., мужчина, 55 лет. Занимается административным трудом (на руководящей должности). Рост 173 см, масса тела 76 кг. Наследственный анамнез не отягощен. Не курит, алкоголь употребляет крайне редко (до 2—3 раз в год). Ведет активный образ жизни, занимается спортом на любительском уровне (футбол, волейбол, большой теннис). Был направлен в РНЦХ им. акад. Б.В. Петровского на консультацию после проведенной декомпрессионной ламинэктомии ThVII—ThVIII, транспедикулярной фиксации ThVI—ThIX от 31.01.17. При плановой КТ грудного отдела позвоночника выявлено выстояние транспедикулярно винта ThVI слева за пределы тела позвонка и его интимное прилежание к стенке аорты. В зоне контакта винта с сосудом признаки интрамуральной гематомы. Случай обсужден на консилиуме в составе заведующего отделением хирургии позвоночника, заведующего отделением хирургии аорты и ее ветвей, заведующего отделением рентгенохирургии и аритмологии. По результатам консилиума рекомендовано проведение оперативного вмешательства в 2 этапа: эндопротезирование грудного отдела аорты первым этапом и ревизия системы транспедикулярной фиксации и перемонтаж системы вторым этапом.
Впервые пациент отметил появление боли в грудном отделе позвоночника в сентябре 2016 г., во время игры в волейбол. Обратился за консультацией к нейрохирургу, назначено консервативное лечение. На фоне лечения улучшения не отмечено. Болевой синдром прогрессировал, присоединилась боль в покое. В январе 2017 г. в связи с неэффективностью терапии повторно обратился за медицинской помощью, проведена КТ грудного отдела позвоночника, в ходе которой обнаружены компрессионные переломы тел ThVII—ThVIII позвонков. Высказано предположение о метастатическом характере поражения позвонков, в связи с чем пациент был госпитализирован для проведения диагностических мероприятий. Проведен комплекс лабораторно-инструментальных исследований, по результатам которых данных, свидетельствующих в пользу онкологического заболевания, не выявлено. Принято решение о необходимости стабилизации позвоночника. 31.01.17 выполнено оперативное вмешательство: декомпрессионная ламинэктомия ThVII—ThVIII, транспедикулярная фиксация ThVI—ThIX с установкой деротационной поперечины. Ранний послеоперационный период протекал гладко, рана заживала первичным натяжением. В связи с подозрением на миеломную болезнь пациент направлен на консультацию в НМИЦ гематологии.
16.02.17 в центре гематологии установлен диагноз множественной миеломы. Пациенту проведено 5 курсов паллиативной химиотерапии по программе VCD, 2 курса — по программе VRD. После проведения лечения выполнена КТ (рис. 1 и 2) Рис. 1. Контрольные компьютерные томограммы органов грудной клетки от 25.05.17. Установлено неправильное положение левого винта ThVI, прилежание его к аорте. Рис. 2. Контрольные компьютерные томограммы органов грудной клетки от 04.07.17. Отмечается деформация стенки аорты, образование интрамуральной гематомы. грудного отдела позвоночника, обнаружено некорректное положение транспедикулярного винта. Пациент направлен на консультацию по месту оперативного лечения, где клиническая картина расценена как удовлетворительная и рекомендовано динамическое наблюдение.
Пациент направлен в РНЦХ им. акад. Б.В. Петровского на консультацию. Случай обсужден на консилиуме в составе заведующего отделением хирургии аорты и ее ветвей, заведующего отделением рентгенохирургии и аритмологии, заведующего отделением хирургии позвоночника. По результатам консилиума рекомендовано проведение оперативного вмешательства в 2 этапа: эндопротезирование грудного отдела аорты и ревизия системы транспедикулярной фиксации и перемонтаж системы.
13.07.17 больной госпитализирован в отделение рентгенохирургических методов диагностики и лечения с основным диагнозом: интрамуральная гематома грудного отдела аорты, состояние после декомпрессионной ламинэктомии ThVII—ThVIII, транспедикулярной фиксации ThVI—ThIX от 31.01.2017; фоновое заболевание — множественная миелома, протекающая с парапротеинемией G-каппа и протеинурией BJ-каппа, делецией 17p13/TP53, IIIA стадия по DSS, II стадия по ISS. Состояние после 5 курсов химиотерапии по программе VCD. Первично-резистентное течение. Состояние после 2 курсов терапии по программе VRD. Распространенный остеодеструктивный процесс. Вторичный гуморальный иммунодефицит. Рецидивирующая вирусная инфекция наружных половых органов вне обострения. Двусторонний блефарит в стадии разрешения.

После предоперационной подготовки 14.07.17 выполнено оперативное вмешательство: эндопротезирование грудного отдела аорты стент-графтом ValiantThoracic VAMF2828C150TE — первым этапом, ревизия системы транспедикулярной фиксации, перемонтаж левого винта ThVI — вторым этапом (рис. 3). Рис. 3. Интраоперационные рентгенограммы позвоночника после установки стент-графта.
Оперативное вмешательство прошло без осложнений. В ходе второго этапа выявлено нестабильное положение транспедикулярного винта ThVI слева. Винт удален. Под контролем рентгеновской установки с электронно-оптическим преобразователем винт транспедикулярно введен в тело ThVI позвонка под другим углом. На контрольных снимках выстояния за тело позвонка не отмечено.
Проведение оперативного вмешательство с целью восстановления передней опорной колонны позвоночника (формирование корпородеза) нецелесообразно в данной ситуации из-за состояния пациента по основному заболеванию. Принято решение о проведении вмешательства после прохождения полного лечения миеломной болезни и по стабилизации состояния.
Ранний послеоперационный период протекал гладко, раны зажили первичным натяжением. Пациент активизирован на 2-е сутки после оперативного вмешательства.

На контрольной КТ: положение системы транспедикулярной фиксации удовлетворительное, выхождения винтов за тела позвонков не отмечено, положение эндопротеза аорты удовлетворительное (рис. 4). Рис. 4. Компьютерные томограммы органов грудной клетки от 18.07.17. Винты расположены в теле позвонка, не выстоят за кортикальный слой; положение эндопротеза аорты правильное.
На 4-е сутки пациент в удовлетворительном состоянии выписан под амбулаторное наблюдение кардиолога, сосудистого хирурга и травматолога-ортопеда. На 12-е сутки удалены швы.
Пациент активизирован, полностью вернулся к труду и повседневной жизни, занимается физкультурой.

В октябре 2017 г. в связи с ухудшением состояния госпитализирован в НМИЦ гематологии в связи с прогрессированием миеломной болезни. После проведения коррекции курсов химиотерапии пациенту выполнена контрольная КТ грудного отдела позвоночника, выявлены новые мягкотканые очаги в телах позвонков (рис. 5). Рис. 5. Контрольные компьютерные томограммы органов грудной клетки от 14.11.17. Положение транспедикулярных винтов удовлетворительное, система стабильна; положение стент-графта в аорте правильное. Отмечается появление новых мягкотканых очагов в телах позвонков. Система транспедикулярной фиксации стабильна, миграции винтов не отмечено. Пациент проходит лечение в условиях НМИЦ гематологии.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflict of interest.
Сведения об авторах
Грудная и брюшная аорта в
1) трехмерной реконструкции (левое боковое изображение),
2) парасагиттальная многоплоскостная реконструкция (multiplanar reconstruction — MPR) вдоль осевой линии (левая средняя часть),
3) выпрямленная MPR вдоль осевой линии с заданными ориентирами (а-I) (правая сторона),
4) поперечные сечения, ориентированные ортогонально к осевой линии с ориентирами (A-J).
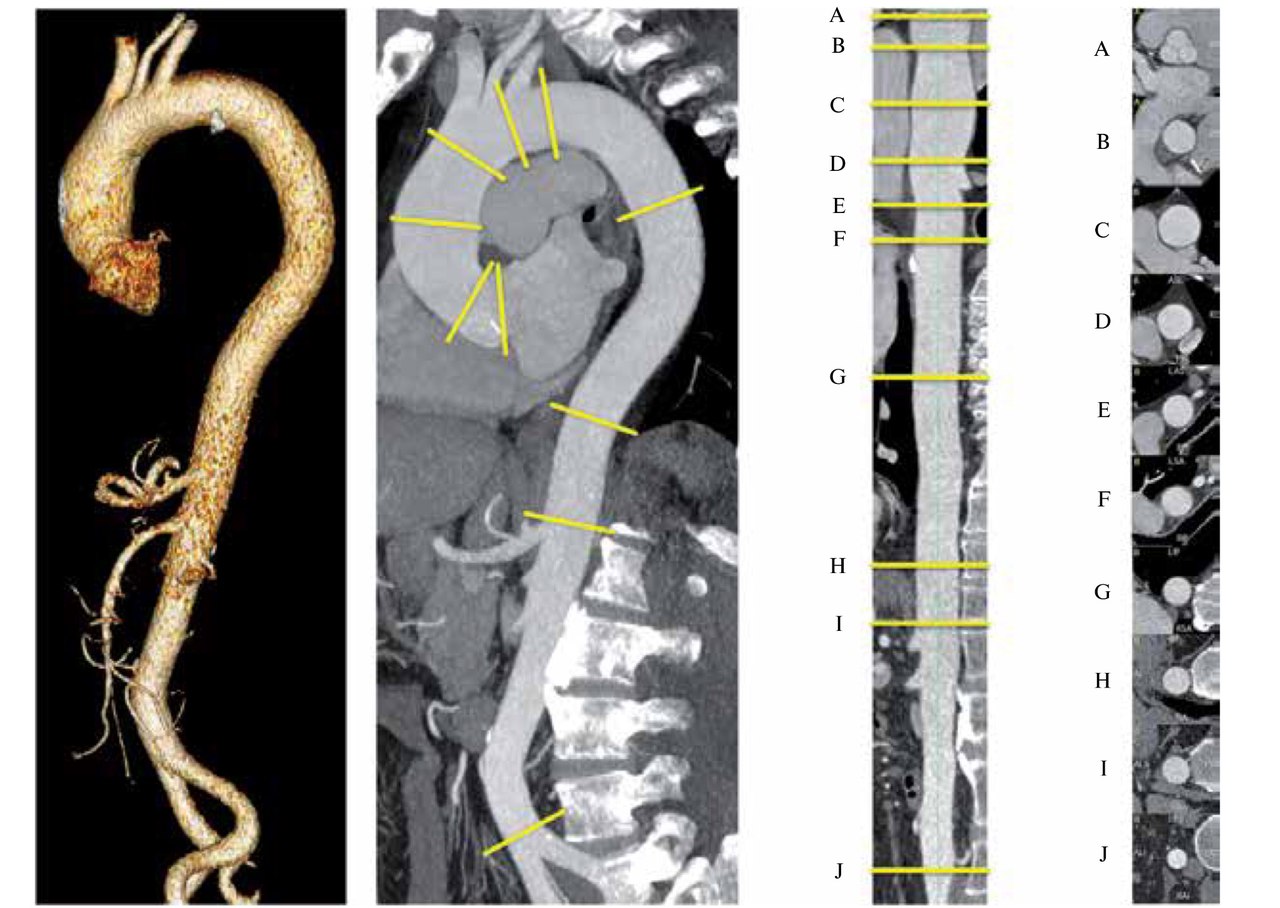
Примечание: точки A-J следует использовать при оценке диаметров аорты:
(A) синусы Вальсальвы,
(B) синотубулярное соединение,
(С) середина восходящей аорты (как указано),
(D), проксимальный отдел дуги аорты (аорта в области отхождения брахиоцефального ствола),
(е) в середине дуги аорты (между левой общей сонной артерией и подключичной артерией),
(F) проксимальный отдел нисходящей грудной аорты (примерно 2 см дистальнее левой подключичной артерии),
(g), в середине нисходящей аорты (уровень легочной артерии, как легко идентифицируемых точек, как указано),
(Н) уровень диафрагмы,
(I), уровень отхождения чревного ствола,
(J) прямо перед бифуркацией аорты.
(Предоставлено F Nensa, институт диагностической и интервенционной радиологии, эссен).
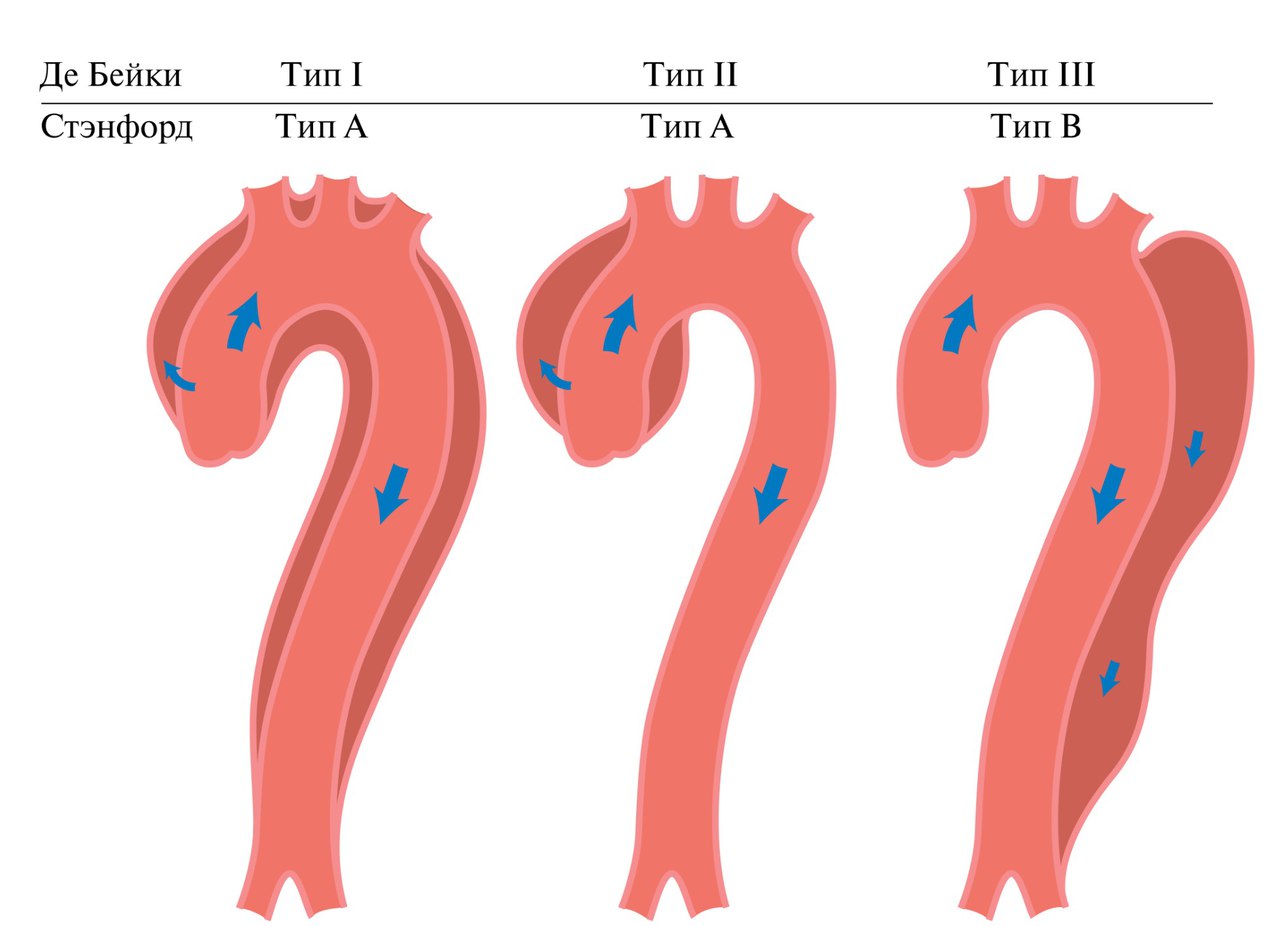
Классификация расслоения аорты по распространению.
Примечание: схемы Ра класс 1, в котором выделяют типы I, II, и III по De Bakey.
Также изображены классы по stanford A и В.
В типе III выделяют подтипы III A в III C. (подтип зависит от вовлечения грудной или брюшной аорты, по Reul и др.)
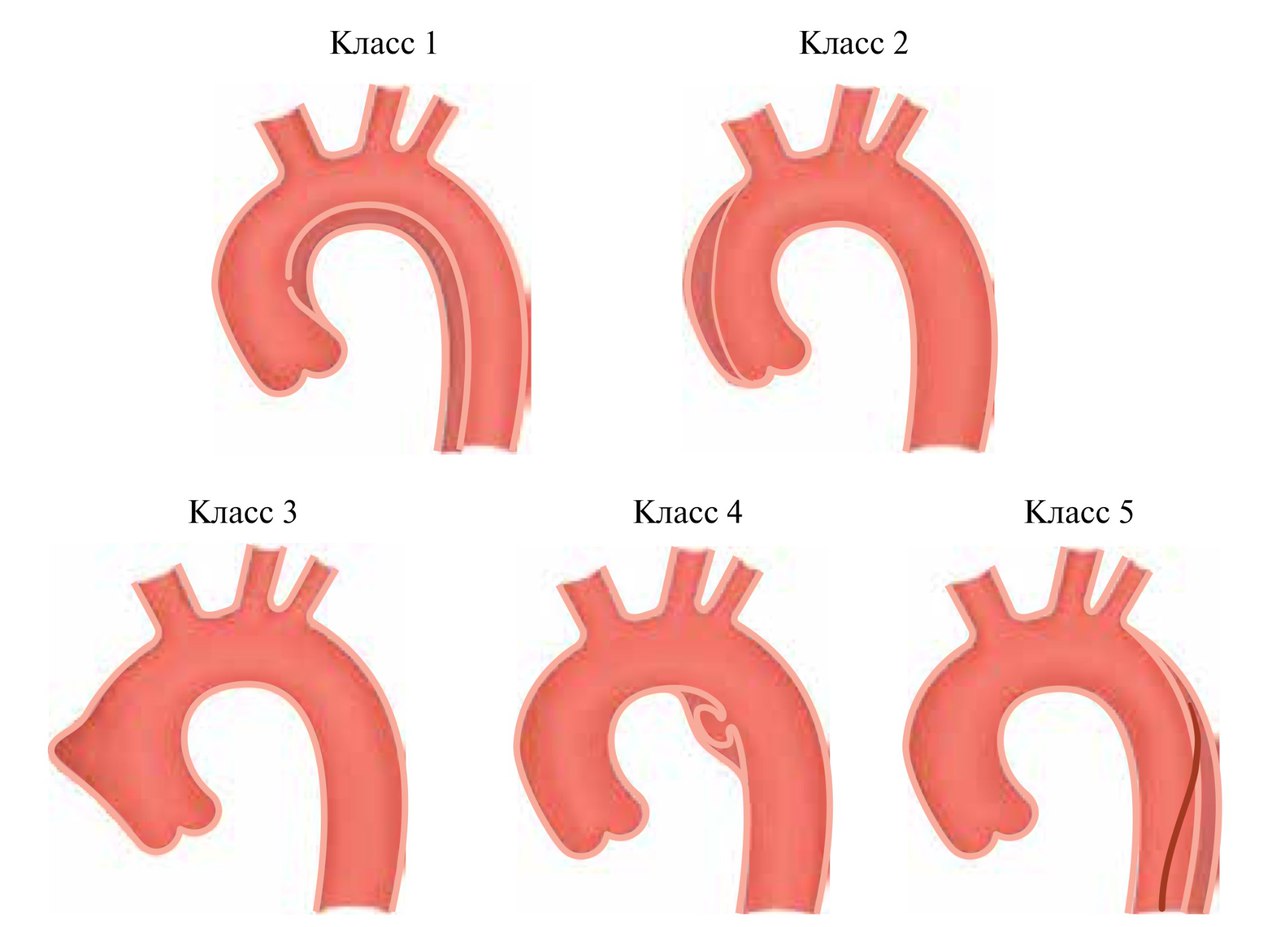
Классификация расслоения аорты при остром коронарном синдроме.
Примечание:
класс 1: классическое расслоение аорты с истинным и ложным просветом с или без связи между двумя просветами.
класс 2: интрамуральная гематома.
класс 3: малозаметное или дискретное расслоение аорты с выпячиванием стенки аорты.
класс 4: Язва области атеросклеротической бляшки аорты с последующем разрывом бляшки.
класс 5: Ятрогенное или травматическое расслоение аорты, проявляется катетер-индуцированным разделением интимы.
Естественная история и проблема острых интрамуральных гематомы продолжает обсуждаться. Сердечно-сосудистые хирурги Красноярска настаивают на том, что коррекция при острой интрамуральной гематоме восходящей аорты должна осуществляться хирургическим путем из-за недопустимо высокой смертности при медикаментозном лечении. Некоторые исследования пациентов утверждают, что гематомы стенки аорты отражают более доброкачественное состояние, в котором агрессивная медикаментозная терапия и контрольное УЗИ сердца может позволить бдительно изучить и избежать хирургического вмешательства у некоторых пациентов. Причин такого расхождения может касаться генетического варианта заболевания аорты у пациентов в разных странах. Острые интрамуральные гематомы, когда они впервые диагностируются, могут выглядеть как классические тонкие структуры при расслоении аорты, из которых может выставляться диагноз при начальной визуализации на УЗИ сердца. Но в итоге на последующей эхокардиографии или повторном рассмотрении первоначальных исследований, диагноз корректируется. Второй сценарий является прогрессирование интрамуральных гематом в классическое расслоение аорты, что фиксируется между первоначальным диагностическим исследованием и последующим промежуточным изображением на УЗИ сердца. Не редкость, когда интрамуральные гематомы переходят в тип Б расслоения.

Для пациента в течение нескольких часов от появления симптомов с явной острой гематомой в области восходящей аорты с расширением ее на устья коронарных артерий приводит к ишемии миокарда и недостаточности аортального клапана. В таких случаях выжидательная тактика гораздо более опасна, чем хирургическое вмешательство. И наоборот, у пациента в течение 48 часов после появления симптомов с ограниченной интрамуральной гематомой возле арки и идущим дистальным расслоением, выжидательное и медикаментозное лечение представляется целесообразным в свете имеющихся в настоящее время данных. Учитывая эти неопределенности, пока дальнейшие исследования обеспечивают получение более прогностических данных, многие специалисты рекомендуют окончательную реконструкцию аорты при острой интрамуральной гематоме восходящей аорты. Менее агрессивное отношение к гематомам, идущим в нисходящую аорту. Аналогично этому принята стратегия при типе B-расслоения аорты.
ТУПАЯ ТРАВМА АОРТЫ
Травматические поражения аорты являются более смертоносными по отношению к естественному возникновению аневризм. По некоторым данным 85% из всех травматических поражений аорты приводит к смерти от свободного разрыва стенки, и только 25% уцелевших в первый час имеют шанс на выживание. До 70% выживают в течение 6 часов, 50% в течение 24 часов, и 10% в ближайшие 4 месяца, если не проведено соответствующей терапии. Эта впечатляющая смертность легла в концепцию раннего хирургического вмешательства, которое также связано с оперативной смертностью от 15 до 50%, несмотря на прогресс в кардиохирургии, хирургии аорты, а также анестезиологии. В настоящее время, современная концепция управляемой гипотензии и установление индивидуальных стент-графтов может быть более перспективным. Первоначальный опыт работы в Красноярске с поэтапным интервенционным подходом, как представляется, связан с улучшением прогноза.
ТРИГГЕРЫ РАССЛОЕНИЯ АОРТЫ
Аорты и ее варианты возникают в слабых местах интимы в >95% случаев. Первичный разрыв начинается и непосредственно затрагивает внутреннюю стенку аорты, а вторичный разрыв возникает на уровне vasa vasorum с начальным внутренним кровотечением - два инициирующих механизма развития острого аортального синдрома.
Триггерами для инициирования поражения могут быть травмы или повторяющиеся «хронические» микротравмы пульсирующего потока в аорте, особенно при наличии хронической артериальной гипертензии. Кроме того, сама по себе гипертония вызывает высокую жесткость сосудов, и аорта становиться менее эластичной на более высокие стрессы, что делает ее более восприимчивой к пульсовому систолическому давлению. Вместе с медленным, но прогрессивным негативным ремоделированием стенки аорты и в сочетании с ускоренным атеросклерозом, возникает непрерывный износ стенки, ухудшение эластичности, и, как следствие, потеря коллагена и эластина в медиальном слое. Все это представляется процессом, предрасполагающим к последующим острым аортальным синдромам.
Таким образом, любой патологический процесс нарушения целостности эластичных и мышечных компонентов интимы может вызвать расслоение аорты, например, такие как ее кистозный некроз. Фокусной кистозный некроз интимы имеет прямую связь с давностью гипертонии, пожилым возрастом, а в ряде с наследственными заболеваниями соединительной ткани. Наиболее часто встречается синдром Марфана и Элерса–Данлоса, предрасполагающих к возникновению острого аортального синдрома в молодом возрасте. Однако, пик заболеваемости острого аортального синдрома в Красноярске имеется в возрасте между 55 и 75, с явным преобладанием мужчин.
У пациентов моложе 40 лет, распределение аневризм равна между полами, вероятно, вследствие возникновения расслоения аорты у женщин в конце беременности. Среди факторов, предрасполагающих к этому кроме болезней соединительной ткани, нелеченая артериальная гипертензия встречается в 80% острых аортальных синдромов.
Гипертония может не только ослабить медиаинтимальный слой аорты, но ускорить склероз vasa vasorum или питательных интрамуральных сосудов. Пусковая роль артериальной гипертензии подтверждается данными наблюдений. Например, коарктация предрасполагает к острому аортальному синдрому, как и другие сценарии, такие как врожденный двустворчатый, одностворчатый аортальный клапан или приобретенный стеноз аортального клапана (особенно после поздней замены аортального клапана). Острый аортальный синдром также связан с синдромом Тернера или Нунан, и гигантоклеточным артериитом. У молодых женщин, особенно при синдроме Марфана, имеется повышенный риск для расслоения аорты, что может быть вызвано увеличением объема кровяного давления и сердечного выброса в третьем триместре. При этом когда расширен корень аорты, пациенты подвергаются особо высокому риску полной диссекции аорты, и в большинстве случаях был обнаружен диагноз синдрома Марфана.
Ятрогенные поражения связаны с локализованным стрессом стенки аорты, когда возникает интрамуральная гематома или частичный разрыв, как правило, после внутриартериальной катетеризации или установки внутриаортального баллона. Также такая ситуация может начаться в результате прямого механического воздействия и возникнуть в достаточно здоровых участках аорты.
Сосудистые хирурги установили, что естественное течение аневризмы грудной аорты зависит от её размера и расположения. Средний темп роста аневризм для грудной аорты составил 0,1 см в год. Тем не менее, темпы роста были значительно больше при аневризмах нисходящей аорты (0,19 см в год), чем для случаев в восходящей аортой (0,07 см в год). Кроме того, аневризмы грудной аорты с разрывом росли значительно более быстрыми темпами (0,14 см в год), чем те, которые были без разрыва (0,09 см в год). Не удивительно, пациенты с синдромом Марфана также более быстрый рост аневризмы.
В это же время в Красноярске средний уровень разрыва аорты или ее расслоение составил 2% в год для аневризмы грудной аорты менее 5 см в диаметре, 3% в год для аневризм 5,0–5,9 см, а 7% в год для аневризм 6,0 см или больше. Другие исследования сосудистыми хирургами, которые сосредоточены на естественном течении аневризм грудной и торакоабдоминальной аорты установили, что вероятность разрыва увеличивается при хронической обструктивной болезни легких и в пожилом возрасте.

Размер торакальной аневризмы аорты является важным предиктором темпа роста. Мониторинг пациентов с аневризмой грудной аорты обнаружили, что аневризмы, которые были 5,0 см или меньше росли медленнее, чем у тех, размером более 5,0 см, и единственным независимым предиктором быстрого роста (>0,5 см в год) был первоначальный диаметр аорты более 5,0 см. Тем не менее, даже при учете начального размера аневризмы наблюдаются значительные различия. По-прежнему рассматривается индивидуальные темпы роста аневризмы, тем самым делая для данного конкретного пациента.
Истинная заболеваемость острым расслоением аорты трудно определить, так как многие случаи не диагностируются, но документально заболеваемость в Красноярске составляет примерно 2,9 на 100 000 в год. Здоровая аорта с неповрежденным медиальным слоем редко расслаивается. Таким образом, любой патологический процесс или состояние, которое повреждает эластический и мышечный компонент медии аорты предрасполагает к ее расслоению. Действительно, кистозное перерождение медиального слоя, как указывалось выше, является основным предрасполагающим фактором диссекции в дальнейшем.
Пик заболеваемости расслоения аорты приходиться на шестой и седьмой декады жизни, со средним возрастом 62 года (у пациентов мужского пола, имеющие средний возраст 60 лет и пациенток женского пола, средний возраст - 67 лет). В целом, мужчины заболевали в два раза чаще, чем женщины (68% против 32%) и в более раннем возрасте. Однако с возрастом разница уменьшается, и среди тех, кто старше 75, мужчины и женщины с аневризмами аорты представлены в равной степени.
Примерно три четверти пациентов имели в анамнезе историю гипертензии и только 14% знали о наличии аневризмы грудной аорты по данным обследований (УЗИ, рентген, МРТ). Остальные пациенты с предсуществующей аневризмой были просто незамеченными из-за отсутствия клиники до расслоения аорты. Двустворчатый аортальный клапан присутствовал в 3,4% случаев расслоение аорты, то есть ненамного меньше, чем 5% инцидентов, обусловленных синдромом Марфана. Как и в случае с восходящей грудной аорты, риск диссекции аорты, как представляется, быть независимыми от тяжести двустворчатого клапана стеноз. Гораздо реже имеется сочетание расслоения аорты встречается с другими врожденными сердечно-сосудистыми патологиями, в том числе с коарктацией аорты и синдром Тернера.
Факторы риска и проявления аневризм отличаются между младшей и старшей групп пациентов. Лишь 7% больных были моложе 40 лет. Неудивительно, что синдром Марфана является основным фактором риска среди молодых пациентов, и составляет 50% случаев. С другой стороны, этот факт должен быть переосмыслен, чтобы подчеркнуть, что 50% молодых пациентов не имеют в основе аневризмы синдром Марфана как предрасполагающий фактор риска расслоения аорты. Кроме того, артериальная гипертония встречается значительно реже в качестве фактора риска среди молодых пациентов, среди них только 25% были с повышенных давлением.
В течение многих десятилетий, было признано, что существует необъяснимая связь между беременностью и аневризмой аорты, как правило, возникающей в третьем триместре беременности или в раннем послеродовом периоде. В реанимацию попадают лишь 0,2% всех случаев расслоения аорты, связанных с беременностью. Это подразумевает, что есть с беременностью некая причинно-следственная связь. Впрочем, вполне вероятно, что беременность осложняет заболевания аорты среди женщин из-за некоторых подчиненных связей с кистозным медиальным перерождением, как основной причиной патологии аорты.
Сосудистые хирурги считают, что травма также может вызвать расслоение аорты. Тупые травмы, как правило, вызывают локализованные разрывы, гематомы, или истинный разрыв аорты, но довольно редко вызывают классическое расслоение аорты. Чаще ятрогенные травмы связан с истинным расслоением аорты и составляет 5% случаев в отделениях реанимации. Манипуляции катетерами и электродами внутри аорты и вставки баллонов внутриаортального насоса может привести к повреждению интимы аорты и вызвать расслоение аорты. Кроме того, кардиохирургия также влечет за собой очень небольшой риск (0.12–0.16%) острого расслоения аорты, которое, как правило, обнаруживается вовремя и устраняется в отделении сосудистой хирургии интраоперационно. Расслоение аорты происходит чаще как позднее осложнение в кардиохирургии, как правило, возникает через месяцы и годы после операции. Более того, 22% пациентов с острой диссекцией аорты имели проблемную историю до кардиохирургии, 9% имели существовавшие ранее заболевания аорты (до торакоабдоминальной аневризмы аорты или расслоения), у 5% были проблемы до замены аортального клапана. Ассоциация расслоения аорты с заменой аортального клапана может свидетельствовать о том, что основной неблагополучия был двустворчатый аортальный клапан и таким образом, вероятно, имела место кистозная медиальная дегенерация.
Данные исследований в сосудистой хирургии свидетельствуют о том, что есть модели хронобиологический острого расслоения аорты. Существует суточное колебание в наступлении расслоения аорты, которое возникает наиболее часто в первые дневные часы от 6 часов утра до полудня и наименее часто в ночные часы от полуночи до 6 часов утра. Этот циркадный паттерн аналогичен для всех подгрупп обследованных и предполагает, что существует вероятность общих триггеров. Интерес представляет тот факт, что эта картина аналогична той, что врачи наблюдали с начала развития острого коронарного синдрома. Есть также сезонные колебания заболеваемости аорты, с существенно более высокими показателями аорты в зимние месяцы, в то время как скорость событий была низкой в летние месяцы.
УЗИ аорты брюшной полости при аневризме нередкая ситуация. Пациент, который приходит в кабинет УЗИ с классической болью в животе с иррадиацией в спину, при гипотонии и пульсирующим образованием в брюшной полости, не является дилеммой диагностики. Ультразвуковое сканирование может быстро отделить диагноз расслоения аорты у пациентов пожилого возраста с неопределенными жалобами животе. Особенно это важно у пожилого пациента с похожими симптомами, которые имитируют нефролитиаз. Если подозревают расслоение, то метод эхографии брюшной аорты сопоставим с контрастной КТ, хотя, как правило, последний более точен, чем УЗИ, так как по всей длине аорты могут быть наглядно получены изображения в считанные минуты без помех от кишечного газа. Ультразвуковая диагностика может выявить аневризмы брюшной аорты в отношении почечных сосудов, что очень важно, поскольку в случае возникновения диссекции, расширение может распространяться на почечные артерии. Напомним, что аорта и подвздошные артерии измеряются от внешнего края стенки на одной стороне, до внешнего поля на другой стенке. Это измерение следует проводить в двух плоскостях, поперечной и продольной. Большинство аневризм происходят на уровне пупка, на стыке бифуркации и может переходить на подвздошные сосуды.

Аневризма может расшириться в поперечном или продольном диаметре. Точность УЗИ обследования может быть снижена при ожирении, помех от газа из кишечника, или крайней болезненности живота. Врач проводя сканирование внутренних органов должен знать несколько подводных камней при сканировании брюшной аорты. Если кишечные газы препятствуют адекватной визуализации аорты на передней брюшной стенке, то датчик может быть направлен от боковой брюшной стенки, или воспользоваться помощью печени или селезенки в качестве акустического окна для визуализации аорты и нижней полой вены. Кроме того, пациент может быть развернут лежа набок.
Истинный диаметр аорты должен быть измерен с помощью датчика, который расположен перпендикулярно к сосуду, если это сделать в косой или угловой позиции, то она будет преувеличивать истинный диаметр аорты. Кроме того, надо понимать, что даже небольшая аневризма, не исключает разрыва. Врач на УЗИ должен также оценить наличие интраперитонеальной жидкости при обследовании пациента с острой аневризмой аорты брюшной полости. Иногда парааортальные узлы можно спутать с аортой, когда они имитируют аневризмы. Эти узлы часто находятся кпереди от аорты, но они могут быть найдены также на задней стенке, обкладывая аорту и вытесняя ее вверх или в сторону от тела позвонков. Узлы имеют неправильную форму без просвета и сосудистого потока при цветном картировании.
УЗИ ПРИ РАССЛОЕНИЕ АОРТЫ БРЮШНОЙ ПОЛОСТИ
Расслаивающая аневризма аорты - это состояние, когда имеется распространяющаяся интрамуральная гематома фактически рассекает ее по всей длине, с отхождением интимы и, в отдельных эпизодах, часть среднего слоя - медии. Как следствие при расслоении аорты образуется дефект или разрыв в интиме аорты сопутствует слабости аортальной стенки. В этот момент кровь скачкообразно идет под медиальный слой, разделяя интиму от адвентицию. Этот канал называется «ложным просветом». Часть крови в ложном просвете прорвать стенку и сообщиться с истинным просветом в любом месте по ходу диссекции, образовав фенестрацию. Большинство типов расслоения аорты будет происходить по одному из трех видов:
- расслоение начинается в корне аорты с возможным продлением на дугу, нисходящую аорту и брюшную аорту;
- на уровне левой подключичной артерии, с расширением в нисходящую часть аорты или брюшную аорту; и
- только на уровне восходящей аорты.
Около 70% диссекций на эхографии находятся в восходящей аорте, от 10% до 20% в дуги аорты, а 20% - в брюшной аорте. Чаще всего, разрыв стенки будет распространяться дистально в аорте, до подвздошных сосудов, хотя расширение в проксимальном направлении также может произойти.
Артериальная гипертензия почти всегда связано с расслоением аорты. Возраст большинства пациентов колеблется от 50 до 70 лет, с более высокой распространенностью у мужчин, чем женщин. В возрасте до 40 лет, заболеваемость у мужчин и женщин равна. У женщин, по данным УЗИ, 50% расслоений происходят во время беременности (гормональный дисбаланс, связанная с беременностью гипертония, склероз и некроз медиального слоя и vasa vasorum все вместе вносят свой вклад.) Без лечения, расслаивающая аорты может привести к смерти, если она затрудняет приток крови к мозгу или разрыв настолько велик, что объемы кровопотери происходят катастрофически стремительно.
Клинические данные за расслоение аорты перед проведением УЗИ
Наиболее типичным проявлением является внезапное начало тяжелых, разрывающих болей в груди с иррадиацией в руки, шею, или спину. Обморок возникает у небольшого процента пациентов. Сложность симптоматики будет зависеть от размера расширения, расслоения, конкретных участков аорты и расположение внешнего разрыва, если это присутствует. Если поражены сонные артерии, то это может привести к гемиплегии. При участии подключичных и подвздошных сосудов появляется снижение или отсутствие пульса в руке или ноге.
Местоположение боли может быть подсказкой о месте расслоения. Если болевые центры в переднем отделе грудной клетки, то обычно присутствует проксимальное расслоение, а сильные боли в межлопаточной области чаще происходят с вовлечением дистальных отделов аорты. Однако, большинство пациентов с дистальной диссекцией аорты имеют боли в спине. Окклюзия висцеральных артерий может проявляться болью в животе.
Результаты ультразвукового исследования брюшного отдела аорты. При острой аортальной диссекции, время имеет существенное значение и, следовательно, магнитно-резонансная томография (МРТ) и контрастная КТ для оценки аортальной диссекции не всегда применимы. В стабилизированном пациента с подозрением на диссекцию, УЗИ может быть легко выполнено. При этом необходимо проводить как эхокардиографию, так и ультразвуковую диагностику брюшной аорты. Размер аорты может быть несколько увеличены, но это еще не обязательно расслаивающая аневризма. На ультразвуковом исследовании классическими признаками при визуализации, является нахождение лоскута на месте расслоения. Эхогенная мембрана интимы в аорте или подвздошных артериях может быть видна, и она свободно может двигаться с артериальной пульсацией на УЗИ, если истинный и ложный просвет проходимы. Однако, если мембрана толстая или просвет тромбирован, то она может не двигаться.
Цветовое допплеровское картирование может продемонстрировать медленный поток в обе стороны от истинного к ложному просвету. Поток по скорости меньше или идет ретроградно в ложном просвете. Врач УЗИ должен искать наличие мембраны интимы с сопутствующими тромбами в подвздошных, почечных и верхней брыжеечной артериях.
При псевдодиссекции на цветном допплере демонстрируется турбулентный поток крови, что указывает на наличие гипоэхогенного тромба вблизи внешнего края аорты с его эхогенным слоистым строением. При это при псевдоаневризме не видно лоскута интимы.
Читайте также:

