Интести бактериофаг при прыщах
Обновлено: 18.04.2024
Московский научно-практический Центр дерматовенерологии и косметологии Департамента здравоохранения, Москва
Поливалентные бактериофаги: перспективы применения в дерматологии
Журнал: Клиническая дерматология и венерология. 2015;14(1): 79‑84
Московский научно-практический Центр дерматовенерологии и косметологии Департамента здравоохранения, Москва
На сегодняшний день одной из актуальных проблем современной медицинской науки является антибиотикорезистентность микроорганизмов. Данное обстоятельство обусловливает рецидивирующее течение пиодермий, торпидность к традиционно применяемым препаратам. В тоже время повышенная вирулентность микроорганизмов в совокупности с нарушением барьерной функции кожи, которая отмечается при ряде распространенных хронических дерматозов (например, при атопическом дерматите), создает условия для вторичного инфицирования очагов поражения, что приводит к развитию «порочного» круга и хронизации процесса. Таким образом, расширение арсенала средств, обладающих антибактериальным действием в отношении патогенных бактерий, имеющих этиологическое значение как при пиодермиях, так и при вторично инфицированных дерматозах, является весьма актуальным. К таким альтернативным препаратам относятся бактериофаги. Статья носит обзорный характер и содержит основные сведения об эффективности применения поливалентных бактериофагов в клинической практике.
Московский научно-практический Центр дерматовенерологии и косметологии Департамента здравоохранения, Москва
На сегодняшний день одной из актуальных проблем современной медицинской науки является антибиотикорезистентность патогенных микроорганизмов. Данное обстоятельство обусловливает рецидивирующее течение пиодермий, торпидность к традиционно применяемым препаратам. В тоже время повышенная вирулентность микроорганизмов в совокупности с нарушением барьерной функции кожи, которая отмечается при ряде распространенных хронических дерматозов (например, при атопическом дерматите), создает условия для вторичного инфицирования очагов поражения, что приводит к развитию «порочного» круга и к хронизации процесса. Таким образом, расширение арсенала средств, обладающих антибактериальным действием в отношении патогенных бактерий, имеющих этиологическое значение как при пиодермиях, так и при вторично инфицированных дерматозах, является весьма актуальным. К таким альтернативным препаратам относятся бактериофаги.
К основным условиям, необходимым для развития пиодермии и вторичного инфицирования очагов хронических дерматозов, относят наличие «входных ворот» (нарушение барьерной функции кожи), снижение иммунной реактивности и неспецифической резистентности человека и достаточную вирулентность самого возбудителя.
Барьерная функция кожи обеспечивается множеством факторов: прежде всего, механическая защита рогового и зернистого слоев, кислая рН 5,5 на поверхности кожи, антибактериальные свойства кожного сала, антибиотические свойства нормальной микрофлоры, факторы врожденного и адаптивного иммунитета. Нарушения в любом из перечисленных звеньев могут приводить к развитию инфекций кожи.
Еще одним предиктором возникновения пиодермий и контаминации патологическими бактериями очагов при воспалительных заболеваниях кожи является нарушение локального и/или общего иммунитета. В случаях с пиодермиями превалируют нарушения в системе адаптивного иммунитета, в большей степени обусловленные наличием сопутствующей соматической патологии (сахарный диабет, метаболический синдром, эндокринопатии, иммунодефицитные состояния и др.). Присоединение вторичной инфекции при дерматозах в основном обусловлено нарушениями во врожденном иммунитете самой кожи, а иммуноопосредованное воспаление вызывает нарушения барьерной функции кожи.
Однако одним из основных предикторов развития бактериальной инфекции все-таки является вирулентность бактерий, которая обеспечивается следующими факторами:
1. наличие микрокапсулы, которая защищает бактерии от поглощения фагоцитами;
2. компоненты клеточной стенки, которые стимулируют развитие воспалительных реакций, усиливают синтез ИЛ-1 макрофагами, активируют систему комлемента и являются мощными хемоаттрактантами для нейтрофилов;
3. ферменты, вырабатываемые бактериями, которые разрушают молекулы β-лактамных антибиотиков, облегчают адгезию и проникновение микроорганизмов в ткани.
В развитии гнойничковых болезней кожи ведущая роль принадлежит стафилококкам и стрептококкам, хотя и другие микроорганизмы могут быть причиной гнойного процесса: Staphylococcus aureus встречается в 85—90%; Streptococcus pyogenes (группы A, C, G) — в 10%; St. epidermidis в 5%. Этиологическую значимость в развитии вторичного инфицирования при экземе, атопическом дерматите и дерматофитозах прежде всего имеет золотистый стафилококк или/и стрептококки группы А, а при хронических язвах (варикозные, травматические) — Escherichia сoli, Proteus, Pseudomonas, Bacteroides, Clostridium perfringens (см. рисунок).

Основные возбудители пиодермий.
Принципы терапии инфекционных (бактериальных) заболеваний кожи включают использование комплексных методов этиопатогенетической терапии прежде всего направленных на элиминацию возбудителя. При этом основными препаратами по-прежнему остаются антибиотики, спектр эффективных препаратов которых имеет тенденцию к уменьшению, что связано с глобальным ростом устойчивости микроорганизмов к антибактериальным препаратам [1]. Данная проблема обозначена ВОЗ как актуальнейшая, поскольку может привести к тому, что большинство инфекционных болезней могут выйти из-под контроля [2, 4—6].
Основными причинами развития антибиотикорезистентности бактерий являются:
— отсутствие структуры, на которую действует антибиотик (например, бактерии рода микоплазма нечувствительны к пенициллину, так как не имеют клеточной стенки);
— непроницаемость для антибиотика (большинство грамотрицательных бактерий невосприимчивы к пенициллину G, поскольку клеточная стенка защищена дополнительной мембраной);
— способность микроорганизма переводить антибиотик в неактивную форму (многие стафилококки содержат фермент β-лактамазу, который разрушает β-лактамное кольцо большинства пенициллинов);
— генные мутации, в результате которых обмен веществ микроорганизма изменен таким образом, что блокируемые антибиотиком реакции больше не являются критичными для жизнедеятельности микроорганизма;
— способность микроорганизма «выкачивать» антибиотик из клетки.
На сегодняшний день уже сформировалась устойчивость к ряду антибиотиков у таких возбудителей инфекций кожи, как Staphylococcus aureus (MRSA — метициллин-резистентный S. aureus), Escherichia coli и Klebsiella pneumoniae, продуцирующие β-лактамазы широкого и расширенного спектра, Pseudomonas aeruginosa и Acinetobacter baumannii, резистентные к карбапенемам, Enterococcus faecium и Enterococcus faecalis (VRE — ванкомицин-резистентные энтерококки) и ряда других микроорганизмов [2].
В связи с этим одной из первостепенных задач современной медицинской науки является разработка и применение дополнительных средств борьбы с патогенными бактериальными микроорганизмами, в качестве которых могут выступать бактериофаги.
Бактериофаг — «пожиратель бактерий» (phagos — «пожираю», греч.) — относится к группе вирусов, который избирательно поглощает бактерии. В природе бактериофаги широко распространены и являются естественными ограничителями распространения бактерий, при этом фагам характерна высокая специфичность в отношении определенного рода бактерий. Несмотря на то что история активного изучения эффективности фагов в терапии бактериальных инфекций восходит к началу ХХ века, после широкого внедрения в клиническую практику антибиотиков в силу их большей эффективности на тот момент интерес к фагам несколько ослабел, и они отошли на второй план. Однако сегодня в свете проблемы антибиотикорезистентности интерес к ним вновь возрастает.
Необходимо отметить, что применение бактериофагов, как и любых других антибактериальных препаратов, должно основываться на принципах доказательной медицины. Основным условием эффективности бактериофагов должна быть их достаточно высокая вирулентность в отношении этиологически значимых бактерий. Таким образом, бактериофаги в лабораторных условиях проходят проверку на предмет достаточности их литической активности, после чего они могут быть рекомендованы к применению в клинической практике [3, 7—9].
Для того, чтобы бактериофаг мог быть рекомендован для применения в клинической практике, необходимо, его соответствие следующим параметрам:
— высокая вирулентность, обусловливающая полный лизис бактерий;
— сохранение активности в клетке-хозяине;
— возможность длительного хранения с сохранением литической активности;
— отсутствие активности в отношении представителей резидентной микробиоты.
Взаимодействие фага с клеткой-мишенью протекает в несколько этапов и заканчивается лизисом бактериальной клетки, репродукцией новых полноценных фагов и выбросом их в окружающую среду. Поэтому очень важно, чтобы лизис был полным (завершенным), а данный аспект могут обеспечить только высоковирулентные бактериофаги.
Недостаточная лизирующая активность фагов может приводить к появлению у бактерий генов вирулентности, что, например, в случаях с госпитальной инфекцией способствует эпидемическому распространению инфекции клональных линий бактерий. Поэтому применение невирулентных или умеренно вирулентных бактериофагов недопустимо, а при использовании фагов в лечебных целях необходим микробиологический контроль.
Существуют определенные правила применения бактериофагов на практике. Перед назначением препарата необходимо провести оценку спектра и степени его вирулентности для решения вопроса о чувствительности к нему возбудителя, так как в ряде случаев может отмечаться литическая инертность фагов, которая может быть связана с узким спектром литической активности самого бактериофага или с атипичными свойствами бактериальной культуры. По результатам бактериологического исследования делают вывод о наличии или отсутствии чувствительности определенного микроорганизма, выделенного из биоматериала конкретного пациента к данному бактериофагу.
Современные препараты бактериофагов представляют собой комплекс поликлональных высоковирулентных бактериальных вирусов, специально подобранных против наиболее часто встречающихся групп возбудителей бактериальных инфекций. Бактериофаги выпускаются в форме таблеток, растворов, гелей. Многочисленные исследования доказали сопоставимую, а в ряде случаев даже превосходящую антибиотики эффективность фагов в отношении инфекций, вызванных антибиотикорезистентными возбудителями, при этом бактериофаги не вызывают побочных токсических и аллергических реакций и не имеют противопоказаний [10—12]. Помимо антибактериального эффекта, бактериофаги повышают адаптивные возможности организма, положительно влияя на факторы специфического и неспецифического иммунитета, что может быть особенно ценно при лечение иммуноопосредованных воспалительных заболеваний кожи, осложненных вторичной инфекцией. Немаловажным является быстрота их действия и глубина проникновения, что является отличительной чертой фагов [13].
Сегодня препараты бактериофагов в виде моно- и комбинированных препаратов в России производят два предприятия: ФГУП НПО «Микроген» Минздрава России (жидкие и таблетированные формы) и ООО НПЦ «МикроМир» (гели).
Одним из первых комбинированных лечебно-профилактических препаратов бактериофагов, появившихся в арсенале врачей, является «Пиобактериофаг поливалентный» (производство НПО «Микроген»). Высокая терапевтическая и профилактическая эффективность пиобактериофага доказана в многочисленных клинических исследованиях. Так, в работе И.Н. Хайруллина и соавт. сообщается об успешном применении в хирургической практике пиобактериофага у пациентов с инфекцией в области хирургического вмешательства, когда применение фага сократило сроки заживления раневого дефекта более чем в 2 раза [14]. По данным Л.П. Зуевой и соавт. [15], пиобактериофаг вызывает не только высокий терапевтический эффект в отношении бактериальных инфекций, но и обладает профилактическим потенциалом, что было показано на примере частоты внутрибольничных заражений синегнойной инфекцией, которая снизилась в 5 раз.
Как было описано выше, одним из факторов развития антибиотикорезистентности является формирование бактериями биопленок. Имеются данные о разрушающем действии фагов на биопленку, что может быть еще одним предиктором эффективности комбинированных методик с применением бактериофагов [16, 17].
Безусловно, рациональные схемы лечения пиодермий и вторично инфицированных дерматозов, а также профилактики рецидивирования процесса должны включать методы специфической антибактериальной направленности с использованием препаратов, действие которых направлено на подавление патогенных микроорганизмов и восстановление нормальной микробиоты кожи [18, 19]. В дерматологии наиболее перспективными и востребованными в силу этиологической значимости данных возбудителей являются бактериофаги, активные в отношении стафилококков и стрептококков. К таким бактериофагам относится Секстафаг (пиобактериофаг поливалентный) (ФГУП «НПО «Микроген» Минздрава России). Данный препарат представляет собой стерильный фильтрат фаголизатов бактерий Staphylococcus, Streptococcus, Proteus (P. vulgaris, P. mirabilis), Pseudomonas aeruginosa, энтеропатогенных Escherichia coli, Klebsiella pneumoniae.
Секстафаг показан для лечения различных клинических разновидностей пиодермий, в том числе глубоких, так как для него характерны глубокое проникновение и высокая биодоступность. Секстафаг может применяться в комплексе лечебных мероприятий или в виде монотерапии, например, при единичных элементах поверхностных пиодермий. Немаловажным преимуществом пиобактериофага является возможность его назначения per os и наружно, что, безусловно, способствует повышению терапевтической эффективности за счет общего воздействия на состояние микробиоты организма. Местно препарат может использоваться в виде орошения, примочек. При глубоких пиодермиях бактериофаг пункционно вводят в полость очага после удаления гноя, при этом необходимо помнить, что количество вводимого препарата должно быть несколько меньше объема удаленного гноя.
Профилактическое использование препарата Секстафаг показано пациентам с рецидивирующим течением пиодермии, что наиболее характерно для больных со сниженной иммунной реактивностью (сахарный диабет, метаболический синдром, эндокринопатии).
В отношении воспалительных заболеваний кожи, когда контаминация патологическими бактериями не только осложняет течение дерматоза, но и может быть одним из патогенетических звеньев, применение поливалентного бактериофага показано с различных позиций. Классический пример: атопический дерматит, при котором в развитии и поддержании хронического воспалительного процесса в коже немаловажную роль играет S. аureus и его токсины, выступающие в роли суперантигенов, поэтому лизирование данных бактерий приводит к клинической ремиссии. Таким образом, при хронических дерматозах, осложненных вторичной инфекцией, целесообразность применения поливалентного пиобактериофага обусловлена патогенетической направленностью действия препарата, а отсутствие противопоказаний и побочных эффектов позволяют рекомендовать его пациентам детского возраста и беременным, что особенно важно, когда арсенал терапевтических средств крайне ограничен.
При пиодермиях (особенно при хроническом течении заболеваний) особое значение имеет профилактическое применения бактериофагов, возможность наружного использования, что открывает широкие перспективы для дерматологической практики. Гель для наружного применения Фагодерм (ООО НПЦ «МикроМир») позволяет проводить профилактику бактериофагами. Гель содержит комплекс, состоящий из 47 видов вирулентных бактериофагов, отличающихся по морфологической структуре и рецепторной специфичности, активных в отношении подавляющего большинства патогенных и условно-патогенных микроорганизмов, вызывающих бактериальные инфекции кожи, при этом для Фагодерма характерна толерантность в отношении резистентной микрофлоры биоты кожи. Уже имеются данные об эффективности его применения в дерматологии при бактериальных инфекциях кожи [20, 21].
Результаты клинических испытаний Фагодерма показали выраженное противовоспалительное и ранозаживляющее действие геля. Применение геля при акне способствовало элиминации патогенов на обрабатываемой поверхности [21], санации очага воспаления от патогенов в 45% случаев, снижению количества возбудителей до уровня нормофлоры кожи в 55% случаев [20].
Гель Фагодерм особенно эффективен в качестве профилактического средства у пациентов с рецидивирующим течением пиодермий, а также для профилактики инфицирования очагов при хронических дерматозах, после различных косметологических и хирургических манипуляций, когда существует риск контаминации патогенными бактериями.
Таким образом, сегодня одним из перспективных направлений современной дерматовенерологии можно считать применение системных и топических бактериофагов, что определяет актуальность данной терапии как при пиодермиях, так и при вторично инфицированных дерматозах. Высокая эффективность препаратов, патогенетическая направленность, отсутствие токсичности и побочных эффектов предопределяют целесообразность применения данных средств в комплексном лечении больных пиодермиями и хроническими дерматозами, при которых контаминация патогенными микроорганизмами является патогенетически значимой.

17.10.2019
На протяжении многих десятков лет антибиотики спасают человечество, однако существует мнение, что их эра подходит к концу. Причиной тому стало легкомыслие людей. Многие пациенты — как правило, это успешные карьеристы, профессионалы, у которых нет времени на посещение врача — практикуют самостоятельный прием препаратов. В результате все большее количество инфекций приобретает устойчивость к воздействию антибиотиков, снижается действенность и эффективность этих препаратов. Рекомендации Всемирной организации здравоохранения - строго контролировать прием антибиотиков, во всех случаях, где это возможно, искать им альтернативу. В настоящее время эффективным альтернативным заменителем антибиотиков считаются бактериофаги.
Бактериофаг — это вирус, который размножается в живых клетках хозяина. Он состоит из ДНК и белковой оболочки. Важное преимущество бактериофагов перед антибиотиками в том, что они не нарушают нормальную микрофлору организма. Это возможно за счет целевого воздействия: бактериофаги присоединяются лишь к одному типу микробов.
ДНК фага размножается, проникая внутрь болезнетворной клетки, далее разрывает оболочку клетки-хозяина и поражает микробы. Бактериофаги часто используют в комплексной антибактериальной терапии. Если нет смертельной угрозы для пациента, этому альтернативному средству борьбы с болезнями отдается предпочтение. В настоящее время создано многообразие фагов, выпущено большое количество лекарственных форм — свечи, аэрозоли, растворы, таблетки и пр.
Бактериофаги используют во многих сферах медицины:
- гинекологии;
- хирургии;
- отоларингологии;
- гастроэнтерологии;
- пульмонологии;
- урологии.
В зависимости от возбудителя болезней и вида заболевания назначается определенный медикамент.
Преимущества бактериофагов перед антибиотиками:
- не вызывают привыкания и не угнетают иммунитет человека;
- совместимы со всеми лекарственными препаратами, в том числе с антибиотиками (бактериофаги усиливают их действие);
- не вызывают резистентности у бактериальных культур;
- эффективны в лечении малочувствительных к антибиотикам вялотекущих бактериальных инфекций;
- избирательно воздействуют, не уничтожают полезную бактериальную микрофлору;
- не имеют противопоказаний.
В то же время использовать бактериофаги самостоятельно, без назначения и наблюдения специалиста может быть не менее опасно, чем антибиотики. Ведь для того, чтобы выявить возбудителя болезни и понять, насколько он чувствителен к фагам, требуется специальное исследование.
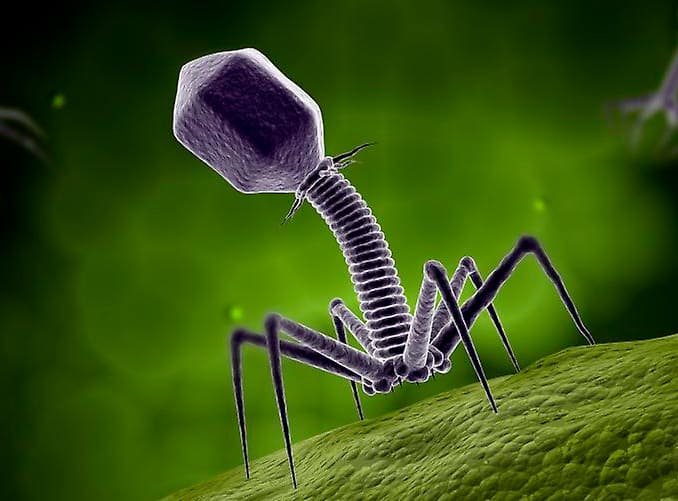
Однако бактериофаги используют не только в лечении, но и в профилактике заболеваний бактериальной природы, например, вызванных:
- гемолитической кишечной палочкой;
- стафилококком, стрептококком, энтерококком;
- синегнойной палочкой;
- протеем и т.д.;
На протяжении длительного времени бактериофаги успешно используются при лечении:
- гнойно-воспалительных заболеваний полости рта и околозубных тканей;
- заболеваний ЛОР-органов;
- дисбактериоза у взрослых и детей;
- при пиодермии кожных покровов, укусах насекомых и животных, раневых инфекциях;
- бактериальных заболеваний мочеполовой системы.
Также их используют для профилактики в случае осложнений бактериального характера при ОРЗ, гриппе. При раннем выявлении возбудителя, при грамотно назначенной профилактике эффективность фаговых препаратов наибольшая.
Несмотря на все плюсы, вряд ли можно предположить, что бактериофаги способны полностью исключить использование антибиотиков на данном этапе развития науки и медицины. Оба этих препарата применяются в разных ситуациях и, скорее, дополняют друг друга. Как и в случае с антибиотиками, важно следить за тем, чтобы их использование не вышло из-под контроля специалистов. Только так они останутся важным подспорьем в борьбе с инфекциями.
Алешкин А. В. Бактериофаги в инфекционной патологии: прошлое, настоящее и будущее // Лекции по исследованию и применению бактериофагов. 2016. Ульяновск. С. 11—51.
Бактериофаги: биология и применение. 2012. М: «Научный мир». Ред.: Э. Каттер и А. Сулаквелидзе.Górski A. et al. Phages targeting infected tissues: novel approach to phage therapy. // Future Microbiol. 2015. V. 10. P. 199—204.
Międzybrodzki R. et al. Clinical aspects of phage therapy // Adv. Virus. Res. 2012. V. 83. P. 73—121.
Отоларинголог, врач высшей категории, к.м.н. директор «СМЦ» Катеринчева Ольга Александровна
Заболевания ЛОР-органов отличаются значительной распространенностью и активной ролью в формировании многочисленных, порой тяжелых, осложнений.
Высокая частота этих заболеваний во многом связана с острой респираторной инфекцией (ОРИ), занимающей ведущее место в структуре современной патологии человека. По самым скромным подсчетам, ежегодно в мире регистрируется до 10 млрд заболевших ОРИ, а в России — от 27,3 до 41,2 млн человек [1]. Острые респираторные заболевания составляют почти 90% всех инфекционных болезней [2].
Этиологически значимыми возбудителями ОРИ, кроме вирусов, являются стрептококки, стафилококки, гемофильная палочка и другие микроорганизмы [3].
Наряду с типичными и хорошо известными неспецифическими признаками инфекционного заболевания — недомоганием, повышением температуры тела, головной болью, ОРИ проявляется и симптомами, характерными для поражения начальных отделов респираторного тракта и уха.
Одними из наиболее частых заболеваний, ассоциированных с ОРИ, являются воспалительные изменения слизистой оболочки носа (острый ринит) и околоносовых пазух (острый синусит, риносинусит), которые регистрируются у 5—10% больных с ОРИ и входят в десятку наиболее часто встречающихся в амбулаторной практике заболеваний. Риносинусит отличается склонностью к рецидивам и в 10—15% случаев приобретает хроническое течение [4, 5].
Другим не менее частым заболеванием, связанным с ОРИ, является острый тонзиллофарингит (ОТФ), по поводу которого за медицинской помощью ежегодно обращается примерно 10% населения развитых стран [6]. Среди бактериальных возбудителей ОТФ наиболее значимым является бета-гемолитический стрептококк группы, А (БГСА), вызывающий до 30% случаев ОТФ у детей в возрасте 5—15 лет. Реже возникновение ОТФ связано со стрептококками других серологических групп, а также Mycoplasma pneumoniae, Chlamydia pneumoniae, Arcanobacterium hаemolyticum, Haemophilus influenzae, Moraxella catarrhalis и др. [7].
Клиническими проявлениями стрептококкового ОТФ являются воспаление небных миндалин, шейный лимфаденит, лихорадка и отсутствие кашля. Наличие у пациента всех четырех симптомов или трех симптомов и положительного теста на БГСА рассматривается в качестве основания для антибактериальной терапии. Для вирусного фарингита, кроме изменений в глотке, характерны так называемые респираторные симптомы — ринит, дисфония, кашель. Прием антибиотиков в этих случаях, как правило, неэффективен.
Нередко на фоне ОРИ развивается воспаление наружного и/или среднего уха. Удельный вес наружного отита (НО) в структуре обращаемости составляет около 12% [8]. Наиболее распространенными патогенами при бактериальном, НО являются Pseudomonas aeruginosa (50—70%), Staphylococcus aureus (10%), Staphylococcus epidermidis (8—10%), бета-гемолитический стрептококк (5%) [9].
Еще одним частым осложнением инфекции верхних дыхательных путей является острый средний отит (ОСО), занимающий лидирующее положение в структуре современной патологии, в особенности детского возраста. Например, к 3-летнему возрасту 83% детей переносят хотя бы 1 эпизод ОСО, а у 46% — диагностируется 3 и более случаев этого заболевания [10].
Таким образом, актуальность проблемы ОРИ обусловлена, с одной стороны, значительной распространенностью и высокой вероятностью их осложненного течения, а с другой — быстрым формированием на этом фоне бактериально-ассоциированных заболеваний верхних дыхательных путей, в первую очередь острого риносинусита, ОТФ и острого отита.
В практическом отношении поставить этиологически правильный диагноз, т. е. дифференцировать конкретные нозологические формы в зависимости от возбудителя, учитывая только клинические признаки заболевания, крайне сложно. Это обстоятельство нередко является источником ошибочного применения антибактериальных препаратов, до 75% которых, по данным экспертов ВОЗ, используются нерационально [11]. Достаточно яркой иллюстрацией необоснованного применения антибиотиков является их назначение 95% пациентов с симптомами ОТФ [12]. В определенной степени это подтверждается и данными многоцентрового исследования, проведенного в России, — у 95% пациентов боль в горле являлась основанием для назначения антибиотиков [13]. В США этот показатель составил 73% [14].
Очевидно, что эффективное лечение бактериально-ассоциированной патологии ЛОР-органов зачастую невозможно без адекватной антибиотикотерапии. Вместе с тем четкие дифференциально-диагностические критерии, позволяющие с высокой степенью достоверности говорить о наличии вирусной или бактериальной инфекции, например, при остром риносинусите, за исключением культурального исследования аспирата из синуса, отсутствуют. Как правило, в качестве основного признака бактериальной этиологии синусита рассматривается временнoй фактор — сохранение или прогрессирование симптомов заболевания на протяжении 5—7 дней. В связи с этим современные клинические рекомендации и согласительные документы экспертов, представляющих различные медицинские специальности, отмечают важность исключения антибактериальных средств из протоколов лечения неосложненного острого риносинусита в течение первых 5—7 дней развития заболевания, поскольку назначение антибиотиков, как известно, не оказывает влияния на течение и исход вирусной инфекции, а нерациональное применение антибактериальных препаратов способствует быстрой селекции резистентных штаммов этиологически значимых возбудителей инфекционной патологии ЛОР-органов [15, 16].
Следует отметить, что значительные изменения в профиле микробной резистентности отмечаются у наиболее вероятных возбудителей острых заболеваний ЛОР-органов, в частности S. pneumoniae. Устойчивость пневмококков, например, к b-лактамным антибиотикам связана с изменением пенициллинсвязывающих белков, которые являются ферментами, обеспечивающими строительство клеточной стенки бактерий. В то же время пенициллинрезистентные пневмококки часто демонстрируют одновременную устойчивость к макролидам, ко-тримоксазолу, тетрациклинам и в отдельных случаях — к цефалоспоринам III поколения (цефотаксиму, цефтриаксону). Отмечено, что за период с 1994 по 1999 г. резистентность пневмококков к макролидам в США выросла почти в три раза. Рост устойчивости пневмококков к макролидам объясняют, в первую очередь, наличием гена mefE, обусловливающего эффлюкс (активное выведение) макролидов из клетки. В 4 исследованиях, опубликованных в 90-х годах, показано, что более 30% штаммов S. pneumoniaе отличались умеренной устойчивостью к пенициллину по сравнению с 0,02% в период с 1979 по 1987 г. [17]. Схожая ситуация наблюдается и в отношении распространенности антибиотикорезистентных штаммов H. influenzae и M. catarralis [15, 18, 19]. Перечисленные обстоятельства крайне отрицательно сказываются на эффективности антибактериального лечения воспалительных заболеваний ЛОР-органов.
Как известно, механизм действия бактериофагов заключается в их проникновении в бактериальные клетки и взаимодействии с геномом, что приводит, в зависимости от природы фага, к лизогенному или литическому эффекту. При литическом действии бактериофаги начинают размножаться и разрушать бактериальную клетку, а при лизогенном геном фага интегрируется в бактериальный геном и передается из поколения в поколение. При этом в некотором количестве клеток периодически синтезируются вирионы, лизирующие эти клетки и выходящие затем во внешнюю среду. Такие фаги называются умеренными, а фаги, вызывающие литический эффект, — вирулентными [21]. Именно вирулентные бактериофаги используются в лечении и профилактике. Определенные перспективы в повышении эффективности лечения хронического отита связываются с применением поливалентного препарата бактериофагов, предназначенного для воздействия на антибиотикорезистентные штаммы P. aeruginosa [22], интраназальных форм (мази и капли) бактериофагов для профилактики и лечения внутригоспитальных инфекций, вызываемых метициллин-резистентными S. aureus (MRSA) [23].
Получены обнадеживающие результаты изучения активности муреиновой гидролазы (лизина), которая продуцируется стрептококковым бактериофагом С (1), в отношении стрептококков групп А, С и Е. В иследованиях на экспериментальных животных показано, что лизин (муреиновая гидролаза) оказывает летальное действие на стрептококки группы, А in vitro и in vivo без воздействия на другие микроорганизмы. В частности, 1000 единиц (10 нг) этого фермента было достаточно для эрадикации 10 7 стрептококков в течение 5 с. При введении лизина орально в дозе 500 ЕД мышам с высокой степенью колонизации ротоглотки стрептококками, микроорганизмы не обнаруживались уже через 2 ч после начала лечения лизином [24]. Авторы полагают, что применение лизина может быть использовано для элиминации и снижения количества бактерий, колонизирующих слизистую оболочку верхних дыхательных путей как при клинически выраженном заболевании, так и при носительстве, способствуя снижению заболеваемости стрептококковыми инфекциями. Однако бактериофаги обладают более высокой специфичностью действия.
В нашей стране бактериофаги для лечения и профилактики различных инфекций производятся ФГУП «НПО «Микроген» Минздрава России с 40-х годов XX столетия. Областью их применения традиционно являются гнойно-инфекционные заболевания различной локализации [20].
Результаты клинического исследования свидетельствуют о положительном влиянии фаготерапии на клинические проявления хронического тонзиллита и высеваемость S. аureus с поверхности небных миндалин [25]. В частности, на фоне монотерапии стафилококковым бактериофагом у больных, имевших до лечения скудный рост золотистого стафилококка, после применения бактериофага S. аureus не выделялся в течение 1 мес. У 8 пациентов с умеренным ростом на следующий день после окончания фаготерапии наблюдался очень скудный и скудный рост стафилококка у 4 обследованных; у остальных 4 пациентов сохранился умеренный характер роста. В дальнейшем S. aureus не высевался у 2 пациентов через 10 и 30 дней после фаготерапии. Умеренный рост на протяжении всего времени наблюдения сохранился у 1 обследованного. Однако в этом случае, как и у всех пациентов этой группы, по окончании фаготерапии отсутствовали жалобы на боли и дискомфорт, наблюдалась положительная динамика фарингоскопических изменений. У пациентов с обильным ростом S. aureus (7 человек) после применения бактериофага золотистый стафилококк не высевался на следующий день у 1, через 10 дней у 3, через 30 дней у 1 пациента. Очень скудный и скудный рост S. aureus регистрировался у 3 пациентов через 10 и 30 дней после фаготерапии, умеренный — у 2 пациентов на следующий день, у 1 — через 10 и 30 дней после завершения фаготерапии. Обильный рост S. aureus сохранялся у 2 пациентов в течение 1 мес наблюдения. При этом авторы наблюдали снижение степени выделения золотистого стафилококка (с 10 6 до 10 3 КОЕ/мл) и регресс клинической симптоматики хронического тонзиллита. Положительные результаты регистрировались и при сочетании фаготерапии с другими методами лечения хронического тонзиллита, в частности в комбинации с применением аппарата Тонзиллор (10 процедур по стандартной методике). Отмечается эффективность применения внутригортанных инстилляций раствора бактериофага при ларингите [26]. Согласно полученным авторами данным, использование в комплексном лечении таких пациентов специфического бактериофага в виде инстилляций в гортань, а в случае тяжелого обострения — в виде приема внутрь, позволяет существенно сократить продолжительность лечения, повышая его качество, достичь более длительной ремиссии болезни и снизить частоту обострений.
Показано значение местного (внутрипазушного) применения пиобактериофага комплексного (ФГУП «НПО «Микроген» Минздрава России), представляющего собой смесь стерильных фильтратов фаголизатов стафилококков, стрептококков, энтерококков, протея, клебсиелл пневмонии и окситока, синегнойной и кишечной палочек, при лечении больных риносинуситом [27].
В отличие от антибиотикотерапии, на фоне которой сохранялись признаки воспаления в виде активации нейтрофильного звена иммунной системы, увеличения внеклеточной пероксидазной активности и угнетения процесса фагоцитоза, применение пиобактериофага сопровождалось улучшением показателей завершенности фагоцитоза, что свидетельствует о снижении интенсивности воспаления с восстановлением адекватного иммунного ответа слизистой оболочки носа, а также положительной динамике клинических проявлений заболевания [27].
Пиобактериофаг поливалентный — Секстафаг (ФГУП «НПО «Микроген» Минздрава России) способен специфически лизировать наиболее значимые возбудители заболеваний ЛОР-органов, в частности стафилококки и другие микроорганизмы. В связи с этим показаниями к применению этого препарата являются гнойно-воспалительные заболевания верхних дыхательных путей и уха — риносинусит, средний отит, тонзиллофарингит, ларингит, а также их осложнения — паратонзиллярный абсцесс и др. Способ применения препарата Секстафаг (пиобактериофаг поливалентный) зависит от характера и локализации патологического процесса. Согласно инструкции производителя, препарат может применятся местно, в виде полосканий, орошений, аппликаций; для введения в околоносовые пазухи, полость среднего уха, промывания полости абсцесса. Доза определяется индивидуально. Для внутриполостного введения при инфекциях ЛОР-органов рекомендуется использовать от 2,0 до 20,0 мл 1—3 раза в день. Длительность лечения пиобактериофагом поливалентным составляет от 5 до 15 дней. При необходимости возможно проведение повторных курсов лечения.
Включение в схему лечения препарата пиобактериофаг поливалентный (Секстафаг) стимулирует повышение способности Нф к завершенности фагоцитоза и уменьшению уровня ВПА (маркера воспаления). Монотерапия препаратом пиобактериофаг поливалентный не сопровождается снижением фагоцитарных свойств Нф, а показатели местного иммунитета соответствуют ПЗЛ и свидетельствуют о завершении воспалительного процесса. Следовательно, препарат пиобактериофаг поливалентный (Секстафаг), обладает противовоспалительными и иммунорегуляторными свойствами, что проявляется нормализацией показателей местного иммунитета [27].
Еще одним средством для профилактики на основе бактериофагов является гель Отофаг (ООО НПЦ «МикроМир»). Это новый топический препарат с бактериофагами (50 мл, концентрация 10 5 —10 6 БОЕ/см 3 ): S.aureus spp., M. catarrhalis, P. aeruginosa spp., Morganella morganii, Proteus vulgaris spp., Escherichiacoli spp., Streptococcus pyogenes spp., Klebsiella spp., H. sinfluenzae spp., Providencia rettgeri spp., Bacteroides spp., Neisseria spp., с широким спектром профилактической активности, способный осуществлять эффективный специфический лизис бактерий, в частности — этиологически значимых возбудителей инфекционно-воспалительных заболеваний ЛОР-органов [28].
Гель рекомендуется применять местно (в виде аппликаций) на слизистую оболочку полости носа, поверхности небных миндалин, кожу наружного слухового прохода 2—3 раза в день до исчезновения патологических изменений.
Таким образом, применение бактериофагов при лечении часто встречающихся инфекций ЛОР-органов является одним из перспективных разделов клинической оториноларингологии. Во многом это связано с реальными преимуществами бактериофагов — их высокой специфичностью, отсутствием воздействия на нормальную микрофлору организма, стимулирующим влиянием на гуморальное и клеточное звенья иммунитета, отсутствием токсичности, аллергогенности и тератогенного действия.
К преимуществам бактериофаговой терапии следует отнести и такие ее характеристики, как эффективность против антибиотикорезистентных возбудителей, возможность применения при аллергии к антибиотикам. В связи с этим есть основания полагать, что дальнейшие исследования этого направления будут способствовать повышению эффективности лечения воспалительных заболеваний верхних дыхательных путей и уха.

Тип упаковки Раствор для приема внутрь и ректального введения, фл. 20 мл, №4 Производитель Филиал АО "НПО "Микроген" в г. Пермь "Пермское НПО "Биомед" | Филиал АО НПО "Микроген" в г. Н.Новгород "ИМБИО"

Тип упаковки Раствор для приема внутрь и ректального введения, фл. 100мл Производитель Филиал АО "НПО "Микроген" в г. Пермь "Пермское НПО "Биомед" | Филиал АО НПО "Микроген" в г. Н.Новгород "ИМБИО"
Препарат показан для лечения и профилактики заболеваний желудочно-кишечного тракта, вызванных бактериями дизентерии, сальмонеллами, эшерихиями коли, протеем, энтерококками, стафилококками, псевдомонас аэрогиноза или их сочетанием
Филиал АО "НПО "Микроген" в г. Пермь "Пермское НПО "Биомед"
Филиал АО НПО "Микроген" в г. Н.Новгород "ИМБИО"
Стерильные очищенные фильтраты фаголизатов S. flexneri 1, 2, 3, 4 серотипов (с активностью по Аппельману - не менее 10 -6 ), S. sonnei, S. typhimurium (с активностью по Аппельману - не менее 10 -5 ), S. flexneri 6 серотипа, остальных серотипов Salmonella, Е. coli, Proteus, Enterococcus, Staphylococcus, Р. aeruginosa (с активностью по Аппельману - не менее 10 -4 ) - до 1 мл.
Прозрачная жидкость желтого цвета различной степени интенсивности, допускается зеленоватый оттенок.
Препарат вызывает специфический лизис бактерий Shigella flexneri 1, 2, 3, 4, 6 серотипов, Shigella sonnei, Salmonella paratyphi A, Salmonella paratyphi B, Salmonella typhimurium, Salmonella infantis, Salmonella choleraesuis, Salmonella oranienburg, Salmonella enteritidis, энтеропатогенной Escherichia coli, Proteus vulgaris, Proteus mirabilis, Enterococcus, Staphylococcus, Pseudomonas aeruginosa.
Лечение и профилактика заболеваний желудочно-кишечного тракта, вызванных бактериями дизентерии, сальмонеллами, эшерихиями коли, протеем, энтерококками, стафилококками, псевдомонас аэругиноза или их сочетанием: бактериальная дизентерия; сальмонеллез; диспепсия; дисбактериоз; энтероколит, колит.
Важным условием эффективной фаготерапии является предварительное определение фагочувствительности возбудителя.
Гиперчувствительность к компонентам препарата.
Целесообразно применение препарата при наличии инфекций, вызванных фагочувствительными штаммами бактерий (по рекомендации врача).
Препарат предназначен для приема внутрь и ректального введения. Для лечения препарат принимают внутрь 4 раза в день за 0,5 - 1 ч до приема пищи с первого дня заболевания в течение 7-10 дней.
Детям первых месяцев жизни в первые два дня приема препарат разводят кипяченой водой в два раза, в случае отсутствия побочных реакций (срыгивания, высыпаний на коже) в дальнейшем можно применять бактериофаг неразведенным. Препарат применяют через рот 3 раза в сутки за 30 минут до кормления. В случаях неукротимой рвоты препарат применяют в виде высоких клизм (через газоотводную трубку или катетер) ежедневно. Возможно сочетание ректального (в виде высоких клизм) и перорального применения препарата. Курс лечения 7-10 дней.
Интести ® ‑бактериофаг
лечение и профилактика бактериальных кишечных инфекций
- Устраняет причину бактериального воспаления кишечника¹
- Разрешен к применению с рождения¹
- Продается без рецепта
Почему Интести ® ‑бактериофаг

- Обладает антибактериальным действием¹
- Не повреждает нормальную кишечную микрофлору²
- Для всей семьи, включая детей с рождения¹
- Сочетается с другими лекарственными препаратами¹
Когда применять
Лечение
Профилактика
При появлении кишечной инфекции в детских и взрослых коллективах, а также в зонах наводнения
Интести ® ‑бактериофаг - это комплексный препарат. В его составе бактериофаги против бактерий протея, энтерококков, кишечной палочки, стафилококков, синегнойной палочки, шигелл, сальмонелл
Перед началом лечения определите возбудителей кишечной инфекции, которых может атаковать бактериофаг. Для этого необходимо сдать анализ
Как действует Интести ® ‑бактериофаг
Так бактериофаги атакуют и разрушают возбудителя инфекции 3
Бактериофаг прикрепляется к бактерии
Вводит в бактерию свой генетический материал и заражает ее
Выход бактериофагов и гибель бактериальной клетки
далее бактериофаги размножаются и берут бактерию под контроль
Как применять Интести ® ‑бактериофаг
Лечение бактериальных
и кишечных инфекций
за 30-60 мин до еды
за 30-60 мин до еды
за 30-60 мин до еды
за 30-60 мин до еды
Дети старше 8 лет и взрослые
за 30-60 мин до еды
за 30-60 мин до еды
Если после лечения улучшения не наступает,
симптомы усиливаются или появляются новые,
обязательно обратитесь к врачу
Профилактика при
эпидемиологической ситуации
за 30-60 мин до еды
зависит от эпидситуации
за 30-60 мин до еды
зависит от эпидситуации
за 30-60 мин до еды
зависит от эпидситуации
за 30-60 мин до еды
зависит от эпидситуации
Дети старше 8 лет и взрослые
за 30-60 мин до еды
зависит от эпидситуации
за 30-60 мин до еды
зависит от эпидситуации
Вопросы и ответы
Данные ответы не являются телемедицинской услугой.
Мы лишь помогаем лучше разобраться в особенностях препарата Интести®‑бактериофаг
При каких заболеваниях можно принимать Интести®‑бактериофаг?
Согласно инструкции по медицинском применению, лекарственный препарат Интести®‑бактериофаг применяется для лечения и профилактики заболеваний желудочно – кишечного тракта, вызванных бактериями сальмонеллеза, дизентерии, бактериального энтероколита и колита, бактериального дисбактериоза.
Может ли Интести®‑бактериофаг полностью заменить антибиотики?
При бактериальной кишечной инфекции решение о назначении антимикробной терапии принимает врач. Бактериофаги относят к антибактериальным препаратам и, в случае решения врача, могут быть использованы как самостоятельная антибактериальная терапия, так и совместно с антибиотиками.
Интести®‑бактериофаг обладает антибактериальным действием и активен в отношении бактерий шигеллы, сальмонеллы, энтеропатогенной кишечной палочки, протея, энтерококков, стафилококка, синегнойной палочки. При этом действует на конкретные типы этих микроорганизмов и не влияет на полезную микрофлору.
Интести®‑бактериофаг применяется при лечении легких форм сальмонеллеза и дизентерии, при бактерионосительстве (когда проявлений заболевания нет, а патогенные бактерии продолжаются выделяться), а также для профилактики заражения в эпидемических очагах. Препарат применяется для лечения и профилактики инфекций желудочно-кишечного тракта, вызванных кишечной палочкой, протеем, энтерококком, стафилококком, синегнойной палочкой.
Можно ли принимать Интести®‑бактериофаг для профилактики?
Если в детском саду или школе, который посещает ваш ребенок, в детском лагере или на базе отдыха было выявлено заражение дизентерией, сальмонеллезом, энтеропатогенной кишечной палочкой, протем, энтерококком, стафилококком, синегнойной палочкой, врач проводит профилактику Интести®‑бактериофагом всем, кто был в контакте с заболевшим.
Если вы находитесь в неблагоприятных санитарных условиях, например, в зоне наводнения, важно начать фагопрофилактику Интести®‑бактериофагом как можно раньше. Это позволит снизить риск заражения бактериальными кишечными инфекциями.
Согласно инструкции по медицинскому применению, оптимальная схема применения – ежедневный прием разовой возрастной дозы.
А вот как долго нужно проводить профилактику зависит от эпидемической ситуации.
Источник: Клинические рекомендации (протокол лечения) оказания медицинской помощи детям, больным шигиллезом, ФГБУ НИИДИ ФМБА России, 2015.
Клинические рекомендации (протокол лечения) оказания медицинской помощи детям, больным сальмонеллезом, ФГБУ НИИДИ ФМБА России, 2013.
С какого возраста можно применять Интести®‑бактериофаг у детей?
Препарат подходит детям с первых дней жизни. Малышам грудного возраста вначале рекомендуется развести препарат с небольшим количеством кипяченой воды 1:2 в первые два приема. И, если не наблюдается нежелательных явлений, применять Интести®‑бактериофаг без разбавления.
Интести®‑бактериофаг действует только на клетки бактерий, которые вызывают кишечные инфекции, и не повреждают на здоровую микрофлору.
Можно ли принимать Интести®‑бактериофаг беременным и кормящим мамам?
Если при беременности или кормлении грудью выявлена бактериальная кишечная инфекция или есть риск заражения после контакта с больным, рекомендуем проконсультироваться с лечащим врачом для назначения соответствующего лечения. В схему лечения могут входить бактериофаги.
Интести®‑бактериофаг разрешается применять при беременности (во всех триместрах) и во время грудного вскармливания.
Для лечения необходимо предварительно сделать лабораторный анализ на чувствительность.
Можно ли принимать Интести®‑бактериофаг с другими препаратами?
Прием Интести®‑бактериофага возможен с большинством лекарственных препаратов, в том числе с антибиотиками.
Можно ли принимать Интести®‑бактериофаг с едой или разводить водой?
Согласно инструкции по медицинскому применению Интести®‑бактериофаг рекомендуется принимать за час до еды
(у детей за 30 минут до кормления).
Малышам первых месяцев жизни вначале рекомендуется развести препарат с небольшим количеством кипяченной воды 1:2
на первые два приема. И, если не наблюдается нежелательных явлений, применять Интести®‑бактериофаг без разбавления.
Нужно ли после лечения Интести®‑бактериофага принимать пробиотики?
Бактериофаги созданы природой для регулирования численности бактерий. Они помогают поддерживать баланс микрофлоры в норме, препятствуя размножению возбудителей инфекции, в том числе в кишечнике.
Интести®‑бактериофаг не уничтожает микрофлору кишечника, поэтому прием пробиотика не требуется.
Источник: Халли П. Фебвр, Сангита РАО, Мелинда Гиндин, Натали Д. М. Гудвин, Элайджа Файнер, Хорхе С. Виванко, Шен Лу, Дэниел К. Мантер, Тейлор К. Уоллес, и Тиффани л. Вейр Исследование фагов: влияние дополнительного потребления бактериофагов на воспаление и кишечную микробиоту у здоровых взрослых Питательные вещества. 2019 Mar; 11 (3): 666.
Имеются противопоказания. Перед применением необходимо проконсультироваться с врачом
1 Согласно инструкции по препарату Интести®- бактериофаг РУ ЛС-001999 от 10.08.2020
2 Халли П. Фебвр, Сангита РАО, Мелинда Гиндин, Натали Д. М. Гудвин, Элайджа Файнер, Хорхе С. Виванко, Шен Лу, Дэниел К. Мантер, Тейлор К. Уоллес, и Тиффани л. Вейр Исследование фагов: влияние дополнительного потребления бактериофагов на воспаление и кишечную микробиоту у здоровых взрослых Питательные вещества. 2019 Mar; 11 (3): 666. 3
3 The Wall Street Journal.
Читайте также:

