Инсульт при диабете пролежни
Обновлено: 02.05.2024
ФГБУ «Эндокринологический научный центр» Минздрава России
Институт диабета Эндокринологического научного центра, Москва
Сосудистые поражения головного мозга при сахарном диабете: решенные и нерешенные вопросы
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. 2015;115(8): 79‑82
ФГБУ «Эндокринологический научный центр» Минздрава России
Представлен обзор отечественных и зарубежных исследований, касающихся частоты факторов риска и особенностей ишемического мозгового инсульта у больных сахарным диабетом 2-го типа (СД 2-го типа). Подробно проанализированы специфические факторы риска инсульта при СД 2-го типа, такие как хроническая и острая гипергликемия, рецидивирующие эпизоды гипогликемии, инсулинорезистентность и гиперинсулинемия. Представлены современные требования к контролю гипергликемии у лиц с перенесенными сосудистыми нарушениями. Обращено внимание на высокую частоту сочетания поражения многих сосудов у пациентов с СД 2-го типа.
ФГБУ «Эндокринологический научный центр» Минздрава России
Институт диабета Эндокринологического научного центра, Москва
Сахарный диабет (СД) является наиболее опасным вызовом всему мировому сообществу и приоритетом национальных систем здравоохранения всех без исключения стран мира. Численность больных СД, и прежде всего больных СД 2-го типа, увеличивается со скоростью, опережающей прогнозы экспертов Всемирной диабетической федерации (IDF). Так, за последние 10 лет (с 2004 по 2014 г.) число больных СД увеличилось вдвое: со 194 до 387 млн человек, в то время как по прогнозам экспертов IDF от 2004 г., такая их численность ожидалась не ранее 2030 г. [1, 2]. Согласно последним прогнозам в 2035 г. СД будут болеть 592 млн человек, т. е. каждый 10-й житель планеты. Опасность заключается в том, что более половины больных не знают о своем диагнозе, а следовательно, не получают лечения.

Таблица 1. Особенности инсульта у больных сахарным диабетом
Факторы риска развития инсульта при СД 2-го типа можно подразделить на традиционные, общие для всего населения планеты и специфические, которые встречаются преимущественно у больных СД 2-го типа.
Традиционные факторы риска мозгового инсульта при СД 2-го типа
К традиционным факторам риска развития инсульта относятся артериальная гипертензия, атерогенная дислипидемия, ожирение, курение, перенесенные ранее инсульты, наследственная отягощенность по сердечно-сосудистым заболеваниям. Вклад традиционных факторов (гипертония и дислипидемия) в развитие инсульта при СД 2-го типа предположительно более высок, чем в его отсутствие. Так, в исследовании STENO-2, посвященном изучению комплексного влияния нескольких факторов риска на смертность при СД 2-го типа, было показано, что успешная первичная профилактика инсульта на 64% зависит от оптимальной коррекции дислипидемии и на 25% — от коррекции артериального давления, в то время как вклад непосредственно контроля гипергликемии, оцененного по динамике уровня гликированного гемоглобина (HbA1c), не превысил 8% [6]. Аналогичные данные были получены в недавно завершенном долгосрочном исследовании, включавшем 26 924 больных СД 2-го типа, наблюдавшихся более 6 лет, в течение которых стояла задача достичь оптимального контроля гипергликемии (HbA1c<7%), артериальной гипертонии (САД <130 мм рт.ст.) и дислипидемии (содержание холестерина липопротеидов низкой плотности — ХЛНП — менее 2,6 ммоль/л) [7]. При отсутствии достижения перечисленных целей отношение рисков развития инсульта у больных СД 2-го типа составляло 2,56 по сравнению с пациентами, достигшими целевых значений по всем трем показателям. Оптимальный контроль только гликемии (т.е. достижение HbA1c<7%) снижал отношение рисков до 2,0, однако наилучший профилактический эффект был достигнут при эффективном контроле САД или ХЛНП, или обоих этих факторов (отношение рисков 1,14; 1,35 и 0,6 соответственно) (рис. 1).

Рис. 1. Независимый вклад HbA1c, САД и ХЛНП в риск развития инсульта при СД 2-го типа [4]. Оптимальный контроль: HbА1c
Специфические факторы риска мозгового инсульта при СД 2-го типа
К специфическим факторам риска инсульта при СД относят состояние хронической гипергликемии, рецидивирующие эпизоды гипогликемии вследствие несбалансированной сахароснижающей терапии и инсулинорезистентность, т. е. нечувствительность периферических тканей к действию инсулина.
Хроническая гипергликемия рассматривается как один из основных неблагоприятных факторов риска развития любого сердечно-сосудистого события при СД 2-го типа. Глюкоза является активным химическим соединением, вступающим в реакции взаимодействия практически со всеми компонентами циркулирующей крови, белками и липидами, приводящими к образованию конечных продуктов гликозилирования. Эти соединения являются чрезвычайно токсичными для клеток эндотелия сосудов. В результате этих процессов нарушаются механизмы релаксации сосудов, активируется свертывающая система крови, развиваются окислительный стресс и дисфункция эндотелия, что влечет в конечном итоге развитие неблагоприятных сосудистых исходов. Интегральным показателем хронической гипергликемии является степень связывания гемоглобина с глюкозой, определяемая по процентному содержанию HbA1c. Чем выше его уровень, тем более высокие средние значения гликемии отмечались у пациента в последние 2—3 мес. У здоровых этот показатель не превышает 6,5%. Одно из крупнейших исследований в диабетологии — UKPDS [8], в котором прослеживалась судьба больных СД 2-го типа в течение 10 лет от дебюта заболевания, продемонстрировало прямую зависимость развития сосудистых осложнений СД 2-го типа от уровня HbA1c. В этом исследовании было показано, что увеличение HbA1c на каждый 1% повышает риск развития инсульта на 17% и, напротив, снижение HbA1c на 1% уменьшает риск инсульта на 12%. В недавно проведенном китайском исследовании ACROSS-China [9] были получены данные о тесной связи уровня HbA1c и частоты повторного инсульта через 3 мес и 1 год после первого события (рис. 2). При уровне HbA1c более 7,2% частота повторного инсульта через 3 мес составляла 17,7, а через 1 год — почти 23%.

Рис. 2. Частота повторного инсульта (ось ординат, %) в зависимости от уровня HbA1c (ось абсцисс, %) [9].
При СД 2-го типа опасность представляет не только хроническая, но и острая гипергликемия. Механизмы патогенного воздействия острой гипергликемии на головной мозг чрезвычайно многообразны и опосредованы как нарушением мозговой микроциркуляции, так и токсическим воздействием непосредственно на ткань мозга. С острой гипергликемией связывают вероятность развития мозгового ацидоза и накопления лактата в паренхиме мозга, образования свободных радикалов, цитотоксического отека мозга, нарушения проницаемости гематоэнцефалического барьера. Острая гипергликемия приводит к нарушению ауторегуляции тонуса церебральных артерий, что может сопровождаться отсроченной реперфузией с опасностью геморрагической трансформации зоны инфаркта мозга [4].
Гипогликемия представляет собой не менее серьезную опасность для сосудов головного мозга, чем гипергликемия. Часто повторяющиеся эпизоды гипогликемии могут приводить к тяжелым гемодинамическим и гемореологическим последствиям. Снижение уровня сахара крови менее 3,6 ммоль/л активирует выброс адреналина, глюкагона и гормона роста, а ниже 3,0 ммоль/л — повышает секрецию кортизола. Эти гормональные сдвиги провоцируют развитие спазма сосудов, тахикардии, аритмии, гипертонического криза. В дальнейшем активируется свертывающая система крови, усиливаются адгезивные свойства тромбоцитов, что в совокупности с гемодинамическим «срывом» приводит к высокому риску окклюзии сосудов, тромбозу или тромбоэмболии. Снижение уровня гликемии менее 2,6 ммоль/л обусловливает развитие нейрогликопенических расстройств, которые могут сопровождаться развертыванием инсультоподобной клинической картины (гемиплегия, афазия, спутанность сознания). Известно, что различные регионы мозга имеют различную чувствительность к недостатку глюкозы. Описаны изменения результатов МРТ головного мозга после повторных эпизодов тяжелой гипогликемии. Эти изменения чаще всего локализовались в базальных ганглиях, коре больших полушарий, черной субстанции и гиппокампе [10], указывая на то, что эти зоны более всего зависимы от метаболизма глюкозы. Нередко гипогликемия приводит к более тяжелым повреждениям головного мозга, нежели умеренная гипергликемия. Именно поэтому во всем мире для лиц с СД 2-го типа, уже перенесших сердечно-сосудистые катастрофы, приняты менее строгие целевые показатели контроля углеводного обмена, чем для пациентов без сосудистых осложнений. В России в декабре 2011 г. был одобрен консенсус Российской ассоциации эндокринологов, определяющий индивидуальные целевые показатели гликемии для больных СД 2-го типа в зависимости от возраста, наличия осложнений и склонности к гипогликемическим состояниям [11]. Согласно этому документу, больным СД 2-го типа, перенесшим ранее сердечно-сосудистые события (в том числе инсульт), рекомендовано поддерживать целевые уровни HbA1c 7,5—8,0%, глюкозы плазмы натощак 7,5—8,0 ммоль/л и глюкозы плазмы через 2 ч после пищевой нагрузки 10—12 ммоль/л.
Инсулинорезистентность (ИР) традиционно рассматривается как основной патогенетический механизм развития самого СД 2-го типа и как фактор риска генерализованного атеросклероза у больных СД 2-го типа, в том числе и ишемического инсульта. ИР представляет собой нарушенный биологический ответ периферических тканей организма на воздействие эндогенного или экзогенного инсулина, что приводит к развитию компенсаторной гиперинсулинемии. Имеется немало фактов, свидетельствующих о том, что высокие концентрации инсулина оказывают прямое атерогенное действие на стенки сосудов, вызывая пролиферацию и миграцию гладкомышечных клеток, пролиферацию фибробластов, активацию свертывающей системы крови, снижение активности фибринолиза. Связь между ИР, гиперинсулинемией и развитием атеросклероза была прослежена в ставшем классическим исследовании IRAS (Insulin Resistance Atherosclerosis Study), где в качестве маркера атеросклеротического поражения сосудов измерялась толщина интимы- медия сонной артерии. В ходе исследования была выявлена прямая зависимость между степенью ИР и толщиной интимы-медия общей сонной артерии как у лиц без СД, так и у больных СД 2-го типа. Расчетными методами было показано, что на каждую 1 единицу ИР толщина стенки сонной артерии увеличивается на 30 микрон. Также было показано, что выраженная ИР (оцененная расчетным методом по индексу HOMA >2,8) в 3 раза повышает риск развития ишемического инсульта даже у лиц, не имеющих СД 2-го типа [12].
В последние годы феномен ИР вновь привлек к себе внимание, но уже не только со стороны эндокринологов и кардиологов, но и со стороны неврологов и психиатров. Связано это с обнаружением причинно-следственной связи между ИР тканей мозга и болезнью Альцгеймера. Связь эта настолько тесна, что болезнь Альцгеймера стали называть «диабет 3-го типа» или «диабет мозга» [13]. Предполагают, что задолго до первых проявлений болезни Альцгеймера некоторые участки мозга теряют на своей поверхности рецепторы к инсулину, вследствие чего прерывается нормальный внутриклеточный путь передачи сигнала с участием субстрата инсулиновых рецепторов-1 (IRS-1) и, как следствие, нарушается нормальное усвоение глюкозы нейронами. Одновременно с этим в ткани мозга начинает накапливаться нейротоксический белок β-амилоид (аналогичный процесс происходит в островковых клетках поджелудочной железы). Наиболее выражены эти изменения в тех участках мозга, которые отвечают за когнитивные процессы. Таким образом, болезнь Альцгеймера и СД 2-го типа очень схожи по своим патогенетическим механизмам и часто сопутствуют друг другу.
Поражение многих сосудов при СД 2-го типа. Как правило, у больных СД 2-го типа атеросклеротические изменения сосудов развиваются одновременно в нескольких сосудистых бассейнах, вовлекая брахиоцефальные и коронарные артерии, артерии нижних конечностей и почечные сосуды. По данным Эндокринологического научного центра МЗ РФ, частота сочетанного поражения 2 и более сосудистых бассейнов при СД 2-го типа составляет 66%, что в 2 раза выше, чем у лиц, не имеющих СД [14]. Факторами, ассоциированными с множественным макрососудистым поражением, помимо традиционных, являются сниженная скорость клубочковой фильтрации, выраженная дисфункция эндотелия (накопление асимметричного диметиларгинина — ADMA), признаки субклинического воспаления (высокая концентрация фибриногена) [14]. Высокая частота сочетанных стенозов магистральных сосудов при СД 2-го типа требует активного обследования основных сосудистых бассейнов при наличии факторов риска и/или перенесенного сосудистого события.
Сахарный диабет часто становится одной из основных причин возникновения инсульта. Взаимосвязь двух заболеваний достаточно тесная — при диабете повышается уровень сахара в крови, что делает её более густой и увеличивает риск закупорки сосудов. Инсульт развивается как раз по причине замедления или остановки кровообращения, которое возникает при разрыве микрососудов головного мозга или закупорке тромбами. Чтобы вылечить патологии, необходимо обратиться к эндокринологу и неврологу.

Причины возникновения
Диабет сопровождается высоким содержанием холестерина и глюкозы в крови. Холестерин провоцирует формирование атеросклеротических бляшек, наростов на внутренних стенках сосудов, которые замедляют микроциркуляцию крови. Глюкоза сгущает кровь — такие сгустки накапливаются и перекрывают артерии, что так же препятствует нормальному кровообращению. Таким образом, в головной мозг перестают поступать кровь, кислород, питательные вещества и возникает инсульт, острое нарушение мозгового кровоснабжения.
При сахарном диабете обычно держится стабильно высокое артериальное давление (гипертония), что часто становится причиной приступа ОНМК. Другие причины:
- атеросклероз;
- кардиосклероз;
- компрессия нервных волокон;
- тромбозы;
- тромбофлебиты;
- нарушения обмена веществ;
- расстройства эндокринной системы;
- быстрая свёртываемость крови.
Статью проверил
Дата публикации: 24 Марта 2021 года
Дата проверки: 24 Марта 2021 года
Дата обновления: 24 Июня 2022 года
Содержание статьи
О чем говорит эпилепсия после инсульта?
Одновременное развитие двух опасных заболеваний говорит о таких нарушениях функций в организме:
- патологическая слабость сосудистых стенок;
- повышенное содержание холестерина, глюкозы и гормонов;
- повреждения работы органов эндокринной, кровеносной, сердечно-сосудистой систем;
- сниженный иммунитет и подверженность аутоиммунным болезням.
Выявить сахарный диабет можно по таким признакам:
- снижение остроты зрения;
- резкая потеря веса;
- хроническая усталость;
- постоянный голод и жажда;
- высокое артериальное давление;
- слабый иммунитет;
- недержание мочи ночью;
- онемение конечностей;
- покалывание в руках или ногах;
- долгое заживление ран.
Разновидности
Диабет бывает двух типов:
- Первый. Возникает из-за недостаточного количества инсулина, который выполняет функцию угнетателя глюкозы. Дефицит инсулина провоцирует образование высокого уровня сахара и скопления кровяных сгустков.
- Второй. Основные причины до конца не изучены. Недостатка инсулина нет, но глюкоза превышает свою норму.
Как снять симптомы?
Острые приступы сахарного диабета выражаются в головокружении, холодном поту, учащённом сердцебиении, побледнении лица, слабости мышц. Чтобы снять симптомы и облегчить состояние, нужно успокоиться, прилечь, измерять уровень сахара. Помогают гипотензивные препараты и диуретики, а также свежий воздух и глубокое дыхание. При резком снижении глюкозы нужно принять сахар и вызвать врача.
К какому врачу обратиться и когда?
Для прохождения лечебного курса нужно обращаться к врачу-эндокринологу, неврологу или кардиологу. Специалист может проконсультировать, правильно оказать первую помощь, провести осмотр, диагностику и назначить необходимое лечение. Как правило, диабетики знают о своём диагнозе, поэтому могут заметить симптомы, после которых следует обязательно вызывать врача.
Лечение
Лечение начинают с осмотра и диагностики пациента. На приёме больной рассказывает о проявлениях болезни и своём состоянии. Диабетикам назначают такие анализы:
Медикаментозное лечение
Чтобы снизить уровень сахара в крови, врачи выписывают препараты различных групп:
- Бигуаниды. Уменьшают всасывание углеводов, ускоряют сочетание инсулина с рецепторами, окисляют жирные кислоты.
- Глиптины. Угнетают гормоны поджелудочной железы, снижают угрозу гипогликемии.
- Сульфонилмочевины. Активизируют инсулиновую секрецию, уменьшают сосудистые патологии.
- Глиниды. Стимулируют выработку инсулина, имеют высокую биодоступность.
- Ингибиторы α-глюкозидаз. Сокращают перепады уровня сахара в крови, защищают поджелудочную железу.
- АГ ГПП-1. Ускоряют насыщение, препятствуют развитию сердечных болезней.
- иНГЛТ-2. Способствуют быстрому выведению излишков глюкозы из организма через почки.
- Глитазоны. Блокируют инсулинорезистентность, сохраняют функции поджелудочной железы.
Хирургическое лечение
Хирургия при диабете чаще применяется за границей. В клиниках принимают пациентов на тяжёлых стадиях. Обычно применяют трансплантацию поджелудочной железы, иногда делают одномоментную операцию по пересадке поджелудочной железы и почки.
Консервативная терапия
Один из эффективных оздоровительных методов — лечебная физкультура. Занятия проводит врач спортивной медицины. Упражнения направлены на разработку мышц, устранение атрофии, восстановление рефлексов, что особенно важно после инсульта. Также показаны сеансы лечебного массажа, которые помогают наладить микроциркуляцию крови и успокоить нервную систему.
Физиотерапия — ещё один способ оздоровить организм. Обычно назначают такие процедуры:
- электрофорез калия;
- импульсную электротерапию;
- магнитотерапию;
- ультразвуковую терапию;
- дарсонвализацию головы и шеи;
- бальнеотерапию;
- кислородные коктейли;
- грязелечение.
Источники
«Клинические особенности ишемического инсульта, развившегося на фоне сахарного диабета 2 типа», ЛА Щепанкевич, ЕВ Вострикова, ПИ Пилипенко, ЛЭ Ахундова, КО Федорова. Медицина и образование в Сибири, 2012.
«Острое нарушение мозгового кровообращения у больных сахарным диабетом 2 типа», Сергей Валентинович Какорин, Элеонора Владимировна Тулякова, Кира Владимировна Воронкова, Ашот Мусаелович Мкртумян. Сахарный диабет, 2013.
Статью проверил

Публикуем только проверенную информацию
Размещенные на сайте материалы написаны авторами с медицинским образованием и специалистами компании ЦМРТ
Сахарный диабет (СД) — одно из наиболее распространенных эндокринных заболеваний. По данным мировой статистики, в настоящее время сахарным диабетом страдает от 2 до 4% населения. Хотя СД не является основным фактором
Сахарный диабет (СД) — одно из наиболее распространенных эндокринных заболеваний. По данным мировой статистики, в настоящее время сахарным диабетом страдает от 2 до 4% населения. Хотя СД не является основным фактором риска развития инсульта, он может серьезно осложнить течение и возможности реабилитации пациентов, перенесших инсульт. Некорректная терапия СД, особенно в остром периоде инсульта, может существенно повысить риск повторного инсульта или увеличить площадь ишемического очага.
У больных с СД в 25 раз выше риск развития почечной недостаточности, инфарктов, инсультов и слепоты, а продолжительность жизни в среднем меньше на 15 лет, чем в популяции в целом.
Эпидемиология инсульта при сахарном диабете
Роль СД как фактора риска возникновения первого инсульта была продемонстрирована в популяции 55—84 лет на основе десятилетнего наблюдения, проводившегося в г. Фрамингем (США).
Так, выявлено, что у людей старше 40 лет острые нарушения мозгового кровообращения возникают на фоне СД в полтора-два раза чаще, чем у лиц, не страдающих этим заболеванием, а в возрасте до 40 лет — в три-четыре раза чаще, причем среди заболевших со значительным перевесом преобладают женщины. В возрасте до 40 лет в случае непродолжительного течения СД при гипогликемической коме развивается кровоизлияние в мозг, а при длительном (более 15—20 лет) — инфаркт мозга. Нередко, особенно у пожилых больных инсультом, СД не диагностируется, хотя может встречаться у 50% пациентов. Среди людей, страдающих СД, существенно выше летальность при инсульте.
До сих пор до конца не установлено соотношение заболеваемости ишемическим и геморрагическим инсультом у больных СД. Так, по данным патологоанатомических исследований, этот показатель практически не отличается от среднепопуляционного — инфаркт мозга при СД наблюдается в три-четыре раза чаще, чем кровоизлияние. В то же время, по клиническим данным, инфаркт мозга у больных СД развивается в 5–6 раз чаще, чем кровоизлияния.
Патофизиологические механизмы инсульта при сахарном диабете
У подавляющего большинства (72—75%) больных СД с инфарктом мозга отмечается нетромботический характер инсульта, в то время как среди населения в целом этот показатель достигает лишь 60%. В развитии более распространенного нетромботического инфаркта мозга у больных СД ведущая роль принадлежит хронической мозговой сосудистой недостаточности, среди причин которой следует отметить поражение симпатических вазомоторных нервов, понижение окислительных процессов и гипокапнию. Нетромботический инсульт нередко возникает у больных при активной деятельности, когда существенно возрастает потребность в увеличении кровоснабжения мозга, вследствие чего создаются условия для появления цереброваскулярной недостаточности. Причинами развития инфаркта мозга тромботического характера у больных СД являются значительные атеросклеротические изменения сосудов мозга, повышение вязкости крови и нарушение ее коагуляционных свойств (угнетение антисвертывающей и активация свертывающей системы). Выявлена прямая зависимость депрессии защитных антисвертывающих реакций организма от длительности СД, выраженности и распространенности поражения сосудистой системы.
Существенную роль в развитии цереброваскулярных нарушений играет патология магистральных артерий головы: сонных и позвоночных артерий, которые при СД часто поражаются атеросклерозом. Важность изучения влияния глюкозы и инсулина на толщину мышечного слоя артерий (индекс IMT) подтверждена работами, проводившимися в рамках международной программы IRAS. Так, увеличение этого показателя по сравнению с контрольной группой, выявленное в ходе проспективных наблюдений с использованием ультразвуковой сонографии, не только свидетельствует о наличии атеросклероза, но и позволяет судить о влиянии различных факторов риска у больных СД. Причем обнаружена значимая корреляция как с низкой, так и с высокой концентрацией инсулина таких факторов, как пол, индекс массы тела, толерантность к глюкозе, уровень триглицеридов, апо-липопротеидов А-1 и В-1, фибриногена, кровяного давления. Гиперинсулинемия и гипоинсулинемия оцениваются как независимые факторы риска каротидного атеросклероза. Чем ниже уровень инсулина, тем больше выражен атеросклероз внутренней сонной артерии. Зависимость между факторами риска и каротидным атеросклерозом менее выражена у пожилых, чем у молодых больных. Максимальный стеноз и максимальная толщина стенок общей и внутренней сонной артерий с возрастом увеличиваются больше у мужчин, чем у женщин, и лучше коррелируют с данными о перенесенных инсульте и коронарной болезни сердца. Выявлена связь этих показателей с систолическим АД, гипертрофией левого желудочка сердца, концентрацией холестерина липопротеидов низкой плотности, триглицеридов, глюкозы и инсулина, а уровень холестерина липопротеидов высокой плотности и величина диастолического АД имели обратную связь с максимальными показателями IMT внутренней сонной артерии и степенью стеноза артерий.
У пожилых больных с СД 2 типа IMT в области бифуркации общей сонной артерии был больше, чем в контрольной группе, и коррелировал с уровнем инсулина в плазме (спустя 1 ч после нагрузки глюкозой), концентрацией в сыворотке крови липопротеидов низкой плотности, триглицеридов и апопротеина В. Основным фактором, влияющим на IMT при СД, является уровень инсулина после нагрузки глюкозой вместе с нарушением профиля липопротеидов и синдромом резистентности к инсулину.
Клинические особенности инсульта у больных с сахарным диабетом
У больных СД, по сравнению с лицами, не страдающими этим заболеванием, имеется ряд особенностей в клинике острых нарушений мозгового кровообращения. Инфаркт мозга у них чаще возникает днем, в период активности, нередко развивается на фоне повышенного АД, сопровождается более высокой летальностью; у некоторых больных он имеет псевдотуморозное течение. У пациентов с СД отмечается более тяжелое течение инсульта, более выражен отек головного мозга, выше смертность.
При кровоизлияниях в мозг отмечаются очень высокая смертность, выраженная декомпенсация диабетических нарушений; у половины больных наблюдаются длительные коматозные состояния. Паренхиматозные кровоизлияния нередко развиваются постепенно; при субарахноидальном кровоизлиянии начало не острое, сопровождающееся нерезко выраженными менингеальными симптомами и умеренным психомоторным возбуждением.
Особый интерес представляет дифференциальный диагноз инсульта с метаболическими расстройствами, которые нередко могут имитировать клиническую картину инсульта у больных СД.
Энцефалопатии, вследствие метаболических или токсических нарушений, обычно вызывают подострое развитие нарушений сознания, с системными расстройствами или без них и минимальными очаговыми расстройствами. Чаще всего в качестве очаговой неврологической симптоматики обнаруживаются генерализованная гиперрефлексия и симптом Бабинского. Иногда метаболические нарушения проявляются очаговыми неврологическими симптомами и жалобами, которые могут начинаться остро и имитировать инсульт. Это относится как к гипогликемии, так и к гипергликемии. Гиперосмолярность при гипергликемии способна вызывать уменьшение мозгового кровотока, фокальный неврологический дефицит, т. е. симптомы, имитирующие инсульт.
Хотя гипогликемия обычно вызывает признаки адренергической активности, такие, как потливость и тахикардия, иногда у больных отмечаются только очаговые неврологические проявления без адренергических симптомов. В этом случае необходим дифференциальный диагноз с инсультом. Пациенты практически всегда получают гипогликемические препараты по поводу диабета, поэтому у них возможно развитие гипогликемии. Жалобы, как правило, стереотипны и возникают до еды (утром перед завтраком, ночью) или после физической нагрузки. Симптоматика уменьшается после приема глюкозы. Уровень сахара в крови снижается до 2-2,5 ммоль/л в начале приступа, однако может нормализоваться самопроизвольно или после приема глюкозы. Однако следует помнить, что при длительном течении сахарного диабета гипогликемическое состояние может наступать у больного даже при, казалось бы, «нормальных» значениях глюкозы крови. Если у больного с сахарным диабетом подозревают инсульт, симптомы которого проявились рано утром, непременно нужно иметь в виду возможность наличия у пациента гипогликемии, которая требует адекватной коррекции.
Гипергликемия (уровень сахара крови выше 8 ммоль/л при разовом исследовании или выше 6,7 ммоль/л при мониторировании) наблюдается у 43% пациентов с острым инсультом. Из них у 25% больных диагноз сахарного диабета был поставлен ранее, а еще у 25% отмечался повышенный уровень гликозилированного гемоглобина, что свидетельствует о латентном течении диабета. Однако у 50% пациентов уровень гликозилированного гемоглобина был в пределах нормы, это свидетельствует о том, что повышение уровня глюкозы связано с инсультом. Версия, согласно которой гипергликемия является следствием стрессового высвобождения кортикостероидов и катехоламинов, представляется спорной.
Особенности терапии инсульта при сахарном диабете
При лечении диабетиков, перенесших инсульт, практикующий врач сталкивается с рядом проблем. Во-первых, это связано с необходимостью более тщательного мониторинга уровня глюкозы крови. Кроме того, у пациентов, длительно страдающих СД, имеются, как правило, другие поражения внутренних органов, вызванные сахарным диабетом, что также следует учитывать в ходе комплексной терапии.
Основными направлениями лечения являются:
- проведение общих мероприятий, включающих контроль АД, коррекцию метаболических нарушений и поддержание гомеостаза;
- предупреждение отека головного мозга;
- назначение антикоагулянтов и ангиагрегантов;
- двигательная нейрореабилитация;
- логопедическая реабилитация.
Гипергликемия после инсульта является плохим прогностическим знаком. Это можно объяснить тем, что более тяжелые инсульты влекут за собой более выраженную стресс-реакцию и, следовательно, становятся причиной гипергликемии. Гипергликемия в остром периоде инсульта играет важную роль в выборе тактики ведения пациента. Есть свидетельства, что гипергликемия может способствовать увеличению площади очага поражения. T. A. Baird, M. W. Parsons и соавт. обнаружено прямое отрицательное влияние повышения уровня глюкозы крови на процесс ишемизации участка головного мозга.
По данным D. M. Bravata и соавт. (1996), частота развития гипергликемии в остром периоде варьировала от 6 до 31%. Однако только у одного пациента (1%) был обнаружен гемоглобин типа А1, т. е. подтвердился диагноз сахарного диабета.
Вместе с тем, диабетические микро- и макроангиопатии существенно осложняют патофизиологическую картину инсульта. При ведении пациентов, перенесших острый инсульт, важно контролировать уровень глюкозы крови, определять концентрацию гликозилированного гемоглобина, возможно также проведение теста на толерантность к глюкозе.
Гипогликемия, как уже говорилось ранее, может имитировать клиническую картину инсульта или ТИА. Вместе с тем, в остром периоде инсульта из-за снижения потребления пищи гипогликемия нередко возникает у пациентов, получающих сахароснижающие препараты. Так как гипогликемия может существенно осложнить течение инсульта и стать причиной нарастания неврологического дефицита, уровень сахара крови у пациентов, получающих сахароснижающие препараты, должен контролироваться особенно тщательно.
С первых дней после инсульта важно начать профилактику повторного инсульта. У пациентов с инсулинонезависимым СД адекватная антигипертензивная терапия и рутинная терапия антикоагулянтами могут существенно снизить риск развития инсульта.
У пациентов с диабетом, даже длительно протекающим, программа двигательной реабилитации должна быть составлена с учетом возможных поражений периферической нервной системы, сосудов, а также других органов и систем. Так, например, наличие сенситивной атаксии, вследствие диабетической полинейропатии, в определенной степени лимитирует возможности двигательной реабилитации, а кожные поражения могут явиться противопоказанием для массажа. В некоторых случаях необходимо использование специальной ортопедической обуви.
Обязателен адекватный контроль углеводного обмена, осмолярности плазмы.
Летальность при инсульте у больных сахарным диабетом составляет 40,3—59,3% — это выше среднего показателя в основной группе населения, а при кровоизлияниях достигает 70—100%. Среди причин частых летальных исходов можно назвать затруднения при диагностике (при инсульте ошибочно ставят диагноз диабетической или гипогликемической комы и др.), декомпенсацию диабетических обменных нарушений, диабетические сосудистые изменения, сопутствующие заболевания и осложнения СД (инфаркт миокарда, нефропатия, повышенная ранимость кожных покровов и др.), обширность очагов инфаркта мозга, трудности проведения рациональной терапии в связи с одновременным лечением по поводу инсульта и СД.
По вопросам литературы обращайтесь в редакцию.
Т. Т. Батышева, кандидат медицинских наук
А. А. Рыжак, кандидат медицинских наук
Л. А. Новикова
Поликлиника восстановительного лечения №7 УЗ ЦАО, Москва
ЦРБ, Севск, Брянская обл.
Что такое диабетическая стопа? Причины возникновения, диагностику и методы лечения разберем в статье доктора Есипенко И. А., сосудистого хирурга со стажем в 37 лет.
Над статьей доктора Есипенко И. А. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
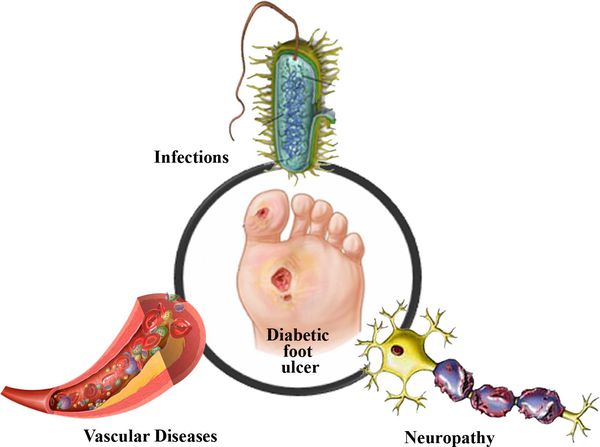
Диабетическая стопа (синдром диабетической стопы, СДС) — это тяжёлое осложнение сахарного диабета в виде инфекции, язв или разрушения глубоких тканей, которое возникает в связи с нарушением макроструктуры стопы и микроциркуляции крови, по причине разрушения нервных окончаний и нервных волокон. [10]
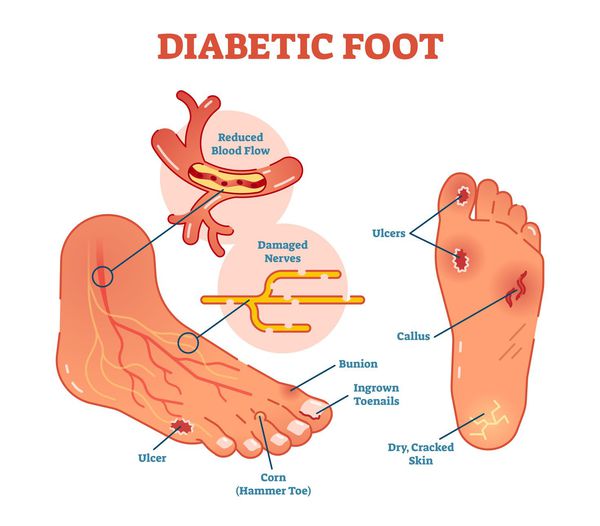
Главная причина ДС — это сахарный диабет (СД). И хотя синдром диабетической стопы не развивается с первого дня увеличения уровня глюкозы в крови более 7,0-8,0 ммоль/л, каждый пациент с диагнозом «сахарный диабет» должен помнить о таком грозном возможном осложнении.
Хронические раны на ногах у людей с сахарным диабетом встречаются в 4-15 % случаев. В некоторых случаях они становятся первым признаком развившегося диабета [10] .
Основные «пусковые механизмы» развития язв при СДС:
1. Ношение неудобной обуви. К изменению нагрузки на суставы стопы, сдавливанию или потёртости кожи, локальной микроишемии, инфильтрату, или некрозу могу привести любые дефекты обуви:
- несоответствующий размер обуви (меньше или больше, чем нужно);
- стоптанные и/или высокие каблуки;
- рубец на стельке;
- дефект подошвы;
- мокрая обувь;
- несоответствие обуви времени года.
2. Увеличенный вес тела. Учитывая площадь стоп, при увеличении веса тела (даже на 1 кг) увеличивается и нагрузка на каждый сустав стопы. Самая уязвимая область — подошвенная поверхность.
3. Разрастание эпидермиса (поверхности) кожи. Этот процесс происходит из-за нарушенных обменных процессов в коже на фоне СД (под утолщённым эпидермисом-"мозолью" в слоях кожи нарушается микроциркуляция, что приводит к микроишемии и некрозу).
4. Микротравмы:
- укусы животных;
- уколы шипами растений;
- порезы при педикюре и т. п.
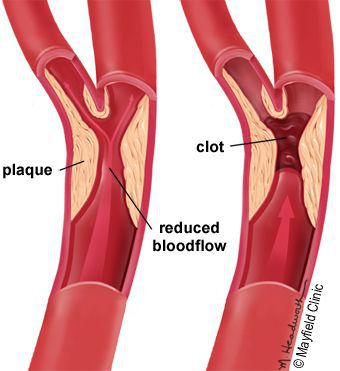
5. Стенозы (сужение) и окклюзии (закупорка) магистральных артерий. В результате отсутствия кровоснабжения в стопах и голенях к микроишемии присоединяется макроишемия и развитие гангрены конечности.
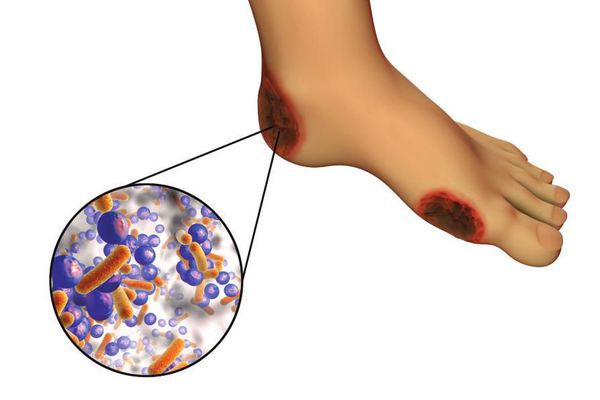
6. Условно патогенная или патогенная микрофлора. Активизация флоры (микробов и других микроорганизмов) на поверхности кожи в условиях СД приводит к воспалению кожного покрова, а в условия ишемии или микротравмы значительно ускоряется развитие гангрены.
Часто наблюдается сочетание нескольких причин возникновения язв при СДС.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы диабетической стопы
Отправной точкой развития СДС считается не дата установления диагноза «Сахарный диабет», а время, когда были выявлены первые симптомы СД (однократные подъёмы глюкозы крови, сухость во рту и другие).
Симптомы СДС:
- онемение, зябкость, жжение, отёки в стопах и другие неприятные ощущения;
- выпадение волос на на стопах и голенях, потливость стоп;
- изменение окраски кожи (гиперемия, гиперпигментация, цианоз);
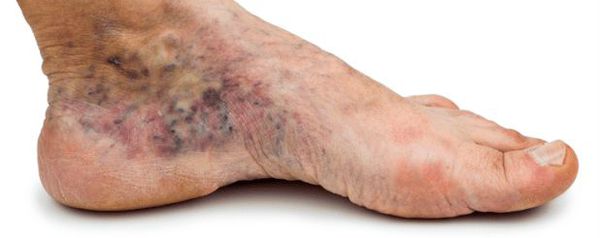
- утолщение, расслаивание, изменение формы и цвета ногтевых пластинок;
- кровоизлияния под ногтевой пластинкой в виде «синяков» под ногтями;
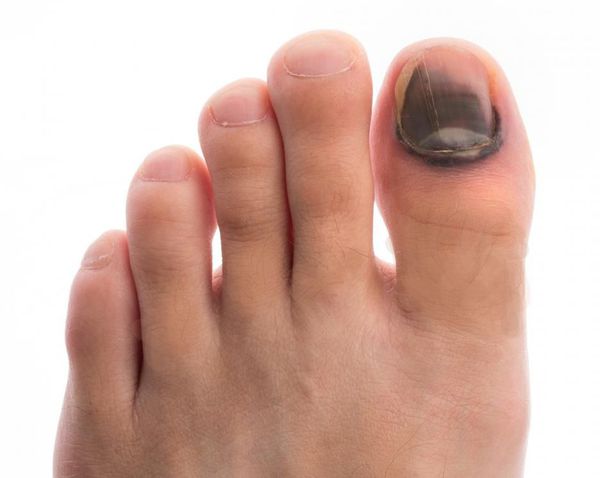
- деформация стоп;
- снижение чувствительности стоп — вибрационного, температурного, болевого и тактильного восприятия;
- боль в области стопы и язвы, возникающая как в покое или ночью, так и при ходьбе на определённые расстояния;
- истончение кожи, шелушение;
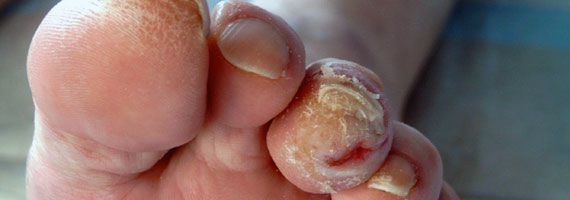
- понижение или увеличение температуры стоп и голеней;
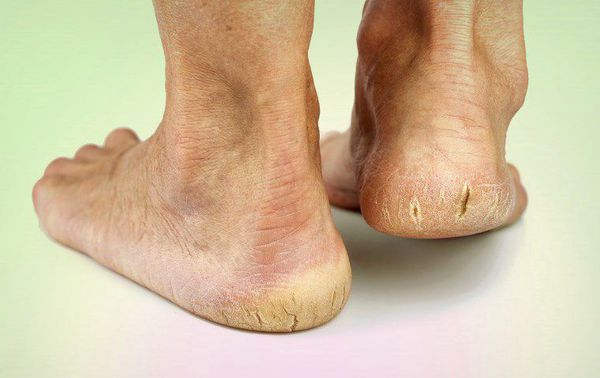
- длительная эпителизация (заживление) микротравм — до двух месяцев, при этом остаются коричневые рубцы;
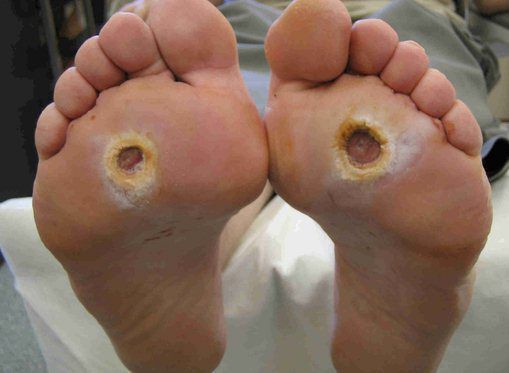
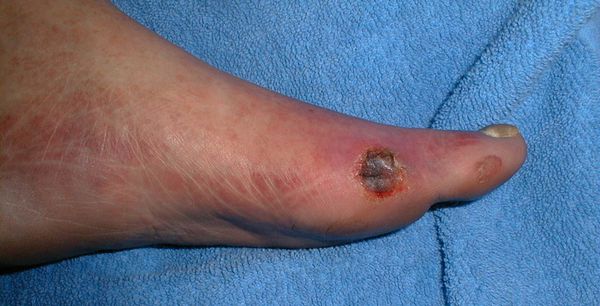
- трофические язвы, длительно не заживающие на стопах.
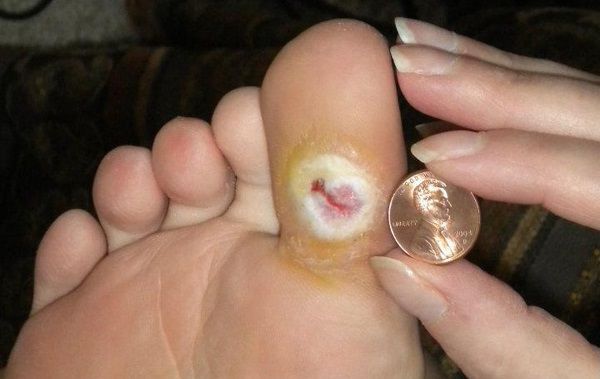
Чаще всего трофическим изменениям подвержены дистальные отделы конечности: пальцы и подошвенная поверхность стопы в проекции головок плюсневых костей. Зона образования трофической язвы зависит от причины её возникновения.
Патогенез диабетической стопы
Механизм развития СДС представляет собой следующую последовательность нарушений:
- Снижается выработка гормона инсулина.
- Увеличивается уровеь глюкозы в крови — развивается гипергликемия.
- Блокируется кровоток в мелких сосудах, через сосудистую стенку перестаёт поступать кислород и другие микроэлементы.
- Разрушаются нервные волокна и рецепторы.
- Наступает микро- и макроишемия тканей стопы.
- Образуются трофические язвы.
Таким образом, при СДС происходит повреждение всех тканей ноги.
В результате дефицита инсулина в организме диабетика количество глюкозы в крови увеличивается. Это в свою очередь негативно сказывается на состоянии как мелких, так и крупных сосудов:
- на стенках сосудов скапливаются иммунологические вещества;
- мембраны становятся отёчными;
- просвет сосудов сужается.
В результате этих изменений кровообращение нарушается и образуются небольшие тромбы. Эти изменения в организме препятствуют поступлению достаточного количества микроэлементов и кислорода в клетки и тем самым приводят к нарушениям обменного процесса. Кислородное голодание тканей замедляет процесс деления клеток и провоцирует их распад.
Увеличение уровня глюкозы в крови также становятся причиной поражения нервных волокон — снижается чувствительность.
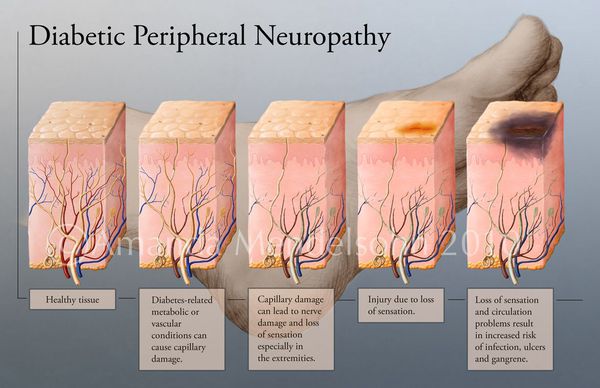
Все деструктивные процессы, происходящие в тканях стопы приводят к тому, что любое повреждение кожи становится лёгким процессом, а заживление — длительным. Усугубить состояние стопы могут присоединившиеся инфекции, которые способны привести к образованию гангрены — некрозу тканей. [9]
Классификация и стадии развития диабетической стопы
Классификация I Международного симпозиума по диабетической стопе
В 1991 году в Нидерландах на I Международном симпозиуме была принята классификация СДС, которая является наиболее распространённой. [1] Она предполагает разделение заболевания на три типа в зависимости от преобладающего патологического процесса:
- нейропатическая инфицированная стопа:
- длительное течение сахарного диабета;
- позднее возникновение осложнений;
- отсутствие болевого синдрома;
- цвет и температура кожи не изменены;
- уменьшение всех видов периферической чувствительности;
- наличие периферического пульса.
Классификация Вагнера
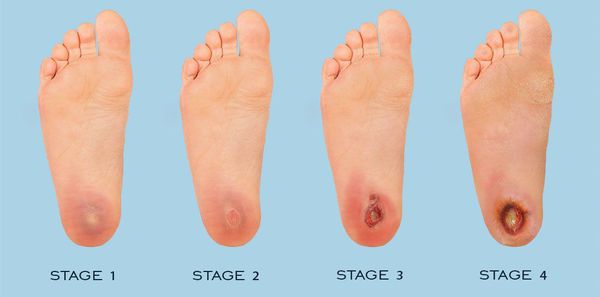
По степени выраженности поражений тканей стопы выделяют следующие стадии СДС: [6] [7]
- Стадия 0 — изменение костной структуры стопы — артропатия;
- Стадия 1 — изъязвление (язвы) кожи;
- Стадия 2 — изъязвление всех мягких тканей, дном язвы являются кости и сухожилия;
- Стадия 3 — абсцедирование и остеомиелит (воспаление костной ткани);
- Стадия 4 — образование гангрены дистальных отделов стопы (пальцев);
- Стадия 5 — образование гангрены стопы и отделов голени.
Классификация Техасского университета
Данная классификация была разработана в 1996-1998 годах. [8] В её основе лежит оценка язвы по глубине, наличию инфицирования и ишемии — риска ампутации конечности.

Инсульт – резкий сбой в системе кровообращения головного мозга, который приводит к поражению его различных участков, которые теряют функциональные способности.
Вместе с кровью в мозг прекращается поступление кислорода. Это приводит к нарушению питания клеток.
Короткий ответ на вопрос, сколько живут после инсульта, зависит от типа мозгового удара, а также того, насколько серьезные последствия, — при ишемическом смертность в первые 72 часа – не более 15%; при геморрагическом – не более 35%; самое опасное — субарахноидальное кровоизлияние – выживаемость в первые 72 часа около 50%. Подробности — ниже.
Коротко о главном — особенности ишемии и геморрагии

Выделяют два основных вида инсульта:
- Ишемический. Приводит к сокращению сосудов в голове, что закупоривает их стенки, вызываю гипоксию.
- Геморрагический. Процесс кровоизлияния в головной мозг, зачастую возможен летальный исход.
По статистическим данным соотношение между двумя видами составляет 80% на 20% (Consilium Medicum №02 2000).
Ишемический инсульт может развиться в любом возрасте — у детей, подростков, людей среднего возраста и пожилых. Степень тяжести последствий также индивидуальна, зависит от скорости принятия решений после приступа, правильности диагностики, назначенного лечения.
Геморрагический инсульт может случиться с человеком любого возраста. Он возникает резко, сопровождается тяжелым состоянием пациента, постоянными рвотными рефлексами и сильной головной болью. При первых признаках человек часто теряет сознание.
- резкие движения, смена положения;
- еда с большим количеством жира и прочих вредных составляющих;
- вредные привычки — курение, алкогольная зависимость, наркомания;
- высокая температура воды при водных процедурах или на улице;
- чрезмерная нагрузка физического или психологического типа на организм человека;
- сердечная аритмия;
- проблемы с артериальным давлением.
Информация об инсульте — кликабельно
При появлении первых симптомов инсульта следует быть внимательным и расторопным, счет идет на минуты. В среднем через 3-4 часа после появления первых признаков состояние кровеносных сосудов головного мозга ухудшается, а последствия могут стать необратимыми. Именно первые 3-4 часа являются важнейшими в борьбе с болезнью.
Если признаки и болевые ощущения проходят в течение суток, скорей всего у человека был микроинсульт.

Симптоматика левостороннего и правостороннего инсульта различается
Алгоритм действий при появлении симптомов:
- Положить больного на горизонтальную поверхность, голову держать под углом 30 градусов.
- Если пострадавший ощущает резкие рвотные рефлексы, нужно развернуть его голову вбок.
- Следует внимательно следить за изменением давления и пульса. Рекомендуется замерять их и отслеживать колебания.
- При появлении врачей скорой помощи следует полностью описать картину произошедшего. Рассказать, какие действия были предприняты до приезда медиков.

Сколько живут после инсульта: статистика в подробностях
Продолжительность жизни человека после инсульта сугубо индивидуальна. В 20% случаев смерть человека наступает мгновенно.
Исследования показали, что в первые 30 дней смертность составляет 30-40%, после первого года после инсульта умирают примерно 50 % пациентов.
Повторный процесс нарушения кровообращения головного мозга повышает возможность смерти. Зачастую, если у больного случился первый инсульт – он сможет прожить до 10 лет, однако при повторной атаке на мозг длительность жизни составляет не более 3 лет.
Причина такой высокой смертности после повторного инсульта в том, что после первого приступа в головном мозге остаются пораженные очаги.

Зависимость от возраста и пола
При кровоизлиянии до 40 лет – летальный исход в 15%, после 50 лет – 45 % случаев.
У женщин смертность выше, чем у мужчин – 39% против 29%.
Новорожденным и людям в возрасте от 65 лет и выше пережить инсульт в несколько раз тяжелее. Это обусловлено возрастными факторами кровеносных сосудов и их стенок, которые не могут быстро восстанавливаться. У новорожденных клетки еще не сформировались. Подобные проблемы со стенками приводят к:
- воспалению черепно-мозговых нервов;
- поражению сосудистой системы;
- кровоизлиянию.

Размер очага поражения
Это главный аспект, который влияет на то, сколько может прожить человек после инсульта. Ткани, подверженные некрозу, восстанавливаются долгое время.
Чем больше пораженная область, тем плачевней прогноз.
Как последствия влияют на исход
Если после инсульта у больного начали развиваться сопутствующие патологии (паралич, онемение или нарушение психологических функций), то длительность жизни уменьшается в несколько раз.
Помимо этого данные последствия создают предпосылки к возникновению пролежней. Пролежни формируют непоправимые процессы в кровообращении всего организма. Психические расстройства требуют круглосуточного ухода за больным, так как он не способен трезво оценивать ситуацию и вовремя принимать лекарственные препараты.
Длительность жизни без движения
Человек, который обездвижен после приступа, не имеет необходимого желания для длительного восстановления. Из-за этой психологической особенности человек не стремиться придерживаться всех норм и процедур, из-за чего мышечная выносливость уменьшается, волокна теряют тонус, а кровоток в конечностях нарушается.
Это в конечном итоге ведет к возникновению тромбов и некрозу тканей, которые отравляют кровь.
Как продлить и улучшить жизнь после ишемического инсульта
Период после приступа ишемии делят на пять периодов:
- Критический этап – первые 72 часа.
- Острый период – 25-30 дней.
- Первый этап восстановления – от 3 – 6 месяцев.
- Второй период восстановления – 12 – 24 месяца.
- Остаточные процессы – От 24 месяцев и более.

Длительность жизни после ишемического инсульта зависит от многочисленных факторов — от размеров поражения головного мозга до лечебных мероприятий. Оказание первой медицинской помощи также влияет на результат восстановления, здесь действует простое правило: чем раньше – тем лучше.
В первый год после ишемического кровоизлияния выживает 65% больных, спустя 5 лет выживает половина, ну а через 10 лет в живых остается лишь четверть.
Продлить жизнь помогут:
- правильный образ жизни;
- диагностика раз в 2 – 3 месяца;
- питание;
- восстановительная гимнастика.
Из рациона питания следует исключить соль, сахар, жирную и мучную пищу, копчености и соусы. В рационе должны преобладать овощи и фрукты, большое количество клетчатки и вегетарианские супы. Питание должно быть дробным, 5 приемов пищи маленькими порциями.
Предотвратить возникновение повторного приступа поможет своевременная диагностика и лечебная физкультура, которая улучшает качество кровотока.
Как продлить и улучшить жизнь после геморрагического инсульта
Прогноз после геморрагического кровоизлияния хуже, последствия тяжелее, жизнь короче. В первые 7 дней после инсульта с организмом человека происходят основные изменения и развиваются осложнения. Больной находится без движения, все болезни обостряются. В некоторых случаях пациента подключают к аппарату искусственной поддержки дыхания.
Только спустя 20 дней становится понятно, сколько сможет прожить человек. Длительность жизни также зависит и от реабилитации, однако стоит понимать, что былые физические возможности не вернуть.
Исследования показывают, что средняя длительность жизни после геморрагического кровоизлияния составляет 2-3 года.
Единственное, что поможет продлить жизнь – постоянный присмотр врачей и своевременная качественная медицинская реабилитация. Также следует изменить рацион питания, исключить стрессовые ситуации и заниматься ЛФК, но только с разрешения врачей.
Инвалидами становятся 50% больных перенесших инсульт, 30% из которых нуждаются в постороннем уходе с помощью сиделки, — это люди, которые становятся привязанными к кровати на всю жизнь.
Среди всех смертей от сердечно-сосудистых заболеваний 27% приходится на мозговой инсульт ишемического генеза.
Читайте также:

