Имунофан при атопическом дерматите
Обновлено: 25.04.2024
Нарушение иммунных механизмов защиты организма приводит к появлению инфекционных осложнений, аутоиммунной патологии, развитию злокачественных опухолей и аллергических заболеваний.
Нарушение иммунных механизмов защиты организма приводит к появлению инфекционных осложнений, аутоиммунной патологии, развитию злокачественных опухолей и аллергических заболеваний. Вторичная иммунная недостаточность часто наблюдается при вирусных, паразитарных и некоторых бактериальных инфекциях, при истощении организма, длительном стрессе, при тяжелых травмах, ожогах, интоксикациях, при лечении онкологических больных химиотерапевтическими средствами или с помощью лучевой терапии, при длительном воздействии вредных факторов в процессе профессиональной деятельности или в неблагоприятных экологических условиях. Полноценная реализация функций иммунокомпетентных клеток во многом определяется их генетической стабильностью. Генетическая стабильность может быть охарактеризована состоянием структуры ДНК иммунокомпетентных клеток и их способностью к репарации ДНК.
За два десятилетия накоплены данные о роли повреждений ДНК клеток крови в развитии вторичных иммунодефицитных состояний при различных заболеваниях. Нами было впервые обнаружено значительное снижение способности лимфоцитов и нейтрофилов периферической крови к репарации ДНК и повышение спонтанного репаративного синтеза ДНК при инфаркте миокарда, аутоиммунных и опухолевых заболеваниях, ряде инфекционных болезней, в том числе герпесе, вирусных гепатитах, неспецифических заболеваниях легких и др. Кроме того, выявлено накопление повреждений в ДНК этих клеток при вышеперечисленных патологических состояниях. Корреляционный анализ позволил заключить, что степень повреждения и нарушения репарации ДНК коррелирует с изменениями лабораторных морфофункциональных показателей состояния иммунной системы. Регистрируемые при изученных заболеваниях изменения в структуре и репарации ДНК лейкоцитов могут обусловливаться токсическими воздействиями эндогенной природы либо индуцироваться при взаимодействии бактериальных, вирусных, опухолевых антигенов или аутоантигенов с клеточной поверхностью. Описанные изменения являются одним из ключевых молекулярно-биологических механизмов формирования иммунной недостаточности и развития вторичных иммунодефицитных состояний.
Раскрытие роли иммунной системы в физиологических и патофизиологических процессах создало предпосылки для разработки методов лечения и профилактики болезней, основанных на направленной регуляции иммунных реакций. Методы регуляции иммунных реакций можно разделить на специфические и неспецифические, учитывая, что многие методы и иммунотропные препараты могут одновременно оказывать влияние на звенья специфического и неспецифического иммунного ответа.
Методы неспецифической иммунотерапии по преимущественной направленности действия можно условно разделить на иммунодепрессивные и иммуностимулирующие. Последние играют ключевую роль в коррекции вторичной иммунной недостаточности.
Необходимость применения иммуностимулирующих средств (иммуномодуляторов) связана не только с патогенетическими особенностями заболеваний, но и с методами их лечения. Антибактериальное лечение инфекционных болезней, химио- и лучевая терапия опухолей, любые оперативные вмешательства и многие другие методы лечения приводят к дальнейшему повреждению структуры ДНК лимфоцитов и гранулоцитов периферической крови, усугубляя вторичную иммунную недостаточность.
Препаратом выбора для лечения таких состояний может быть только иммуномодулятор, способный повышать генетическую стабильность лимфоцитов. Результаты наших исследований показывают, что к таким иммуномодуляторам относится имунофан — регуляторный пептид четвертого поколения. Принципиальным отличием имунофана от многих других иммуномодуляторов является его модулирующее действие на другие системы гомеостаза организма. Данные, полученные нами еще десять лет назад, доказывают, что присутствие имунофана защищает ДНК лимфоцитов при воздействии низких концентраций перекиси водорода. Обработка клеток препаратом повышает их защитный потенциал, оцениваемый по степени повреждения ДНК. При исследовании влияния имунофана на структуру ДНК лимфоцитов и нейтрофилов периферической крови выявлена нормализация этих показателей после завершения патогенетической терапии у больных бруцеллезом. Напротив, использование бруцеллезной вакцины усугубляет степень повреждения.
При терапии имунофаном отмечается также стабилизация уровня продукции свободных форм кислорода фагоцитами до значений физиологической нормы, что позволяет сохранить их резервные возможности к бактериальному киллингу и избежать повреждающего действия на клетки ближайшего окружения [1]. Эффект детоксикации особенно важен для восстановления иммунитета после химиолучевой терапии онкологических больных. Наши исследования убедительно показывают, что в процессе химиотерапии в ядросодержащих клетках крови накапливаются повреждения ДНК, степень которых существенно превышает уровень спонтанных повреждений, в связи с чем обосновано применение имунофана [2]. Действительно, благодаря приему имунофана достигается два эффекта: коррекция окислительно-восстановительного статуса и восстановление иммунной системы организма [1].
Имунофан эффективен в очень низких дозах, для него характерна высокая биодоступность, он не накапливается в организме, оказывает биологическое действие через специфические рецепторы, утилизируется в результате естественных обменных процессов и обладает низкой токсичностью. Именно поэтому мы применяли имунофан при хронических обструктивных заболеваниях легких (ХОЗЛ). Активизация пролиферации и дифференцирования Т-лимфоцитов больных ХОЗЛ под действием имунофана, вероятно, осуществляется альтернативным способом, посредством включения продукции других факторов, контролирующих рост и развитие клеток. Благодаря простагландиннезависимому характеру действия имунофан выглядит более предпочтительным препаратом, чем тимические гормоны, что позволяет избежать выраженных осложнений со стороны очага воспаления и обеспечивает эффективную сочетанную терапию противовоспалительными препаратами нестероидного ряда. Имунофан действует на клетки иммунной системы через различные механизмы. С одной стороны, препарат стимулирует образование ИЛ-2 иммунокомпетентными клетками, с другой — повышает чувствительность лимфоидных клеток к этому лимфокину, что, вероятно, реализуется посредством увеличения плотности соответствующих рецепторов. Имунофан оказывает регулирующее влияние на продукцию медиаторов иммунитета, иммуноглобулинов, в том числе, при недостаточности IgA или гиперпродукции IgE, обеспечивает восстановление пролиферативной активности лимфоцитов у иммунокомпроментированных лиц и стимулирует синтез антителпродуцирующих клеток [1].
Анализ результатов лечения больных хроническими обструктивными заболеваниями показал отсутствие немедленного терапевтического эффекта от применения препарата. Его качество проявилось только при катамнестическом наблюдении в течение трех лет. Длительность ремиссии у пациентов, получавших имунофан, значительно превышала соответствующие сроки, зафиксированные в контрольной группе: на 1,6 месяца у больных бронхиальной астмой и на 2,1 месяца в группе больных хроническим бронхитом. Препарат повышал качество жизни больных, его переносимость оценена как хорошая, поскольку ни у одного из исследуемых нами больных (35 — хроническим бронхитом и 31 — инфекционно-зависимым вариантом бронхиальной астмы) не отмечено побочных эффектов.
Таким образом, иммунофан является новым препаратом, полностью соответствующим принципам патогенетической терапии инфекционных и неинфекционных заболеваний человека. Молекулярно-биологический анализ механизма действия препарата убедительно показывает обоснованность его применения в широкой клинической практике.
Литература
1. Лебедев В. В., Шелепова Т. М., Степанов О. Г. и др. Имунофан — регуляторный пептид в терапии инфекционных и неинфекционных болезней / Под ред. В. И. Покровского. М.: Праминко, 1998. С. 120
2. Москалева Е. Ю., Илюшина Н. А., Тарасов В. Н. и др. Вестник Онкоцентра РАМН, приложение. 1994. С. 57-58
The practice of application of new topical agents to the treatment of atopic dermatitis in children
N.G. Korotky, B.N. Gamayunov, A.A. Tikhomirov State federal facility "Russian State Medical University", Moscow
Ключевые слова: атопический лерматит, наружная терапия, пелиатрическая практика, крем унилерм. Key words: atopic dermatitis, external therapy, pediatric practice, uniderm cream.
Среди всего многообразия средств для наружной терапии кортикостероидные препараты являются наиболее востребованными в силу быстроты развития и выраженности противовоспалительного действия. Можно отметить, что топические препараты глюкокортикостероиды (ГКС) являются одними из самых часто назначаемых пациентам с аллергодерматозами [1].
Доля аллергических поражений кожи в структуре детских заболеваний неуклонно увеличивается. Особенно тревожным является значительный рост аллергических болезней кожи с хроническим и рецидивирующим течением, торпидных к традиционной, в том числе наружной терапии. Среди аллергодерматозов у детей наиболее часто встречается атопический дерматит (АД) [2].
Проблема АД приобретает в последние годы все большее медико-социальное значение, распространенность заболевания неуклонно растет, составляя по некоторым данным в различных странах мира от 6 до 25%, а в России — до 35%. Кроме того, АД является фактором риска развития бронхиальной астмы у детей, поскольку поливалентная сенсибилизация, формирующаяся при АД, сопровождается не только локальным воспалением кожи, но и системным иммунным ответом с вовлечением в процесс различных разделов респираторного тракта [2, 3].
В настоящее время общепризнанна иммунологическая концепция патогенеза АД, основанная на понятии атопии как генетически обусловленной способности организма к выработке высокой концентрации общего и специфических антител класса IgE в ответ на действие аллергенов окружающей среды. Клинически АД характеризуется кожным зудом, возрастным полиморфизмом высыпаний, определенной локализацией, стадийностью и хроническим течением [2,4].
Ведущим механизмом развития АД является изменение соотношения между Т-хелперами первого (Thl) и Т-хелперами второго (Тп2) порядка в пользу последних, что приводит к изменению профиля их цитокиновой секреции и повышенной продукции общего и специфических антител класса IgE, которые фиксируются при помощи Fc-фрагментов к специфическим рецепторам на мембранах тучных клеток и базофилов. При повторном поступлении антиген распознается фиксированными на тучной клетке антителами, происходит активация тучной клетки с высвобождением преформированных медиаторов аллергии — гистамина, серотонина, кининов, которые обусловливают развитие ранней фазы аллергического ответа, проявляющейся у больных АД интенсивным зудом и гиперемией [4].
Затем воспалительный процесс приобретает хроническое течение, что определяется следующими механизмами. Т-клетки памяти способны мигрировать в кожу с последующей экспрессией на кератиноцитах, клетках Лангерганса и эндотелиоцитах, что поддерживает местную активацию Т-клеток. Повторное или постоянное воздействие аллергена вызывает как немедленную, так и позднюю фазы аллергического ответа, а также клеточную пролиферацию по Th-2 типу. В свою очередь клетки Th-2 продуцируют цитокины, которые, с одной стороны, обеспечивают постоянное повышение уровня IgE, а с другой, стимулируют эозинофилы, тучные клетки и макрофаги к высвобождению различных медиаторов воспаления [4].
Поддерживает хроническое течение АД и так называемый зудорасчесный цикл, поскольку зуд является его постоянным симптомом. Кератиноциты, повреждаемые при расчесывании кожи, высвобождают цитокины и медиаторы, которые привлекают клетки в места воспаления в коже. Все это вместе приводит к реализации аллергического воспаления с преимущественной локализацией в коже [4].
Однако воспалительные поражения кожи при АД могут развиваться без участия IgE, тем более что, по данным литературы, приблизительно у 25% больных АД уровень IgE не превышает норму. Безусловно, важную роль играют нейропептиды и лейкотриены, тучные клетки, эозинофилы, кератиноциты, нарушение барьерной функции эпидермиса. Тучные клетки, выделяющие при дегрануляции гистамин, протеазы, простагландины, лейкотриены, серотонин, расположены вблизи окончаний чувствительных нервов в коже и стимулируются не только интерлейкином (ИЛ-) 4, но и нейропептидами, при этом прослеживается возможность психического влияния на манифестацию АД. Эти факторы рассматриваются как особо важные неспецифические механизмы в патогенезе АД [4].
Таким образом, в развитии атопического дерматита участвуют не только иммунные, но и неспецифические (неиммунные) механизмы. Они вместе и определяют своеобразие реакции кожи на действие причинных факторов, выражающееся в особенностях иммунного ответа и гиперреактивности [5].
Секрет успешного применения топических ГКС в лечении АД заключается в их многообразном влиянии на процессы воспаления в коже [6].
Наиболее важными эффектами ГКС являются:
— увеличение связывания гистамина и серотонина в коже и уменьшение чувствительности нервных окончаний к нейропептидам и гистамину;
— угнетение синтеза ИЛ-4, ИЛ-5, ИЛ-13, у-интерферона и других цитокинов;
— уменьшение активности фосфолипазы А2 и продукции эйкозаноидов, а также снижение экспрессии молекул клеточной адгезии и чувствительности эндотелия к медиаторам аллергии;
— торможение миграции эозинофилов и пролиферации Т-лимфоцитов; снижение сосудистой проницаемости и нарушений микроциркуляции.
Однако, несмотря на все положительные эффекты топических ГКС, не следует забывать, что при неправильном их применении велика возможность развития как местных, так и системных побочных эффектов. К числу местных побочных эффектов, встречающихся при использовании наружных ГКС, относятся атрофия кожи; акнеформная сыпь, фолликулиты; периоральный дерматит; телеангиэктазии; стрии; гипертрихоз; присоединение вторичной инфекции.
Возможны также и системные побочные эффекты, такие как подавление функции коркового вещества надпочечников, задержка роста, синдром Иценко—Кушинга и др., которые, однако возникают очень редко.
В педиатрической практике при назначении отдается предпочтение негалогенизированным препаратам ГКС последнего поколения. Они обладают высокой эффективностью и безопасностью, возможностью применения 1 раз в сутки, в том числе у детей раннего возраста.
С целью оценки клинической эффективности, переносимости и безопасности мы изучали результаты применения крема Унидерм («Акрихин», Россия) в наружной терапии АД различной степени тяжести у детей в возрасте от 6 мес. до 17 лет. Нами были поставлены следующие задачи исследования:
1. Оценить безопасность, переносимость и терапевтический эффект крема Унидерм при лечении 30 детей с АД.
2. На ограниченной группе пациентов (п=10) изучить влияние крема Унидерм (мометазона фуроат) на функцию гипоталамо-гипофизарно-надпочечниковой системы (определение уровня кортизола в плазме крови до, через 1 и 2 нед. ежедневного применения крема Унидерм). В данное исследование были включены 30 детей с различными клиническими формами АД (эритематозная,эритематозно-сквамознаяиэритематозно-сквамозная с лихенификацией) легкой, средней и тяжелой степени тяжести в возрасте от 6 мес. до 17 лет — 14 девочек и 16 мальчиков (табл. 1).
У всех детей был подтвержденный АД в состоянии обострения кожного процесса с легкой, средней или тяжелой степенью тяжести заболевания. Длительность заболевания у наблюдаемых детей колебалась от 5 мес до 16 лет.
В исследование не включали пациентов, не соответствующих указанному возрасту, а также пациентов, соответствующих критериям включения, но получающие системную и местную терапию основного заболевания следующими препаратами: ГКС (преднизолон, дексаметазон и др.); цитостатиками (циклоспорин); любыми топическими ГКС и их комбинациями, а также увлажняющими местными средствами менее чем за 7 дней до момента включения в исследование.
Крем Унидерм наносили на пораженные участки кожи 1 раз в день. Допускалось прекращение использования препарата в сроки после окончания 1-й или 2-й нед. от начала лечения при достижении у больного полной клинической ремиссии.
Таблица 1. Характеристика обследованных больных
Возраст
Девочки
Мальчики
Всего
От 6 мес. до 5 лет
От 11 до 17 лет
Таблица 2. Распределение больных АД на группы
в зависимости от значения коэффициента SCORAD (kS) при первичном осмотре
Группы больных
Степень тяжести заболевания (kS)
Среднее значение (kS)
Число больных
У 10 пациентов с тяжелой степенью тяжести АД крем Унидерм применяли ежедневно в течение 2 нед. До начала исследования, через 1 и 2 нед. наружной терапии у этих же больных брали кровь (определение уровня кортизона в плазме) для оценки влияния крема Унидерм на функцию гипоталамо-гипофизарно-надпочечниковой системы (системная безопасность).
Общая продолжительность исследования составила 3 нед. и включала первичный клинический осмотр с контрольными осмотрами через 1,2 и 3 нед. от начала лечения.
Кроме того, в процессе терапии больные по показаниям получали антигистаминные препараты, седативную микстуру, туширование расчесов 5% раствором перманганата калия или 1% раствором метиленового синего. В наружной терапии применялся только крем Унидерм.
Для объективной оценки степени тяжести течения заболевания и эффективности проводимой терапии у наблюдаемых детей мы использовали коэффициент SCORAD (kS). Этот коэффициент объединяет площадь поражения кожи, степень выраженности объективных (эритема, образование папул/ везикул, мокнутие, экскориации, лихенификация, сухость кожи) и субъективных (зуд кожи и/или нарушение сна) симптомов. При максимальной распространенности процесса и выраженности объективных и субъективных симптомов SCORAD= 103, а в их полное отсутствие SCORAD=0.
Используя коэффициент SCORAD (kS), объективно оценивали степень тяжести кожного процесса у каждого обследуемого ребенка: 0 < kS < 20 — легкая степень, 20 < kS < 40 — средняя степень, kS >40 — тяжелая степень заболевания.
Для определения коэффициента SCORAD (kS) применяли специально разработанную компьютерную программу Калькулятор SCORAD.
На каждого больного была заведена индивидуальная карта, в которой оценивалась динамика кожного процесса в ходе исследования (kS до и после применения крема Унидерм).
Эффективность терапии оценивали по следующим параметрам: клиническая ремиссия, значительное улучшение, улучшение, без эффекта, ухудшение и отражали в виде графика изменения среднего значения SCORAD во времени на 8, 15 и 22-й дни от начала исследования для каждой степени тяжести заболевания. По горизонтали отмечали время лечения в днях, а по вертикали — среднее значение SCORAD (рис. 1).
Рис. 1. Динамика среднего значения kS у детей, страдающих атопическим дерматитом, в процессе 3-недельного исследования крема Унидерм.
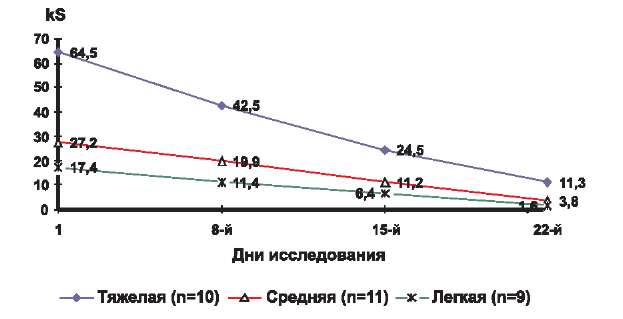
В соответствии с полученными значениями коэффициента SCORAD на первичном осмотре до начала лечения кремом Унидерм мы разделили всех участвовавших в исследовании детей (п=30) на 3 группы по степени тяжести течения кожного процесса (табл. 2).
В 1-ю группу — с легкой степенью тяжести течения заболевания (kS до 20) — вошли 9 больных со средним значением kS в целом по группе 17,4.
Во 2-ю группу вошли 11 пациентов со средней степенью тяжести кожного процесса. Среднее значение kS в целом по группе равно 27,2.
В 3-ю группу объединили 10 детей с тяжелым течением заболевания (kS > 40). Среднее значение kS в этой группе равнялось 64,5.
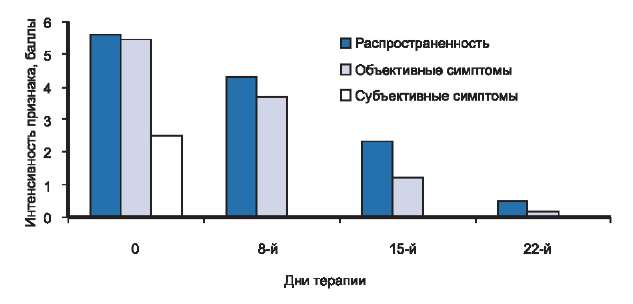
Клиническая картина АД у больных 1-й группы характеризовалась ограниченной площадью поражения кожных покровов. Патологический процесс локализовался в локтевых сгибах, подколенных ямках, периоральной области и был представлен слабо выраженной эритемой, единичными мелко папулезными элементами, экскориациями, умеренно выраженной сухостью кожи и мелко пластинчатым шелушением. Кроме того, отмечался незначительный зуд кожи и лихенификация в очагах поражения.
Среди преобладающих симптомов у пациентов 2-й группы мы выделили более интенсивный зуд кожи по сравнению с таковым в предыдущей группе больных, в ряде случаев сопровождающийся нарушением сна. Кожный процесс носил распространенный характер и локализовался на коже лица (периорбитальная и периоральная области), передней поверхности шеи, локтевых сгибах, сгибательной и разгибательной поверхностях лучезапястных суставов, подколенных ямках. Отмечалась более выраженная острота воспалительной реакции: умеренно выраженные эритема и отек, папулезные элементы ярко-красного цвета, серозно-геморрагические корочки, экскориации, трещины на фоне очагов лихенефикации, выраженной сухости кожи и значительного шелушения, как в очагах АД, так и на не пораженной коже.
У 10 детей, составивших 3-ю группу, патологический процесс локализовался на коже лица, передне- и заднебоковых поверхностей шеи, туловища, верхних и нижних конечностей, где на фоне значительно выраженной отечной эритемы отмечались многочисленные папулезные элементы, серозногеморрагические корочки, экскориации, трещины. При слиянии папулезных элементов отмечалась выраженная лихенификация кожи. Больные жаловались на интенсивный зуд кожи, который у 2 пациентов сопровождался выраженным нарушением сна.
Рис. 2. Динамика распространенности, объективных и субъективных симптомов у больных с тяжелой степенью тяжести атопического дерматита в процессе исследования.
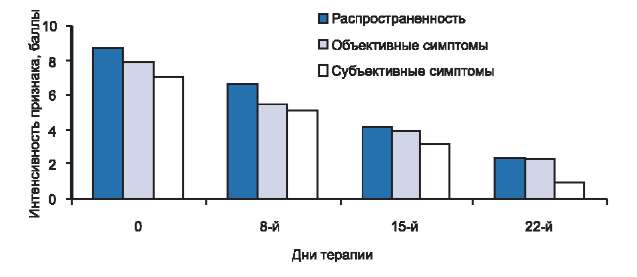
Рис. 3. Динамика распространенности, объективных и субъективных симптомов у больных со средней степенью тяжести атопического дерматита в процессе исследования.
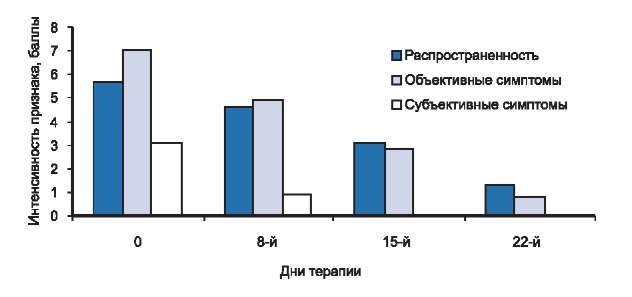
Рис. 4. Динамика распространенности, объективных и субъективных симптомов у больных с легкой степенью тяжести атопического дерматита в процессе исследования.
Обобщая результаты 3-недельного исследования крема Унидерм в терапии детей, больных АД легкой, средней и тяжелой степени тяжести, мы констатировали клиническую ремиссию у 15 детей (50,0%), значительное улучшение — у 11 (36,7%), улучшение — у 4 (13,3%) (табл. 3). Случаев развития побочных эффектов, осложнений, а также отсутствия клинического эффекта и/или ухудшения в течении заболевания на фоне наружной терапии кремом Унидерм не наблюдали.
Таблица 3. Клиническая эффективность применения крема Унидермв терапии детей, больных АД
Форма выпуска, упаковка и состав препарата Имунофан
| Суппозитории ректальные | 1 супп. |
| аргинил-альфа-аспартил-лизил-валил-тирозил-аргинин | 90 мкг |
5 шт. - упаковки ячейковые контурные (1) - пачки картонные.
Фармакологическое действие
Иммуностимулирующий препарат. Препарат обладает иммунорегулирующим, детоксикационным, гепатопротекторным действием и вызывает инактивацию свободнорадикальных перекисных соединений.
Фармакологическое действие основано на достижении трех основных эффектов: коррекция иммунной системы, восстановление баланса окислительно-антиокислительной реакции организма и ингибирование множественной лекарственной устойчивости, опосредованной белками трансмембранного транспортного насоса клетки.
Действие препарата начинает развиватся в течение 2-3 ч (быстрая фаза) и продолжается до 4 месяцев (средняя и медленные фазы).
В течение быстрой фазы (продолжительность до 2-3 сут) проявляется прежде всего детоксикационный эффект – усиливается антиоксидантная защита организма путем стимуляции продукции церулоплазмина, лактоферрина, активности каталазы; препарат нормализует перекисное окисление липидов, ингибирует распад фосфолипидов клеточной мембраны и синтез арахидоновой кислоты с последующим снижением уровня холестерина в крови и продукции медиаторов воспаления. При токсическом и инфекционном поражении печени препарат предотвращает цитолиз, снижает активность трансаминаз и уровень билирубина в сыворотке крови.
В течение средней фазы (начинается через 2-3 сут продолжительность – до 7-10 сут) происходит усиление реакций фагоцитоза и гибели внутриклеточных бактерий и вирусов.
В течение медленной фазы (начинает развиваться на 7-10 сутки, продолжительность до 4 месяцев) проявляется иммунорегуляторное действие Имунофана – восстановление нарушенных показателей клеточного и гуморального иммунитета. В этот период наблюдается нормализация иммунорегуляторного индекса, отмечается увеличение продукции специфических антител. Влияние Имунофана на продукцию специфических противовирусных и антибактериальных антител эквивалентно действию некоторых лечебных вакцин. В отличие от последних препарат не оказывает существенного влияния на продукцию реагиновых антител класса IgE и не усиливает реакцию гиперчувствительности немедленного типа; Имунофан стимулирует образование IgA при его врожденной недостаточности.
Имунофан эффективно подавляет множественную лекарственную устойчивость опухолевых клеток и повышает их чувствительность к действию цитостатических препаратов.
Показания препарата Имунофан
Профилактика и лечение у взрослых и детей старше 2 лет:
- иммунодефицитных и токсических состояний;
- хронических воспалительных заболеваний различной этиологии.
У взрослых в качестве адъюванта при вакцинации против бактериальных и вирусных инфекций.
Открыть список кодов МКБ-10| Код МКБ-10 | Показание |
| A07.2 | Криптоспоридиоз |
| A23 | Бруцеллез |
| A36 | Дифтерия |
| A40 | Стрептококковый сепсис |
| A41 | Другой сепсис |
| A56.0 | Хламидийные инфекции нижних отделов мочеполового тракта |
| A56.1 | Хламидийные инфекции органов малого таза и других мочеполовых органов |
| A60 | Аногенитальная герпетическая вирусная инфекция [herpes simplex] |
| B00 | Инфекции, вызванные вирусом простого герпеса [herpes simplex] |
| B02 | Опоясывающий лишай [herpes zoster] |
| B18.0 | Хронический вирусный гепатит В с дельта-агентом |
| B18.1 | Хронический вирусный гепатит B без дельта-агента |
| B18.2 | Хронический вирусный гепатит С |
| B24 | Болезнь, вызванная вирусом иммунодефицита человека [ВИЧ], неуточненная |
| B25 | Цитомегаловирусная болезнь |
| B45 | Криптококкоз |
| B58 | Токсоплазмоз |
| B59 | Пневмоцистоз (B17.3*) |
| B97.7 | Папилломавирусы как причина болезней, классифицированных в других рубриках |
| C96.9 | Злокачественное новообразование лимфоидной, кроветворной и родственных им тканей неуточненное |
| D14.1 | Доброкачественное новообразование гортани |
| I33 | Острый и подострый эндокардит |
| J44 | Другая хроническая обструктивная легочная болезнь |
| K81.1 | Хронический холецистит |
| K86.1 | Другие хронические панкреатиты |
| L40 | Псориаз |
| M05 | Серопозитивный ревматоидный артрит |
| T30 | Термические и химические ожоги неуточненной локализации |
| T79.3 | Посттравматическая раневая инфекция, не классифицированная в других рубриках |
Режим дозирования
Ректально. Разовая и суточная доза – 100 мкг (1 суппозиторий).
У детей со злокачественным заболеванием кроветворной или лимфоидной ткани: 1 раз/сут, ежедневно, курс лечения 10-20 суппозиториев. Назначение препарата следует проводить в течение всего курса химио-лучевой терапии и после окончания курса для профилактики развития токсикоза.
В комплексной терапии детей с паппиломатозом гортани и ротоглотки: 1 раз/сут, ежедневно, курс лечения 10 суппозиториев.
При оппортунистических инфекциях (цитомегаловирусная и герпетическая инфекция, токсоплазмоз, хламидиоз, пневмоцистоз, криптоспоридиоз): 1 раз/сут, ежедневно, курс лечения 10 суппозиториев.
В комплексной терапии ВИЧ-инфекции: 1 раз/сут, ежедневно, курс лечения 15-20 суппозиториев. При необходимости следует проводить повторные курсы через 2-4 недели.
При хроническом вирусном гепатите и хроническом бруцеллезе: 1 раз/сут, ежедневно, курс лечения 15-20 суппозиториев, для предотвращения рецидива следует проводить повторные курсы через 2-3 месяца.
При лечении ожогов III-IV степени с явлениями токсемии, септикотоксемии, у хирургических больных с септическим эндокардитом, длительно незаживающими ранами конечностей, гнойно-септическими осложнениями: 1 раз/сут, ежедневно, курс лечения 7-10 суппозиториев, при необходимости курс препарата следует продолжать до 20 суппозиториев.
При лечении псориаза: 1 раз/сут, ежедневно, курс лечения 15-20 суппозиториев.
Форма выпуска, упаковка и состав препарата Имунофан
| Спрей назальный дозированный | 1 доза |
| аргинил-альфа-аспартил-лизил-валил-тирозил-аргинин | 50 мкг |
40 доз - флаконы пластиковые с дозирующим устройством (1) - пачки картонные.
Фармакологическое действие
Препарат обладает иммунорегулирующим, детоксикационным, гепатопротекторным действием и вызывает инактивацию свободнорадикальных и перекисных соединений. Фармакологическое действие основано на достижении 3 основных эффектов: коррекции иммунной системы, восстановления баланса окислительно-антиокислительной реакции организма и ингибирования множественной лекарственной устойчивости, опосредованной белками трансмембранного транспортного насоса клетки.
Действие препарата начинает развиваться в течение 2-3 ч (быстрая фаза) и продолжается до 4 месяцев (средняя и медленная фазы).
В течение быстрой фазы (продолжительность - до 2-3 сут) проявляется, прежде всего, детоксикационный эффект - усиливается антиоксидантная защита организма путем стимуляции продукции церулоплазмина, лактоферрина, активности каталазы; препарат нормализует перекисное окисление липидов, ингибирует распад фосфолипидов клеточной мембраны и синтез арахидоновой кислоты с последующим снижением уровня холестерина крови и продукции медиаторов воспаления. При токсическом и инфекционном поражении печени препарат предотвращает цитолиз, снижает активность трансаминаз и уровень билирубина в сыворотке крови.
В течение средней фазы (начинается через 2-3 сут, продолжительность - до 7-10 сут) происходит усиление реакций фагоцитоза и гибели внутриклеточных бактерий и вирусов.
В течение медленной фазы (начинает развиваться на 7-10 сут, продолжительность до 4 месяцев) проявляется иммунорегулирующее действие препарата - восстановление нарушенных показателей клеточного и гуморального иммунитета. В этот период наблюдается восстановление иммунорегуляторного индекса, отмечается увеличение продукции специфических антител. Влияние препарата на продукцию специфических противовирусных и антибактериальных антител эквивалентно действию лечебных вакцин. В отличие от последних препарат не оказывает существенного влияния на продукцию реагиновых антител класса IgE и не усиливает реакцию повышенной чувствительности немедленного типа. Имунофан стимулирует образование IgA при его врожденной недостаточности.
Имунофан эффективно подавляет множественную лекарственную устойчивость опухолевых клеток и повышает их чувствительность к действию химиотерапевтических препаратов.
Показания препарата Имунофан
- применяют у взрослых и детей старше 2-х лет для профилактики и лечения иммунодефицитных и токсических состояний, острых и хронических инфекционно-воспалительных заболеваний.
| Код МКБ-10 | Показание |
| A23 | Бруцеллез |
| A56.0 | Хламидийные инфекции нижних отделов мочеполового тракта |
| A56.1 | Хламидийные инфекции органов малого таза и других мочеполовых органов |
| A60 | Аногенитальная герпетическая вирусная инфекция [herpes simplex] |
| B00 | Инфекции, вызванные вирусом простого герпеса [herpes simplex] |
| B02 | Опоясывающий лишай [herpes zoster] |
| B18.0 | Хронический вирусный гепатит В с дельта-агентом |
| B18.1 | Хронический вирусный гепатит B без дельта-агента |
| B18.2 | Хронический вирусный гепатит С |
| B24 | Болезнь, вызванная вирусом иммунодефицита человека [ВИЧ], неуточненная |
| B25 | Цитомегаловирусная болезнь |
| B38 | Кокцидиоидомикоз |
| B58 | Токсоплазмоз |
| B59 | Пневмоцистоз (B17.3*) |
| D84.9 | Иммунодефицит неуточненный |
Режим дозирования
Интраназально. При использовании флакон следует держать вертикально, распылителем вверх. Снять защитный колпачок с распылителя. Перед первым применением заполнить дозирующий насос путем нажатия на широкий ободок распылителя 3-4 раза. Вставить распылитель в носовой ход при вертикальном положении головы. Однократно нажать широкий ободок распылителя до упора. В одной дозе препарата содержится 50 мкг имунофана. Суточная доза не должна превышать 200 мкг.
В комплексной терапии острых и хронических инфекционно-восиалительных заболеваний, сопровождающихся симптомами интоксикации и иммунодефицитного состояния , Имунофан назначают по 1 дозе (50 мкг) в каждый носовой ход 2 раза/сут, ежедневно в течение 10-15 дней.
При оппортунистических инфекциях (цитомегаловирусная и герпетическая инфекция, токсоплазмоз, хламидиоз, пневмоцистоз, криптоспоридиоз):
- по 1 дозе (50 мкг) в каждый носовой ход 2 раза/сут, ежедневно, курс лечения 10-15 дней. При необходимости возможно повторение курса через 2-4 недели.
При хроническом вирусном гепатите и хроническом бруцеллезе :
- по 1 дозе (50 мкг) в каждый носовой ход 1 раз/сут, ежедневно, курс лечения 10-15 дней, для предотвращения рецидива следует проводить повторные курсы через 4 - 6 месяцев.
В схеме лечения больных ВИЧ-инфекцией :
- 1 дозе (50 мкг) в каждый носовой ход 1 раз/сут, ежедневно, в течение 10-15 дней. При необходимости возможно повторение курса через 2-4 недели.
При лечении онкологических больных в схеме радикального комбинированного лечения (химио-лучевая терапия и операции):
У больных с распространенным опухолевым процессом (III- IV стадии) различной локализации в плане комплексной или симптоматической терапии:

Атопический дерматит — это хроническое воспалительное заболевание кожи, которое проявляется зудящими красными пятнами, сыпью, шелушением и сухостью. Это заболевание диагностируется у 30% детей и у 10% взрослых. Однако, зачастую атопическому дерматиту не уделяется должного внимания, и некорректное лечение этой болезни может замедлять наступление ремиссии и ухудшать общий уровень здоровья. О 5 самых распространенных ошибках в тактике лечения рассказывает дерматолог Анна Трушина.
Ошибка №1. Излишняя диагностика, направленная на выявление «некожных» причин.
Причины развития атопического дерматита кроются в генетически обусловленных особенностях:
1. Со стороны кожи — связаны с нарушением барьерной функции.
2. Со стороны иммунной системы. В ответ на проникновение раздражителей и аллергенов через нарушенный кожный барьер формируется воспаление.
Ошибка №2. Поиск причинного аллергена.
Атопический дерматит не является аллергическим заболеванием по своей природе. Однако, аллергические реакции могут сочетаться с атопическим дерматитом, как сопутствующее заболевание. Так происходит примерно у 20-30% пациентов.
Поэтому сам по себе атопический дерматит не является поводом для сдачи дорогостоящих панелей на специфические аллергены, а анализ должен сдаваться только при подозрении на конкретную аллергическую реакцию у части пациентов.
Ошибка №3. Соблюдение необоснованной диеты.
Часто атопический дерматит становится поводом для назначения строгой “гипоаллергенной” диеты. Детский рацион становится однообразным и скучным. Однако, такие пищевые ограничения не обоснованы с научной точки зрения и не приносят желаемого результата, даже если параллельно есть аллергия.
Помимо отсутствия эффекта, строгая диета способна нанести вред организму. Она приводит к дефициту важных нутриентов, минералов и витаминов, что может негативно сказаться на общем состоянии здоровья ребенка. Поэтому детям с атопическим дерматитом нужно питаться разнообразно и сбалансированно. Из рациона исключаются только те продукты, роль которых четко доказана с обострением патологического процесса. Аналогичные правила применимы и к питанию мамы, если малыш находится на грудном вскармливании.
Ошибка №4. Нерациональный уход за кожей.
Основа лечения атопического дерматита это восстановление барьерной функции кожи и устранение воспаления. Поэтому назначаются такие средства, которые помогают УВЛАЖНИТЬ и смягчить кожный покров и удержать влагу внутри него, и тем самым улучшить защитные свойства кожи. В комплексе используются также мероприятия, которые уменьшают вероятность развития воспалительного процесса, т.е. ограничивается контакт кожи с потенциальными агрессорами из внешней среды.
Чтобы реализовать перечисленные выше цели, требуется тщательный и бережный уход за кожей ребенка-атопика с использованием ЭМОЛЕНТОВ. Это специальные средства, лосьоны, кремы, бальзамы, которые при нанесении на кожу смягчают и увлажняют ее, способствуют заполнению межклеточных пространств в коже, восстанавливая ее барьерные свойства.
Важно понимать, что использования простых детских кремов 1-2 раза в день может быть недостаточно. Для правильного ухода требуется нанесение специальных эмолентов в достаточном объеме. Они распределяются толстым (!) слоем как на проблемные, так и на визуально неизмененные участки кожи. При этом, кратность нанесения напрямую зависит от состояния кожи. Требуется использовать эмоленты столько раз в течение дня, чтобы весь день наощупь кожа оставалось гладкой, мягкой и без шелушения.
Ошибка №5. Отказ от «гормонов».
При атопическом дерматите внутри кожи происходит воспалительный процесс (само слово “дерматит” в дословном переводе на русский означает воспаление кожи). Именно поэтому в период обострения используются противовоспалительные наружные средства, которые позволяют остановить воспаление. К таким средствам относят наружные глюкокортикостероиды. Однако многие родители отказываются от этих «гормонов» из-за стероидофобии (боязни использования стероидов).
Топические (т.е. используемые наружно: лосьоны, эмульсии, мази, кремы) кортикостероиды на протяжении не одного десятилетия используются в лечении атопического дерматита. За это время они продемонстрировали высокую эффективность и высокий профиль безопасности.
Если же родители не используют кортикостероиды в тех случаях, когда к этому есть показания, или делают это нерационально (назначают самостоятельно без учета степени и формы кожного воспаления, самостоятельно отменяют гормон раньше необходимого срока без контроля врача), то это может привести к ухудшению состояния кожи, формированию очагов хронического воспаления и другим местным осложнениям.
Заключение
Читайте также:

