Иммунные расстройства при болезнях кожи реферат
Обновлено: 26.04.2024
Меланома кожи, от древнегреческого «melas» (черный) и «oma» (опухоль), агрессивное злокачественное образование, развивающееся в результате необратимого генетического перерождения меланобластов и меланоцитов. Данные клетки продуцируют пигмент меланин и отвечают за цвет кожи, способность к загару и образование невусов (родинок). На протяжении последних десятилетий наблюдается неуклонный рост заболеваемости. Эту тенденцию чаще всего объясняют возросшим воздействием ультрафиолетовых лучей и модой на загар.
Меланома, что это такое?
Меланоциты синтезируют пигменты, отвечающие за окрашивание кожи, цвет глаз, волос. Пигментированные образования, переполненные меланином, называются родинками и могут проявляться в течение всей жизни. Определенные причинные факторы экзогенного (от греч. «exo» — внешнего) и эндогенного («endo» — внутреннего) характера способны вызвать озлокачествление невусов. Вследствие этого, риску развития меланомы подвергаются участки тела, где имеются врожденные или приобретенные невусы: кожа, реже слизистые оболочки и сетчатка глаза. Измененные клетки способны бесконтрольно размножаться и расти, формируя опухоль, метастазируя. Чаще всего, среди доброкачественных «собратьев», обнаруживают одиночное злокачественное новообразование.

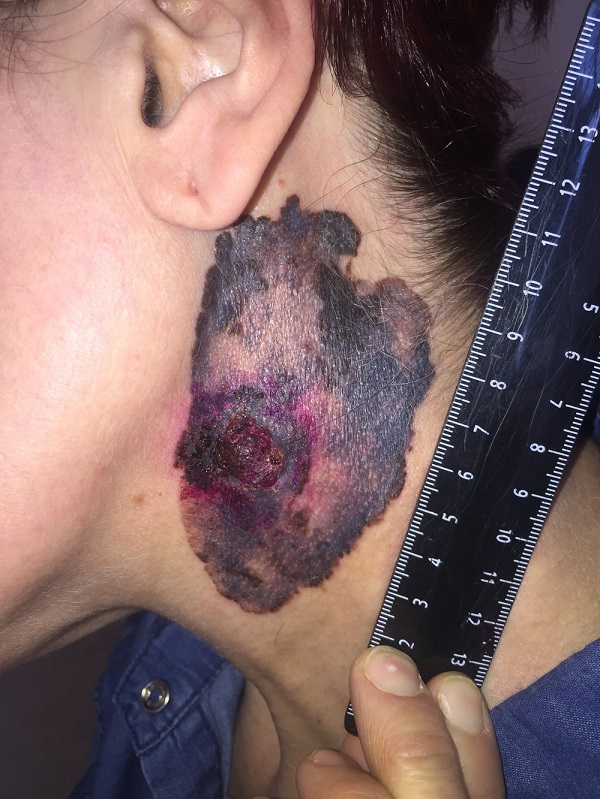
Клиническая картина разнообразна. Размеры, очертание, поверхность, пигментация, плотность опухоли варьируются в широких пределах. Любые изменения, происходящие с родинкой, должны насторожить.
Характерные черты
Опухоль меланома, развивающаяся из невуса, отличается продолжительным нарастанием изменений (вплоть до нескольких лет) и последующей агрессивной трансформацией (1-2 месяца). Ранняя самодиагностика и своевременный осмотр у специалиста помогут выявить симптомы меланомы:
- Гладкая зеркальная поверхность, с исчезновением кожных борозд.
- Увеличение размеров, рост по поверхности.
- Неприятные ощущения в области родинки: зуд, покалывание, жжение.
- Сухость, шелушение.
- Изъязвление, кровотечение.
- Признаки воспалительного процесса в области родинки и окружающих ее тканей.
- Появление дочерних образований.
Внезапное появление подкожных уплотнений и узелков также может свидетельствовать о развивающемся заболевании.
Клиническая классификация. Виды меланомы
Меланома проявляется в различных формах, выделяют 3 основных типа:
Опухоль меланоцитарного происхождения. Наиболее часто встречающееся заболевание (от 70 до 75% случаев) среди людей европеоидной расы, среднего возраста. Сравнительно небольшая, сложной формы с неровными краями. Окрас неравномерный, рыже-бурый или бурый, с мелкими вкраплениями синюшного оттенка. Новообразование имеет тенденцию к дефекту ткани, сопровождающемуся выделениями (чаще кровянистыми). Рост возможен как по поверхности, так и вглубь. Переход к фазе вертикального роста может занимать месяцы и даже годы.
Как выглядит меланома на фото?
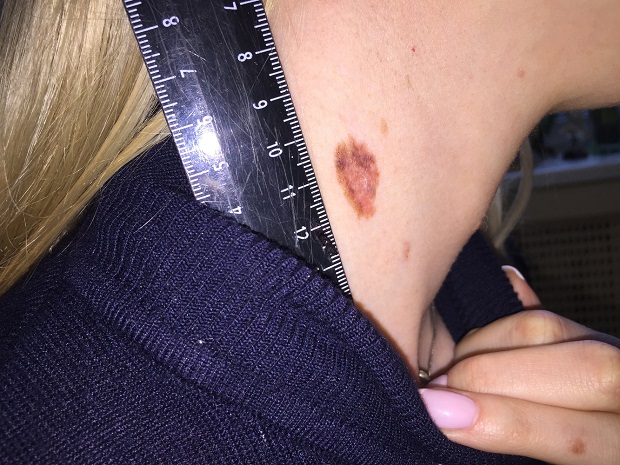
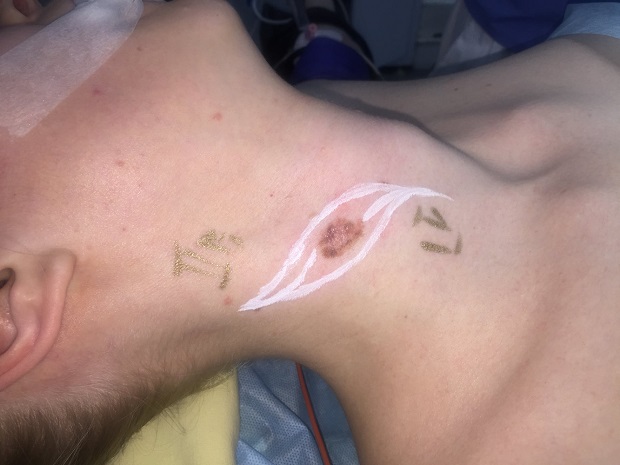
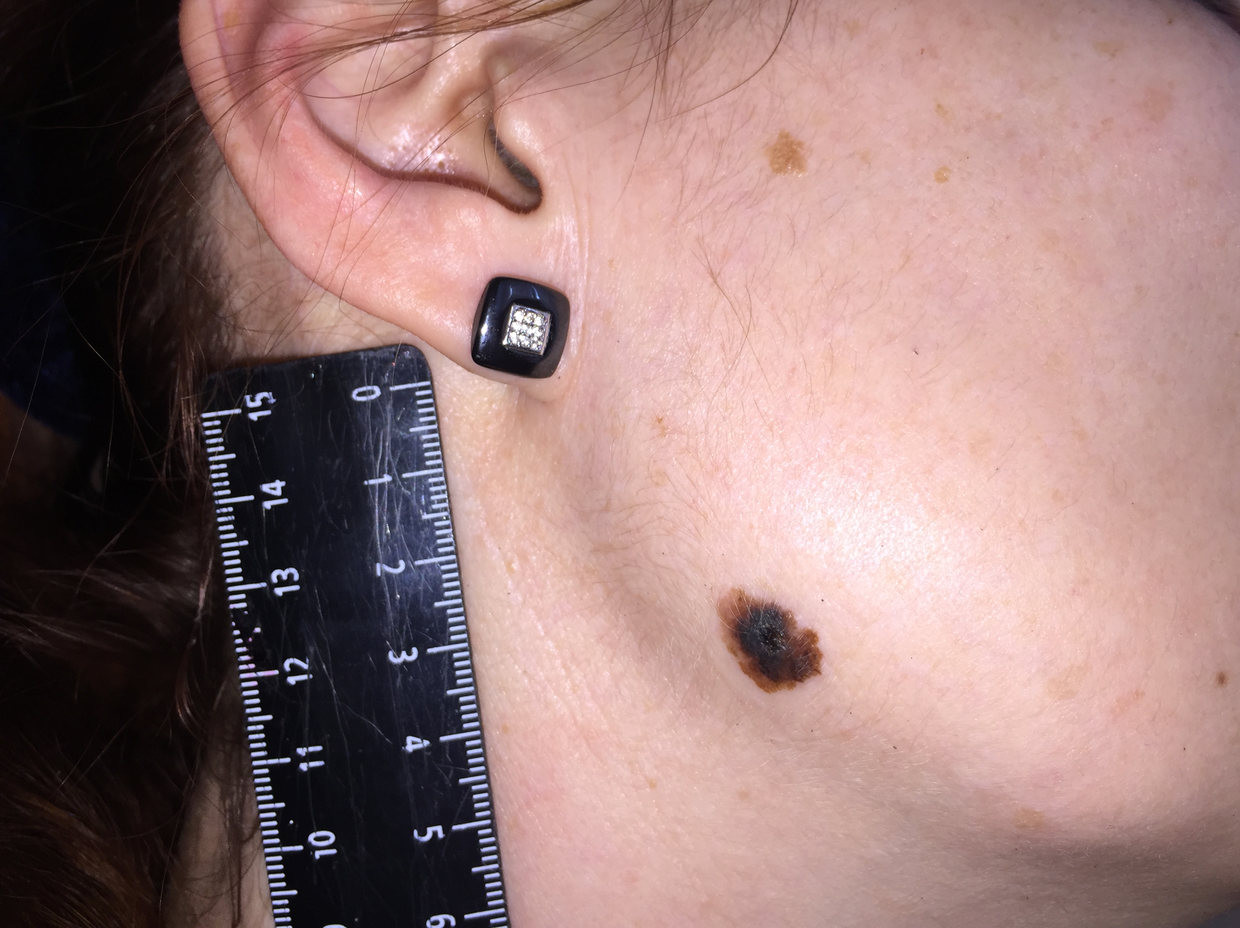
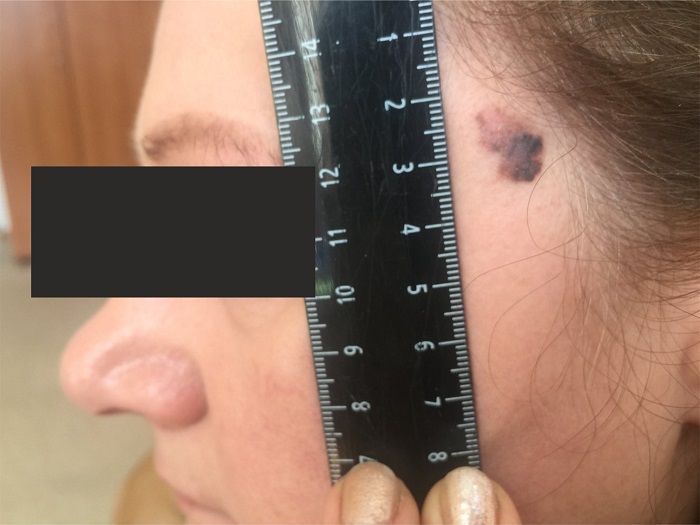
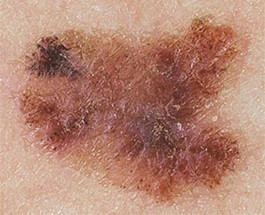
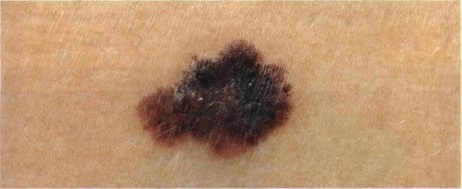
Нодулярное (уменьшительное от лат. «nodus» — узел) образование встречается реже (14-30%). Наиболее агрессивная форма. Рак меланома характеризуется быстрым ростом (от 4 месяцев до 2 лет). Развивается на объективно неизмененной коже без видимых повреждений или из пигментного невуса. Рост вертикальный. Окрас равномерный, темно-синий или черный. В редких случаях подобная опухоль, имеющая сходство с узелком или папулой может быть не пигментированной.
Заболеванию подвержены лица пожилого возраста (после 60 лет) и выявляется в 5-10% случаев. Открытые участки кожного покрова (лицо, шею, руки) захватывают узелки темно-синего, темно- или светло-коричневого цвета диаметром до 3мм. Медленный радиальный рост опухоли в верхних отделах кожи (20 лет и дольше до вертикальной инвазии в глубокие слои дермы) может захватывать волосяные фоликулы.
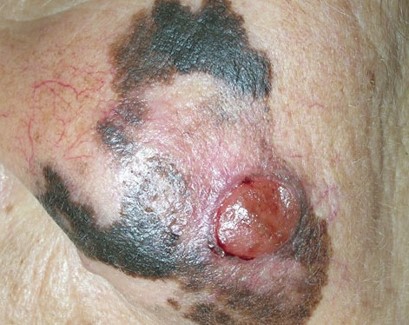
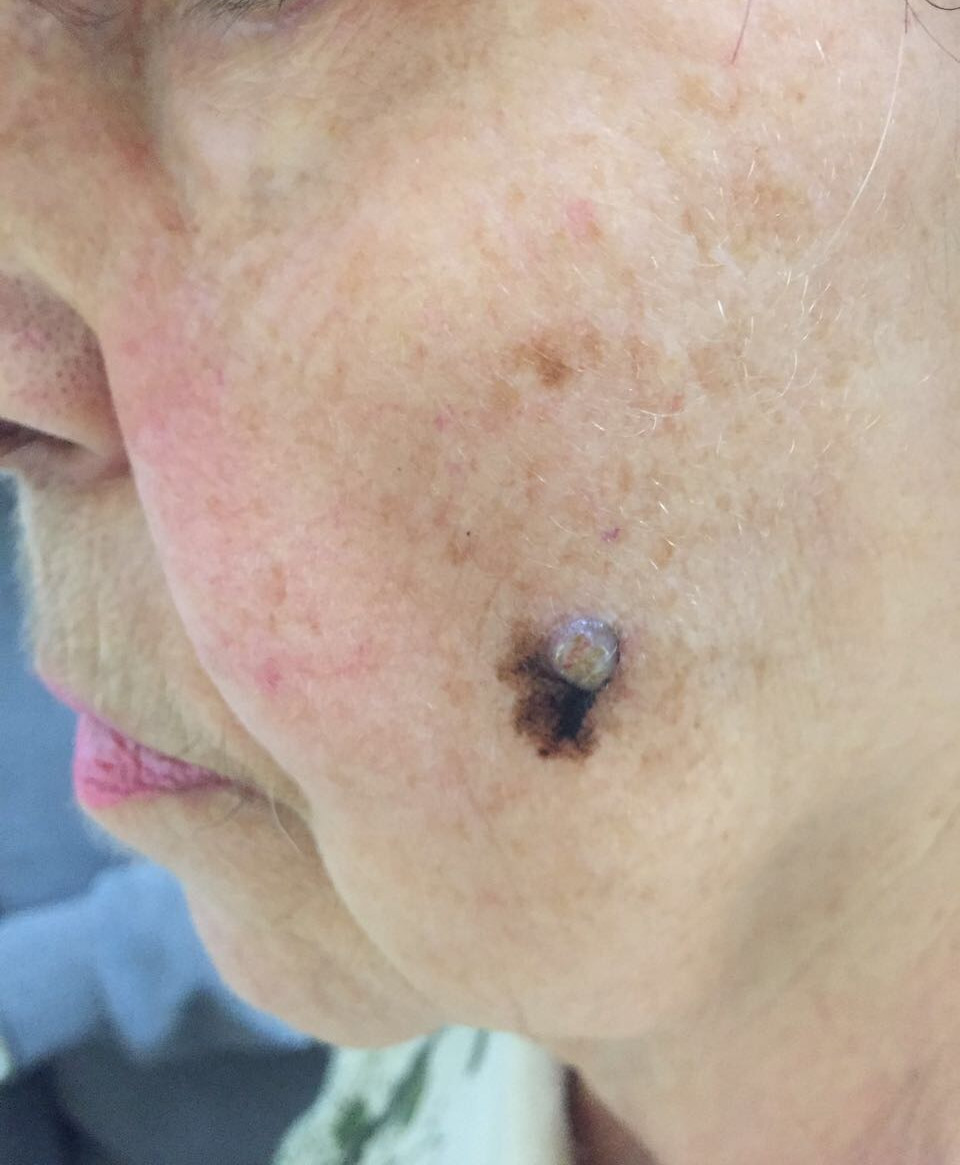
Первые признаки меланомы
Меланома – это приобретение клетками неблагоприятных признаков малигнизации (свойств озлокачествления), выраженное различными симптомами.
Для удобства запоминания признаков меланомы используют правило «ФИГАРО»:
Форма – вздутая над поверхностью;
Изменения – ускоренный рост;
Границы – ажурные, неправильные, изрезанные;
Асимметрия – отсутствие зеркальной схожести двух половинок образования;
Размер – критической величиной считается образование диаметром более, чем 6 мм;
Окраска – неравномерность цвета, включение беспорядочных пятен черного, синего, розового, красного цвета.
В широкой практике также популярен англоязычный вариант, суммирующий основные, наиболее типичные признаки – «правило ABCDE»:
Asymmetry – асимметричность, при которой, если провести воображаемую черту, делящую образование пополам, одна половина не будет похожа на другую.
Border irregularity – край неровный, фестончатый.
Color – цвет, отличный от других пигментных образований. Возможны вкрапления участков синего, белого, красного цветов.
Diameter – диаметр. Любое образование более 6 мм требует дополнительного наблюдения.
Evolution – изменчивость, развитие: плотности, структуры, размера.

Без специальных исследований сложно определить тип невуса, но вовремя замеченные изменения в характере пятна помогут обнаружить озлокачествление.
Диагностика
- Визуальный метод. Осмотр кожных покровов, с использованием «правила злокачественности».
- Физический метод. Пальпация доступных групп лимфоузлов.
- Дерматоскопия. Оптическое неинвазивное поверхностное исследование эпидермиса при помощи специальных приборов, дающих 10-40-кратное увеличение.
- Сиаскопия. Аппаратный спектрофотометрический анализ, заключающийся в интракутантном (глубинном) сканировании образования.





- Рентген.
- УЗИ внутренних органов и регионарных лимфоузлов.
- Биопсия. Возможен как забор образования целиком, так и его части (эксцизионная или инцизионная).
Стадии меланомы
Опухоль имеет несколько стадий развития.
- При нулевой и первой – клетки опухоли располагаются во внешнем слое дермы (локально);
- На второй и третьей – развитие изъязвлений в поражении, распространением на ближайшие лимфоузлы (локально-регионально);
- На четвертой – поражение лимфоузлов, органов, других участков кожи человека (отдаленное метастазирование).
Лечение
- Лечение локальных местных повреждений состоит в своевременном выявлении и хирургическом вмешательстве. Удаление чаще всего проводится под инфильтрационной анестезией. Для иссечения образований большого размера возможно применение общего обезболивания. Помимо злокачественных образований, существует ряд предмеланомных заболеваний, в которых показан хирургический метод.
- Локально-регионарные повреждения. Лечение включает в себя иссечение с увеличенным захватом площади и лимфодиссекцию пораженных лимфатических узлов. Разновидности нерезектабельных, транзиторно метастазирующих опухолей подвергают изолированной регионарной химиоперфузии. В определенных случаях отлично зарекомендовал себя комбинированный подход, с проведением дополнительной терапии, стимулирующей иммунитет.
- Лечение отдаленных метастазов выполняется монорежимной химиотерапией. Определенные виды мутаций подвергаются воздействию прицельных таргетных препаратов.
Меланома. Прогноз выживаемости
Толщина новообразования, глубина инвазии, локализация, наличие изъязвлений и радикальность вмешательства при лечении болезни имеет важное прогностическое значение.
Радикальное воздействие на поверхностные меланомы обеспечивает пятилетнюю выживаемость в 95 процентах заболеваемости. Опухоль с поражением лимфатических узлов снижает этот процент до 40.
Противопоказания
Принадлежность человека к светочувствительному фототипу, большое количество невусов, атипичные родинки, наличие наследственной предрасположенности, иммунных и эндокринных нарушений – дополнительные факторы в пользу внимательного отношения к кожным новообразованиям. Противопоказано:
- Травматизация
- Самодеятельное удаление родинок
- Длительное пребывание под УФ-излучением без средств защиты кожи
Лечение после операции
При локальных стадиях наблюдение проводится в течение 5 лет. 10 лет – при других формах. Этот срок считается достаточным для обнаружения появления рецидива заболевания. Пациент инструктируется о применении соответствующих средств защиты от УФ лучей, в условиях естественного и искусственного излучения.


Авторская публикация:
ГАФТОН ИВАН ГЕОРГИЕВИЧ
врач-онколог
НМИЦ онкологии им Н.Н. Петрова

Фотографии из личного архива:
РАДЖАБОВА ЗАМИРА АХМЕДОВНА
врач-онколог, заведующий хирургическим отделением опухолей головы и шеи
НМИЦ онкологии им. Н.Н. Петрова
Кожа является крупнейшим специализированным органом человека, площадь которого составляет 2 м 2 , а масса — почти 3 кг. Она выполняет ряд важнейших функций. В частности, кожа — это барьерный орган и, что особенно важно отметить, подобно тимусу, она является местом, где созревают некоторые типы иммунных клеток и протекают иммунологические реакции. В принципе, в кожном барьере представлены все типы клеток, способные осуществлять широкий спектриммунных реакций. Это дает основание считать кожу органом иммунной системы.
В начале 80х гг. XX века была сформулирована концепция лимфоидной ткани кожи — skin-associated lymphoid tissue (SALT), которая продолжает развиваться и в наши дни. В соответствии с современными взглядами наряду с лимфоцитами к иммунной системе кожи следует отнести нейтрофилы, тучные клетки и эозинофилы, клетки Лангерганса и кератиноциты [3, 4, 20].
Лимфоциты
Для лимфоидных клеток характерна рециркуляция — постоянный обмен между кровью, лимфой и органами, содержащими лимфоидную ткань. Другой особенностью данной клеточной популяции является хоминг — заселение определенных участков лимфоидных органов и тканей. Поэтому внутридермальные лимфоциты отличаются от циркулирующих в периферической крови. Для изучения популяционного состава лимфоцитов кожи были использованы методы иммуногистохимии и «кожного окна» (определение процентного содержания клеток на отпечатке с небольшого участка кожи после удаления поверхностного слоя эпидермиса). Это позволило установить, что в норме лимфоидные клетки кожи являются преимущественно Т-лимфоцитами: CD5+ — 19%, CD3+ — 48%, CD25+ — 26%, CD4+ — 33%, CD22+ — 18% [7, 14]. Все они имеют достаточно специфичный общий маркер — кожный лимфоцитарный антиген (CLA), который считается рецептором, контролирующим сродство Т-клеток к коже. CLA — это адгезивная молекула на мембране, которая обеспечивает связывание Т-лимфоцита с эндотелием посткапиллярных венул кожи и переход его в дерму. CLA-позитивные T-клетки составляют 10—15% циркулирующих клеток крови. Популяция CLA-позитивных Т-клеток представлена несколькими субпопуляциями, различающимися по рецепторному статусу и функциональной активности [10, 11, 12]. Для всех CLA-позитивных Т-клеток характерна экспрессия кожного Т-клеточного хемоаттрактанта (CTACK), который «привлекает» в кожу Т-лимфоциты из циркуляции, прежде всего при различных воспалительных процессах. Совокупность накопленных сегодня клинико-экспериментальных данных показывает, что CTACK играет важную роль в иммунном ответе кожи. Наиболее значима его патогенетическая роль как провоспалительного фактора при таких заболеваниях, как атопический и контактный дерматиты [13].

Кроме того, большинство Т-лимфоцитов нормальной кожи здорового человека имеют рецепторы к другим хемокинам — биологически активным веществам, контролирующим миграцию клеток, в частности лимфоцитов. Это способствует их активному участию в различных иммунологических реакциях, как физиологических, так и патологических [1, 6, 21].
Т-клетки кожи способны дифференцироваться в цитотоксические клетки или клетки памяти (CD45RO). Клетки памяти экспрессируют также кожный лимфоцитарный антиген (CLA), образуются в лимфатических узлах, дренирующих кожу, и возвращаются в кожу при воспалении. В норме они участвуют в формировании иммунитета в коже, а при патологии принимают участие в патогенезе кожной Т-клеточной лимфомы, отторжения трансплантата, атопического дерматита и т. д. [2, 5, 10, 17]. Около трети лимфоцитов кожи являются Т-хелперами (СD4+). В последние годы показано, что данная субпопуляция клеток представлена двумя разновидностями —Th1 и Th2, которые различаются прежде всего по спектру продуцируемых цитокинов. В норме между этими клетками существует определенный баланс; при заболеваниях кожи соотношение Th1/Th2 меняется. Например,при воспалительных процессах повышается активность Th1-лимфоцитов [1, 8, 12, 15]. Таким образом, лимфоциты кожи представляют собой гетерогенную клеточную популяцию, в которой присутствуют клетки рециркулирующего пула и специфические кожные лимфоциты. Для последних характерен своеобразный набор клеточных рецепторов, обусловливающих их тропность к коже, а также определенный набор продуцируемых цитокинов, позволяющий им участвовать в различных клеточных реакциях, которые обеспечивают репарацию кожи.
Нейтрофилы
Нейтрофилы содержатся в нормальной коже в незначительном количестве, а при острых воспалительных процессах их число существенно возрастает. Кроме того, нейтрофильные гранулоциты участвуют в регуляции репаративных процессов путем взаимодействия с другими клетками (макрофагами, кератиноцитами). Одним из механизмов этого взаимодействия является продукция нейтрофилокинов, стимулирующих секрецию фибробластами и лимфоцитами факторов роста, которые в свою очередь индуцируют пролиферативную активность клеток регенерирующей ткани [3, 18].
Тучные клетки и эозинофилы
Тучные клетки (ТК) и эозинофилы кожи участвуют в различных патологических процессах, прежде всего — в аллергических. При внедрении аллергена в кожу он взаимодействует с эозинофилами и ТК, несущими на своей поверхности IgE-антитела. В результате этого взаимодействия происходит активация и дегрануляция клеток с последующим высвобождением различных медиаторов (субстанции Р, интерлейкинов 1 и 6, хемокинов). Они способствуют миграции в очаг патологического процесса других иммунокомпетентных клеток и поддерживают активность воспалительной реакции. Количество и функциональная активность этих клеток по-разному меняются при различных кожных заболеваниях. Кроме того, ТК и эозинофилы играют определенную роль в реализации патогенных эффектов стресса на кожу [2, 6, 9].
Клетки Лангерганса

Клетки Лангерганса (КЛ) относятся к специализированным клеткам эпидермиса и составляют 2-3% от общего числа его клеток. Они представляют собой одну из форм дендритных клеток, имеющих моноцитарно-макрофагальное происхождение и выполняющих в организме важнейшие иммунные функции, прежде всего — как антигенпрезентирующие клетки. Дендритные клетки являются ключевым звеном, связывающим приобретенный и врожденный иммунитет [16].
При воспалении и других процессах, связанных с антигенной стимуляцией, КЛ приобретают двигательную активность, покидают эпидермис с током тканевой жидкости и, перемещаясь по лимфе, претерпевают определенные морфологические трансформации, в результате чего становятся так называемыми «вуалевыми» клетками. Достигая лимфатических узлов, они активно взаимо действуют с другими иммунокомпетентными клетками и осуществляют презентацию им антигенов. КЛ способны взаимодейство вать с различными типами Т-клеток, модулируя таким образом различные типы иммунных реакций (воспаление, аутоиммунитет). Кроме того, КЛ непосредственно участвуют в уничтожении бактерий в коже.
Кератиноциты
Кератиноциты также следует отнести к иммунной системе кожи. Они продуцируют широкий спектр регуляторных молекул (ростовых факторов, цитокинов), чем обусловлено их участие в иммунной защите кожи [2, 8, 16, 21]. Нарушение взаимодействия молекул адгезии на поверхности кератиноцитов с рецепторами лимфоцитов является важным механизмом патогенеза ряда заболеваний, например псориаза [5, 7, 17, 19].
Меланоциты
В последние годы эти пигмент-продуцирующие клетки кожи стали относить и к иммунокомпетентным, поскольку они, как и кератиноциты, способны продуцировать ряд цитокинов (интерлейкины 1, 3 и 6, фактор некроза опухолей, трансформирующий фактор роста и другие), которые выступают в роли медиаторов иммунного ответа в дерме [2].
Цитокины — биорегуляторы иммунных реакций
Последние десятилетия характеризовались бурным накоплением данных о новом классе иммунорегуляторных молекул — цитокинов. Они включают в себя огромное количество различных веществ, в том числе интерлейкинов, которые выполняют коммуникативную функцию между иммуноцитами и оказывают различные регуляторные влияния как в рамках иммунной системы, так и в других органах и тканях. В настоящее время в коже обнаружено большинство известных интерлейкинов: их функции связаны с кожей, а нарушение продукции лежит в основе патогенеза ряда кожных заболеваний, в частности псориаза и атопического дерматита [2, 6, 7].
Иммунная система кожи при инфекционном и неинфекционном поражении
Иммунная система кожи участвует в реализации и врожденного, и приобретенного иммунитета. Наиболее значимо ее роль проявляется при нарушении целостности барьера и проникновении в дерму микро организмов. При этом SALT реагирует как единая функциональная система. В анти-генпрезентирующих клетках происходят процессинг и презентация антигена, в ходе которых КЛ превращаются в дендритные клетки и перемещаются по дерме в лимфатические узлы. В результате они приобретают способность взаимодействовать с Т-хелперами, которые затем активируют В-клетки и частично дифференцируются в эффекторные лимфоциты и клетки памяти. Т-клетки памяти, несущие CLA, способны из кровотока мигрировать в эпидермис; именно они и преобладают в коже. В результате увеличения числа Т-клеток, контактирующих с наиболее «актуальными» антигенами, вносится поправка в антигенраспознающий репертуар Т- лимфоцитов. Этим определяется активность иммунного ответа.
При неинфекционном поражении кожи, например при травме, иммунная система активно участвует в заживлении кожной раны. Заживление кожной раны — это динамичный интерактивный процесс с участием медиаторов, клеток крови, межклеточного матрикса и мезенхимальных клеток, который состоит из трех фаз: воспаление, образование грануляционной ткани и тканевое ремоделирование. Воспаление является реакцией организма в целом и кожи в частности на травму. Ведущая роль в его развитии принадлежит клеткам крови — нейтрофилам. Они не только участвуют в гемостазе, но и выделяют биологически активные вещества.

В результате происходит активация моноцитов-макрофагов, которые служат связующим звеном между воспалением и регенерацией. Активация этих клеток приводит к индукции пролиферации эпидермиса. Необходимо отметить, что реэпителизация начинается уже через несколько часов поле нанесения травмы. Первоначально она идет за счет сокращения внутриклеточных тонофиламентов, что повышает миграционную способность эпидермальных клеток. Примерно через четверо суток в ране определяется новообразованная строма (грануляционная ткань). Под влиянием различных цитокинов, продуцируемых иммунокомпетентными клетками, в ней происходят дифференцировка фибробластов, синтез коллагена, новообразование сосудов. Активное участие в этих процессах принимают цитокины, и в том числе — ростовые факторы (эпидермальный, трансформирующий, тромбоцитарный, эндотелиальный и другие). Метаболизм коллагена, появление в грануляционной ткани миофибробластов, пролиферация кератиноцитов и целый ряд других клеточных событий, завершающих «созревание» грануляционной ткани, приводят к формированию кожного рубца, что свидетельствует о восстановлении целостности ткани и завершении репаративного процесса [19, 21].
Таким образом, в коже представлены все типы иммунного ответа — врожденный и приобретенный (адоптивный), клеточный и гуморальный. Благодаря этому возможны и неспецифическая защитная функция (иммуноглобулины, лизоцим, лактоферрин, дефенсины, фагоцитоз), и первичное распознавание антигена с последующей его презентацией и пролиферацией антиген-специфических Т-клеток. В результате в дерме осуществляются как цитотоксические реакции, так и антителообразование. Необходимо подчеркнуть, что особенностью кожи как иммунного органа является относительное преобладание врожденного иммунитета над приобретенным, а в системе врожденного иммунитета кожи в свою очередь превалируют клеточные факторы. Анализ многочисленных научных данных позволяет полагать, что иммунные реакции имеют отношение к большинству физиологических и патологических процессов, происходящих в коже.

Нарушения функции SALT
На обширном экспериментальном и клиническом материале показано, что нарушения функций SALT — реактивности Т-клеток, продукции цитокинов, экспрессии хемокинов на клетках, межклеточных взаимодействий и других иммунологических реакций — приводят к развитию ряда заболеваний, любое из которых сопровождается изменением внешнего вида кожи. Это могут быть воспалительные заболевания кожи (фурункулы, акне), атопический дерматит, псориаз, Т-клеточная кожная лимфома [5, 16, 17]. Известно, что возрастные изменения кожи также связаны с изменением ее иммунологических функций. В стареющей коже наблюдаются мононуклеарная инфильтрация, снижение числа клеток Лангерганса и изменение продукции иммунокомпетентными клетками цитокинов, влияющих на пролиферацию и дифференцировку клеток кожи.
Разнообразие клеток, входящих в иммунную систему кожи, а также многообразие их функций объясняют тот факт, что на уровне кожи возможно проявление всех типов иммунопатологических синдромов (иммунодефицитный, аутоиммунный, аллергический, лимфопролиферативный). Иммунодефицитный синдром проявляется, например, фурункулезом и другими гнойно-воспалительными процессами. При дефектах фагоцитоза кожа становится чувствительной ко многим бактериальным и грибковым инфекциям, но иммунный ответ нарушается на любой антиген, поскольку страдает антигенная презентация.
Аллергический (гиперергический) синдром встречается достаточно часто и имеет место при контактном и атопическом дерматитах. Явления гиперергии характерны и для псориаза. Аутоиммунный синдром также имеет кожные проявления (склеродермия, системная красная волчанка). Примером лимфопролиферативного синдрома служит Т-клеточная лимфома кожи (грибовидный микоз).
Диагностика всех этих состояний основана на клинических признаках. Например, для иммунодефицитного заболевания это будут такие критерии, как рецидивирующее течение инфекционного поражения кожи, его затяжное течение несмотря на проведение адекватной фармакотерапии, тенденция к генерализации инфекционно-воспалительного процесса в коже, резистентность к антимикробной терапии, преобладание в очаге поражения некротических изменений над воспалительными, несоответствие локальных и системных проявлений кожной инфекции. Специфических тестов, характеризующих состояние иммунитета кожи, в практической медицине не существует. Дерматолог может ориентироваться на стандартные иммунологические показатели крови. В научных же исследованиях используют морфологическую (гистологическую) оценку иммунокомпетентных структур кожи, метод «кожного окна» и некоторые другие.
Как улучшить иммунитет кожи?
Патология иммунной системы приводит к развитию иммунозависимой патологии. Поэтому потребность в стимуляции иммунитета кожи при его угнетении патогенетически обоснована. Для этих целей могут быть рекомендованы такие препараты, как Полиоксидоний и Ликопид. Некоторые иммуномодуляторы (например, Рибоксин) могут использоваться как для системного, так и для местного применения, в том числе в мезотерапевтических методиках. При этом интрадермальные иньекции оказывают влияние преимущественно на иммунную систему кожи, а системное применение приводит к активации лимфопоэза в тимусе и лимфатических узлах. Другими словами, выбор способа введения препарата (местное или системное) должен базироваться на характере иммунных нарушений — как в коже, так и в организме в целом.

Умеренным иммунотропным действием обладают и неспецифические адаптогены (витаминно-микроэлементные комплексы, настойка аралии и т. п.). Мы обнаружили иммуноактивные свойства у органического кремния, который широко используется в мезотерапевтической практике. В лечении заболеваний, вызванных повышенной реактивностью иммунной системы (псориаз, лимфомы), используют иммунодепрессанты (циклоспорин). Последним достижением иммунофармакологии является использование в качестве ингибиторов иммунной системы моноклональных (высокоспецифичных) антител.
Улучшая иммунный статус кожи, следует помнить о том, что иммунная система кожи, морфологически представленная SALT, с одной стороны, является достаточно автономным отделом иммунной системы организма, с другой — имеет с ней тесные морфофункциональные и регуляторные взаимоотношения. Нарушения нормальных иммунных реакций в коже приводят к развитию многих дерматологических заболеваний и подавляющего большинства эстетических проблем, в том числе к преждевременному старению кожи. Неудивительно, что кожа является мишенью для иммунотерапевтических вмешательств, в частности иммуномезотерапии. Более подробно этот вопрос мы планируем рассмотреть в следующих публикациях.

Человеческий костный мозг способствует выработке лимфоцитов. После проникновения в кровяное русло, они становятся незрелыми. К первому месту, где происходит их созревание, относится тимус, ко второму лимфатический узел. Локализацией тимуса является верхняя часть грудной клетки, а лимфатических узлов – шея, пах, подмышечная впадина. Т-лимфоцитами называются клетки после созревательного процесса в тимусе, а в-лимфоциты, созревшие в лимфатическом узле. Эти два вида лимфоцитов вырабатывают антитела, которые борются с чужеродными тканями и инфекциями. Реакция антитела направлена только на антиген, который ему соответствует. К примеру, у ребенка, который переболел свинкой, не будет вырабатываться иммунитет от кори.
Сутью вакцинации является знакомство иммунитета с определенного рода недугом. Ведение вакцины означает, что в организм проникает маленькая доза возбудителя, которая нужна для дальнейшего разрушительного действия антител на антигены. Однако встречаются ситуации, когда начинается атака лимфоцитов на ткани собственного организма. Так начинает развиваться аутоиммунные заболевания. Они встречаются приблизительно у 10 процентов населения мировых стран. Медицинская практика показывает, что редкие аутоиммунные заболевания поражают мужчин реже, чем женщин. Существует десять основных причин, вследствие которых наступает летальный исход. К таким причинам относится аутоиммунные и иммуннодефицитные заболевания.
В организме каждого человека есть иммунитет, который начинает свое развитие с момента рождения. В его состав входят специальные органы и клетки, защищающие от негативного микробного и вирусного воздействия. Иммунная система основана на механизме, способном различать собственную ткань от чужеродной. Различное повреждение провоцирует дисфункцию иммунитета, вследствие чего он перестает различать собственные клетки от чужих. Такое явление активирует производство аутоантител, ошибочно нападающих на здоровые клетки. В результате исчезает регуляторная работа т-лимфоцитов, появляются тяжелые аутоиммунные заболевания, которые поражают внутренние органы и системы организма.
Следует рассмотреть перечень аутоиммунных заболеваний. К первому типу относится расстройство, появляющееся, когда нарушается гистогематический барьер. Второй тип болезней появляется после того, как трансформируется ткань организма от физического, химического, вирусного воздействия. Происходит глубокие метаморфозные процессы в здоровых клетках, как результат – восприятие их чужими. Существуют случаи, когда происходит антигенная или экзоантигенная концентрация. Организм отреагирует повреждением клетки, на оболочке которой сохранился антигенный комплекс. Иногда контакт с вирусом провоцирует образование антигена, обладающего гибридным свойством. Это способно поразить центральную нервную систему.
В третью группу входят заболевания аутоиммунной системы, при которых происходит коалисценция ткани с экзоантигеном. В результате активизируется естественная реакция, направленная на пораженные участки. Четвертая группа включает недуги, причиной которых является генетическое отклонение или влияние неблагоприятного внешнего фактора. Это влечет стремительную мутацию клеток иммунитета, которая проявляется красной волчанкой.
Развитие заболевания аутоиммунного характера способно развиваться в любом возрасте. Несмотря на это, есть группа людей, у которых предрасположенность к аутоиммунным заболеваниям выше. А именно:
- Человек, который подвергается негативному воздействию внешних факторов. Специалисты по аутоиммунным заболеваниям в Москве выделяют влияние солнечного света, химических веществ, вирусной или бактериальной инфекции, которые вызывают патологические процессы в иммунной системе.
- Женщина в детородном возрасте. Аутоиммунные болезни встречаются у женщин чаще, чем у мужчин.
- Определенные расы и этнические группы. Признаки аутоиммунного заболевания чаще возникают у человека с белой кожей. К примеру, афроамериканцы и испанцы тяжело переносят системную красную волчанку.
- Наследственный фактор. Следует запомнить, что аутоиммунные заболевания передаются по наследству от ближайших родственников. Медицинская практика показывает, что в семейном анамнезе могут диагностироваться разные типы расстройства иммунитета.
Почему появляются
Медицинские исследования выделяют внутренние и внешние причины, почему возникают аутоиммунные заболевания. Одной из внутренних причин, когда происходит агрессия и бесконтрольное размножение лимфоцитов, является генная мутация первого типа. При этом исчезает распознавание лимфоцитами здоровых клеток. Человек получает по наследству от близкого родственника такое иммунное расстройство. Учитывая мутационный процесс в конкретном органе или системе, может развиться тиреоидит, зоб.
К другой внутренней причине относится генная мутация второго типа, при которой происходит бесконтрольное размножение лимфоцитов-санитаров. В результате появляются иммунные и аутоиммунные заболевания, которые, в основном, передаются по наследству. Среди внешних причин аутоиммунного заболевания выделяют тяжелую затяжную инфекционную болезнь, после которой происходит неадекватное поведение иммунных клеток, а также негативное воздействие факторов окружающей среды (радиация, ультрафиолетовые лучи). Возникновение сбоя иммунитет происходит из-за хитрости клетки-возбудителя недуга. Они способны притвориться схожими на собственные, но патогенные клетки. В результате лимфоциты теряют возможность распознавать чужеродные организмы, и начинают бороться с обоими.
Появляются системные аутоиммунные заболевания, когда нарушается целостность гематобарьера, которые отделяют определенный орган или ткань от крови. Нормой считается отсутствие проникновения в кровоток клеточных антигенов. Это значит, что т-лимфоциты не вырабатывают к ним толерантность. К забарьерным относят клетки мозга, щитовидки, и клетки, которые вырабатывают инсулин. При наличии такого механизма развивается хронический аутоиммунный простатит. Это значит, что спермопродуцирующие клетки отделяются от крови при помощи гематотестикулярного барьера. Инфицирование, воспаление, травма могут стать причинами нарушения его целостности, в результате начинается аутоагрессия, направленная на ткани простаты.
Какие виды аутоиммунных болезней существуют
Говоря о классификации расстройств, выделяют три группы аутоиммунных заболеваний. К первой группе относятся органоспецифические патологии, характеризующиеся направлением антител и лимфоцитов на аутоантиген одного или нескольких органов. Сюда относится забарьерный антиген, к которому нет врожденной толерантности. Вторая группа включает органонеспецифические болезни, когда происходит взаимодействие аутоантител и лимфоцитов с аутоантигенами ткани или органа. Патологический процесс развивается, когда уже существует толерантность. Третья группа состоит из вышеперечисленных механизмов.
Если человек столкнулся с иммунным расстройством, он заинтересуется, какой врач занимается аутоиммунными заболеваниями. При органоспецифической аутоиммунной болезни необходимо обратиться к профильному врачу. При смешанном или системном недуге требуется квалифицированная помощь многих врачей. Это невролог, гематолог, ревматолог, эндокринолог, кардиолог, пульмонолог, дерматолог, нефролог.
Что относится к аутоиммунным заболеваниям системного типа
Появление красной волчанки связано с нарушением аутоиммунного процесса, когда привлечены все внутренние органы. Недуг поражает два-три человека из тысячи. Возникает красная волчанка, когда в организме образовываются аномальные антитела из-за влияния генетического фактора. Подтверждением является наличие взаимосвязи патологии с нехваткой наследственных компонентов иммунитета. Кроме этого, спровоцировать появление иммунного расстройства может токсическое вещество, вирус, бесконтрольное употребление медикаментозных средств.
Системное расстройство на протяжении длительного времени протекает без симптомов, проявляется кожным высыпанием, нарушается опорно-двигательная система. Однако в это время в организме нарастает интенсивность иммунного дисбаланса, который может стать причиной воспалительного процесса любого внутреннего органа. Красная волчанка характеризуется поражением соединительной ткани, присутствующей в органах и системах. В результате обнаруживаются кожные высыпания на лице и груди, кожа становится чувствительной к воздействию ультрафиолета (покраснение, сыпь, пятна). Распознавательным признаком служит появление на теле дисковидного элемента, у которого красная окантовка, бледная середина.
При таком аутоиммунном заболевании симптомы следующие:
- Появление волчаночного артрита характеризуется резкими или ноющими болями, припухлостью, покраснением суставов, которые задействованы в патологическом процессе. После ограниченного движения пораженной конечности наступает полное обездвиживание костного сочленения.
- Поврежденные внешние серозные оболочки внутренних органов вызывают приступы кашля, боль при вдыхании и выдыхании. Доктор услышит влажный хрип в нижней доле легкого.
- Происходит поражение сердца и сосудов, появляется щемящая боль, нарушен ритм сокращений сердца.
- Из-за патологических сосудистых изменений, синеют стопы и кисти, холодеют конечности.
- Появление зрительных и слуховых галлюцинаций, состояние бреда.
- При абдоминальном синдроме появляется боль в животе, диарея, анорексия.
Если возникает вопрос, как выявить аутоиммунное заболевание, следует применить комплексное обследование, которое включает клинический, лабораторный, иммунологический, и гистологический метод. Врач назначит сдать кровь на общий анализ, пройти электрокардиографию, рентген, узи брюшной полости, почек. При своевременно начатом лечении аутоиммунного заболевания, у пациента возрастают шансы избежать патологического изменения внутреннего органа или системы. Терапевтические мероприятия состоят из приема противовоспалительных и подавляющих иммунитет препаратов, а также кортикостероидов.
Воспалительная миопатия
Сюда относится группа болезней, которые вызваны мышечным воспалением и слабостью. Наличие полимиозита и дерматомиозита зачастую диагностируется у женщин. Воспалительная миопатия вызывает медленно прогрессирующую слабость тех мышц, которые задают движение двух сторон тела. Дерматомиозит характеризуется кожной сыпью, сопровождающуюся слабостью в мышцах. Человек устает после длительной ходьбы или пребывания в стоячем положении. Отмечаются частые спотыкания, падение, затруднение при глотании пищи или воды, вдыхании или выдыхании воздуха.
Наличие миастении
Это аутоиммунное заболевание, как диагностировать и лечить, подскажут в клинике Москвы. Характеризуется атакой иммунитета нервов и мышц, которые присутствуют во всем теле. У человека с миастенией двоится в глазах, трудно сфокусировать взгляд и опускать веки. Появляется затрудненное глотание, частая отрыжка, удушье. Кроме этого выделяют:
- Наступление паралича, слабости.
- Трудно держать голову.
- Тяжело опускаться или подниматься по лестнице, поднимать вещи.
- Исчезает внятная речь.
Поражение псориазом
При таком недуге происходит избыточное и быстрое появление новых кожных клеток, накопление которых обнаруживается на кожном покрове. Заболевший человек замечает появление плотных красных пятен, которые покрыты чешуйкой. К области, где присутствуют такие пятна, относится голова, локти, колени. Также появляется зуд и болезненные ощущения, негативно сказывающиеся на работоспособности, ухудшающие сон.
Псориаз может сопровождаться формой артрита, при которой поражаются суставы и фаланги пальцев верхних и нижних конечностей. При затрагивании позвоночника появляется боль в области спины. Человек может обратиться за лечением аутоиммунного заболевания в Москве.
При синдроме Шегрена
Список аутоиммунных заболеваний у человека пополняется синдромом Шегрена, который характеризуется атакой слезных и слюнных желез. При таком синдроме у пациента выделяют такие признаки:
- Сухость глаз.
- Появление сильного кариеса зубов.
- Наличие сухости в полости рта.
- Помутнение в глазах.
- Затрудненное глотание пищи и напитков.
- Опухают и болят суставы.
- Обнаруживается опухлость гланд.
- Повышенная температура при аутоиммунном заболевании.
- Человек теряет вкусовые ощущения.
- Голос приобретает хриплый характер.
- Появление чрезмерной усталости.
Наличие склеродермии
Расстройство иммунитета, при котором появляется аномальное развитие соединительных тканей в кожном покрове и сосудах. Признаки склеродермии следующие:
- Появление одышки.
- Кожа утолщается.
- Видно обеление, покраснение или посинение пальцев верхних и нижних конечностей.
- Резко снижается масса тела.
- Появляется частые диареи или запоры.
- Кожа рук и предплечий становится блестящей.
- Болезненные ощущения, отечность пальцев.
- Кожа на лице натягивается, похожа на маску.
- Затрудненное глотание.
- Появляются раны на пальцах.
Выявление ревматоидного артрита
При перечислении, что относится к аутоиммунным заболеваниям, следует выделить ревматоидный артрит, при котором воспаляются суставы и окружающая их ткань. Появиться может в любом возрасте. Исследования по излечению аутоиммунного заболевания такого типа заключаются в сдаче анализа крови на наличие ревматоидного фактора, и магнитном резонансе пораженного сустава.
Наличие сахарного диабета
При определении, какие бывают аутоиммунные заболевания, следует отнести сахарный диабет первого типа, при котором нарушается обмен углеводов и воды. В результате нарушается функционирование поджелудочной, которой вырабатывается инсулин. Он помогает перерабатывать сахар. Недуг можно приобрести или получить по наследству. Нехватка инсулина провоцирует возникновение гнойничковых поражений кожного покрова. Начинают крошиться зубы, появляется чувство грудной жабы, скачет артериальное давление, нарушается функционирование почек, нервной системы, резкое ухудшение зрительной функции.
Симптоматика имеет постепенный характер. Начало сахарного диабета сопровождается следующими признаками:
- Медленно заживают раны.
- Присутствие постоянной сухости в ротовой полости.
- Повышается склонность к образованию гнойного процесса на кожных покровах и тканях.
- Обильное потоотделение.
- Слабость во всех мышцах.
- Появляется жажда, которую трудно утолить. В результате больному приходится выпивать несколько литров в сутки.
- Кожа начинает чесаться из-за чрезмерной сухости.
- Частые позывы к мочеиспусканию.
Наличие одного из вышеперечисленных симптомов служит поводом для сдачи крови на определение глюкозного показателя. Если отсутствует лечение аутоиммунного заболевания, появляются другие признаки:
- Изо рта слышен запах ацетона.
- Дисфункция зрительного органа.
- Теряется сознание.
- Постоянная головная боль.
- Лицо и голени отекают.
- Болезненные ощущения в сердце.
- Печень увеличена.
- Онемевают и болят ноги, что не позволяет полноценно ходить.
- Кожа на стопах теряет чувствительность.
- Резко повышается артериальное давление.
Человека, который столкнулся с сахарным диабетом, интересует, можно ли избавиться от аутоиммунного заболевания такого вида, к какому врачу обратиться, сколько будет длиться лечение. После проведенного обследования, врачом назначаются препарат, который стимулирует работу поджелудочной, чтобы вырабатывалось больше инсулина. А также медикаменты, способные повысить клеточную восприимчивость к инсулину, ингибиторы и агонисты. Для избавления от сахарного диабета следует соблюдать диетическое питание, в котором мало углеводов, не заниматься самолечением, посещать спортзал для повышения двигательной активности. Бывают случаи, когда необходимо вводить инсулин, чтобы нормализовать уровень глюкозы.
Выявление саркоидоза
Относится к редкому хроническому воспалительному заболеванию, которое поражает четыре человека из ста тысяч. Происходит поражение легких. Редко встречается у детей и лиц преклонного возраста. Саркоидоз характеризуется затрудненным дыханием при физической нагрузке, резким понижением массы тела, потере аппетита, чрезмерной утомляемостью. Может присоединиться апатия, слабость в мышцах, приступы кашля. Признаками саркоидоза являются отхаркивание с примесью крови, одышка, болезненные ощущения в груди. При запущенной форме снижается дыхательная функция из-за воспалительного процесса в легких. Может наблюдаться нарушение в глазном яблоке, суставах, кожном покрове. При отсутствии лечения аутоиммунных заболеваний иммуноглобулинами повышается риск полной потере зрения.
Появиться саркоидоз может из-за контакта с бериллием или цирконием, сильной реакции организма на грибковое воздействие, сосновую пыльцу, атипические микробактерии, а также при генетической предрасположенности. Для определения патологии делается рентген и кожное тестирование Квейма Силцбаха. При возникновении вопроса, как лечить аутоиммунное заболевание такого типа, необходимо посетить квалифицированного врача. Он определяет возбудителя болезни, сколько длиться недуг, и выписывает медикаментозные препараты, употребление которых поможет избежать поражения жизненно важных органов. Без своевременного не начать терапию, прогноз на аутоиммунное заболевание такого вида не утешительный. Человек может ослепнуть и получить дыхательную недостаточность.
Какая существует профилактика аутоиммунных заболеваний
Чтобы понизить риск возникновения иммунной патологии, следует полностью долечивать вирусную инфекцию, острые респираторные заболевания. В рацион человека должны входить продукты питания, в состав которых входят витамины и микроэлементы. А также свежие овощи, фрукты, цельное зерно, обезжиренные молочные продукты, постный источник белка. Исключить насыщенные жиры, холестерин, соль, рафинированный сахар. Количество приемов пищи составляет два-четыре раза.
Минимизировать стрессовые ситуации, нервное перенапряжение, так как нарушения в центральной нервной системе способствуют увеличению чувствительности иммунной системы к негативному воздействию внешнего и внутреннего фактора. Начать медитировать, читать книги, выбрать хобби. Также, человек должен полноценно отдыхать. Плохой сон провоцирует сбой в гормональной выработке. Заниматься умеренными физическими нагрузками, йогой. Повышать нагрузки необходимо только после консультации с врачом. Соблюдая профилактические правила, человек уменьшит вероятность появления иммунного расстройства.

Студент медицинского факультета УЛГУ. Интересы: современные медицинские технологии, открытия в области медицины, перспективы развития медицины в России и за рубежом.
- Запись опубликована: 12.12.2019
- Reading time: 3 минут чтения
Ученые выяснили, что аутоиммунные заболевания вызываются стрессом.
Среди множества заболеваний эти патологии считаются наиболее слабоизученными. При их возникновении по каким-то неизвестным причинам организм вдруг начинает «атаковать» собственные ткани или клетки, принимая их за чужие.
Это приводит к возникновению воспалительных процессов, поражающих практически все органы – кожу, суставы, сердце, печень, почки, репродуктивную систему, кишечник, щитовидную железу.
Механизм возникновения аутоиммунных патологий
Иммунную систему можно сравнить с армией, охраняющей организм от вирусов, микробов, простейших и других «названных гостей». Иммунитет также уничтожает раковые и другие патологические клетки.
Любой инородный белок, попавший в организм, оценивается по принципу свой-чужой. При обнаружении угрозы иммунная система приступает к уничтожению. Для этого плазматические клетки, вырабатывают особые вещества – антитела- иммуноглобулины (Ig). Их задача – связать «пришельцев» и «пометить» их для последующего уничтожения. Возникают комплексы антиген-антитело, которые распознаются и уничтожаются специальными белками или клетками-фагоцитами.
Уничтожением чужеродных белков занимается ещё один вид иммунных клеток Т-лимфоциты. Они отыскивают « пришельцев» по специфическим комплексам, образующимся в организме в ответ на их внедрение. Т- лимфоциты уничтожают даже собственные клетки, если они заражены.
Образующиеся при иммунном ответе иммуноглобулины Ig сохраняются после выздоровления. При повторном заражении они быстро нейтрализуют возбудителей и болезнь не возникает. Поэтому краснухой, свинкой, ветрянкой, корью и некоторыми другими инфекциями можно переболеть всего один раз.
Здоровая иммунная система умеет отличать «своих» от «чужих», давая команду на уничтожение только болезнетворных микроорганизмов и не трогая нужные белки, соединения и ткани. Такое свойство называют толерантностью.

Уничтожение болезнетворных микроорганизмов
Однако, в некоторых случаях, по каким-то причинам толерантность иммунной системы нарушается. Она начинает атаковать ткани собственного организма, ферменты и белки, принимая их за чужеродные компоненты.
В результате образуется аутоантитела к собственным клеткам и нужным веществам, вырабатываемым организмом. У больного развивается аутоиммунное заболевание. В крови обнаруживаются патологические антитела и маркеры воспаления– С-реактивный белок, ускоренное СОЭ.
Эти патологии могут затрагивать самые разные органы и ткани:
- Суставы, с возникновением множественных воспалений – полиартритов.
- Сердце, с возникновением сердечных пороков.
- Поджелудочной железы, с развитием юношеского диабета.
- Нервной системы с возникновением рассеянного склероза.
- Кожи. При аутоиммунных патологиях на ней появляются высыпания, корочки, язвы.
- Почек, с развитием аутоиммунного нефрита- поражения, приводящего к почечной недостаточности.
- Репродуктивной системы, с возникновением аутоиммунного оофорита.
- Щитовидной железы, с развитием воспаления – тиреоидита Хашимото.
- Надпочечников, с развитием болезни Аддисона, при которой эти органы не могут вырабатывать достаточное количество гормонов.
- Слюнных и слёзных желез с развитием синдрома Шегрена, сопровождающегося сухостью глаз и слизистых оболочек.
- Кишечника с развитием болезни Крона. При этой патологии на его стенке образуются язвы и уплотнения (инфильтраты). Больные страдают от боли в животе, нарушений пищеварения и кровотечений.
Некоторые аутоиммунные заболевания, например, красная волчанка, поражают весь организм, вызывая изменения в сосудах, суставах, почках, коже.
Лечатся аутоиммунные заболевания очень тяжело. Больным назначают гормоны, а иногда даже химиопрепараты, которые обычно применяются при раке. Причины этих заболеваний доподлинно неизвестны, но недавно ученые выяснили, что они чаще развиваются на фоне стрессов.
Стресс нарушает работу иммунной системы
Чтобы понять взаимосвязь между стрессом и аутоиммунными заболеваниями в Швеции провели исследование, в котором участвовали 106 464 пациента, подвергшихся воздействию стрессовых ситуаций, и 1 064 640 лиц, не подвергшихся такому воздействию. Обследовали 126 652 братьев и сестер пациентов, перенёсших серьезные нервные потрясения.
Средний возраст пациентов составил 41 год, а всего в исследовании участвовали лица в возрасте 30-50 лет, 40% из них которых были мужчинами. В течение 10 лет заболеваемость аутоиммунными патологиями в группе лиц, переживших стрессовую ситуацию, составила 9,1 на 1000 чел. / год.
У лиц, не подвергавшихся стрессовым ситуациям количество аутоиммунных патологий было гораздо ниже – 6 на 1000 чел./ год. Примерно такой же показатель наблюдался у братьев и сестёр пациентов, перенёсших стресс и заболевших аутоиммунными болезнями. Это указывает на слабую связь заболеваний с наследственностью и высокую – с отрицательными воздействиями на нервную систему.
Особенно высоким было число аутоиммунных заболеваний у пациентов, подвергшихся посттравматическому стрессовому расстройству. Так называется состояние, возникшее на фоне выраженных психотравмирующих обстоятельств – военных действий, природных катаклизмов, дорожно-транспортных происшествий, насилия, террористических актов.
Заболеваемость аутоиммунными патологиями надпочечников у больных после посттравматического стрессового расстройства превышала средние показатели более, чем в 2 раза. Сахарный диабет и аутоиммунный тиреоидит у них возникали на нас 40-50% чаще.

Сахарный диабет
У пострадавших в ходе террористических актов, произошедших в Париже 13.11.15 года, была описана настоящая «эпидемия» болезни Крона и рассеянного склероза . Это еще раз показывает связь аутоиммунных патологий и стрессовых ситуаций.
Поэтому после перенесенных тяжелых психотравмирующих ситуаций нужно обратиться к врачу и обследоваться. Следует сдать кровь на общий анализ, на С-реактивный белок, антитела и основные биохимические показатели. Нужно также сдать общий анализ мочи. Так можно выявить аутоиммунные патологии на самых ранних стадиях, чтобы вовремя начать их лечение.
От проникновения чужеродных бактерий, вирусов и белков организм защищает иммунная система. Она уничтожает собственные дефектные клетки, которые могут дать начало онкологии. Иммунитет имеет сложную структуру. Его работа изучена не полностью, но давно известно, что нормальное функционирование зависит от витаминов.
Как витамины влияют на иммунитет
Витамины – это биологически активные вещества с небольшой молекулярной массой. Они необходимы человеку для поддержания обменных процессов. Витамины участвуют в биохимических реакциях, протекающих в клетках, и выступают в качестве катализаторов или коферментов. Их роль – ускорение или поддержание скорости реакции между другими веществами. Поэтому от их присутствия зависит синтез белков и производство многих компонентов клеток.
Белки – это важный компонент иммунитета, они:
- это часть антитела, которые блокируют чужеродные микроорганизмы;
- помогают формировать зону воспаления, чтобы инфекция не попадала в другие ткани;
- регулируют скорость воспроизведения иммунных клеток;
- участвуют в аллергических реакциях;
- защищают органы от атаки иммунной системы и развития аутоиммунных реакций.

Если человек не получает нужное количество витаминов, белков становится меньше, и эти функции нарушаются.
Почему возникает гиповитаминоз
Дефицит витаминов называется гиповитаминоз, а полное отсутствие нужного вещества – авитаминоз. Эти состояния возникают при недостаточном поступлении или при повышенной потребности организма в биологически активных веществах.
Гиповитаминоз может возникать при неправильном питании, нехватке в рационе овощей и фруктов. Страдает иммунитет у людей, которые длительно придерживаются монодиеты и ограничивают употребление определенных групп продуктов. Не все учитывают изменение потребности в витаминах при определенном рационе. Увеличивая в меню количество белковой пищи, нужно дополнительно повышать содержание витамина В6, а придерживаясь вегетарианства, дополнительно принимать витамин В12. Иначе иммунная система даст сбой и увеличится количество простудных заболеваний, чаще напомнят о себе хронические болезни.
Развитию гиповитаминоза способствуют:
- длительные инфекционные заболевания;
- период выздоровления;
- беременность и кормление грудью;
- болезни пищеварения;
- нехватка солнечного света;
- тяжелый физический труд.
Поэтому врачи назначают всем людям из группы риска препараты для повышения иммунитета.
Можно ли укрепить иммунитет питанием
Если человек ищет способ, как повысить иммунитет, часто он начинает с народных методов или пробует корректировать питание. Некоторые лекарственные растения способны улучшить неспецифические факторы защиты, повышают выработку белков-интерферонов. Такими свойствами обладают средства на основе эхинацеи (например, Найрин эхинацея), березового гриба, ромашки, элеутерококка (например, экстракт элеутерококка) и тимьяна. В народной медицине есть много рецептов приготовления отваров, настоев из этих растений в домашних условиях. Но нет научных данных, подтверждающих высокую эффективность этих средств.
Экстракты трав, которые использует народная медицина, но в точных дозировках, можно приобрести в виде таблеток и готовых растворов. Эти препараты относятся к группе иммуностимуляторов. Они обеспечивают поддержку организма в сезон респираторных заболеваний, помогают быстро восстановиться после болезни и улучшают общее самочувствие.

Основной источник поступления витаминных соединений – продукты питания. Считается, что здоровый взрослый человек сможет обеспечить организм нужными компонентами и укрепить иммунитет, если рацион будет разнообразным и сбалансированным.
Существуют нормы потребления каждого типа витаминов для взрослых и детей, а также беременных женщин. В специальных таблицах можно найти сведения о содержании полезных веществ в 100 г определенных продуктов. После подсчета определяют, какую пищу и в каком количестве нужно употреблять в день, чтобы усиливать свой иммунитет.
Недостаток способа в том, что содержание полезных веществ отличается от стандартных таблиц, а некоторые витамины разрушаются после приготовления продуктов. Поэтому взрослому человеку потребуется съедать несколько килограмм капусты или смородины в день, чтобы получить нужное количество аскорбиновой кислоты.
Когда нужно принимать витамины
Ухудшение функции иммунной системы связывают с окончанием зимнего сезона, но организм нуждается в поддержке круглый год. Витаминные препараты не нужно пить постоянно, достаточно укреплять иммунитет в критические периоды:
- осенью до подъема заболеваемости простудами и зимой;
- после перенесенного ОРВИ или другой инфекции;
- при планировании беременности или в период лактации;
- перед длительным путешествием и сменой часовых поясов или климатических зон;
- после лечения хронического заболевания;
- при длительном или частом употреблении алкоголя;
- при соблюдении строгой диеты.
Иммунитет страдает при гормональных изменениях, которые происходят у женщин в разные периоды жизни. Его укрепление зависит не только от правильно подобранного основного лечения, но и использования витаминных средств.
ТОП-5 витаминов для укрепления иммунитета
Поднятию функции защитной системы помогают не все препараты. Исследования позволили выделить витамины, повышающие иммунитет и укрепляющие здоровье. Они выпускаются в виде отдельных лекарственных препаратов, которые можно использовать самостоятельно дома. Но чтобы эффективное средство не принесло вред, перед тем как потратить на него деньги, нужно посоветоваться с врачом. Он поможет определить, каких веществ не хватает и в какой дозировке их лучше принимать.
Витамин D
На первом месте среди средств для укрепления иммунитета витамин Д, или кальциферол. Его выработка происходит в коже под влиянием ультрафиолета у всех взрослых людей. Но в зимний сезон, в северных широтах, где солнечного света мало, организму не хватает кальциферола. Из-за гиповитаминоза снижается иммунитет, ухудшается всасывание кальция, может развиться остеопороз. У детей нехватка витамина приводит к рахиту. Фукции витамина Д различны.При его участии осуществляется противоопухолевый имунитет;проведено несколько клинических исследований, согласно которым,при нормальном содержании витаминов Д риск развития, например, рака кишечника снижается, практически, вчетверо. В настоящее время,исследуется возможность применения витаминов этой группы в лечении псориаза, остеопороза,избыточной массы тела, сердечно-сосудистых заболеваний; Витамин Д применяется для снижения возрастных изменений в тканях, профилактики таких тяжелейших болезней,как болезнь Альцгеймера, различных видов деменций и заболеваний,разрушающих оболочку нерва, состояний мышечной слабости и т.д.
В самостоятельно(в домашних условиях)можно повышать содержание кальциферола рыбьим жиром, употребляя большое количество морской рыбы,выращенной в диких условиях, яица(желток),молочные продукты,водоросли,икра,кукурузное масло, некоторые виды лесных грибов.Самое большое содержание в лососине и печени трески. Взрослым можно применять комплексы, которые содержат холекальциферол и кальций, чтобы улучшать иммунитет и поддерживать минеральную плотность костей.
Группа В
Витаминные средства группы В включают несколько типов веществ. Доказано, что повышение иммунитета обеспечивают витамины В2, В6, В12. В домашних условиях их можно получить из животных продуктов: молока, яиц, печени,злаковые, бобовые, орехи,мясо, морепродукты, картофель.
Влияние на иммунитет заключается в способности улучшать противомикробную защиту, увеличивать выработку Т и В-лимфоцитов, которые борются с патогенными микроорганизмами.

Красивая и здоровая кожа, нормальное зрение, в сочетании с В9 он улучшает процессы кроветворения. он стимулирует образование аденозитрифосфорной кислоты- «бензин» для работы клеток. Нехватка витамина В2 (рибофлавина) проявляется в виде нарушений пищеварения, развития конъюнктивита, стоматита, себорейного дерматита. Если в организме мало В2, это проявляется склонностью к частым инфекционным заболеваниям.У больных ВИЧ гиповитаминоз ускоряет переход болезни в более тяжелую стадию.
Для укрепления иммунитета витаминные препараты группы В выпускаются в виде отдельных средств каждого вида или готовых комплексов из 2 и более компонентов (например, Суперум). В некоторых случаях для быстрого эффекта врач может назначить раствор для уколов.
Токоферол, или витамин Е
Эффективный способ получить суточную дозу токоферола – ежедневно употреблять в пищу семечки, орехи и растительные масла. Но потребность в витамине усиливает большое количество в рационе полиненасыщенных жирных кислот, которые содержатся в морской рыбе и морепродуктах.
Укрепление иммунной функции при помощи токоферола происходит за счет увеличения антиоксидантной защиты клеточных оболочек. Он усиливает способность организма противостоять разрушительному влиянию вредных экологических факторов, вирусов. Этот витамин помогает повысить выработку антител, а также блокирует размножение опухолевых клеток. Чаще всего его эффект усиливают аскорбиновая кислота и ретинол, которые вместе формируют антиоксидантный комплекс.
Аскорбиновая кислота
При появлении первых признаков простуды быстро укрепить иммунитет помогает аскорбиновая кислота, или витамин С. Ее можно найти в большинстве продуктов растительного происхождения:
- квашеной капусте;
- смородине;
- шпинате;
- сладком перце;
- томатах;
- шиповнике;
- цитрусовых.
Но аскорбиновая кислота разрушается при нагревании до 60°С, поэтому термически обработанная пища, чай уже не способны поддержать иммунную систему. Хороший способ – использовать готовые препараты, в которых точно известна дозировка активного вещества.

Витамин С усиливает выработку всех типов антител, увеличивает активность клеток-макрофагов, которые поглощают чужеродные микроорганизмы и опасные вещества. Он помогает укрепить сосудистую стенку, нормализует обменные процессы в печени и обезвреживание в ней токсинов.
Витамин А
Исследования показали, что ретинол, или витамин А, усиливает синтез белков-интерлейкинов. Они стимулируют деление Т-лимфоцитов. Эти клетки являются активными участниками иммунных реакций, они выявляют и уничтожают вирусы и бактерии, борются с опухолевыми клетками. Использование препаратов ретинола позволяет увеличить устойчивость к инфекциям, ускорить выздоровление и обеспечить антиоксидантную защиту.
Ретинол можно найти в привычных продуктах. В большом количестве он содержится в моркови, яйцах, печени трески, молоке и сливочном масле. Его много в шалфее, базилике, паприке и боярышнике.
Комплекс или по отдельности
Если врач заметит признаки гиповитаминоза, он назначит витаминный препарат определенного типа. Например, при остеопорозе нужен кальциферол, но для улучшения эффекта его используют вместе с кальцием. Людям, часто страдающим вирусным конъюнктивитом назначат пиридоксин. Но некоторые вещества работают лучше, если их используют в одной таблетке. Это относится к антиоксидантному комплексу из витаминов А, Е и С. Его можно использовать как для профилактики снижения иммунитета, так и на этапе выздоровления.
Потребность в биологически активных веществах изменяется в зависимости от возраста, пола, сопутствующих патологий. Поэтому врачи могут рекомендовать готовые поливитаминные комплексы. Они имеют сбалансированный состав, учитывают индивидуальные особенности организма и помогут противостоять многим болезням.
Читайте также:

