Иммунал при плоских бородавках
Обновлено: 27.04.2024
Статья посвящена папилломавирусной инфекции (ПВИ) - одной из самых распространенных вирусных инфекций, передаваемых половым путем. Представлены сведения о биологии вируса, путях заражения, патогенезе, клинических проявлениях инфекции. Рассматриваются различные клинические формы заболевания: манифестные - остроконечные кондиломы (аногенитальные бородавки), субклинические (интраэпителиальная неоплазия) и латентные. Обсуждаются подходы к лечению лечения ПВИ, включающие деструктивные (физические, химические), хирургические, иммунологические и комбинированные методы. Приводятся доказательства эффективности применения препарата Изопринозина - иммуномодулятора с противовирусной активностью при различных формах ПВИ, изученного в многочисленных зарубежных и отечественных исследованиях.
Ключевые слова: папилломавирусная инфекция, остроконечные кондиломы, деструктивные методы лечения, иммунокорригирующая терапия, Изопринозин
Папилломавирусная инфекция (ПВИ) относится к наиболее распространенным инфекциям, передаваемым половым путем. В США ежегодно выявляют около 5 млн новых случаев этого заболевания. По данным зарубежных исследований, практически каждый человек, живущий половой жизнью, инфицирован вирусом папилломы человека (ВПЧ). Заражение ВПЧ может произойти даже при однократном половом контакте вследствие высокой контагиозности вируса. Более половины женщин и мужчин приобретают эту инфекцию в течение первых двух лет сексуально активной жизни. Риск заражения значительно возрастает при наличии многочисленных половых партнеров и раннем начале половой жизни. По данным отечественных исследований, разные формы ПВИ гениталий встречаются у 44,3 % пациенток, обращающихся в гинекологические учреждения по различным причинам. По данным биопсий шейки матки, субклинические формы инфекции выявляются у 8,1 % женщин.
Этиопатогенез папилломавирусной инфекции
ВПЧ относится к безоболочечным вирусам, содержит двухцепочечную ДНК, имеет икосаэдрическую форму. Он является строго эпителиотропным, т. к. вначале поражает базальный слой эпителия кожи и слизистых оболочек гениталий и других органов (гортани, ротовой полости, глаз и др.), а его жизненный цикл связан с дифференциацией эпителиальных клеток. Репликация ДНК ВПЧ происходит только в клетках базального слоя, а в клетках других слоев эпидермиса вирусные частицы лишь персистируют. При заражении ВПЧ в клетках эпидермиса нарушается нормальный процесс дифференцировки. Происходит клональная экспансия инфицированных ВПЧ-клеток базального слоя с их трансформацией и последующей малигнизацией. Этот процесс контролируют гены ВПЧ, кодирующие ранние белки Е6 и Е7. Морфологически при этом наблюдаются деформация слоев эпидермиса, общее утолщение кожи и слизистых оболочек. В стадии развитой инфекции клетки шиповатого слоя при переходе в зернистый оказываются наиболее активными в синтезе вирусной ДНК. Эта фаза жизненного цикла ВПЧ характеризует второй этап экспансии вирусной инфекции внутри эпидермиса. Экспрессия поздних генов L1 и L2 наступает на конечной стадии дифференцировки в роговом слое, где наблюдаются активная сборка зрелых вирусных частиц и их выделение из клеток на поверхности кожи. Участки кожи и слизистых оболочек, на поверхности которых происходит активное выделение и почкование вируса, представляют наибольшую опасность для контактного заражения [1, 15].
Типы ВПЧ "высокого риска", особенно 16-й, 18, 31 и 45-й, ассоциируются с дисплазией шейки матки, а также с раком шейки матки, заднего прохода, вульвы и полового члена. Типы ВПЧ "низкого риска", прежде всего 6-й и 11-й, вызывают развитие остроконечных кондилом. Пациенты с остроконечными кондиломами могут быть одновременно инфицированы вирусами нескольких типов. Определение типа ВПЧ помогает оценить риск малигнизации [2].
Сексуальные контакты — основной путь заражения ВПЧ. Аутоинокуляция, контактнобытовой путь передачи инфекции допускаются, но изучены мало. Заражению способствуют микротравмы кожи и слизистых оболочек. Возможен вертикальный способ заражения, т. е. вирус может передаться новорожденному во время прохождения по родовым путям и послужить причиной развития рецидивирующего респираторного папилломатоза.
Клинические проявления ПВИ
В большинстве случаев инфекция ВПЧ протекает бессимптомно. Наиболее известными практическим врачам проявлениями этой инфекции являются остроконечные кондиломы, которые возникают в среднем через 1—3 месяца после заражения. С момента инфицирования и до развития предраковых заболеваний или рака in situ обычно проходит от 5 до 30 лет и очень редко - менее года. У 40 % больных отмечены субклинические, малосимптомные проявления заболевания в виде мелких плоских бородавок.
Манифестация инфекции ВПЧ наиболее часто сопровождается появлением остроконечных кондилом (аногенитальных бородавок). Они возникают, как правило, на коже и слизистых оболочках половых органов или в анальной области в местах трения и травматизации при половом акте. У лиц, практикующих орально-генитальные контакты, кондиломы могут возникнуть на губах, языке, небе. Чаще высыпания представлены узелковыми образованиями, сгруппированными по 5-15 элементов, иногда сливающимися в бляшки; реже высыпания бывают единичными. Слияние в крупные бляшки происходит при иммуносупрессии, соматических заболеваниях, метаболических нарушениях, интоксикациях. У некоторых больных с выраженными нарушениями клеточного иммунитета (ВИЧ-инфекцией, на фоне иммуносупрессивной терапии), при беременности развиваются очень крупные генитальные бородавки - гигантские кондиломы Бушке-Левенштейна. Эта предраковая инвазивная и деструктирующая опухоль ассоциируется с ВПЧ-6 и ВПЧ-11. Кондиломы могут быть плоской, конической или напоминающей цветную капусту форм. Цвет образований варьируется от беловато-телесного до розовато-синюшного, реже - красновато-коричневого.
Клинически выделяют четыре типа остроконечных кондилом:
Остроконечные кондиломы обычно бессимптомны и часто случайно выявляются самим больным или врачом при осмотре. Однако крупные или травмированные, изъязвленные или подвергшиеся вторичной инфекции бородавки сопровождаются зудом, болью, неприятным запахом и гнойным отделяемым. При локализации кондилом в уретре могут развиться признаки вялотекущего уретрита, кондиломы могут вызвать раздвоение струи мочи или даже обструкцию уретрального отверстия [3].
Диагностика и принципы лечения
Для диагностики ВПЧ-инфекции помимо клинического осмотра проводят лабораторные методы исследования: цитологические, гистологические, а также молекулярно-генетические, получившие в последнее время широкое распространение. ПЦР является более чувствительным методом диагностики, чем цитологическое исследование, и способна выявить субклинические и латентные формы заболевания. Метод имеет не только важную диагностическую ценность, но и прогностическое значение, т. к. позволяет идентифицировать отдельные типы ВПЧ [2].
Лечение ВПЧ-инфекции направлено на устранение ее клинических проявлений - остроконечных кондилом.
Для этого применяют различные методы наружной терапии:
Эффективность этих методов лечения составляет от 30 до 70 %. Активность ВПЧ зависит прежде всего от иммунного статуса и реакции организма на инфекцию. Для повышения эффективности терапии в лечебный комплекс необходимо включать противовирусные препараты и иммуномодуляторы для стимуляции иммунного ответа пациента [4, 16].
Показано, что иммунный ответ хозяина имеет большое значение в предотвращении клинической манифестации ВПЧ-инфекции. Клеточный иммунитет играет основную роль как в персистенции, так и в спонтанном регрессе кондилом, который может наступить через 6-8 месяцев. Это подтверждается данными о более высокой частоте ВПЧ-ассоциированных заболеваний у реципиентов трансплантата внутренних органов и ВИЧ-инфицированных. Нарушение Т-клеточного иммунитета у больных кондиломами проявляется снижением количества клеток Лангерганса в очагах поражения и большом числе CD4+- и CD8+-T-лимфоцитов в инфильтрате регрессирующих генитальных бородавок [1].
Изопринозин в лечении ПВИ
Иммуномодулирующее действие Изопринозина заключается в усилении пролиферации и стимулировании функций Т-лимфоцитов: Т-хелперов, естественных клеток-киллеров; увеличении продукции интерлейкинов и нормализации продукции интерферона. Препарат стимулирует биохимические процессы в макрофагах, повышает хемотаксическую и фагоцитарную активность моноцитов, макрофагов и полиморфноядерных клеток. Иммуномодулирующие потенции Изопринозина более активно проявляются в стимулировании клеточного, чем гуморального, иммунитета. Опытным путем было показано, что его действие в большей степени проявляется при иммуносупрессии по сравнению со здоровым организмом. Изопринозин восстанавливает и усиливает деятельность клеток иммунной системы, тем самым повышает способность организма эффективно противостоять инфекциям.
Препарат отличается от других иммуномодуляторов тем, что обладает не только иммуномодулирующим, но и противовирусным (подтвержденным in vivo и in vitro) действием. Противовирусное действие Изопринозина заключается в подавлении репликации ДНК и РНК вирусов посредством связывания с рибосомой клетки и изменения ее стереохимического строения. Фармакокинетика препарата хорошо изучена. Максимальная концентрация Изопринозина достигается через час после приема 1,5 г препарата. Первый период полувыведения (50 минут) связан в выведением инозина и проходит с образованием мочевой кислоты. Второй период полувыведения диметиламино-2-пропанол β-ацетамидо-бензоата равен 3—5 часам, при этом метаболиты выводятся почками. Во время приема Изопринозина не рекомендуется применять иммунодепрессанты, а также лекарственные препараты, обладающие нефротоксичным действием [5, 6].
Благодаря своему комплексному действию Изопринозин более 35 лет успешно применяется при лечении различных, в т. ч. трудно поддающихся терапии, инфекционных заболеваниях кожи и слизистых оболочек. Основными показаниями к применению препарата в дерматовенерологии служат вирусные дерматозы: ПВИ, простой герпес, опоясывающий лишай. Многочисленные исследования подтвердили высокую клиническую эффективность Изопринозина в лечении персистирующих герпес-вирусных инфекций. Антивирусная активность препарата проявляется не только в области клинических проявлений (везикулы, эрозии), но и в нервных ганглиях. Поэтому он оказывает свое лечебное действие как в фазе обострения герпетической инфекции, так и в межрецидивный период. Препарат можно назначать в поддерживающей дозе на период до 6 месяцев [7, 14, 18].
Проведенные исследования показали, что применение инозиплекса в комплексе с деструктивными методами у пациентов с остроконечными кондиломами способствует более активному их разрешению и уменьшает частоту рецидивов, что объясняется активным иммунокорригирующим и противовирусным действиями препарата во всех зонах инвазии ВПЧ в коже [10, 17]. Препарат применяли по 1000 мг три раза в сутки в течение 28 дней.
В настоящее время несомненной представляется ведущая роль ВПЧ в генезе рака шейки матки. ВПЧ также может инициировать и поддерживать хронические воспалительные процессы в нижних отделах гениталий, поскольку при ВПЧ-индуцированном изменении структуры эпителия создаются предпосылки к заражению различными вирусными, бактериальными, протозойными, грибковыми и другими инфекциями. Показано, что одновременное инфицирование ВПЧ и вирусом простого герпеса II типа в два раза повышает риск развития плоскоклеточного рака шейки матки [19]. Имеются данные об успешном применении Изопринозина в лечении ПВИ шейки матки, цервикальной интраэпителиальной неоплазии и даже преинвазивного рака шейки матки.
В поликлиническом отделении Центра охраны здоровья матери и ребенка была изучена эффективность комбинированного лечения (этиотропный препарат, Изопринозин и абляция) 64 больных с гистологически подтвержденными субклиническими формами ПВИ на фоне хронического цервицита. Все пациентки были разделены на основную группу, в которой применяли комбинированное лечение с Изопринозином и этиотропным средством, и контрольную группу, где после курса этиологического лечения проводили только локальную монодеструкцию очагов плоскоклеточного интраэпителиального поражения. Изопринозин назначали по 2 таблетки (1000 мг) 3 раза в сутки на протяжении 5 дней за 7-10 дней до деструкции очагов. Анализ результатов проведенного лечения и последующее наблюдение за пациентками показали, что эффективность комбинированного лечения с применением Изопринозина была выше и составила 87,5 %, а при монодеструкции - 65,6 %. Рецидивирование ПВИ к 6-му месяцу наблюдения было выявлено лишь у 9,4 % женщин, принимавших Изопринозин, а в контрольной группе - у 28,1 % пациенток. Симптоматика воспалительного процесса на шейке матки наблюдалась только при рецидиве ВПЧ-инфекции. Кроме того, на фоне комплексного лечения через 6 месяцев чаще наблюдалась элиминация ВПЧ (65,6 и 46,9 % соответственно) и более качественная эпителизация. На основании полученных данных авторы пришли к выводу, что адекватная иммунотерапия способствует более полной элиминации ПВЧ, т. к. позволяет воздействовать не только на участок эпителия, где произошла клиническая манифестация, но и на резервуары ВПЧ в эпителии, находящиеся в латентном состоянии. Поэтому включение антивирусного иммуномодулирующего препарата Изопринозин в курс лечения больных хроническим цервицитом и ПВИ является обоснованным и перспективным [5].
Заключение
ПВИ вследствие ее широкой распространенности и отсутствия надежных методов лечения на сегодняшний день является актуальной проблемой в клинической практике. Терапевтическая стратегия при этом заболевании должна быть направлена не только на удаление локальных очагов инфекции — остроконечных кондилом, но и на воздействие на субклинические и латентные формы ВПЧ-инфекции. При этом большое значение в предотвращении рецидива и процесса канцерогенеза имеет элиминация ВПЧ. Поэтому в терапевтический комплекс необходимо включать препараты с противовирусным и иммуномодулирующим действиями для активации иммунной системы организма и подавления вирусной активности. Изопринозин является одним из наиболее изученных и эффективных иммунных препаратов с противовирусным действием. Более 35 лет его с успехом применяют в широкой клинической практике для лечения ПВИ и других вирус-ассоциированных заболеваний кожи и слизистых оболочек. Хорошая переносимость препарата, минимум побочных эффектов, возможность применять его в индивидуальной дозировке и в комбинации с другими методами лечения позволяют использовать его в лечении ВПЧ как у детей, так и у взрослых.

Цинк оказывает серьезное влияние на иммунную систему, его дефицит приводит к снижению нормального функционирования различных звеньев иммунитета. Основываясь на этом, было проведено клиническое исследование эффективности приема таблетированного сульфата цинка в дозе 10 мг/кг, ежедневно. О полном исчезновении бородавок сообщили в 87 % случаев, в группе плацебо улучшений не отмечалось.
Механизм действия локальной иммунотерапии с помощью контактного сенсибилизатора основан на реакции гиперчувствительности замедленного типа. Иммунный ответ в данном случае направлен против комплекса сенсибилизатора, который выступает в роли гаптена и вирусных белков, что приводит к быстрому регрессу бородавок. Данный препарат должен отвечать следующим требованиям: к нему должно быть чувствительно, по крайней мере, 95% людей, он должен быть химически стабилен, экономически целесообразен и свободен от побочных эффектов. В 1973 году Льюис впервые сообщил о локальной иммунотерапии при лечении бородавок с помощью Динитрохлорбензола (DNCB). Препарат продемонстрировл 80% эффективность, по сравнению с плацебо – 38%. Данный препарат обладает мутагенными свойствами, вследствие чего не может применяться длительно. Поэтому в качестве контактного сеснсибилизатора в настоящее время применяются два препарата дифинилциклопрофенон (DCP) и дибутиловый эфир сквариковой кислоты (SADBE). Данные препараты имеют длительный срок годности (3–6 месяцев при комнатной температуре).
Бакли и др. провел исследование эффективности DCP у пациентов с бородавками на руках и подошвенными бородавками, сохраняющимися более 8 лет. Пациентов сенсибилизировали трехкратным нанесением 2%-ого раствора DCP в области средней трети плеча, каждые 10 - 14 дней, до возникновения эритемы. После удаления гиперкератоза на бородавки наносился раствор DCP с постепенным повышением концентрации: 0.01 %, 0.05 %, 0.1 %, 0.25 %, 0.5 %, 1.0 %, 1.5 %, 2.0 %, 3.0 %, 4.0 % и 6.0 %. Подошвенные бородавки начинали обрабатывать 2.0 % раствором, бородавки на руках 0.1 %. Обработка проводилась от 1 до 4 раз в месяц, в зависимости от ответа. При каждом посещении, после опроса об отрицательных воздействиях и степени улучшения, концентрация DCP увеличивалась на один шаг, если на предыдущую обработку не было никакого ответа, либо сохранялась предыдущая концентрация, если отмечалась нормальная реакция в виде эритемы, либо концентрация понижалась, если происходило образование пузырей. Сорок два человека из 48 прошли полный курс, эффективность составила 88%. Отрицательные воздействия отмечались у 56 % этих пациентов (болезненное образование вздутий около бородавки, везикулярные высыпания в других областях, гриппоподобные симптомы, паховая лимфаденопатия). Таким образом пациенты с упорным течением данного заболевания, прежде всего с подошвенными и ладонными бородавками могут рассматриваться, как кандидаты для лечения DCP. По сравнению с другими подобными препаратами DCP является менее разрушительным, менее дорогостоящим и может использоваться для параллельного лечения множественных бородавок.
Введение интерферона в область поражения.
При остроконечных кондиломах, устойчивых к другим видам терапии, проводилось местное введение интерферона-альфа. Рандомизированное, двойное слепое, плацебоконтролируемое исследование продемонстрировало полное разрешение у 62 % пациентов по сравнению с 21 % в контрольной группе плацебо.
5-Фторурацил использовался локально в качестве антипролиферативного препарата при лечении бородавок. В одном проспективном, плацебоконтролируемом, слепом, рандомизированном исследовании получена 70 % эффективность. 5-фторурацил вводился вместе с лидокаином, чтобы уменьшить боль и адреналином, чтобы вызвать сужение сосудов, и таким образом длительно сохранить высокую местную концентрацию препарата.
Цемитидин действует как иммуномодулятор в больших дозах, угнетая функцию T-супрессоров, приводит к увеличению пролиферации лимфоцитов, таким образом увеличивает клеточно-опосредованный иммунный ответ. В трех различных исследованиях по эффективности цимитидина не выявлено разницы между группами пациентов получавших препарат и группами плацебо.
Крем с 5 % содержанием имиквимода представляет из себя иммуномодулятор, который может стимулировать синтез цитокинов, включая интерферон-альфа, интерлeйкин 1, интерлeйкин 6, ФНО и др. Поглощение имиквимода черех неповрежденную кожу невилико. Использованиен имиквимода при лечении аногенитальных кондилом было одобрено FDA Соединенных Штатов в 1997, позднее препарат был разрешен для лечения негипертрофического актинического кератоза и базалиомы.
Использование имиквимода для лечения неостроконечных бородавок не было формально оценено рандомизированным, контролируемым исследованием. Однако, в одном открытом, неконтролируемом исследовании, пациенты применяли 5% крем 1раз в день в течение 5 дней подряд, лечение продолжалось до 16 недель или до полного разрешения бородавок. Полное выздоровление произошло у 30 % пациентов; у 26 % пациентов было 50%-ое сокращение размера бородавок. При дальнейшем наблюдении за 32 недели рецидивов не наблюдалось. У 31% отмечалась небольшая местная воспалительная реакция. Недостатком данного препарата является его высокая стоимость и большая длительность курса лечения. Отмечается высокая эффективность использования имиквимода после лазерного удаления бородавок в период непосредственно после заживления раны, что приводило к значительному снижению числа рецидивов.
Проводилась исследование эффективности аутовакцины, полученной из бородавок пациента, вакцина вводилась подкожно раз в неделю, в течение 6 недель. У 84 % пациентов были получены отличные результаты - полная ремиссия наблюдалась в течение 46 месяцев.
Сегодня, развитие новых вакцин для лечения остроконечных кондилом прогрессирует с большой скоростью. Клинические испытания данных вакцин, способных предотвратить развитие вирус-индуцированных опухолей, показали их высокую эффективность и безопасность. С помощью методов генной инженерии, главный белок капсулы вируса папилломы человека - белок L1, экспрессирован на поверхности другого организма – на клетках дрожжей, таким образом клетки дрожжей воспринимаются организмом как вирусы папилломы и вызывают иммунный ответ. Квадривалентная вакцина (6, 11, 16 и 18 типы вирусов) показала в 90% уменьшение возникновения у женщин персистирующей ВПЧ-инфекции в течение 36 месяцев, по сравнению с группой плацебо. В настоящее время эти вакцины выполняют только профилактическую роль, при уже имеющейся ВПЧ-инфекции они не имеют терапевтической ценности. К сожалению отсутствуют вакцины созданные для предотвращения развития вульгарных бородавок.

Блеомицин, антибиотик, полученный из Streptomyces verticillus, является терапией резерва для бородавок плохо поддающихся лечению. Препарат оказывает влияние на кератиноциты и ретикулоэндотелиальные ткани, угнетает синтез ДНК и белков, является сигнальным веществом для начала апоптоза (запрограммированной клеточной гибели). Блеомицин не действует непосредственно на вирус, он вызывает острый некроз ткани, который в свою очередь приводит к стимуляции иммунного ответа, что подтверждается тем, что у иммуносупрессивных пациентов (после трансплантации почки) эффективность резко снижается. Блеомицин из-за его токсичности не рекомендуется использовать у детей, беременных и иммуносупресивных пациентов. Нежелательными эффектами являются боль, чувство жжения, отек в течение 24 - 72 часов после инъекции. Побочными эффектами являются синдром Рейно, с дистрофическими изменениями или полной потерей ногтевых пластин. Также блеомицин может вызвать лимфангит и гиперпигментацию. Двойное слепое, плацебо-контролируемое исследование применения блеомицина при бородавках, не поддающихся, по крайней мере, двум традиционным методам лечения, сравнило одно - двукратное введение блеомицина с введением обычного физиологического раствора. Эффективность при подошвенных бородавках составила (60 %), при околоногтевых бородавках (94 %), при локализации в любых других местах на конечностях, но с предварительным удалением гиперкератоза - 95 %. Таким образом, эффективность лечения зависит от его техники. При использовании раздвоенной иглы, эффективность достигала 92%, при этом проводилось только одно введение блеомицина с использованием техники многократных инъекций, при данном методе потребовалось всего 0.001 единиц блеомицина, по сравнению с обычной техникой, где используется 0.2 единицы. Нужно избегать попадания блеомицина на неповрежденную тонкую кожу. Другая техника заключалась в местном нанесении на бородавку капли блеомицина, а уже затем проводился укол иглой 28 размера, эффективность этой техники сосавила 92%. Также описаны случаи, когда для введения блеомицина использовался модифицированный аппарат для татуировок.
Пять рандомизированных, контролируемых исследований оценивали эффективность блеомицина, однако полученные результаты оказались противоречивы - результат варьируется от 16% до 94%. В трех исследованиях показана более высокая эффективность блеомицина по сравнению с плацебо, в четвертом не было выявлено различий, а в пятом показано, что эффективность плацебо больше, чем у блеомицина. При этом не выявлено связи между эффективностью и дозой введенного блеомицина в течение всего курса лечения (3 месяца).
Эпидермальный рост и дифференцировка угнетаются ретиноидами, таким же образом нарушается и рост бородавки. Более того, они являются мощными иммуномодуляторами, есть данные, что ретиноиды могут нарушать транскрипцию вируса в инфицированных клетках. Ретиноиды могут применяться как внутрь, так и местно. Лечение бородавок кремом, содержащим третиноин приводило к излечению 85% детей, по сравнению с группой плацебо - 32%. У группы детей, которые ежедневно принимали этритинат (тигазон) в течение 3 месяцев выздоровление наблюдалось в 80% случаев. Другое исследование показало эффективность системного приема изотретиноина (роаккутана), особенно при кондиломах. В связи с этим большой интерес представляет использование ретиноидов для лечения/профилактики рака шейки матки, индуцированного вирусом папилломы человека.
Экстракт смолы из корней Podophyllum peltatum, который произрастает на востоке и среднем западе Северной Америки, использовали еще индейцы для лечения бородавок. Из сырого экстракта, получают подофиллотоксин, 4-диметилподофиллотоксин, альфа-пелтатин и бетта-пелтатин. Первое применение подофиллина во врачебной практике состоялось в 1930 году в Новом Орлеане, подофиллин был использован для лечения гинекологических кондилом. С тех пор смола подофиллина использовалась главным образом в лечении кондилом.
Исследование 1990 года продемонстрировало эффективность 41%, проводилось лечение подофиллином кондилом в аногенитальной области в течение 6 недель, однако в течение 3-х месяцев только у 17% наблюдалась полная ремиссия. Похожие данные были получены в 1991 году - эффективность 45%, у 73 % из них ремиссия сохранялась в течение 9 месяцев. Этот результат сравнивался с подкожным введением интерферона-α2a, в течение 3 месяцев, эффективность составила 23%, из них у 77% ремиссия сохранялась в течение 9 месяцев. Преимущество подофиллина состоит в том, что он может наноситься самостоятельно, и стоимость его невелика. В исследованиях, проводимых между 1969 и 1975 годами, эффективность подофиллина составила 81% при лечении подошвенных бородавок (данный процент сопоставим с 84% эффективности при использовании салициловой и молочной кислоты). Стандарты лечения аногенитальных кондилом в Америке и Англии включают подофиллин в свои рекомендации, однако показано, что смола подофиллина менее эффективна, с трудом поддается стандартизации по действующему веществу и вследствии этого иногда приводит к токсичности, а также менее экономически выгодна, чем очищенный подофиллотоксин.
Растение Podophyllum hexandrum произрастет в гористых областях Индии и в Гималаях, содержит более высокое содержание подофиллотоксина, который собственно и вызывает нарушение клеточного деления, благодаря связыванию с микротрубочками, участвующими в метафазе митоза. В небольшом слепом, плацебоконтролируемом, рандомизированном исследовании (19 человек в группе лечения и 19 человек в группе контроля), пациенты самостоятельно наносили 0,5% раствор подофиллотоксина, 2р/день- 3 дня подряд, в течение 4-х недель. Эффективность лечения: у 94.9 % уменьшилась область распространения, у 84.1 % сократилось количество бородавок, аналогичные значения для группы плацебо составили 7.1 % и 2.6 %. Однако только у 21% сохранялась ремиссия в течение 2-х недель, и у всех пациентов отмечался рецидив при долгосрочном наблюдении. Таким образом, подофиллотоксин оказался эффективным только для краткосрочного лечения.
Более позднее рандомизированное исследование заключалось в сравнении наружного лечения остроконечных кондилом 20%-ым раствором подофиллина и самостоятельного нанесения 0.5 % крема с подофиллотоксином - 2р/день-3 дня, через неделю по такой же схеме лечение повторялось. Эффективность у пациентов получавших подофиллин составила 74%, а у пациентов, самостоятельно наносивших крем с подофиллотоксином 94 %. Возможность самостоятельного нанесения препарата делает этот метод очень привлекательным для лечения кондилом.

Нитрат серебра раньше был широко известен, прежде всего, как препарат, использующийся у новорожденных с целью предотвращения конъюнктивита. Но затем он был вытеснен антибиотиками, и в дальнейшем применялся для прижигания гнойных и пупочных гранулем, при носовом кровотечении, при мозолях и бородавках. Данный метод в настоящее время более широко используется в Англии, где карандаши апликаторы содержащие 95%-нитрат серебра доступны для продажи без рецепта. В Соединенных Штатах, однако, Управление по контролю за продуктами и лекарственными средствами предупредило потребителей, что все безрецептурные препараты, содержащие коллоидное серебро или соли серебра для внутреннего или наружного применения, не являются безопасными. Применение нитрата серебра должно проводится с осторожностью, чтобы избежать чрезмерных ожогов и необратимого окрашивания ткани. Клиническая эффективность метода оценивается как средняя и составляет 43 %, однако через месяц после окончания терапии наблюдалось выздоровление еще у 26%. Нитрат серебра применялся трехкратно, с перерывом между каждой апликацией в три дня. Лечение в группе плацебо закончилось выздоровлением 11% и улучшением в 14% случаев.
Салициловая кислота – это лечение, которое в первую очередь выбирает большинство пациентов, так как оно самое недорогое. Это кератолитическая терапия, т.е. сопровождающаяся разрушением зараженного вирусом эпидермиса, при этом раздражающее действие салициловой кислоты приводит к усилению местного иммунного ответа. Используется салициловая кислота с концентрацией от 10 до 60%. Из безрецептурных препаратов доступна 17%-ая салициловая кислота, в виде крема, и 40%-ый пластырь. Основные преимущества салициловой кислоты: удобство применения, экономическая выгода, незначительная боль. Недостатком данного метода является его длительность. Основной побочный эффект - контактный дерматит. Бородавки размачиваются в теплой воде в течение 5 мин, затем с помощью пемзы снимается поверхностный гиперкератоз и накладывается салициловая кислота. Салициловая кислота в виде крема меняется каждые сутки, в виде пластыря каждые 48 часов. Пациенты (особенно дети) обычно хорошо принимают данный вид лечения. Обзор, посвященный 13 разным исследованиям эффективности салициловой кислоты в концентрациях от 15 % до 60 % (большее количество исследователей использовали салициловую кислоту от 15 % до 26 %, иногда в комбинации молочной кислотой), показал эффективность данного лечения в 75 %, по сравнению с 48 % в группе плацебо. Монотерапия 5-фторурацилом, глютаральдегидом, криотерапия или лечение подофиллином оказались менее эффективными, чем лечение салициловой кислотой. Особенно хорошо для лечения данным методом подходят подошвенные бородавки, в отличие от бородавок на лице, лечение которых осложняется раздражением и опасно возможным рубцеванием.
Кантаридин (ангидрид кантаридиновой кислоты)- получают из половых желез жука известного, как Шпанская мушка. Применение данного препарата приводит к эпидермальному некрозу клеток, акантолизу, что клиническое проявляется формированием пузыря. С 1992 года лекарственное средство больше не доступно в Соединенных Штатах, но по-прежнему может быть приобретено в Канаде. Способ применения: кантаридин, так же, как и салициловая кислота накладывается на предварительно очищенную от гиперкератоза бородавку и закрывается пластырем на 24 часа. На месте бородавки образуется пузырь, который заживет через 1 - 2 недели. Повторное нанесение кантаридина возможно через 1-3 недели. Эффективность лечения, как при подошвенных, так и при околоногтевых бородавках достаточно высока и составляет 80%. Преимуществами метода является отсутствие болезненности и рубцевания. К сожалению, не было проведено ни одного рандомизированного, плацебоконтролируемого исследования для лечения кантаридином вульгарных бородавок.
Что такое папилломавирусная инфекция (ВПЧ)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Борисовой Элины Вячеславовны, гинеколога со стажем в 35 лет.
Над статьей доктора Борисовой Элины Вячеславовны работали литературный редактор Юлия Липовская , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Папилломавирусная инфекция — это состояние, развивающееся при заражении какой-либо разновидностью вируса папилломы человека (ВПЧ). Возбудители данной группы могут существовать только в человеческом организме, поражая кожу и слизистые оболочки, приводя к появлению папиллом, бородавок, плоских и остроконечных кондилом. [1] [2] [4]
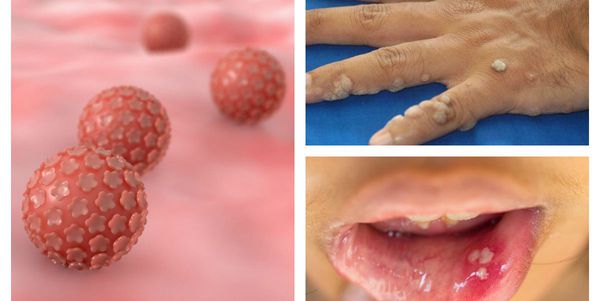
ВПЧ довольно широко распространён в человеческой популяции, особенно среди сексуально активных людей, а это свыше 80% всего населения. До недавнего времени вирусы этой группы считались относительно безобидными, вызывающими лишь косметические дефекты, но последние научные исследования показывают, что проблема гораздо серьёзнее. [9]
На сегодняшний день науке известно несколько сотен штаммов (типов) папилломавирусов . Около 40 из них преимущественно поражают аногенитальную область и передаются половым путём. Особую опасность представляют штаммы высокого онкогенного риска, так как они могут спровоцировать развитие онкологических заболеваний, в том числе рака шейки матки.
Чаще всего заражение происходит в молодом возрасте, как правило, с началом половой жизни, при этом возможно неоднократное инфицирование. Наиболее уязвимой группой в плане вероятности заражения ВПЧ и развития неблагоприятных последствий являются молодые женщины в возрасте 15-30 лет.
Помимо этого ВПЧ может перейти от инфицированной матери к ребёнку, например, при родах. Не исключается и контактно-бытовой способ передачи возбудителя, например, при соприкосновениях и даже при совместном использовании предметов личной гигиены.
К факторам риска, способствующим заражению ВПЧ, развитию хронической папилломавирусной инфекции и её переходу в предраковые состояния с потенциальным перерождением в злокачественную опухоль, относятся:
- иммунодефицит любого происхождения, в том числе вследствие ВИЧ-инфекции, лучевых поражений, применения иммунодепрессантов при трансплантации органов и тканей, лечения цитостатиками и других причин;
- подавленное состояние иммунитета во время беременности;
- раннее начало половой жизни;
- частая смена половых партнёров, незащищённый секс;
- инфицированность высокоонкогенными штаммами ВПЧ;
- заражение одновременно несколькими типами ВПЧ;
- наличие других инфекций, передающихся половым путём, например, герпесвирусной и цитомегаловирусной инфекции, вируса Эпштейна — Барр, гепатитов В и С, гонореи и трихомониаза;
- стресс, истощение, гиповитаминоз, гормональный дисбаланс;
- многократные роды и аборты;
- тяжёлые хронические заболевания, в том числе сахарный диабет;
- вредные привычки (курение, злоупотребление спиртным);
- низкий социальный статус, плохие условия жизни, неудовлетворительная интимная гигиена;
- пренебрежение регулярными профилактическими обследованиями (один из важнейших факторов риска);
- низкий уровень развития медицины в регионе проживания.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы папилломавирусной инфекции
Далеко не всегда человек догадывается о наличии в своём организме папилломавирусной инфекции, оставаясь при этом источником заражения для потенциальных партнёров. [1] [2] Дело в том, что заболевание может долгое время протекать бессимптомно: вирус скрыто существует в организме от нескольких месяцев до нескольких лет, никак себя не проявляя. Кроме того, уже имеющиеся проявления инфекции не всегда доступны для наружного обзора. Например, если папилломы, бородавки и кондиломы на открытых участках тела и поверхности гениталий ещё можно заметить самостоятельно, то патологические изменения, локализующиеся на шейке матки, сможет обнаружить только специалист в ходе осмотра с применением соответствующих инструментов.
И всё же существует несколько симптомов, которые прямо или косвенно могут указывать на наличие папилломавирусной инфекции и её неблагоприятных последствий. [3] К ним относятся:
- появление на коже и/или слизистых оболочках каких-либо разрастаний различных форм (на тонкой ножке или с широким основанием, нитевидной, округлой или плоской конфигурации, в форме цветной капусты или петушиного гребня) и размеров (от образований в несколько миллиметров до разрастаний, занимающих всю промежность);
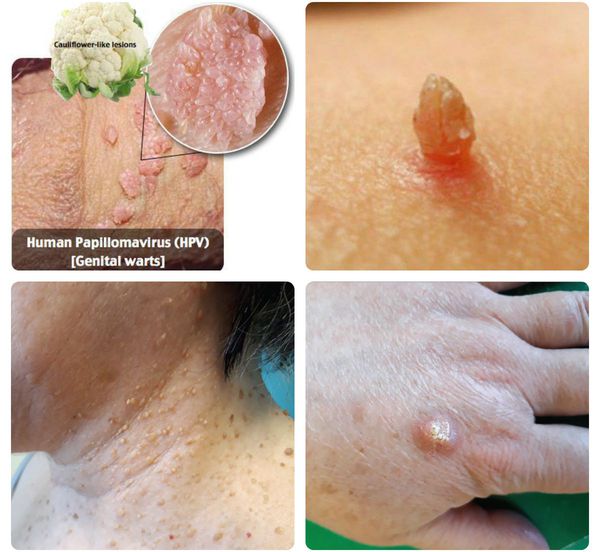
- отёчность и воспалительная инфильтрация папилломатозных разрастаний (остроконечных кондилом), их ранимость и кровоточивость, что приводит к присоединению вторичной инфекции с появлением гнойного отделяемого с неприятным запахом;
- зуд, жжение, мокнутие в области промежности, появление обильных белей, даже при отсутствии видимых патологических образований;
- межменструальные кровянистые выделения, в том числе появляющиеся в результате полового контакта:
- дискомфорт во время полового акта.
Наиболее тревожными признаками заболевания являются:
- постоянные боли в области спины и таза;
- слабость;
- беспричинная потеря веса;
- опухание одной или обеих ног.
Патогенез папилломавирусной инфекции
Заражение папилломавирусной инфекцией происходит при попадании вирусных частиц на кожу или слизистую оболочку. [1] [2] Излюбленная локализация инфекции на теле женщины — промежность, большие и малые половые губы, вульва, влагалище и шейка матки, у мужчин — половой член. Может также произойти поражение слизистой полости рта, пищевода, мочевого пузыря, трахеи, конъюнктивы и других органов и тканей.
Заражению способствуют микротравмы и потёртости. Особенно благоприятные для инфицирования условия создаются при половом акте. В 60–80% случаев достаточно однократного сексуального контакта с больным папилломавирусной инфекцией или бессимптомным носителем ВПЧ. К развитию заболевания может привести попадание в организм буквально единичных вирусных частиц.
При наличии предрасполагающих факторов (микроповреждения, слабого иммунитета и других) возбудитель проникает в эпителиальную ткань до её базального слоя. Там он прикрепляется к оболочке незрелой клетки и внедряется сначала в её цитоплазму, а затем и в ядро, где повреждает генетический аппарат. После этого начинается деление клеток с изменённым геномом, что приводит к появлению в месте внедрения вируса генитальных кондилом (образований, которые постепенно разрастаются), а, например, на шейке матки — к развитию диспластических процессов различной степени тяжести (дисплазия шейки матки).
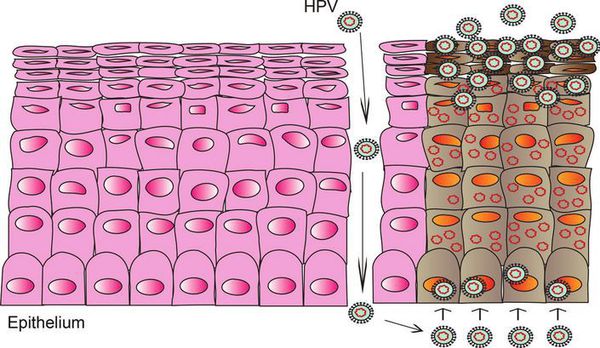
В случае ВПЧ высокого онкогенного риска определённые гены в вирусной ДНК кодируют синтез специфических белков-онкопротеинов (Е6 и Е7), которые подавляют противораковую защиту клеток. Под действием онкопротеинов нарушается стабильность генома клеток, стимулируется их размножение и снижается способность к дифференцировке — всё это со временем может привести к онкопатологии. [12]
Формирование новых полноценных вирусных частиц, способных инфицировать другого человека, происходит уже не в базальном, а в самых поверхностных слоях поражённого эпителия. Возбудитель может содержаться в слущивающихся отмирающих клетках, которые отделаются слизистой оболочкой. Таким образом они переходят к новому хозяину при тесном (сексуальном или бытовом) контакте.
Классификация и стадии развития папилломавирусной инфекции
По способности индуцировать развитие злокачественных новообразований ВПЧ подразделяют на четыре группы: [8]
- неонкогенные штаммы ВПЧ (типы 1-5);
- ВПЧ низкого онкогенного риска (типы 6, 11, 40, 42-44, 54, 61, 70, 72, 81);
- ВПЧ среднего онкогенного риска (типы 26, 31, 33, 35, 51-53, 58, 66);
- ВПЧ высокого онкогенного риска (типы 16, 18, 39, 45, 56, 59, 68, 73, 82).
Клинические формы папилломавирусной инфекции: [5]
- латентная — скрытая форма, не имеющая клинических и морфологических признаков, но обнаруживаемая иммунохимическими и молекулярно-биологическими методами;
- субклиническая — возникает у лиц с нормальным иммунитетом, определяется только специальными диагностическими методами (пробы с растворами-индикаторами, гистологические и цитологические исследования);
- манифестная — появляется у лиц с временным или стойким снижением иммунитета, в случае генитальной папилломавирусной инфекции характеризуется появлением кондилом.
Латентная инфекция может переходить в субклиническую и манифестную форму в случае возникновения предрасполагающих условий (факторов риска), но чаще всего она протекает бессимптомно, не манифестируя.
Клинические проявления папилломавирусной инфекции:
- кожные поражения: подошвенные, плоские и обычные (вульгарные) бородавки, бородавчатая эпидермодисплазия, бородавки Бютчера и небородавчатые поражения кожи;
- поражения слизистых оболочек гениталий: кондиломы, некондиломатозные поражения, карциномы;
- поражения слизистых вне гениталий: папилломатоз гортани, карциномы шеи, языка и другое.
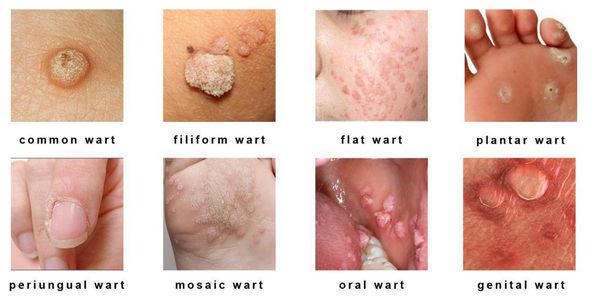
Разновидности поражений:
- экзофитные — видимые разрастания в виде папиллом и бородавок;
- эндофитные — образования, располагающиеся в толще ткани, которые не видны невооружённым глазом.
Осложнения папилломавирусной инфекции
Основными наиболее опасными осложнениями папилломавирусной инфекции являются злокачественные новообразования. Но возможны и другие серьёзные последствия:
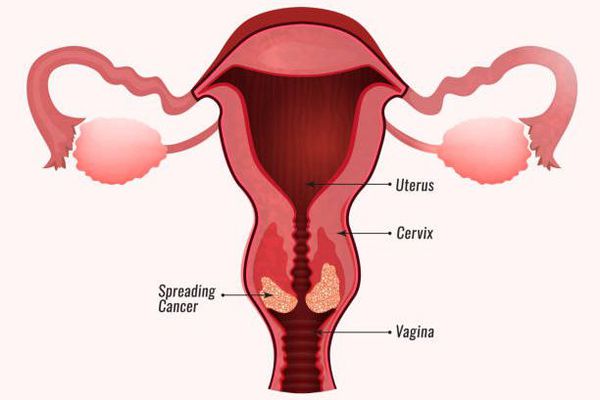
- Злокачественные новообразования заднего прохода, вульвы, полового члена и ротоглотки. Повышение риска их развития также связывают с высокоонкогенными штаммами ВПЧ. [6]
- Остроконечные кондиломы на гениталиях, папилломатоз верхних дыхательных путей (рецидивирующий респираторный папилломатоз, веррукозный ларингит). Причиной возникновения могут стать 6-й и 11-й типы вируса, несмотря на свой низкий онкогенный риск. В случае папилломатоза есть вероятность полной потери голоса, обструкции (перекрытия) гортани с развитием асфиксии. Это довольно редкое заболевание может возникать у детей, рождённых женщинами с папилломавирусной инфекцией. По разным данным, заражение может происходить как во время родов, так и внутриутробно. Как правило, респираторный папилломатоз начинает проявляться в детском и подростковом возрасте, он склонен к неоднократным рецидивам после удаления множественных папиллом, перекрывающих дыхательные пути.
- Гнойно-септические осложнения. Папилломатозные разрастания на слизистых оболочках очень ранимы, легко травмируются, и через участки мокнутия, расчёсов и потёртостей может проникать вторичная инфекция, которая в свою очередь и вызывает нагноение.
Диагностика папилломавирусной инфекции
Основные цели диагностических мероприятий: [3]
- ранняя диагностика папилломавирусной инфекции для динамического наблюдения и лечения;
- своевременное обнаружение и лечение предраковых изменений, что позволяет на 80% предотвратить развитие злокачественных новообразований;
- выявление онкологических новообразований на ранних стадиях, что в большинстве случаев даёт хороший прогноз эффективного излечения;
- решение вопроса о целесообразности вакцинации.
Для выявления папилломавирусной инфекции на сегодняшний день существует целый комплекс диагностических процедур:
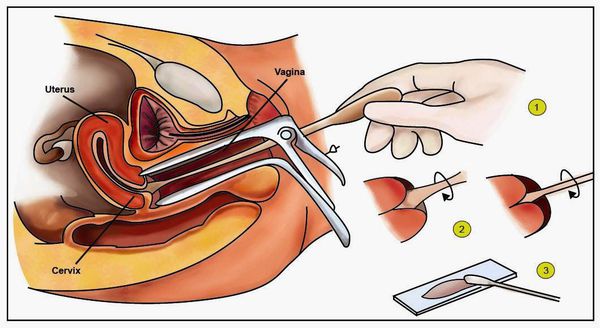
- Гинекологический осмотр в зеркалах — позволяет увидеть папилломатозные разрастания (аногенитальные кондиломы) и другие изменения.
- Классический тест Папаниколау (мазки с поверхности шейки матки и стенок влагалища для цитологического исследования) — обнаруживает ранние признаки дисплазии и злокачественного перерождения.
- Пробы с уксусной кислотой и раствором Люголя — выявляют участки поражения слизистой шейки матки.
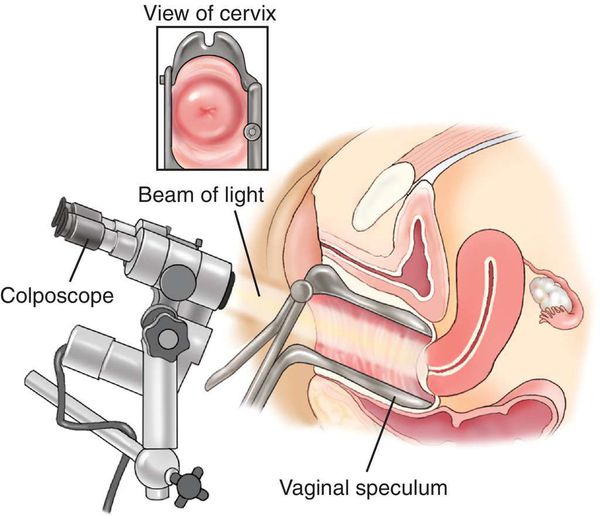
- Кольпоскопия, в том числе с биопсией подозрительных участков и их гистологическим исследованием, — определяет характер имеющегося новообразования.
- Иммунофлюоресцентный анализ (ИФА) обнаруживает в цервикальном соскобе онкопротеины (Е7 и Е6). Этот метод достаточно новый, с его помощью можно различить носительство ВПЧ и первые признаки злокачественного перерождения в клетках, [12] оценить агрессивность данного процесса, сделать предположения относительно прогноза заболевания.
- Полимеразная цепная реакция (ПЦР) находит вирусную ДНК в биологическом материале (соскоб со слизистой), определяет тип ВПЧ, степень его онкогенности, а также количество вирусных частиц, что косвенно позволяет судить о характере течения папилломавирусной инфекции у данного пациента, возможности спонтанного излечения или высокого риска прогрессирования. Обнаружение ВПЧ с помощью этого возможно даже при латентном течении болезни, когда цитологические и гистологические методы не эффективны.
Целесообразно дополнительное обследование пациента на наличие других инфекций, передающихся половым путём, так как папилломавирус в 90% случаев с ними сочетается, и это может осложнять течение заболевания.
Лечение папилломавирусной инфекции
Лечение папилломавирусной инфекции должно быть комплексным и включать следующие составляющие: [3] [5]
- деструкцию (удаление) видимых проявлений (аногенитальных кондилом и др.);
- иммуномодулирующую терапию;
- противовирусную терапию;
- лечение сопутствующих инфекций, передающихся половым путём.
Деструктивные методы делятся на две основные группы:
- химические — с применением трихлоруксусной кислоты, а также таких препаратов, как "Солкодерм", "Колломак", "Ферезол" и др.;
- физические — хирургическое удаление, электрокоагуляция, криодеструкция, радиоволновая и плазменная коагуляция, лазеротерапия.
Лечение сопутствующих половых инфекций проводят до начала деструктивной терапии на фоне адекватной иммунокоррекции.
Удаление видимых проявлений папилломавирусной инфекции должно сочетаться с противовирусной терапией — как с общей, так и с применением препаратов местного действия после удаления кондилом.
Следует помнить, что успешно проведённое лечение не исключает развитие рецидивов в дальнейшем, особенно у пациентов с нарушениями иммунитета. Поэтому за ними устанавливается динамическое наблюдение в течение как минимум 1-2 лет.
Прогноз. Профилактика
В 90% случаев здоровая иммунная система человека справляется с папилломавирусной инфекцией самостоятельно за период от полугода до двух лет с момента инфицирования, после чего происходит полное выздоровление с исчезновением вируса из организма. При этом не формируется напряжённого пожизненного иммунитета, то есть человек может заразиться повторно.
В других случаях, при наличии предрасполагающих факторов, заболевание приобретает хроническую форму, склонную к длительному скрытому течению с периодическими рецидивами и возможным развитием тяжёлых осложнений.
От момента попадания вируса в организм до развития предраковых состояний и тем более возникновения рака может пройти достаточно много времени, иногда десятки лет. Поэтому регулярные профилактические обследования, своевременное выявление и лечение предраковых состояний — вполне реальный и эффективный способ избежать самого неблагоприятного варианта развития событий. [13] С этой целью Всемирная организация здравоохранения рекомендует всем женщинам старше 30 лет при первичном скрининге проходить не только “рутинное” цитологическое исследование, но и делать тест на наличие ВПЧ. [10]
Регулярное посещение гинеколога (при отсутствии каких-либо жалоб — раз в год) с проведением теста Папаниколау позволяет своевременно обнаружить начальные признаки дисплазии и предпринять все необходимые меры для предотвращения прогрессирования процесса и его перехода в онкологическое заболевание.
Использование методов барьерной контрацепции хоть и не полностью защищает от инфицирования, но несколько снижает его вероятность.
Главным методом первичной профилактики папилломавирусной инфекции считается вакцинация. [11] Современные вакцины разработаны с целью защиты от наиболее опасных, высокоонкогенных штаммов ВПЧ, ответственных за 70-80% случаев развития рака шейки матки. Стандартный курс, состоящий из трёх прививок, даёт вполне надёжную защиту.
Читайте также:

