Хронический гастрит с дисплазией эпителия что это такое
Обновлено: 24.04.2024
Аденома желудка (аденоматозный полип) — это доброкачественное новообразование из клеток железистого эпителия с признаками дисплазии. Макроскопически она представляет собой вырост слизистой оболочки на тонкой ножке, либо на широком основании. Микроскопически определяется хаотическое разрастание эпителия с многочисленными морфологическими изменениями (ядерный полиморфизм, признаки пролиферации и т. д.).
Аденомы желудка являются серьёзной патологией. Риск их перерождения в рак чрезвычайно высок – 40-50 %. Поэтому своевременное выявление и лечение аденоматозных образований считается одним из приоритетных направлений современной гастроэнтерологии.
Причины развития
Чаще всего аденоматозные полипы желудка развиваются из-за атрофического гастрита или гастрита с пониженной кислотностью. Также фоном для появления доброкачественных опухолей могут послужить любые хронические заболевания пищеварительной системы (эрозии, язвенная болезнь и т. д.).
Основные причины, приводящие к образованию аденом, следующие:
- «внедрение» в оболочку слизистой желудка участков кишечного эпителия — кишечная метаплазия;
- чрезмерная клеточная пролиферация на фоне хронического воспаления с последующей гиперплазией эпителиальной ткани;
- повреждение внутренней оболочки желудка продуктами жизнедеятельности микроорганизмов Helicobacter pуlori, которые снижают кислотность пищеварительного сока и защитные свойства выделяемой слизи;
- систематический приём ингибиторов протонной помпы, которые подавляя выработку соляной кислоты, тем самым увеличивают продукцию гастрина, стимулирующего деление клеток.
По статистике мужчины болеют в два раза чаще женщин. Развивается патология обычно в возрасте 40-60 лет. У некоторых людей имеется генетическая предрасположенность к образованию доброкачественных опухолей желудочно-кишечного тракта. Чрезмерное курение, употребление грубой пищи и крепких спиртных напитков, приём некоторых медикаментов также способствует появлению аденом.
Симптомы
Аденома желудка часто протекает бессимптомно и становится «случайной» находкой при эндоскопическом исследовании ЖКТ. Так как новообразования формируются преимущественно на фоне атрофического гастрита (реже они связаны с другой желудочной патологией), у пациента будет наблюдаться клиническая картина, характерная для данного заболевания:
- снижение аппетита;
- отрыжка;
- изжога;
- тошнота;
- рвота, после употребления грубой, «тяжёлой», жирной, острой еды;
- дискомфорт, тяжесть и боли в эпигастральной области;
- ощущение переполнения желудка, даже после приёма малой порции пищи.
При разрастании полипов и увеличении их размеров до 2 см и более, могут появляться следующие симптомы патологии:
- Постоянная ноющая боль в желудке, на зависящая от приёма пищи, связанная с наличием воспаления в слизистых оболочках ЖКТ.
- Признаки внутреннего кровотечения, возникающие при повреждении или изъязвлении аденомы (дёгтеобразный стул, рвота с кровью, анемия).
- Симптоматика, связанная с хронической кровопотерей, — снижение массы тела, быстрая утомляемость, упадок сил, усталость, головокружения, тахикардия и т. д.
Аденоматозный полип желудка может в любой момент трансформироваться в аденокарциному. Как правило, при малигнизации опухоли состояние человека ухудшается.
Аденомы могут приводить к развитию серьезных осложнений. При перекруте ножки, питающей полип, возникает тромбоз сосудов и некроз тканей. У пациента появляются интенсивные боли в желудке, повышается температура тела и также добавляются другие признаки интоксикации организма. Если произошло ущемление аденоматозного образования, продвижение еды по пищеварительному тракту останавливается и в эпигастральной области появляются резкие схваткообразные боли. Оба состояния требуют неотложной врачебной помощи.
Классификация аденомы желудка
Аденоматозный полип может располагаться на любом участке органа. Чаще аденома желудка локализуется в антральном отделе и в области привратника (место перехода в 12-типерстную кишку).
Аденомы желудка по гистологическому типу подразделяют на три группы:
- Ворсинчатый (виллезный, папиллярный) тип аденомы. Является наиболее благоприятным в плане дальнейшего прогноза. Опухоль, как правило, имеет широкое основание и характерный «мохнатый» внешний вид. Она состоит из множества ворсинок и соединительнотканных элементов с небольшим количеством железистого эпителия (не более 25%).
- Смешанная форма аденомы. Имеет более выраженную степень дисплазии по сравнению с предыдущим видом. Опухоль содержит в разном соотношении ворсинчатые и тубулярные структуры. На долю папиллярной ткани приходится от 25 до 75%).
- Тубулярная аденома. Является наиболее распространённым видом. Опухоль имеет чёткие границы, малиновый цвет, состоит из эпителиальных желез. Под микроскопом видны многочисленные изменённые, ветвящиеся трубочки, более длинные и широкие, чем в норме. Для этой аденомы характерны медленный рост и высокая степень малигнизации.
Клиницисты подразделяют аденоматозные полипы желудка на доброкачественные, переходные типы и малигнизированные (рак).
Диагностика
Диагностировать патологию и определить гистотип опухоли позволяет эндоскопическое исследование желудка (ФГДС). С помощью гастроскопии можно детально изучить состояние слизистой органа, обнаружить аденомы размером даже менее 5 мм, оценить структуру каждого новообразования и взять гистологический материал для анализа.
Также диагностика включает в себя опрос и осмотр пациента, рентгеноскопию желудка с контрастированием, общие клинические анализы, лабораторные тесты и другие методики. При подтверждении злокачественного процесса дальнейшее обследование и лечение проводит онколог.

Лечение аденомы желудка
Диагностированная аденома желудка требует активной врачебной тактики, так как в большинстве случаев она трансформируется в рак, и тут особо опасна тубулярная форма. Выбор лечения в основном зависит от гистологического строения и размера новообразования.
Папиллярные и смешанные варианты в некоторых случаях допускают выжидательную тактику (малый размер, наличие медицинских противопоказаний к операции и т. д.). Если аденоматозный полип в желудке не удаляют, пациент ежегодно проходит гастроскопию. При появлении признаков малигнизации, быстром росте опухоли или наличии осложнений поднимается вопрос о хирургическом вмешательстве.
Тубулярные аденомы всегда подлежат оперативному лечению. Для удаления полипов небольшого размера на тонкой ножке, не имеющих признаков атипии, используется гастроскоп. На слизистый нарост накидывается петля и с помощью электрокоагуляции его убирают. Такой способ считается менее травматичным и менее опасным для пациента. Слизистая желудка восстанавливается через 2-8 недель. Спустя 2-3 месяца после операции проводится контрольная эндоскопия, чтобы подтвердить отсутствие рецидива.
Если у аденомы широкое основание, опухоль имеет большой диаметр или насчитывается несколько крупных полипов, применяют лапароскопический доступ. При выявлении в аденоматозном образовании злокачественных клеток может быть проведена резекция желудка или другие радикальные операции, с учетом показаний и стадии процесса. Также оперативные вмешательства могут выполняться «открытым» доступом через разрез брюшной стенки.
Питание при аденоме желудка
Диета при аденоматозных полипах в желудке назначается гастроэнтерологом с учётом фоновой патологии (язвенная болезнь, гастрит и т. д.). Для предупреждения роста аденом и их рецидива после операции рекомендуется соблюдение следующих правил:
- Из меню исключают «тяжёлые», жирные, острые и любые блюда, которые могут травмировать желудочную слизистую или вызвать её раздражение. То же касается напитков.
- Сводится к минимуму потребление «вредной» пищи, фастфуда, полуфабрикатов и т. д.
- Нельзя переедать, желательно есть малыми порциями с соблюдением принципов рационального питания.
Любая погрешность в режиме питания способна усугубить течение болезни.
Профилактика
Специфических профилактических мер при данной патологии не разработано. Чтобы свести к минимуму риск образования аденоматозных полипов и злокачественных новообразований желудочно-кишечного такта, следует придерживаться правил здорового образа жизни. Важно соблюдение «щадящей» диеты.
Также необходимо отказаться от вредных привычек (курение, алкоголь) и приёма некоторых лекарственных препаратов (НПВС, кортикостероиды и другие). Нельзя допускать стрессов. Следует вовремя лечить хронические заболевания органов пищеварения.
При своевременном обнаружении аденомы и её радикальном лечении, как правило, прогноз благоприятный.
В «Евроонко» имеется все необходимое оборудование для точной диагностики и эффективного лечения аденомы желудка. Наши специалисты руководствуются современными и официально одобренными протоколами и стандартами. Предпочтение отдается малотравматичным методикам, но при необходимости наши хирурги готовы выполнить операции любой сложности.
Цель исследования. Оптимизировать тактику ведения пациентов с диспластическими изменениями желудка низкой степени, включающую хромоскопию, магнификационное эндоскопическое исследование, применение эндоскопических методов лечения. Материал и методы исследования. Скрининговому эндоскопическому исследованию были подвергнуты 13255 больных с хроническим гастритом, в результате чего у 224 пациентов были диагностированы диспластические изменения, в том числе у 190 – дисплазия низкой степени, у 34 пациентов – дисплазия высокой степени. Всем больным с диспластическими изменениями выполняли магнификационную гастродуоденоскопию, хромоскопию 0,5 % раствором метиленового синего с забором гастробиоптатов слизистой оболочки желудка (СОЖ), при выявлении дисплазии высокой степени проводили эндоскопическое ультразвуковое исследование (ЭУЗИ). Результаты и выводы. Пациентам с дисплазией СОЖ низкой степени выполняли колпачковую или петлевую резекцию участка диспластически измененной СОЖ. Проведенное исследование продемонстрировало, что динамическое наблюдение больных в группе риска развития пренеопластических поражений желудка, включающее комплексную диагностику с эндоскопическим ультразвуковым исследованием и магнификационной эндоскопией, индивидуализированный забор материала для патогистологического исследования в зависимости от степени дисплазии, позволяет своевременно диагностировать и лечить пренеопластические изменения и ранний рак желудка.

1. Аруин Л.И., Капуллир Л.Л., Исаков В.А. Морфологическая диагностика болезней желудка и кишечника. – М.,1998. – 484 с.
2. Аруин Л.И., Кононов А.В., Мозговой С.И. Новая классификация хронического гастрита // Актуальные вопросы патологической анатомии: материалы III съезда Российского общества патологоанатомов. – Самара, 2009. – Т.1. – С. 5–8.
3. Аруин Л.И. Рак желудка // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. – 1999. – т.9, № 1. – С. 67–72.
4. Catalano F., Trecca A., Rodella L., et al. The modern treatment of early gastric cancer: our experience in an Italian cohort // Surgical Endoscopy and Other Interventional Techniques. – 2009. – № 23(7). – Р. 1581–1586.
5. Current European concepts in the management of Helicobacter pylori infection: The Maastricht Consensus Report. Gut. – 1997. – № 41 (1). – Р. 8–13.
6. Demirel B.B., Akkas B.E., Vural G.U. Clinical factors related with helicobacter pylori infection--is there an association with gastric cancer history in first-degree family members? // Asian Pac J Cancer Prev. – 2013. – № 14(3). – Р. 1797–802.
7. Goldstein N.S., Levin K.J. Gastric epithelial dysplasia and adenoma: historical review and histological criteria for grading. Hum. Pathol. – 1997. – № 28. – P. 127–133.
8. Inoue H., Takeshita K., Hori H., Muraoka Y., Yoneshima H., Endo M. Endoscopic mucosal resection with a cap-fitted panendoscope for esophagus, stomach, and colon mucosal lesions Gastrointestinal Endoscopy. – 1993. – № 39. – Р. 58–62.
9. Japanese Gastric Cancer Association Japanese Classification of Gastric Carcinoma, 2nd English ed. Gastric Cancer. – 1998. – № 1. – Р. 10–24.
10. Koch H.K., Oehlert M. and Oehlert W. An evaluation of gastric dysplasia in the years 1986 and 1987. Pathol Res Pract. – Vol.186, № 1, – Р. 80–84.
11. Nakamoto S., Sakai Y., Kasanuki J., et al. Indications for the use of endoscopic mucosal resection for early gastric cancer in Japan: a comparative study with endoscopic submucosal dissection. Endoscopy. – 2009. – № 41(9). – Р. 746–750.
12. Rugge M., De Boni M., G. Pennelli, M. De Bona, L. Giacomelli, M. Fassan, D. Basso, M. Plebani, D.Y. Graham Gastritis OLGA-staging and gastric cancer risk: a twelve-year clinico-pathological follow-up study // Alimentary Pharmacology & Therapeutics. – 2010. – Vol. 31, Issue 10. – Р. 1104–1111.
13. Ruggу M., Leandro G., Farinati F. Et al. Gastric epithelial dysplasia. – Cancer, 1995. – Vol.76. – Р. 376–82.
14. Sakaki N., Iida Y., Okazaki Y., Kawamura S., Takemoto T. Magnifying endoscopic observation of the gastric mucosa, particularly in patients with atrophic gastritis // Endoscopy. – 1978. – Vol.10. – Р. 269–274.
При выявлении дисплазии высокой степени, как правило, рекомендуют эндоскопическое удаление зоны дисплазии [4, 11]. Однако до настоящего времени тактика ведения пациентов с дисплазией низкой степени остается недостаточно разработанной.
Цель – оптимизировать тактику ведения пациентов с диспластическими изменениями желудка низкой степени, включающую хромоскопию, магнификационное эндоскопическое исследование, применение эндоскопических методов лечения.
Материал и методы исследования
Скрининговому эндоскопическому исследованию были подвергнуты 13255 больных с хроническим гастритом, наблюдавшихся с 2005 по 2008 годы в Российском центре функциональной хирургической гастроэнтерологии, а с 2008 по 2011 годы – в краевых клинических больницах № 1 и 2. За время проведения скрининга было выявлено 224 случая диспластических изменений СОЖ.
Пациенты с диспластическими изменениями СОЖ находились под динамическим диспансерным наблюдением, в ходе которого были выделены 2 группы. В 1-ю группу (190 человек) вошли пациенты с диспластическими изменениями СОЖ низкой степени, 2-я группа (34 человек) представлена больными с диспластическими изменениями высокой степени.
Всем больным выполняли магнификационную гастродуоденоскопию с функцией 115-кратного оптического увеличения, хромоскопию 0,5 % раствором метиленового синего и забором гастробиоптатов СОЖ по схеме: антральный отдел (3 биоптата: 1, 2 – большая и малая кривизна, 3 – угол желудка), тело желудка (1, 2 – большая и малая кривизна или передняя и задняя стенки тела желудка), а также из всех очаговых изменений СОЖ. Пациентам с дисплазией высокой степени проводили эндоскопическое ультразвуковое исследование (ЭУЗИ) с целью определения распространенности процесса. Стадию и степень хронического атрофического гастрита (ХАГ) определяли гистологически и гистохимически, учитывая выраженность атрофии, воспаления и дисрегенераторных изменений (метаплазия, дисплазия) в гастробиоптатах, с последующей оценкой интегральных показателей по визуально-аналоговой шкале, утверждённой решением III съезда Российского общества патологоанатомов [2].
В ходе диспансерного наблюдения все пациенты получали стандартную медикаментозную терапию в течение 8 недель: полная суточная доза ингибиторов протонной помпы, эрадикационная терапия 1 или 2 линии при подтверждении контаминации Нelicobacter рylori [5, 6]. В комплексное лечение при необходимости включали цитопротективную терапию (висмут трикалия дицитрат), антациды.
Статистическая обработка данных проводилась с помощью программы Statistica 6.0. Анализ различий качественных признаков проводился с использованием точного критерия Фишера. Полученные различия считались статистически значимыми при значениях р < 0,05.
Результаты исследования и их обсуждение
Для описания изменений на поверхности диспластических образований слизистой желудка были использованы классификации, предложенные Sakaki и японской ассоциацией исследования рака желудка [9, 14]. По типу изменений формы желудочной ямки и данных патогистологического исследования больные распределились следующим образом: в первой группе смешанный тип коротких линейных и извитых ямок (тип ВС) выявлялся у 16 (8,4 %) пациентов, удлиненные извитые ямки (тип С) – у 104 (54,7 %), ворсинчатоподобные ямки (тип CD) – у 65 (34,2 %), ямки в виде сетки (тип D) – у 5 (2,6 %); во второй группе смешанный тип коротких линейных и извитых ямок (тип ВС) не встретился, удлиненные извитые ямки (тип С) диагностированы у 3 (8,8 %), ворсинчатоподобные ямки (тип CD) – у 21 (61,8 %), ямки в виде сетки (тип D) – у 10 (29,4 %).
При выявлении дисплазии низкой степени методом петлевой электроэксцизии были прооперированы 52 пациента, с помощью колпачковой резекции или щипцов для «горячей» биопсии – 104 человека. Дисплазия высокой степени СОЖ у 34 пациентов явилась показанием к выполнению эндоскопической резекции с диссекцией в подслизистом слое.
Удаление диспластических образований СОЖ небольшого размера (менее 0,5 см), на основания которых трудно набросить петлю, осуществлялось с помощью метода колпачковой резекции, предложенного Inoue [8]. Электроэксцизия диспластических образований СОЖ с помощью колпачка применялась для получения материала для исследования и с целью лечения. При диспластических образованиях слизистой желудка небольшого размера во время электроэксцизии обычным петлевым методом ткани сгорают и не удается получить полноценный материал для гистологического исследования. Слизистая оболочка после удаления очаговых образований методом колпачковой резекции заживала в течение 7–10 дней.
При выполнении электроэксцизии мы применяли различные технические приемы, облегчающие выполнение манипуляции и обеспечивающие безопасность вмешательства. Так, для полного удаления образования и предупреждения перфорации желудка по игле под основание образования вводился стерильный раствор: раствор хлорида натрия 0,9 % – 10,0 мл, адреналин 0,1 % – 1,0 мл, раствор метиленового синего 0,5 % – 1,0 мл. За счет образовавшегося инфильтрата образование приподнималось, облегчая наложение петли на нужном уровне, а наличие красителя и сосудосуживающего препарата позволяло оценивать глубину удаления и снизить риск интраоперационного кровотечения. После наложения петли во время эндоскопического лечения проводилось пробное затягивание петли и отведение полипа от собственной мышечной оболочки слизистой. При этом осматривалось место наложения петли под увеличением для оценки адекватности удаления.
Удаление полиповидных образований более 0,5 см производилось петлей со стандартным сечением режущей части на различных режимах электрохирургического аппарата. При электроэксцизии на разных режимах работы электрохирургического блока значительного кровотечения не отмечалось. Отсечение производилось на режиме резания. Ожоговый струп отторгался в течение 4–6 дней. После удаления образования возникал дефект слизистой оболочки желудка, иногда значительных размеров, который заживал в течение 3–4 недель. Дефекты после удаления очага диспластически измененной слизистой оболочки закономерно заживали. У большинства больных отсутствовали какие-либо клинические проявления. У 32 пациентов с низкой степенью дисплазии (16,8 %) возникли осложнения (таблица) в виде кровотечения, которое диагностировалось в первые часы или сутки после вмешательства и было остановлено консервативно с использованием эндоскопических методик.
Сравнительные результаты эндоскопической петлевой резекции, колпачковой резекции, обычной эндоскопической резекции с эндоскопической резекцией слизистой оболочки с диссекцией в подслизистом слое
Часто приходят на прием пациенты, которым было проведено эндоскопическое исследование желудка и в заключении специалист пишет: «хронический гастрит, кишечная метаплазия». Если о хроническом гастрите наши пациенты наслышаны, то кишечная метаплазия вызывает тревогу и мысли о злокачественном поражении желудка. Так ли это?
Термин «хронический гастрит» обозначает хроническое воспаление желудка, но речь идет не обо всей стенке желудка, а только слизистой оболочке, в которой наряду с воспалительными и атрофическими процессами развивается нарушение обновления клеток слизистой желудка, что является важным признаком гастрита и может определять прогноз хронического гастрита.
О слизистой желудка подробнее
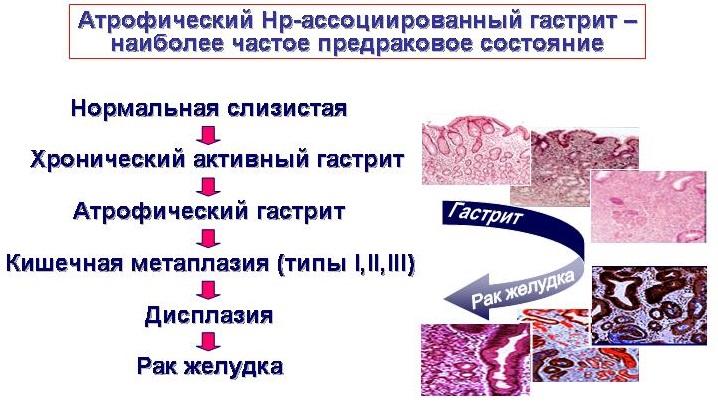
Слизистой желудка свойственно постоянное клеточное обновление. При любых повреждениях слизистой желудка активизируется регенерация, что приводит к восстановлению структуры слизистой. Свидетельством нарушения клеточного обновления при хроническом гастрите служат характерные для него изменения слизистой, нарушение фаз клеточного обновления, которые хорошо известны морфологам и определяются как нарушения морфологической перестройки слизистой оболочки желудка в виде кишечной метаплазии и дисплазии слизистой.
Поэтому при проведении эндоскопического исследования необходимо провести множественные биопсии слизистой желудка, чтобы подтвердить диагноз хронического гастрита, при котором может наблюдаться качественное нарушение регенерации (восстановления) клеток и замещение их несвойственными для желудка или его отделов клетками, т.е. речь идет о замещении желудочного эпителия кишечным. Метаплазия (от греческого «образование, формирование) — стойкое замещение клеток одного типа на клетки другого типа при сохранении видовой принадлежности ткани.
Что представляет собой кишечная метаплазия
Кишечная метаплазия была описана более ста лет назад, и до настоящего времени она изучается, главным образом, из-за возможной связи с раком желудка. Кишечная метаплазия встречается достаточно часто. В пожилом возрасте ее находят и у практически здоровых людей, но особенно часто при атрофическом гастрите почти в 100%. При язвах желудка – в 81%. При язвах 12-перстной кишки – 47%. Рак желудка занимает 4 место в структуре онкологических заболеваний.
Уровень пепсиногенов в крови является маркером хронического атрофического гастрита и риска развития рака желудка. Поэтому проведение определения по анализу крови уровня пепсиногенов и хеликобактерной инфекции улучшает выявление хронического атрофического гастрита и рака желудка.
При подозрении у пациента хронического атрофического гастрита (по результатам гастропанели) показано проведение гастродуоденоскопии с множественной биопсией слизистой желудка. Гистологическое подтверждение кишечной метаплазии является наиболее надежным маркером атрофии слизистой оболочки желудка. Пациенты, у которых диагностирован хронический атрофический гастрит с кишечной метаплазией, находятся в группе риска по развитию рака желудка (аденокарциномы желудка).
Факторами риска кишечной метаплазии могут быть:
- хеликобактерная инфекция,
- нерациональное питание,
- генетические факторы,
- экологическая среда,
- табакокурение,
- дуоденогастральный рефлюкс — желчный рефлюкс в желудок,
- нарушение кишечной микрофлоры.
Кишечная метаплазия — типы
В настоящее время различают два типа метаплазии – полную, напоминающую слизистую тонкой кишки, метаплазия 1 типа и неполную, напоминающую слизистую толстой кишки, метаплазия 2 типа.
Полная кишечная метаплазия

Она встречается наиболее часто при хронических гастритах. Тонкокишечный эпителий, образующий участки метаплазии, вообще мало склонен к малигнизации (раковому перерождению). Широко известным фактором является большая редкость рака тонкой кишки. Поэтому полную кишечную метаплазию не относят к предраковым изменениям слизистой. Если наблюдаются проявления хронического гастрита, то динамическое наблюдение и проведение гастродуодкерскопии проводится через 3-5 лет.
В питании показано употреблять продукты, обладающие обволакивающими свойствами — рисовый отвар, кисель, фрукты в запеченном виде, джемы на пектинах, из трав – семя льна.
Неполная кишечная метаплазия
Напоминает слизистую толстой кишки и выявляется у 11% больных всеми доброкачественными заболеваниями желудка, но при раке желудка она наблюдается в 94% случаев. Неполная кишечная метаплазия показала более высокую специфичность этого признака изменения слизистой желудка к раку, но низкая чувствительность (38%) говорит об ограниченном значении ее как показателя прогноза развития рака кишечного типа. Важным фактором при этом имеет большая площадь замещения нормального желудочного эпителия кишечным.
Известна связь хронического атрофического гастрита, кишечной метаплазии и хеликобактер пилори, при которых ликвидация хеликобактера способна предотвратить развитие и прогрессирование атрофии, а также возможно обратное развитие атрофии слизистой желудка. Наличие же кишечной метаплазии является признаком хеликобактерного гастрита. Пациенты с неполной кишечной метаплазией наблюдаются динамически ежегодно.
Неполная кишечная метаплазия слизистой желудка часто переходит в следующую стадию перестройки слизистой – дисплазию метаплазированного эпителия.
Морфологическая диагностика болезней желудка
Дисплазия метаплазированного эпителия – диагноз морфологический. О ней можно говорить при наличии клеточной атипии и нарушении структуры клеток слизистой оболочки желудка. В зависимости от выраженности этих изменений выделяют 3 степени дисплазии:
- 1 — слабая,
- 2- умеренная,
- 3- выраженная или тяжелая степень.
Понятие дисплазии было предложено для обозначения предраковых изменений, формирования групп повышенного риска для наблюдения и превентивного лечения. Исследования развития дисплазий показали, что у больных с дисплазией 2 степени в 4-8% найдено прогрессирование в дисплазию 3 степени.
Наблюдение больных дисплазией 1 и 2 степени
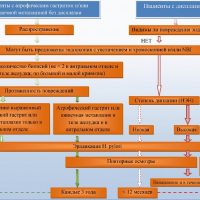
При слабой степени дисплазии, выявленной у людей старше 60 лет на фоне выраженного гастрита, рекомендуется проведение повторных эндоскопий с биопсиями через 12 месяцев и затем каждые 3 года.
При выявлении в биоптатах слизистой желудка признаков тяжелой дисплазии следует провести множественные повторные биопсии через 6-12 месяцев, так как тяжелая дисплазия чаще свидетельствует не о том, что у больного может возникнуть рак, а о том, что он уже есть. И если даже рак еще не обнаружен, то таким больным рекомендуется хирургическое лечение — хирургическая или эндоскопическая резекция из-за высокой вероятности развития аденокарциномы (рака желудка). У 25% дисплазия высокой степени может спрогрессировать до аденокарциномы в течение года.
Иначе просто динамическое наблюдение даже с множеством биопсий при эндоскопии при подтверждении тяжелой дисплазии слизистой желудка может закончиться тем, что будет упущено время для диагностики раннего рака желудка и своевременного лечения и выздоровления.
Лечение больных дисплазией 3 степени
У пациентов, у которых выявлен хронический атрофический гастрит с дисплазией, которая связана со штаммами хеликобактер пилори высокой вирулентности, повышенный риск развития рака желудка. Эрадикация хеликобактер пилори может привести к регрессу атрофических процессов в желудке и снижению риска рака желудка. При дисплазии требуется эрадикация хеликобактер пилори, ритмичное питание, защита слизистой желудка от повреждения ее лекарственными средствами.
Если при обследовании выявлен низкий уровень пепсиногена I и низкое соотношение пепсиноген I/пепсиноген II, это уже серьезная стадия атрофического гастрита/ Рекомендуется гастродуоденоскопия с множественной биопсией, даже в тех случаях, если серологический тест (определение антител в сыворотке крови) на хеликобактер пилори не выявил инфекцию в желудке.
Морфологами в биоптатах слизистой оболочки желудка по новой системе стадирования атрофического гастрита (OLGA) cумммируются показатели атрофии в теле и антральном отделе желудка с определением баллов в каждом биоптате. III и IV стадии выраженности атрофического гастрита по этой системе свидетельствует о высокой реальности развития рака желудка
Кишечная метаплазия – будьте бдительны!
В заключении хочу привести слова проф. Аруина Л.И., опытного и знающего морфолога, который сказал: «хронический гастрит и рак желудка разделяет дистанция огромного размера, а дисплазия и рак желудка живут в одной квартире».
Будьте внимательны к своему здоровью, вовремя проводите обследования, задавайте вопросы доктору, следуйте его рекомендациям. Здоровья вам!

Хронический атрофический гастртит (ХАГ) является морфологическим, а не клиническим, диагнозом. Часто гистологические изменения не коррелируют с клиникой, а только визуально обнаруживаемая атрофия (истончение) слизистой не подтверждается при исследовании биоптатов.
Основные гистологические признаки ХАГ:
- атрофия желудочных желез;
- кишечная метаплазия Метаплазия - стойкое замещение дифференцированных клеток одного типа дифференцированными клетками другого типа при сохранении основной видовой принадлежности ткани.
желудочного эпителия;
- появление лимфоцитарных фолликулов в атрофированной слизистой;
- признаки воспаления могут присутствовать в большей или меньшей степени в зависимости от активности гастрита; инфильтрация Инфильтрация - проникновение в ткани и накопление в них несвойственных им клеточных элементов, жидкостей и (или) химических веществ.
различается по клеточному составу.

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
Классификация
Единая классификация хронического атрофического гастрита отсутствует. Ниже приведены наиболее приемлемые для практической работы варианты классификации.
I. По локализации:
- антральный гастрит;
- гастрит (преимущественно или только) тела желудка;
- мультифокальный гастрит.
II. По морфологии.
Для морфологической оценки хронического гастрита российские авторы (Аруин Л.И., Капуллер Л.Л., Исаков В.А., 1998) предлагают использовать визуально-аналоговую шкалу. При ХПГ данная шкала позволяет оценить степень выраженности воспаления с помощью полуколичественных критериев.


Визуальная аналоговая шкала морфологической оценки хронического гастрита
| Признак | Норма | Слабая | Умеренная | Выраженная |
| Обсеменение H.pylori | ||||
| Инфильтрация нейтрофилами | ||||
| Хроническое воспаление | ||||
| Атрофия привратника | ||||
| Атрофия тела желудка | ||||
| Кишечная метаплазия |
Примечание к таблице. В данной таблице отмечается наличие морфологических признаков согласно прилагаемому ниже изображению.
Хроническое воспаление, вызванное Н. pylori: в настоящее время считается, что при исследовании (объектив Х40) СОЖ содержит в норме не более 2-5 лимфоцитов, плазматических клеток и макрофагов в поле зрения или 2-3 мононуклеара в одном валике. Наличие 1-2 плазмоцитов в поле зрения уже свидетельствует о хроническом воспалении.
Не требуют полуколичественной оценки, но указываются следующие признаки: потеря муцина, наличие лимфатических узелков, фовеолярная гиперплазия, пилорическая метаплазия, панкреатическая метаплазия, гиперплазия эндокринных клеток.
В зависимости от степени распространенности дистрофически измененных клеток среди "нормальных" клеток поверхностного эпителия в поле зрения, а также от глубины проникновения воспалительной инфильтрации в толщину слизистой оболочки, среди поверхностных гастритов выделяют:
- слабо выраженный (первая стадия воспалительной активности);
- умеренно выраженный (вторая стадия воспалительной активности);
- сильно выраженный (третья стадия воспалительной активности).
При слабо, умеренно и сильно выраженном поверхностном гастрите дистрофически измененные клетки среди "нормальных" клеток поверхностного эпителия занимают разный процент в поле зрения слизистой оболочки. При этом воспалительная инфильтрация проникает в глубь собственной пластинки слизистой оболочки на уровне желудочковых ямок (слабо выраженная), на уровне верхних и средних отделов желез (умеренно выраженная) и до мышечной пластинки слизистой оболочки (сильно выраженная).

В классификации ХАГ по выраженности атрофии и ее виду выделены три категории изменений слизистой оболочки желудка (СОЖ).
1. Отсутствие атрофии. В антральном отделе расположены пилорические железы, а в слизистой оболочке тела желудка – главные железы с большим количеством главных и париетальных клеток . Среди клеток ямочного эпителия могут встречаться мелкие очаги кишечной метаплазии в виде единичных бокаловидных клеток – "частичная кишечная метаплазия".
3. Атрофия желудочных желез. Подразделяется на два главных типа:
3.1 Метапластический тип атрофии характеризуется утратой желудочных желез, свойственных данному отделу, с замещением их кишечными, а применительно к слизистой оболочке тела желудка – пилорическими железами.
3.2 Неметапластический тип атрофии: в слизистой оболочке сохраняются железы, характерные для соответствующего отдела желудка, но наблюдается уменьшение объема железистой ткани. Железы становятся редкими и неглубокими. Наблюдается фиброз и фибромускулярная пролиферация собственной пластинки слизистой оболочки.
В данной классификации сохранена полуколичественная оценка степени тяжести атрофии: слабая, умеренная и тяжелая.
При практическом использовании эта классификация показала очень высокий уровень согласованности в интерпретации гистологической картины (до 78%) между разными морфологами. По критериям данной классификации большинство патологоанатомов одинаково оценивали состояние СОЖ.
При слабой неметапластической атрофии в антральном отделе уменьшается количество и глубина пилорических желез, разделенных фиброзным матриксом, а при тяжелой – пилорические железы практически полностью замещены соединительной тканью.
Умеренная неметапластическая атрофия слизистой оболочки тела желудка сопровождается уменьшением количества главных желез, отмечается углубление желудочных ямок и разрастание соединительной ткани в собственной пластинке слизистой оболочки.
При тяжелой неметапластической атрофии слизистой оболочки тела желудка главные железы полностью отсутствуют.
При тяжелой метапластической атрофии в антральном отделе пилорические железы, а в слизистой оболочке тела желудка – главные железы полностью замещены железами кишечного типа.
Раздельная оценка атрофических изменений в антральном и фундальном отделах желудка имеет высокую клиническую значимость, однако затрудняет интегративное восприятие общего состояния СОЖ. Помимо этого, в категорию неопределенных атрофий попадает большое количество случаев с продолжающейся воспалительной реакцией, а также изолированная атрофия СОЖ без воспаления встречается очень редко.
IV. По степени и стадии хронического гастрита (ХГ).
В качестве аналога метода оценки хронического гастрита по степени и стадии используется принцип оценки степени выраженности воспалительных изменений и стадии фиброза при хронических гепатитах.
Под степенью ХГ понимают общую выраженность воспаления: полуколичественно суммарно оценивается лимфоплазмоцитарная и нейтрофильная инфильтрация в биоптатах слизистой оболочки из антрального отдела и тела желудка.
Оценка производится в баллах по визуально-аналоговой шкале (ВАШ):
- 0 – инфильтрация отсутствует;
- 1 – слабая;
- 2 – умеренная;
- 3 – выраженная.
Итоговый балл (G0–G3) представляет собой сумму баллов нейтрофильной и моноцитарной инфильтрации (теоретически от 0 до 6) и, будучи проставленным в таблице отдельно для антрального отдела и тела желудка, указывает на степень ХГ.
Степень 0 – означает отсутствие инфильтрации во всех биоптатах, степень IV – резко выраженную инфильтрацию во всех биоптатах.
А
Н
Т
Р
У
М
Дисплазия – это нарушение строения тканей организма, с упрощением их структуры, деформацией клеток и их составных частей. Обусловленные генетическими причинами врожденные дисплазии, как правило, имеют многообразные проявления, часто множественные и в разных системах.
Дисплазии слизистых оболочек имеют локальную привязку к определённому органу, как-то желудок, кишечник, шейка матки. В отличии от всех прочих дисплазий этот вид патологии не наследуется и не связан с глобальным генетическим сбоем, а вызывается жизнедеятельностью патологической микрофлоры.
Виды дисплазии
Дисплазии очень разнообразны и разнородны, врожденные и благоприобретенные дисплазии по сути очень разные процессы, одни захватывают несколько систем, другие – только участки слизистой оболочки.
Врожденные дисплазии проявляются аномалиями развития – отклонениям в строении, не мешающими нормальному функционированию, и пороками развития – эти аномалии уже нарушают функционирование анатомической области.
Дисплазии слизистой не формируют пороков и аномалий развития, но способны привести к злокачественным процессам. Абсолютно разные проявления дисплазий не позволяют создать единую классификацию, каждый исследователь проблемы предлагает собственную систематизацию разнородной патологии, не свободную от недостатков.
Врожденные дисплазии формируются во внутриутробном периоде, клинические проявления затрагивают покровные ткани и костно-мышечную систему, разделение их весьма условно.
Выделяют дисплазию эктодермы – поверхностной ткани зародыша, из которой формируются наружные покровы: кожа с ногтями и волосами и слизистая ротовой полости с зубами. Патология может проявиться в любом возрасте, в любом наборе признаков и с любой их выраженностью. Это может быть только сухость кожи с небольшими пятнышками атрофии и почти полным отсутствием зубов или гнездная плешивость с без ногтей и с лунообразными дефектами зубной эмали при полном наборе зубов. Возможно и просто снижение числа потовых желез в коже, что приводит к быстрому перегреванию уже в младенчестве и опасности внезапной смерти.
У подавляющего большинства страдающих генетической дисплазией соединительной ткани возможны нарушения всех систем организма от незначительных до опасных для жизни и с любым набором признаков: неврологические нарушения, пороки сердечных клапанов, изменения скелета, аневризмы сосудов, размягчение колец трахеи, опущение почек, а также приводящие к внезапной смерти сочетанное поражение сердечно-сосудистой и дыхательной систем. Наиболее активный всплеск проявлений отмечается в подростковом возрасте, когда, например, резко прогрессирует сколиоз и плоскостопие, появляется сердечная аритмия и близорукость. Сформировано несколько синдромов с характерными внешними проявлениями, опять-таки с вариабельной выраженностью – от мизерных отдельных проявлений до чрезвычайно выраженных с ранней гибелью от осложнений, как синдром Марфана и несовершенный остеогенез.
Дисплазия суставов проявляется врожденными пороками развития крупных – тазобедренных и коленных, а также мелких суставов кисти и стопы, и по своей сути может считаться все той же дисплазией соединительной ткани, но в отдельно взятой суставной системе. Как правило, патология выявляется у грудничка, но в минимальной форме может проходить незаметно, констатируют которую при обследовании по поводу случайной травмы ноги.
Дисплазию фиброзную выдают одиночные и множественные кисты в костях. Некоторые люди до глубокой старости проживают здоровую жизнь и узнают о генетической патологии в виде небольшой кисточки случайно при рентгене по другому поводу. Другие страдают хроническими болями и деформацией конечности, часто с укорочением, из-за множества кистозных полостей в костной ткани.
Дисплазию слизистых оболочек внутренних органов «зарабатывают» в процессе жизни. В большинстве случаев процесс не проявляется симптомами или имеет нехарактерные и нестабильные минимальные признаки, находят его при микроскопии кусочка ткани. Дисплазия может прогрессировать от легкой степени, через среднюю и тяжелую вплоть до рака нулевой стадии – и в этом её главная опасность. Тяжелую степень дисплазии сложно, а иногда и невозможно достоверно отличить от неинвазивного рака in situ.
Дисплазия желудка клинически может проявляться желудочной патологией, нередко у пациента отмечается инфицирование хеликобактерией. Патология заключается в упрощении клеточного строения – снижении дифференцировки, изменении клеточных ядер и других внутриклеточных структур. Легкая дисплазия не только переходит в среднюю, но и регрессирует, аналогично протекает и средняя, а тяжелая считается предраковым процессом и подлежит серьёзному лечению и наблюдению. Желудочная дисплазия по частоте встречаемости существенно уступает метаплазии – формированию в слизистой участков из клеток очень похожих на клетки толстой или тонкой кишки. При микроскопии вокруг любой дисплазии обязательно находят участки кишечной метаплазии и это тоже предраковый процесс.
Первичная дисплазия уротелия - нечасто встречающаяся патология, проявляющаяся симптоматикой раздраженного мочевого пузыря с частыми и болезненными позывами на мочеиспускание. Этот вариант дисплазии не принято разделять на степени, вероятность развития рака на диспластичном фоне чуть больше 15% и переход в нулевую стадию рака займет от 4 до 8 лет.
Цервикальная или дисплазия слизистой шейки матки очень частая патология, поскольку её ведущая причина – инфицированность вирусом папилломы человека. Сам вирус убить невозможно – он устойчив к любым лекарствам, но он смертен и у подавляющего большинства женщин самостоятельно излечивается в ближайшие два-три года.
Степени дисплазии
На трёх женщин с легкой дисплазией шеечной слизистой приходится одна пациентка со средней и тяжелой дисплазией. У девяти из десяти женщин место патологического изменения слизистой расположено у перехода плоского эпителия в железистый, который в норме находится у начала цервикального канала, но вследствие родов и абортов может перемещаться вглубь канала ближе к полости матки.
Дисплазия характеризуется появлением неправильных клеток – атипичных, но межклеточные структуры совсем не страдают. Клетки изменяют свою форму, ядра в них тоже меняют размер, форму и цвет. Ядра более крупные, неровные с толстой наружной оболочкой, внутриклеточная жидкость светлеет и увеличивается в объёме. Вместо абсолютно одинаковых клеточек эпителия появляется полная клеточная пересортица, усиленно делящаяся на такие же дефектные экземпляры. Вероятность развития рака в этой группе разноразмерных клеток доходит до 50%, правда, на это потребуются многие годы.
Степени дисплазии или по современной классификации, подчеркивающий возможность прогрессии до злокачественного процесса, цервикальной интраэпителиальной неоплазии или CIN градуируются следующим образом:
- Легкая цервикальная дисплазия или CIN I – патология располагается в одной трети пласта эпителия. Исследования показали, что у двух третей женщин в течение трёх лет с момента заражения вирусом папилломы человека 16 и 18 типов (ВПЧ) процесс самопроизвольно разрешится вследствие естественной гибели пораженной вирусом клетки, которую вирус не успеет покинуть и слущится вместе со своим клеточным «домиком». У трёх из десяти зараженных женщин ВПЧ продолжит жить дальше, а у одной перейдёт в среднюю степень дисплазии, тем не менее легкая дисплазия не считается предраком.
- Средняя степень цервикальной дисплазии или CIN II – поражение охватывает больше половины толщины эпителия – до двух третей. У трёх из сотни с течением времени такая дисплазия прогрессирует в тяжелую.
- При тяжелой степени цервикальной дисплазии или CIN III свободным от атипических клеток остается только поверхность эпителия, визуально даже в электронном микроскопе это патологическое состояние очень похоже на рак in situ. Предполагается, что у каждой седьмой женщины с диагностированной CIN III уже есть злокачественные клетки, тем не менее, у каждой третьей пациентки тяжелая дисплазия может уйти в среднюю и легкую степень и даже исчезнуть. Проблема в одном – нельзя сказать у кого в будущем будет рак шейки матки, а кто им не заболеет.
Риск рака реален у женщины с длительной цервикальной неоплазией, поэтому оперируют даже легкую дисплазию, не исчезнувшую после 36 месяцев наблюдения. Кстати, инфицирование ВПЧ не обещает обязательной дисплазии, у каждой четвертой зараженной женщины вирус не внедряется внутрь клеток – «проносится» мимо к выходу из половых путей.
Диагностика заболевания
Дисплазия слизистой не болит, не мешает жить – у неё нет симптомов.
Самый простой способ выявления патологии слизистой шейки матки был придуман Папаниколау в 1940-х годах и состоял он из взятия соскоба поверхностных клеток. Сегодня применяется модифицированный инструментарий, позволяющий собрать больше материала. Исследование клеток под микроскопом – цитология позволяет определиться во следующим диагностическим этапом – кольпоскопией.
Расширенная кольпоскопия – осмотр тканей под большим увеличением от пятикратного до 30-кратного, с дополнительным усилением «картинки» специальными обработками растворами, что помогает выбору оптимального места для взятия кусочка ткани – биопсии участка дисплазии. Кусочки слизистой размером не менее 3 миллиметров отправляются на микроскопию – гистологию. Биопсия исключается при воспалении и инфекциях, но только на время.

Дальше при морфологическом подтверждении дисплазии проводится выскабливание слизистой оболочки цервикального канала для выявления его изменений, у женщины дисплазия может локализоваться в железистых криптах – ямках слизистой и зона эпителиального перехода способна смещаться выше. Выскабливание визуализирует скрытый от глаза патологический субстрат.
Лечение дисплазии
При врожденных дисплазиях радикального лечение не существует, при некоторых опасных для жизни пороках развития проводятся операции, но вся терапия направлена только на уменьшение симптомов с увеличением двигательной активности и паллиативная по своей сути.
При дисплазии суставов разработаны эффективные, но тягостные методики многомесячной фиксации для создания покоя и предоставления времени для не случившегося во внутриутробном периоде развития.
При дисплазии желудка проводится избавление от хеликобактерии, налаживается ритм питания, модифицируется диета и образ жизни в сторону нормального, используются защищающие слизистую от повреждений лекарственные средства.
Лечение дисплазии шейки матки зависит от её выраженности: при легкой степени дисплазии прибегают к консервативным мероприятиям. Вирус папилломы человека устойчив к лекарственному воздействию, но его жизнедеятельность поддерживают нарушения слизистой оболочки при хроническом воспалении, способствует снижение иммунитета при гормональных нарушениях и системных заболеваниях.
Здоровой женщине проще избавится от ВПЧ, но при наличии у неё болезней необходимо помочь организму – излечить острое воспаление, перевести хронический процесс в длительную ремиссию, добиться гормонального баланса, нормализовать сахар и другие элементы крови.
При длительно существующей CIN I, которую наблюдают почти 3 года без тенденции ткани к нормализации структуры, тоже оперируют – удаляют сектор шейки. Сектор похож на геометрическую фигуру – конус, отсюда и название операции – конизация.
Среднюю и тяжелую дисплазию лечат только хирургией – проводится конизация шейки матки радиоволновым или лазерным методами. Операция высокоэффективна, почти не оставляет рубцов и не мешает в дальнейшем забеременеть и выносить ребенка.
Восстановительный период
Биопсия шейки матки для диагностики дисплазии при правильном выполнении не чревата проблемами, но некоторым пациенткам с хроническими воспалительными процессами половой сферы требуется профилактическое применение антибиотиков. Не допускается использование в послеоперационном периоде вагинальных тампонов и промывания влагалища, на 2 недели также исключается половая жизнь.
После конизации по поводу дисплазии несколько дней беспокоят не столько боли, сколь неприятные ощущения внизу живота. Будут и выделения, в первые дни могут быть прожилки крови или окрашивание кровью. С течением времени выделения осветляются и уменьшается их количество. Длительность истечения зависит от скорости заживления. Возможно усиление менструации. На полное восстановление слоя слизистой потребуется несколько недель, период ограничений увеличивается, как минимум до месяца, то есть на это время полностью исключается секс, тампоны, спринцевания и высокие физические нагрузки.
Восстановление обязательно должен контролировать врач. Результат лечения оценивает контрольная кольпоскопия и соскоб слизистой – не должно быть признаков атипии и участков дисплазии.
Предраковые процессы и дисплазии умеют лечить обычные гинекологи, но наблюдение специалиста с онкологической подготовкой, тем более в специализированной онкологической клинике поднимает диагностику и терапию на должный уровень качества.
Читайте также:

