Гнойное воспаление кожи при сахарном диабете
Обновлено: 24.04.2024
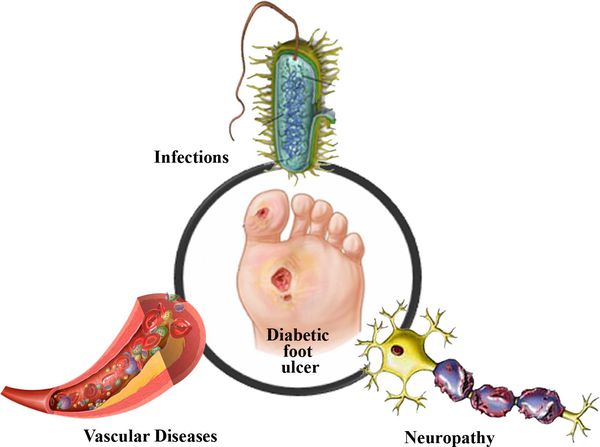
Гнойные заболевания и гангрена, как осложнения сахарного диабета
Частота развития гнойной хирургической инфекции, а так же возникновение гангрены у больных, страдающих сахарным диабетом, составляет в среднем 10-25%. Указанный показатель зависит от ряда причин, основными из которых являются тяжесть течения основной патологии, степень компенсации, наличие сопутствующих заболеваний. Взаимное отягощение течения диабета и гнойной инфекции обуславливает возникновение различных осложнений. Осложнения, связанные с течением сахарного диабета возникают на фоне активации контринсулярных факторов при неадекватном инсулина обеспечении.
Одним из ведущих осложнений сахарного диабета является синдром “диабетическая стопа” (СДС), который развивается у 30-80% больных. По данным Гурьевой 1999 года, 40-60% всех ампутаций нижних конечностей производятся у больных с СДС. При этом летальность составляет от 28 до 40% (Пятилетняя выживаемость 25-40%). В 85% случаях ампутации предшествует язвенное поражение стоп.
2. Разобрать классификацию синдрома “диабетическая стопа”.
Стадии поражения стоп
0 – кожные покровы интактны, могут быть костные деформации;
I – поверхностная язва;
II – глубокая язва;
III – остеомиелит или глубокий абсцесс;
IV – локальная гангрена;
V - распространенная гангрена стопы;
Антибактериальная терапия
При нейропатической форме СДС истонченная кожа перестает выполнять барьерную функцию. При наличии инфекционного поражения мягких тканей стопы необходимо назначение терапии по приему антибиотиков, по возможности с учетом чувствительности к микрофлоре, при этом доза и длительность применения препаратов зависят от тяжести процесса и скорости заживления ран. Такая терапия может проводиться до двух-трех месяцев.
Хирургическое лечение
Местное лечение гангрены включает удаление некротических тканей, обработку краев язвенной поверхности, адекватное дренирование гнойных очагов гангрены и обеспечение асептичности раненой поверхности.
Для более быстрого заживления ран необходимо создать полный покой и разгрузку стопы. При этом могут быть использованы кресло-каталка, костыли и специальная разгрузочная обувь.
При развитии остеоартропатии (сустава Шарко), рекомендовано ношение индивидуальной ортопедической обуви. Наиболее благоприятный прогноз заживления язв при невропатической форме СДС.
Лечение гангрены народными средствами
Так же, может применяться народная медицина. Средства народного лечения гангрены нижних конечностей применяется в том случае, если есть специалист по травам, которого называют фитотерапевтом. Фитотерапевт подберет индивидуально сбор трав для каждого, с учетом аллергий и противопоказаний.
Видео синдрома диабетической стопы
Ампутация
При неэффективности органосохраняющего хирургического лечения гангрены, необходимо решать вопрос о выполнении ампутации. Показания ампутация конечности на уровне бедра:
• атеросклероз магистральных сосудов при плече лодыжечном индексе ниже 0,3 на фоне сахарного диабета тяжелой формы;
• полиорганная недостаточность и выраженное гнойно-воспалительное явление на стопе с переходом на голень;
Показания к ампутации конечности на уровне голени:
• наличие обширного гнойно-воспалительного процесса на стопе с остеомиелитом и поражением голеностопного сустава с сохраненной пульсацией на подколенной артерии.
Таким образом, лечение СДС может быть только комплексным, при этом недооценка даже одного из компонентов программы лечебных мероприятий может свести, на нет все усилия.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Как известно, больные сахарным диабетом склонны к развитию гнойно-воспалительных заболеваний кожи и мягких тканей (подкожная жировая клетчатка, фасции и т.д.). Гнойные процессы (абсцессы, флегмоны, фурункулы, карбункулы, гидрадениты…) развиваются у ≈10 - 25% больных сахарным диабетом. Для диабета характерны обменные нарушения, вызывающие повышенную травматичность кожи и зуд, что способствует появлению микротравм и размножению патогенной микрофлоры. Вследствие микроангиопатии и нейропатии кожи, нарушается ее трофика и взаимоотношение дермы с подкожной жировой клетчаткой.
С появлением гнойного очага катастрофически нарастают гипергликемия, глюкозурия, кетоацидоз, электролитные нарушения. По мере увеличения гнойника увеличивается и вероятность декомпенсации сахарного диабета в результате развития воспалительного ацидоза, инактивации инсулина накапливающимися в этом очаге микробными токсинами и протеолитическими ферментами разрушенных лейкоцитов.
Снижение иммунологической реактивности организма и антибиотикорезистентность способствуют генерализации гнойно-некротического процесса и развитию сепсиса. Гнойная инфекция любой этиологии приводит к тому, что латентная и легкая форма сахарного диабета может перейти в тяжелую, трудно поддающуюся коррекции.
Местные изменения при возникновении абсцесса, карбункула или флегмоны характеризуются развитием обширного гнойно-некротического очага без признаков его отграничения с неярко выраженной реакцией воспаления. В связи с пониженной сопротивляемостью организма инфекции воспаление нередко приобретает обширный деструктивный характер. Гнойный экссудат при этом быстро распространяется по сухожильным влагалищам и сопровождается лимфаденитом и лимфангоитом. Снижение сопротивляемости к инфекции и частое возникновение гнойно-воспалительных заболеваний у больных сахарным диабетом обусловлены нарушениями иммунологических и пластических процессов в тканях. В основе этого лежит дефицит инсулина, оказывающего активное влияние на все метаболические процессы.
Поэтому при обнаружении появления каких-либо воспалительных признаков на коже и мягких тканях (покраснение, отёк, уплотнение, боли…) важно во время обратиться к специалисту на ранней стадии этого процесса и вовремя начать лечение, чтобы предотвратить дальнейшее развитие и прогрессирование гнойно-некротических изменений мягких тканей.
Лечение. Больным сахарным диабетом с гнойно-воспалительными заболеваниями кожи и подкожной клетчатки показано срочное оперативное лечение – вскрытие и дренирование гнойника. Это устраняет источник интоксикации и является эффективным методом компенсации сахарного диабета, так как удаляются микробные токсины и ферменты, разрушающие инсулин. В последующем, после стабилизации состояния больного по показаниям при необходимости возможно выполнение дополнительно некрэктомии и вскрытие плохо дренируемых затеков.
Что такое диабетическая стопа? Причины возникновения, диагностику и методы лечения разберем в статье доктора Есипенко И. А., сосудистого хирурга со стажем в 37 лет.
Над статьей доктора Есипенко И. А. работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Диабетическая стопа (синдром диабетической стопы, СДС) — это тяжёлое осложнение сахарного диабета в виде инфекции, язв или разрушения глубоких тканей, которое возникает в связи с нарушением макроструктуры стопы и микроциркуляции крови, по причине разрушения нервных окончаний и нервных волокон. [10]
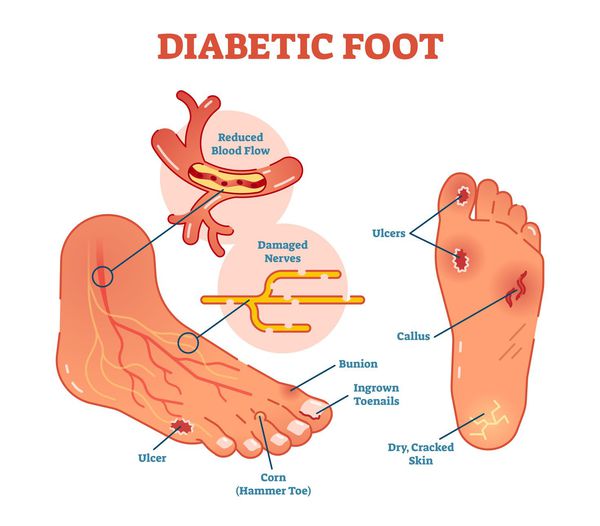
Главная причина ДС — это сахарный диабет (СД). И хотя синдром диабетической стопы не развивается с первого дня увеличения уровня глюкозы в крови более 7,0-8,0 ммоль/л, каждый пациент с диагнозом «сахарный диабет» должен помнить о таком грозном возможном осложнении.
Хронические раны на ногах у людей с сахарным диабетом встречаются в 4-15 % случаев. В некоторых случаях они становятся первым признаком развившегося диабета [10] .
Основные «пусковые механизмы» развития язв при СДС:
1. Ношение неудобной обуви. К изменению нагрузки на суставы стопы, сдавливанию или потёртости кожи, локальной микроишемии, инфильтрату, или некрозу могу привести любые дефекты обуви:
- несоответствующий размер обуви (меньше или больше, чем нужно);
- стоптанные и/или высокие каблуки;
- рубец на стельке;
- дефект подошвы;
- мокрая обувь;
- несоответствие обуви времени года.
2. Увеличенный вес тела. Учитывая площадь стоп, при увеличении веса тела (даже на 1 кг) увеличивается и нагрузка на каждый сустав стопы. Самая уязвимая область — подошвенная поверхность.
3. Разрастание эпидермиса (поверхности) кожи. Этот процесс происходит из-за нарушенных обменных процессов в коже на фоне СД (под утолщённым эпидермисом-"мозолью" в слоях кожи нарушается микроциркуляция, что приводит к микроишемии и некрозу).
4. Микротравмы:
- укусы животных;
- уколы шипами растений;
- порезы при педикюре и т. п.
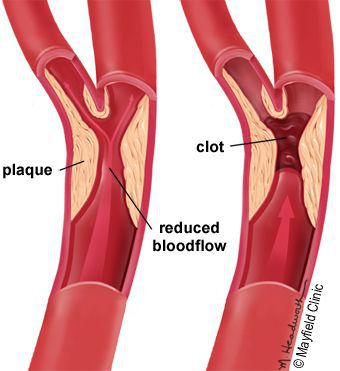
5. Стенозы (сужение) и окклюзии (закупорка) магистральных артерий. В результате отсутствия кровоснабжения в стопах и голенях к микроишемии присоединяется макроишемия и развитие гангрены конечности.
6. Условно патогенная или патогенная микрофлора. Активизация флоры (микробов и других микроорганизмов) на поверхности кожи в условиях СД приводит к воспалению кожного покрова, а в условия ишемии или микротравмы значительно ускоряется развитие гангрены.
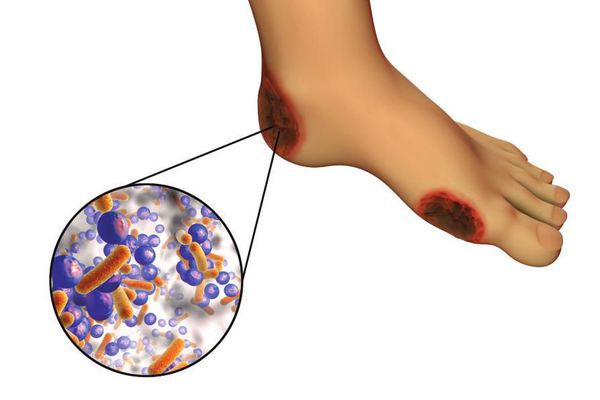
Часто наблюдается сочетание нескольких причин возникновения язв при СДС.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы диабетической стопы
Отправной точкой развития СДС считается не дата установления диагноза «Сахарный диабет», а время, когда были выявлены первые симптомы СД (однократные подъёмы глюкозы крови, сухость во рту и другие).
Симптомы СДС:
- онемение, зябкость, жжение, отёки в стопах и другие неприятные ощущения;
- выпадение волос на на стопах и голенях, потливость стоп;
- изменение окраски кожи (гиперемия, гиперпигментация, цианоз);
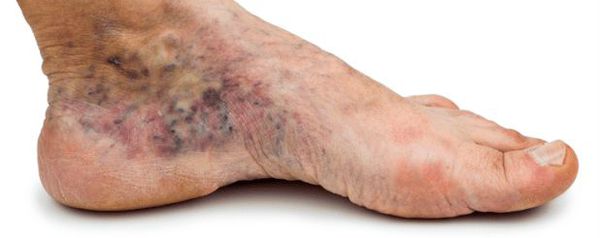
- утолщение, расслаивание, изменение формы и цвета ногтевых пластинок;
- кровоизлияния под ногтевой пластинкой в виде «синяков» под ногтями;
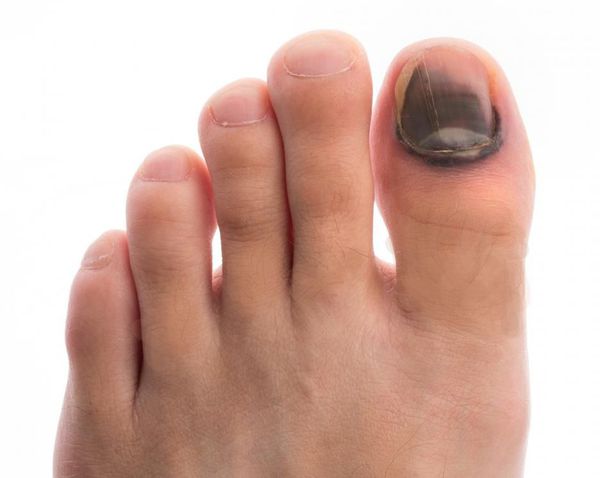
- деформация стоп;
- снижение чувствительности стоп — вибрационного, температурного, болевого и тактильного восприятия;
- боль в области стопы и язвы, возникающая как в покое или ночью, так и при ходьбе на определённые расстояния;
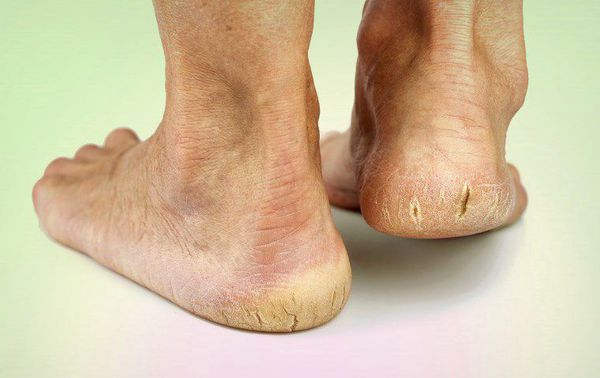
- истончение кожи, шелушение;
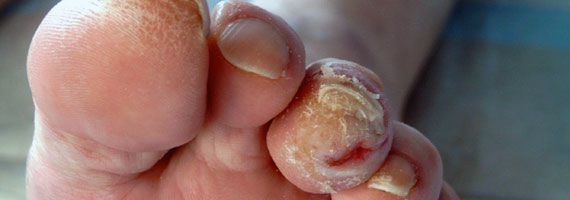
- понижение или увеличение температуры стоп и голеней;
- длительная эпителизация (заживление) микротравм — до двух месяцев, при этом остаются коричневые рубцы;
- трофические язвы, длительно не заживающие на стопах.
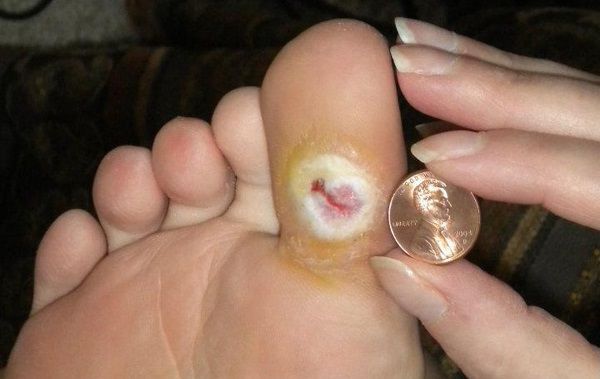
Чаще всего трофическим изменениям подвержены дистальные отделы конечности: пальцы и подошвенная поверхность стопы в проекции головок плюсневых костей. Зона образования трофической язвы зависит от причины её возникновения.
Патогенез диабетической стопы
Механизм развития СДС представляет собой следующую последовательность нарушений:
- Снижается выработка гормона инсулина.
- Увеличивается уровеь глюкозы в крови — развивается гипергликемия.
- Блокируется кровоток в мелких сосудах, через сосудистую стенку перестаёт поступать кислород и другие микроэлементы.
- Разрушаются нервные волокна и рецепторы.
- Наступает микро- и макроишемия тканей стопы.
- Образуются трофические язвы.
Таким образом, при СДС происходит повреждение всех тканей ноги.
В результате дефицита инсулина в организме диабетика количество глюкозы в крови увеличивается. Это в свою очередь негативно сказывается на состоянии как мелких, так и крупных сосудов:
- на стенках сосудов скапливаются иммунологические вещества;
- мембраны становятся отёчными;
- просвет сосудов сужается.
В результате этих изменений кровообращение нарушается и образуются небольшие тромбы. Эти изменения в организме препятствуют поступлению достаточного количества микроэлементов и кислорода в клетки и тем самым приводят к нарушениям обменного процесса. Кислородное голодание тканей замедляет процесс деления клеток и провоцирует их распад.
Увеличение уровня глюкозы в крови также становятся причиной поражения нервных волокон — снижается чувствительность.
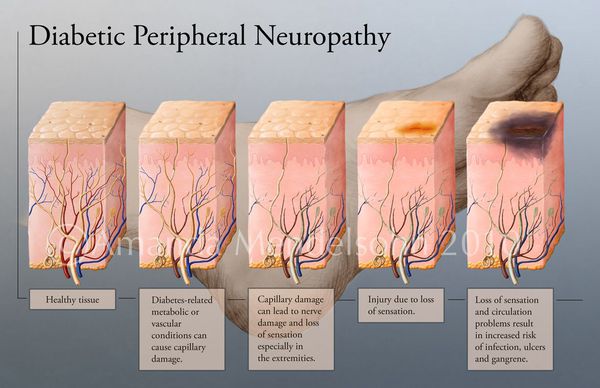
Все деструктивные процессы, происходящие в тканях стопы приводят к тому, что любое повреждение кожи становится лёгким процессом, а заживление — длительным. Усугубить состояние стопы могут присоединившиеся инфекции, которые способны привести к образованию гангрены — некрозу тканей. [9]
Классификация и стадии развития диабетической стопы
Классификация I Международного симпозиума по диабетической стопе
В 1991 году в Нидерландах на I Международном симпозиуме была принята классификация СДС, которая является наиболее распространённой. [1] Она предполагает разделение заболевания на три типа в зависимости от преобладающего патологического процесса:
- нейропатическая инфицированная стопа:
- длительное течение сахарного диабета;
- позднее возникновение осложнений;
- отсутствие болевого синдрома;
- цвет и температура кожи не изменены;
- уменьшение всех видов периферической чувствительности;
- наличие периферического пульса.
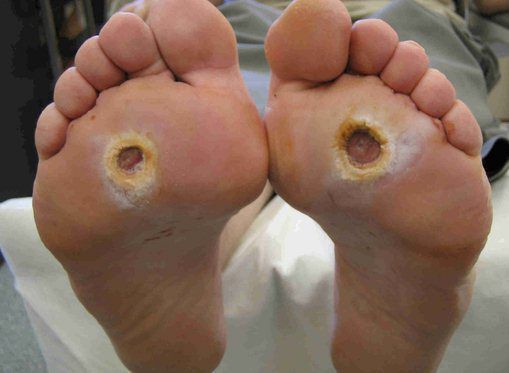
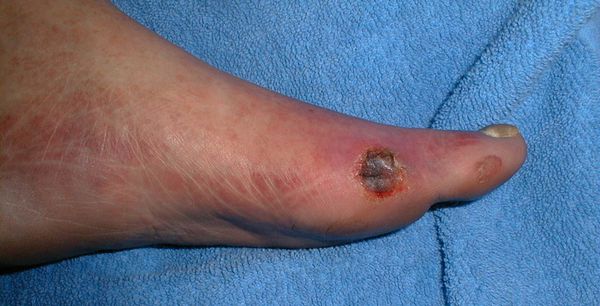
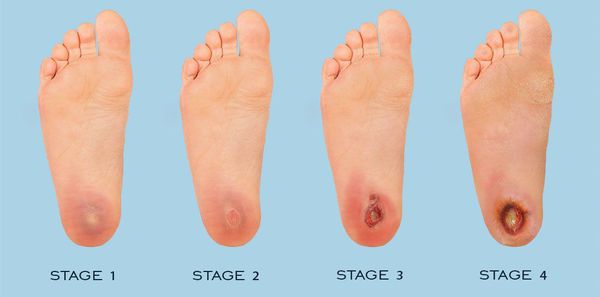
Классификация Вагнера
По степени выраженности поражений тканей стопы выделяют следующие стадии СДС: [6] [7]
- Стадия 0 — изменение костной структуры стопы — артропатия;
- Стадия 1 — изъязвление (язвы) кожи;
- Стадия 2 — изъязвление всех мягких тканей, дном язвы являются кости и сухожилия;
- Стадия 3 — абсцедирование и остеомиелит (воспаление костной ткани);
- Стадия 4 — образование гангрены дистальных отделов стопы (пальцев);
- Стадия 5 — образование гангрены стопы и отделов голени.
Классификация Техасского университета
Данная классификация была разработана в 1996-1998 годах. [8] В её основе лежит оценка язвы по глубине, наличию инфицирования и ишемии — риска ампутации конечности.
Нарастание частоты заболеваемости инсулинзависимым сахарным диабетом (ИЗСД) у детей и подростков требует расширения исследований по профилактическому и раннему выявлению как доклинических стадий сахарного диабета (СД), так и его осложнений, своевременное
Ряд авторов не только признают, что поражение кожи при ИЗСД является наиболее доступным признаком для клинической оценки врачом, но и прослеживают связь между поражением кожи при ИЗСД и такими осложнениями этого заболевания, как нефропатия, нейропатия, ретинопатия, развитие ограничения подвижности суставов (ОПС) — артропатия (хайропатия)
В настоящее время поражение кожи при ИЗСД у детей может быть классифицировано следующим образом: первичное, вторичное и смешанное (сочетанное) поражения кожи; метаболические нарушения кожи; поражение кожи, связанное с лечением ИЗСД
Нарастание частоты заболеваемости инсулинзависимым сахарным диабетом (ИЗСД) у детей и подростков требует расширения исследований по профилактическому и раннему выявлению как доклинических стадий сахарного диабета (СД), так и его осложнений, своевременное обнаружение и лечение которых являются основными факторами, позволяющими предотвратить инвалидизацию и сократить смертность больных. При ИЗСД поражаются все органы и ткани организма, наиболее общим механизмом поражения является формирование диабетической микроангиопатии. Ряд авторов не только признают, что поражение кожи при ИЗСД является наиболее доступным признаком для клинической оценки врачом, но и прослеживают связь между поражением кожи при ИЗСД и такими осложнениями этого заболевания, как нефропатия, нейропатия, ретинопатия, развитие ограничения подвижности суставов (ОПС) — артропатия (хайропатия). Большинство исследований, проведенных в основном у взрослых больных, страдающих как инсулиннезависимым сахарным диабетом (ИНСД), так и ИЗСД, статистически достоверно показывают, что частота встречаемости симптомокомплекса поражения кожи, чаще всего описываемого как «диабетическая дермопатия», возрастает с повышением частоты других специфических осложнений СД. Все исследователи отмечают, что своевременная диагностика и лечение, включающее повышение уровня гликемического контроля, уменьшают проявления осложнений, а на ранних стадиях делают возможным их обратное развитие.
Особенностью кожных покровов ребенка, обусловливающей их повышенную чувствительность к патологическим изменениям, является более тонкий, чем у взрослых, и более рыхлый слой эпидермиса за счет большего содержания воды. Граница между эпидермисом и дермой неровная, связь между ними слабее, чем у взрослых. Дерма имеет преимущественно клеточную структуру, особенно у детей до шести лет; коллагеновые волокна очень тонкие, эластические, слабо развиты, тогда как волокнистая структура у взрослых имеет малое количество клеточных элементов. За счет этих особенностей защитная функция кожи у детей ослаблена — кожа более ранима, склонна к инфицированию (недостаточная кератинизация рогового слоя, его тонкость, незрелость местного иммунитета), эпидермолизу (легкое отделение эпидермиса от дермы), особенно у детей до трех лет. Поверхность детской кожи суше, чем у взрослых, имеет более выраженную склонность к шелушению вследствие физиологического паракератоза и более слабого функционирования железистого аппарата кожи.
Большинство исследователей считают, что поражения кожи при СД встречаются довольно часто, и, учитывая микроскопические изменения, они могут достигать даже 100% при манифестации заболевания. С помощью гистологических и электронно-микроскопических исследований доказано сходство морфологического строения кожи больных СД в возрасте моложе 40 лет и практически здоровых людей старше 60 лет. У них исчезают эластические волокна и активируются фибробласты, отмечаются разрывы коллагеновых пучков, снижение синтеза эластина и полимеризации коллагена при повышении количества коллагеновых белков, глюкозоаминогликанов, структурных гликопротеинов. При этом установлено, что снижение количества эластических волокон на всех стадиях старения кожи обычно предшествует изменениям коллагена.
У детей, в отличие от взрослых, практически не встречаются такие разнообразные, распространенные при СД первичные формы поражения кожи микроангиопатического и макроангиопатического генеза (в связи с резистентностью к инсулину), как генерализованная кольцевидная гранулема (granuloma annulare), папуллезно-роговой дерматоз Карле (hyperkeratosis follicularis et parafollicularis in cutem penetrans), папиллярно-пигментная дистрофия кожи (acanthosis nigricans), эруптивные ксантомы (xantoma papuloeruptivum), склередема (scleredema), кальцифилаксия (calcifilaxia), а также исчезающие гранулемы, резипелоидоподобная эритема, пигментный пурпурный дерматоз, периунгвальные телеангиоэктазии. Также крайне редки у детей и такие вторичные инфекционные поражения, в том числе кожи, как злокачественный наружный отит — тяжелая инфекция, вызываемая Pseudomonas; неклостридиальная газовая гангрена, как правило вызываемая Proteus, Klebsiella, E. coli, Pseudomonas; некротизирующий фасциит — смертельная инфекция, поражающая поверхностную фасцию. Из метаболических нарушений кожи, сопровождающих СД, практически не встречаются у детей гемохроматоз и порфирия.
- классическая — единичные крупные очаги поражения, чаще встречаемые на коже голеней, нередко с изъязвлениями;
- атипичная — с двумя вариантами течения — склеродермоподобным и поверхностно-бляшечным.
Никакое современное лечение, направленное либо на коррекцию углеводного обмена и метаболических нарушений, либо на улучшение микроциркуляции и тканевой резистентности (лазеротерапия, рентгенотерапия, криодеструкция и др.), не позволяет добиться стойких радикальных результатов. В настоящее время большинство исследователей все же рассматривают ЛН как самостоятельное заболевание — хронический дерматоз.
Таким образом, в настоящее время поражения кожи при ИЗСД у детей может быть классифицированы следующим образом:
- первичное, вторичное и смешанное (сочетанное) поражение кожи;
- метаболические нарушения кожи;
- поражение кожи, связанное с лечением ИЗСД.
Первичное поражение кожи — это сосудистые поражения (осложнения) микроангиопатического генеза — структурные и функциональные нарушения в мелких кровеносных сосудах (артериолы, венулы, капилляры). Клинически проявляются эритемой конечностей, внешне напоминающей рожу, иногда с изъязвлениями. Микроскопически характерны утолщение базальных мембран сосудов и пролиферация эндотелиальных клеток. К ним относится диабетическая дермопатия и рубеоз. Собственно диабетическая дермопатия — одна из самых распространенных форм поражения кожи — выражается в образовании множественных бессимптомных двухсторонних атрофических гиперпигментированных пятен, чаще всего на голенях. Их присутствие свидетельствует о возможности микрососудистых изменений в других тканях. Специфическое лечение дермопатии не проводится. Также имеет место рубеоз — розовый оттенок кожи лица у больных ИЗСД, обусловленный функциональной микроангиопатией или повышенным сродством гликированного гемоглобина к кислороду.
Вторичное поражение кожи включает: кожные инфекции — бактериальные и грибковые; неврологические нарушения — сенсорные, моторные и автономные.
Больные СД склонны к развитию инфекционно-воспалительных заболеваний, особенно при неудовлетворительном контроле гликемии. На поверхности кожи больных СД выявляется в 2,5 раза больше микроорганизмов, чем у здоровых лиц, а бактерицидная активность кожи у больных СД ниже, чем у здоровых, в среднем на 20%, и это снижение прямо коррелирует с тяжестью течения СД, в связи с чем при СД, в том числе ИЗСД, часто наблюдаются различные инфекционно-воспалительные и инфекционно-грибковые заболевания кожи. Прежде всего они развиваются на коже нижних конечностей, пораженных нейропатией и ишемией. Это обычно полимикробные инфекции: золотистый стафилококк, гемолитический стрептококк, грамотрицательные аэробные бактерии и множество анаэробов. На ногах, в области мозолей или в других местах трения и нарушения целостности кожи, в области ногтевых лож образуются язвы или нагноения. Инфекция может распространиться на окружающие ткани, вызывая некротизирующий целлюлит, лимфангит, гнойный миозит, некротизирующий фасциит, остеомиелит или даже газовую гангрену (такие исходы распространения инфекции у детей практически не встречаются). Пиодермии, фурункулы, карбункулы, флегмоны, рожа, дерматиты, эпидермофития, кандидомикоз, хронические паронихии и панариции, инфицированная гангрена встречаются у больных СД значительно чаще, чем в популяции. По принятой нами классификации ИЗСД у детей и подростков инфекционно-воспалительные и инфекционно-грибковые заболевания, в том числе кожи, отнесены не к сопутствующим ИЗСД заболеваниям, а к неспецифическим осложнениям ИЗСД, что правомерно, так как распространенность, тяжесть этих поражений, сложность их лечения у детей обусловлена именно наличием ИЗСД. Фурункулез у больных СД протекает тяжело и длительно, а подкожные абсцессы головы могут привести даже к тяжелым поражениям мозга. У взрослых больных СД встречается и гангрена Фурнье, для которой характерно поражение подкожных тканей в области полового члена, мошонки и промежности, реже — стенки живота. Возбудителем этого поражения является смешанная аэробная и анаэробная микрофлора. Микробно-воспалительные процессы при СД могут привести к сепсису. Присоединение инфекционно-воспалительных и грибковых заболеваний кожи, как правило, приводит к тяжелым и длительным декомпенсациям СД и увеличивает потребность организма в инсулине. У лиц с хорошим контролем СД фурункулез и карбункулы встречаются не чаще, чем в популяции здоровых. Из грибковых поражений у детей с ИЗСД наиболее распространены кандидозы, чаще всего вызывающие ангулярные стоматиты, паронихии, вульвовагиниты или баланиты.
Эпидермофитии у детей с ИЗСД довольно редки, но часто осложняются вторичной бактериальной инфекцией. Крайне редки у детей трудно поддающиеся терапии фикомикоз, мукормикоз, при которых в процесс могут вовлекаться мозговые оболочки. У детей с ИЗСД довольно распространены дерматомикозы, особенно стоп и ладоней, кожа которых становится сухой и чешуйчатой.
Широко распространены вторичные нарушения кожи, связанные с неврологической патологией при СД. Среди них: сенсорные нарушения — онемение пальцев ног, постепенно распространяющееся выше, захватывающее стопы, способствующее развитию травматических язвенных поражений, вторичных инфекций и гангрены, особенно при наличии сосудистых изменений; моторные нарушения — слабость межкостных мышц вызывает уплощение стоп с потерей смягчающей функции подошвы стоп; автономные (вегетативные) нарушения — гипергидроз верхней половины тела и сухость кожи нижней части туловища. Эти проявления относятся к диабетической нейропатии, поражающей 5-50% больных СД. У детей с ИЗСД наиболее часто встречается дистальная симметричная сенсорно-моторная полинейропатия с минимальными кожными проявлениями (сухость кожи, гиперкератоз, мозоли, вторичное инфицирование пораженных участков кожи, нарушения роста ногтей), обратимая в фазе начальных проявлений. Именно нейропатия — один из ведущих патогенетических факторов развития в дальнейшем синдрома «диабетической стопы» (ДС). Среди больных СД, осложненным синдромом ДС, частота ампутации нижних конечностей в 15 раз выше, чем у остального населения. При преобладании нейропатических изменений над изменениями периферического кровотока развивается нейропатическая форма ДС, одним из вариантов течения которой является поражение кожи — нейропатическая язва. Она чаще возникает на участках стопы, испытывающих давление, — плантарной поверхности и межпальцевых промежутках. Длительно протекающая сенсорно-моторная нейропатия приводит к деформации стопы с перераспределением и повышением давления на ее отдельные участки. В этих местах отмечается утолщение кожи, гиперкератоз с высокой плотностью. В дальнейшем развивается аутолиз подлежащих мягких тканей с формированием язвенного дефекта, при этом больной может ничего не замечать из-за снижения болевой чувствительности. Язвенный дефект может вторично инфицироваться, в том числе анаэробной микрофлорой, с развитием гипертермии, лейкоцитоза, требующих срочного хирургического лечения с некроэктомией, антибактериальной терапией, улучшением гликемического контроля. У детей все формы ДС встречаются крайне редко, но начальные проявления имеют место в детском возрасте, что требует адекватного обучения, обследования и лечения больных, в том числе прицельного осмотра состояния кожи при ИЗСД.
К смешанному (сочетанному) поражению кожи при СД относятся: утолщение кожи (синдром «диабетической руки» — ОПС с утолщением кожи и склеродермоподобным синдромом), желтый цвет кожи и ногтей, синдром «диабетических пузырей», пруригус и повреждения волос. К нему же следует отнести склеродермоподобные изменения кожи пальцев и тыльной части кистей рук, снижающие их подвижность. Кожа утолщается в области пальцевых суставов и периунгвально. Эти изменения, иногда в сочетании с артропатией (ОПС), описываются некоторыми исследователями как синдром «диабетической руки». Часто с утолщением кожи ассоциируется гиперкератоз. Желтый цвет кожи и ногтей (ксантохромия) ранее связывался с гиперкаротинемией, но сейчас доказано, что при СД в крови сохраняется нормальный уровень каротина. В настоящее время этиология и патогенез не выяснены. Синдром «диабетических пузырей» возникает редко, как правило на коже конечностей. Выявляются одиночные или множественные пузыри, заживающие без рубцевания через две—пять недель. Возможна симптоматическая терапия. Пруригус — поражение кожи в аногенитальной области на фоне кандидоза (гиперемия, трещины, шелушения, вторичное инфицирование). Иногда при плохо контролируемом СД может быть диффузное выпадение, а у больных пониженного питания — избыточный рост волос (лануго) на коже рук и спины. Редко, обычно при плохом уровне гликемического контроля, наблюдаются повышенное шелушение кожи, себорейный дерматит, ихтиозоподобный синдром, особенно в области голеней.
К метаболическим нарушениям кожи при СД относится ксантоматоз, редко встречающийся в детском возрасте и являющийся следствием гиперлипидемии. Клинически ксантоматоз проявляется в виде плотных желтых папул с эритематозным ободком, чаще на кистях, стопах, ягодицах, разгибательных поверхностях верхних и нижних конечностей. Купируется адекватной инсулинотерапией.
Специфическими кожными осложнениями лечения ИЗСД являются липодистрофии, образующиеся в местах инъекций инсулина. Встречаются в виде липом или липогипертрофий (плюс-ткань) и липоатрофий (минус-ткань). В связи с широким применением в настоящее время хорошо очищенных биосинтетических человеческих инсулинов липоатрофии встречаются крайне редко. В настоящее время именно липогипертрофии, или липомы, представляют собой наиболее распространенную проблему для больных ИЗСД, даже при небольшом сроке заболевания. Они возникают в результате некорректной техники введения инсулина (нарушения схем ротаций мест инъекций инсулина, несоблюдение техники и правил введения препаратов), а иногда и без видимых причин; затрудняют абсорбцию и метаболизм инсулина, ухудшают компенсацию заболевания, увеличивают потребность в инсулине, создают косметические дефекты на коже. Кроме вышеописанных правил профилактики липодистрофий, в случае их появления дополнительно и с хорошим эффектом применяется массаж липом, физиотерапия. Также у некоторых больных периодически возникают кровоподтеки в местах инъекций инсулина. Эти места, как правило, теплее на ощупь, чем окружающая кожа.
Обобщая вышеизложенное, можно сказать, что исследование кожи, представляющей собой наиболее доступную неинвазивному клиническому осмотру систему организма, имеет огромное клиническое значение. Знание особенностей поражения кожи у детей при ИЗСД не только помогает в оценке фазы течения заболевания, но и имеет непреходящее значение для решения вопросов о направлении диагностического поиска, коррекции лечения и прогнозе течения ИЗСД.
Н.К.Починина, зав.кафедрой оториноларингологии и сурдологии оториноларингологии доцент, к.м.н. Н.А. Шлыкова, ассистент кафедры оториноларингологии и сурдологии оториноларингологии
ГБОУ ДПО Пензенский институт усовершенствования врачей Министерства здравоохранения Российской Федерации
Актуальной проблемой ринологии на сегодняшний день являются воспалительные заболевания носа и околоносовых пазух. Острые и хронические синуситы встречаются у людей всех возрастов. В последние десятилетия заболеваемость синуситами увеличилась почти в 3 раза, а удельный вес госпитализированных больных увеличивается ежегодно на 1,5-2%. В среднем около 5-15% взрослого населения страдает синуситами [1]. Одним из факторов, отягощающих течение данной патологии, является наличие сопутствующего сахарного диабета 2-го типа (СД-2).
Часто острые воспалительные заболевания носа и околоносовых пазух приобретают хронический характер и отличаются вялым, длительным течением, что ухудшает качество жизни. Это связано как с изменением вирулентности и резистентности микрофлоры, являющейся этиологическим фактором возникновения синусита, так и со снижением иммунологической реактивности организма.
Известно, что микрофлора, колонизирующая верхние дыхательные пути, представлена сапрофитными микроорганизмами и условно-патогенными бактериями. К микроорганизмам, являющимся основными современными возбудителями острых форм синуситов, относят Streptococcus pneumoniae и Haemophilus influenzae. Реже возбудителями могут быть Streptococcus pyogenes, Moraxella catarrhalis, Staphylococcus aureus, а также анаэробы [2]. Основными возбудителями хронических форм риносинуситов являются анаэробные микроорганизмы (Peptostreptococcus spp., Bacteroides spp., Veillonella spp., Prevotella spp., Fusobacterium spp., Corynebacterium spp.). Также встречаются золотистый стафилококк, пневмококк, гемофильная палочка, грамотрицательные бактерии, грибы [3].
В настоящее время отечественные и зарубежные авторы уделяют большое внимание особенностям высеваемой микрофлоры, состоянию иммунной системы, а также выбору антимикробных препаратов у больных верхнечелюстным синуситом. При этом в мировой научной литературе достаточно мало данных, характеризующих степень иммунных расстройств как на местном, так и на системном уровне. В настоящее время имеются интересные публикации о применении препарата Мирамистин при патологии верхнечелюстных пазух [4, 5].
Однако до сих пор нет работ, посвященных эффективности местного использования препарата Мирамистин у больных с риносинуситами на фоне сахарного диабета 2 типа. Препарат Мирамистин обладает широким спектром антимикробного действия, включая госпитальные штаммы, резистентные к антибиотикам, нормализует транспортную функцию мерцательного эпителия, обладает противовоспалительным действием, в то же время не повреждает слизистые оболочки. При хронических процессах применение Мирамистина сокращает сроки лечения, уменьшает число рецидивов. Препарат не обладает местнораздражающим и аллергизирующим действием, а также стимулирует местные защитные реакции за счет активации фагоцитоза и моноцитарно-макрофагальной системы.
Целью работы было изучение клинико-лабораторной эффективности использования препарата Мирамистин у больных с риносинуситами на фоне сахарного диабета 2 типа.
Материалы и методы
Исследование проводилось на базе ЛОР-отделения ГБУЗ ГКБ СМП им. ГА. Захарьина, г Пенза. Под нашим наблюдением находились две группы больных -53 человека с гнойными риносинуситами и сопутствующим сахарным диабетом 2 типа (СД-2). Возраст больных составлял от 32 до 75 лет.
Первую группу (основную) составили 27 пациентов, которые вместе с традиционной терапией получали местно препарат Мирамистин. Методика применения Мирамистина: после аппликационной анестезии раствором 10% лидокаина производилась пункция верхнечелюстной пазухи и установка трубчатого дренажа. Затем пазуха промывалась 0,9% раствором хлорида натрия. После промывания в верхнечелюстную пазуху вводили 10 мл 0,01% стерильного раствора Мирамистина. Промывание проводилось ежедневно в течение 7-8 дней.
Вторую группу (группа сравнения) составили 26 пациентов, которые получали аналогичную терапию, за исключением препарата Мирамистин.
Микробиологические методы включали взятие мазка из среднего носового хода с определением чувствительности к антибактериальным препаратам методом посева на питательные среды.
Иммунологические исследования проводились до начала лечения и при выписке из стационара. Для изучения нейтрофильного звена фагоцитоза оценивали абсолютное количество лейкоцитов и нейтрофилов периферической крови,проводили тест оценки разницы спонтанной светосуммы (РСС-тест) [6].
В качестве показателей нормы использовали результаты обследования 20 здоровых лиц.
Статистическую обработку данных проводили с помощью программы Statistica 6.0 на персональном компьютере с использованием непараметрического критерия Манна-Уитни. Гипотезы рассматривались как статистически достоверные при р
Результаты
В первую очередь мы оценивали длительность нахождения трубчатого дренажа в пазухе и продолжительность госпитализации. Как видно из таблицы №1, трубчатый дренаж в 1 группе находился в пазухе при остром риносинусите 6,35±0,48 дня, во 2 группе при остром процессе дренаж находился в пазухе 7,72±0,33 дня. При сравнении течения хронического процесса в группах выявлено достоверное увеличение длительности нахождения трубчатого дренажа во 2 группе, где она составила 7,57±0,53 дня по сравнению с показателями 1 группы (6,92±0,56 дня).
При оценке продолжительности госпитализации было выявлено достоверное увеличение сроков госпитализации пациентов 2 группы как с острым процессом (10,34±0,65 к/д), так и с хроническим процессом (10,18±0,57 к/д) по сравнению с 1 группой, где продолжительность госпитализации пациентов с острым процессом составила 9,15±0,95к/д, с хроническим процессом - 9,93±0,85 к/д.
Во вторую очередь мы оценивали спектр возбудителей, а также антибактериальную чувствительность микрофлоры у больных с риносинуситами.
Из представленных данных можно сделать вывод, что бактериальный пейзаж характеризуется в основном монофлорой как при остром, так и при хроническом процессе. Наличие микробных ассоциаций выявлено в 4 случаях при остром риносинусите: в виде Staphylococcus epidermidis+Streptococcus pneumoniae. При хроническом риносинусите микробные ассоциации были выявлены в 6 случаях и были представлены Corynebacterium xerosis+Candida albicans; Staphylococcus epidermidis+Actinobacter semanii.
При оценке антибиотикочувствительности выделенная микрофлора оказалась чувствительна к действию макролидов, цефалоспоринов 3 поколения, фторхинолонов 3-4 поколения. Наибольшая резистентность бактерий наблюдалась к пенициллинам, тетрациклину, линкомицину.
Таблица 1. Длительность нахождения канюли в верхнечелюстной пазухе и длительность госпитализации
| 1 группа | 2 группа | |||
| Острый риносинусит n=14 | Хронический риносинусит n=13 | Острый риносинусит n=13 | Хронический риносинусит n=13 | |
| Длительность нахождения канюли, дни | 6,35±0,48 | 6,92±0,56 | 7,72±0,33 | 7,57±0,53 |
| Длительность госпитализации, дни | 9,15±0,95 | 9,93±0,85 | 10,34±0,65 | 10,18±0,57 |
Таблица 2. Характеристика микрофлоры у больных острым и хроническим риносинуситом на фоне сахарного диабета 2 типа
| Микроорганизмы | Острый риносинусит n=27 | Хронический риносинусит n=26 |
| Staphylococcus epidermidis | 10 (37,0%) | 7 (26,9%) |
| Staphylococcus aureus | 8 (29,6%) | 5 (19,2%) |
| Staphylococcus warneri | 5 (18,5,%) | - |
| Streptococcus pneumoniae | - | 3 (11,5%) |
| Pseudomonas aeruginosa | - | 7 (26,9%) |
| Enterobacter aerugenes | - | 1 (3,8%) |
| Роста нет | 4 (14,8%) | 3 (11,5%) |
Таблица 3. Функциональные показатели нейтрофильного звена фагоцитоза
| Показатель | Контрольная группа (n=20) (Me [LQ-UQ]) | I группа (n=27) (Me [LQ-UQ]) | II группа (n=26) (Me [LQ-UQ]) |
| Лейкоциты | 6,5 [5,1-7,9] | 7,9 [6,7-9,6] * | 7,4 [5,7-9,8] * |
| Нейтрофилы | 3,8 [2,9-4,5] | 4,9 [3,9-6,0] * | 4,4 [3,3-5,9] |
| РСС-тест | 3,8 [2,3-5,4] | 0,2 [-4,0-3,5] * | 2,3 [-2,7-7,1] ** |
Также мы оценивали иммунный статус, при этом определяли показатели гуморального звена иммунитета.
Данные о повышенном количестве лейкоцитов и нейтрофилов отражают адекватную реакцию нейтрофильного звена фагоцитоза на развитие в организме пиогенной инфекции.
При изучении показателя РСС-теста значительные изменения были выявлены только в 1 группе больных, где отмечалось достоверное снижение данного показателя (0,2 [-4,0-3,5]) по сравнению с контрольной группой (3,8 [2,3-5,4]) и 2 группой, показатель которой составил 2,3 [-2,7-7,1]. Выявленное снижение показателя РСС-теста в 1 группе свидетельствовало о снижении активности и резерва активации нейтрофилов под действием гнойной инфекции, что отражает снижение функции нейтрофилов.
Читайте также:

